Abstract
Introduzione
Durante il processo decisionale avverso, la generalizzazione consente di applicare l’esperienza diretta con un sottoinsieme limitato di stimoli pericolosi del mondo reale a un insieme molto più ampio di stimoli potenzialmente correlati. Ad esempio, se mangiare un particolare frutto foraggiato ha portato in passato ad un’intossicazione alimentare, può essere adattabile per evitare l’apparizione di frutti simili in futuro. Come processo evolutivo ben conservato, la generalizzazione consente una navigazione sicura ed efficiente di un mondo complesso e multidimensionale(Sutton e Barto, 1998; Ghirlanda ed Enquist, 2003). Tuttavia, l’eccessivageneralizzazione, con il risultato di evitare in modo inappropriato stimoli, azioni o contesti sicuri, è stata suggerita come un possibile meccanismo patologico in una serie di disturbi psicologici tra cui ansia, dolore cronico e depressione(Duits et al., 2015; Dymond et al., 2015; Vlaeyen e Linton, 2012; Harvie et al., 2017; Pearson et al., 2015).
Il lavoro precedente sulla generalizzazione avversa si è concentrato sulla previsione delle punizioni nei disegni passivi (pavloviani). Tali studi hanno rivelato l’evidenza di risposte soggettive, fisiologiche e neurali più elevate a stimoli che presentano una somiglianza percettiva con gli esemplari appresi(Dymond et al., 2015). Tuttavia, non è chiaro fino a che punto queste osservazioni si estendano a un contesto decisionale, ossia se si debba o meno dare una risposta di elusione di fronte a determinati stimoli, consentendoci di esercitare un controllo sull’ esperienza di esiti avversivi. Sebbene i processi pavloviani possano influenzare l’apprendimento dell’evitamento, quest’ultimo comporta l’acquisizione di un insieme fondamentalmente distinto di valori relativi alle azioni stesse. Si tratta di una distinzione clinicamente importante, poiché le teorie di molti disturbi psicologici si riferiscono specificamente a comportamenti evitanti eccessivi al di là della paura soggettiva(Krypotos et al., 2015) – per esempio, riducendo le opportunità di estinzione della paura inappropriata o permettendo che l’evitamento non necessario si trasformi in un controllo basato sull’abitudine (Arnaudova et al.,2017; LeDoux et al., 2017; Gillan et al., 2014).
Ci sono una serie di potenziali meccanismi attraverso i quali la generalizzazione dell’evitamento potrebbe essere implementata dal cervello. Come sottolineato in alcuni racconti, l’incertezza percettiva nell’identità dello stimolo da sola può effettivamente produrre una generalizzazione. Sebbene vi sia un dibattito su come la capacità discriminante sia controllata in molti esperimenti di generalizzazione(Struyf et al., 2015), vi sono buone prove che l’esperienza con esiti avversivi altera la rappresentazione degli stimoli predittivi nelle cortecce sensoriali primarie(Weinberger, 2007; Sasaki et al., 2010; Wigestrand et al., 2017), e che questo può portare a cambiamenti nella discriminazione degli stimoli assoluti(Resnik et al., 2011; Laufer e Paz, 2012; Aizenberg e Geffen , 2013). D’altra parte, la generalizzazione può avvenire anche a livello di rappresentazioni di valore, attraverso il trasferimento del valore acquisito a stimoli simili, ma discriminanti, durante l’apprendimento. Nel caso di Pavlovian, diversi fenomeni comportamentali consolidati implicano processi di generalizzazione dei valori in gioco tra le specie(Hanson, 1959; Schechtman et al., 2010). Il fatto che sia i processi percettivi che quelli di valore possano operare in parallelo può spiegare perché i recenti studi di neuroimaging hanno evidenziato diverse aree cerebrali (ad esempio, la corteccia limbica rispetto alle regioni sensoriali primarie) come chiave per la generalizzazione avversa di Pavlovian nell’uomo(Onat e Büchel, 2015; Laufer et al., 2016).
Un ulteriore fattore importante nel controllo dell’apprendimento di evitare l’apprendimento è il rafforzamento da parte degli stati neutrali (o ‘sicurezza’), che segnalano l’omissione della punizione. È probabile che la generalizzazione su questi stati possa anche influenzare il comportamento: per esempio nel caso Pavlovian, l’evidenza di ciò si vede negli effetti di ‘peak-shift’, per cui la presenza di un segnale di sicurezza percettivamente simile sembra inibire la risposta ai vicini segnali di avversione (Hanson,1959). E ‘quindi possibile che la sotto-generalizzazione dei segnali di sicurezza, in contrasto con l’eccessiva generalizzazione dei segnali avversivi, potrebbe essere un fattore che contribuisce alla suscettibilità a disturbi come l’ansia generalizzata negli esseri umani(Grupe e Nitschke, 2013).
Qui, affrontiamo tre domande chiave: primo, ci sono buone prove di generalizzazione nell’apprendimento dell’evitamento negli esseri umani?; secondo, possiamo distinguere le componenti comportamentali e neurali relative al valore percettivo, al valore avverso e al valore di sicurezza? e terzo, quale componente predice i sintomi psicologici rilevanti? Abbiamo utilizzato un compito percettivo progettato su misura in combinazione con la modellazione dell’apprendimento di rinforzo per studiare due gruppi: un campione di laboratorio(N= 26) che ha eseguito un compito di prevenzione del dolore con neuroimaging simultaneo (fMRI), e una coorte più ampia di individui (N = 482), che ha eseguito un compito di prevenzione delle perdite monetarie online insieme a una batteria di questionari progettati per sondare le dimensioni dei sintomi psicologici rilevanti (Gillan e Daw, 2016).
Risultati
Il disegno complessivo dello studio è riassunto nella Figura 1a. In entrambi i gruppi di partecipanti, la generalizzazione delle risposte strumentali è stata testata utilizzando un paradigma di evitamento costoso(Figura 1c). In breve, ai partecipanti è stato detto che avrebbero visto sul loro schermo una serie di forme simili a fiori, alcune delle quali erano “sicure” e altre “pericolose”. Se vedevano una forma pericolosa e non reagivano, c’era un’alta probabilità che ricevessero una dolorosa scossa elettrica (campione fMRI), o che perdessero 10 centesimi dalla loro puntata in contanti (campione online usando Amazon Mechanical Turk, AMT). Se avessero visto una forma sicura, non avrebbero mai ricevuto una scossa elettrica (o perso soldi) in quel processo. Per sfuggire alla possibilità di uno shock doloroso (o di una perdita di denaro) quando pensavano che fosse stata presentata una forma pericolosa, ai partecipanti è stato detto che potevano premere il pulsante “escape” sulla loro tastiera. Ai partecipanti è stato detto che l’esito avverso non si sarebbe mai verificato in un processo quando avessero premuto il pulsante ‘escape’ – ma – che, cosa importante, la pressione del pulsante era associata a un piccolo costo. In particolare, ogni volta che premevano il pulsante di fuga, questo veniva registrato su un contatore nella parte inferiore del loro schermo. Alla fine di ogni blocco del compito, essi ricevevano ulteriori dolorose scosse (o perdevano ulteriore denaro) a seconda di quante volte avevano premuto il pulsante durante quel blocco (una scossa in più o una perdita del 10 per cento ogni cinque pressioni del pulsante). La strategia ottimale (per ridurre al minimo la quantità di dolore ricevuto o di denaro perso) sarebbe quindi quella di premere il pulsante se pensassero di aver visto una forma pericolosa, ma non di premere se pensassero che sullo schermo ci fosse una forma sicura.
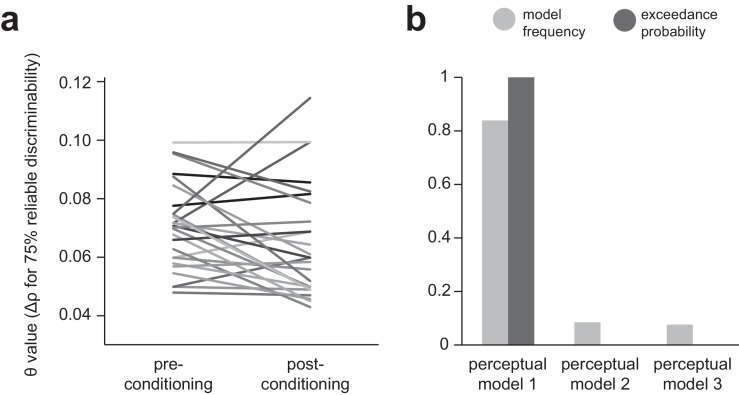
Figura 1-figure supplement 3.Figura 1—supplemento alla figura 3. Studio del design e riassunto del comportamento complessivo.Relazione tra le prove di evitamento medio sullo stimolo di generalizzazione (GS) durante la generalizzazione del compito di evitamento strumentale, e le valutazioni visive della scala analogica del dolore/perdita media post-task.evitamento proporzionato per stimoli individuali del compito (riga in alto) e per tipo di CS e numero di blocco (riga in basso) per la generalizzazione del compito di evitamento strumentale.Effetti del condizionamento sull’acuità percettiva per gli stimoli del compito.(a) Progettazione dello studio e protocollo per i due gruppi di partecipanti; fMRI, laboratorio e campione di imaging funzionale; AMT, Amazon Mechanical Turk (web-based) campione.(b) compito percettivo ritardato-punito, utilizzato per determinare il 75% di stimoli di generalizzazione (GSs) su base individuale per la generalizzazione del compito di evitamento strumentale (c) nel campione fMRI (nel campione AMT, GSs sono stati generati sulla base dell’acuità percettiva media determinata nei test pilota).d) Sintesi del comportamento sul compito di generalizzazione nei campioni fMRI ede) AMT. ISI, intervallo inter-stimolo; ITI, intervallo inter-trial; CS+, stimolo condizionato con esito doloroso o perdita, CS-, stimolo condizionato con esito neutro (nessun dolore o perdita). Le barre di errore rappresentano SD. *p=0,006, **p<0,001, t-test campione abbinato.a) fMRI,b) AMT, campioni (Spearman ρ = 0,692, 0,641, rispettivamente).(a) fMRI,(b) AMT, campioni. ns, p>0,3. ^p=0,19, **p<0,001, misure ripetute ANOVA per differenze nella media degli stimoli di generalizzazione (GS).c) fRMI,d) AMT, campioni. Le barre di errore rappresentano l’errore standard.(a) Cambiamenti nell’acutezza percettiva misurata dal compito percettivo punito in ritardo, prima e dopo il condizionamento (esecuzione della generalizzazione del compito di evitamento strumentale), per ogni partecipante al gruppo fMRI. θ, cambiamento del parametro ρ dello stimolo ‘spikiness’ richiesto per identificare una forma come diversa nel 75% delle prove.b) Risultati del confronto del modello bayesiano effettuato per determinare il miglior modello di performance percettiva dei partecipanti durante la generalizzazione del compito di evitamento strumentale. Modello 1, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva dei GS è fissata al 75%. Modello 2, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva delle GS è fissata al valore determinato dal test di acuità post condizionamento. Modello 3, un modello di generalizzazione solo percettiva in cui la discriminabilità delle GS cambia linearmente dal valore derivato dal pre al post-condizionamento, nel corso del compito. Frequenza del modello, percentuale di partecipanti per i quali un modello è stato il migliore; probabilità di superamento, probabilità che il modello in questione sia il più frequentemente utilizzato nella popolazione.
Fondamentalmente, su una piccola parte delle prove, le forme presentate erano stimoli di generalizzazione (GS). I GS sono stati generati individualmente usando stime precise della capacità percettiva (misurata nella prima sessione di studio per il gruppo fMRI) per essere del 75% distinguibili in modo affidabile dal punto di vista percettivo dagli stimoli associati ai risultati avversivi (CS+ s). (A causa dei vincoli di tempo e della mancanza di controllo sull’ambiente di test, le GS sono state generate sulla base dell’acutezza percettiva media di uno studio pilota nel gruppo online). Il compito percettivo(Figura 1b) è stato progettato su misura sulla base delle raccomandazioni di una recente revisione(Struyf et al., 2015). In particolare, al fine di fornire un test equo delle prestazioni percettive durante il compito di generalizzazione, gli stimoli non erano immediatamente comparabili (per garantire che le GS fossero affidabili e discriminabili in senso assoluto, se presentate isolatamente;[Slivinske e Hall, 1960]), e il test si è svolto nello stesso contesto emotivo (cioè sotto la minaccia di uno shock doloroso).
È importante notare che l’array di stimoli del compito (in termini di disposizione degli stimoli CS+ e CS- nello spazio percettivo) è stato scelto specificamente per sondare le asimmetrie nel comportamento di generalizzazione che risultano dai meccanismi basati sui valori – vedi Figura 1b . Una di queste potenziali asimmetrie è uno spostamento caratteristico della risposta di picco dalla CS+ alla GS circostante, lontano dalla direzione della CS- nello spazio percettivo (noto come ‘spostamento di picco’), che è stato proposto come risultato dell’interazione di gradienti di generalizzazione eccitatori e inibitori intorno agli stimoli CS+ e CS- a seguito del condizionamento pavloviano (Hanson, 1959). Fondamentalmente, l’array asimmetrico qui utilizzato ci ha permesso di confrontare le risposte ai GS CS+ sia vicini che lontani nello spazio percettivo rispetto ai CS- – consentendo la rilevazione di effetti di interazione dei gradienti come lo spostamento di picco nell’elusione strumentale, e permettendo la separazione dei gradienti di generalizzazione firmati in modo opposto intorno agli stimoli CS+ e CS-.
Abbiamo condotto una serie di analisi sui dati delle nostre due coorti per rispondere alle nostre domande chiave. In primo luogo, abbiamo usato la modellazione dell’apprendimento di rinforzo per indagare se c’era evidenza di generalizzazione basata sui valori nel comportamento di evitamento. Successivamente, abbiamo usato l’analisi univariata dei dati fMRI per identificare le regioni cerebrali che codificavano quantità interne modellate specifiche dei processi di generalizzazione basati sui valori. Abbiamo poi adottato un approccio multivariato per indagare come la rappresentazione distribuita degli stimoli di generalizzazione in queste regioni sia cambiata nel corso del compito, e come questo sia collegato alle differenze individuali di generalizzazione. Infine, abbiamo usato i dati della nostra batteria di questionari online per determinare se specifici elementi di generalizzazione di evitamento erano sintomi psicologici auto-rappresentati.

Figura 1-figure supplement 3.Relazione tra le prove di evitamento medio sugli stimoli di generalizzazione (GS) durante la generalizzazione di un compito di evitamento strumentale e le valutazioni visive su scala analogica del dolore/perdita media dopo il compito.evitamento proporzionale per stimoli individuali (riga in alto) e per tipo di CS e numero di blocco (riga in basso) per la generalizzazione di un compito di evitamento strumentale.Effetti del condizionamento sull’acuità percettiva per gli stimoli del compito.(a) Progettazione dello studio e protocollo per i due gruppi di partecipanti; fMRI, laboratorio e campione di imaging funzionale; AMT, Amazon Mechanical Turk (web-based) campione.(b) compito percettivo ritardato-punito, utilizzato per determinare il 75% di stimoli di generalizzazione (GSs) su base individuale per la generalizzazione del compito di evitamento strumentale (c) nel campione fMRI (nel campione AMT, GSs sono stati generati sulla base dell’acuità percettiva media determinata nei test pilota).d) Sintesi del comportamento sul compito di generalizzazione nei campioni fMRI ede) AMT. ISI, intervallo inter-stimolo; ITI, intervallo inter-trial; CS+, stimolo condizionato con esito doloroso o perdita, CS-, stimolo condizionato con esito neutro (nessun dolore o perdita). Le barre di errore rappresentano SD. *p=0,006, **p<0,001, t-test campione abbinato.a) fMRI,b) AMT, campioni (Spearman ρ = 0,692, 0,641, rispettivamente).(a) fMRI,(b) AMT, campioni. ns, p>0,3. ^p=0,19, **p<0,001, misure ripetute ANOVA per differenze nella media degli stimoli di generalizzazione (GS).c) fRMI,d) AMT, campioni. Le barre di errore rappresentano l’errore standard.(a) Cambiamenti nell’acutezza percettiva misurata dal compito percettivo punito in ritardo, prima e dopo il condizionamento (esecuzione della generalizzazione del compito di evitamento strumentale), per ogni partecipante al gruppo fMRI. θ, cambiamento del parametro ρ dello stimolo ‘spikiness’ richiesto per identificare una forma come diversa nel 75% delle prove.b) Risultati del confronto del modello bayesiano effettuato per determinare il miglior modello di performance percettiva dei partecipanti durante la generalizzazione del compito di evitamento strumentale. Modello 1, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva dei GS è fissata al 75%. Modello 2, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva delle GS è fissata al valore determinato dal test di acuità post condizionamento. Modello 3, un modello di generalizzazione solo percettiva in cui la discriminabilità delle GS cambia linearmente dal valore derivato dal pre al post-condizionamento, nel corso del compito. Frequenza del modello, percentuale di partecipanti per i quali un modello è stato il migliore; probabilità di superamento, probabilità che il modello in questione sia il più frequentemente utilizzato nella popolazione.

Figura 1-figure supplement 1.Relazione tra la media delle prove di evitamento su stimolo di generalizzazione (GS) durante la generalizzazione del compito di evitamento strumentale, e la media delle valutazioni della scala analogica visiva post-task della scala del dolore/perdita.(a) fMRI,(b) AMT, campioni (Spearman ρ = 0,692, 0,641, rispettivamente).
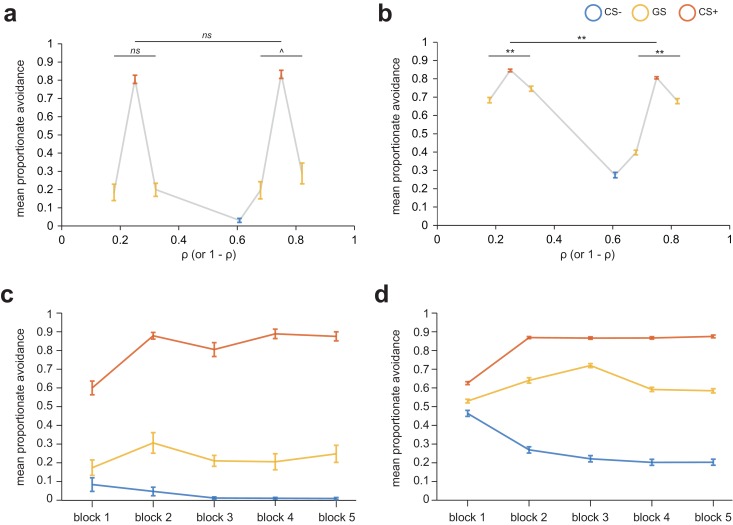
Figura 1-figure supplement 2.Figura 1—supplemento di figura 2. Evitamento proporzionale per gli stimoli dei singoli compiti (riga superiore) e per tipo di CS e numero di blocco (riga inferiore) per la generalizzazione dei compiti di evitamento strumentale.a) fMRI,b) AMT, campioni. ns, p>0.3. ^p=0,19, **p<0,001, misure ripetute ANOVA per differenze di evitamento medio tra gli stimoli di generalizzazione (GS).c) fRMI,d) AMT, campioni. Le barre di errore rappresentano l’errore standard.

Figura 1-figure supplement 3.Effetti del condizionamento sull’acutezza percettiva per gli stimoli di compito.(a) Cambiamenti nell’acuità percettiva misurata dal compito percettivo punito in ritardo, prima e dopo il condizionamento (esecuzione della generalizzazione del compito di evitamento strumentale), per ogni partecipante al gruppo fMRI. θ, cambiamento del parametro di stimolo ‘spikiness’ ρ richiesto per identificare una forma come diversa nel 75% delle prove.b) Risultati del confronto del modello bayesiano effettuato per determinare il miglior modello di performance percettiva dei partecipanti durante la generalizzazione del compito di evitamento strumentale. Modello 1, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva dei GS è fissata al 75%. Modello 2, un modello di generalizzazione solo percettiva in cui la discriminabilità percettiva delle GS è fissata al valore determinato dal test di acuità post condizionamento. Modello 3, un modello di generalizzazione solo percettiva in cui la discriminabilità delle GS cambia linearmente dal valore derivato dal pre al post-condizionamento, nel corso del compito. Frequenza del modello, percentuale di partecipanti per i quali un modello è stato il migliore; probabilità di superamento, probabilità che il modello in questione sia il più frequentemente utilizzato nella popolazione.
Evidenza di generalizzazione nel comportamento di evitamento
Per entrambi i gruppi di partecipanti, la frequenza dell’evitamento in risposta agli stimoli di generalizzazione è stata intermedia rispetto a quella evocata dagli stimoli CS- e CS+ (tutti p<0,0001, test di coppia-campione t; fMRI: GS vs CS- t25= 7,57, differenza media = 0,18 [95%CI 0,14-0,24], GS vs CS+ t25 = -17.6, differenza media = -0,60 [95%CI da -0,67 a -0,54]; AMT: GS vs CS- t481 = 27.0, differenza media = 0,35 [95%CI 0,33 – 0,38], GS vs CS+ t481 = -26,6,differenza media = -0,20 [95%CI -0,19 a -0,21]; Figura 1d,e). Nonostante non sia mai stato associato all’esito avverso, i partecipanti hanno anche valutato i GSs significativamente superiori agli stimoli CS- (ma inferiori a CS+) sulle scale di aspettativa dolore/perdita post-task (tutti p<0,0001, test di coppia-campione t; fMRI: GS vs CS- t25= 5,69, differenza media = 24,1 [95%CI 15-33], GS vs CS+ t25 = -8,14,differenza media = -52 [95% CI -39 a -66]; AMT: GS vs CS- t481 = 29.4, differenza media = 41,7 [95% CI 40,0-44,6], GS vs CS+ t481 = -16 ,5, media diversa = -18 [95% CI da -16,0 a -20,3], su scale analogiche visive che vanno da 0 a 100; [Figura 1d,e]).
C’è stata anche una significativa relazione positiva tra il relativo GS avoidance e il relativo GS pain/loss expectancy rating post-task in entrambi i gruppi (fMRI, Spearman’s ρ = 0.655, p=0,00027; AMT, Spearman’s ρ = 0,432, p=2,2e-16; entrambe le misure all’interno del partecipante z-transformato, per le relazioni tra i punteggi grezzi vedi [Figura 1-figuresupplement 1]). Ciò suggerisce che una maggiore frequenza di risposte di evitamento (più la mancanza di estinzione associata) si traduce in una maggiore consapevolezza delle convinzioni negative dell’aspettativa per gli stimoli di generalizzazione. Non c’era alcuna relazione tra l’evitamento proporzionale negli studi GS e l’acutezza percettiva alla sessione 1 (valori individuali θ) o l’intensità assoluta della stimolazione elettrica dolorosa (ampiezza della corrente) nel campione fMRI (tutti p>0,2).
Ciò solleva la questione se l’evitamento osservato negli studi GS sia stato superiore a quello che ci si aspetterebbe dalla sola incertezza percettiva. In particolare, l’evitamento medio proporzionato sugli studi GS nel gruppo fMRI era intorno a 0,2 (o ~0,25 quando è stato scalato rispetto all’evitamento medio individuale CS+) – il che, dato che i GS sono stati generati per essere del 75% distinguibili in modo affidabile dai CS+, è ciò che si sarebbe potuto prevedere da un conto puramente percettivo delle prestazioni del compito. I tempi medi di reazione per la realizzazione di risposte di evitamento sono stati anche significativamente più lenti per i GS rispetto agli stimoli CS+ in entrambi i gruppi, suggerendo una maggiore incertezza su queste prove (p=0,006, p=2.07e-11, prove t campione accoppiato; fMRI: t25= 3,00, differenza media = 167 ms [95% CI 51,2-282], AMT: t481 = 6,87,differenza media = 38,8 ms [95% CI 27,7-49,9]; [Figura 1d,e]). Per risolvere questo problema, abbiamo testato la presenza di ulteriori processi di generalizzazione basati sul valore in entrambi i set di dati utilizzando un approccio di confronto dei modelli basato sui principi.
Semplicemente, abbiamo applicato una serie di modelli di apprendimento di rinforzo per evitare i dati di entrambi i campioni (algoritmi di apprendimento Q modificati, con tassi di apprendimento variabili prova per prova determinati dalla regola di associabilità Pearce-Hall,[Sutton and Barto, 1998; Le Pelley, 2004] – vedi Materiali e metodi). In primo luogo, ci adattiamo a un modello con la sola ‘generalizzazione’ percettiva (modellata come 25% di possibilità di confusione percettiva tra i GS e le CS+ adiacenti) – cioè dove tutti gli stimoli dei compiti sono stati trattati come stati indipendenti, senza alcun trasferimento di valore tra gli stati. In secondo luogo, si adatta un modello con generalizzazione percettiva più un ulteriore processo di generalizzazione basato sul valore. Poiché ci sono prove che le funzioni di generalizzazione sono approssimativamente di forma gaussiana, almeno lungo una singola dimensione percettiva(Ghirlanda ed Enquist, 2003), questo è stato implementato come uno smussamento gaussiano del valore dello stimolo attraverso lo spazio percettivo, con un singolo parametro libero (σ) che regola l’ampiezza di questa funzione. In terzo luogo, si adatta un modello con generalizzazione percettiva più due parametri liberi aggiuntivi che governano l’ampiezza dei processi di generalizzazione basati su valori aggiuntivi – uno per il feedback avverso (shock/loss) e uno per il feedback neutro (no shock/no loss) (σ A e σN,rispettivamente). Questo modello è stato informato da precedenti osservazioni empiriche che le funzioni di generalizzazione variano in gradiente o ampiezza per il feedback avversivo, neutro e gratificante(Schechtman et al., 2010; Resnik e Paz, 2015; Laufer et al., 2016).
I modelli di cui sopra erano adatti ad evitare i dati di entrambi i gruppi utilizzando un approccio di Bayes variazionale all’inversione del modello, in un quadro a effetti misti (per cui i priori all’interno dei soggetti sono iterativamente raffinati e abbinati alla distribuzione della popolazione parentale dedotta; vedere Materiali e metodi). Il confronto del modello bayesiano a effetti casuali ha indicato che in entrambi i campioni il modello con due meccanismi aggiuntivi di generalizzazione del valore (che governano separatamente l’ampiezza della generalizzazione dal feedback avverso e neutro) rappresentava al meglio i dati di evitamento, come indicizzato dalla probabilità di superamento (probabilità che il modello in questione fosse il più frequentemente utilizzato nella popolazione; fMRI, EP = 0,823, AMT, EP =~ 1; Figura 2a).
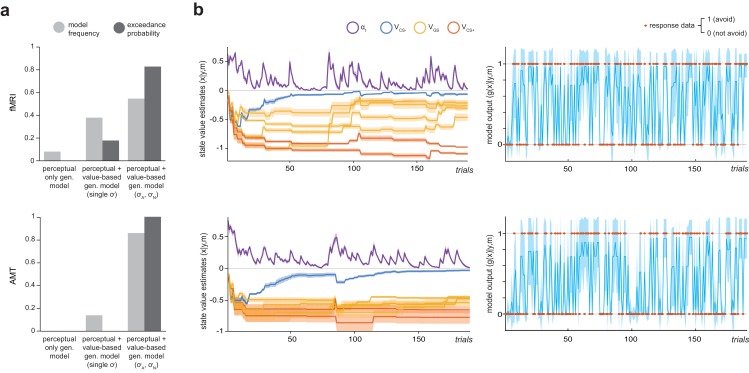
Figura 2.Modellizzazione computazionale del comportamento di prevenzione strumentale.(a) Risultati del confronto dei modelli bayesiani a effetti casuali per i campioni di laboratorio (fMRI) e online (AMT). Per entrambi i gruppi, il modello migliore è stato quello che ha implementato sia la generalizzazione percettiva che quella basata su valori aggiuntivi tra gli stimoli, con parametri separati che regolano l’ampiezza della generalizzazione dalfeedback avverso (σ A)e neutro (σ N). Frequenza del modello, percentuale di partecipanti per i quali un modello è stato il migliore; probabilità di superamento, probabilità che il modello in questione sia il più frequentemente utilizzato nella popolazione.b) Ilustrazione delle stime del valore dello stato posteriore (x: il valore di non evitare per ogni CS, VCS, più il tasso di apprendimento variabile, α t)e l’output del modello (g(x)) per il modello vincente (m) per un partecipante generalizzante inferiore (riga superiore) e un partecipante generalizzante superiore (riga inferiore) del gruppo fMRI. I punti arancioni sui pannelli laterali di destra illustrano i dati di risposta effettivi (y) su ogni prova. L’ombreggiatura rappresenta la varianza della densità posteriore.
Sia per i dati fMRI che per quelli AMT, questo modello ha fornito un buon resoconto delle decisioni di evitamento. La precisione predittiva media(r2, per i dati di scelta binaria è equivalente alla percentuale di classificazioni corrette) è stata di 0,868 (±0,07) per fMRI e 0,849 (±0.11) per i gruppi AMT, e il ‘valore p’ bayesiano (probabilità posteriore dell’ipotesi nulla di scelta casuale) era ≤6,8e-7 per tutti i partecipanti fMRI, e ≤0,026 per 477/482 partecipanti AMT. In entrambi i gruppi, i valori del parametro che descrive l’ampiezza del feedback avverso (σ A) non erano correlati ai valori di altri parametri del modello che regolano il tasso di apprendimento, il bias di scelta e la stocasticità di scelta (vedi Materiali e metodi; tutti p>0.09), suggerendo una sufficiente identificabilità del parametro. In entrambi i campioni, i valori σ A erano significativamente più grandi dei valori del parametro che regola l’ampiezza della generalizzazione dal feedback neutro (sicuro), σ N, che indica una generalizzazione più ampia per i risultati avversivi rispetto a quelli neutri (p=3.0e-8, p=2,2e-16, campioni correlati Wilcoxon ha firmato i test di rango; fMRI: media σ A=0,752 ± 0,29, media σ N=0,028 ± 0,03; AMT: media σ A=0,695 ± 0,23, media σ N=0,057 ± 0,05). È interessante notare che i valori σ A non erano significativamente correlati ai valori σ N( gruppofMRI, Spearman ρ = -0,169, p>0,4; gruppo AMT, ρ = 0,06, p>0,17), suggerendo che questi possono essere processi almeno parzialmente indipendenti.
È importante notare che solo un modello che includa meccanismi di generalizzazione basati su valori aggiuntivi può generare asimmetrie nel comportamento di evitamento attraverso coppie di stimoli di generalizzazione (spostamento di picco), come risulta dalla Figura 1-figure supplement 2. Inoltre, le tracce di esempio per due partecipanti rappresentativi del gruppo fMRI(Figura 2b) illustrano che i valori degli stimoli tendono ad essere asintoti – cioè che secondo questo modello la generalizzazione del valore attraverso gli stimoli si presume sia relativamente costante nel tempo. Questa ipotesi è coerente con i nostri dati comportamentali, in quanto un’analisi time-on-task ha mostrato che dopo il periodo iniziale di apprendimento esplorativo (blocchi 1-2), la generalizzazione in termini di GS avoidance rimane abbastanza stabile. In entrambi i gruppi di partecipanti, ci sono stati effetti significativi sia di tipo CS e numero di blocco, sia di un’interazione di tipo CS*blocco, sulla risposta di evitamento proporzionale (fMRI: F2,50=406,3, F4,100=6,14, F8,200=8,68, rispettivamente; AMT: F2,962=1077,9, F4,1962=24,3, F8,3848=263,0, rispettivamente; tutti p<0,001, misure ripetute ANOVA). Nel campione fMRI, l’interazione del tipo CS*blocco è stata guidata da un minore evitamento per gli stimoli CS+ nel blocco uno rispetto al resto del compito (p≤0,004; altri tipi di CS non ci sono differenze significative tra i blocchi; confronti a coppie Bonferroni corretti per i confronti multipli). Questo suggerisce una strategia di non-elusione esplorativa per consentire un corretto apprendimento degli stimoli CS+ nel blocco 1, ma una generalizzazione abbastanza costante dell’elusione attraverso i blocchi successivi. Nel campione AMT, c’è stata anche una minore evitamento per gli stimoli CS+ nel blocco uno rispetto agli altri blocchi (tutti p<0,001), ma una diminuzione dell’evitamento per gli stimoli CS- nei blocchi successivi (3-5) rispetto ai blocchi precedenti (1 e 2; tutti p<0,001). Complessivamente l’evitamento di GS ha mostrato piccoli aumenti poi diminuisce nei primi tre blocchi (p<0,001), prima di stabilizzarsi tra i blocchi 4 e 5 (p>0,5, Bonferroni-corregge i confronti a coppie; vedere [Figura1-figure supplement 2]).

Figura 2.Modellazione computazionale del comportamento di evitamento strumentale.(a) Risultati del confronto dei modelli bayesiani a effetti casuali per i campioni di laboratorio (fMRI) e online (AMT). Per entrambi i gruppi, il modello migliore è stato quello che ha implementato sia la generalizzazione percettiva che quella basata su valori aggiuntivi tra gli stimoli, con parametri separati che regolano l’ampiezza della generalizzazione dalfeedback avverso (σ A)e neutro (σ N). Frequenza del modello, percentuale di partecipanti per i quali un modello è stato il migliore; probabilità di superamento, probabilità che il modello in questione sia il più frequentemente utilizzato nella popolazione.b) Ilustrazione delle stime del valore dello stato posteriore (x: il valore di non evitare per ogni CS, VCS, più il tasso di apprendimento variabile, α t)e l’output del modello (g(x)) per il modello vincente (m) per un partecipante generalizzante inferiore (riga superiore) e un partecipante generalizzante superiore (riga inferiore) del gruppo fMRI. I punti arancioni sui pannelli laterali di destra illustrano i dati di risposta effettivi (y) su ogni prova. L’ombreggiatura rappresenta la varianza della densità posteriore.
Prove degli effetti del condizionamento sull’acutezza percettiva
Nel gruppo fMRI, l’acutezza percettiva per gli stimoli del compito è stata testata sia prima che dopo aver portato avanti il nostro paradigma di generalizzazione dell’evitamento strumentale, al fine di testare i possibili effetti di condizionamento avverso sulla discriminabilità degli stimoli di generalizzazione (le tre sessioni di test sono state effettuate su tre giorni consecutivi per tutti i partecipanti, quindi ogni cambiamento rilevato rifletterebbe probabilmente i cambiamenti post-consolidamento nella performance percettiva).
Non c’è stata una forte evidenza di cambiamento dell’acuità percettiva in termini di valore θ (differenza nel parametro rho della forma ‘spikiness’ per una discriminazione percettiva affidabile al 75%) prima e dopo il condizionamento (media θ 0.071 ± 0,015 sulla sessione 1, 0,065 ± 0,019 sulla sessione 3; tendenza non significativa verso una maggiore acuità sulla sessione 3, p=0,061, relativi-campioni di Wilcoxon test di rango firmato; [Figura 1-figure supplement 3]). Il confronto del modello bayesiano ha indicato che un modello in cui la discriminabilità dello stimolo di generalizzazione è stata mantenuta costante al 75% rappresentava meglio i dati di evitamento rispetto ad un modello in cui la discriminabilità è stata mantenuta costante al livello stimato post-test (sessione 3), o un modello in cui la discriminabilità GS è stata ipotizzata essere lineare tra i valori della sessione 1 e della sessione 3 (probabilità di superamento per il modello costante al 75% = ~1; [Figura 1-figuresupplement 3]). Pertanto la discriminabilità GS è stata mantenuta costante tra le prove al 75% in tutti i modelli.
Differenze nel comportamento di evitamento tra coorti di laboratorio e online
Come si può vedere nella Figura 1, sia la media dell’evitamento che la media dell’aspettativa di esito avverso per i GS (in assenza di evitamento) erano più elevate nel campione AMT rispetto al campione MRI (media proporzionale dell’evitamento dei GS nel gruppo MRI): 0,22 ± 0,14, AMT: 0,63 ± 0,18; valutazione media dell’aspettativa di dolore/perdita [su 100] nel gruppo MRI: 30 ± 23, AMT: 63 ± 19). Una potenziale spiegazione di questa differenza è che c’era una minore discriminazione assoluta degli stimoli di generalizzazione per i partecipanti all’AMT. Sebbene i valori θ (differenza in ρ tra gli stimoli CS+ e GS) fossero simili per la coorte online e quella basata sul laboratorio (0,071 ± 0,015 per il gruppo di risonanza magnetica, e 0,065 per tutti i partecipanti all’AMT), non siamo stati in grado di controllare fattori come la distanza dei partecipanti dallo schermo e la minimizzazione della finestra sperimentale, che possono aver portato a GS meno discriminabili di quanto stimato nel nostro studio pilota (vedi Materiali e metodi). Inoltre, è possibile che i partecipanti che conducono lo studio online abbiano prestato meno attenzione al compito rispetto ai partecipanti supervisionati in laboratorio (ad esempio, erano multitasking), con conseguente aumento dei tassi di risposta indipendenti dagli stimoli. Infine, è possibile che ci siano state differenze a livello di gruppo per quanto riguarda l’orientamento decisionale per la perdita monetaria rispetto al rinforzatore del dolore – ad esempio a causa delle differenze nell’avversione generale tra i due risultati. In effetti, c’è stata evidenza di una differenza nel bias decisionale, come catturato dal parametro di bias softmax, tra i gruppi. Il bias medio contro la decisione di evitare era di 0,415 ± 0,14 nel campione di risonanza magnetica, e di 0,315 ± 0,15 nel campione di AMT (p=0,0013, 95% CI per la differenza 0,04-0,16, t28,5=3,56; test Welch-Satterthwaite a due campioni t; nb grande differenza in N tra i gruppi).
Regioni cerebrali che codificano le quantità del modello di codifica specifiche per la generalizzazione basata sul valore
Poiché i nostri dati comportamentali hanno fornito la prova della presenza di generalizzazione nell’elusione strumentale in entrambi i gruppi, abbiamo poi impiegato un approccio di analisi univariata ai nostri dati di imaging funzionale per indagare se le quantità del modello specifiche dei processi di generalizzazione legati al valore fossero codificate in segnali regionali dipendenti dal livello di ossigeno nel sangue (BOLD).
Oltre al lavoro che ha evidenziato il ruolo dell’insula, dell’amigdala e della corteccia sensoriale primaria nella generalizzazione avversa a seguito del condizionamento pavloviano(Ghosh e Chattarji, 2015; Onat e Büchel, 2015; Resnik e Paz, 2015; Laufer et al., 2016), precedenti studi di imaging funzionale hanno identificato lo striato e la corteccia prefrontale come gradienti di generalizzazione codificanti nei volontari umani sani(Dunsmoor et al., 2011; Greenberg et al., 2013; Lissek et al., 2014). Tuttavia, il contributo dell’incertezza percettiva (cioè l’assoluta discriminabilità degli “stimoli di generalizzazione” rispetto ad altri stimoli condizionati) non è sempre adeguatamente affrontato nello studio di tali gradienti. In questo caso, abbiamo utilizzato un approccio parametrico rigoroso per identificare ulteriori varianze in BOLD regionali che possono essere attribuite al nostro modello di generalizzazione basato sul valore vincente, oltre a quello che può essere spiegato da un conto puramente percettivo. Questo è stato ottenuto utilizzando regressori ortogonali in serie derivati da ciascun modello per prevedere la variazione prova per prova del segnale di BOLD nelle nostre regioni di interesse (vedi Figura 3a e Materiali e metodi).
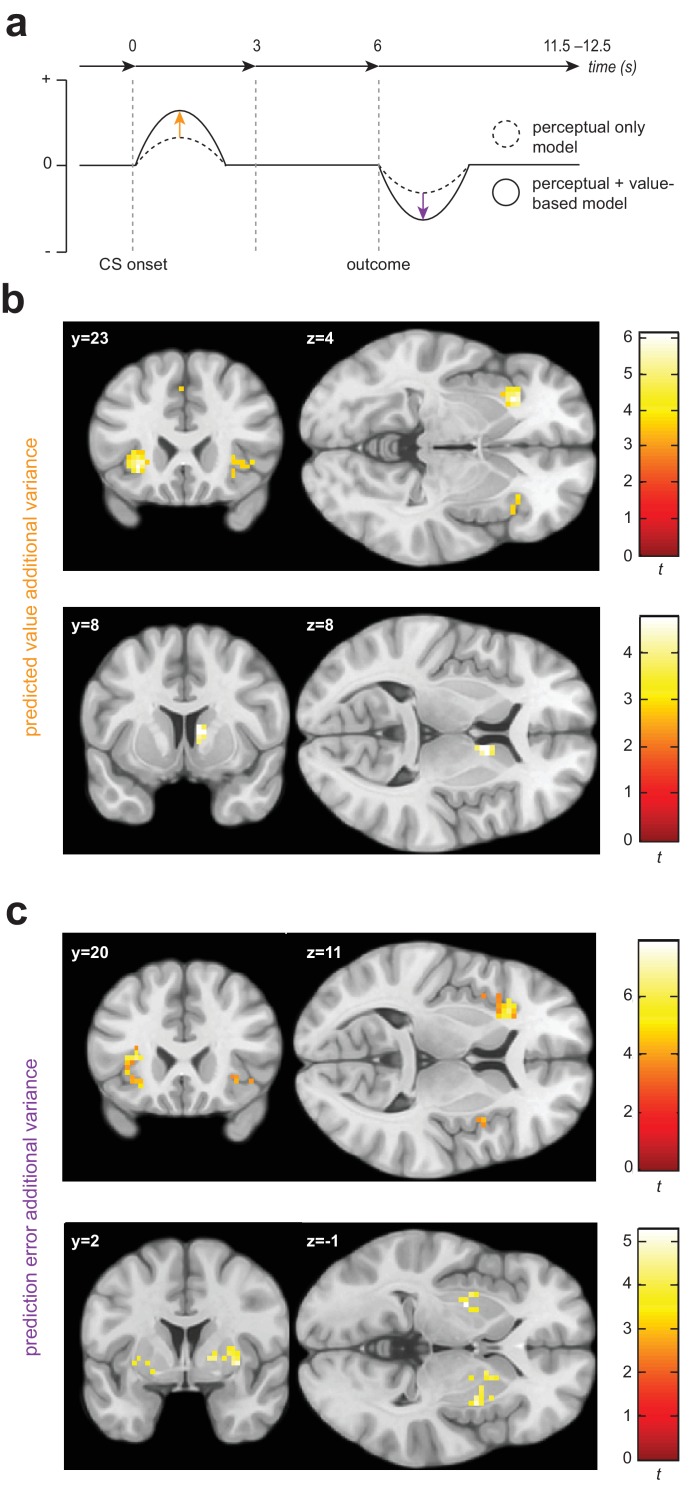
Figura 3.Le mappe statistiche univariate evidenziano le regioni cerebrali in cui le variazioni del segnale di BOLD sono significativamente correlate alla variazione prova per prova delle grandezze interne del modello di generalizzazione basata sul valore, oltre a quanto può essere spiegato da un conto puramente percettivo.(a) Schema di un singolo trial per il gruppo fMRI, che mostra la differenza tra la probabilità stimata di ricevere uno shock (se non viene fatta una risposta di evitamento) e l’errore di previsione degli esiti, come derivato dal solo percettivo rispetto ai modelli di generalizzazione basati sul valore aggiunto + percettivo.(b) Codifica significativa della generalizzazione basata sul valore addizionale nel valore atteso di ogni stimolo (probabilità di ricevere uno shock doloroso se non si ottiene una risposta di evitamento), al momento dell’insorgenza dello stimolo nell’insula anteriore e nel caudato destro.(c) Codifica significativa della generalizzazione aggiuntiva basata sul valore, espressa in grandezza dell’errore di previsione al momento della ricezione dell’esito nell’insula anteriore, nel putamene e nel pallido destro. L’ombreggiatura della mappa a colori rappresenta i valori t.
Abbiamo trovato la prova per la codifica della varianza supplementare nella prova per prova i valori di stimolo attesi derivanti dal modello di generalizzazione basato sul valore, sia nella corteccia insulare anteriore e lo striato dorsale(Figura 3b). Il segnale di BOLD era maggiore quando il valore atteso di un particolare stimolo era più basso (o la probabilità prevista di ricevere uno shock doloroso se non è stata fatta una risposta di evitamento era più alta) nell’insula anteriore sinistra(pWB= 0.0073, k= 73, picco voxel [-30,23,-4], Z = 4,71; tendenza sotto soglia nell’insula anteriore destra: pSVC = 0.073, k= 9, voxel di picco [42,23,-1], Z = 3,45), e caudato destro (pSVC = 0,024, k = 20,voxel di picco [9,8,8], Z = 3,95). Non c’erano prove di una codifica univariata di questo segnale nella corteccia visiva primaria (V1) o nell’amigdala. Non abbiamo anche trovato alcuna prova di codifica negativa di valore avversivo (maggiore segnale di BOLD con minore probabilità prevista di shock, o ‘segnalazione di sicurezza’) nella corteccia prefrontale ventromediale (vmPFC).
Oltre ai segnali di valore atteso, abbiamo esaminato la potenziale codifica degli errori di previsione, che sono i principali segnali di apprendimento nell’apprendimento del rinforzo (PEs; definito come la differenza tra il risultato effettivo e quello previsto in un dato processo – vedi Materiali e metodi). Abbiamo focalizzato la nostra analisi sui PEs firmati negativamente (generati su prove in cui non è stato ricevuto alcuno shock, ma il P(shock) previsto era >0), in quanto questo vincola l’analisi sia alle prove in cui non è stata fatta una risposta di evitamento (sulle prove di evitamento PE = 0, per definizione), sia alle prove di generalizzazione in cui, a causa della sola incertezza percettiva, il P(shock) previsto sarà >0, ma non viene mai fornito alcun risultato avverso. (I PE firmati positivamente sono altamente collineari con somministrazione di shock e quindi difficili da rilevare sotto il nostro disegno).
Abbiamo anche trovato prove di una significativa codifica di ulteriori varianze nei segnali PE dal modello di generalizzazione basato sul valore in insula e striato(Figura 3c). In particolare, il segnale BOLD era maggiore quando il PE di prova era più negativo nell’insula anteriore, bilateralmente (a sinistra: pSVC= 9,72e-5, k = 93, picco voxel [-33,20,11], Z = 5.48; a destra: pSVC= 0,024, k = 19, peak voxel [33,26,-4], Z = 4,35), insula destra più posteriore (pSVC = 5.85e-5, k= 65, voxel di picco [48,8,-4], Z = 4,40), putamen, bilateralmente (a sinistra: pSVC = 0,024, k = 20 ,voxel di picco [-27,-4,-1], Z = 4.29; a destra: pSVC= 0,009, k = 31, peak voxel [33,2,-1], Z = 4,06), e pallidum destro (pSVC = 0,046, k = 14, peak voxel[18,5,2], Z = 3,74). Cluster significativi sono stati osservati anche nella corteccia cingolata media(pWB= 0,001, k = 103, voxel di picco [6,14,44], Z = 4.46), opercolo parietale sinistro(pWB= 3,56e-5, k = 168, peak voxel [-48,-25,14], Z = 4,10), lobule parietale inferiore destro (pWB = 0.003, k= 90, voxel di picco [54,-40,26], Z = 3,82) e giro frontale inferiore (pWB = 0,023, k = 56, voxel di picco [42,5,35], Z= 4.31) – ma non abbiamo trovato alcuna evidenza di codifica dei segnali PE derivati dalla generalizzazione dei valori in V1, l’amigdala, o vmPFC.

Figura 3.Figura 3. Mappe statistiche univariate evidenziano le regioni cerebrali in cui i cambiamenti nel segnale di BOLD sono significativamente correlati alla variazione prova per prova delle grandezze del modello interno del modello di generalizzazione basato sul valore, oltre a quello che può essere spiegato da un conto puramente percettivo.(a) Schema di un singolo trial per il gruppo fMRI, che mostra la differenza tra la probabilità stimata di ricevere uno shock (se non viene fatta una risposta di evitamento) e l’errore di previsione degli esiti, come derivato dal solo percettivo rispetto ai modelli di generalizzazione basati sul valore aggiunto + percettivo.(b) Codifica significativa della generalizzazione basata sul valore addizionale nel valore atteso di ogni stimolo (probabilità di ricevere uno shock doloroso se non si ottiene una risposta di evitamento), al momento dell’insorgenza dello stimolo nell’insula anteriore e nel caudato destro.(c) Codifica significativa della generalizzazione aggiuntiva basata sul valore, espressa in grandezza dell’errore di previsione al momento della ricezione dell’esito nell’insula anteriore, nel putamene e nel pallido destro. L’ombreggiatura della mappa a colori rappresenta i valori t.
Cambiamenti nella rappresentazione neurale degli stimoli di generalizzazione nel corso del compito: relazione con le differenze individuali nel comportamento di evitamento
Studi precedenti in modelli animali hanno dimostrato che nel corso del condizionamento, la rappresentazione dello stimolo condizionato (CS+) in termini di pattern di risposta in molte singole unità può arrivare ad assomigliare a quella del rinforzatore primario avverso (ad es. Grewe et al., 2017). Per completare i nostri risultati univariati, abbiamo quindi esaminato come diversi stimoli di compito sono stati rappresentati nello spazio multivariato utilizzando l’analisi della somiglianza rappresentazionale(Kriegeskorte et al., 2008). Questo approccio permette di considerare l’intera geometria rappresentazionale attraverso specifiche regioni cerebrali – come le informazioni sono codificate, così come se lo sono o meno – e dipende dal calcolo delle metriche di distanza per quantificare come (dis)similmente diversi tipi di stimoli sono rappresentati nello spazio multivariato (in fMRI, attraverso tutti i voxel in un particolare volume cerebrale).
Seguendo l’approccio di un recente studio di condizionamento avverso nei roditori(Grewe et al., 2017), abbiamo esaminato come la differenza di rappresentazione è cambiata nelle nostre regioni di interesse in precedenza (blocchi 1-2) rispetto a quelle successive (blocchi 3-5) nel compito – e, soprattutto, come questo cambiamento è legato alle differenze individuali nelle espressioni comportamentali complessive di condizionamento. In particolare, abbiamo indagato se i cambiamenti nella rappresentazione di GS, rispetto a CS+, gli stimoli nel corso del compito riguardavano la tendenza individuale a generalizzare il valore da CS+ a stimoli GS – come catturato comportamentale nelle risposte di evitamento su prove GS. Abbiamo calcolato una stima robusta e convalidata incrociata della distanza rappresentazionale, il contrasto discriminante lineare di Fisher (vedere Materiali e metodi, Figura 4a) per massimizzare l’affidabilità dei nostri risultati. È importante notare che l’uso di una misura di distanza cross-validata significa che le stime di (dis)-similarità derivate sono imparziali dal rumore (che può potenzialmente variare tra gli individui e i percorsi di imaging), e hanno un punto zero significativo(Walther et al., 2016).
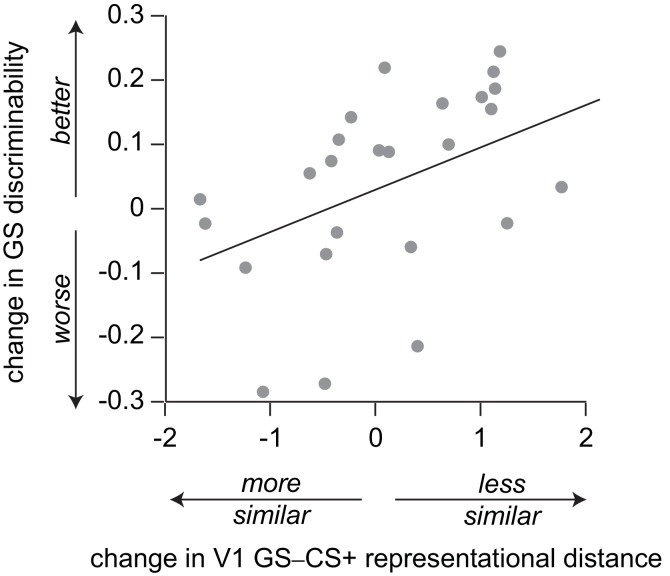
Figura 4-figure supplemento 1.I risultati della fMRI multivariata evidenziano le regioni in cui il cambiamento nella geometria di rappresentazione nel corso del compito tra stimoli di generalizzazione (GS) e stimoli associati al dolore (CS+s) è correlato alle differenze individuali nell’evitare GS complessivo e il parametro del modello che governa l’ampiezza della generalizzazione da feedback avverso (σ A).Relazione tra il cambiamento nella discriminazione degli stimoli, pre vs post-condizionamento, e il cambiamento nella distanza rappresentazionale GS-CS + (CV LDC) nella corteccia visiva primaria (V1) nel corso del compito di generalizzazione.(a) Schema dell’analisi di contrasto discriminante lineare (basato su[Kriegeskorte et al., 2007]). All’interno di cross-validazione pieghe, i dati da una corsa di imaging viene proiettato sul confine decisione ottimale derivato da altre corse, al fine di rimuovere l’inflazione dal rumore nella stima finale distanza (ottenuta facendo la media tra le pieghe).(b) Modelli di regressione multipli che descrivono in dettaglio come i cambiamenti nella (dis)somiglianza rappresentazionale nel corso del compito in ogni ROI si riferiscono all’elusione relativa complessiva nelle prove di generalizzazione, e(c) alle differenze individuali nel parametro del modello che regola l’ampiezza della generalizzazione dal feedback avverso. Le barre di errore rappresentano l’errore standard.(d) Visualizzazione delle relazioni bivariate tra il cambiamento della geometria rappresentazionale e l’evitamento di GS grezzo (nella corteccia visiva primaria), e(e) tra il cambiamento della geometria rappresentazionale e i singoli valori σ A (nell’insula anteriore, amigdala e V1), ponderati in base alla precisione della stima dei singoli parametri (1/varianza posteriore). La maggiore dimensione della bolla rappresenta una maggiore precisione (e quindi un maggiore peso di regressione). L’ombreggiatura in azzurro sulle immagini strutturali illustra i dati dei volumi di ROI da cui sono stati estratti in ogni caso. CV LDC, leave-one-out cross-validated contrasto lineare discriminante; un insula, insula anteriore; vmPFC, corteccia prefontale ventromediale. *p<0.05, **p<0.01.Pre-condizionamento (test del primo giorno), la discriminabilità per lo stimolo target ± θ era di 0,75 (75% di giudizi di differenza corretti), per definizione. Post-condizionamento (test del 3° giorno), la discriminabilità media per il target ± θ è stata di 0,79 (SD 0,14).
Nel complesso, per nessuna regione di interesse c’è stato un significativo cambiamento a livello di gruppo nella distanza rappresentazionale tra gli stimoli GS e CS+ (tutti p>0,03, test p>0,03, test di coppia-campione t; soglia Bonferroni-corretta = 0,01 per alfa = 0,05). Tuttavia, tra gli individui, maggiore aumento della somiglianza della rappresentazione di GS a stimoli CS + nel corso del compito nella corteccia visiva primaria è stata correlata ad una maggiore generalizzazione comportamentale in termini di maggiore evitamento GS relativo (p = 0,010, modello di regressione lineare multipla p = 0,010, modello di regressione lineare; Tabella 1, Figura 4b). Per gli individui che hanno fatto una maggiore proporzione relativa di risposte di evitamento verso gli stimoli di generalizzazione, la rappresentazione V1 degli stimoli GS è risultata più simile a quella degli stimoli CS+ nel corso del compito – ma per gli individui che hanno evitato meno nelle prove GS, gli stimoli GS sono risultati meno rappresentati in modo simile ai CS+ in queste regioni (per la visualizzazione della relazione tra l’evitamento GS proporzionale grezzo e il cambiamento di distanza V1, vedi Figura 4d ). Non c’è stata evidenza di una relazione significativa tra il cambiamento di distanza rappresentazionale GS-CS+ e la relativa elusione GS nell’insula anteriore, striato, amigdala o vmPFC (Tabella 1,Figura 4b ). Abbiamo confermato questi risultati implementando una regressione regolarizzata cross-validata (CV LASSO, vedi Materiali e metodi) sugli stessi dati (questo tipo di regressione riduce i coefficienti predittori non significativi a zero, e in generale risulta in coefficienti più piccoli rispetto alla regressione lineare tradizionale). Nell’ambito di questo robusto approccio, la variazione della somiglianza GS-CS+ in V1, ma non in altre regioni, è stata mantenuta come un significativo predittore di evitamento relativo di GS (β = -0,040), nel modello che minimizzava l’errore medio al quadrato (MSE).
| Variazione della distanza di rappresentazione GS-CS+ | β | SE | t | p |
|---|---|---|---|---|
| a. insula | −0.04287 | 0.06798 | −0.631 | 0.535 |
| caudato | −0.02304 | 0.04173 | −0.552 | 0.587 |
| amigdala | −0.09792 | 0.09905 | −0.989 | 0.335 |
| V1 | −0.10072 | 0.03531 | −2.852 | 0.010* |
| vmPFC | −0.07407 | 0.07938 | −0.933 | 0.362 |
Utilizzando un test post hoc, abbiamo esaminato se i cambiamenti nella distanza di rappresentazione GS-CS+ in V1 possono essere correlati a cambiamenti nella discriminabilità assoluta degli stimoli di generalizzazione (come misurato il giorno prima e il giorno dopo la sessione di test di generalizzazione). La discriminabilità media per i GS (CS+ ± θ) è stata di 0,75 nella sessione 1, per definizione, e di 0,79 nella sessione 3 (±0,14, range 0,465-0,994; anche se si noti a livello di gruppo non c’è stato alcun cambiamento significativo nei valori θ misurati tra le sessioni, vedi sopra). Nell’ambito di questa analisi esplorativa, abbiamo trovato prove di una significativa associazione tra il cambiamento della distanza rappresentazionale V1 GS-CS+ durante il compito, e i cambiamenti post-condizionamento della discriminabilità percettiva dei GS. Gli individui che hanno mostrato un aumento della somiglianza di rappresentazione hanno mostrato peggiori prestazioni percettive post-(vs pre) condizionamento, e quelli che hanno mostrato una diminuzione della somiglianza mostrando migliori prestazioni (Spearman ρ = 0,518, p = 0,007; vedi [Figura4-figure supplement 1]). Non vi era alcuna relazione significativa tra il cambiamento di acutezza percettiva e la distanza rappresentazionale in qualsiasi altra regione del cervello (tutti p>0,09).
Tutti i risultati univariati fMRI presentati sopra sono rimasti significativi se re-ran utilizzando regressori derivati da un modello in cui la discriminabilità percettiva di GSs cambia linearmente nel corso del compito da pre- a post-condizionamento livelli di acuità misurata (pieno, senza soglia mappe statistiche per tutte le analisi sono disponibili a Neurovault; neurovault.org/collections/3177).

Figura 4-figure supplemento 1.I risultati della fMRI multivariata evidenziano le regioni in cui il cambiamento nella geometria di rappresentazione nel corso del compito tra stimoli di generalizzazione (GS) e stimoli associati al dolore (CS+s) è correlato alle differenze individuali in generale evitare GS e il parametro del modello che governa l’ampiezza della generalizzazione da feedback avverso (σ A).Relazione tra il cambiamento nella discriminazione degli stimoli, pre vs post-condizionamento, e il cambiamento nella distanza rappresentazionale GS-CS + (CV LDC) nella corteccia visiva primaria (V1) nel corso del compito di generalizzazione.(a) Schema dell’analisi di contrasto discriminante lineare (basato su[Kriegeskorte et al., 2007]). All’interno di cross-validazione pieghe, i dati da una corsa di imaging viene proiettato sul confine decisione ottimale derivato da altre corse, al fine di rimuovere l’inflazione dal rumore nella stima finale distanza (ottenuta facendo la media tra le pieghe).(b) Modelli di regressione multipli che descrivono in dettaglio come i cambiamenti nella (dis)somiglianza rappresentazionale nel corso del compito in ogni ROI si riferiscono all’elusione relativa complessiva nelle prove di generalizzazione, e(c) alle differenze individuali nel parametro del modello che regola l’ampiezza della generalizzazione dal feedback avverso. Le barre di errore rappresentano l’errore standard.(d) Visualizzazione delle relazioni bivariate tra il cambiamento della geometria rappresentazionale e l’evitamento di GS grezzo (nella corteccia visiva primaria), e(e) tra il cambiamento della geometria rappresentazionale e i singoli valori σ A (nell’insula anteriore, amigdala e V1), ponderati in base alla precisione della stima dei singoli parametri (1/varianza posteriore). La maggiore dimensione della bolla rappresenta una maggiore precisione (e quindi un maggiore peso di regressione). L’ombreggiatura in azzurro sulle immagini strutturali illustra i dati dei volumi di ROI da cui sono stati estratti in ogni caso. CV LDC, leave-one-out cross-validated contrasto lineare discriminante; un insula, insula anteriore; vmPFC, corteccia prefontale ventromediale. *p<0.05, **p<0.01.Pre-condizionamento (test del primo giorno), la discriminabilità per lo stimolo target ± θ era di 0,75 (75% di giudizi di differenza corretti), per definizione. Post-condizionamento (test del 3° giorno), la discriminabilità media per il target ± θ è stata di 0,79 (SD 0,14).

Figura 4-figure supplement 1.Relazione tra il cambiamento nella discriminabilità dello stimolo, pre vs post-condizionamento, e il cambiamento nella distanza di rappresentazione GS-CS + (CV LDC) nella corteccia visiva primaria (V1) nel corso del compito di generalizzazione.Pre-condizionamento (test del primo giorno), la discriminabilità per lo stimolo target ± θ era di 0,75 (75% di giudizi di differenza corretti), per definizione. Post-condizionamento (test del 3° giorno), la discriminabilità media per il target ± θ è stata di 0,79 (SD 0,14).
Cambiamenti nella rappresentazione neurale degli stimoli di generalizzazione nel corso del compito: relazione con le differenze individuali nella generalizzazione basata sui valori
Abbiamo anche cercato di mettere in relazione i singoli cambiamenti nella somiglianza della rappresentazione di GS verso gli stimoli CS+ nel corso del compito con le stime dei singoli parametri del modello che regolano l’ampiezza della generalizzazione, in particolare dal feedback avverso (valori σ A).
Abbiamo scoperto che i maggiori aumenti della similarità di rappresentazione delle GS rispetto agli stimoli CS+ nel corso del task nell’insula anteriore e nell’amigdala erano correlati ad una maggiore generalizzazione da stime di parametri di feedback avverso (p=0,024, p=0,012, rispettivamente, modello di regressione lineare multipla ponderata con precisione; si veda la Tabella 2, Figura 4c,e). Abbiamo anche scoperto che la variazione della distanza rappresentazionale GS-CS+ nella V1 era correlata a differenze individuali nella generalizzazione del feedback avverso – nella direzione opposta (p<0,001; Tabella 2). In modo piuttosto contro-intuitivo, gli aumenti della somiglianza GS-CS+ in V1 sono stati associati a valori più bassi dei parametri di generalizzazione del valore avverso (Figura 4c,e). Una possibile spiegazione di questa scoperta è che è il risultato di cambiamenti mediati da V1 nell’acuità percettiva per i GS – cioè un aumento della somiglianza rappresentazionale GS-CS+ nel corso del compito, associata ad una diminuzione dell’acuità percettiva per gli stimoli GS, si traduce in una minore richiesta di generalizzazione aggiuntiva basata sul valore in questi individui. In particolare, questa relazione bidirezionale persisteva se i valori individuali σ A venivano ricalcolati utilizzando un modello comportamentale che teneva conto dei potenziali cambiamenti indotti dal condizionamento dell’acuità percettiva (ad es. discriminabilità percettiva degli stimoli di generalizzazione cambiato linearmente attraverso le prove da pre a post-test di generalizzazione valori misurati; amigdala: β = -0.353, SE = 0,07, t = -5, 42, p=2,65e-5; V1: β = 0,204, SE = 0,04, t = 5,08, p=5,77e-5). Questo suggerisce che un presunto compromesso di generalizzazione percettiva vs valore basato su generalizzazione esiste a livello cerebrale, piuttosto che a livello comportamentale. Variazione della distanza rappresentativa in nessuna regione è sopravvissuto come un predittore di σ A valori nel modello più robusto CV LASSO.
| Cambiamento nella distanza rappresentazionale GS-CS | β | SE | t | p |
|---|---|---|---|---|
| a. insula | −0.357 | 0.146 | −2.448 | 0.024* |
| caudato | −0.082 | 0.043 | −1.908 | 0.071 |
| amigdala | −0.285 | 0.103 | −2.761 | 0.012* |
| V1 | 0.299 | 0.064 | 4.684 | <0.001* |
| vmPFC | 0.277 | 0.217 | 1.277 | 0.216 |
Anche se meno ben studiato rispetto al dominio avversivo, ci sono prove che l’amigdala è anche coinvolto nell’acquisizione di informazioni sulla sicurezza nei roditori e primati non umani(Rogan et al., 2005; Genud-Gabai et al., 2013), e che il trascinamento mediale prefrontale dell’amigdala è associato con la sicurezza appresa (successo nel superamento della paura generalizzata condizionata) nei topi(Likhtik et al., 2014). Questo si adatta a una vasta letteratura sul vmPFC che svolge un ruolo nella “segnalazione di sicurezza” negli esseri umani (Fullanaet al., 2016). Come un’ulteriore analisi esplorativa, abbiamo quindi indagato se ci fosse una relazione tra il cambiamento in GS-CS- similitudine nel corso del compito nel amigdala e vmPFC e valori individuali del parametro che regola l’ampiezza della generalizzazione da neutro (non dolore) feedback, σ N. (Nb, acausa della disposizione degli stimoli compito, vedi Figura 1b, il nostro progetto non è ottimizzato per sondare GS-CS- generalizzazione valore a livello di categoria di stimolo).
Abbiamo trovato prove di relazioni significative tra GS-CS- cambiamento di somiglianza tra l’amigdala e vmPFC e i singoli valori σ N– in modo tale che gli individui in cui la rappresentazione dei GS è risultata più simile a CS- in entrambe queste regioni avevano valori dei parametri di generalizzazione più neutri (“sicurezza”) (amigdala: β = -0.043, SE 0,0086, t= -5,02, p=4,43e-5; vmPFC: β = -0,069, SE 0,009, t = -7,58, p=1,07e-7; modello di regressione lineare multipla ponderata con precisione). La variazione rappresentativa del vmPFC (ma non dell’amigdala) è stata mantenuta nel modello LASSO del CV MSE che minimizza il CV (β = -0,032).
Relazione tra le differenze individuali nella generalizzazione basata sui valori e la psicopatologia auto-riferita
Le ipotesi sul ruolo della generalizzazione nei disturbi psicologici tendono a riferirsi a una eccessiva generalizzazione dell’informazione avversa – ma è stato anche proposto che una scarsa discriminazione (ad esempio tra CS+ e CS- nei gruppi di ansiosi) può essere dovuta a un apprendimento inadeguato degli spunti di sicurezza. Abbiamo quindi esaminato prima di tutto come i punteggi dei sintomi psicologici si riferiscono ai valori σ A individuali, ma abbiamo anche esaminato le possibili relazioni con i valori σ N individuali, nella nostra coorte online (N = 482).
Seguendo l’approccio di Gillan et al. (2016), il gruppo online ha completato una batteria di questionari di auto-relazione che hanno sondato i sintomi ipotizzati in relazione all’iper-generalizzazione avversa (ansia da tratto, sintomi di disturbo dell’umore, tratti ossessivo-compulsivi e stile cognitivo ‘globale’), oltre ad alcune misure di controllo positive (scale di apatia e di impulsività). (Un riassunto dei punteggi di queste misure e altre informazioni demografiche per entrambi i campioni è disponibile nel file supplementare 1). Per consentire il confronto con i risultati di Gillan et al., le informazioni di self-report sono state confrontate per la prima volta con le stime dei singoli parametri utilizzando modelli di regressione lineare ponderati con precisione, il controllo per l’età e l’identità di genere (vedi Materiali e metodi). Questo approccio è stato poi integrato dall’implementazione di modelli di regressione regolarizzati e convalidati trasversalmente (CV LASSO regression), come nella sezione precedente (questi modelli includevano anche l’età e l’identità di genere come regressori di nessun interesse).
In primo luogo, abbiamo cercato di identificare se i singoli valori del parametro che regola l’ampiezza della generalizzazione dal feedback avverso (σ A) fossero correlati ai punteggi dei sintomi su qualsiasi misura. I punteggi totali tra le misure hanno mostrato una buona o eccellente affidabilità interna (media di Cronbach α = 0,882, vedi file supplementare 2), e, come ci si potrebbe aspettare, covariata significativamente tra i partecipanti (media assoluta r per l’inter-correlazione tra i punteggi = 0,479). La regressione dei punteggi totali rispetto alle stime dei parametri è stata quindi implementata in modelli separati per ogni misura, al fine di consentire una significativa suddivisione della varianza. Il valore p di Nyholt-Bonferroni corretto per la significatività attraverso questi modelli separati di misure non indipendenti è stato p<0,010 per mantenere un alfa di 0,05 (numero effettivo di variabili indipendenti = 5,0, vedi Materiali e metodi).
Le stime dei parametri che regolano l’ampiezza della generalizzazione dal feedback avverso sono state trovate significativamente associate positivamente con i punteggi di ansia tratto (maggiore ampiezza con maggiore ansia), e in modo significativamente negativo associato con l’apatia tratto (minore ampiezza con maggiore apatia; ansia, p=0,009, apatia, p<0,001, modelli di regressione lineare individuali ponderati con precisione che controllano per età e sesso; si veda la Tabella 3, Figura 5a). Questi due effetti sono rimasti significativi quando i punteggi di ansia e apatia sono stati inclusi nello stesso modello, suggerendo che fossero indipendenti (ansia: β = 0.050, SE 0,015, t= 3,34, apatia: β = -0,060, SE 0,014, t = -4,28; entrambi p<0,001). Questo risultato è stato confermato dall’analisi cross-validata e regolarizzata; quando tutti i predittori sono stati inseriti nello stesso modello, sia i punteggi totali di ansia che quelli di apatia sono stati mantenuti come predittori nel modello che minimizzava l’MSE (β = 0,021, β = -0,032, rispettivamente). Nessun punteggio totale del questionario era significativamente correlato ai valori σ N (p>0,05).
| Misura del questionario | β | SE | t | p |
|---|---|---|---|---|
| Totale STAI | 0.039 | 0.015 | 2.626 | 0.009* |
| Totale AMI | −0.051 | 0.014 | −3.687 | <0.001* |
| Totale OCI-R | 0.005 | 0.014 | 0.373 | 0.710 |
| PHQ9 totale | 0.021 | 0.015 | 1.476 | 0.141 |
| Totale BIS-11 | −0.005 | 0.013 | −0.410 | 0.682 |
| CSQ globale | −0.014 | 0.014 | −0.978 | 0.328 |
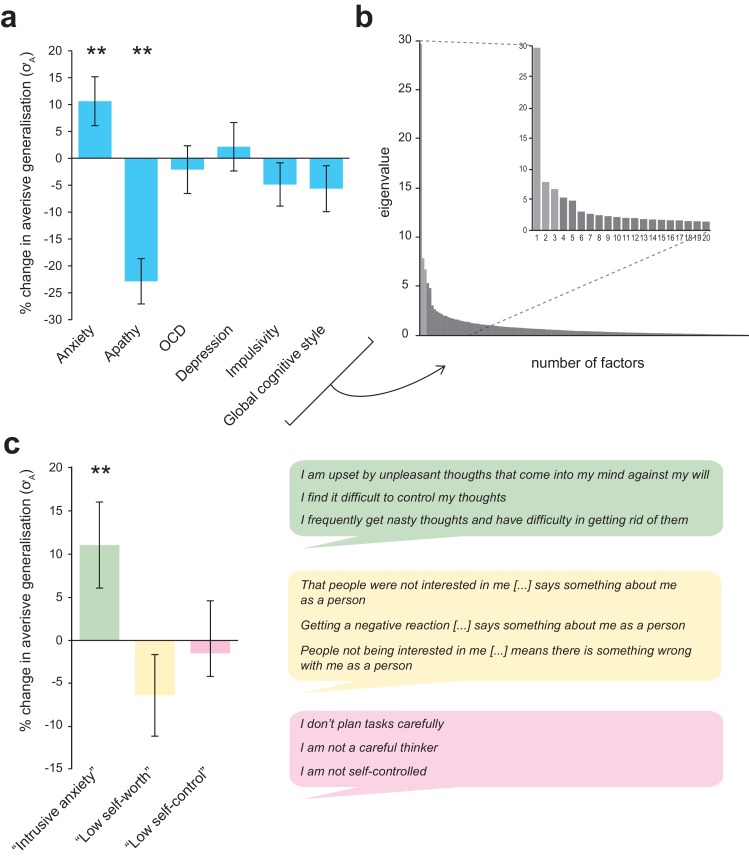
Figura 5.Associazioni tra le differenze individuali nella generalizzazione avversa e i punteggi dei sintomi psicologici.(a) Variazione percentuale del parametro del modello che regola l’ampiezza della generalizzazione dal feedback avversivo (σ A) con un aumento di una deviazione standard del punteggio totale su ogni singola misura del questionario utilizzata (modelli di regressione individuale).b) Scree plot che indica i risultati di un’analisi fattoriale in cui sono stati inseriti tutti gli item di risposta di queste misure(N= 142) (inserto, primi 20 fattori). Una soluzione a tre fattori (barre sfumate più chiare) è stata indicata come la struttura più parsimoniosa.c) Variazione percentuale in σ Acon un aumento di 1 SD per ciascuno dei punteggi dei sintomi derivati dall’analisi fattoriale (modello a regressione singola). Il pannello di destra mostra i primi tre elementi di caricamento per ogni fattore, che sono stati utilizzati per ricavare le etichette dei fattori. Le barre di errore rappresentano l’errore standard. **p≤0.009.
Come per Gillan et al, abbiamo anche cercato di ridurre la colliarità nella nostra batteria di misure di auto-rapporto inserendo tutti gli elementi registrati(N= 142) in un’analisi dei fattori. Utilizzando un metodo identico a quello descritto nel documento citato in precedenza (vedi Materiali e metodi), abbiamo ricavato una soluzione a tre fattori (per il diagramma del ghiaione si veda la Figura 5b) . Questi fattori sono stati etichettati come “ansia intrusiva”, “bassa autostima” e “basso autocontrollo” sulla base dei loro elementi di carico superiore (vedi Figura 5c).
Il fattore ‘ansia intrusiva’ è stato composto per lo più da elementi della scala dei tratti dell’Inventario dell’Ansia di Stato (STAI; 20 elementi, carico medio = 0,457 ± 0.12), Indice Ossessivo-Compulsivo (OCI; 18 item, principalmente item che sondano i pensieri intrusivi e controllano il comportamento, carico medio = 0,602 ± 0,087), Questionario sulla salute del medico (PHQ9; 8 item che sondano i sintomi del disturbo dell’umore, carico medio = 0,531 ± 0.056), e la Scala dell’Impulsività di Barratt (BIS; sei voci relative a pensieri intrusivi e inquietudini, carico medio = 0,386 ± 0,15). La ‘Bassa autostima’ era composta per lo più da item del Questionario di Stile Cognitivo (CSQ; 37 item, principalmente da bassa autostima e da subscale di attribuzione interna, caricamento medio = 0.518 ± 0,13) e lo STAI (11 items, principalmente relativi a bassa autostima/negativa, caricamento medio = 0,322 ± 0,054). L'”autocontrollo basso” comprendeva per lo più voci della BRI (23 voci, principalmente dalle scale di impulsività non pianificabili e attenzionali, carico medio = 0,485 ± 0.15), con un certo carico dall’indice di motivazione dell’apatia (AMI; sei item dalla subscale dell’amotivazione comportamentale, carico medio = 0.356 ± 0.093) e STAI (sette item relativi alla sensazione di non contento/non riposato, carico medio 0.321 ± 0.04). (Per il caricamento completo degli elementi per ogni fattore, vedere il file supplementare 3).
Il punteggio del sintomo derivato dall’analisi dei fattori di “ansia intrusiva” è stato significativamente e selettivamente correlato alle differenze individuali nell’ampiezza di generalizzazione avversa (valori σ A) – sia nei modelli di regressione multipla lineare che in quelli robusti (p=0,008, modello di regressione multipla ponderata con precisione; vedere la Tabella 4, Figura 5c ; solo il fattore mantenuto nel modello LASSO CV MSE che minimizza il CV, β = 0,019). Nessuno dei punteggi dei sintomi derivati dall’analisi dei fattori è stato correlato ai singoli valori σ N (tutti p>0,1).
| Punteggio dei sintomi derivati dall’analisi fattoriale | β | SE | t | p |
|---|---|---|---|---|
| “Ansia invadente | 0.043 | 0.016 | 2.677 | 0.008* |
| “Bassa autostima | −0.019 | 0.015 | −1.255 | 0.210 |
| Mancanza di autocontrollo | −0.000 | 0.014 | −0.032 | 0.975 |

Figura 5.Associazioni tra le differenze individuali nella generalizzazione avversiva e i punteggi dei sintomi psicologici.(a) Variazione percentuale del parametro del modello che regola l’ampiezza della generalizzazione dal feedback avversivo (σ A) con un aumento di una deviazione standard del punteggio totale su ogni singola misura del questionario utilizzata (modelli di regressione individuale).b) Scree plot che indica i risultati di un’analisi fattoriale in cui sono stati inseriti tutti gli item di risposta di queste misure(N= 142) (inserto, primi 20 fattori). Una soluzione a tre fattori (barre sfumate più chiare) è stata indicata come la struttura più parsimoniosa.c) Variazione percentuale in σ Acon un aumento di 1 SD per ciascuno dei punteggi dei sintomi derivati dall’analisi fattoriale (modello a regressione singola). Il pannello di destra mostra i primi tre elementi di caricamento per ogni fattore, che sono stati utilizzati per ricavare le etichette dei fattori. Le barre di errore rappresentano l’errore standard. **p≤0.009.
Discussione
I risultati qui presentati forniscono una solida evidenza per la generalizzazione dell’apprendimento dell’elusione umana. In particolare, dimostriamo che la generalizzazione implica una serie di processi distinti relativi a diverse componenti dell’evitamento: incertezza percettiva, generalizzazione dei valori avversa e generalizzazione dei valori neutri (di sicurezza). Questi processi si riferiscono ciascuno a diversi modelli di rappresentazioni neurali nel cervello. Infine, mostriamo che la generalizzazione avversiva dei valori è un predittore specifico dell’ansia da tratto in un ampio campione di popolazione.
Esaminare il comportamento di evitamento strumentale ci permette di indagare su come gli individui apprendono e attribuiscono valore all’insieme delle azioni che possono intraprendere di fronte a un particolare stimolo o situazione (come distinto dalle associazioni di stimolo-valore pavloviano apprese passivamente). Utilizzando la modellazione dell’apprendimento di rinforzo, abbiamo trovato prove comportamentali per ulteriori contributi basati sul valore per evitare la generalizzazione (cioè oltre a quello che ci si potrebbe aspettare dalla sola incertezza percettiva) in due gruppi indipendenti di partecipanti (campionando diverse popolazioni, e utilizzando due diversi tipi di rinforzo avverso). In particolare, i dati di scelta di entrambi i gruppi hanno supportato un resoconto della generalizzazione del valore che ha permesso di ottenere un’ampiezza di generalizzazione diversa dal feedback avverso (dolore o perdita monetaria) rispetto a quello neutro (nessun dolore o perdita). Coerentemente con i precedenti studi di generalizzazione del condizionamento pavloviano negli esseri umani e nei primati non umani, abbiamo osservato funzioni di generalizzazione più ampie per il feedback avversivo rispetto a quello neutro(Schechtman et al., 2010; Resnik e Paz, 2015; Laufer et al., 2016). In entrambi i gruppi, le stime dei parametri liberi che regolano le larghezze di questi due processi non erano correlate, suggerendo che potrebbero riguardare meccanismi almeno parzialmente separabili.
L’adozione di un approccio esplicito basato su modelli ci ha permesso di identificare le regioni cerebrali in cui il segnale di BOLD era correlato alla varianza delle grandezze modellate specifiche della generalizzazione basata sul valore (cioè, il valore atteso e i segnali di errore di previsione). Quando la potenziale confusione percettiva tra stimoli visivamente simili è stata adeguatamente considerata, abbiamo trovato prove per la codifica dei segnali di generalizzazione relativi al valore nell’insula anteriore e nello striato dorsale. L’insula anteriore e lo striato (più ventrale) sono stati precedentemente implicati nella rappresentazione dei segnali di errore di previsione e di valore attesi nel condizionamento del dolore di ordine superiore(Seymour et al., 2004), e lo striato dorsale è implicato nei segnali di errore di previsione nell’apprendimento di evitamento(Palminteri et al., 2012; Seymour et al., 2012; Eldar et al., 2016), suggerendo un ruolo importante per queste strutture nell’apprendimento avversivo (vedi anche Delgado et al., 2009). Dorsal, piuttosto che un controllo striatale più ventrale, è stato anche implicato nel trasferimento da un obiettivo diretto all’evitamento basato sull’abitudine nei paradigmi strumentali(LeDoux et al., 2017). Una maggiore comprensione del controllo abituale nell’evitare l’eccesso di evitamento ha una particolare rilevanza clinica in quanto può spiegare perché l’evitamento disadattivo può persistere dopo l’estinzione (ad esempio, contribuendo al trattamento di resistenza nella terapia di esposizione per i disturbi d’ansia[Treanor e Barry, 2017]), ed è stato proposto come meccanismo di base nel disturbo ossessivo-compulsivo(Gillan et al., 2014). Non abbiamo trovato alcuna evidenza di codifica univariata specifica per le quantità modello basato sul valore nella amigdala, corteccia visiva primaria (V1), o corteccia prefrontale ventromediale (vmPFC). Tuttavia, questo può essere dovuto al fatto che questo tipo di analisi non è ideale per rilevare rappresentazioni distribuite coinvolte nell’apprendimento associativo.
In precedenti studi sul condizionamento avversivo pavloviano, è stato dimostrato che gli stimoli condizionati positivamente vengono ad essere rappresentati più strettamente al risultato avversivo primario nello spazio multivariato (ad esempio attraverso l’attività di ensemble neurali nell’amigdala basolaterale,[Grewe et al., 2017]). Qui, abbiamo usato una misura robusta, cross-validata della distanza di rappresentazione per analizzare i dati attraverso tutti i voxel nelle regioni di interesse, e abbiamo trovato che una maggiore somiglianza di rappresentazione di GS a CS +stimuli nel corso del compito nella corteccia sensoriale primaria è stata correlata ad una maggiore generalizzazione comportamentale complessiva (maggiore evitamento proporzionato su prove di generalizzazione). Gli individui per i quali gli stimoli GS è venuto ad essere più strettamente rappresentati a CS +s in queste regioni del cervello (pur non essendo mai stato direttamente associato con l’esito avverso) ha scelto di evitare di più a fronte di stimoli GS – e viceversa. Questo cambiamento nella geometria di rappresentazione, in associazione con la mancanza di opportunità di estinzione di valore inappropriatamente generalizzato in un contesto di evitamento, può aver contribuito alla stabilità della generalizzazione (in termini di evitamento complessivo di GS) che abbiamo osservato nelle fasi successive del compito.
Coerentemente con i resoconti percettivi della generalizzazione, un’analisi post-hoc ha suggerito che il cambiamento rappresentazionale per i GS rispetto ai CS +stimuli nel corso del compito nella corteccia visiva primaria potrebbe rappresentare una parte della generalizzazione dell’evitamento che abbiamo osservato (in aggiunta o in parallelo ai meccanismi basati sui valori sopra identificati). Gli individui che hanno evitato più frequentemente nelle prove di generalizzazione, e che hanno mostrato aumenti associati in GS-CS + similitudine rappresentativa in V1, hanno mostrato una diminuzione dell’acutezza percettiva per gli stimoli del compito nel test percettivo del giorno successivo – con il modello opposto osservato nei partecipanti che hanno mostrato un minore evitamento di GS. Le diminuzioni assolute della discriminabilità per gli stimoli dei compiti si traducono in una maggiore generalizzazione “gratuita” (senza dover ricorrere a meccanismi aggiuntivi), e quindi possono contribuire a mantenere la generalizzazione in alcuni partecipanti.
Tuttavia, coerentemente con i resoconti che favoriscono il coinvolgimento di una rete più ampia di regioni cerebrali nel coordinamento delle generalizzazioni attraverso gli stimoli, abbiamo anche trovato un ruolo per le rappresentazioni multivariate dell’insula anteriore e dell’amigdala nelle differenze individuali nelle generalizzazioni di valore avverse. Gli individui che avevano stime più elevate per il parametro del modello che regola la generalizzazione del valore, in particolare a causa del feedback avverso, hanno mostrato un maggiore aumento della somiglianza tra GS-CS e rappresentazione in queste regioni. Un po ‘sorprendentemente, la relazione opposta è stata osservata nella corteccia visiva primaria, in modo tale che gli aumenti GS-CS +similarità in questa regione sono stati associati con le stime individuali più basse del parametro di generalizzazione avversive individuali generalizzazione. Una potenziale spiegazione di questa scoperta è che esiste un qualche tipo di meccanismo di compensazione tra i processi di generalizzazione percettivi e quelli basati sui valori, che agisce a livello cerebrale piuttosto che a livello di comportamento. È interessante notare che i cambiamenti nella capacità discriminativa a seguito di condizionamento avversivo sono stati recentemente associati con l’elaborazione alterata dell’insula e dell’amigdala degli stimoli visivi negli esseri umani(Shalev et al., 2018). Tuttavia, questo risultato è stato inaspettato e quindi beneficerebbe notevolmente da ulteriori indagini nel lavoro futuro.
Anche se meno ottimizzato sotto la nostra progettazione, abbiamo anche condotto un’analisi per verificare se i cambiamenti nella GS rispetto agli stimoli CS- possono essere associati a stime individuali del parametro del modello che regola l’ampiezza della generalizzazione in particolare dai risultati neutri (o ‘sicuri’) (in questo caso, omissione dello shock doloroso). Gli individui con valori più alti del parametro che governa l’ampiezza della generalizzazione da feedback neutro hanno mostrato maggiori aumenti nella somiglianza GS-CS- nel corso del compito sia nell’amigdala che nel vmPFC. Questo si aggiunge a un corpus di lavori che suggeriscono che la funzione dell’amigdala non è importante solo per la generalizzazione delle risposte di paura, ma che è anche coinvolta nell’apprendimento della sicurezza(Genud-Gabai et al., 2013; Likhtik et al., 2014). Un recente studio sui roditori suggerisce che l’amigdala laterale può essere una regione particolarmente importante per la comprensione delle differenze individuali nel comportamento della paura nei confronti di nuovi stimoli percettivamente ambigui, con diverse sottopopolazioni neuronali coinvolte nella discriminazione di nuovi stimoli sicuri e risposte di paura inappropriate – in un modo che sarebbe difficile da rilevare facendo la media dei segnali in questa regione nel suo complesso (Grossoet al., 2018). Sebbene sia stato precedentemente dimostrato che il vmPFC mostra gradienti di generalizzazione derivati dalla similitudine percettiva inversa a seguito di un condizionamento avverso (ad esempio Lissek et al., 2014; Onat e Büchel, 2015), non è sempre chiaro dal disegno sperimentale se questo rappresenti il semplice inverso dei gradienti avversi (derivanti dalla CS+), o piuttosto la segnalazione positiva dei gradienti di sicurezza (derivanti dalla CS-). L’evidenza qui presentata fornisce un timido supporto a quest’ultima considerazione, almeno in un contesto strumentale.
L’eccessiva elusione in risposta a contesti o stimoli che non rappresentano una minaccia per la salute o il benessere di un individuo può compromettere significativamente il funzionamento generale ed è spesso associata a livelli elevati di disagio psicologico (Arnaudovaet al., 2017). Tale evitamento disadattivo è stato identificato come una dimensione patologica di base attraverso diversi disturbi psicologici, tra cui disturbi d’ansia, disturbo ossessivo-compulsivo, dolore cronico e depressione(LeDoux et al., 2017). L’eccessiva generalizzazione del feedback avversivo per includere stimoli o contesti non minacciosi ma psicologicamente simili è stata proposta come un meccanismo chiave alla base dell’avvio e del mantenimento dell’evitamento eccessivo in queste condizioni(Duits et al., 2015; Dymond et al., 2015; Harvie et al., 2017; Pearson et al., 2015) – tuttavia, il legame tra generalizzazione del valore negativo e comportamenti di evitamento inappropriati è stato relativamente poco esplorato.
Abbiamo trovato relazioni selettive tra i punteggi dei sintomi psicologici e le stime dei singoli parametri che regolano l’ampiezza della generalizzazione del valore da risultati avversivi, ma non sicuri/neutri. La più grande relazione positiva tra il punteggio dei sintomi e l’ampiezza della generalizzazione avversiva è stata per il punteggio derivato dall’analisi dei fattori etichettato come “ansia intrusiva”, che comprendeva principalmente oggetti che sondavano l’ansia da tratto auto-riferito, ma anche rapporti di pensieri intrusivi dall’inventario ossessivo-compulsivo (aumento % del valore del parametro con un aumento di 1SD del punteggio del sintomo è stato dell’11,0% per l’ansia intrusiva, e del 10,6% per il solo tratto ansioso). Abbiamo anche trovato una significativa relazione negativa tra l’apatia auto-riferita e la generalizzazione avversa (diminuzione del 22,9% del valore del parametro con un aumento di 1SD del punteggio del sintomo) – un effetto che sembrava essere indipendente da quello relativo all’ansia auto-riferita. Si tratta di un dato interessante, poiché spesso si pensa che l’apatia comporti una maggiore sensibilità allo sforzo percepito, o una minore sensibilità alle potenziali ricompense, piuttosto che un minore impatto delle informazioni sulle punizioni (ad esempio Bonnelle et al., 2015). Poiché, a quanto ci risulta, non c’è stato in precedenza alcun collegamento tra l’apatia autodenunciata e la generalizzazione avversa, questa constatazione trarrebbe beneficio da future repliche.
In sintesi, i risultati qui riportati dimostrano i benefici dell’analisi di processi complessi come la generalizzazione in componenti separate, e l’esame delle relazioni individuali tra queste componenti e i meccanismi neurali e la psicopatologia auto-rappresentata. Questo approccio può aiutare a unificare precedenti osservazioni apparentemente contraddittorie e sottolinea che sia i processi percettivi che quelli basati sui valori sono probabilmente all’opera nei fenomeni di generalizzazione. L’identificazione dei pazienti tra le diverse categorie diagnostiche che possono avere un deficit primario in un’eccessiva generalizzazione avversa può aiutare a indirizzarli verso trattamenti che funzionano in modo più efficace. Inoltre, una maggiore comprensione dei meccanismi di eccessiva generalizzazione dell’evitamento (compreso il trasferimento a sistemi di controllo basati sull’abitudine) può aiutare a migliorare la comprensione della resistenza al trattamento in questi disturbi.
Materiali e metodi
Codice e disponibilità dei dati
Tutti i codici rilevanti per la generazione di stimoli, la raccolta e l’analisi dei dati, oltre ai dati comportamentali grezzi, sono disponibili alla pagina Open Science Framework del progetto (osf.io/25t3f). I dati grezzi di imaging funzionale sono depositati presso openfMRI (openfmri.org/dataset/ds000249) e le mappe statistiche derivate sono disponibili presso NeuroVault (neurovault.org/collections/3177).
Design
campione fMRI
Protocollo
Ogni partecipante ha completato tre sessioni di test in 3 giorni consecutivi. Il primo giorno, i partecipanti sono stati pre-selezionati, hanno dato il loro consenso informato e hanno eseguito un primo test di acuità sensoriale per gli stimoli del compito di generalizzazione. Il secondo giorno, i partecipanti hanno completato la generalizzazione del compito di evitamento strumentale (eseguito in scanner fMRI, utilizzando stimoli di condizionamento generati individualmente [CSs] derivati dalla performance percettiva del primo giorno), seguito da valutazioni della scala analogica visiva (VAS) dell’aspettativa di dolore per ogni CS. Il terzo giorno, i partecipanti hanno ripetuto il test di acuità percettiva.
Tutti i partecipanti sono stati reclutati tramite pubblicità online. I criteri di esclusione erano la mancinismo e l’anamnesi di malattie neurologiche o psicologiche, oltre ai consueti criteri di sicurezza della risonanza magnetica. La dimensione del campione è stata scelta sulla base di un calcolo della potenza. Precedenti studi di imaging funzionale nell’uomo hanno trovato dimensioni di effetto nella regione di r= ~ 0,5 per le misure di segnale di BOLD legate alla generalizzazione e le misure individuali di differenza (Greenberget al., 2013; Lissek et al. , 2014; Cha et al., 2014 ). Abbiamo calcolato che un campione di N= 26 ci permetterebbe di rilevare r = 0,5 con un alfa di 0,05 e potenza dell’80%, a due code (modello a punto di correlazione biseriale, G*Power versione 3.1.9.2). I volontari sono stati pagati £ 20 / h in ricompensa per il loro tempo e il disagio derivante dalla dolorosa stimolazione elettrica. Lo studio è stato approvato dal Comitato Etico di Ricerca di Psicologia dell’Università di Cambridge.
Ritardata punita compito discriminazione percettiva
Prima di iniziare il compito, i partecipanti sono stati introdotti all’elettrodo e all’elettrodo di shock ed è stata eseguita una procedura di work-up (come descritto di seguito) per impostare il livello di stimolazione dolorosa. Il compito percettivo ritardato-punito è stato poi eseguito, come riassunto nella Figura 1b. In breve, su ogni prova, i partecipanti hanno visto una forma individuale (stimolo target o di confronto, ordine randomizzato su ogni prova), seguita da una maschera (immagine media della forma strapazzata), periodo di ritardo (schermo bianco), seconda forma e seconda maschera. Alla fine di ogni prova, i partecipanti dovevano indicare se pensavano che le due forme fossero uguali o diverse. Il periodo di ritardo inter-stimolo di quattro secondi è stato scelto per essere abbastanza lungo da rendere impossibile il confronto degli stimoli con meccanismi istantanei, ma richiedeva un confronto nella memoria a breve termine (ad esempio, i dati dei primati suggeriscono che le prestazioni di discriminazione per le caratteristiche visive diminuiscono significativamente da <1 s a circa 4-5 s di ritardo inter-stimolo, [Pasternake Greenlee, 2005]), e approssimativamente abbinato all’intervallo inter-trial dal compito di generalizzazione. Ci sono stati 16 studi per intervallo di valori assoluti per obiettivo (160 studi in totale), e gli studi sono stati divisi in quattro blocchi uguali. Alla fine di ogni blocco, i partecipanti hanno ricevuto un feedback su quanti giudizi errati avevano espresso, e hanno ricevuto un numero proporzionale di scosse elettriche dolorose come punizione (una scossa dolorosa ogni cinque giudizi errati).
Gli stimoli sono stati cinque volte simmetrici a forma di fiore, come descritto in van Dam e Ernst, 2015. Questi sono stati selezionati sulla base del fatto che possono essere generati in modo continuo lungo un unico asse percettivo di “spigolosità” utilizzando la descrizione matematica fornita nel documento, e l’evidenza psicofisica che dimostra che sono percettivamente lineari (cioè che le soglie di discriminazione sono costanti lungo questo asse). La ‘spigolosità’ della forma è parametrizzata da un singolo valore, ρ ( dove 0 < ρ <1), che mette in relazione i raggi interni ed esterni della forma in modo tale che gli stimoli siano di superficie costante. Gli stimoli bersaglio erano forme con i valori ρ dei due stimoli CS+ del compito di generalizzazione (0,25 e 0,75). Questi stimoli target sono stati confrontati con stimoli di confronto di intervalli di ±0, 0,05, 0,075, 0,1, e 0,15 ρ , in modo che la gamma possibile di forme diverse era ben piastrellata. I partecipanti hanno lavorato su un insieme predefinito di stimoli di confronto (in contrapposizione a un approccio basato sulle scale) in modo che la pre-esposizione agli stimoli di condizionamento del compito (e quindi l’opportunità di apprendimento percettivo) fosse abbinata tra gli individui.
Generalizzazione del compito di prevenzione strumentale (versione del dolore)
I partecipanti hanno completato cinque blocchi di 38 prove ciascuno. In ogni prova, ai partecipanti è stato presentato uno stimolo al centro del loro schermo. Questo ha dato inizio ad un periodo di decisione di 3 s, durante il quale devono decidere se fare o meno una risposta di “fuga” (evasione). A seguito di ciò, è apparso un riquadro giallo intorno alla forma, che indicava il momento in cui una risposta di evitamento poteva essere fatta era finita e avrebbero ricevuto il risultato per quel processo. Se una risposta di evitamento è stata fatta, non è mai stato dato alcuno shock in quel processo. Se non è stata fatta alcuna elusione, e lo stimolo era una forma “sicura” (CS-), non è stato erogato alcuno shock. Se lo stimolo era una forma “pericolosa” (CS+), uno shock doloroso è stato erogato sull’80% degli studi di non elusione alla fine di questo periodo di risultati (cioè 6 s dall’inizio dello stimolo, Figura 1c ).
Su una bassa frequenza di prove, le forme erano stimoli di generalizzazione (GSs; 2 presentazioni di ogni GS per 38 blocchi di prova). Questi stimoli sono stati generati individualmente per essere distinguibili in modo affidabile al 75% da CS+ s adiacenti in base alla performance percettiva del compito del primo giorno (vedi Figura 1b), e non sono mai stati associati a shock dolorosi. I tipi di prova sono stati presentati nel seguente rapporto: 10 CS-: 10 CS+(*2): 2 GS(*due per CS+) in una sequenza pseudorandom, al fine di minimizzare l’apprendimento degli stimoli GS. Anche se gli studi precedenti hanno avuto la tendenza ad utilizzare disegni con stimoli di generalizzazione multipli, l’uso di un singolo GS intorno a ogni CS+ nello spazio percettivo è il disegno più efficiente se la discriminabilità percettiva degli stimoli della sonda è accuratamente nota, e si è agnostici circa l’identità precisa della funzione di generalizzazione (ad esempio esponenziale vs gaussiano, assumendo questa costante tra gli individui). La frequenza di presentazione dei singoli GS (10 per GS) è stata paragonabile ai recenti studi di imaging funzionale della generalizzazione pavloviana (ad es. 7 e 34 presentazioni per GS durante le fasi di test di generalizzazione, rispettivamente:Laufer et al, 2016; Onat e Büchel, 2015]).
L’array di stimoli era asimmetrico nello spazio percettivo (vedi Figura 1b), con due stimoli CS+ (e quattro GS associati) – uno più vicino e più lontano da un CS intermedio -. Questo array è stato scelto al fine di sondare la presenza di asimmetrie caratteristiche nelle risposte condizionate che si ipotizza derivino dall’interazione di gradienti di generalizzazione firmati in modo opposto (ad esempio peak shift,[Hanson, 1959]), e sulla base di precedenti osservazioni che il cambiamento nella discriminabilità percettiva degli stimoli condizionati in modo avverso (CS+ s) può dipendere dalla relativa “vicinanza” degli stimoli di sicurezza (CS-s) nello spazio percettivo (Aizenberg eGeffen, 2013). La direzione dell’asse (in termini di ‘spigolosità’ crescente o decrescente) è stata controbilanciata tra i partecipanti.
Campione online
Protocollo
Al fine di testare la relazione con i sintomi psicologici del mondo reale in un campione opportunamente alimentato, è stata effettuata anche una versione online dello studio, seguendo l’approccio di Gillan et al.(Gillan and Daw, 2016; Gillan et al., 2016). I partecipanti erano lavoratori di Amazon Mechanical Turk (AMT) con sede negli USA (in pratica, avevano un conto AMT collegato alla banca statunitense con un numero di previdenza sociale statunitense). I partecipanti dovevano avere più di 18 anni, ma per il resto rimanevano anonimi.
I partecipanti hanno completato una procedura di consenso online e hanno fornito informazioni demografiche limitate (età e identità di genere). Hanno poi letto diverse schermate di istruzioni dettagliate sui compiti (inclusi esempi visivi di prove campione), basate sulle istruzioni standardizzate fornite ai partecipanti agli studi di laboratorio. Ai partecipanti è stato richiesto di superare un quiz di 10 item true/false sulla struttura dei compiti prima di continuare (con un punteggio inferiore a 10/10 i partecipanti hanno restituito le schermate delle istruzioni). Hanno poi eseguito una versione basata sulla perdita monetaria della generalizzazione del compito di prevenzione strumentale (vedi sotto), seguita da una serie di questionari che sondano i sintomi psicologici e lo stile cognitivo.
Abbiamo calcolato che una dimensione finale del campione >459 dovrebbe essere alimentata per rilevare una piccola dimensione di effetto di 0,13 o superiore (associazione tra parametri comportamentali e di auto-relazione), ad alfa = 0,05 e 80% di potenza (modello biseriale a due punti a coda). Come atteso attrito a seguito di controllo di qualità è stato ~ 15% (Gillanet al., 2016), abbiamo raccolto N = 550 set di dati completi, producendo una dimensione finale previsto campione di ~ 468.
I tassi di pagamento erano basati sugli standard etici del Regno Unito per gli esperimenti online (equivalenti a un minimo di £5 ph). Ai partecipanti è stato pagato un tasso forfettario di 2,50 dollari per la partecipazione, più un bonus aggiuntivo fino a circa 3,00 dollari a seconda delle prestazioni dell’attività. Il pagamento medio del bonus è stato di $2,21 (±0,82) e il tempo medio tra l’accettazione e l’invio dell’attività è stato di 42 minuti (equivalente a $6,72 di media oraria). Lo studio è stato approvato dal comitato etico dell’Università di Cambridge Psychology Research Ethics Committee.
Generalization of instrumental avoidance task (versione in perdita)
Il compito di generalizzazione era identico nella struttura a quello svolto dai partecipanti in laboratorio, ma utilizzava la perdita monetaria invece dello shock doloroso come rinforzo avverso(Figura 1c). Prima di iniziare il compito, i partecipanti sono stati dotati di una quota di 6,00 dollari, e hanno dato istruzioni che, sebbene una certa quantità di perdita fosse inevitabile, qualsiasi somma rimanesse alla fine del compito sarebbe stata pagata direttamente a loro come bonus (la perdita aveva quindi un valore reale). Poiché i dati di BOLD non venivano raccolti, le prove erano leggermente più brevi di quelle del gruppo fMRI (seconda serie di dati temporali, Figura 1c) – anche se la durata del periodo di decisione è stata mantenuta invariata.
I test percettivi non sono stati eseguiti nel campione online a causa di vincoli temporali e dell’incapacità di controllare l’ambiente di test (ad esempio la distanza dei partecipanti dallo schermo, le dimensioni della finestra, ecc. Gli stimoli di generalizzazione sono stati quindi gli stessi per tutti i partecipanti, e generati sulla base delle prestazioni percettive medie sul compito percettivo in un campione pilota. Questo test pilota è stato effettuato nelle stesse condizioni e con gli stessi parametri temporali descritti per il campione di risonanza magnetica, con l’eccezione che non sono stati somministrati shock punitivi (e non sono stati applicati ai partecipanti apparecchi antidolorifici).
Batteria del questionario
Dopo aver completato il compito di generalizzazione, i partecipanti hanno completato diverse misure di autodenuncia (l’ordine del questionario è stato randomizzato tra i partecipanti). Queste misure sono state scelte per sondare i costrutti psicologici ipotizzati in relazione all’eccessiva generalizzazione degli esiti avversivi (ansia, depressione e sintomatologia ossessivo-compulsiva), così come i controlli positivi che potrebbero suggerire un effetto più generale della psicopatologia sulla performance del compito (impulsività, apatia). I questionari consistevano nella scala dei tratti del Stato-Trait Anxiety Inventory (STAI;[Spielberger et al., 1970]); il Physician’s Healthy Questionnaire 9 (PHQ9; [Martin et al., 2006]), una breve misura dei sintomi dei disturbi dell’umore; l’Indice Ossessivo-Compulsivo (forma breve) riveduto (OCI-R;[Foa et al., 2002]); la Scala di Impulsività Barratt v11 (BIS-11;[Patton et al., 1995]); e l’Indice di Motivazione dell’Apatia (AMI;[Ang et al., 2017]). Tutte le misure scelte sono state precedentemente dimostrate adatte all’uso nella popolazione generale.
È stata inoltre somministrata una breve versione del Questionario di Stile Cognitivo (CSQ-SF;[Meins et al., 2012]). Questa misura di auto-rapporto chiede ai partecipanti di immaginarsi in vari scenari (ad es. “Immagina di andare a una festa e la gente non è interessata a te”), e poi sonda le cause immaginate di questo scenario lungo dimensioni di attribuzioni “interne”, “globali” e “stabili”, oltre a una bassa autostima. Su questa misura, uno stile cognitivo più ‘globale’ riflette una tendenza ad attribuire eventi negativi a cause che sono generali, piuttosto che specifiche (una forma cognitiva di eccessiva generalizzazione), ed è stato trovato essere un predittore del futuro stato d’animo depresso (Pearsonet al., 2015). Il CSQ-SF è stato somministrato alla fine della batteria di questionari per tutti i partecipanti al fine di evitare possibili effetti di induzione dell’umore.
Procedura di controllo della qualità
In seguito a precedenti studi che utilizzavano l’AMT(Crump et al., 2013; Gillan et al., 2016), sono stati applicati in sequenza al set di dati una serie di criteri di esclusione per cercare di escludere risposte di scarsa qualità. In primo luogo, abbiamo escluso i partecipanti che hanno fatto risposte di evitamento su meno del 50% del totale degli studi CS+ (che indicano la mancanza di apprendimento/risposte di scarsa qualità su questi studi), N = 62. In secondo luogo, abbiamo ulteriormente escluso i partecipanti che hanno selezionato la risposta sbagliata ad un elemento di cattura inserito nella batteria del questionario (“Si prega di selezionare la risposta “un po’” se si sta leggendo questa domanda”), N = 6. In totale sono stati esclusi 68 set di dati (il 12,3% di quelli raccolti), per un campione finale di 482. La qualità dei dati del questionario è stata ulteriormente valutata attraverso il calcolo dei coefficienti interni di affidabilità per ogni misura (α di Cronbach).
Raccolta dei dati
campione fMRI
La presentazione degli stimoli e la raccolta delle risposte è stata codificata utilizzando Cogent2000 v1.30, eseguito in Matlab R2015b (Mathworks). I test percettivi del primo e del terzo giorno si sono svolti in laboratorio e i test di generalizzazione in uno scanner fMRI. Le dimensioni degli stimoli in termini di angolo visivo sotteso sono state abbinate tra ambienti di laboratorio e scanner per garantire una discriminazione costante.
Per la stimolazione dolorosa, la corrente elettrica è stata generata utilizzando lo stimolatore a corrente costante DS7A (Digitimer), consegnato ad un elettrodo anulare personalizzato compatibile con la fMRI (che fornisce una sensazione altamente sgradevole, come una puntura di spillo), indossato sul dorso della mano dominante (destra) del partecipante. Tutti i partecipanti sono stati sottoposti a una procedura di work-up di intensità standardizzata all’inizio di ogni giornata di test, al fine di far corrispondere i livelli di dolore soggettivo tra le sessioni a un livello che è stato segnalato come doloroso, ma sopportabile (8 su 10 su un VAS che va da 0 [‘nessun dolore’] a 10 [‘peggior dolore immaginabile’]). La configurazione di consegna del dolore era identica per le sessioni di laboratorio e di risonanza magnetica.
I dati di imaging funzionale sono stati raccolti su un 3T Siemens Magnetom Skyra (Siemens Healthcare), equipaggiato con una bobina di testa a 32 canali. I dati di respirazione sono stati raccolti durante la scansione funzionale usando una cintura respiratoria pneumatica (BrainProducts), e i dati di scelta (evitamento) sono stati registrati usando una scatola a bottone compatibile con la risonanza magnetica.
Le mappe di campo sono state acquisite al fine di correggere le disomogeneità nel campo magnetico statico (corto TE = 5,19 ms, lungo TE = 7,56 ms, 32 × 3 mm a fette). Cinque sessioni funzionali di 212 volumi sono stati raccolti utilizzando una sequenza di eco planare gradiente di imaging planare (EPI) (TR = 2000 ms, TE = 30 ms, angolo di rotazione = 90°)., inclinazione=-30°, fette per volume = 25, dimensione voxel 3 × 3 × 3 mm; questo includeva tre volumi fittizi, oltre ai tre pre-discaricati dallo scanner). Campo visivo limitato (vincolato da apparecchiature utilizzate per la raccolta di dati fisiologici aggiuntivi) è stato allineato alla base del cervello e angolato lontano dalle orbite, in modo che ci fosse una copertura completa dei lobi occipitale e temporale, più corteccia prefrontale. È stata anche raccolta una scansione strutturale MPRAGE ponderata T1 (dimensione voxel 1 × 1 × 1 mm). I metadati della sequenza completa sono disponibili su openfMRI (openfmri.org/dataset/ds000249).
Campione online
L’esperimento è stato codificato in javascript usando jsPsych ([de Leeuw, 2015]; disponibile su github.com/jspsych/jsPsych), ed è stato distribuito ad Amazon Mechanical Turk tramite il motore psiTurk ([Gureckis et al., 2016]; disponibile su github.com/NYUCCL/psiTurk). L’esperimento è stato ospitato nel cloud utilizzando un’istanza EC2 di Amazon Web Services. Una descrizione più dettagliata di questa configurazione è disponibile su osf.io/mjgtr. Il compito non è stato reso disponibile su dispositivi mobili (telefoni o tablet) nel tentativo di garantire una dimensione minima dello schermo.
Analisi
Acuità percettiva
Per i partecipanti al campione fMRI, le funzioni psicometriche (una funzione logistica con parametri liberi che regolano la pendenza, il bias, e il tasso di decadimento, o l’errore indipendente dallo stimolo) sono state adattate ai dati di risposta dal compito percettivo utilizzando il toolbox psignifit v2.5.6 (disponibile su bootstrap-software.org/psignifit), eseguito in Matlab. Formalmente,P(diff)=1/(1+exp((α-Δρ)/β))dove P(diff) è la probabilità di riportare la forma di confronto come diversa (limitata tra i limiti di 0 e 1-lapse rate), Δρ è la differenza del parametro di forma ρ tra gli stimoli target e quelli di confronto, e α determina il bias, e β governa la pendenza, della funzione logistica. Questo toolbox implementa il metodo della massima probabilità limitata di adattamento della funzione psicometrica descritto in Wichmann e Hill (2001).
Le singole funzioni psicometriche sono state poi utilizzate per calcolare il diverso valore in ρ necessario affinché lo stimolo di confronto sia distinguibile dal target nel 75% delle prove (d’ora in poi, θ ).
Comportamento strumentale di evitamento
Il comportamento di prevenzione è stato modellato utilizzando un insieme di algoritmi di apprendimento Q modificati(Sutton e Barto, 1998). Ogni stimolo è stato modellato come un diverso stato, con il valore di esecuzione di ogni azione(evitare o nonAvocare) in ogni stato(Vs,a) aggiornato dopo ogni prova(t) sulla base di una semplice regola di Rescorla-Wagner – cioè sulla base della differenza tra il valore previsto di quella coppia di azioni statali e l’effettivo risultato di ogni prova (Rt(codificato come 0 per nessuna scossa / nessuna perdita e -1 per scossa / perdita monetaria). Formalmente,
Vs,a,t+1 = Vs,a,t + κ*α t*(Rt –Vs,a, t)
Tasso di apprendimento(αt) è stato aggiornato ad ogni prova, secondo la regola di associabilità di Pearce-Hall empiricamente ben supportata(Le Pelley, 2004):
α t+1 =η*| (Rt – Vs, a,t)| + (1– η)* α t
Secondo questa regola, il tasso di apprendimento di ogni prova è determinato dalla grandezza assoluta degli errori di previsione del passato, in modo tale che le stime dei valori delle azioni statali sono aggiornate di più quando i risultati precedenti sono stati più sorprendenti, e di meno quando sono stati meno sorprendenti. Questo permette che l’apprendimento in termini di aggiustamento dei valori modellati sia maggiore quando i risultati sono più sorprendenti (ad esempio all’inizio dell’attività), ma minore (che porta a valori più stabili) quando i risultati sono meglio previsti. Un tasso di apprendimento non costante assicura anche che i parametri che governano l’ampiezza della generalizzazione basata sui valori, che si suppone siano costanti nel corso del compito, siano identificabili durante la stima dei parametri (vedere le equazioni seguenti). Le differenze individuali nel grado di dipendenza dalla storia degli errori di previsione e dalla scala generale del tasso di apprendimento sono regolate dai parametri liberi κ e η.
Per modellare la “generalizzazione” percettiva (possibilità di confusione di identità tra GS e CS+ s adiacenti), è stato definito il valore di non evitare per i GS su un dato trial:
VGS,nonAvoidale = 0.75*VGS,nonAvoid,t + 0.25*VadjacentCS+,nonAvoid,t
Per i modelli con generalizzazione aggiuntiva basata sui valori, ad ogni prova i valori di tutti gli stati sono stati aggiornati in proporzione alla loro somiglianza percettiva con lo stato attuale, i, utilizzando una regola simile a quella impiegata negli studi precedenti(Kahnt et al., 2012; van Dam e Ernst, 2015) – cioè secondo una funzione gaussiana a larghezza variabile nello spazio percettivo. Per ogni stato, j:
Gj = 1/exp((ρ i – ρ j)2/ (2*σ 2))
Vj,a,t+1 = Vj,a,t + κ*α t*(Rt – Vi,a, t)*Gj
dove ρ è il parametro che governa la forma ‘spikiness’, e l’ampiezza della funzione gaussiana che governa la generalizzazione è determinata dal parametro libero σ. Per il campione fMRI, i valori ρ medi sono stati utilizzati durante il fitting del modello per tutti i soggetti, in quanto gli stimoli erano stati abbinati nello spazio percettivo soggettivo. Per il modello a 2 larghezze, sono stati adattati diversi valori σ a seconda che il risultato di quello studio fosse avverso o neutro (σA e σNrispettivamente).
Poiché ai partecipanti è stato esplicitamente indicato che non avrebbero mai ricevuto l’esito avverso se avessero fatto una risposta di evitamento, il valore di evitare in qualsiasi stato(Vs,Evitare,t) è stata mantenuta costante a 0. Le stime di valore erano adatte ai dati di scelta binaria tramite una funzione di osservazione softmax, tenendo conto del costo di una risposta di elusione (shock aggiuntivo o perdita monetaria unitaria da ricevere alla fine di quel blocco per ogni cinque pressioni di tasto effettuate, o 0,2 per decisione di elusione):
P(evitare)=1/(1 + exp(-β*(Vs,evitare,t –Vs,nonAvoid,t – 0,2 – polarizzazione) )))
dove il parametro libero β determina quanto P(evitare) è guidato dalla differenza di valore tra le due possibili azioni (Vs,evitare,t – – Vs,nonAvoidale,t), e il parametro di polarizzazione determina la polarizzazione complessiva verso la scelta di una particolare azione (evitare o non evitare).
Per entrambi i campioni, i modelli sono stati adattati ai dati di scelta (evitamento) utilizzando l’approccio variazionale Bayes all’inversione del modello implementato nel toolbox VBA ([Daunizeau et al., 2014]; disponibile su mbb-team.github.io/VBA-toolbox), eseguito in Matlab. L’adattamento del modello è stato eseguito in un quadro a effetti misti. Semplicemente, dopo il primo round di inversione del modello, le singole stime dei valori dei parametri posteriori liberi vengono utilizzate per approssimare la distribuzione della popolazione da cui sono stati ricavati questi valori, che viene poi utilizzata come precedente per il successivo round di inferenza, fino alla convergenza (nessuna ulteriore riduzione a livello di gruppo di energia libera). Questo approccio riduce la probabilità di valori anomali in qualsiasi stima di singoli parametri.
Il confronto del modello è stato effettuato mediante il confronto del modello bayesiano a effetti casuali(Rigoux et al., 2014). Questo metodo di confronto del modello presuppone che la popolazione sia composta da soggetti che si differenziano per il modello che li descrive meglio, quindi induce un modello probabilistico gerarchico che può essere invertito per derivare la densità posteriore sulle frequenze del modello, dati i dati dei partecipanti. Secondo questo approccio, la metrica critica per un dato modello è la sua probabilità di superamento, o la probabilità che quel particolare modello sia più frequente di tutti gli altri modelli del set di confronto.
Dati di imaging funzionale
Pre-elaborazione
I dati di imaging funzionale sono stati pre-processati utilizzando l’SPM12 (Wellcome Trust Centre for Neuroimaging, www.fil.ion.ucl.ac.uk/spm) a Matlab. In breve, le immagini funzionali sono state riallineate alla prima immagine funzionale in ogni sequenza, non affilate, corrette per il tempo di acquisizione e normalizzate nello spazio MNI tramite mappe di probabilità tissutali derivate dall’immagine strutturale co-registrata. L’intera pipeline di pre-elaborazione disponibile è disponibile su osf.io/f9drs come script Matlab compatibile con BIDS(Gorgolewski et al., 2016). Infine, le immagini sono state lisciate tramite convoluzione con una larghezza di 8 mm a metà del kernel gaussiano per l’analisi univariata (ma non multivariata).
I dati della cintura di respirazione sono stati elaborati utilizzando il toolbox PhysIO ([Kasper et al., 2017]; disponibile su translationalneuromodeling.org/tapas), che fornisce la correzione del rumore fisiologico per i dati di imaging funzionale utilizzando l’espansione di Fourier della fase respiratoria implementata nell’algoritmo RETROICOR(Glover et al., 2000).
Analisi univariata
I dati di imaging funzionale sono stati analizzati per la prima volta secondo un approccio univario di massa basato sul modello lineare generale per i dati delle serie temporali in ogni voxel, come implementato in SPM12. Questo permette di rilevare se la varianza in BOLD in ogni voxel è significativamente correlata alle quantità interne modellate (cioè se particolari termini del modello sono codificati nel corso del tempo del segnale in BOLD), con relativa specificità spaziale. Diversi modelli sono stati adattati ai dati delle singole serie temporali di BOLD utilizzando una stima limitata della massima probabilità per produrre mappe statistiche individuali al primo livello, che sono state utilizzate per determinare la significatività al secondo livello utilizzando un campione di t-t-test in un quadro di effetti casuali.
Tutti i modelli di primo livello includevano i seguenti regressori di nessun interesse: 8 regressori di respirazione e 6 regressori di movimento (con traslazione >1,5 mm o rotazione >1° su qualsiasi prova con conseguente inclusione di un ulteriore regressore anomalo), più funzioni delta al momento della risposta di evitamento e della ricezione dello shock (i set di risposta di evitamento includevano un modulatore parametrico che rappresentava il tempo di reazione, poiché nel complesso abbiamo osservato diverse RT medie per gli stimoli GS e CS+). Inoltre:
Modello 1: Analisi del valore atteso. Abbiamo studiato la codifica dei segnali interni modellati che rappresentano la valutazione iniziale dello stimolo (cioè il risultato che ci si aspetterebbe se non fosse stata fatta una risposta di evitamento), piuttosto che i valori associati all’azione scelta su ogni trial (cioè il valore atteso del risultato di quel trial, a seguito della scelta). Per facilitare l’interpretazione, è stato modellato il valore interno di non evitare su un dato studio(Vs,nonAvoid,t) è stata moltiplicata per -1 per rappresentare efficacemente la P(shock) prevista per quel particolare stimolo. Il modello di imaging consisteva di funzioni delta per l’insorgenza di CS (tutti gli studi), con modulatori parametrici di (i) P(shock) stimato secondo il modello solo percettivo (ii) P(shock) stimato secondo il modello di generalizzazione basato sulla percezione +valore.
Modello 2: Analisi degli errori di previsione. L’errore di previsione (PE) è stato definito come la differenza tra l’esito previsto e quello effettivo di un determinato processo, o(Rt – – Vs,a,t). NB per definizione questo è uguale a 0 su tutti gli studi in cui è stata fatta una risposta di evitamento. Il modello di imaging consisteva di funzioni delta al momento della consegna del risultato atteso (tutti gli studi), con modulatori parametrici di (i) PE di prova secondo il modello solo percettivo (ii) PE di prova secondo il modello di generalizzazione basato sulla percezione + valore. Anche in questo caso, per facilità di interpretazione, i termini di PE sono stati moltiplicati per -1 – in modo che i PE positivi rappresentassero la ricezione dello shock (dove il P(shock) previsto era <1), e i PE negativi rappresentassero l’omissione dello shock (dove il P(shock) previsto era >0) .
Tutti i regressori sono stati convolti con una funzione di risposta emodinamica canonica, con correzione per la deriva a bassa frequenza mediante filtraggio passa alto (1/128 s) e correzione per errori correlati in serie mediante l’applicazione di un processo autoregressivo di primo ordine (AR(1)).
I regressori basati su modello computazionale sono stati ricavati utilizzando i valori dei singoli parametri liberi da soggetto e tutti i regressori sono stati ortogonalizzati durante la stima del modello. SPM assegna la varianza ai modulatori parametrici in modo successivo, in modo tale che in un quadro ortogonalizzato, un risultato significativo da un secondo modulatore parametrico rappresenta quello dovuto alla varianza oltre a quella assegnata al primo modulatore(Mumford et al., 2015). A causa della natura del nostro task design (cioè che i partecipanti sono tenuti ad effettuare risposte motorie solo su prove sulle quali desiderano evitare l’esito dello stimolo presentato), è possibile che le risposte di valore atteso (previste P(shock)) siano parzialmente contaminate dalle risposte di preparazione motoria (nonostante l’inclusione di adeguati regressori di fastidio), a causa della relativa tempistica di questi eventi. Questo non dovrebbe essere il caso dell’analisi dell’errore di previsione dei risultati, in quanto questa si concentra su prove in cui non è stata fatta una risposta di evitamento (vedi Risultati). Inoltre, c’è una maggiore variabilità nell’errore di previsione rispetto ai segnali di valore attesi nel corso del compito, rendendo il primo più facile da discernere statisticamente. Tuttavia, i cambiamenti nella rappresentazione degli stimoli categorici associati al valore sono ben valutati utilizzando un approccio multivariato (vedi sotto).
Una soglia iniziale di formazione del cluster di p<0,001 (non corretto), dimensione del cluster ≥10, è stata applicata alle mappe statistiche di secondo livello, seguita da una correzione del tasso di errore a livello di famiglia di cluster (FWE) a livello del cervello intero (pWB). La correzione del piccolo volume(pSVC) è stata applicata in regioni di interesse a priori (ROI): cioè l’insula, l’amigdala, lo striato, la corteccia visiva primaria (V1) e la corteccia prefrontale ventromediale (vmPFC) (vedi testo principale). Le ROI sono state definite anatomicamente utilizzando l’atlante automatico di etichettatura anatomica (aal)(Tzourio-Mazoyer et al., 2002) in SPM (‘striatum’=caudato + putamen+pallidum; ‘V1’=Brodmann Area 17; ‘vmPFC’= cortecce orbito-frontali medie).
Nell’analisi sono stati inclusi solo i voxel presenti in tutti i soggetti. Ai fini della visualizzazione, le mappe statistiche sono state soglia a p<0.001 (non corretto), e si sovrappongono su un’immagine strutturale di alta qualità media MNI-spazio MNI-spazio disponibile come parte del pacchetto MRIcroGL. Tutte le coordinate voxel citate si riferiscono allo spazio MNI, in mm.
Analisi multivariata
L’analisi di similitudine rappresentativa (RSA) è stata effettuata utilizzando materiali provenienti dal toolbox RSA ([Nili et al., 2014]; disponibile su github.com/rsagroup/rsatoolbox), eseguito in Matlab.
Per questa analisi, i dati delle serie temporali estratti da tutti i voxel di ogni ROI sono stati prima multivariatamente normalizzati per il rumore (i dati erano immagini beta tratte da un semplice modello lineare generale categorico che consisteva in un semplice modello lineare generale categorico che consisteva nell’insorgenza di stimoli per tipo e degli stessi regressori di fastidiosi regressori delle analisi univariate). Abbiamo calcolato i valori di contrasto lineare discriminante tra coppie di categorie di stimoli (CS-, GS, CS+) come una stima robusta della dissimilarità rappresentazionale(Walther et al., 2016). Questo approccio comporta la costruzione di un limite di decisione ottimale (iperpiano) tra coppie di rappresentazioni multivariate (cioè il segnale di BOLD in tutti i voxel, vedi Figura 4a). I valori LDC sono una misura continua della distanza rappresentazionale (dissimilarità) tracciata mediante campionamento di una dimensione ortogonale a questo confine di decisione (discriminante lineare di Fisher). Per garantire che le distanze sono stati imparziali dal rumore (e quindi aveva un punto zero significativo), i valori LDC sono stati stimati utilizzando un leave-one-out cross-validazione approccio attraverso corse di imaging funzionale (questo costituisce una stima cross-validata della distanza Mahlanobis;[Walther et al., 2016]).
Le regioni di interesse apriori erano le stesse dell’analisi univariata. Tuttavia, secondo il nostro piano di analisi, dove possibile le ROI anatomiche sono state sostituite da ROI funzionali definite dall’analisi univariata a livello di gruppo. In particolare, i cluster di insula e caudato anteriori identificati nella Figura 3b sono stati sostituiti da ROI anatomiche a struttura intera. Ciò è stato fatto sulla base del fatto che (1) l’analisi univariata ha indicato il coinvolgimento di questi voxel in specifici processi di generalizzazione legati al valore, e (2) l’analisi precedente ha dimostrato che l’affidabilità di LDC RDMs cade bruscamente per le ROI più grandi (> ~ 250 voxel, [Waltheret al., 2016]; ROI anatomici per l’intera insula = 1019 voxel, per lo striato intero = 3482 voxel; ROI dell’insula funzionale anteriore = 71 voxel, ROI caudato funzionale = 20 voxel, maschere disponibili presso osf.io/25t3f).
Dati del questionario
Il punteggio totale del questionario e i punteggi dei singoli item sono stati scalati (z-scored tra i partecipanti) prima di un’ulteriore analisi.
L’analisi dei fattori è stata effettuata come descritto in Gillan et al (2016): implementata in R v3.4.0 (R Foundation for Statistical Computing), utilizzando la funzione factanal (pacchetto psicologico) con rotazione obliqua (oblimin). Il numero di fattori da estrarre è stato determinato utilizzando il metodo Cattell-Nelson-Gorsuch(Gorsuch e Nelson, 1981) (pacchetto nFactors), in base al quale vengono analizzati i gradienti successivi della trama del ghiaione per determinare il punto “gomito”, dopo il quale c’è poco guadagno nel mantenere i fattori aggiuntivi. I nomi dei fattori sono stati scelti sulla base degli elementi a più alto carico per ogni fattore.
Differenze individuali
La normalità della distribuzione delle singole variabili (o delle differenze tra le variabili all’interno del soggetto) è stata valutata utilizzando il test di Shapiro-Wilk e, se del caso, sono state utilizzate statistiche non parametriche per i test a coppie.
Nel campione fMRI, le stime di similarità rappresentazionali multivariate di tutte le ROI sono state confrontate con l’evitamento complessivo di GS utilizzando un modello di regressione lineare multipla a minimi quadrati ordinario. L’evitamento medio tra i diversi tipi di prova è stato valutato con un punteggio z all’interno dei partecipanti, al fine di ottenere una misura dell’evitamento GS relativo (cioè prendendo in considerazione la variazione individuale della tendenza ad evitare su CS- e CS + prove).
I parametri dei singoli modelli che regolano la generalizzazione basata sul valore (σ A/σN) sono stati correlati a variabili di interesse (somiglianza rappresentazionale multivariata nel campione fMRI, psicopatologia auto-rapportata nel campione online) utilizzando modelli di regressione lineare multipla a minimi quadrati ponderati. Questo metodo produce la stima della massima stima della regressione di probabilità quando il rumore non è costante tra le misure (cioè i dati sono eteroscedatici;[Carroll e Ruppert, 1988]). Poiché la casella degli strumenti VBA produce la varianza delle stime dei parametri posteriori e la media, i pesi sono stati definiti come la precisione delle stime dei singoli parametri (cioè 1/varianza posteriore). Le analisi di regressione sono state implementate in R utilizzando la funzione lm (pacchetto psicologico). In tutti i modelli di regressione dei dati del questionario sono state incluse anche informazioni sull’età (z-scored) e sul genere (punteggio binario come maschio vs femmina/altro) come predittori di nessun interesse. Nella sintassi R: fit.wls = lm(σ A ~ predittore(i) +ageZ + genere, pesi = σ A precisione)
Laddove i predittori dei candidati erano significativamente collineari (come nel caso dei dati dei punteggi totali del questionario), sono stati implementati in modelli di regressione separati. La correzione dei confronti multipli per questi modelli è stata ottenuta attraverso la correzione Nyholt-Bonferroni(Li e Ji, 2005), che produce una correzione Bonferroni modificata per le variabili non indipendenti (correlate) stimando il “numero effettivo di variabili indipendenti” dagli autovalori della loro matrice di correlazione. Anche se abbiamo raccolto i dati di ansia tratto nel gruppo di risonanza magnetica (al fine di caratterizzare i livelli di ansia generale nel campione, e lo screening di tutti gli individui con ansia non diagnosticata patologicamente significativa), non abbiamo previsto di confrontare le differenze individuali nel comportamento per caratterizzare l’ansia in questo campione, come le dimensioni dell’effetto da studi precedenti relativi ai parametri del modello di decisione dei parametri del modello ai sintomi psicologici suggeriscono che questo sarebbe significativamente sottodimensionato (ad esempio[Gillan et al., 2016]).
Come test più robusto, abbiamo integrato le nostre analisi di regressione lineare con modelli di regressione regolarizzati e validati in modo incrociato, dove tutti i predittori sono stati inclusi in un unico modello. In particolare, abbiamo utilizzato la regressione LASSO (LASSO) con una regressione con operatore di restringimento e selezione meno assoluta(Tibshirani, 1996) con una convalida incrociata lasciata una sola volta. Questo approccio riduce efficacemente i predittori non significativi a zero e fornisce una stima più robusta dei coefficienti di regressione. Questo è stato implementato usando il pacchetto glmnet in R. Nella sintassi R: fit.cv = cv.glmnet(y= σ A, x = tutti i predittori, alpha = 1, nfolds = N, pesi = σ A precision)
References
- Aizenberg M, Geffen MN. Bidirectional effects of aversive learning on perceptual acuity are mediated by the sensory cortex. Nature Neuroscience. 2013; 16:994-996. DOI | PubMed
- Ang YS, Lockwood P, Apps MA, Muhammed K, Husain M. Distinct subtypes of apathy revealed by the apathy motivation index. Plos One. 2017; 12DOI | PubMed
- Arnaudova I, Kindt M, Fanselow M, Beckers T. Pathways towards the proliferation of avoidance in anxiety and implications for treatment. Behaviour Research and Therapy. 2017; 96:3-13. DOI | PubMed
- Bonnelle V, Veromann KR, Burnett Heyes S, Lo Sterzo E, Manohar S, Husain M. Characterization of reward and effort mechanisms in apathy. Journal of Physiology-Paris. 2015; 109:16-26. DOI | PubMed
- Carroll RJ, Ruppert D. Transformation and Weighting in Regression. CRC Press; 1988. DOI
- Cha J, Carlson JM, Dedora DJ, Greenberg T, Proudfit GH, Mujica-Parodi LR. Hyper-reactive human ventral tegmental area and aberrant mesocorticolimbic connectivity in overgeneralization of fear in generalized anxiety disorder. Journal of Neuroscience. 2014; 34:5855-5860. DOI | PubMed
- Crump MJ, McDonnell JV, Gureckis TM. Evaluating Amazon’s mechanical turk as a tool for experimental behavioral research. PLoS ONE. 2013; 8DOI | PubMed
- Daunizeau J, Adam V, Rigoux L. VBA: a probabilistic treatment of nonlinear models for neurobiological and behavioural data. PLoS Computational Biology. 2014; 10DOI | PubMed
- de Leeuw JR. jsPsych: a JavaScript library for creating behavioral experiments in a Web browser. Behavior Research Methods. 2015; 47:1-12. DOI | PubMed
- Delgado MR, Jou RL, Ledoux JE, Phelps EA. Avoiding negative outcomes: tracking the mechanisms of avoidance learning in humans during fear conditioning. Frontiers in Behavioral Neuroscience. 2009; 3DOI | PubMed
- Duits P, Cath DC, Lissek S, Hox JJ, Hamm AO, Engelhard IM, van den Hout MA, Baas JM. Updated meta-analysis of classical fear conditioning in the anxiety disorders. Depression and Anxiety. 2015; 32:239-253. DOI | PubMed
- Dunsmoor JE, Prince SE, Murty VP, Kragel PA, LaBar KS. Neurobehavioral mechanisms of human fear generalization. NeuroImage. 2011; 55:1878-1888. DOI | PubMed
- Dymond S, Dunsmoor JE, Vervliet B, Roche B, Hermans D. Fear generalization in humans: systematic review and implications for anxiety disorder research. Behavior Therapy. 2015; 46:561-582. DOI | PubMed
- Eldar E, Hauser TU, Dayan P, Dolan RJ. Striatal structure and function predict individual biases in learning to avoid pain. PNAS. 2016; 113:4812-4817. DOI | PubMed
- Foa EB, Huppert JD, Leiberg S, Langner R, Kichic R, Hajcak G, Salkovskis PM. The obsessive-compulsive inventory: development and validation of a short version. Psychological Assessment. 2002; 14:485-496. DOI | PubMed
- Fullana MA, Harrison BJ, Soriano-Mas C, Vervliet B, Cardoner N, Àvila-Parcet A, Radua J. Neural signatures of human fear conditioning: an updated and extended meta-analysis of fMRI studies. Molecular Psychiatry. 2016; 21:500-508. DOI | PubMed
- Genud-Gabai R, Klavir O, Paz R. Safety signals in the primate amygdala. Journal of Neuroscience. 2013; 33:17986-17994. DOI | PubMed
- Ghirlanda S, Enquist M. A century of generalization. Animal Behaviour. 2003; 66:15-36. DOI
- Ghosh S, Chattarji S. Neuronal encoding of the switch from specific to generalized fear. Nature Neuroscience. 2015; 18:112-120. DOI | PubMed
- Gillan CM, Daw ND. Taking Psychiatry Research Online. Neuron. 2016; 91:19-23. DOI | PubMed
- Gillan CM, Kosinski M, Whelan R, Phelps EA, Daw ND. Characterizing a psychiatric symptom dimension related to deficits in goal-directed control. eLife. 2016; 5DOI | PubMed
- Gillan CM, Morein-Zamir S, Urcelay GP, Sule A, Voon V, Apergis-Schoute AM, Fineberg NA, Sahakian BJ, Robbins TW. Enhanced avoidance habits in obsessive-compulsive disorder. Biological Psychiatry. 2014; 75:631-638. DOI | PubMed
- Glover GH, Li TQ, Ress D. Image-based method for retrospective correction of physiological motion effects in fMRI: RETROICOR. Magnetic Resonance in Medicine. 2000; 44:162-167. DOI | PubMed
- Gorgolewski KJ, Auer T, Calhoun VD, Craddock RC, Das S, Duff EP, Flandin G, Ghosh SS, Glatard T, Halchenko YO, Handwerker DA, Hanke M, Keator D, Li X, Michael Z, Maumet C, Nichols BN, Nichols TE, Pellman J, Poline JB, Rokem A, Schaefer G, Sochat V, Triplett W, Turner JA, Varoquaux G, Poldrack RA. The brain imaging data structure, a format for organizing and describing outputs of neuroimaging experiments. Scientific Data. 2016; 3DOI | PubMed
- Gorsuch RL, Nelson J. CNG scree test: an objective procedure for determining the number of factors. 1981.
- Greenberg T, Carlson JM, Cha J, Hajcak G, Mujica-Parodi LR. Neural reactivity tracks fear generalization gradients. Biological Psychology. 2013; 92:2-8. DOI | PubMed
- Grewe BF, Gründemann J, Kitch LJ, Lecoq JA, Parker JG, Marshall JD, Larkin MC, Jercog PE, Grenier F, Li JZ, Lüthi A, Schnitzer MJ. Neural ensemble dynamics underlying a long-term associative memory. Nature. 2017; 543:670-675. DOI | PubMed
- Grosso A, Santoni G, Manassero E, Renna A, Sacchetti B. A neuronal basis for fear discrimination in the lateral amygdala. Nature Communications. 2018; 9DOI | PubMed
- Grupe DW, Nitschke JB. Uncertainty and anticipation in anxiety: an integrated neurobiological and psychological perspective. Nature Reviews Neuroscience. 2013; 14:488-501. DOI | PubMed
- Gureckis TM, Martin J, McDonnell J, Rich AS, Markant D, Coenen A, Halpern D, Hamrick JB, Chan P. psiTurk: An open-source framework for conducting replicable behavioral experiments online. Behavior Research Methods. 2016; 48:829-842. DOI | PubMed
- Hanson HM. Effects of discrimination training on stimulus generalization. Journal of Experimental Psychology. 1959; 58:334. DOI | PubMed
- Harvie DS, Moseley GL, Hillier SL, Meulders A. Classical conditioning differences associated with chronic pain: a systematic review. The Journal of Pain. 2017; 18:889-898. DOI | PubMed
- Kahnt T, Park SQ, Burke CJ, Tobler PN. How glitter relates to gold: similarity-dependent reward prediction errors in the human striatum. Journal of Neuroscience. 2012; 32:16521-16529. DOI | PubMed
- Kasper L, Bollmann S, Diaconescu AO, Hutton C, Heinzle J, Iglesias S, Hauser TU, Sebold M, Manjaly ZM, Pruessmann KP, Stephan KE. The PhysIO toolbox for modeling physiological noise in fMRI Data. Journal of Neuroscience Methods. 2017; 276:56-72. DOI | PubMed
- Kriegeskorte N, Formisano E, Sorger B, Goebel R. Individual faces elicit distinct response patterns in human anterior temporal cortex. PNAS. 2007; 104:20600-20605. DOI | PubMed
- Kriegeskorte N, Mur M, Bandettini P. Representational similarity analysis – connecting the branches of systems neuroscience. Frontiers in Systems Neuroscience. 2008; 2DOI | PubMed
- Krypotos AM, Effting M, Kindt M, Beckers T. Avoidance learning: a review of theoretical models and recent developments. Frontiers in Behavioral Neuroscience. 2015; 9DOI | PubMed
- Laufer O, Israeli D, Paz R. Behavioral and neural mechanisms of overgeneralization in anxiety. Current Biology. 2016; 26:713-722. DOI | PubMed
- Laufer O, Paz R. Monetary loss alters perceptual thresholds and compromises future decisions via amygdala and prefrontal networks. Journal of Neuroscience. 2012; 32:6304-6311. DOI | PubMed
- Le Pelley ME. The role of associative history in models of associative learning: a selective review and a hybrid model. The Quarterly Journal of Experimental Psychology Section B. 2004; 57:193-243. DOI
- LeDoux JE, Moscarello J, Sears R, Campese V. The birth, death and resurrection of avoidance: a reconceptualization of a troubled paradigm. Molecular Psychiatry. 2017; 22:24-36. DOI | PubMed
- Li J, Ji L. Adjusting multiple testing in multilocus analyses using the eigenvalues of a correlation matrix. Heredity. 2005; 95:221-227. DOI | PubMed
- Likhtik E, Stujenske JM, Topiwala MA, Harris AZ, Gordon JA. Prefrontal entrainment of amygdala activity signals safety in learned fear and innate anxiety. Nature Neuroscience. 2014; 17:106-113. DOI | PubMed
- Lissek S, Bradford DE, Alvarez RP, Burton P, Espensen-Sturges T, Reynolds RC, Grillon C. Neural substrates of classically conditioned fear-generalization in humans: a parametric fMRI study. Social Cognitive and Affective Neuroscience. 2014; 9:1134-1142. DOI | PubMed
- Martin A, Rief W, Klaiberg A, Braehler E. Validity of the brief patient health questionnaire mood scale (PHQ-9) in the general population. General Hospital Psychiatry. 2006; 28:71-77. DOI | PubMed
- Meins E, McCarthy-Jones S, Fernyhough C, Lewis G, Bentall RP, Alloy LB. Assessing negative cognitive style: development and validation of a short-form version of the cognitive style questionnaire. Personality and Individual Differences. 2012; 52:581-585. DOI | PubMed
- Mumford JA, Poline JB, Poldrack RA. Orthogonalization of regressors in FMRI models. PLoS One. 2015; 10DOI | PubMed
- Nili H, Wingfield C, Walther A, Su L, Marslen-Wilson W, Kriegeskorte N. A toolbox for representational similarity analysis. PLoS Computational Biology. 2014; 10DOI | PubMed
- Onat S, Büchel C. The neuronal basis of fear generalization in humans. Nature Neuroscience. 2015; 18:1811-1818. DOI | PubMed
- Palminteri S, Justo D, Jauffret C, Pavlicek B, Dauta A, Delmaire C, Czernecki V, Karachi C, Capelle L, Durr A, Pessiglione M. Critical roles for anterior insula and dorsal striatum in punishment-based avoidance learning. Neuron. 2012; 76:998-1009. DOI | PubMed
- Pasternak T, Greenlee MW. Working memory in primate sensory systems. Nature Reviews Neuroscience. 2005; 6:97-107. DOI | PubMed
- Patton JH, Stanford MS, Barratt ES. Factor structure of the Barratt impulsiveness scale. Journal of Clinical Psychology. 1995; 51:768-774. DOI | PubMed
- Pearson RM, Heron J, Button K, Bentall RP, Fernyhough C, Mahedy L, Bowes L, Lewis G. Cognitive styles and future depressed mood in early adulthood: the importance of global attributions. Journal of Affective Disorders. 2015; 171:60-67. DOI | PubMed
- Resnik J, Paz R. Fear generalization in the primate amygdala. Nature Neuroscience. 2015; 18:188-190. DOI | PubMed
- Resnik J, Sobel N, Paz R. Auditory aversive learning increases discrimination thresholds. Nature Neuroscience. 2011; 14:791-796. DOI | PubMed
- Rigoux L, Stephan KE, Friston KJ, Daunizeau J. Bayesian model selection for group studies – revisited. NeuroImage. 2014; 84:971-985. DOI | PubMed
- Rogan MT, Leon KS, Perez DL, Kandel ER. Distinct neural signatures for safety and danger in the amygdala and striatum of the mouse. Neuron. 2005; 46:309-320. DOI | PubMed
- Sasaki Y, Nanez JE, Watanabe T. Advances in visual perceptual learning and plasticity. Nature Reviews Neuroscience. 2010; 11:53-60. DOI | PubMed
- Schechtman E, Laufer O, Paz R. Negative valence widens generalization of learning. Journal of Neuroscience. 2010; 30:10460-10464. DOI | PubMed
- Seymour B, Daw ND, Roiser JP, Dayan P, Dolan R. Serotonin selectively modulates reward value in human decision-making. Journal of Neuroscience. 2012; 32:5833-5842. DOI | PubMed
- Seymour B, O’Doherty JP, Dayan P, Koltzenburg M, Jones AK, Dolan RJ, Friston KJ, Frackowiak RS. Temporal difference models describe higher-order learning in humans. Nature. 2004; 429:664-667. DOI | PubMed
- Shalev L, Paz R, Avidan G. Visual aversive learning compromises sensory discrimination. The Journal of Neuroscience. 2018; 38:2766-2779. DOI | PubMed
- Slivinske AJ, Hall JF. The discriminability of tones used to test stimulus-generalization. The American Journal of Psychology. 1960; 73:581-586. DOI
- Spielberger CD, Gorsuch RL, Lushene RE. The State-Trait Anxiety Inventory: Test Manual for Form X. Consulting Psychologists Press: Palo Alto, CA; 1970.
- Struyf D, Zaman J, Vervliet B, Van Diest I. Perceptual discrimination in fear generalization: mechanistic and clinical implications. Neuroscience & Biobehavioral Reviews. 2015; 59:201-207. DOI | PubMed
- Sutton RS, Barto AG. Reinforcement Learning: An Introduction. MIT Press; 1998.
- Tibshirani R. Regression Shrinkage and Selection via the Lasso. Journal of the Royal Statistical Society. Series B . 1996; 58:267-288.
- Treanor M, Barry TJ. Treatment of avoidance behavior as an adjunct to exposure therapy: Insights from modern learning theory. Behaviour Research and Therapy. 2017; 96:30-36. DOI | PubMed
- Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, Mazoyer B, Joliot M. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage. 2002; 15:273-289. DOI | PubMed
- van Dam LC, Ernst MO. Mapping shape to visuomotor mapping: learning and generalisation of sensorimotor behaviour based on contextual information. PLoS Computational Biology. 2015; 11DOI | PubMed
- Vlaeyen JW, Linton SJ. Fear-avoidance model of chronic musculoskeletal pain: 12 years on. Pain. 2012; 153:1147. DOI | PubMed
- Walther A, Nili H, Ejaz N, Alink A, Kriegeskorte N, Diedrichsen J. Reliability of dissimilarity measures for multi-voxel pattern analysis. NeuroImage. 2016; 137DOI | PubMed
- Weinberger NM. Associative representational plasticity in the auditory cortex: a synthesis of two disciplines. Learning & Memory. 2007; 14:1-16. DOI | PubMed
- Wichmann FA, Hill NJ. The psychometric function: I. Fitting, sampling, and goodness of fit. Perception & Psychophysics. 2001; 63:1293-1313. DOI | PubMed
- Wigestrand MB, Schiff HC, Fyhn M, LeDoux JE, Sears RM. Primary auditory cortex regulates threat memory specificity. Learning & Memory. 2017; 24:55-58. DOI | PubMed
Fonte
Norbury A, Robbins TW, Seymour B, Lee D () Value generalization in human avoidance learning. eLife 7e34779. https://doi.org/10.7554/eLife.34779





