Dichiarazione di rilevanza
Le teorie prevalenti che spiegano il recupero funzionale delle funzioni del linguaggio dopo l’ictus ischemico perinatale differiscono notevolmente sul ruolo delle regioni perilesionali funzionalmente risparmiate rispetto alle omologhe aree cerebrali contralesionali non colpite. Qui, abbiamo valutato come i modelli di riorganizzazione funzionale e strutturale del cervello sono stati associati con i risultati del linguaggio in un gruppo di bambini di quattro anni con ictus ischemico arterioso perinatale sinistro (PAIS). Indici di lateralizzazione più grandi di connettività sia funzionale che strutturale verso l’emisfero destro sono stati associati a livelli più alti di sviluppo del linguaggio. Così, la plasticità interemisferica attraverso meccanismi di iperconnettività strutturale e funzionale potrebbe essere cruciale nei danni precoci, probabilmente attraverso la degenerazione dei neuroni che proiettano dalle aree temporali a quelle frontali insieme alla germinazione assonale controlaterale sull’emisfero destro.
Introduzione
Negli adulti, l’elaborazione del linguaggio si basa su una rete ampiamente distribuita che coinvolge principalmente le regioni cerebrali perisilvane dell’emisfero sinistro(Friederici, 2011; Price, 2012). Queste aree cerebrali sono interconnesse attraverso fasci di fibre di materia bianca (WM), formando complessivamente le vie dorsali e ventrali coinvolte nell’elaborazione del linguaggio(Catani et al., 2005; Hickok e Poeppel, 2007; Rauschecker e Scott, 2009). Secondo i modelli dual-stream, la via dorsale comprende il fascicolo arcuato (AF) composto dal segmento lungo che collega le regioni temporali posteriori superiori con l’area di Broca, il segmento anteriore che collega il lobo parietale inferiore (IPL) con l’area di Broca, e il segmento posteriore dalle regioni pST all’IPL (Cataniet al., 2005, 2007). Dal punto di vista funzionale, la FA è nota per contribuire alle trasformazioni da suono ad articolazione(Liberman e Mattingly ,1985; Hickok e Poeppel, 2007), all’apprendimento del linguaggio fonologico(López-Barroso et al., 2013), all’integrazione audio-motoria (Assaneo et al.,2019), all’elaborazionefonologica(Vandermosten et al.,2012) e alla memoria di lavoro (Meyer et al.,2014). Il flusso ventrale collega il giroscopio occipitale superiore temporale, il giroscopio angolare e il giroscopio frontale inferiore ed è formato dal fascicolo inferiore fronto-occipitale (IFOF), dal fascicolo longitudinale inferiore (ILF) e dal fascicolo uncinato (UF; Bajada et al., 2015). Questo percorso ventrale contribuisce piuttosto all’elaborazione semantica, alla mappatura sonora, all’apprendimento delle parole semantiche e al riconoscimento degli oggetti uditivi(Catani et al., 2003; Saur et al., 2008; Friederici, 2009; Ripollés et al., 2017). È interessante notare che gli studi di neuroimaging hanno rivelato che i neonati possono reclutare una rete neurale bilaterale con una predominanza già lasciata per gli stimoli linguistici(Shultz et al., 2014; Dehaene-Lambertz e Spelke, 2015). Sebbene sia ancora in discussione, alcuni dei tratti di materia bianca come le AF sono già sviluppati e funzionali alla nascita, mentre altri come l’UF si stanno ancora sviluppando a causa di una maturazione ritardata(Zhang et al., 2007; Perani et al., 2011; Brauer et al., 2013; Bajada et al., 2015). Nonostante il fatto che funzioni linguistiche di basso livello possano essere presenti già alla nascita, come testimoniano le attivazioni corticali sinistre per specifiche caratteristiche spettro-temporali dell’input vocale(Dehaene-Lambertz et al., 2002, 2006; Telkemeyer et al., 2009; Perani et al., 2010), il successivo sviluppo di funzioni linguistiche di ordine superiore può comportare una lateralizzazione graduata verso l’emisfero sinistro che emerge con l’età(Brown et al., 2005; Szaflarski et al., 2006). Ad esempio, è stato dimostrato che la maturazione corticale delle regioni temporoparietali si verifica molto più lentamente rispetto alla maturazione delle regioni cerebrali frontali(Leroy et al., 2011). Questa lenta maturazione è stata evidenziata anche a livello di MM con una maturazione più lenta e una maggiore sensibilità ai fattori ambientali del segmento posteriore destro della FA rispetto ai segmenti anteriore e lungo(Budisavljevic et al., 2015). Questi risultati favoriscono una visione plastica e dipendente dall’esperienza delle basi neurali dell’acquisizione del linguaggio nei bambini in fase di sviluppo.
In questo contesto, lo studio di bambini con lesioni cerebrali precoci come l’ictus ischemico arterioso perinatale (PAIS) fornisce un’opportunità unica per studiare la riorganizzazione del cervello e i meccanismi di plasticità che hanno luogo prima dello sviluppo del linguaggio. La PAIS si verifica in una nascita su 4000(Nelson e Lynch, 2004) e può avere effetti negativi a lungo termine sullo sviluppo cognitivo e sulle funzioni del linguaggio dei bambini rispetto ai coetanei in fase di sviluppo (Ballantyneet al., 2008; Westmacott et al., 2009; Westmacott et al., 2010; Reilly , et al., 2013). Tuttavia, a differenza dell’ictus che si verifica in età adulta, la PAIS sull’emisfero sinistro non induce generalmente l’afasia post-ictus(Bates et al., 2001; Stiles et al., 2005), sebbene dati molto recenti suggeriscano la possibile esistenza di una forma evolutiva di afasia di conduzione dopo l’ictus neonatale(Northam et al., 2018; Schlaug, 2018). A causa della bassa incidenza di PAIS, nessun precedente studio di neuroimaging è stato condotto in questa popolazione durante il periodo pre-scolastico, quando l’apprendimento e processi neuroplastici sono in corso. Qui, abbiamo valutato per la prima volta come i modelli di riorganizzazione strutturale e funzionale del cervello sono stati associati con i risultati del linguaggio in un gruppo di bambini di quattro anni con PAIS sinistra. A questo scopo, abbiamo raccolto misure a grana fine degli aspetti ricettivi e produttivi del linguaggio, nonché misure standardizzate di sviluppo cognitivo. Abbiamo anche raccolto dati di neuroimmagini sia strutturali che funzionali in anestesia leggera. È importante notare che abbiamo utilizzato un gruppo di bambini sani provenienti dal Pediatric MRI Data Repository [National Institutes of Health (NIH) MRI Study of Normal Brain Development] che hanno trovato corrispondenza nell’età e nel sesso per servire come controllo per le analisi strutturali di connettività.
Considerando il ruolo delle regioni perilesionali funzionalmente risparmiate rispetto alle omologhe aree cerebrali contralesionali non colpite nelle attuali teorie di recupero funzionale dopo l’ictus precoce, ci aspettavamo che i bambini con ictus perinatale che colpisce la FA sinistra fossero i più compromessi nelle funzioni del linguaggio. Questo modello di risultati confermerebbe che l’integrità funzionale dell’emisfero sinistro è obbligatoria per ottenere un normale sviluppo del linguaggio(Raja-Beharelle et al., 2010). Tuttavia, se l’emisfero destro è in grado di “prendere il sopravvento” sulle funzioni del linguaggio solitamente supportate dall’emisfero sinistro (Staudtet al., 2002; Tillema, et al., 2008; Tivarus et al., 2012), allora dovremmo osservare una relazione significativa tra i parametri strutturali (ad es, proprietà microstrutturali dei percorsi WM correlati al linguaggio) e/o attivazioni funzionali nell’emisfero destro e misure del linguaggio ricettivo ed espressivo, in linea con le precedenti evidenze degli adulti sul ruolo del percorso dorsale destro nel recupero dall’afasia indotta da ictus sinistro(Forkel et al., 2014; Pani et al., 2016).
Materiali e metodi
Etica e partecipanti
Al presente studio hanno partecipato sei bambini con PAIS sintomatica (due bambine) sull’emisfero sinistro. Questi bambini facevano parte di un più ampio studio multicentrico osservazionale prospettico sulla PAIS sintomatica acuta. La selezione di questi bambini è stata fatta in base all’età minima alla quale le valutazioni comportamentali e neuroimaging potrebbe essere fatto in un intervallo di tempo ragionevole per tutti loro. Tutti i bambini, tranne due, sono stati sottoposti a terapia logopedica su base settimanale (L2 e L6). La PAIS sintomatica è stata definita come il riscontro di una lesione ischemica da uno studio di risonanza magnetica nel territorio delle principali arterie cerebrali [arteria cerebrale media (MCA), arteria cerebrale anteriore (ACA) e arteria cerebrale posteriore (PCA)] in un neonato che presentava crisi epilettiche, apnea ricorrente o deficit neurologico acuto durante i primi giorni di vita. I neonati con (1) chiaro segno di perdita di tessuto o di atrofia nella risonanza magnetica indicativa di un vecchio infarto che si è verificato prima della nascita, (2) malformazioni vascolari, (3) anomalie congenite o cromosomiche, (4) malattie metaboliche o infettive, (5) malattie cardiache complesse congenite o neonati con ossigenazione a membrana extracorporea, sono stati esclusi dallo studio. In particolare, la diagnostica basata sulla risonanza magnetica è stata eseguita su dati anatomici acquisiti su uno scanner a risonanza magnetica a corpo intero 1,5 T con una specifica bobina di testa neonatale entro 7 d dopo il verificarsi dei sintomi neurologici. Questi dati di RM hanno permesso di classificare le lesioni in base al territorio arterioso coinvolto (cioè, quattro segmenti: M1-M4). La classificazione di ogni infarto è stata ottenuta da due neurologi indipendenti non vedendo i dati clinici. Le discrepanze nella classificazione della PAIS sono state discusse e risolte per consenso in occasione di una rivalutazione congiunta tra tre osservatori: AGA e due neurologi non vedenti di fronte ai dati clinici. La compromissione motoria è stata presa in considerazione quando i neonati avevano chiari segni clinici di monoplegia/emplegia (GMFCS almeno I e/o BFMF a I livello). I neonati con anomalie minori come la mano precoce, lievi anomalie di tono o riflessi che non interferiscono con le funzioni non sono stati considerati con una compromissione motoria. È importante notare che, mentre tutti i bambini che presentavano crisi epilettiche nei tre primi giorni dopo la nascita, nessun bambino soffriva di epilessia al momento della risonanza magnetica.
La risonanza magnetica cerebrale è stata acquisita anche a 3,8 anni (SD = 0,26) per controllare la lesione residua e per ottenere i dati funzionali e strutturali qui riportati. Questi dati di risonanza magnetica hanno dimostrato che tutti i bambini hanno avuto infarti del MCA che interessano diverse regioni cerebrali(Tabella 1; Fig. 1). Al momento dello studio, tutti i bambini hanno mostrato una preferenza per la mano destra. I genitori dei bambini hanno ricevuto informazioni sullo studio in forma scritta e orale e il loro consenso scritto è stato ottenuto prima dell’inizio dello studio. Lo studio è stato approvato dal Comitato Etico di una località che sarà identificata se l’articolo sarà pubblicato in conformità alla Dichiarazione di Helsinki.
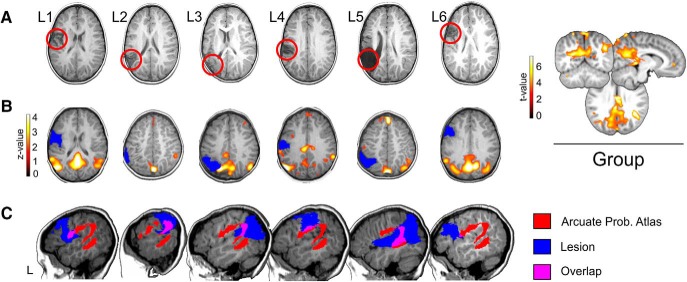
Figura 1.
A, Rappresentazione delle lesioni strutturali nello spazio nativo utilizzando un’immagine assiale T1-w. Le lesioni possono essere viste come aree ipo-intense e sono evidenziate con un cerchio rosso. Viene utilizzata la convenzione neurologica. B, DMN individuali per ogni paziente, ottenuti utilizzando ICA spaziale di gruppo sui dati dello stato di riposo (vedi Materiali e Metodi). I dati individuali sono in z-score(p <0,05, non corretto) e presentati sopra T1 di ogni paziente registrato in uno spazio comune (quattro anni modello di cervello MRI di quattro anni ottenuto dal database MRI Neurodevelopmental; vedi Materiali e Metodi). Questo è stato fatto come dimostrazione della qualità dei dati, dato che il propofol può ridurre la connettività in aree corticali di importanza per lo studio attuale(Boveroux et al., 2010). A destra, il DMN medio per tutti i pazienti è raffigurato, utilizzando i valori t(p < 0,01, non corretto) su un modello canonico di cervello di quattro anni di risonanza magnetica. CI modelli di probabilità per l’arcuata sinistra (segmento anteriore, posteriore e lungo) sono stati estratti dall’atlante del Tractotrone(Thiebaut de Schotten et al., 2011; Rojkova et al., 2016), sogliati all’80% (solo i voxel che secondo l’atlante hanno una probabilità dell’80% di far parte della FA sono mostrati) e registrati in uno spazio comune (il modello cerebrale di quattro anni di risonanza magnetica ottenuto dal database di risonanza magnetica per lo sviluppo neurologico). Per ogni paziente, qui vengono rappresentati l’atlante probabilistico arcuato (in rosso), la lesione (in blu) e la sovrapposizione tra di loro (in rosa) su una fetta sagittale dell’emisfero sinistro. Viene utilizzata la convenzione neurologica. L, emisfero sinistro.
| Codice paziente | Età alla scansione (anni) | Sesso | Età gestazionale alla nascita (settimane) | Peso alla nascita(g) | Debutto clinico(ore di età) | Età della risonanza magnetica (d) | Vascularterritory | Volume della corsa alla nascita (ml) | Danneggiamento del motore (emiplegia) | Epilessiaa |
|---|---|---|---|---|---|---|---|---|---|---|
| L1 | 4 | M | 41 | 3160 | Convulsioni cloniche a 12 ore | 4 | M2 L | 18890 | No | No |
| L2 | 3.5 | F | 41 | 2960 | Convulsioni cloniche a 26 ore | 10 | M4 L | 47428 | Sì | No |
| L3 | 4 | M | 40 | 3560 | Convulsioni cloniche a 48 ore | 20 | M1Post-biforcazione L | 17588 | No | No |
| L4 | 4 | F | 41 | 2600 | Convulsioni cloniche a 18 ore | 4 | M2 sup L | 27882 | No | No |
| L5 | 4 | M | 39 | 3340 | Convulsioni cloniche a 24 ore | 5 | M1Post-biforcazione L | 36512 | No | No |
| L6 | 3.5 | M | 40 | 3025 | Convulsioni cloniche a 41 ore | 5 | M1Post-biforcazione L | 23509 | Sì | No |
Inoltre, abbiamo utilizzato un gruppo di nove bambini sani (tre femmine, 4,30 ± 1,09 anni) provenienti da un archivio pediatrico di risonanza magnetica per il controllo delle analisi strutturali di connettività. Il gruppo di controllo e i pazienti sono stati abbinati in età[t(13) = 1,02; p = 0,32. Non è stata riscontrata alcuna differenza di genere (χ 2 = 0,313; p = 0,57). In particolare, i dati utilizzati nella preparazione di questo articolo sono stati ottenuti dal Pediatric MRI Data Repository creato dall’NIH MRI Study of Normal Brain Development (abbiamo cercato tutti i dati dei bambini tra i tre e i sei anni con dati DW-MRI). Si tratta di uno studio longitudinale multisito sui bambini in fase di sviluppo, dall’età neonatale fino all’età adulta, condotto dal Brain Development Cooperative Group e sostenuto dall’Istituto Nazionale per la Salute del Bambino e lo Sviluppo Umano, il National Institute on Drug Abuse, il National Institute of Mental Health, e il National Institute of Neurologic Disorders and Stroke (contratti N01-HD02-3343, N01-MH9-0002, e N01-NS-9-2314, N01-NS-9-2315, N01-NS-9-2316, N01-NS-9-2317, N01-NS-9-2319, e N01-NS-9-2320). Un elenco dei siti partecipanti e un elenco completo dei ricercatori dello studio sono disponibili all’indirizzo https://www.bic.mni.mcgill.ca/nihpd_info/info2/participating_centers.html. Questo manoscritto riflette le opinioni degli autori e potrebbe non riflettere le opinioni o i punti di vista del NIH.

Figura 1.
A, Rappresentazione delle lesioni strutturali nello spazio nativo utilizzando un’immagine assiale T1-w. Le lesioni possono essere viste come aree ipo-intense e sono evidenziate con un cerchio rosso. Viene utilizzata la convenzione neurologica. B, DMN individuali per ogni paziente, ottenuti utilizzando ICA spaziale di gruppo sui dati dello stato di riposo (vedi Materiali e Metodi). I dati individuali sono in z-score(p <0,05, non corretto) e presentati sopra T1 di ogni paziente registrato in uno spazio comune (quattro anni modello di cervello MRI di quattro anni ottenuto dal database MRI Neurodevelopmental; vedi Materiali e Metodi). Questo è stato fatto come dimostrazione della qualità dei dati, dato che il propofol può ridurre la connettività in aree corticali di importanza per lo studio attuale(Boveroux et al., 2010). A destra, il DMN medio per tutti i pazienti è raffigurato, utilizzando i valori t(p < 0,01, non corretto) su un modello canonico di cervello di quattro anni di risonanza magnetica. CI modelli di probabilità per l’arcuata sinistra (segmento anteriore, posteriore e lungo) sono stati estratti dall’atlante del Tractotrone(Thiebaut de Schotten et al., 2011; Rojkova et al., 2016), sogliati all’80% (solo i voxel che secondo l’atlante hanno una probabilità dell’80% di far parte della FA sono mostrati) e registrati in uno spazio comune (il modello cerebrale di quattro anni di risonanza magnetica ottenuto dal database di risonanza magnetica per lo sviluppo neurologico). Per ogni paziente, qui vengono rappresentati l’atlante probabilistico arcuato (in rosso), la lesione (in blu) e la sovrapposizione tra di loro (in rosa) su una fetta sagittale dell’emisfero sinistro. Viene utilizzata la convenzione neurologica. L, emisfero sinistro.
Valutazione neuropsicologica
Test neuropsicologici standard
Le funzioni cognitive nei settori della memoria e dell’apprendimento, dell’elaborazione visuo-spaziale, delle capacità sensomotorie e del linguaggio sono state valutate utilizzando la batteria NEPSY-II con il sottotest specifico adatto a testare bambini dai tre ai quattro anni(Korkman et al., 2007, adattamento spagnolo). In particolare, abbiamo valutato: (1) funzioni linguistiche (test parziali: comprensione delle istruzioni; denominazione e identificazione delle parti del corpo; generazione di parole; elaborazione fonologica; e denominazione accelerata); (2) funzioni di memoria e di apprendimento (test parziali: memoria per i disegni; memoria narrativa; e ripetizione delle frasi); (3) elaborazione visuo-spaziale (test parziali: costruzione di blocchi; e copia dei disegni); e (4) elaborazione sensomotoria (test parziali: imitazione della posizione delle mani e precisione visuo-motoria). I punteggi grezzi di ogni subtest sono stati convertiti in valori scalari e confrontati con i valori normativi (media = 10, SD = 2).
Misure linguistiche
Il vocabolario ricettivo è stato valutato utilizzando il test del vocabolario per immagini Peabody (PPVT-III; Dunn et al., 1997, con norme spagnole) che offre un punteggio grezzo che può essere trasformato in un grado percentile, un QI verbale ricettivo (media = 100, SD = 15) e la corrispondente età evolutiva.
Lo sviluppo fonologico ha valutato la produzione fonologica di 32 parole comuni, per lo più disillabiche, coinvolgendo 15 diverse forme di parole e coprendo tutti i segmenti consonanti e le combinazioni di segmenti in spagnolo(Bosch, 2004). Questo strumento di valutazione utilizza immagini che favoriscono la produzione di enunciati piuttosto che la semplice denominazione. Dalla produzione spontanea dei bambini, la lunghezza media fonologica dell’enunciato (pMLU; cioè, la complessità fonologica basata sull’accuratezza nella produzione di consonanti, dittonghi e struttura sillabica complessa) e la prossimità fonologica di una parola intera alla corrispondente forma di parola adulta (cioè, la prossimità) sono stati ottenuti punteggi per la complessità e la vicinanza alle produzioni di destinazione, rispettivamente (Ingram, 2002). Il pMLU della lista di parole di questo strumento è 8.31. Questo è il valore ottenuto se tutte le parole target sono state prodotte correttamente, il punteggio di prossimità in questo caso (pMLU per bambini/ pMLU target) è 1. L’analisi dei dati originali di un campione(N = 50) di bambini di quattro anni di Bosch (2004), utilizzato come gruppo di riferimento, ha prodotto i seguenti valori: pMLU medio = 7,55 (SD = 0,55) e punteggio medio di prossimità = 0,91 (SD = 0,064).
La complessità espressiva del linguaggio è stata valutata a partire da registrazioni di enunciati spontanei prodotti in una situazione di conversazione/gioco semistrutturata utilizzando giocattoli e libri illustrati. Gli enunciati spontanei dei bambini sono stati trascritti in modo da ottenere i valori della MLU in parole e la MLU dei cinque enunciati più lunghi (max-L). Queste misure sono state poi confrontate con i valori di riferimento di un gruppo di controllo di età pari a N = 50 bambini di lingua spagnola a quattro anni(Vázquez e Alonso, 2007). La media MLU in parole per questo gruppo di riferimento è 3,91 (±1 SD: 4,45-3,37). Il valore medio del punteggio max-L è 10,56 (±1 SD: 12,47-8,65).
Analisi statistica
A livello individuale, i dati di ogni paziente sono stati confrontati con il livello di performance di un gruppo di controllo in base all’età. I confronti sono stati effettuati utilizzando il test t modificato, specificamente progettato per confrontare un individuo con un piccolo campione di partecipanti al controllo(Crawford et al., 2010).
A livello di gruppo, i test di Mann-Whitney per campioni indipendenti sono stati utilizzati per confrontare i punteggi comportamentali dei bambini con ictus con quelli di un gruppo di controllo quando presente (cioè, misure fonologiche di complessità e prossimità, pMLU, e complessità dell’enunciato nel discorso spontaneo, MLU e L-max).
Procedura di risonanza magnetica
Procedura di sedazione
Abbiamo seguito esattamente la stessa procedura di un precedente articolo(François et al., 2016). In particolare, per ridurre l’artefatto di movimento del partecipante durante l’esame di risonanza magnetica, i bambini sono stati precedentemente sedati come raccomandato nella neuroimmagine funzionale pediatrica(Souweidane et al., 1999; Kerssens et al., 2005; Lai et al., 2011; Bernal et al., 2012; DiFrancesco et al., 2013). I bambini sono stati valutati dall’anestesista e la restrizione dell’assunzione di cibo è stata controllata. In primo luogo, e con l’obiettivo di acquisire informazioni strutturali di risonanza magnetica (le sequenze di risonanza magnetica strutturale e DW-MRI richiedono un controllo preciso e attento dei movimenti della testa e del corpo del neonato), l’anestesia è stata indotta attraverso una maschera con sevoflurane, che è il metodo di routine utilizzato in François et al. (2016). Subito dopo questa procedura, la linea endovenosa è stata posizionata e i bambini sono stati passati ad un anestetico per via endovenosa con propofol. La dose iniziale di propofol è stata regolata per rendere i bambini immobili ma in grado di mantenere le vie aeree con una maschera laringea. Il dosaggio di propofol per induzione era di 2 mg / kg e dopo la perfusione, un dosaggio di 8-10 mg / kg / h è stato somministrato. Il dosaggio è stato ridotto a 6 mg/kg/h fino alla fine della procedura. Sia il sevoflurano che il propofol hanno effetti collaterali molto piccoli e sono farmaci usati abitualmente nella neuroimmagine pediatrica. La durata della sedazione con entrambi i farmaci è molto ridotta, consentendo tempi di recupero molto rapidi(Bernal et al., 2012). È importante sottolineare che abbiamo considerato la farmacocinetica del sevoflurano per garantire che i compiti funzionali fossero svolti esclusivamente in anestesia propofolica. Per questo motivo, abbiamo indotto una rapida transizione all’anestesia con il propofol dopo sevoflurane e, inoltre, abbiamo eseguito i primi 18 minuti della parte di imaging strutturale garantendo che il possibile effetto del sevoflurano nel successivo compito di fMRI fosse minimo. Infatti, la bassa solubilità del sevoflurano nel sangue induce una concentrazione alveolare in rapida diminuzione dopo la cessazione dell’agente inalato che è legata a tempi di recupero e di lavaggio molto rapidi(Yasuda et al., 1991; Bernal et al., 2012). Tuttavia, e dato che il propofol può ridurre la connettività in aree corticali significative per lo studio attuale(Boveroux et al., 2010), abbiamo ricostruito le reti fMRI standard a riposo (rs-fMRI) [cioè la rete in modalità predefinita (DMN)] utilizzando l’analisi indipendente dei componenti (ICA) come dimostrazione della qualità dei dati. I dati pre-processati dello stato di riposo di tutti i pazienti (vedi sotto fMRI pre-elaborazione e analisi statistica; i dati sono stati normalizzati in uno spazio modello di quattro anni fa) sono stati presentati al Group Spatial ICA, utilizzando il Group ICA di fMRI Toolbox (GIFT v4.0b; http://mialab.mrn.org/software/gift/; Calhoun et al., 2001a). Il valore medio per punto temporale è stato rimosso e i dati sono stati concatenati e ridotti a 10 componenti indipendenti utilizzando un’analisi a due fasi dei componenti principali e l’algoritmo infomax(Bell e Sejnowski, 1995). Infine, i dati sono stati scalati a z-score. Per ottenere statistiche di gruppo per l’intero cervello, la mappa spaziale di ciascuna delle componenti ICA (cioè le reti) recuperate per tutti i partecipanti è stata sottoposta ad un’analisi di secondo livello utilizzando un test di un campione t sotto SPM12, che tratta la mappa spaziale di ciascun soggetto come un effetto casuale (Calhounet al., 2001b). Il DMN è stato selezionato ispezionando visivamente i risultati di questo gruppo. Questo gruppo DMN insieme al DMN individuale di ogni paziente sono mostrati in Figura 1B.
Scansione MRI
I dati della risonanza magnetica sono stati raccolti su uno scanner a risonanza magnetica a corpo intero da 1,5 T in una posizione che sarà identificata in caso di pubblicazione dell’articolo (GE Signa HD). L’acquisizione di un’immagine strutturale T1-w ad alta risoluzione (sequenza di eco a gradiente di acquisizione rapida preparata per la magnetizzazione; TR = 12,396 ms, TE = 5,22 ms, spessore della fetta = 0,4297 mm, risoluzione 1-mm in piano, 180 fette, dimensione della matrice = 512 × 512) è stata seguita da una sequenza DW-MRI. DW-MRI scansioni sono state acquisite con una sequenza di immagini ecoplanari (EPI) (TR = 16500 ms, TE = 100 ms, 48 fette assiali, spessore della fetta 2,5 mm, FOV: 270, matrice di acquisizione: 100 × 100, matrice di ricostruzione: 256 × 256, dimensione voxel: 1,05 × 1,05 × 2,5 mm3). Una corsa con un volume ponderato non di diffusione (utilizzando una copertura di sequenza di spin-echo EPI di tutta la testa) e 29 volumi ponderati per diffusione (valore b di 1500 s/mm2) è stata acquisita. È stata anche raccolta un’immagine finale FLAIR (TR = 11002 ms, TE = 95 ms, spessore della fetta = 0,3711 mm, risoluzione in piano di 4,5 mm, 35 fette coronali, dimensione della matrice = 512 × 512). Dopo la raccolta dei dati strutturali, è stato condotto un compito di lingua fMRI. È stata acquisita una serie funzionale di 120 (6 min) immagini funzionali sensibili al contrasto BOLD [sequenza di eco a gradiente echoplanar T2* ponderata; TR = 3000 ms (come in Perani et al., 2010, 2011) TE = 60 ms, angolo di rotazione di 80°, matrice di acquisizione = 64 × 64, risoluzione in piano di 3,75 mm, spessore di 3,5 mm, nessun gap, 34 fette assiali allineate al piano che interseca le commissure anteriori e posteriori]. Inoltre, 100 volumi (5 min) di stato di riposo (non sono stati presentati stimoli durante l’acquisizione) sono stati raccolti utilizzando gli stessi parametri di acquisizione come per il compito di ascolto passivo.
DW-MRI dati per il gruppo di controllo facevano parte del rilascio esteso di diffusione tensor imaging 5.1 del NIH Pediatric MRI Data Repository (cinque controlli: Siemens, 10 volumi con b = 0 s/mm2 e 50 direzioni con un valore b di 1100 s/mm2, TR: 7900 ms, TE: 87 ms, 60 fette assiali, FOV: 240, matrice di acquisizione: 96 × 96, dimensione voxel: 2,5 × 2,5 × 2.5 mm3; un controllo con gli stessi parametri dei precedenti, ma con 7 b0s e 46 direzioni; un controllo con gli stessi parametri dei primi cinque controlli, ma con TR: 7800 ms e TE:85; un controllo con gli stessi parametri dei primi cinque controlli, ma con TR: 8700 ms e 66 fette assiali; un controllo, General Electric, Siemens, 2 volumi con b = 0 s/mm2 e 15 direzioni con un valore b di 1100 s/mm2, TR: 19580.5 ms, TE: 84,8 ms, 60 fette assiali, FOV: 240, matrice di acquisizione: 9 × 96, dimensione voxel: 1,88 × 1,88 × 2,5 mm3).
progettazione sperimentale fMRI
Per il compito linguistico abbiamo usato una narrazione spontanea di una breve storia per bambini(The Snowman di Raymond Briggs) registrata in un discorso diretto da una donna di madrelingua spagnola. Il racconto è stato diviso in dieci blocchi di 20 s, ogni blocco contenente brevi frasi che formano una sequenza di frasi di intonazione completa.
Come controllo acustico per il compito linguistico, abbiamo generato stimoli musicali composti da sequenze di toni discreti utilizzando la tecnica sviluppata in(Patel et al., 1998; vedi anche Liu et al., 2010) per convertire i modelli di intonazione degli enunciati parlati in analoghi tonali. Per ogni frase linguistica, è stata sintetizzata una sequenza di toni con la stessa tonalità e gli stessi schemi temporali delle sillabe della frase. Per prima cosa, per ogni sillaba sono stati generati degli analoghi di tono discreti per ogni sillaba in ogni frase usando un algoritmo specifico. Questo nuovo suono rappresentava la somma della frequenza fondamentale alla mediana F0 della sillaba originale [= (max F0 + min F0)/2] più le sue sette armoniche dispari (della stessa ampiezza e con fase sinusoidale) ed è stato campionato a 44,1 kHz. È importante notare che l’analogico di tono aveva la stessa durata della sillaba originale, per equiparare la durata della sillaba. Un cono di 8ms di inizio e di offset è stato successivamente applicato al tono per regolare il tempo di salita/discesa. Gli analoghi di tono di tutte le sillabe e in ogni frase sono stati combinati insieme, preservando le lacune silenziose come negli enunciati originali, per formare una sequenza di toni discreti. Usando questa tecnica, abbiamo fatto in modo che ogni frase del discorso avesse una corrispondenza musicale-frase paragonabile in parametri generali come la lunghezza, la velocità, così come in modelli di frequenza e tempi più a grana più fine.
Dieci blocchi di 20 s contenenti la storia originale (condizione della lingua) o il suo analogo musicale (condizione di controllo) sono stati presentati in ordine, con periodi di riposo di 15 s tra i blocchi dove non sono stati presentati stimoli (condizione di riposo). I periodi di riposo sono stati impostati a 15 s perché la risposta di BOLD nei bambini ritorna ai livelli di base più velocemente che negli adulti(Richter e Richter, 2003; Blasi et al., 2011).
fMRI preelaborazione e analisi statistica
I dati sono stati pre-processati utilizzando il software Statistical Parameter Mapping (SPM8, Wellcome Trust Center for Neuroimaging, University College, Londra, Regno Unito; www.fil.ion.ucl.ac.uk/spm/). Le immagini funzionali (compito linguistico e i dati rs-fMRI) sono state prima riallineate e poi co-registrate al corrispondente T1 utilizzando FLIRT di FSL (FMRIB’s Linear Image Registration Tool; Jenkinson et al., 2012). Come detto in precedenza, abbiamo usato un modello adatto all’età per registrare le immagini di risonanza magnetica dei bambini nello stesso spazio(Richards et al., 2016). In particolare, abbiamo utilizzato FNIRT di FSL (FMRIB’s Nonlinear Image Registration Tool; Jenkinson et al., 2012), per normalizzare la T1-w del nostro paziente e la sua maschera per lesioni corrispondente a un modello di risonanza magnetica cerebrale di quattro anni ottenuto dal Neurodevelopmental MRI Database(https://jerlab.sc.edu/projects/neurodevelopmental-mri-database/; Almli et al., 2007; Sanchez et al., 2012; Fillmore et al., 2015; Richards et al., 2016). Abbiamo prima registrato linearmente la T1-w degli individui e la mappa delle lesioni corrispondente al modello di quattro anni fa utilizzando FLIRT. Poi, abbiamo usato FNIRT per registrare in modo non lineare le immagini dei bambini T1 nel modello cerebrale specifico per età di cui sopra. Per tutti questi passaggi è stato utilizzato il mascheramento della funzione di costo(Brett et al., 2001; Andersen et al., 2010; Ripollés et al., 2012). I parametri di registrazione ottenuti durante questi calcoli sono stati applicati alle maschere di lesione, alla fMRI e ai dati rs-fMRI (precedentemente registrati al corrispondente T1) per normalizzarli allo spazio comune (il template di quattro anni fa). Infine, i dati fMRI e rs-fMRI sono stati levigati spazialmente con un kernel FWHM di 8 mm.
Infine, è stata eseguita un’analisi di gruppo fMRI. In primo luogo, è stata specificata una matrice di progettazione bloccata utilizzando la funzione di risposta emodinamica canonica. Sono state specificate tre diverse condizioni: lingua, controllo e riposo. I dati sono stati filtrati ad alta frequenza (fino ad un massimo di 1/128 Hz), e le autocorrelazioni seriali sono state stimate usando un modello autoregressivo [AR(1)]. Gli effetti di movimento rimanenti sono stati minimizzati includendo nel modello anche i parametri di movimento stimati. È stato calcolato un linguaggio > riposo e controllo > contrasto di riposo. Questi due contrasti sono stati inseriti in un modello di campioni accoppiati di secondo livello in cui il contrasto di controllo > linguaggio è stato calcolato per il gruppo di danno emisferico sinistro. Vengono riportati solo i cluster che sopravvivono ad una soglia non corretta di p < 0,001 a livello di voxel con una dimensione minima del cluster di cinque voxel.
Materia grigia (GM) e perdita di WM e localizzazione precisa della lesione
Per localizzare con precisione le aree interessate dalla lesione in ogni paziente, abbiamo utilizzato l’atlante cerebrale LONI LPBA40 adattato di quattro anni fa incluso nel database di risonanza magnetica per lo sviluppo neurologico(Shattuck et al., 2008; Richards et al., 2016) e le maschere per le lesioni che sono state registrate in questo spazio. Inoltre, per fornire una misura della perdita di GM e WM, abbiamo calcolato una stima della dimensione della lesione(Tillema et al., 2008) come segue. Abbiamo segmentato le immagini T1-w in GM e WM utilizzando i priori di segmentazione GM e WM di quattro anni inclusi nel Neurodevelopmental MRI Database(Richards et al., 2016) utilizzando la segmentazione unificata(Ashburner e Friston, 2005). Il cervelletto e il tronco encefalico sono stati poi mascherati utilizzando l’atlante manuale di quattro anni del database di risonanza magnetica per lo sviluppo neurologico(Fillmore et al., 2015; Richards et al., 2016). I rapporti tra il volume totale di GM e WM sia nell’emisfero destro che in quello sinistro sono stati calcolati e convertiti in una percentuale di perdita dell’emisfero cerebrale sinistro dovuta all’ictus (Tillema et al., 2008). Recenti evidenze mostrano che, sebbene ci siano differenze tra i volumi GM/WM sinistro e destro nei controlli sani, questi non dovrebbero superare l’1%(Carne et al., 2006).
Pre-elaborazione DW-MRI
L’elaborazione dei dati di diffusione è stata avviata correggendo le distorsioni da correnti parassite e il movimento della testa con il Diffusion Toolbox (FDT) di FMRIB, che fa parte della FMRIB Software Library (FSL 5.0.1, www.fmrib.ox.ac.uk/fsl/; Jenkinson et al., 2012). Successivamente, la matrice del gradiente è stata ruotata(Leemans e Jones 2009). In seguito, l’estrazione del cervello è stata eseguita utilizzando lo strumento di estrazione del cervello(Smith et al., 2006), che è anche parte della distribuzione FSL. L’analisi è proseguita con la ricostruzione dei tensori di diffusione utilizzando l’algoritmo lineare dei minimi quadrati incluso nel Diffusion Toolkit 0.6.2.2 (Ruopeng Wang, Van J. Wedeen, TrackVis.org/dtk, Martinos Center for Biomedical Imaging, Massachusetts General Hospital). Questa pipeline di analisi è stata scelta come nostro parametro di acquisizione e messa a punto con questa procedura(François et al., 2016).
Per il gruppo di controllo, abbiamo utilizzato direttamente i tensori forniti dal NIH Pediatric MRI Data Repository (già preprocessati utilizzando la pipeline standard TORTOISE; Pierpaoli et al., 2010). Abbiamo scelto di utilizzare i tensori già elaborati per utilizzare i dati con la migliore qualità fornita dal repository. Questi tensori sono stati trasformati in un formato compatibile con il Diffusion Toolkit utilizzando script interni (il codice è disponibile all’indirizzo https://github.com/pripolles/Diffusion-Tools/).
Sia per i dati del paziente che per quelli del controllo, la tractografia dell’intero cervello è stata eseguita utilizzando il Diffusion Toolkit 0.6.2.210 e l’algoritmo di ottimizzazione interpolata. La trattografia è stata avviata solo in voxel con un valore di anisotropia frazionaria (FA) >0,2 ed è stata fermata quando l’angolo tra due passi consecutivi era maggiore di 35°. Il tracciamento deterministico è stato eseguito con un approccio a due regioni di interesse (ROI) utilizzando il software TrackVis(www.trackvis.org; Ruopeng Wang, Van J. Wedeen, TrackVis.org, Martinos Center for Biomedical Imaging, Massachusetts General Hospital).
Tractografia deterministica
Data la natura del nostro dataset (individui pediatrici con lesioni) abbiamo deciso di utilizzare la tractografia deterministica manuale per sezionare i tratti di interesse, in quanto ci ha permesso di disegnare ROI specifici adattati a ciascun individuo. In altre parole, per ogni individuo e tratto abbiamo disegnato delle ROI specifiche per lo spazio nativo che tenevano conto della neuroanatomia di ogni partecipante.
Per ogni set di dati, i tre segmenti di AF sono stati definiti seguendo la procedura riportata da Catani et al. (2007) e utilizzata anche in López-Barroso et al. (2013), Tuomiranta et al. ( 2014) e François et al. ( 2016). Tutti i ROI sono stati definiti utilizzando come riferimento la mappa FA o RGB FA. Queste mappe FA e RGB-FA sono state generate da tensori di diffusione che sono stati ricostruiti utilizzando il metodo dei minimi quadrati lineari fornito nel Diffusion Toolkit. Il ROI per l’area frontale è stato posizionato nel piano coronale, tra la fessura centrale e la proiezione corticale del tratto. Il ROI per l’area temporale è stato posizionato nel piano assiale che comprende le fibre che scendono verso il lobo temporale posteriore attraverso la porzione posteriore dello stelo temporale. Il terzo ROI 2D è stato definito sul piano sagittale che comprende il giroscopio angolare e sovramarginale dell’IPL. Per sezionare virtualmente i tre segmenti di interesse, sono state applicate diverse combinazioni di due ROI. Le linee di flusso che attraversano le ROI frontali e temporali sono state classificate come il segmento lungo della FA, le linee di flusso che collegano le ROI temporali e parietali hanno costituito il segmento posteriore della FA, e le linee di flusso che attraversano le ROI frontali e parietali hanno costituito il segmento anteriore della FA. Questo processo è stato condotto sia per l’emisfero sinistro che per l’emisfero destro. Come controllo, abbiamo anche eseguito dissezioni virtuali in vivo di IFOF, ILF e UF. Queste dissezioni sono state eseguite per entrambi gli emisferi. Per ogni set di dati, abbiamo posizionato tre ROI sferici (come in Ripollés et al., 2017) a livello del lobo temporale anteriore (ROI temporale), la regione posteriore situata tra il lobo occipitale e il lobo temporale (ROI occipitale) e il piano anteriore della capsula esterna/estrema (ROI frontale). per definire ciascuno dei tratti di interesse abbiamo applicato, ancora una volta, un approccio a due ROI. L’ILF è stato ottenuto collegando il ROI temporale e quello occipitale. Le linee di flusso che passano attraverso il lobo occipitale e le ROI frontali sono state considerate come parte dell’IFOF. Il ROI della capsula frontale è stato unito al ROI temporale per delineare l’UF. Tutte queste ROI sono state applicate secondo i punti di riferimento anatomici definiti nel rapporto di ricerca di Catani e Thiebaut de Schotten (2008). Inoltre, l’esclusione di singole strutture di fibre che non rappresentano parte dei tratti sezionati è stata ottenuta utilizzando i no-ROI specifici del soggetto. Questa procedura è stata effettuata sia per i pazienti che per i controlli.
Data la posizione delle lesioni dei pazienti, abbiamo analizzato il volume della FA. Il volume è stato scelto in quanto recenti indagini hanno rivelato che questo parametro della FA è sensibile alle differenze individuali(Saygin et al., 2013; Ocklenburg et al., 2014; Sreedharan et al., 2015; Vaquero et al., 2017) e che è anche legato all’apprendimento delle parole(Assaneo et al., 2019). Abbiamo estratto il volume dalla somma dei tre segmenti di ogni emisfero per ottenere i valori di AF completamente a sinistra e AF completamente a destra. L’indice di lateralizzazione è stato calcolato [indice di lateralizzazione = (valori su R – valori su L)/(valori su R + valori su L)] ed è stato incluso nell’analisi per vedere se la riorganizzazione della WM destra ha una relazione con lo sviluppo del linguaggio. L’indice di lateralizzazione va da -1 a 1: i valori negativi rappresentano la lateralizzazione sinistra, i valori intorno alla distribuzione simmetrica zero e i valori positivi la lateralizzazione destra (López-Barrosoet al., 2013). Come controllo, abbiamo anche calcolato il LI per IFOF, ILF e UF utilizzando la stessa procedura. Abbiamo confrontato le LI per la FA, ILF, IFOF e UF tra i controlli e i pazienti utilizzando test non parametrici Wilcoxon Mann-Whitney. A causa del numero limitato di pazienti, sono state calcolate analisi statistiche Bayesiane di conferma per tutti questi tra i confronti di gruppo utilizzando JASP con il default(Rouder e Morey ,2012; Morey e Rouder, 2015; JASP Team, 2018). Abbiamo utilizzato i fattori di Bayes (BF10), che per il confronto in questione riflettono la differenza tra i dati probabili (ad esempio, un BF10 = 3 implica che una differenza tra i gruppi ha tre volte più probabilità di essere osservata nell’ipotesi alternativa).
Per esplorare il legame tra il volume della FA e gli aspetti produttivi del linguaggio, abbiamo eseguito quattro correlazioni non parametriche di Spearman tra il volume della FA completa e (1) le due misure di sviluppo fonologico (complessità fonologica e punteggi di prossimità) e (2) le due misure di complessità espressiva del linguaggio (MLU e L-max). Per correggere i confronti multipli, il tasso di falsificazione (FDR) è stato controllato a δ = 0,05 dove vengono eseguiti test multipli (Benjaminie Hochberg, 1995).
rs-fMRI analisi funzionale della connettività
I dati rs-fMRI sono stati analizzati seguendo la logica delle analisi tractografiche. I dati rs-fMRI già preprocessati sono stati analizzati utilizzando il toolbox funzionale di connettività (CONN) v17f(Whitfield-Gabrieli e Nieto-Castanon, 2012). Dopo la preelaborazione, le immagini sono state filtrate in banda passante a 0,008-0,09 Hz e denotate regredendo i sei parametri di movimento ottenuti durante il riallineamento e i segnali di materia bianca e del liquido cerebrospinale. Infine, i dati sono stati detratti. Dati i risultati della tractografia (vedi Risultati) che hanno evidenziato un coinvolgimento cruciale del fascicolo arcuato nelle funzioni del linguaggio nella popolazione di pazienti studiati, abbiamo eseguito un’analisi rs-fMRI che ha ulteriormente confermato questi risultati. A questo scopo, abbiamo selezionato le due regioni principali collegate dal fascicolo arcuato: il giro temporale superiore (STG) e il giro frontale inferiore (IFG; comprendente sia la parte opercularis che triangolare). Questi ROI sono stati estratti dall’atlante cerebrale LONI LPBA40 adattato di quattro anni, incluso nel database di risonanza magnetica per lo sviluppo neurologico(Shattuck et al., 2008; Richards et al., 2016). I dati per tutti i voxel all’interno di un ROI sono stati mediati e una correlazione per partecipante ed emisfero è stata calcolata tra la STG e l’IFG. Questi coefficienti di correlazione sono stati convertiti in valori z utilizzando la trasformazione r-to-z di Fisher. I valori z dell’emisfero destro per ciascuna delle quattro correlazioni sono stati sottratti dalle loro controparti dell’emisfero sinistro per ottenere un indice di lateralità rs-fMRI analogo a quello ottenuto per la tractografia (per un’analisi simile, vedere López-Barroso et al., 2013). Le associazioni tra questi indici di lateralità e (1) le due misure di sviluppo fonologico (complessità fonologica e punteggi di prossimità) e (2) le due misure di complessità espressiva del linguaggio (MLU e L-max) sono state poi esplorate utilizzando le correlazioni di Spearman. Per correggere i confronti multipli, il FDR è stato controllato a δ = 0,05 dove vengono eseguiti test multipli (Benjaminie Hochberg, 1995).
Risultati
Test neuropsicologici
Test del vocabolario delle immagini di Peabody
I punteggi ottenuti nel test di vocabolario di Peabody (PPVT-III, con norme spagnole) hanno fornito una stima del QI verbale che rientra nei limiti normali con tutti i bambini che hanno un QI verbale normale(Fig. 2A).
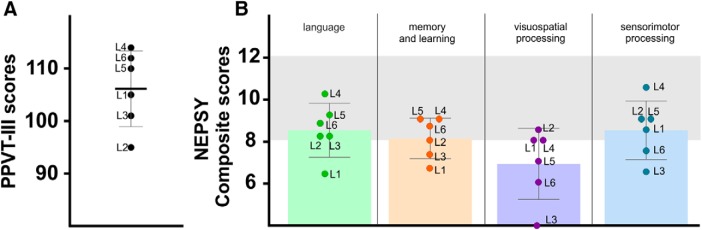
Figura 2.Risultati cognitivi. A, Risultati del test PPVT-III per ogni paziente. Le barre mostrano la media e la SD. B, Mezzi e SDs barplot dei punteggi compositi del NEPSY-II. Gli slot grigi indicano l’intervallo dei punteggi normativi (8-12).

Figura 2.Risultati cognitivi. A, Risultati del test PPVT-III per ogni paziente. Le barre mostrano la media e la SD. B, Le barre delle medie e delle SD dei punteggi compositi del NEPSY-II. Gli slot grigi indicano l’intervallo dei punteggi normativi (8-12).
NEPSY II
I punteggi ottenuti da alcuni test parziali selezionati del NEPSY-II sono stati analizzati separatamente per ogni test parziale. I punteggi compositi corrispondenti a quattro dei domini cognitivi specifici del NEPSY-II (cioè, lingua, memoria e apprendimento, elaborazione visuo-spaziale e sensorimotoria; vedi Materiali e Metodi) sono stati anche calcolati facendo la media dei punteggi scalari ottenuti nei sottotest di destinazione di ogni dominio. Come gruppo, i risultati hanno mostrato che i punteggi scalari medi rientrano nell’intervallo normale (cioè, 8-12, 27°-75° percentile) ad eccezione dell’elaborazione fonologica, della memoria narrativa, della costruzione dei blocchi, della copia del disegno e dei test di precisione visuo-motori che mostrano i punteggi medi leggermente al di sotto dei valori attesi (Fig. 3). Quando si considerano i punteggi compositi, il punteggio medio nel dominio della lingua, anche se relativamente basso, rientrava nel range normale. Valori simili sono stati ottenuti sia nel dominio della memoria e dell’apprendimento che in quello della sensorimotricità. Tuttavia, il punteggio medio composito nel dominio dell’elaborazione visuospaziale era chiaramente al di sotto del range normale con un valore medio <8, corrispondente ai valori dell’11°-25° percentile.
Sviluppo fonologico
Sono state ottenute due misure, la complessità fonologica (MLU fonologico, pMLU) e la prossimità fonologica di tutte le parole (punteggio di prossimità). Per prima cosa abbiamo confrontato la performance individuale con un gruppo di controllo in base all’età utilizzando il test t modificato, specificamente progettato per confrontare un paziente con un piccolo campione di partecipanti al controllo(Crawford et al., 2010). A livello individuale, solo un bambino (L1) ha presentato un punteggio di complessità significativamente più basso rispetto ai controlli(p = 0,002, test t modificato, a una coda). Questo paziente ha presentato un livello particolarmente basso di performance nella misura della prossimità fonologica(p < 0,001, test t modificato, a una coda; Tabella 2; Fig. 4A,B). A livello di gruppo, i test di Mann-Whitney che hanno confrontato i bambini con il PAIS con i controlli non hanno evidenziato differenze significative (p >0,05).
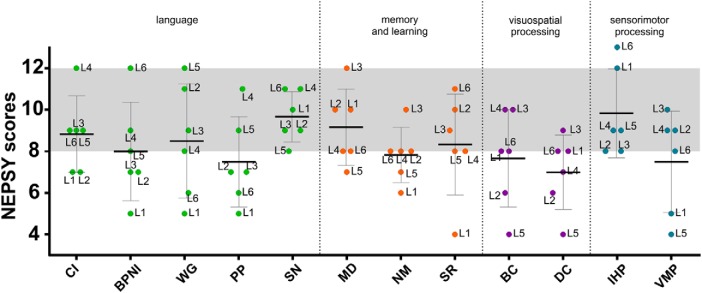
Figura 3.Mezzi e SD boxplot nei diversi sottotest del NEPSY-II (CI, comprensione delle istruzioni; BPNI, denominazione e identificazione delle parti del corpo; WG, generazione di parole; PP, elaborazione fonologica; SN, denominazione accelerata; MD, memoria per i disegni; NM, memoria narrativa; SR, ripetizione di frasi; BC, costruzione di blocchi; DC, copia di progetti; IHP, imitazione delle posizioni delle mani; VMP, precisione visuo-motoria) raggruppate in domini (verde, lingua; arancione, memoria e apprendimento; viola, elaborazione visuo-spaziale; blu, elaborazione sensorimotoria). La fessura grigia indica il range dei punteggi normativi (8-12).
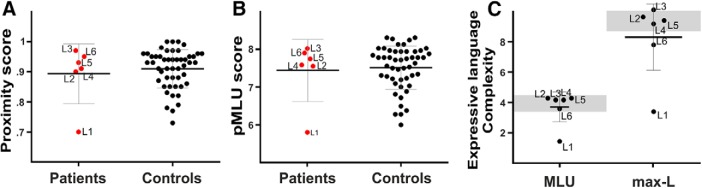
Figura 4.Misure linguistiche espressive. Boxplot di media e SD per bambini con PAIS e controlli, per i punteggi di prossimità e complessità. I grafici rappresentano i punteggi individuali per il punteggio di prossimità (A) per i punteggi pMLU (B) e dal gruppo di riferimento(N = 50), il valore medio del gruppo (in nero) e il punteggio di ogni paziente (in rosso). Il punteggio massimo per il punteggio pMLU (complessità della struttura segmentale delle parole (consonanti) è 8,31; il punteggio massimo per il punteggio di prossimità è 1. C, Complessità della complessità del discorso spontaneo con la MLU in parole e la MLU dei cinque enunciati più lunghi (max-L) per ogni paziente. Gli slot grigi indicano che i punteggi vanno da un gruppo di controllo di età pari a N = 50 bambini di lingua spagnola all’età di 4 anni(Vázquez e Alonso, 2007).
| Complessità fonologica | Prossimità fonologica | |
|---|---|---|
| L1 | 5.81* | 0.70* |
| L2 | 7.56 | 0.90 |
| L3 | 8.03 | 0.97 |
| L4 | 7.59 | 0.91 |
| L5 | 7.75 | 0.93 |
| L6 | 7.91 | 0.95 |
| Controlli | 7.44 (0.81) | 0.89 (0.09) |

Figura 3.Mezzi e SD boxplot nei diversi sottotest del NEPSY-II (CI, comprensione delle istruzioni; BPNI, denominazione e identificazione delle parti del corpo; WG, generazione di parole; PP, elaborazione fonologica; SN, denominazione accelerata; MD, memoria per i disegni; NM, memoria narrativa; SR, ripetizione di frasi; BC, costruzione di blocchi; DC, copia di progetti; IHP, imitazione delle posizioni delle mani; VMP, precisione visuo-motoria) raggruppate in domini (verde, lingua; arancione, memoria e apprendimento; viola, elaborazione visuo-spaziale; blu, elaborazione sensorimotoria). La fessura grigia indica il range dei punteggi normativi (8-12).

Figura 4.Misure linguistiche espressive. Boxplot di mezzi e SD per bambini con PAIS e controlli, per i punteggi di prossimità e complessità. I grafici rappresentano i punteggi individuali per il punteggio di prossimità (A) per i punteggi pMLU (B) e dal gruppo di riferimento(N = 50), il valore medio del gruppo (in nero) e il punteggio di ogni paziente (in rosso). Il punteggio massimo per il punteggio pMLU (complessità della struttura segmentale delle parole (consonanti) è 8,31; il punteggio massimo per il punteggio di prossimità è 1. C, Complessità della complessità del discorso spontaneo con la MLU in parole e la MLU dei cinque enunciati più lunghi (max-L) per ogni paziente. Gli slot grigi indicano che i punteggi vanno da un gruppo di controllo di età pari a N = 50 bambini di lingua spagnola all’età di 4 anni(Vázquez e Alonso, 2007).
Complessità dell’irriducibilità nel discorso spontaneo
Per esplorare il linguaggio produttivo con un focus specifico sulla complessità sintattica, abbiamo valutato la complessità espressiva del linguaggio dei bambini utilizzando la MLU in parole e la lunghezza media dei cinque enunciati più lunghi (max-L). A livello individuale, L1 ha presentato una performance particolarmente scarsa sia nei punteggi MLU che in quelli max-L(p < 0,001, test t modificato, a una coda; Tabella 3; Fig . 4C).
| MLU | L-max | |
|---|---|---|
| L1 | 1.74* | 4* |
| L2 | 4.2 | 9.4 |
| L3 | 4.1 | 9.8 |
| L4 | 4.1 | 9 |
| L5 | 4.2 | 9.2 |
| L6 | 3.6 | 7.8 |
| Controlli | 3.66 (0.96) | 8.2 (2.16) |
Risultati di neuroimaging
Posizione della lesione
Le lesioni hanno interessato diverse aree della lingua perisilviana sinistra (tra cui l’IFG, il giro temporale medio, la STG e il giro precentrale; Tabella 4; Fig. 1). L’analisi dell’entità delle lesioni riflessa dalla percentuale di perdita dell’emisfero cerebrale sinistro dovuta all’ictus ha rivelato che la perdita di volume di WM era superiore a quella di GM in quattro bambini su sei, suggerendo che le lesioni riguardavano principalmente il tessuto WM.
| % di perdita di GM | % di perdita di WM | ||||
|---|---|---|---|---|---|
| Codice paziente | Posizione della lesione | A sinistra | A destra | A sinistra | A destra |
| L1 | L giroscopio precentrale (39%)L giroscopio centrale (19%)L giroscopio postcentrale (16%)L giroscopio centrale (16%)L MFG (16%) | 0.37 | . | 2.5 | . |
| L2 | L SMG (56%)L AG (33%)L STG (10%) | 4.4 | . | 7.7 | . |
| L3 | L AG (40%)L NEBBIA (25%)L SMG (12%) | 7.8 | . | 10.3 | . |
| L4 | L giro post-centrale (53%)L giro precentrale L SMG (23%)L giro precentrale L (20%) | 4.3 | . | 0.8 | . |
| L5 | L AG (28%)L STG (26%)L SMG (19%)L MTG (8%) | 12.1 | . | 7.4 | . |
| L6 | L IFG (39%)L MFG (33%)L giro precentrale (24%) | 0.6 | . | 1.7 | . |
compito fMRI
Abbiamo ottenuto le attivazioni funzionali da tutti i bambini utilizzando un compito di narrazione passiva durante il quale una breve storia per bambini è stata presentata uditivamente in 20 blocchi lunghi (condizione linguistica). È stata presentata anche una condizione di controllo, che consisteva in un insieme di stimoli simili alla musica (vedi Materiali e Metodi); l’obiettivo di questo contrasto era quello di suscitare un’attività legata più specificamente alle caratteristiche linguistiche degli stimoli (soprattutto fonologiche e semantiche), piuttosto che a spunti uditivi prosodici o più di basso livello (come la durata o il volume) che erano simili per i due tipi di stimolo. Il contrasto tra il linguaggio e la condizione di controllo acustico ha prodotto un’attività significativa (ma non corretta) nel giro temporale medio destro e nell’IFG destro(p < 0,001 non corretto; Fig . 5). Non è stato osservato alcun modello di attività coerente nel contrasto inverso (condizione musicale contro il linguaggio). Si noti, tuttavia, che a causa della limitata N, questi risultati non sono corretti per i confronti multipli.
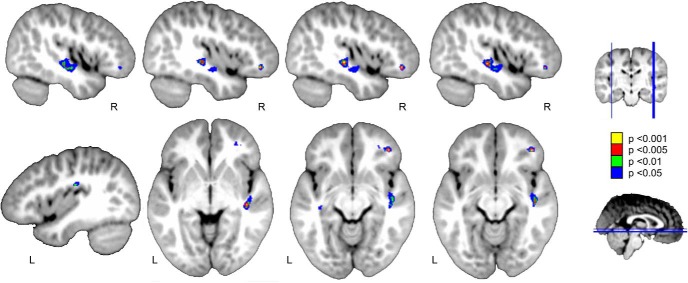
Figura 5.Figura 5. Attivazione della fMRI nell’attività di ascolto passivo per la lingua rispetto al contrasto di controllo nei pazienti. Due gruppi significativi con una maggiore attività di fMRI si trovano sopra il giroscopio frontale inferiore destro e il giroscopio temporale medio. I risultati codificati a colori sono mostrati in giallo e ad un p < 0,001, in rosso a p < 0,005, in verde a p < 0 , 01, e in blu a p < 0,05 soglia non corretta con cinque voxel di estensione del cluster, oltre il database MRI Neurodevelopmental modello di quattro anni da Richards et al . (2016). Viene utilizzata la convenzione neurologica.

Figura 5.Figura 5. Attivazione di fMRI nel compito di ascolto passivo per il linguaggio contro il contrasto di controllo nei pazienti. Due cluster significativi con una maggiore attività di fMRI si trovano sopra il giroscopio frontale inferiore destro e il giroscopio temporale medio. I risultati codificati a colori sono mostrati in giallo e ad un p < 0,001, in rosso a p < 0,005, in verde a p < 0 , 01, e in blu a p < 0,05 soglia non corretta con cinque voxel di estensione del cluster, oltre il database MRI Neurodevelopmental modello di quattro anni da Richards et al . (2016). Viene utilizzata la convenzione neurologica.
Tractografia deterministica
Le dissezioni deterministiche in vivo con l’approccio a due RROI hanno rivelato che per tutti i bambini con PAIS, i tre segmenti della FA erano ben conservati nell’emisfero destro. Nel frattempo, non siamo stati in grado di sezionare la FA sinistra nella maggior parte di essi (L4 e L6 presentavano solo il segmento posteriore, mentre L1 presentava il segmento posteriore e quello lungo ma non quello anteriore). Non abbiamo osservato alcun danno sostanziale alle vie ventrali WM (ILF, IFOF e UF) in entrambi gli emisferi (Fig. 6).
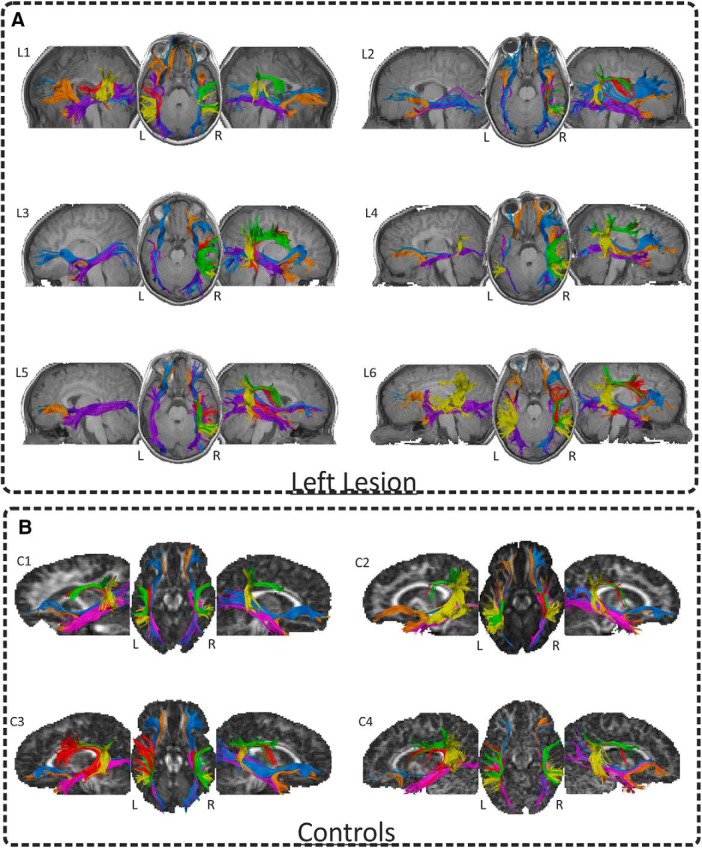
Figura 6.Tractografia deterministica. Le dissezioni DTI in vivo dei quattro tratti di interesse AF/ILF/UF/IFOF mostrati nello spazio nativo sulle immagini T1-w in ogni paziente (A) e quattro controlli (B). Viene utilizzata la convenzione neurologica. L’approccio two-ROI ha rivelato che per tutti i bambini con un PAIS sinistro (A), i tre segmenti della FA erano ben conservati nell’emisfero destro. Nel frattempo, non siamo stati in grado di sezionare la FA sinistra nella maggior parte di essi (L4 e L6 presentavano solo il segmento posteriore, mentre L1 presentava il segmento posteriore e quello lungo ma non quello anteriore). Non abbiamo osservato alcun danno sostanziale per le vie ventrali WM (ILF, IFOF e UF) in entrambi gli emisferi. Al contrario, i tre segmenti della FA sinistra erano sempre presenti nei bambini di controllo (B). Tuttavia, mentre i segmenti anteriore e posteriore della FA destra erano sempre presenti in questi bambini, non siamo stati in grado di ricostruire il segmento lungo della FA in tre controlli.
Le dissezioni deterministiche nel gruppo di controllo hanno rivelato che i tre segmenti della FA sinistra erano sempre presenti. Al contrario, mentre i segmenti anteriore e posteriore della FA destra erano sempre presenti, non siamo stati in grado di ricostruire il segmento lungo della FA in tre bambini di controllo. Fondamentalmente, confrontando l’indice di lateralità per il volume della FA completa nei pazienti e nei controlli, abbiamo scoperto che i pazienti presentavano una FA destra-laterale significativamente più destra rispetto ai controlli(U = 0; p < 0,001; BF10= 147,79). È importante notare che, confrontando il volume della FA destra e sinistra tra i pazienti e i controlli, abbiamo osservato un volume significativamente ridotto della FA sinistra nei pazienti(U = 5; p < 0,009; BF10= 36,95) e un volume maggiore della FA destra (U = 6; p < 0,013; BF10 = 6, 73) nei pazienti rispetto ai controlli. Inoltre, per escludere possibili differenze specifiche del gruppo a causa dei diversi parametri di scansione e delle procedure utilizzate tra i gruppi, abbiamo anche confrontato gli indici di lateralità di diversi tratti di controllo anche in relazione al linguaggio. Non abbiamo trovato differenze tra gli indici di lateralità dei pazienti e dei controlli per l’ILF(U = 18; p = 0,289; BF10 = 0,607), IFOF(U = 25, p = 0,814; BF10 = 0,473), o UF(U = 20; p = 0,409; BF10 = 0,574), il che dimostra ulteriormente che i nostri risultati erano specifici per la FA.

Figura 6.Tractografia deterministica. DTI dissezioni in vivo dei quattro tratti di interesse AF/ILF/UF/IFOF mostrati nello spazio nativo sulle immagini T1-w in ogni paziente (A) e quattro controlli (B). Viene utilizzata la convenzione neurologica. L’approccio two-ROI ha rivelato che per tutti i bambini con un PAIS sinistro (A), i tre segmenti della FA erano ben conservati nell’emisfero destro. Nel frattempo, non siamo stati in grado di sezionare la FA sinistra nella maggior parte di essi (L4 e L6 presentavano solo il segmento posteriore, mentre L1 presentava il segmento posteriore e quello lungo ma non quello anteriore). Non abbiamo osservato alcun danno sostanziale per le vie ventrali WM (ILF, IFOF e UF) in entrambi gli emisferi. Al contrario, i tre segmenti della FA sinistra erano sempre presenti nei bambini di controllo (B). Tuttavia, mentre i segmenti anteriore e posteriore della FA destra erano sempre presenti in questi bambini, non siamo stati in grado di ricostruire il segmento lungo della FA in tre controlli.
Relazioni cervello-comportamentali
Dato che la via dorsale era la più colpita nei pazienti (la lateralità dell’intera FA era significativamente più laterale a destra nei pazienti che nei controlli), abbiamo calcolato gli indici di lateralità sia per i dati strutturali dorsali che per quelli funzionali (vedi Materiali e Metodi). A causa del numero limitato di pazienti, sono state calcolate analisi statistiche bayesiane di conferma per tutte le correlazioni cerebrale-comportamentali con il software JASP utilizzando i priori di default e il modulo di correlazione bayesiana (utilizzando τ-b di Kendall; JASP Team, 2018; Morey e Rouder, 2015; Rouder e Morey , 2012). Abbiamo utilizzato i fattori di Bayes (BF10), che per il confronto in questione riflettono la probabile correlazione dei dati (ad esempio, un BF10 = 3 implica che una correlazione positiva ha tre volte più probabilità di essere osservata nell’ipotesi alternativa).
Abbiamo trovato una significativa correlazione positiva(rs[6] = 0,94; p < 0,0001, FDR-corretto per confronti multipli; BF10= 5,876) tra gli aspetti produttivi del linguaggio (come misurato dal max-L) e l’indice di lateralizzazione per il volume dell’AF completo (Fig.7A). Questo risultato indicava che quanto maggiore era la riorganizzazione sull’emisfero destro (cioè l’indice di lateralizzazione più alto del volume di AF), tanto migliori erano gli aspetti produttivi del linguaggio (valori max-L più alti).
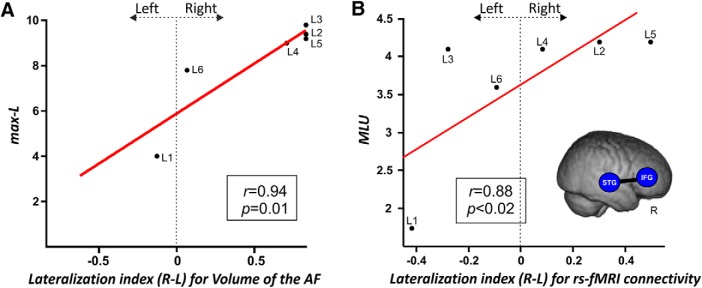
Figura 7.ALa correlazione tra le proprietà DTI estratte dalla ricostruzione manuale del fascicolo arcuato e gli aspetti produttivi del linguaggio. Viene mostrata la correlazione positiva tra l’indice di lateralizzazione per il volume dell’intera AF destra e la lunghezza massima di enunciazione (L-max). Indice di lateralizzazione: valori più vicini a -1 media lateralizzazione a sinistra, valori intorno a 0 rappresentano una distribuzione simmetrica, valori più vicini a 1 media lateralizzazione a destra. Questo risultato dimostra che quanto più la lateralizzazione a destra è l’integrità della FA, tanto migliori sono gli aspetti produttivi del linguaggio. BCorrelazione tra gli indici di lateralità rs-fMRI e gli aspetti produttivi del linguaggio. Lo scatterplot mostra la correlazione positiva di Spearman tra l’indice di lateralizzazione per l’indice di lateralità STG-IFG e l’MLU. Questo risultato dimostra che quanto più è lateralizzata a destra la connettività intrinseca tra le regioni collegate dall’AF, tanto migliori sono gli aspetti produttivi del linguaggio. Un rendering 3D del template di quattro anni fa viene visualizzato con i ROI utilizzati in questa analisi. Vengono visualizzati l’indice di correlazione e i valori p.
A seguito dei risultati della tractografia del comportamento cerebrale, le analisi rs-fMRI hanno mostrato che i valori di lateralità per la forza intrinseca di connettività tra la STG e l’IFG erano positivamente associati agli aspetti produttivi del linguaggio(rs[6] = 0,88; p < 0,02; BF10= 3,43) come misurato dall’MLU in discorso spontaneo; Fig. 7B), sebbene queste analisi non siano sopravvissute alla correzione FDR. Tuttavia, questa constatazione suggerisce che quanto maggiore è stata la riorganizzazione nell’emisfero destro (cioè, maggiore è la connettività funzionale intrinseca tra queste due regioni nell’emisfero destro), tanto migliori sono gli aspetti produttivi del linguaggio. Questo modello di risultati è sorprendentemente parallelo a quello trovato per la lateralizzazione della FA utilizzando la trattografia deterministica e fornisce prove convergenti che un maggiore impegno dell’emisfero destro era legato ad aspetti produttivi del linguaggio in questo gruppo di bambini.

Figura 7.A, Correlazione tra le proprietà DTI estratte dalla ricostruzione manuale del fascicolo arcuato bilateralmente e gli aspetti produttivi del linguaggio. Viene mostrata la correlazione positiva tra l’indice di lateralizzazione per il volume dell’intero AF destro e la lunghezza massima di enunciazione (L-max). Indice di lateralizzazione: valori più vicini a -1 media lateralizzazione a sinistra, valori intorno a 0 rappresentano una distribuzione simmetrica, valori più vicini a 1 media lateralizzazione a destra. Questo risultato dimostra che quanto più la lateralizzazione a destra è l’integrità della FA, tanto migliori sono gli aspetti produttivi del linguaggio. BCorrelazione tra gli indici di lateralità rs-fMRI e gli aspetti produttivi del linguaggio. Lo scatterplot mostra la correlazione positiva di Spearman tra l’indice di lateralizzazione per l’indice di lateralità STG-IFG e l’MLU. Questo risultato dimostra che quanto più è lateralizzata a destra la connettività intrinseca tra le regioni collegate dall’AF, tanto migliori sono gli aspetti produttivi del linguaggio. Un rendering 3D del template di quattro anni fa viene visualizzato con i ROI utilizzati in questa analisi. Vengono visualizzati l’indice di correlazione e i valori p.
Discussione
Nel presente studio, le misure di connettività strutturale hanno indicato un’associazione tra la giusta riorganizzazione del percorso dorsale e le misure di sviluppo espressivo del linguaggio: gli indici di lateralità strutturale del percorso dorsale destro hanno previsto gli esiti della produzione linguistica. Fondamentalmente, gli indici di lateralità strutturale della fibrillazione atriale sono stati significativamente più lateralizzati a destra nei bambini con PAIS sinistra che in un gruppo di controlli abbinati, mentre non sono state osservate differenze per l’UF, l’ILF, o l’IFOF.
Sebbene tutti i bambini avessero normali livelli di vocabolario ricettivo e di QI verbale, hanno presentato risultati di produzione e di elaborazione del linguaggio leggermente bassi come gruppo. La migliore misura della complessità dell’enunciato nel discorso spontaneo (L-max) ha mostrato che la metà dei bambini presentava uno sviluppo sintattico limitato rispetto ai controlli. I risultati individuali dei test linguistici NEPSY-II hanno mostrato che la maggior parte dei bambini erano al di sotto dei punteggi normativi, ad eccezione del test di denominazione accelerato. Oltre a questo, la maggior parte di loro ha avuto punteggi inferiori ai punteggi normativi nei sottotest di elaborazione visuospaziale. Quest’ultimo risultato è in linea con due studi che riportano un’elaborazione visuospaziale alterata indotta da lesioni sinistre(Lidzba et al., 2006a,b). Presi insieme, i dati possono indicare che la riorganizzazione della rete linguistica verso l’emisfero destro può, a sua volta, compromettere le funzioni originariamente supportate dall’emisfero destro, fornendo così un supporto al cosiddetto “effetto crowding” indotto dall’ictus precoce (Satz etal., 1994).
I risultati della fMRI, sebbene non corretti per confronti multipli, hanno rivelato due cluster di attivazione solo sull’emisfero controlesionale, uno nel giro temporale medio destro e l’altro nell’IFG destro. L’elaborazione prosodica e vocale ha recentemente dimostrato di coinvolgere un’organizzazione a doppio flusso di elaborazione con un percorso dorsale e ventrale che collega la STG posteriore destra all’IFG destra e alla corteccia premotoria(Pernet et al., 2015; Sammler et al., 2015; Zäske et al., 2017). Qui, abbiamo usato stimoli di controllo a grana fine in modo tale che ogni frase del discorso dalla condizione di linguaggio avesse una corrispondenza musicale-frase con caratteristiche prosodiche e acustiche simili nella condizione di controllo. Pertanto, questi due gruppi non sono in grado di riflettere l’elaborazione prosodica. Studi precedenti in giovani adulti sani hanno riportato in gran parte attivazioni su queste regioni durante l’elaborazione sintattica e semantica attiva, ma con una chiara lateralizzazione a sinistra(Binder e Desai, 2011). Qui, coerentemente con i precedenti rapporti sulla comprensione del linguaggio nei bambini e negli adulti conictus (Jacola et al., 2006; François et al., 2016; Lidzba et al., 2017a,b), non è stata osservata alcuna attivazione sull’emisfero sinistro. Anche se questi risultati devono essere presi con cautela (a causa della piccola N, la presenza di anestesia, i dati della fMRI non sono stati corretti per confronti multipli), i nostri risultati possono suggerire che sia l’elaborazione delle caratteristiche acustiche del segnale vocale, sia l’elaborazione sintattica di alto ordine, stavano avvenendo nel nostro gruppo di bambini.
Criticamente, sia rs-fMRI che soprattutto i dati DW-MRI hanno fornito prove convergenti che dimostrano che l’emisfero destro può assumere funzioni linguistiche. Il successo del recupero dopo un ictus precoce può essere associato sia ai meccanismi di plasticità perilesionale intraemisferica che a quelli di plasticità controlesionale interemisferica(Raja-Beharelle et al., 2010; Dick et al., 2013). Tuttavia, è importante tenere presente che diversi meccanismi fisiologici di recupero possono essere innescati dopo un ictus ischemico arterioso o lesioni cerebrali periventricolari che possono, a loro volta, spiegare in parte i diversi modelli di risultati riportati qui e nello studio di Raja-Beharelle et al. (2010). Qui, abbiamo trovato che rispetto ai controlli sani, i pazienti presentavano un volume più piccolo della FA sinistra insieme a un volume più grande del suo omologo destro. Queste differenze sono state trasferite all’indice di lateralità della FA: il volume dell’arcuato era più destro-laterale nei pazienti che nei controlli. È interessante notare che abbiamo trovato una chiara associazione positiva tra il volume della FA destra e una misura della produzione linguistica. Inoltre, abbiamo trovato un’associazione tra l’indice di lateralità della forza di connettività intrinseca tra le regioni perisilviche della via dorsale e la MLU (anche se questo risultato non è stato corretto per i confronti multipli). Presi nel loro insieme, questi risultati indicano che la riorganizzazione della rete linguistica sull’emisfero destro può essere realizzata attraverso l’iperconnettività strutturale e funzionale tra le aree temporali e frontali destre. Una maggiore densità di GM nelle regioni temporoparietali destra è stata associata ad una rete linguistica destra-lateralizzata in un ampio gruppo di bambini con epilessia focale lesionale lato sinistro resistente ai farmaci(Pahs et al., 2013). Gli autori hanno suggerito che la dimensione del planum temporale non colpito può presentare una “capacità di riserva” per la riorganizzazione del linguaggio interemisferico in presenza di lesioni all’interno delle regioni perisilvane sinistre. Ulteriori prove dell’importante ruolo della plasticità della corteccia temporale destra nel recupero delle funzioni del linguaggio sono state fornite da studi condotti su sopravvissuti all’ictus dell’emisfero sinistro con afasia(Forkel et al., 2014; Xing et al., 2016; Hope et al., 2017; Lukic et al., 2017; Piai et al., 2017). Uno studio molto recente di Northam et al. (2018) fornisce un maggiore supporto a questa ipotesi, mostrando che la riorganizzazione del cervello verso l’emisfero destro può compensare i deficit di produzione spesso osservati nei bambini con PAIS sinistra. Inoltre, esistono prove recenti nei ratti e negli esseri umani che dimostrano che le lesioni precoci nel sistema motorio possono indurre la germinazione assonale controlaterale(Liu et al., 2008; Schaechter et al., 2009). Si ipotizza che la disconnessione precoce della via dorsale sinistra può indurre la degenerazione dei neuroni che proiettano dalle aree temporali a quelle frontali, mentre innesca la germinazione assonale controlaterale sull’emisfero destro. Questo meccanismo di riorganizzazione controlaterale può, a sua volta, promuovere controlaterale aumentato cambiamenti di plasticità GM GM cambiamenti riflessi da iperconnettività strutturale e funzionale.
I presenti risultati forniscono importanti risultati che consentono di perfezionare un recente modello che descrive l’emergere di funzioni linguistiche sempre più complesse attraverso lo sviluppo(Catani e Bambini, 2014). Sulla base dei precedenti modelli neuroanatomici di elaborazione del linguaggio(Friederici 2011, 2012; Catani et al., 2005; Hickok e Poeppel, 2007; Rauschecker e Scott, 2009), questo modello collega l’evoluzione graduale delle funzioni linguistiche ai cambiamenti neuroanatomici che si verificano durante lo sviluppo iniziale con un ruolo specifico dei segmenti posteriori e lunghi della FA, necessari per il normale sviluppo del linguaggio e soprattutto nell’apprendimento delle parole, nell’elaborazione sintattica e nella memoria di lavoro verbale(Lebel e Beaulieu, 2009; López-Barroso et al., 2013; Catani e Bambini, 2014; Budisavljevic et al., 2015). Tuttavia, questi modelli sono rimasti elusivi sul ruolo dei percorsi dorsali e ventrali di destra. Le stecche prosodiche sono preferibilmente elaborate dall’emisfero destro(Zatorre e Belin, 2001; Giraud et al., 2007; Perani et al., 2010) e sono importanti per l’acquisizione del linguaggio in quanto possono aiutare ad avviare i processi di apprendimento del linguaggio(Shukla et al., 2011; Gervain e Werker 2013; De Diego-Balaguer et al., 2015; Filippi et al., 2017; François et al., 2017). È stato anche rivelato che le regioni cerebrali temporoparietali presentano una maturazione più lenta rispetto alle regioni frontali nei neonati sani(Leroy et al., 2011). Questa lenta maturazione corticale è parallela alla lenta maturazione e all’elevata sensibilità ai fattori ambientali del segmento posteriore destro della FA(Budisavljevic et al., 2015). I nostri risultati, presi insieme alle prove precedenti sul ruolo delle vie dorsali e ventrali destre per l’elaborazione del linguaggio, suggeriscono che l’emisfero destro può anche giocare un ruolo importante nello sviluppo dei bambini e nell’elaborazione del linguaggio dopo l’ictus. Inoltre, anche se ancora in fase di discussione, i dati recenti di bambini con lesioni cerebrali acquisite precocemente mostrano che la finestra temporale per il reclutamento compensativo delle regioni corticali destre omologhe dopo l’ictus sinistro può già chiudersi all’età di cinque anni(Lidzba et al., 2017a). Analogamente a quanto osservato negli adulti con afasia(Forkel et al., 2014; Hartwigsen e Saur, 2019), le regioni temporoparietali destre e il segmento posteriore della FA destra possono essere fondamentali per compensare l’effetto devastante dell’ictus. Pertanto, il maggiore coinvolgimento della via dorsale destra dopo l’ictus precoce può indurre cambiamenti funzionali e strutturali all’interno di una rete linguistica più flessibile rispetto alle lesioni acquisite in una rete funzionale altamente specializzata durante l’età adulta(Levine et al., 2016). La ricerca futura è necessaria per specificare il ruolo delle predisposizioni genetiche che contribuiscono alla specializzazione dell’emisfero sinistro rispetto ai meccanismi neuroplastici che si verificano nell’emisfero destro a fronte di lesioni precoci del sinistro.
Il presente studio presenta alcuni limiti. La dimensione del campione è piccola, il che è un problema intrinseco e ricorrente nello studio di rare condizioni neonatali. Questa limitazione è particolarmente evidente per i risultati della fMRI che non sono stati corretti per i confronti multipli. Inoltre, il compito fMRI qui utilizzato è nuovo in questo tipo di popolazione e i risultati di un gruppo di controllo di bambini sani e/o un gruppo di adulti senza sedazione è necessario per interpretare ulteriormente i nostri dati fMRI in termini di riorganizzazione funzionale. La presenza di degenerazione o necrosi può alterare la microstruttura del tessuto perilesionale, portando a problemi nella stima degli orientamenti delle fibre, soprattutto nelle aree con presenza di fibre incrociate, che possono, a loro volta, indurre artefatti nelle ricostruzioni delle piste(Ciccarelli et al., 2006; Schonberg et al., 2006; Møller et al., 2007; Dell’ Acqua, et al., 2010). L’uso dell’anestesia leggera per evitare movimenti durante l’acquisizione della risonanza magnetica può aver influenzato le attivazioni funzionali in quanto il tasso di fallimento può arrivare al 21% con il propofol e un compito uditivo(Bernal et al., 2012; si noti, tuttavia, che siamo stati in grado di ricostruire le reti ICA canoniche per ogni paziente; Fig. 1B). I dati DWI del database NIH sono stati acquisiti con diversi parametri di scansione che possono influire sul confronto con i dati ottenuti nei pazienti del nostro gruppo. Tuttavia, riteniamo improbabile che questa confusione possa influenzare i nostri risultati, in quanto le differenze osservate erano specifiche per la FA e non per i tratti ventrali che abbiamo usato come controllo. Inoltre, il nostro campione è stato studiato a circa quattro anni di età e quindi non è ancora completamente sviluppato (né in termini di abilità linguistiche né in termini di struttura/funzione cerebrale). Altri deficit linguistici potrebbero apparire in fasi successive e i deficit qui mostrati potrebbero anche essere risolti in base all’età scolare. Inoltre, questo gruppo di bambini si stava sviluppando in un ambiente bilingue (cinque su sei). Il tipo di input linguistico ricevuto durante i primi anni, come la presenza di gesti di co-speech o l’uso del discorso decontestualizzato, ha dimostrato di avere un ruolo importante nello sviluppo delle funzioni linguistiche dopo l’ictus neonatale, in particolare per coloro che mostrano ritardi linguistici iniziali(Rowe et al., 2009; Demir et al., 2014, 2015). Ciò potrebbe essere particolarmente vero per i due pazienti (L2 e L6) che non stavano ricevendo la logopedia, poiché studi precedenti hanno dimostrato che interventi come la terapia basata sulla musica possono indurre una riorganizzazione funzionale e strutturale nei bambini(Zipse et al., 2012). Tuttavia, allo stato attuale, l’impatto specifico sull’esperienza bilingue nei bambini con PAIS rimane piuttosto inesplorato. Nel complesso, questi dati suggeriscono che il “recupero” delle funzioni linguistiche precedentemente riportate una volta che i bambini raggiungono la scuola elementare (Bates,1997) può già verificarsi nei bambini in età prescolare a quattro anni di età, probabilmente a causa dell’apporto linguistico arricchito fornito dai genitori (Demir etal., 2014, 2015), dai caregiver e dai programmi di stimolazione del linguaggio precoce.
In sintesi, riportiamo le prime ricostruzioni 3D dei percorsi del linguaggio dorsale e ventrale insieme a valutazioni a grana fine delle funzioni cognitive e linguistiche in un gruppo omogeneo di bambini di quattro anni che avevano una PAIS sinistra. Forniamo la prova di un’associazione tra i modelli di riorganizzazione strutturale e funzionale (anche se in misura minore) del cervello verso l’emisfero destro e la produzione del linguaggio nei bambini in età prescolare con lesioni congenite. Si ipotizza che la plasticità interemisferica attraverso meccanismi di iperconnettività strutturale e funzionale potrebbe essere cruciale per i risultati positivi a seguito di lesioni precoci.
References
- The NIH MRI study of normal brain development (objective-2): newborns, infants, toddlers, and preschoolers. Neuroimage. 2007; 35:308-325. DOI | PubMed
- Cost function masking during normalization of brains with focal lesions: still a necessity?. Neuroimage. 2010; 53:78-84. DOI | PubMed
- Unified segmentation. Neuroimage. 2005; 26:839-851. DOI | PubMed
- Spontaneous synchronization to speech reveals neural mechanisms facilitating language learning. Nat Neurosci. 2019; 22:627-632. DOI | PubMed
- Transport for language south of the Sylvian fissure: the routes and history of the main tracts and stations in the ventral language network. Cortex. 2015; 69:141-151. DOI | PubMed
- Plasticity in the developing brain: intellectual, language and academic functions in children with ischaemic perinatal stroke. Brain. 2008; 131:2975-2985. DOI | PubMed
- Origins of language disorders: a comparative approach. Dev Neuropsychol. 1997; 13:447-476. DOI
- Differential effects of unilateral lesions on language production in children and adults. Brain Lang. 2001; 79:223-265. DOI | PubMed
- An information-maximization approach to blind separation and blind deconvolution. Neural Comput. 1995; 7:1129-1159. PubMed
- Controlling the false discovery rate: a practical and powerful approach to multiple testing. J R Stat Soc Series B Methodol. 1995;289-300. DOI
- FMRI under sedation: what is the best choice in children?. J Clin Med Res. 2012; 4:363-370. DOI | PubMed
- The neurobiology of semantic memory. Trends Cogn Sci. 2011; 15:527-536. DOI | PubMed
- Early specialization for voice and emotion processing in the infant brain. Curr Biol. 2011; 21:1220-1224. DOI | PubMed
- Evaluación fonológica del habla infantil. Masson: Barcelona; 2004.
- Breakdown of within- and between-network resting state functional magnetic resonance imaging connectivity during propofol-induced loss of consciousness. Anesthesiology. 2010; 113:1038-1053. DOI | PubMed
- Dorsal and ventral pathways in language development. Brain Lang. 2013; 127:289-295. DOI | PubMed
- Spatial normalization of brain images with focal lesions using cost function masking. Neuroimage. 2001; 14:486-500. DOI | PubMed
- Developmental changes in human cerebral functional organization for word generation. Cereb Cortex. 2005; 15:275-290. DOI | PubMed
- Age-related differences and heritability of the perisylvian language networks. J Neurosci. 2015; 35:12625-12634. DOI | PubMed
- fMRI activation in a visual-perception task: network of areas detected using the general linear model and independent components analysis. Neuroimage. 2001a; 14:1080-1088. DOI | PubMed
- A method for making group inferences from functional MRI data using independent component analysis. Hum Brain Mapp. 2001b; 14:140-151. DOI | PubMed
- A model for social communication and language evolution and development (SCALED). Curr Opin Neurobiol. 2014; 28:165-171. DOI | PubMed
- Cerebral cortex: an MRI-based study of volume and variance with age and sex. J Clin Neurosci. 2006; 13:60-72. DOI | PubMed
- Occipito-temporal connections in the human brain. Brain. 2003; 126:2093-2107. DOI | PubMed
- Perisylvian language networks of the human brain. Ann Neurol. 2005; 57:8-16. DOI | PubMed
- Symmetries in human brain language pathways correlate with verbal recall. Proc Natl Acad Sci USA. 2007; 104:17163-17168. DOI | PubMed
- A diffusion tensor imaging tractography atlas for virtual in vivo dissections. Cortex. 2008; 44:1105-1132. DOI | PubMed
- Probabilistic diffusion tractography: a potential tool to assess the rate of disease progression in amyotrophic lateral sclerosis. Brain. 2006; 129:1859-1871. DOI | PubMed
- Point and interval estimates of effect sizes for the case-controls design in neuropsychology: rationale, methods, implementations, and proposed reporting standards. Cogn Neuropsychol. 2010; 27:245-260. DOI | PubMed
- Prosodic cues enhance rule learning by changing speech segmentation mechanisms. Front Psychol. 2015; 6:1478. DOI | PubMed
- The infancy of the human brain. Neuron. 2015; 88:93-109. DOI | PubMed
- Functional neuroimaging of speech perception in infants. Science. 2002; 298:2013-2015. DOI | PubMed
- Functional organization of perisylvian activation during presentation of sentences in preverbal infants. Proc Natl Acad Sci USA. 2006; 103:14240-14245. DOI | PubMed
- A modified damped Richardson-Lucy algorithm to reduce isotropic background effects in spherical deconvolution. Neuroimage. 2010; 49:1446-1458. DOI | PubMed
- Narrative processing in typically developing children and children with early unilateral brain injury: seeing gesture matters. Dev Psychol. 2014; 50:815-828. DOI | PubMed
- Vocabulary, syntax, and narrative development in typically developing children and children with early unilateral brain injury: early parental talk about the “there-and-then” matters. Dev Psychol. 2015; 51:161-175. DOI | PubMed
- Inter-hemispheric functional connectivity following prenatal or perinatal brain injury predicts receptive language outcome. J Neurosci. 2013; 33:5612-5625. DOI | PubMed
- BOLD fMRI in infants under sedation: comparing the impact of pentobarbital and propofol on auditory and language activation. J Magn Reson Imaging. 2013; 38:1184-1195. DOI | PubMed
- .
- Utterance-final position and pitch marking aid word learning in school-age children. R Soc Open Sci. 2017; 4:161035. DOI | PubMed
- Stereotaxic magnetic resonance imaging brain atlases for infants from 3 to 12 months. Dev Neurosci. 2015; 37:515-532. DOI | PubMed
- Anatomical predictors of aphasia recovery: a tractography study of bilateral perisylvian language networks. Brain. 2014; 137:2027-2039. DOI | PubMed
- Language learning and brain reorganization in a 3.5-year-old child with left perinatal stroke revealed using structural and functional connectivity. Cortex. 2016; 77:95-118. DOI | PubMed
- Enhanced neonatal brain responses to sung streams predict vocabulary outcomes by age 18 months. Sci Rep. 2017; 7:12451. DOI | PubMed
- Pathways to language: fiber tracts in the human brain. Trends Cogn Sci. 2009; 13:175-181. DOI | PubMed
- The brain basis of language processing: from structure to function. Physiol Rev. 2011; 91:1357-1392. DOI | PubMed
- Language development and the ontogeny of the dorsal pathway. Front Evol Neurosci. 2012; 4:3. DOI | PubMed
- Prosody cues word order in 7-month-old bilingual infants. Nat Commun. 2013; 4:1490. DOI | PubMed
- Endogenous cortical rhythms determine cerebral specialization for speech perception and production. Neuron. 2007; 56:1127-1134. DOI | PubMed
- Neuroimaging of stroke recovery from aphasia – Insights into plasticity of the human language network. Neuroimage. 2019; 190:14-31. DOI | PubMed
- The cortical organization of speech processing. Nat Rev Neurosci. 2007; 8:393-402. DOI | PubMed
- Right hemisphere structural adaptation and changing language skills years after left hemisphere stroke. Brain. 2017; 140:1718-1728. DOI | PubMed
- The measurement of whole-word productions. J Child Lang. 2002; 29:713-733. PubMed
- Functional magnetic resonance imaging reveals atypical language organization in children following perinatal left middle cerebral artery stroke. Neuropediatrics. 2006; 37:46-52. DOI | PubMed
- .
- FSL. Neuroimage. 2012; 62:782-790. DOI | PubMed
- Attenuated brain response to auditory word stimulation with sevoflurane: a functional magnetic resonance imaging study in humans. Anesthesiology. 2005; 103:11-19. DOI | PubMed
- NEPSY-II. Pearson: San Antonio, TX; 2007.
- Speech stimulation during functional MR imaging as a potential indicator of autism. Radiology. 2011; 260:521-530. DOI | PubMed
- Lateralization of the arcuate fasciculus from childhood to adulthood and its relation to cognitive abilities in children. Hum Brain Mapp. 2009; 30:3563-3573. DOI | PubMed
- The B-matrix must be rotated when correcting for subject motion in DTI data. Magn Reson Med. 2009; 61:1336-1349. DOI | PubMed
- Early maturation of the linguistic dorsal pathway in human infants. J Neurosci. 2011; 31:1500-1506. DOI | PubMed
- The neurobiology of language. Academic Press: London; 2016.
- The motor theory of speech perception revised. Cognition. 1985; 21:1-36. PubMed
- Lesion-induced right-hemispheric language and organization of nonverbal functions. Neuroreport. 2006a; 17:929-933. DOI | PubMed
- Visuospatial deficits in patients with early left-hemispheric lesions and functional reorganization of language: consequence of lesion or reorganization?. Neuropsychologia. 2006b; 44:1088-1094. DOI | PubMed
- The time window for successful right-hemispheric language reorganization in children. Eur J Paediatr Neurol. 2017a; 21:715-721. DOI | PubMed
- Lesion characteristics driving right-hemispheric language reorganization in congenital left-hemispheric brain damage. Brain Lang. 2017b; 173:1-9. DOI | PubMed
- Contralesional axonal remodeling of the corticospinal system in adult rats after stroke and bone marrow stromal cell treatment. Stroke. 2008; 39:2571-2577. DOI | PubMed
- Intonation processing in congenital amusia: discrimination, identification and imitation. Brain. 2010; 133:1682-1693. DOI | PubMed
- Word learning is mediated by the left arcuate fasciculus. Proc Natl Acad Sci USA. 2013; 110:13168-13173. DOI | PubMed
- Right hemisphere grey matter volume and language functions in stroke aphasia. Neural Plast. 2017; 2017:5601509. DOI | PubMed
- Sentence processing and verbal working memory in a white-matter-disconnection patient. Neuropsychologia. 2014; 61:190-196. DOI | PubMed
- Dynamic changes in cortico spinal tracts after stroke detected by fibre tracking. J Neurol Neurosurg Psychiatry. 2007; 78:587-592. DOI | PubMed
- .
- Stroke in newborn infants. Lancet Neurol. 2004; 3:150-158. DOI | PubMed
- Developmental conduction aphasia after neonatal stroke. Ann Neurol. 2018; 83:664-675. DOI | PubMed
- From structure to function in the lateralized brain: how structural properties of the arcuate and uncinate fasciculus are associated with dichotic listening performance. Neurosci Lett. 2014; 580:32-36. DOI | PubMed
- Asymmetry of planum temporale constrains interhemispheric language plasticity in children with focal epilepsy. Brain. 2013; 136:3163-3175. DOI | PubMed
- Right hemisphere structures predict poststroke speech fluency. Neurology. 2016; 86:1574-1581. DOI | PubMed
- Processing prosodic and musical patterns: a neuropsychological investigation. Brain Lang. 1998; 61:123-144. DOI | PubMed
- Functional specializations for music processing in the human newborn brain. Proc Natl Acad Sci USA. 2010; 107:4758-4763. DOI | PubMed
- Neural language networks at birth. Proc Natl Acad Sci USA. 2011; 108:16056-16061. DOI | PubMed
- The human voice areas: spatial organization and inter-individual variability in temporal and extra-temporal cortices. Neuroimage. 2015; 119:164-174. DOI | PubMed
- Neuroplasticity of language in left‐hemisphere stroke: evidence linking subsecond electrophysiology and structural connections. Hum Brain Mapp. 2017; 38:3151-3162. DOI | PubMed
- TORTOISE: an integrated software package for processing of diffusion MRI data. 2010.
- A review and synthesis of the first 20 years of PET and fMRI studies of heard speech, spoken language and reading. Neuroimage. 2012; 62:816-847. DOI | PubMed
- Left hemisphere regions are critical for language in the face of early left focal brain injury. Brain. 2010; 133:1707-1716. DOI | PubMed
- Maps and streams in the auditory cortex: nonhuman primates illuminate human speech processing. Nat Neurosci. 2009; 12:718-724. DOI | PubMed
- Later language development in narratives in children with perinatal stroke. Dev Sci. 2013; 16:67-83. DOI | PubMed
- A database of age-appropriate average MRI templates. Neuroimage. 2016; 124:1254-1259. DOI | PubMed
- The shape of the fMRI BOLD response in children and adults changes systematically with age. Neuroimage. 2003; 20:1122-1131. DOI | PubMed
- Analysis of automated methods for spatial normalization of lesioned brains. Neuroimage. 2012; 60:1296-1306. DOI | PubMed
- Strength of temporal white matter pathways predicts semantic learning. J Neurosci. 2017; 37:11101-11113. DOI | PubMed
- Atlasing the frontal lobe connections and their variability due to age and education: a spherical deconvolution tractography study. Brain Struct Funct. 2016; 221:1751-1766. DOI | PubMed
- Default Bayes factors for model selection in regression. Multivariate Behav Res. 2012; 47:877-903. DOI | PubMed
- Does linguistic input play the same role in language learning for children with and without early brain injury?. Dev Psychol. 2009; 45:90-102. DOI | PubMed
- Dorsal and ventral pathways for prosody. Curr Biol. 2015; 25:3079-3085. DOI | PubMed
- Neurodevelopmental MRI brain templates for children from 2 weeks to 4 years of age. Dev Psychobiol. 2012; 54:77-91. DOI | PubMed
- Re-examination of the crowding hypothesis: effects of age of onset. Neuropsychology. 1994; 8:255-262. DOI
- Ventral and dorsal pathways for language. Proc Natl Acad Sci USA. 2008; 105:18035-18040. DOI | PubMed
- Tracking the roots of reading ability: white matter volume and integrity correlate with phonological awareness in pre-reading and early-reading kindergarten children. J Neurosci. 2013; 33:13251-13258. DOI | PubMed
- Microstructural status of ipsilesional and contralesional corticospinal tract correlates with motor skill in chronic stroke patients. Hum Brain Mapp. 2009; 30:3461-3474. DOI | PubMed
- Even when right is all that’s left: there are still more options for recovery from aphasia. Ann Neurol. 2018; 83:661-663. DOI | PubMed
- Characterization of displaced white matter by brain tumors using combined DTI and fMRI. Neuroimage. 2006; 30:1100-1111. DOI | PubMed
- Construction of a 3D probabilistic atlas of human cortical structures. Neuroimage. 2008; 39:1064-1080. DOI | PubMed
- Prosody guides the rapid mapping of auditory word forms onto visual objects in 6-mo-old infants. Proc Natl Acad Sci USA. 2011; 108:6038-6043. DOI | PubMed
- Neural specialization for speech in the first months of life. Dev Sci. 2014; 17:766-774. DOI | PubMed
- Tract-based spatial statistics: voxel wise analysis of multi-subject diffusion data. Neuroimage. 2006; 31:1487-1505. DOI | PubMed
- Brain mapping in sedated infants and young children with passive-functional magnetic resonance imaging. Pediatr Neurosurg. 1999; 30:86-92. DOI | PubMed
- Arcuate fasciculus laterality by diffusion tensor imaging correlates with language laterality by functional MRI in preadolescent children. Neuroradiology. 2015; 57:291-297. DOI | PubMed
- Right-hemispheric organization of language following early left-sided brain lesions: functional MRI topography. Neuroimage. 2002; 16:954-967. PubMed
- Cognitive development following early brain injury: evidence for neural adaptation. Trends Cogn Sci. 2005; 9:136-143. DOI | PubMed
- A longitudinal functional magnetic resonance imaging study of language development in children 5 to 11 years old. Ann Neurol. 2006; 59:796-807. DOI | PubMed
- Sensitivity of newborn auditory cortex to the temporal structure of sounds. J Neurosci. 2009; 29:14726-14733. DOI | PubMed
- Atlasing location, asymmetry and inter-subject variability of white matter tracts in the human brain with MR diffusion tractography.. Neuroimage. 2011; 54:49-59. DOI | PubMed
- Cortical reorganization of language functioning following perinatal left MCA stroke. Brain Lang. 2008; 106:184-194. DOI | PubMed
- Homotopic language reorganization in the right hemisphere after early left hemisphere injury. Brain Lang. 2012; 123:1-10. DOI | PubMed
- Hidden word learning capacity through orthography in aphasia. Cortex. 2014; 50:174-191. DOI | PubMed
- The left, the better: white-matter brain integrity predicts foreign language imitation ability. Cereb Cortex. 2017; 27:3906-3917. DOI | PubMed
- A tractography study in dyslexia: neuroanatomic correlates of orthographic, phonological and speech processing. Brain. 2012; 135:935-948. DOI | PubMed
- Medidas del desarrollo típico de la morfosintaxis para la evaluación del lenguaje espontáneo de niños hispanohablantes. Revista Logoped Foniatr Audiolog. 2007; 27:140-152. DOI
- Late emergence of cognitive deficits after unilateral neonatal stroke. Stroke. 2009; 40:2012-2019. DOI | PubMed
- Cognitive outcome following unilateral arterial ischaemic stroke in childhood: effects of age at stroke and lesion location. Dev Med Child Neurol. 2010; 52:386-393. DOI | PubMed
- Conn: a functional connectivity toolbox for correlated and anticorrelated brain networks. Brain Connect. 2012; 2:125-141. DOI | PubMed
- Right hemisphere grey matter structure and language outcomes in chronic left hemisphere stroke. Brain. 2016; 139:227-241. DOI | PubMed
- Comparison of kinetics of sevoflurane and isoflurane in humans. Anesth Analg. 1991; 72:316-324. DOI | PubMed
- It doesn’t matter what you say: FMRI correlates of voice learning and recognition independent of speech content. Cortex. 2017; 94:100-112. DOI | PubMed
- Spectral and temporal processing in human auditory cortex. Cereb Cortex. 2001; 11:946-953. DOI | PubMed
- Evidence of slow maturation of the superior longitudinal fasciculus in early childhood by diffusion tensor imaging. Neuroimage. 2007; 38:239-247. DOI | PubMed
- When right is all that is left: plasticity of right-hemisphere tracts in a young aphasic patient. Ann NY Acad Sci. 2012; 1252:237-245. DOI | PubMed
Fonte
François C, Ripollés P, Ferreri L, Muchart J, Sierpowska J, et al. (2019) Right Structural and Functional Reorganization in Four-Year-Old Children with Perinatal Arterial Ischemic Stroke Predict Language Production. eNeuro 6(4): ENEURO.0447-18.2019. https://doi.org/10.1523/ENEURO.0447-18.2019





