Introduzione
Una domanda fondamentale nelle neuroscienze è quali proprietà dei neuroni sono alla base dell’intelligenza umana e sono alla base delle differenze individuali nelle capacità mentali. Finora, la ricerca sperimentale sulle basi neurobiologiche dell’intelligenza ha ampiamente ignorato il livello neuronale e non ha testato direttamente il ruolo dei neuroni umani nelle capacità cognitive, principalmente a causa dell’inaccessibilità dei neuroni umani. Invece, la ricerca si è concentrata sulla ricerca di loci genetici che possono spiegare parte della varianza dell’intelligenza (g di Spearman) in grandi coorti (Lamet al., 2017; Sniekers , 2017; Trampush et al., 2017; Coleman et al., 2018) o sull’identificazione delle regioni cerebrali in studi di imaging del cervello intero la cui struttura o funzione è correlata ai punteggi del QI(Karama et al., 2009; Hulshoff Pol et al., 2006; Narr et al., 2007; McDaniel, 2005; Deary et al., 2010). Alcuni studi hanno evidenziato che la variabilità del volume del cervello e l’intelligenza possono condividere un’origine genetica comune(Hulshoff Pol et al., 2006; Posthuma et al., 2002; Sniekers, 2017), e i singoli geni che sono stati identificati come associati ai punteggi del QI potrebbero aiutare l’intelligenza facilitando la crescita dei neuroni(Sniekers, 2017; Coleman et al., 2018) e influenzando direttamente il fuoco neuronale(Lam et al., 2017).
L’intelligenza è una funzione distribuita che dipende dall’attività di più regioni cerebrali(Deary et al., 2010). Studi di risonanza magnetica strutturale e funzionale in centinaia di soggetti sani hanno rivelato che il volume corticale e la funzione di specifiche aree corticali sono correlati con g(Karama et al., 2009; Choi et al., 2008; Narr et al., 2007). In particolare, le aree situate nella corteccia frontale e temporale mostrano correlazioni multiple dello spessore della materia grigia e dell’attivazione funzionale con i punteggi del QI: gli individui con un QI elevato mostrano un volume di materia grigia maggiore, ad esempio, delle aree 21 e 38 di Brodmann(Choi et al., 2008; Deary et al., 2010; Karama et al.,2009; Narr et al.,2007). La materia grigia corticale consiste per una parte sostanziale di dendriti(Chklovskii et al., 2002; Ikari e Hayashi, 1981), che ricevono e integrano informazioni sinaptiche e influenzano fortemente le proprietà funzionali dei neuroni(Bekkers e Häusser, 2007; Eyal et al., 2014; Vetter et al., 2001). In particolare le aree di associazione di ordine superiore nei lobi temporali e frontali degli esseri umani ospitano neuroni piramidali di straordinaria dimensione e complessità dendritica(Elston, 2003; Mohan et al., 2015) che possono costituire variazioni dello spessore corticale, della funzione neuronale e, in ultima analisi, del QI. Questi neuroni e le loro connessioni costituiscono i principali elementi costitutivi per la codifica, l’elaborazione e l’immagazzinamento di informazioni nel cervello e danno origine alla cognizione(Salinas e Sejnowski, 2001). Dato il loro vasto numero nella neocorteccia umana, anche il minimo cambiamento nell’efficienza del trasferimento di informazioni da parte dei neuroni può tradursi in grandi differenze nelle capacità mentali. Tuttavia, se e come l’attività e la struttura dendritica dei singoli neuroni umani supportano l’intelligenza umana non è stata testata.
Per indagare se le proprietà strutturali e funzionali dei neuroni della corteccia temporale umana si associano all’intelligenza generale, abbiamo raccolto un unico set di dati multimodale da 46 soggetti umani contenenti la fisiologia di una singola cellula (31 soggetti, 129 neuroni), la morfologia neuronale (25 soggetti, 72 neuroni), le scansioni pre-chirurgiche MRI e i punteggi del test del QI (35 soggetti, Figura 1, dati disponibili presso il Dryad Digital Repository: https://doi.org/10.5061/dryad.83dv5j7).
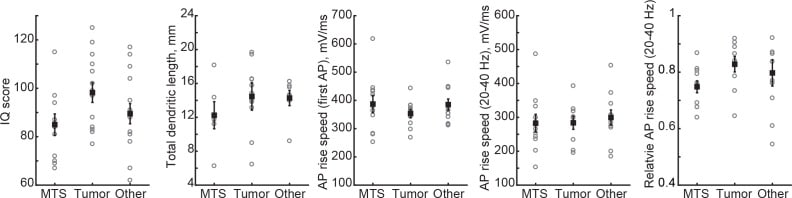
Figura 1-figure supplement 2.Sintesi dell’approccio: il set di dati multidimensionali di soggetti umani conteneva la fisiologia a singola cellula, la morfologia neuronale, la risonanza magnetica e i punteggi dei test del QI (WAIS FSIQ).l’anamnesi della malattia del soggetto e l’età non sono correlate con il QI e la morfologia neuronale.la morfologia neuronale, il QI o la velocità di aumento del QI o dell’AP non sono diversi da un gruppo di pazienti all’altro.L’area del cervello evidenziata in blu indica la posizione delle misurazioni dello spessore corticale, il quadrato nero indica l’origine tipica del tessuto corticale resecato.Le linee nere sono le linee di regressione, l’ombreggiatura rappresenta il 95% degli intervalli di confidenza, i dati sono medi per soggetto ± deviazione standard.I cerchi aperti rappresentano la media per soggetto, i cerchi pieni sono la media per gruppo ±SEM.
Il tessuto cerebrale corticale umano è stato rimosso come parte del trattamento chirurgico per l’epilessia o il tumore(Tabella 1). Il tessuto ha avuto origine quasi esclusivamente dal giro temporale medio, circa 4 cm posteriormente al polo temporale(Figura 2b) come un blocco di ~ 1-1,5 cm di diametro ed è stato rimosso per accedere alla messa a fuoco della malattia in strutture più profonde che giacciono come l’ippocampo o amigdala. In tutti i pazienti, il tessuto neocorticale resecato non faceva parte del focus epilettico o del tumore e non presentava anomalie strutturali/funzionali nell’indagine preoperatoria della risonanza magnetica, nelle registrazioni elettrofisiologiche delle cellule intere o nell’indagine microscopica dei tessuti colorati istochimicamente(Mohan et al., 2015; Testa-Silva et al., 2014; Testa-Silva et al., 2010; Verhoog et al., 2016; Verhoog et al., 2013). In linea con lo stato non patologico del tessuto, non abbiamo osservato alcuna correlazione dei parametri cellulari o dei punteggi del QI con l’anamnesi e l’età del soggetto (Figura 1-figure supplements 1- 2). Dopo la resezione il tessuto è stato immediatamente inserito nel liquido cerebro-spinale artificiale ghiacciato (aCSF) ed entro 15 minuti trasportato al laboratorio, tagliato e mantenuto per consentire registrazioni fisiologiche a singola cellula e riempimento di biocitina.
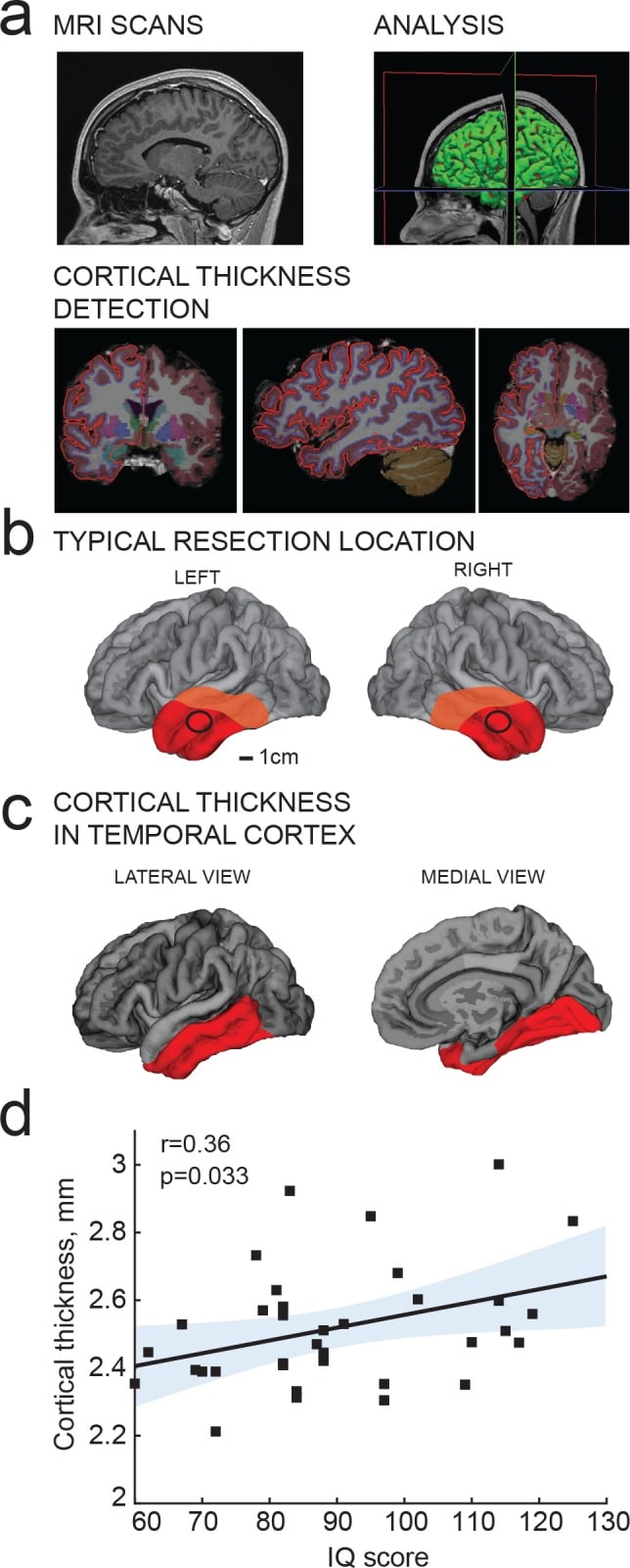
Figura 2.Punteggi QI positivamente correlati con lo spessore corticale del lobo temporale.a) Pipeline di analisi di risonanza magnetica: (1) Risonanza magnetica prechirurgica T1 pesata; (2) analisi morfometrica; (3) Rilevazione dello spessore corticale dai confini del pial e della materia bianca-grigia;(b) La posizione tipica di resezione per il tessuto utilizzato in questo studio è contrassegnata da un cerchio nero; l’area resecata totale media del paziente è mostrata in rosso e l’area resecata massima in arancione;(c) selezione dell’area corticale temporale per le correlazioni con il quoziente intellettivo in b (rosso).(d) spessore corticale medio nel lobo temporale (dall’area evidenziata in rosso in c) correla positivamente con i punteggi del QI degli stessi soggetti (n soggetti = 35). Qui e nelle figure sottostanti, i coefficienti di correlazione di Pearson e i valori p sono riportati negli inserti del grafico, la linea solida rappresenta la regressione lineare (R2 = 0,13), l’area ombreggiata indica il 95% dei limiti di confidenza del fit.
| Numero del paziente | IQ | Età | Diagnosi | Sesso | Farmaci antiepilettici |
|---|---|---|---|---|---|
| 1 | 88 | 41 | Tumore | M | CBZ |
| 2 | 78 | 21 | Altro | F | LEV; VPA |
| 3 | 119 | 66 | Tumore | F | Nessuno |
| 4 | 88 | 31 | Tumore | F | CBZ; LEV |
| 5 | 81 | 51 | Altro | F | CLB; LTG; OXC |
| 6 | 69 | 58 | MTS | F | CZP |
| 7 | 107 | 28 | Tumore | M | LTG; LEV |
| 8 | 115 | 29 | MTS | F | LTG; TPM |
| 9 | 125 | 20 | Tumore | M | CBZ; LEV |
| 10 | 84 | 27 | Tumore | F | CBZ, LTG |
| 11 | 110 | 41 | Tumore | M | CBZ; LTG |
| 12 | 87 | 18 | MTS | M | OXC |
| 13 | 67 | 23 | MTS | F | LEV; OXC |
| 14 | 72 | 53 | MTS | M | CBZ; CLB |
| 15 | 97 | 25 | Tumore | M | Nessuno |
| 16 | 104 | 19 | Altro | M | CLB; OXC |
| 17 | 88 | 48 | Altro | F | CBZ |
| 18 | 65 | 38 | MTS | F | CBZ; LEV |
| 19 | 62 | 40 | Altro | F | Nessuno |
| 20 | 84.5 | 31 | Altro | F | Nessuno |
| 21 | 88 | 35 | Altro | F | CZP; LCS; LTG; LEV |
| 22 | 77 | 54 | Tumore | M | VPA |
| 23 | 91 | 25 | Altro | M | CLB; LCS; LEV |
| 24 | 70 | 31 | MTS | F | CBZ; CLB |
| 25 | 114 | 49 | Altro | M | CBZ; CLB; LEV |
| 26 | 83 | 25 | Tumore | M | Nessuno |
| 27 | 109 | 45 | Altro | F | CBZ; CLB; LTG |
| 28 | 102 | 47 | Tumore | F | CBZ |
| 29 | 67 | 22 | Altro | M | CLB; LTG; LEV |
| 30 | 97 | 38 | MTS | M | CBZ |
| 31 | 79 | 40 | MTS | F | CBZ, CLB, LTG, LEV |
| 32 | 117 | 44 | Altro | M | LCS; VPA |
| 33 | 99 | 30 | Tumore | F | CLB; OXC |
| 34 | 72 | 44 | MTS | M | LTG; LEV |
| 35 | 82 | 41 | Altro | F | CBZ, LEV, TPM |
| 36 | 95 | 29 | Altro | M | CBZ; PB |
| 37 | 91 | 20 | Altro | F | CBZ; LEV |
| 38 | 82 | 21 | Tumore | M | CBZ; LCS; LTG; LEV |
| 39 | 115 | 40 | MTS | M | CBZ; LEV |
| 40 | 97 | 48 | MTS | F | CBZ; ZNS |
| 41 | 94 | 40 | MTS | F | CLB; LTG; ZNS |
| 42 | 81 | 44 | MTS | M | CBZ; LTG |
| 43 | 70 | 33 | MTS | F | CBZ; CLB; LEV |
| 44 | 82 | 51 | Altro | M | CBZ |
| 45 | 114 | 18 | Tumore | F | OXC |
| 46 | 90 | 23 | Altro | M | OXC |
Abbiamo registrato i potenziali d’azione (AP) dei neuroni piramidali umani in strati superficiali della corteccia temporale e abbiamo ricostruito digitalmente le loro strutture dendritiche complete. Abbiamo testato l’ipotesi che la variazione della morfologia neuronale può portare a differenze funzionali nella velocità AP e nel trasferimento di informazioni e spiegare la variazione dei punteggi del QI. Oltre ai nostri risultati sperimentali, abbiamo usato la modellazione computazionale per capire i principi di base del trasferimento efficiente delle informazioni nei neuroni corticali umani.

Figura 1-figure supplement 2.Sintesi dell’approccio: l’insieme di dati multidimensionali di soggetti umani conteneva la fisiologia a singola cellula, la morfologia neuronale, la risonanza magnetica e i punteggi dei test del QI (WAIS FSIQ).l’anamnesi della malattia del soggetto e l’età non sono correlate con il QI e la morfologia neuronale.la morfologia neuronale, il QI o la velocità di crescita del AP non sono diversi da un gruppo di pazienti all’altro.L’area del cervello evidenziata in blu indica la posizione delle misurazioni dello spessore corticale, il quadrato nero indica l’origine tipica del tessuto corticale resecato.Le linee nere sono le linee di regressione, l’ombreggiatura rappresenta il 95% degli intervalli di confidenza, i dati sono medi per soggetto ± deviazione standard.I cerchi aperti rappresentano la media per soggetto, i cerchi pieni sono la media per gruppo ±SEM.
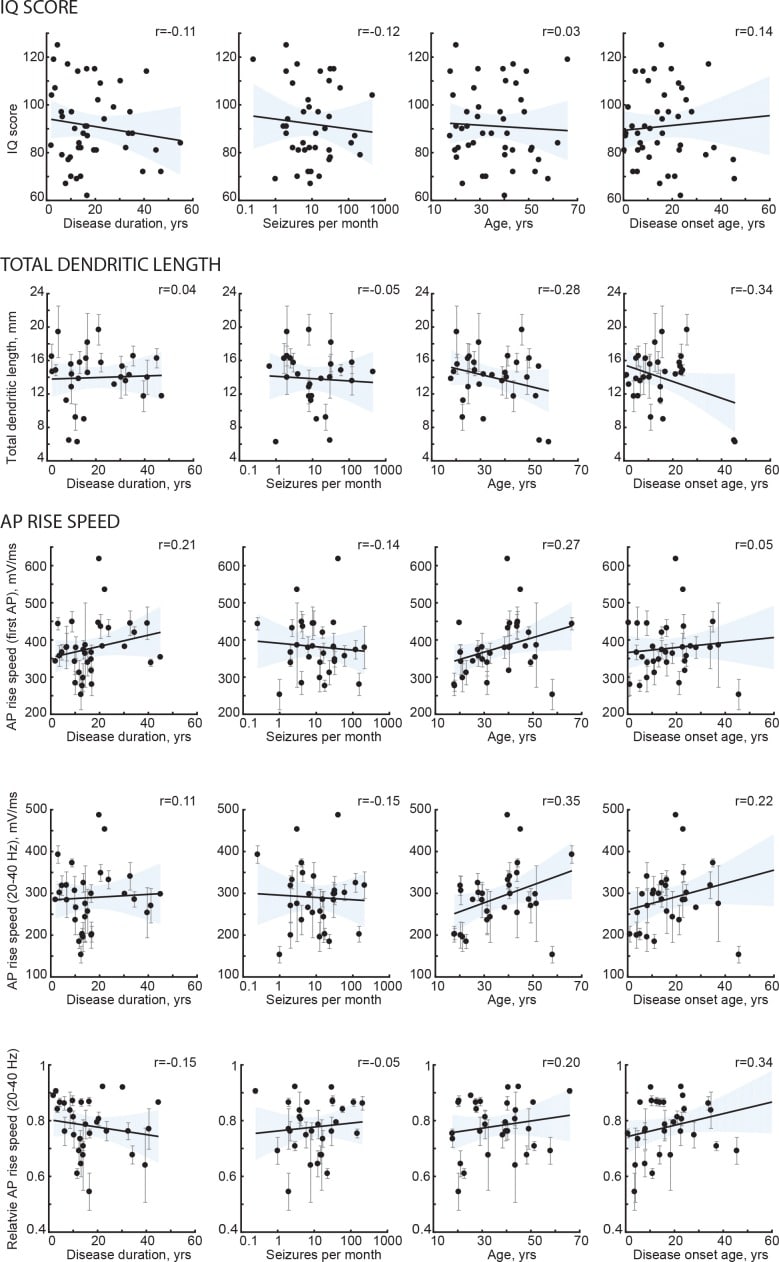
Figura 1-figure supplement 1.L’anamnesi del soggetto e l’età non sono correlate con il QI e la morfologia neuronale.2. Le linee nere sono le linee di regressione, l’ombreggiatura rappresenta il 95% degli intervalli di confidenza, i dati sono medi per soggetto ± deviazione standard.

Figura 1-figure supplement 2.La morfologia neuronale, il QI o la velocità di salita dell’AP non sono diversi da un gruppo di pazienti all’altro.I cerchi aperti rappresentano la media per soggetto, i cerchi pieni sono la media per gruppo ±SEM.

Figura 2.I punteggi del QI sono positivamente correlati con lo spessore corticale del lobo temporale.a) Pipeline di analisi della risonanza magnetica: (1) Risonanza magnetica prechirurgica T1 pesata; (2) Analisi morfometrica; (3) Rilevazione dello spessore corticale dai confini del pial e della materia bianca-grigia;(b) La posizione tipica di resezione per il tessuto utilizzato in questo studio è segnata da un cerchio nero; l’area resecata totale media del paziente è mostrata in rosso e l’area resecata massima in arancione;(c) selezione dell’area corticale temporale per le correlazioni con il quoziente intellettivo in b (rosso).(d) spessore corticale medio nel lobo temporale (dall’area evidenziata in rosso in c) correla positivamente con i punteggi del QI degli stessi soggetti (n soggetti = 35). Qui e nelle figure sottostanti, i coefficienti di correlazione di Pearson e i valori p sono riportati negli inserti del grafico, la linea solida rappresenta la regressione lineare (R2 = 0,13), l’area ombreggiata indica il 95% dei limiti di confidenza del fit.
Risultati
I punteggi del QI sono positivamente correlati con lo spessore corticale del lobo temporale
Lo spessore corticale del lobo temporale è stato associato ai punteggi del QI in centinaia di soggetti sani(Choi et al., 2008; Deary et al., 2010; Hulshoff Pol et al., 2006;Karama et al., 2009; Narr et al.,2007), e per prima cosa ci siamo chiesti se questo vale anche per i soggetti del nostro studio. Da scansioni MRI ponderate T1 ottenute prima dell’intervento chirurgico, abbiamo determinato lo spessore corticale temporale in 35 soggetti utilizzando la morfometria voxel delle aree corticali temporali. Queste aree includevano il tessuto corticale resecato chirurgicamente(Figura 2b) utilizzato per le registrazioni cellulari e ricostruzioni neuronali, che in genere proveniva da posizioni a 4 cm dal polo temporale ed era 1-1,5 cm di diametro (cerchio nero in Figura 2b). L’area corticale resecata totale variava per ogni paziente, ma consisteva di una parte più grande del lobo temporale(Figura 2b; area resecata media in rosso, massima in arancione). La distanza media dei confini della resezione dal polo temporale è stata di 4,2 ± 1,7 cm sul giro temporale superiore, 4,8 ± 1,5 cm sul giro temporale medio e 4,9 ± 1,5 cm sul giro temporale inferiore per i 46 soggetti di questo studio. Nelle immagini di risonanza magnetica, lo spessore corticale è stato misurato nel lobo temporale che comprendeva le aree di resezione e corrispondeva alle aree identificate da associare al QI nei soggetti sani(Choi et al., 2008; Deary et al., 2010; Hulshoff Pol et al., 2006; Karama et al.,2009; Narr et al.,2007) (Figura 2c;in rosso). Il giro temporale superiore è stato escluso da questa analisi in quanto contiene aree per l’elaborazione uditiva, gustativa e del linguaggio che vengono risparmiate durante la resezione. Le misurazioni dello spessore corticale sono state ridotte ad un valore medio di spessore corticale per ogni soggetto. In linea con i risultati in soggetti sani(Choi et al., 2008; Deary et al., 2010; Hulshoff Pol et al., 2006; Narr et al., 2007;Karama et al., 2009) lo spessore corticale medio nei lobi temporali è stato correlato positivamente con i punteggi del QI dei soggetti (Figura 2d).
I punteggi del QI sono positivamente correlati con la struttura dendritica dei neuroni piramidali corticali temporali
Le aree di associazione corticale nei lobi temporali giocano un ruolo chiave nei processi neuronali integrativi di alto livello e i suoi strati superficiali ospitano neuroni di maggiore complessità neuronale(DeFelipe et al., 2002; Elston, 2003; Scholtens et al., 2014; van den Heuvel et al., 2015). Nei roditori, il neuropilo delle aree di associazione corticale è costituito per oltre il 30% da strutture dendritiche(Ikari e Hayashi, 1981). Per testare l’ipotesi che lo spessore corticale temporale umano sia associato alle dimensioni della dendrite, abbiamo utilizzato 72 ricostruzioni complete di neuroni corticali piramidali temporali piramidali etichettati con la biocitina a partire dagli strati 2, 3 e 4 (numero mediano di neuroni per soggetto = 2; media 2,8; variabile da 1 a 10) di cui una parte è stata precedentemente riportata (Mohan etal., 2015). Abbiamo calcolato la lunghezza dendritica totale (TDL) che comprendeva tutti i dendriti basali e apicali senza artefatti apparenti di fetta per ogni neurone. Abbiamo calcolato la TDL da più neuroni per ogni soggetto e abbiamo correlato questi valori medi di TDL con lo spessore corticale temporale medio dello stesso soggetto. Abbiamo trovato che la lunghezza dendritica positivamente correlata con lo spessore corticale medio del lobo temporale (Pearson coefficiente di correlazione r = 0,5, ha spiegato la varianza R2 = 0,25), indicando che la struttura dendritica dei singoli neuroni contribuisce alla citoarchitettura complessiva della corteccia temporale (Figura 3a).
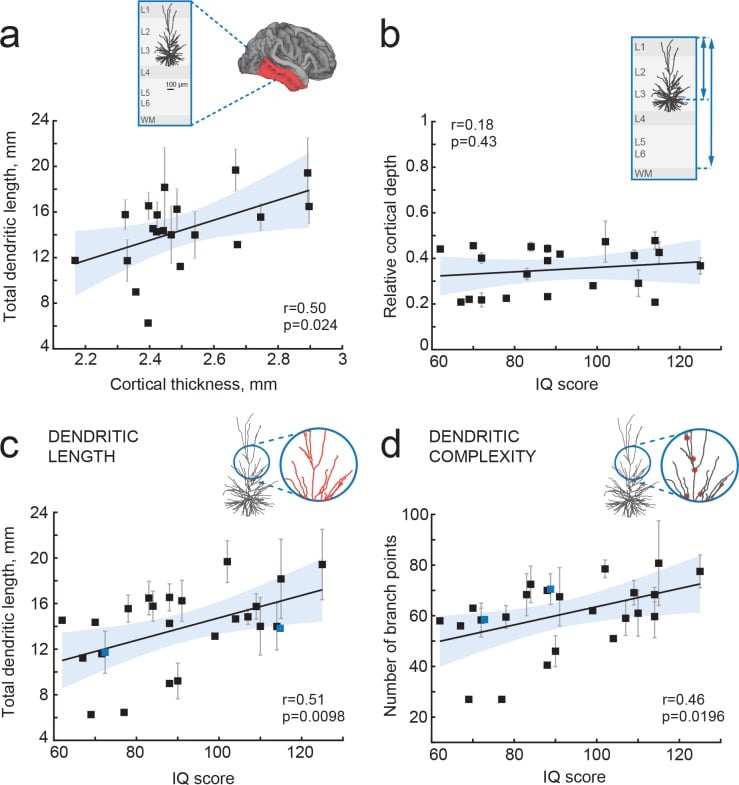
Figura 3.Punteggi QI positivamente correlati con la struttura dendritica delle cellule piramidali corticali temporali.(a) La lunghezza dendritica totale media nelle cellule piramidali in strati superficiali della corteccia temporale correla positivamente con lo spessore corticale nel lobo temporale dello stesso emisfero (area ombreggiata in a, n soggetti = 20; n neuroni = 57, R2 = 0,25). Inset mostra uno schema di tessuto corticale con un neurone ricostruito digitalmente e l’area cerebrale per la stima dello spessore corticale (rosso)(b) La profondità corticale dei neuroni piramidali, rispetto allo spessore corticale nella corteccia temporale dello stesso emisfero, non è correlata con il punteggio del QI (n soggetti = 21, R2 = 0,03). Inset rappresenta il tessuto corticale, le linee blu indicano la profondità del neurone e lo spessore corticale (c) Lunghezza dendritica totale (TDL) e(d) numero di rami dendritici positivamente correlati con i punteggi del QI degli stessi individui (n soggetti = 25, n neuroni = 72, TDL R2 = 0,26, punti di di diramazione R2 = 0,22). I simboli evidenziati in blu sono stati spostati lungo l’asse x per la visualizzazione. I dati sono medi per soggetto ± deviazione standard.
TDL è in parte determinata dalla posizione soma all’interno degli strati corticali: i corpi cellulari dei neuroni piramidali con dendriti più grandi giacciono tipicamente più profondi, a maggiore distanza da pia(Mohan et al., 2015). Per escludere una polarizzazione sistematica nel campionamento, abbiamo determinato la profondità corticale di ogni neurone rispetto allo spessore corticale temporale del soggetto nello stesso emisfero. Non vi era alcuna correlazione tra il punteggio del QI e la profondità corticale relativa dei neuroni piramidali che indica che abbiamo campionato i neuroni a profondità simili tra i soggetti(Figura 3b). Infine, abbiamo testato se il TDL medio e la complessità dei neuroni piramidali si riferiscono ai punteggi del QI dei soggetti. Abbiamo trovato una forte correlazione positiva tra i punteggi TDL del neurone piramidale dell’individuo e i punteggi del QI (coefficiente di correlazione di Pearson r = 0,51, ha spiegato la varianza R2 = 0,26; Figura 3c) così come tra il numero di punti di diramazione dendritica e i punteggi del QI (r = 0,46, R2 = 0,22; Figura 3d). Così, i neuroni piramidali più grandi e più complessi nell’area di associazione temporale possono contribuire in parte alla corteccia più spessa e al collegamento con una maggiore intelligenza.

Figura 3.Figura 3. Il quoziente intellettivo è positivamente correlato con la struttura dendritica delle cellule corticali piramidali temporali.(a) La lunghezza dendritica totale media nelle cellule piramidali in strati superficiali della corteccia temporale correla positivamente con lo spessore corticale nel lobo temporale dello stesso emisfero (area ombreggiata in a, n soggetti = 20; n neuroni = 57, R2 = 0,25). Inset mostra uno schema di tessuto corticale con un neurone ricostruito digitalmente e l’area cerebrale per la stima dello spessore corticale (rosso)(b) La profondità corticale dei neuroni piramidali, rispetto allo spessore corticale nella corteccia temporale dello stesso emisfero, non è correlata con il punteggio del QI (n soggetti = 21, R2 = 0,03). Inset rappresenta il tessuto corticale, le linee blu indicano la profondità del neurone e lo spessore corticale (c) Lunghezza dendritica totale (TDL) e(d) numero di rami dendritici positivamente correlati con i punteggi del QI degli stessi individui (n soggetti = 25, n neuroni = 72, TDL R2 = 0,26, punti di di diramazione R2 = 0,22). I simboli evidenziati in blu sono stati spostati lungo l’asse x per la visualizzazione. I dati sono medi per soggetto ± deviazione standard.
Dendriti più grandi portano ad un più rapido inizio di AP e a migliori proprietà di codifica
I dendriti non solo ricevono la maggior parte delle sinapsi nei neuroni, ma la morfologia dendritica e la condotta ionica agiscono di concerto per regolare l’eccitabilità neuronale(Bekkers e Häusser, 2007; Eyal et al., 2014; Vetter et al., 2001). Nelle simulazioni di modelli in cui i neuroni sono ridotti a sfere e bastoni, aumentando la superficie della membrana dendritica, cioè il carico di impedenza dendritica, accelera la fase di insorgenza degli AP. Questa è una conseguenza della diminuzione delle costanti temporali effettive del neurone con l’aumento delle dimensioni dendritiche e del carico di impedenza dendritica(Eyal et al., 2014). I dendriti più grandi agiscono come un più grande dissipatore per le correnti generate nel segmento iniziale dell’assone durante l’insorgenza degli AP e determinano cambiamenti di potenziale di membrana più rapidi. Inoltre, abbiamo scoperto in precedenza che i neuroni neocorticali piramidali umani, che sono tre volte più grandi dei neuroni piramidali dei roditori(Mohan et al., 2015), hanno onset AP più veloci rispetto ai neuroni dei roditori e sono in grado di tracciare e codificare gli ingressi sinaptici veloci e le variazioni di sotto-soglia del potenziale di membrana con elevata precisione temporale(Testa-Silva et al., 2014). Abbiamo chiesto se le differenze osservate in TDL tra i neuroni piramidali umani hanno influenzato le loro proprietà di codifica e la capacità di trasferire informazioni. A tal fine, abbiamo incorporato le ricostruzioni dendritiche tridimensionali dei 72 neuroni piramidali umani in modelli in silico, li abbiamo dotati di proprietà eccitabili (vedi Materiali e metodi) e abbiamo testato se i loro AP hanno un insorgenza più rapida. Abbiamo trovato che TDL di neuroni modello con alberi dendritici realistici correlati positivamente con la ripidezza degli onset AP (r = 0,4, R2 = 0,16; Figura 4a,b) e dendriti più grandi hanno permesso ai neuroni di generare AP più veloci.
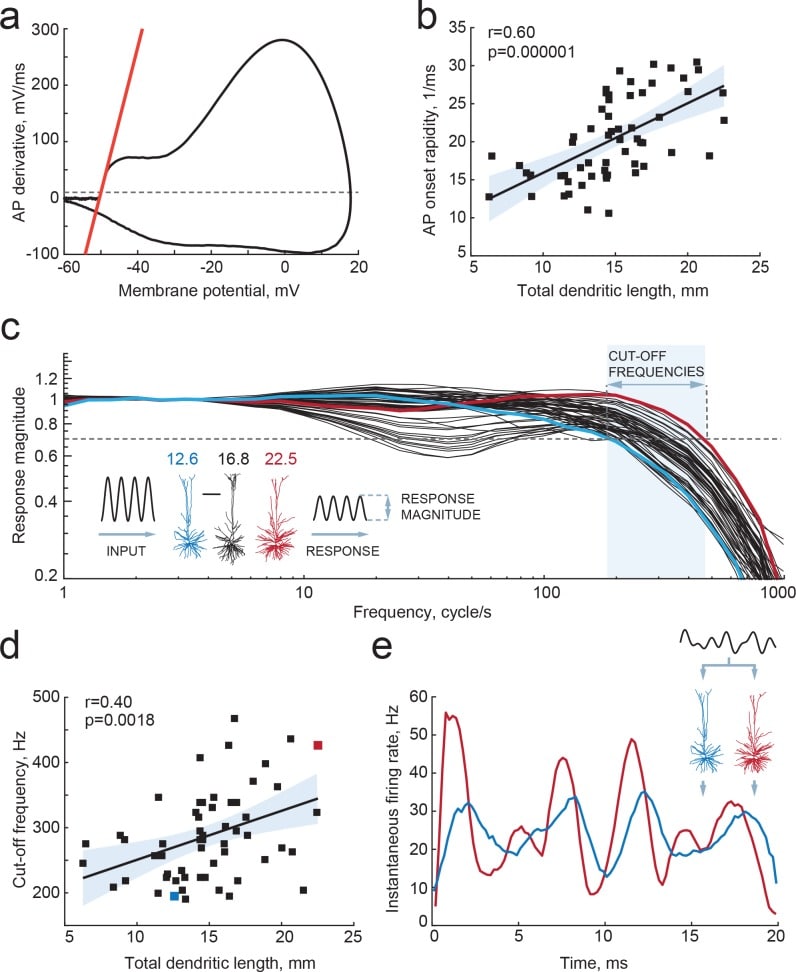
Figura 4.I dendriti più grandi portano all’insorgenza di AP più veloci e a migliori proprietà di codifica.(a,b) TDL più alto porta ad un più rapido insorgenza di AP generati dal modello: (a) l’esempio del diagramma di fase di un AP è mostrato con una linea rossa che rappresenta la velocità di insorgenza – pendenza della derivata AP a 10 mV/ms (linea tratteggiata grigia);(b) i valori di velocità di insorgenza degli AP simulati sono positivamente correlati con TDL (R2 = 0.36).(c) I neuroni del modello hanno ricevuto gli ingressi sinusoidali simulati della pinza amperometrica e hanno generato risposte di picco di diverse grandezze e frequenze. Le tracce rosse e blu sono magnitudini di risposta dei neuroni di esempio con TDL basse (blu) e grandi (rosse); l’inserto mostra esempi di ricostruzioni morfologiche con le loro TDL in mm mostrate sopra. Le frequenze di taglio sono definite all’interno della gamma di frequenza (area ombreggiata) alla quale il neurone modello può ancora tracciare gli ingressi in modo affidabile (produrre una risposta di 0,7 magnitudini di risposta, linea tratteggiata).(d) Le frequenze di taglio sono positivamente correlate con TDL (R2 = 0,16; i neuroni di esempio del pannello (c) sono evidenziati dagli stessi colori).(e) Risposte allo stesso input in due neuroni di esempio da pannelli(b) e(c): la frequenza di sparo istantanea del neurone modello con TDL grande (rosso) segue l’input con maggiore precisione temporale rispetto al neurone modello con TDL più piccolo (blu).
L’esatta tempistica della cottura potenziale di azione permette ai neuroni corticali di trasmettere le informazioni temporali fornite dagli input sinaptici(Köndgen et al., 2008; Ilin et al., 2013; Testa-Silva et al., 2014; Linaro et al., 2018). I neuroni piramidali singoli non sostengono la cottura ad alta frequenza e generalmente non codificano il contenuto di input sinaptici ad alta frequenza nella codifica della frequenza. Invece, la precisione nella tempistica dell’innesco dell’AP permette a questi neuroni di codificare le informazioni ad alta frequenza in entrata nella loro uscita. In contrasto con i neuroni roditori, i neuroni umani possono codificare i cambiamenti di potenziale di membrana sotto soglia su una scala di tempo inferiore ai millisecondi in base alla tempistica degli AP(Testa-Silva et al., 2014). Questa capacità di tracciamento sinaptico degli input si basa fortemente sulla rapidità di insorgenza degli AP(Ilin et al., 2013). Gli AP più veloci consentono ai neuroni di rispondere agli input sinaptici veloci, che non saranno rilevati se la generazione di AP è troppo lenta. In questo modo, i neuroni con AP più veloci possono tradurre le frequenze più alte delle fluttuazioni potenziali della membrana sinaptica in tempi di AP e, in ultima analisi, codificare più informazioni.
Il summenzionato lavoro teorico(Eyal et al., 2014) che utilizza modelli neuronali “a sfera e a bastone” ha dimostrato che i neuroni con compartimenti dendritici più grandi non solo hanno una più veloce rapidità di insorgenza degli AP, ma possono anche cronometrare la generazione di AP a cambiamenti più rapidi dei potenziali di membrana, aumentando le capacità di tracciamento della frequenza delle modulazioni di ingresso, e aumentando la larghezza di banda della frequenza di ingresso delle informazioni codificate circa tre volte. Tuttavia, non è noto se lo stesso effetto sia valido per i neuroni corticali piramidali umani da cui abbiamo registrato, e se la gamma di dimensioni dei compartimenti dendritici che abbiamo esaminato possa portare a significative differenze biofisiche quantitative. Abbiamo testato ciò simulando gli ingressi di corrente sinusoidale di frequenze crescenti in rappresentazioni in silico dei neuroni che abbiamo registrato e ricostruito, e abbiamo studiato come la tempistica di accensione AP di questi neuroni ha seguito i cambiamenti di potenziale di membrana sotto soglia. Troviamo che i neuroni umani con TDL più grandi possono cronometrare in modo affidabile i loro AP a più veloci cambiamenti di potenziale di membrana, con frequenze di taglio fino a 400-500 Hz, mentre i neuroni più piccoli avevano le loro frequenze di taglio già a 200 Hz (Figura 4c,d). Inoltre, vi era una significativa correlazione positiva tra la lunghezza dendritica e la frequenza di taglio(Figura 4d). Infine, dato lo stesso input – composto dalla somma di tre sinusoidi di frequenze crescenti – i neuroni più grandi sono stati in grado di codificare meglio le informazioni temporali che cambiano rapidamente in tempi di accensione AP, rispetto ai neuroni più piccoli(Figura 4e). Così, troviamo che le differenze nella lunghezza dendritica dei neuroni umani portano ad AP più veloci e quindi a più ampie larghezze di banda di frequenza di codifica degli ingressi sinaptici nella temporizzazione dell’uscita AP.

Figura 4.Dendriti più grandi portano ad un inizio AP più veloce e a migliori proprietà di codifica.a,b) TDL più alti portano ad un più rapido insorgenza di AP generati dal modello: (a) l’esempio del diagramma di fase di un AP è mostrato con una linea rossa che rappresenta la velocità di insorgenza – pendenza della derivata AP a 10 mV/ms (linea tratteggiata grigia);(b) i valori di velocità di insorgenza degli AP simulati sono positivamente correlati con TDL (R2 = 0.36).(c) I neuroni del modello hanno ricevuto gli ingressi sinusoidali simulati della pinza amperometrica e hanno generato risposte di picco di diverse grandezze e frequenze. Le tracce rosse e blu sono magnitudini di risposta dei neuroni di esempio con TDL basse (blu) e grandi (rosse); l’inserto mostra esempi di ricostruzioni morfologiche con le loro TDL in mm mostrate sopra. Le frequenze di taglio sono definite all’interno della gamma di frequenza (area ombreggiata) alla quale il neurone modello può ancora tracciare gli ingressi in modo affidabile (produrre una risposta di 0,7 magnitudini di risposta, linea tratteggiata).(d) Le frequenze di taglio sono positivamente correlate con TDL (R2 = 0,16; i neuroni di esempio del pannello (c) sono evidenziati dagli stessi colori).(e) Risposte allo stesso input in due neuroni di esempio da pannelli(b) e(c): la frequenza di sparo istantanea del neurone modello con TDL grande (rosso) segue l’input con maggiore precisione temporale rispetto al neurone modello con TDL più piccolo (blu).
Punteggi di QI più elevati si associano ad AP più veloci
Poiché i neuroni corticali piramidali con grandi dendriti hanno AP più veloci e possono codificare più informazioni nell’output AP, e poiché i grandi dendriti si associano anche a punteggi di QI più alti, ci siamo poi chiesti se i neuroni corticali piramidali umani provenienti da individui con punteggi di QI più alti generano AP più veloci. Per testare questo, abbiamo fatto registrazioni di cellule intere da cellule piramidali in fette acute della corteccia temporale (31 soggetti, 129 neuroni, numero mediano di neuroni per soggetto = 3; che vanno da 1 a 11 Figura 5) e registrato APs a diverse frequenze di cottura in risposta alla depolarizzazione passi corrente. Abbiamo determinato la velocità massima di salita degli AP, che è altamente correlata con la velocità di insorgenza degli AP (r = 0,79 p=4,29e-14, n = 60, dati non mostrati), e può essere determinata in modo più affidabile da registrazioni con frequenze di campionamento tra 10 e 50 kHz. La massima velocità di salita degli AP dipende dalla storia di sparo della cella, con il primo AP del treno che ha la massima velocità di salita degli AP e che rallenta con l’aumentare della frequenza di sparo istantanea, l’intervallo di tempo tra gli AP successivi(Figura 5b-d). Per verificare se la velocità di salita dell’AP differisce tra i gruppi di QI, abbiamo diviso tutti i dati sulla velocità di salita dell’AP in due gruppi basati sul punteggio del QI – sopra e sotto 100. Anche se la velocità di aumento dell’AP del primo AP non era diversa tra i gruppi ad alto e basso QI(Figura 5c), l’AP ha rallentato più forte negli individui con un QI più basso rispetto agli AP degli individui con un QI più alto(Figura 5d). A frequenze di fuoco istantanee più elevate (20-40 Hz), la velocità di salita dell’AP era più alta negli individui con punteggi di QI superiori a 100 (Figura 5c a destra; velocità di salita dell’AP alto QI = 338,4 ± 26,03 mV/ms; velocità di salita dell’AP basso QI = 268,1 ± 12,20 mV/ms, t-test p=0,0113). Abbiamo poi calcolato il rallentamento degli AP con l’aumento della frequenza istantanea normalizzando la velocità di salita degli AP alla velocità di salita del primo AP del treno. Rispetto al primo AP, la velocità di salita a 20-40 Hz ha mostrato un significativo rallentamento nei soggetti con un quoziente intellettivo più basso ed è scesa al 74% della velocità di salita iniziale dell’AP. Al contrario, nei neuroni di soggetti con punteggi più alti del QI, la velocità di aumento AP è rimasta in media all’84%(Figura 5d a destra, QI alto = 0,84 ± 0,014; QI basso = 0,74 ± 0,024, t-test p valore=0,037).
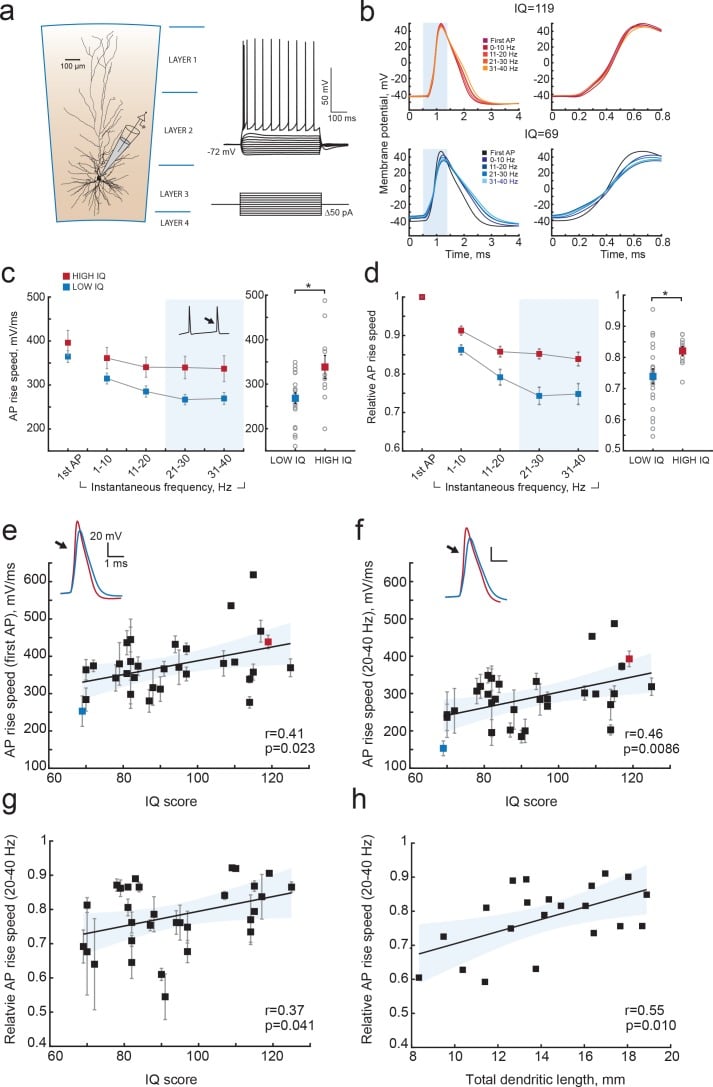
Figura 5.Punteggi più alti del QI si associano ad un’iniziazione AP più veloce.(a) Schema di una registrazione di una cellula intera che mostra la ricostruzione biocitina di un neurone piramidale dalla corteccia temporale umana. A destra: risposte tipiche di tensione alle iniezioni di corrente somatica depolarizzante.(b) Esempi di tracce AP a frequenze di cottura istantanee crescenti (la frequenza è mostrata in codice colore negli inserti) registrate da un soggetto con QI = 119 (pannello superiore, rosso) e un soggetto con QI = 69 (pannello inferiore, blu). La fase di salita degli AP in zona d’ombra viene visualizzata a destra(c) Gli AP di soggetti con quoziente intellettivo più alto sono in grado di mantenere meglio la loro velocità di salita a frequenze crescenti. La velocità media (per neurone e soggetto) di aumento dell’AP e(d) relativa alla prima velocità di aumento dell’AP nei neuroni di soggetti con QI < 100 (rosso, n soggetti = 21, n neuroni = 91) e soggetti con QI > 100 (blu, n soggetti = 10, n neuroni = 38) sono visualizzati contro la frequenza di sparo istantanea. A destra: i punti di dati nell’area ombreggiata sono mostrati come valori medi per 20-40 Hz (i quadrati riempiti sono mezzi di gruppo, i cerchi aperti sono velocità medie di salita per soggetto), *p<0,05.e) I punteggi del QI sono positivamente correlati con le velocità di salita del primo AP del treno (n soggetti 31, n neuroni = 129; R2 = 0.17),(f) velocità di salita AP a 20-40 Hz (stessi dati del pannello di destra in (c),R2=0,21) e (g) velocità di salita AP relative a 20-40 Hz (stessi dati del pannello di destra in (d), R2 = 0,14).(h) I neuroni più grandi mostrano un minore rallentamento della velocità di salita dell’AP a frequenze più alte: le velocità relative di salita dell’AP a 20-40 Hz per i singoli neuroni sono tracciate in funzione della loro TDL (n = 21 neuroni, R2 = 0,30). In c,d i dati sono medi per soggetto ±S.E.M.S.; in e, f, g i dati sono medi ± deviazione standard.
Abbiamo ulteriormente indagato se queste differenze a livello di gruppo riflettono le correlazioni tra i punteggi individuali del QI e le velocità di aumento dell’AP. Abbiamo correlato le velocità medie di aumento dell’AP sia del primo AP che dell’AP a 20-40 Hz da tutti i neuroni dello stesso soggetto al punteggio del QI del soggetto. La velocità di salita AP del primo AP nel treno è stata correlata positivamente con i punteggi del QI (r = 0,41, R2 = 0,17; Figura 5e), e questa correlazione era ancora più forte per le velocità di salita AP a frequenze istantanee di 20-40 Hz (r = 0,46, R2 = 0,21; Figura 5f). È importante notare che anche i valori relativi degli AP hanno mostrato significative correlazioni positive con il QI, indicando che è il relativo rallentamento degli AP alle alte frequenze che si associa all’intelligenza (r = 0,37, R2 = 0,14; Figura 5g). Infine, abbiamo chiesto se il rallentamento degli AP si riferisce alla dimensione dendritica degli stessi neuroni, come suggeriscono i risultati del nostro modello. Troviamo che i neuroni più grandi mostrano un minore rallentamento della velocità di salita degli AP (velocità di AP relative più elevate) a 20-40 Hz (r = 0,55, R2 = 0,30; Figura 5h). Questi risultati rivelano che i punteggi più alti del QI sono accompagnati da AP più veloci durante lo sparo ripetuto di AP, mentre i punteggi più bassi del QI si associano ad un aumento della fatica AP durante l’elevata attività neuronale. Così, i neuroni di individui con punteggi di QI più alti sono meglio equipaggiati per elaborare i segnali sinaptici ad alta velocità e a scale temporali più veloci, che è necessario per codificare grandi quantità di informazioni in modo accurato ed efficiente.

Figura 5.I punteggi più alti del QI si associano ad una più rapida inizializzazione dell’AP.a) Schema di una registrazione di un’intera cellula che mostra la ricostruzione della biocitina di un neurone piramidale dalla corteccia temporale umana. A destra: risposte tipiche di tensione alle iniezioni di corrente somatica depolarizzante.(b) Esempi di tracce AP a frequenze di cottura istantanee crescenti (la frequenza è mostrata in codice colore negli inserti) registrate da un soggetto con quoziente intellettivo = 119 (pannello superiore, rosso) e un soggetto con quoziente intellettivo = 69 (pannello inferiore, blu). La fase di salita degli AP in zona d’ombra viene visualizzata a destra(c) Gli AP di soggetti con quoziente intellettivo più alto sono in grado di mantenere meglio la loro velocità di salita a frequenze crescenti. La velocità media (per neurone e soggetto) di aumento dell’AP e(d) relativa alla prima velocità di aumento dell’AP nei neuroni di soggetti con QI < 100 (rosso, n soggetti = 21, n neuroni = 91) e soggetti con QI > 100 (blu, n soggetti = 10, n neuroni = 38) sono visualizzati contro la frequenza di sparo istantanea. A destra: i punti di dati nell’area ombreggiata sono mostrati come valori medi per 20-40 Hz (i quadrati riempiti sono mezzi di gruppo, i cerchi aperti sono velocità medie di salita per soggetto), *p<0,05.e) I punteggi del QI sono positivamente correlati con le velocità di salita del primo AP del treno (n soggetti 31, n neuroni = 129; R2 = 0.17),(f) velocità di salita AP a 20-40 Hz (stessi dati del pannello di destra in (c),R2=0,21) e (g) velocità di salita AP relative a 20-40 Hz (stessi dati del pannello di destra in (d), R2 = 0,14).(h) I neuroni più grandi mostrano un minore rallentamento della velocità di salita dell’AP a frequenze più alte: le velocità relative di salita dell’AP a 20-40 Hz per i singoli neuroni sono tracciate in funzione della loro TDL (n = 21 neuroni, R2 = 0,30). In c,d i dati sono medi per soggetto ±S.E.M.S.; in e, f, g i dati sono medi ± deviazione standard.
Discussione
I nostri risultati forniscono una prima visione della possibile natura cellulare dell’intelligenza umana e spiegano la variazione individuale dei punteggi del QI in base alle proprietà neuronali: una maggiore velocità di aumento dell’AP durante l’attività neuronale e dendriti più complessi ed estesi si associano ad una maggiore intelligenza. La cinetica dell’AP ha profonde conseguenze per l’elaborazione delle informazioni. In vivo, i neuroni sono costantemente bombardati da ingressi sinaptici ad alta frequenza e la capacità dei neuroni di tenere traccia e di bloccare la fase a questi ingressi determina quanta di questa informazione sinaptica può essere trasmessa ad altri neuroni(Testa-Silva et al., 2014). Il cervello opera su una scala temporale di millisecondi e anche i dettagli sub-millisecondi dei treni di picco contengono informazioni rilevanti dal punto di vista comportamentale che possono guidare le risposte comportamentali(Nemenman et al., 2008). Infatti, una delle scoperte più robuste e replicabili nella psicologia comportamentale è l’associazione dei punteggi di intelligenza con le misure della velocità di elaborazione cognitiva delle informazioni(Barrett et al., 1986). In particolare, i tempi di reazione (RT) in semplici compiti RT forniscono una migliore previsione del QI rispetto ad altri test di velocità di elaborazione, con un coefficiente di regressione di 0,447(Vernon, 1983). Inoltre, elevate correlazioni positive tra RT e altri test di velocità di elaborazione suggeriscono l’esistenza di un comune fattore di velocità mentale(Vernon, 1983). Recentemente, questi risultati classici sono stati confermati in un ampio studio longitudinale basato sulla popolazione che conta più di 2000 partecipanti(Der e Deary, 2017). Particolarmente forti correlazioni tra RT e intelligenza generale sono state segnalate per una scelta leggermente più complessa a 4 scelte(Der e Deary, 2017). I nostri risultati forniscono una spiegazione cellulare biologica per tali fattori di velocità mentale: in condizioni di maggiore attività mentale o di compito cognitivo più impegnativo, i neuroni di individui con un più alto QI sono in grado di sostenere potenziali di azione rapida e possono trasferire più contenuto informativo dall’input sinaptico all’output AP.
Le cellule piramidali sono integratori e accumulatori di informazioni sinaptiche. I dendriti più grandi possono contenere fisicamente più contatti sinaptici e integrare più informazioni. Infatti, i dendriti dei neuroni piramidali umani ricevono il doppio delle sinapsi rispetto ai roditori(DeFelipe et al., 2002) e la connettività cortico-corticale dell’intero cervello è positivamente correlata alla dimensione dei dendriti in queste cellule(Scholtens et al., 2014; van den Heuvel et al., 2015). In questo e in uno studio precedente(Mohan et al., 2015), troviamo quasi 2 volte più grandi le dimensioni del pergolato dendritico (media TDL = 14,67 ± 4 mm) e il numero di rami dendritici (64,03 ± 17,7) rispetto ai rapporti che utilizzano tessuto post-mortem (Jacobs et al., 2001; Bianchi et al., 2013;Elston et al., 2001) . Le differenze potrebbero essere spiegate da una serie di vantaggi dei neuroni riempiti di biocitina nelle resezioni chirurgiche rispetto alle tradizionali macchie di Golgi nel tessuto umano post-mortem. Le fette corticali nel nostro studio sono più spesse (350 μm rispetto a 120-250 μm) e contengono neuroni con dendriti apicali e basali quasi completamente intatte, mentre altri studi utilizzano solo dendriti basali per la quantificazione (Jacobset al., 2001). Inoltre, solo un piccolo numero di neuroni è riempito in una fetta, il che permette di quantificare senza ambiguità tutti i dendriti delle singole cellule. È importante notare che il tessuto proviene da un donatore vivente rispetto alla raccolta di tessuti post-mortem, e quindi non soffre di ritardi post-mortem(de Ruiter, 1983) e solo le cellule funzionali ancora vive vengono riempite. Allo stesso tempo, gli studi post-mortem permettono di effettuare analisi comparative di diverse aree corticali. Un gradiente di complessità delle cellule piramidali negli strati superficiali corticali accompagna la crescente capacità di integrazione delle aree corticali, indicando che dendriti più grandi sono necessarie per un’elaborazione corticale di ordine superiore(Elston et al., 2001; Jacobs et al., 2001; van den Heuvel et al., 2015). I nostri risultati si allineano bene con questi risultati, suggerendo che il gradiente di complessità neuronale esiste anche da individuo a individuo e potrebbe spiegare le differenze nelle capacità mentali.
All’interno della corteccia umana, le aree di associazione contengono neuroni con dendriti più grandi e complessi rispetto alle aree sensoriali primarie, mentre la densità del corpo cellulare neuronale è più bassa nelle aree di associazione corticale rispetto alle aree sensoriali primarie(Elston, 2003; DeFelipe et al., 2002). I neuroni più grandi non sono così compatti all’interno dello spazio corticale come le cellule più piccole. Un recente studio di Genç et al., 2018 ha utilizzato la diffusione multi-shell tensor imaging per stimare la densità dendritica corticale parieto-frontale e ha trovato che i punteggi più alti IQ correlato con valori più bassi di densità dendritica (Gençet al., 2018). Questo può indicare che le aree corticali parieto-frontaliere in individui con punteggi di QI più alti hanno neuroni meno densamente confezionati, e può suggerire che questi neuroni sono più grandi. Nel nostro studio, abbiamo accuratamente determinato la quantità e la complessità della dendriti per ogni neurone, un’unità di calcolo all’interno della corteccia con segnali di input-output ben definiti. Prendendo i risultati di Genç et al., 2018 e il nostro studio insieme possono suggerire che il circuito neuronale associato ad una maggiore intelligenza è organizzato in modo rado ed efficiente, dove le cellule piramidali più grandi e più complesse occupano un volume corticale più grande.
I dendriti più grandi hanno un impatto sull’eccitabilità delle cellule(Bekkers e Häusser, 2007; Vetter et al., 2001) e determinano la forma e la rapidità degli AP (Eyalet al., 2014). L’aumento delle dimensioni dei compartimenti dendritici in silico porta all’accelerazione dell’insorgenza di AP e all’aumento della capacità di codifica dei neuroni(Eyal et al., 2014). Sia nei modelli che nelle registrazioni a fette, è stato dimostrato che i cambiamenti delle dinamiche di iniziazione dell’AP modificano fondamentalmente la codifica dei segnali in rapido cambiamento e la velocità di comunicazione tra insiemi di neuroni corticali(Eyal et al., 2014; Ilin et al., 2013). I neuroni con onset AP veloci possono codificare le alte frequenze e rispondere rapidamente ai sottili cambiamenti di input. Questa capacità può essere compromessa e la velocità di risposta è ridotta quando gli onset AP sono rallentati da manipolazioni sperimentali(Ilin et al., 2013). I nostri risultati non solo dimostrano che la velocità di AP dipende dalla lunghezza dendritica e influenza il trasferimento di informazioni, ma anche che sia la lunghezza dendritica che la velocità di AP nei neuroni umani sono correlate con l’intelligenza. Così, gli individui con dendriti più grandi sono meglio equipaggiati per trasferire informazioni sinaptiche a frequenze più alte.
Notevolmente, la morfologia dendritica e i diversi parametri della forma d’onda AP sono anch’essi parametri che abbiamo identificato in precedenza, mostrando marcate differenze tra gli esseri umani e le altre specie(Mohan et al., 2015; Testa-Silva et al., 2014). Le cellule piramidali umane negli strati 2 e 3 hanno dendriti 3 volte più grandi e complessi rispetto al macaco o al topo (Mohan et al., 2015). Inoltre, le AP umane hanno una soglia di cottura più bassa e una cinetica di insorgenza più veloce sia nelle AP singole che durante la cottura ripetuta(Testa-Silva et al., 2014). Queste differenze tra le specie possono suggerire una pressione evolutiva sia sulla struttura dendritica che sulla forma d’onda AP ed enfatizzare adattamenti specifici delle cellule piramidali umane in aree di associazione per le funzioni cognitive.
I nostri risultati sono stati ottenuti da pazienti sottoposti a procedura neurochirurgica e, quindi, possono potenzialmente sollevare domande su quanto siano rappresentative le nostre scoperte per i normali soggetti umani sani. Anche se non è possibile utilizzare controlli sani per la misurazione di singole cellule, abbiamo affrontato questo problema nel modo seguente. In primo luogo, in tutti i pazienti, il tessuto neocorticale resecato non faceva parte del focus epilettico o del tumore e non presentava anomalie strutturali o funzionali nella risonanza magnetica preoperatoria, nelle registrazioni elettrofisiologiche o nell’indagine microscopica dei tessuti macchiati. In secondo luogo, nessuno dei parametri correlati con l’età all’insorgenza dell’epilessia, la frequenza delle crisi, l’età o la durata della malattia(Figura 1-figure supplement 1). In terzo luogo, il quoziente intellettivo, la lunghezza dendritica o la velocità di aumento AP non erano diversi tra i diversi gruppi di pazienti(Figura 1-figure supplemento 2). Infine, la correlazione dello spessore corticale con l’intelligenza generale che osserviamo nel nostro studio è stata riportata anche in centinaia di soggetti sani. Presi nel loro insieme, questi risultati indicano che i nostri risultati non sono probabilmente influenzati dal background di malattia dei soggetti.
In questo studio, l’intelligenza è stata misurata utilizzando il punteggio del QI di WAIS, che combina i risultati di 11 sottotest individuali di funzionamento cognitivo in un unico punteggio del QI su scala reale (Wechsler,2008; Taylor e Heaton, 2001). Questo inevitabilmente semplifica e riduce un tratto umano multidimensionale ad un unico numero. Sebbene nessuno dei test di intelligenza possa cogliere tutti gli aspetti dell’intelligenza umana, i test del QI hanno dimostrato la loro validità e rilevanza. I risultati di diversi sottotest cognitivi sono altamente correlati e generano un forte fattore generale – l’intelligenza generale o il g di Spearman (Spearman, 1904). La g di Spearman, calcolata sulla base dei subtest del WAIS ed espressa in un punteggio totale del QI su scala reale, è fortemente correlata con i risultati di vita altamente rilevanti, tra cui l’istruzione, l’occupazione e il reddito (Strenze, 2007; Foverskov et al., 2017). Inoltre, l’intelligenza è un tratto stabile nel tempo nello stesso individuo: i risultati dei test di intelligenza a 11 anni predicono i punteggi a 90 anni(Gow et al., 2011; Deary et al., 2013). Così, nonostante le sue carenze, il punteggio del QI su scala reale fornisce una stima rilevante e significativa dell’intelligenza generale che è alla base delle differenze cognitive tra gli individui.
In conclusione, i nostri risultati forniscono la prima prova che già a livello dei singoli neuroni, parametri come la dimensione dendritica e la capacità di mantenere risposte rapide si collegano all’abilità mentale generale. Moltiplicato per un numero astronomico di neuroni corticali nel nostro cervello, cambiamenti molto piccoli in questi parametri possono portare a grandi differenze nelle capacità di codifica e nel trasferimento di informazioni nelle reti corticali e risultare in un vantaggio di velocità nell’elaborazione mentale e, infine, in tempi di reazione più veloci e in una maggiore capacità cognitiva.
Materiali e metodi
Soggetti umani e tessuto cerebrale
Tutte le procedure sono state eseguite con l’approvazione del Comitato Medico Etico del Centro Medico Universitario VU, e in conformità alle procedure di licenza olandesi e alla Dichiarazione di Helsinki. Il consenso informato scritto è stato fornito da tutti i soggetti per l’uso dei dati e dei tessuti per la ricerca scientifica. Tutti i dati sono stati resi anonimi.
Il tessuto cerebrale corticale umano è stato rimosso come parte del trattamento chirurgico del soggetto al fine di ottenere l’accesso a un focus di malattia nelle strutture cerebrali più profonde (ippocampo o amigdala) e tipicamente originato dal mezzo giro temporale (area 21 di Brodmann). Le aree vocali sono state evitate durante la chirurgia di resezione attraverso la mappatura funzionale. Abbiamo ottenuto tessuto neocorticale da 46 pazienti (24 femmine, 22 maschi; fascia di età 18-66 anni, Tabella 1) trattati per la sclerosi temporale mesiale, la rimozione di un tumore dell’ippocampo, lesione dell’ippocampo a basso grado, cavernoma o un’altra patologia non specificata del lobo temporale. Da 35 di questi pazienti abbiamo anche ottenuto scansioni pre-chirurgiche a risonanza magnetica, da 31 pazienti abbiamo registrato il potenziale d’azione di 129 neuroni e da 25 pazienti abbiamo ricostruito completamente le morfologie dendritiche di 72 neuroni.
In tutti i pazienti, il tessuto neocorticale resecato non era parte del fuoco epilettico o tumore e non ha mostrato alcuna anomalia strutturale / funzionale nelle indagini preoperatorie di risonanza magnetica, elettrofisiologici registrazioni di cellule intere o indagini microscopiche di tessuto macchiato. Le registrazioni fisiologiche, le successive ricostruzioni morfologiche, l’analisi morfologica e l’analisi del potenziale d’azione sono state eseguite in cieco al QI dei pazienti.
Punteggi del QI
I punteggi totali del QI sono stati ottenuti da tutti i 46 soggetti utilizzando la versione olandese di Wechsler Adult Intelligence Scale-III (WAIS-III)(Taylor e Heaton, 2001) e in alcuni casi WAIS-IV(Wechsler, 2008) e consistevano nei seguenti sottotest: informazioni, somiglianze, vocabolario, comprensione, disegno di blocchi, ragionamento a matrice, puzzle visivi, comprensione delle immagini, pesi delle figure, portata delle cifre, aritmetica, ricerca di simboli e codifica.
I test sono stati eseguiti nell’ambito di un esame neuropsicologico poco prima dell’intervento chirurgico, di solito entro una settimana.
Dati della risonanza magnetica e stima dello spessore corticale
Le immagini cerebrali ponderate T1 (spessore 1 mm) sono state acquisite con un sistema MR 3T (Signa HDXt, General Electric, Milwaukee, Wisconsin) come parte della valutazione pre-chirurgica (numero di fette = 170-180). La ricostruzione corticale e la segmentazione volumetrica sono state eseguite con la suite di analisi delle immagini Freesurfer(http://freesurfer.net)(Fischl and Dale, 2000). L’elaborazione ha incluso la correzione del movimento e la trasformazione al telaio di Talairach. Il calcolo dello spessore corticale è stato fatto come la distanza più vicina dal confine grigio/bianco al confine grigio/CSF in ogni vertice ed è stato basato sia sull’informazione dell’intensità che sulla continuità dell’intero volume tridimensionale MR(Fischl and Dale, 2000). Le etichette neuroanatomiche sono state automaticamente assegnate alle aree cerebrali in base alla parcellazione dell’atlante corticale di Destrieux come descritto in(Fischl et al., 2004). Per la media, le regioni nei lobi temporali sono state selezionate in base alla parcellazione dell’atlante corticale di Destrieux in ogni soggetto.
Preparazione delle fette
Al momento della resezione chirurgica, il blocco di tessuto corticale è stato immediatamente trasferito nel liquido spinale cerebrale artificiale (aCSF) contenente in (mM): 110 cloruro di colina, 26 NaHCO3, 10 D-glucosio, 11,6 ascorbato di sodio, 7 MgCl2, 3,1 piruvato di sodio, 2,5 KCl, 1,25 NaH2PO4 e 0,5 CaCl2 (300 mOsm) e trasportato al laboratorio di neurofisiologia (entro 500 m dalla sala operatoria). Il tempo di transizione tra la resezione del tessuto e l’inizio della preparazione delle fette era inferiore a 15 min. Dopo la rimozione del pia e l’identificazione dell’asse della materia bianca pia, sono state preparate fette neocorticali (350 μm di spessore) in soluzione ghiacciata di affettatura (stessa composizione come descritto sopra). Le fette sono state poi trasferite in camere di contenimento in cui sono stati conservati per 30 minuti a 34 °C e per 30 minuti a temperatura ambiente prima di registrare in aCSF, che conteneva (in mM): 125 NaCl; 3 KCl; 1,2 NaH2PO4; 1 MgSO4; 2 CaCl2; 26 NaHCO3; 10 D-glucosio (300 mOsm), gorgogliato con gas carbogeno (95% O2/5% CO2), come descritto in precedenza (Mohanet al., 2015; Testa-Silva et al., 2014; Testa-Silva et al., 2010; Verhoog et al., 2013; Verhoog et al., 2016).
Registrazioni elettrofisiologiche
Le fette corticali sono state visualizzate utilizzando la microscopia a contrasto di interferenza differenziale infrarossa (IR-DIC). Dopo che l’intera configurazione della cellula è stata stabilita, sono state registrate le risposte potenziali della membrana a passi di iniezione di corrente (dimensione del passo 30-50 pA). Nessuno dei neuroni ha mostrato l’attività spontanea epilettiforme spiking. Le registrazioni sono state effettuate utilizzando Multiclamp 700A / B amplificatori (Axon Instruments) campionamento a frequenze di 10 a 50 kHz, e passa basso filtrato a 10 a 30 kHz. Le registrazioni sono state digitalizzate dal software pClamp (Axon) e successivamente analizzate off-line utilizzando script Matlab scritti su misura (MathWorks). Pipette patch (3-5 MOhms) sono state estratte da capillari standard in borosilicato e riempite con soluzione intracellulare contenente (in mM): 110 K-gluconato; 10 KCl; 10 HEPES; 10 K-fosfocreatina; 4 ATP-Mg; 0,4 GTP, pH regolato a 7,3 con KOH; 285-290 mOsm, 0,5 mg/ml di biocitina. Tutti gli esperimenti sono stati eseguiti a 32-35 °C. Solo le cellule con equilibrio ponte di <20 MOhm sono stati utilizzati per ulteriori analisi.
Analisi morfologica
Durante le registrazioni elettrofisiologiche, le cellule sono state caricate con biocitina attraverso la pipetta di registrazione. Dopo le registrazioni le fette sono state fissate in paraformaldeide al 4% e le cellule registrate sono state rivelate con il cromogeno 3,3-diamminobenzidina (DAB) tetraidrocloruro utilizzando il metodo dell’avidina-biotina-perossidasi (Horikawae Armstrong, 1988). Le fette (350 μm di spessore) sono state montate su vetrini e incorporate in mowiol (Clariant GmbH, Francoforte sul Meno, Germania). Neuroni senza artefatti apparenti di affettatura e segnale uniforme di biocitina sono stati ricostruiti digitalmente utilizzando il software Neurolucida (Microbrightfield, Williston, VT, USA), utilizzando un obiettivo di olio × 100. Dopo la ricostruzione, le morfologie sono state controllate per una ricostruzione accurata in piani x/y/z, diametro dendritico e continuità dei dendriti. Infine, le ricostruzioni sono state controllate utilizzando una sovrapposizione in Adobe Illustrator tra la ricostruzione di Neurolucida e l’immagine di proiezione Z-stack della Surveyor Software (Chromaphor, Oberhausen, Germania). Sono stati inclusi solo neuroni con strutture dendritiche praticamente complete; sono state escluse le cellule con troncature importanti dovute alla procedura di taglio.
Strati superficiali neuroni piramidali sono stati identificati sulla base di criteri morfologici ed elettrofisiologici a profondità corticale entro 400-1400 µm dalla superficie corticale, che in precedenza abbiamo trovato corrispondere agli strati corticali 2, 3 e 4 negli esseri umani (Mohan etal., 2015). Per ogni neurone, abbiamo estratto la lunghezza dendritica totale (TDL) di tutti i dendriti basali e apicali e il numero di punti di diramazione e abbiamo calcolato la media TDL e il numero medio di punti diramazione per ogni soggetto, mettendo insieme i dati di tutte le cellule all’interno di un soggetto (da 1 a 10 neuroni per soggetto). Per l’analisi morfologica sono stati inclusi solo i neuroni senza tronchi maggiori di dendriti apicali mediante sezionamento dei tessuti(Mohan et al., 2015; Deitcher et al., 2017).
Modellazione dei NEURONI
In seguito a lavori precedenti(Eyal et al., 2014; Eyal et al., 2016) sono stati costruiti i “modelli Hodgkin e Huxley” (Hodgkine Huxley, 1952) di ciascuna delle cellule piramidali umane ricostruite. Ad ogni modello, un assone cilindrico (1 µm di diametro) è stato collegato al soma, costituito da un segmento iniziale dell’assone lungo 50 µm (AIS) e da una parte mielinizzata lunga 1 mm. L’AIS consisteva di 25 compartimenti elettrici, il resto dell’assone di 21 compartimenti. Le simulazioni sono state eseguite con il simulatore software open-source NEURON v.7.5(Carnevale e Hines, 2006)(https://neuron.yale.edu/neuron), con dt = 10 µs di tempo di integrazione a 37 °C. Tutti gli scomparti incorporano proprietà di membrana passiva, con capacità specifica Cm = 0,75 µF/cm2, resistenza assiale Ra = 0,1 MOhm/cm, resistenza specifica Rm = 30,3 MOhm/cm2, e correnti di dispersione con potenziale di inversione E = -70 mV. Nella parte mielinizzata dell’assone Cm è stata diminuita 37,5 volte e Rm è stata aumentata di 5 volte. In tutti i compartimenti dendritici, il Cm è stato aumentato dell’84% e il Rm è stato diminuito della stessa quantità per tenere conto delle spine dendritiche(Sarid et al., 2007; Benavides-Piccione et al., 2002). Le proprietà della membrana attiva consistevano in conduttanze ioniche di sodio (Na+) e potassio (K+) ritardante-riddrizzante ionico, prese dal database SenseLab ModelDB(McDougal et al., 2007; Benavides-Piccione et al,2017)(https://senselab.med.yale.edu/modeldb) e impostato su : gNa = 0 pS/µm2, gK = 0 pS/µm2 nell’assone mielinizzato, gNa = 8000 pS/µm2 e gK = 1500 pS/µm2 in AIS, gNa= 800 pS/µm2, gK = 320 pS/µm2 nel soma, e gNa = 20 pS/µm2 e gK = 10 pS/µm2 per i dendriti. I potenziali di inversione per le correnti Na+ e K+ erano rispettivamente di +50 mV e -85 mV. Le resistenze di ingresso risultanti erano 61,5±4,73 MOhm e i potenziali a riposo erano -70,5±0,02 mV. La velocità di avvio dei potenziali di azione simulati (APs) è stata calcolata come la pendenza dei potenziali di membrana V(t ) nel piano di fase (cioè V(t) vs dV/dt) a 10 mV/ms e mediata attraverso APs nei treni simulati.
Il “guadagno di trasferimento” dinamico ingresso-uscita (Linaroet al., 2018; Köndgen et al., 2008; Testa-Silva et al. , 2014) è stato determinato iniettando correnti di ingresso sinusoidali oscillanti per 120 s al soma, con ampiezza I1, frequenza F (1-1’000 cicli/s), una linea di base DC I0 ampiezza, e la componente fluttuante in modo casuale Irumore:(1)I(t)=I0+I1sin(2πFt)+Rumore(t)
Inoiset era un bianco-noise stocastico gaussiano filtrato in modo esponenziale (Arsiero et al. 2007), con significato zero, varianza s2 e lunghezza della correlazione τI = 5 ms, iterando ad ogni passo di simulazione:(2)Inoiset+dt=1-dt/τIInoiset+s2dt/τIξtwhere {ξt} è una sequenza di numeri gaussiani pseudo-casuali indipendenti. s2 è stata impostata in modo tale che l’iperpolarizzazione del potenziale di membrana ha portato a fluttuazioni potenziali sotto soglia di ~3mV a -75 mV. DC linea di base I0 è stato impostato in modo da indurre un tasso di cottura medio di ~10 spike/s. I1 è stato impostato a 1/6 di I0.
Tempi di cottura AP {tk} sono stati rilevati al soma e raccolti attraverso tutti i valori di F. Il ‘transfer gain’ di uscita
r1F ad una data frequenza F è stato definito come l’ampiezza dei numeri complessi in forma polare: (3)r1F=amplitude∑j=1Nexpj2πFtk/Ndove N è il numero di picchi e j è l’unità immaginaria. r1F è stato ulteriormente normalizzato tor1F0, con F0=3 ciclo/s. Il profilo di r1F assomigliava ad un filtro elettrico passa-basso, con frequenza di taglio Fc definita come la frequenza più alta alla quale1Fc=r1F0/2. Le forme d’onda di ingresso in Figura 4, inset, consisteva di tre componenti che variavano rapidamente per 240 s:(4)It=I0+I1sin2πF1t+sin2πF2t+sin2πF2t+sin2πF3t/3+Inoiset con F1= 200, F2= 300, F3= 450 ciclo/s.
Azione Analisi della forma d’onda potenziale delle registrazioni elettrofisiologiche
Le forme d’onda a potenziale d’azione (AP) sono state estratte da tracce di tensione registrate in risposta a iniezioni di corrente intracellulare e ordinate in base alla loro frequenza di accensione istantanea. La frequenza istantanea è stata determinata come 1/tempo rispetto all’AP precedente. Successivamente, tutti gli AP sono stati abbinati in contenitori a 10 Hz, mentre i primi AP di ogni traccia sono stati isolati in un contenitore separato.
La velocità di salita dell’AP è stata definita come il picco della derivata AP (dV/dt). Per ogni cella analizzata, gli AP rappresentativi con tutti i parametri sono stati tracciati per un controllo visivo al fine di evitare errori nell’analisi.
Per ogni neurone, i valori medi della velocità di salita degli AP in un determinato bin di frequenza sono stati ottenuti facendo la media di tutti gli AP all’interno di quel bin di frequenza. Le velocità relative di aumento dell’AP sono state calcolate dividendo la velocità media di aumento dell’AP in ogni intervallo di frequenze (1-10 Hz, 11-20 Hz, 21-30 Hz e 31-40 Hz) per la velocità media di aumento del primo AP (primi AP nel treno di AP).
Per ottenere i valori AP per ogni soggetto, i parametri AP all’interno di ogni bin di frequenza sono stati mediati per tutti i neuroni di un soggetto. Tutte le analisi degli AP sono state effettuate utilizzando script Matlab personalizzati (codice sorgente disponibile all’indirizzo https://github.com/INF-Rene/Morphys(Verhoog et al., 2018; copia archiviata all’indirizzo https://github.com/elifesciences-publications/Morphys).
Analisi statistica
La significatività statistica di tutte le correlazioni tra i parametri è stata determinata utilizzando la correlazione Pearson e la regressione lineare (utilizzando Matlab, versione R2017a, Mathworks). Poiché sono state misurate più celle per soggetto, le correlazioni sono state calcolate sui valori medi dei parametri per soggetto. Tutti i coefficienti di correlazione Pearson e i valori p per le correlazioni sono mostrati negli inserti delle figure, i coefficienti R2 e le dimensioni del campione sono mostrati nelle legende delle figure e nel testo principale.
Per l’analisi statistica dei dati AP, abbiamo diviso tutti i soggetti in base al loro QI in due gruppi: un gruppo con QI > 100 e un gruppo con QI < 100. Le differenze tra 2 gruppi di QI nei tempi di aumento del QI in AP sono state testate statisticamente utilizzando il t-test degli studenti. Per l’analisi di diversi gruppi di pazienti(Figura 1-figure supplements 2) è stato applicatoun test ANOVA per ogni parametro separatamente.
References
- Arsiero M, Lüscher HR, Lundstrom BN, Giugliano M. The impact of input fluctuations on the frequency-current relationships of layer 5 pyramidal neurons in the rat medial prefrontal cortex. Journal of Neuroscience. 2007; 27:3274-3284. DOI | PubMed
- Barrett P, Eysenck HJ, Lucking S. Reaction time and intelligence: A replicated study. Intelligence. 1986; 10:9-40. DOI
- Bekkers JM, Häusser M. Targeted dendrotomy reveals active and passive contributions of the dendritic tree to synaptic integration and neuronal output. PNAS. 2007; 104:11447-11452. DOI | PubMed
- Benavides-Piccione R, Ballesteros-Yáñez I, DeFelipe J, Yuste R. Cortical area and species differences in dendritic spine morphology. Journal of Neurocytology. 2002; 31:337-346. PubMed
- Bianchi S, Stimpson CD, Bauernfeind AL, Schapiro SJ, Baze WB, McArthur MJ, Bronson E, Hopkins WD, Semendeferi K, Jacobs B, Hof PR, Sherwood CC. Dendritic morphology of pyramidal neurons in the chimpanzee neocortex: regional specializations and comparison to humans. Cerebral Cortex. 2013; 23:2429-2436. DOI | PubMed
- Carnevale NT, Hines ML. The NEURON Book. Cambridge University Press: Cambridge; 2006.
- Chklovskii DB, Schikorski T, Stevens CF. Wiring optimization in cortical circuits. Neuron. 2002; 34:341-347. DOI | PubMed
- Choi YY, Shamosh NA, Cho SH, DeYoung CG, Lee MJ, Lee JM, Kim SI, Cho ZH, Kim K, Gray JR, Lee KH. Multiple bases of human intelligence revealed by cortical thickness and neural activation. Journal of Neuroscience. 2008; 28:10323-10329. DOI | PubMed
- Coleman JRI, Bryois J, Gaspar HA, Jansen PR, Savage JE, Skene N, Plomin R, Muñoz-Manchado AB, Linnarsson S, Crawford G, Hjerling-Leffler J, Sullivan PF, Posthuma D, Breen G. Biological annotation of genetic loci associated with intelligence in a meta-analysis of 87,740 individuals. Molecular Psychiatry. 2018; 533DOI
- de Ruiter JP. The influence of post-mortem fixation delay on the reliability of the Golgi silver impregnation. Brain Research. 1983; 266:143-147. DOI | PubMed
- Deary IJ, Penke L, Johnson W. The neuroscience of human intelligence differences. Nature Reviews Neuroscience. 2010; 11:201-211. DOI | PubMed
- Deary IJ, Pattie A, Starr JM. The stability of intelligence from age 11 to age 90 years: the Lothian birth cohort of 1921. Psychological science. 2013; 24:2361-2368. DOI | PubMed
- DeFelipe J, Alonso-Nanclares L, Arellano JI. Microstructure of the neocortex: comparative aspects. Journal of Neurocytology. 2002; 31:299-316. DOI | PubMed
- Deitcher Y, Eyal G, Kanari L, Verhoog MB, Atenekeng Kahou GA, Mansvelder HD, de Kock CPJ, Segev I. Comprehensive morpho-electrotonic analysis shows 2 distinct classes of l2 and l3 pyramidal neurons in human temporal cortex. Cerebral Cortex. 2017; 27:5398-5414. DOI | PubMed
- Der G, Deary IJ. The relationship between intelligence and reaction time varies with age: Results from three representative narrow-age age cohorts at 30, 50 and 69 years. Intelligence. 2017; 64:89-97. DOI | PubMed
- Elston GN, Benavides-Piccione R, DeFelipe J. The pyramidal cell in cognition: a comparative study in human and monkey. The Journal of Neuroscience. 2001; 21DOI | PubMed
- Elston GN. Cortex, cognition and the cell: new insights into the pyramidal neuron and prefrontal function. Cerebral Cortex. 2003; 13:1124-1138. DOI | PubMed
- Eyal G, Mansvelder HD, de Kock CP, Segev I. Dendrites impact the encoding capabilities of the axon. Journal of Neuroscience. 2014; 34:8063-8071. DOI | PubMed
- Eyal G, Verhoog MB, Testa-Silva G, Deitcher Y, Lodder JC, Benavides-Piccione R, Morales J, DeFelipe J, de Kock CPJ, Mansvelder HD, Segev I. Unique membrane properties and enhanced signal processing in human neocortical neurons. eLife. 2016; 5DOI
- Fischl B, Dale AM. Measuring the thickness of the human cerebral cortex from magnetic resonance images. PNAS. 2000; 97:11050-11055. DOI | PubMed
- Fischl B, van der Kouwe A, Destrieux C, Halgren E, Ségonne F, Salat DH, Busa E, Seidman LJ, Goldstein J, Kennedy D, Caviness V, Makris N, Rosen B, Dale AM. Automatically parcellating the human cerebral cortex. Cerebral Cortex. 2004; 14:11-22. DOI | PubMed
- Foverskov E, Mortensen EL, Holm A, Pedersen JLM, Osler M, Lund R. Socioeconomic position across the life course and cognitive ability later in life: the importance of considering early cognitive ability. Journal of Aging and Health. 2017; 1DOI
- Genç E, Fraenz C, Schlüter C, Friedrich P, Hossiep R, Voelkle MC, Ling JM, Güntürkün O, Jung RE. Diffusion markers of dendritic density and arborization in gray matter predict differences in intelligence. Nature Communications. 2018; 9DOI | PubMed
- Gow AJ, Johnson W, Pattie A, Brett CE, Roberts B, Starr JM, Deary IJ. Stability and change in intelligence from age 11 to ages 70, 79, and 87: the Lothian Birth Cohorts of 1921 and 1936. Psychology and Aging. 2011; 26:232-240. DOI | PubMed
- Hodgkin AL, Huxley AF. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 1952; 117:500-544. DOI | PubMed
- Horikawa K, Armstrong WE. A versatile means of intracellular labeling: injection of biocytin and its detection with avidin conjugates. Journal of Neuroscience Methods. 1988; 25:1-11. DOI | PubMed
- Hulshoff Pol HE, Schnack HG, Posthuma D, Mandl RC, Baaré WF, van Oel C, van Haren NE, Collins DL, Evans AC, Amunts K, Bürgel U, Zilles K, de Geus E, Boomsma DI, Kahn RS. Genetic contributions to human brain morphology and intelligence. Journal of Neuroscience. 2006; 26:10235-10242. DOI | PubMed
- Ikari K, Hayashi M. Aging in the neuropil of cerebral cortex–a quantitative ultrastructural study. Psychiatry and Clinical Neurosciences. 1981; 35:477-486. DOI | PubMed
- Ilin V, Malyshev A, Wolf F, Volgushev M. Fast computations in cortical ensembles require rapid initiation of action potentials. Journal of Neuroscience. 2013; 33:2281-2292. DOI | PubMed
- Jacobs B, Schall M, Prather M, Kapler E, Driscoll L, Baca S, Jacobs J, Ford K, Wainwright M, Treml M. Regional dendritic and spine variation in human cerebral cortex: a quantitative golgi study. Cerebral Cortex. 2001; 11:558-571. DOI | PubMed
- Karama S, Ad-Dab’bagh Y, Haier RJ, Deary IJ, Lyttelton OC, Lepage C, Evans AC, Brain Development Cooperative Group. Positive association between cognitive ability and cortical thickness in a representative US sample of healthy 6 to 18 year-olds. NeuroImage. 2009; 37:145-155. DOI
- Köndgen H, Geisler C, Fusi S, Wang XJ, Lüscher HR, Giugliano M. The dynamical response properties of neocortical neurons to temporally modulated noisy inputs in vitro. Cerebral Cortex. 2008; 18:2086-2097. DOI | PubMed
- Lam M, Trampush JW, Yu J, Knowles E, Davies G, Liewald DC, Starr JM, Djurovic S, Melle I, Sundet K, Christoforou A, Reinvang I, DeRosse P, Lundervold AJ, Steen VM, Espeseth T, Räikkönen K, Widen E, Palotie A, Eriksson JG, Giegling I, Konte B, Roussos P, Giakoumaki S, Burdick KE, Payton A, Ollier W, Chiba-Falek O, Attix DK, Need AC, Cirulli ET, Voineskos AN, Stefanis NC, Avramopoulos D, Hatzimanolis A, Arking DE, Smyrnis N, Bilder RM, Freimer NA, Cannon TD, London E, Poldrack RA, Sabb FW, Congdon E, Conley ED, Scult MA, Dickinson D, Straub RE, Donohoe G, Morris D, Corvin A, Gill M, Hariri AR, Weinberger DR, Pendleton N, Bitsios P, Rujescu D, Lahti J, Le Hellard S, Keller MC, Andreassen OA, Deary IJ, Glahn DC, Malhotra AK, Lencz T. Large-Scale Cognitive GWAS Meta-Analysis Reveals Tissue-Specific Neural Expression and Potential Nootropic Drug Targets. Cell Reports. 2017; 21:2597-2613. DOI | PubMed
- Linaro D, Biró I, Giugliano M. Dynamical response properties of neocortical neurons to conductance-driven time-varying inputs. European Journal of Neuroscience. 2018; 47:17-32. DOI | PubMed
- McDaniel M. Big-brained people are smarter: A meta-analysis of the relationship between in vivo brain volume and intelligence. Intelligence. 2005; 33:337-346. DOI
- McDougal RA, Morse TM, Carnevale T, Marenco L, Wang R, Migliore M, Miller PL, Shepherd GM, Hines ML. Twenty years of ModelDB and beyond: building essential modeling tools for the future of neuroscience. Journal of Computational Neuroscience. 2017; 42:1-10. DOI | PubMed
- Mohan H, Verhoog MB, Doreswamy KK, Eyal G, Aardse R, Lodder BN, Goriounova NA, Asamoah B, B Brakspear AB, Groot C, van der Sluis S, Testa-Silva G, Obermayer J, Boudewijns ZS, Narayanan RT, Baayen JC, Segev I, Mansvelder HD, de Kock CP. Dendritic and Axonal Architecture of Individual Pyramidal Neurons across Layers of Adult Human Neocortex. Cerebral Cortex. 2015; 25:4839-4853. DOI | PubMed
- Narr KL, Woods RP, Thompson PM, Szeszko P, Robinson D, Dimtcheva T, Gurbani M, Toga AW, Bilder RM. Relationships between IQ and regional cortical gray matter thickness in healthy adults. Cerebral Cortex. 2007; 17:2163-2171. DOI | PubMed
- Nemenman I, Lewen GD, Bialek W, de Ruyter van Steveninck RR. Neural coding of natural stimuli: information at sub-millisecond resolution. PLoS Computational Biology. 2008; 4DOI | PubMed
- Posthuma D, De Geus EJ, Baaré WF, Hulshoff Pol HE, Kahn RS, Boomsma DI. The association between brain volume and intelligence is of genetic origin. Nature Neuroscience. 2002; 5:83-84. DOI | PubMed
- Salinas E, Sejnowski TJ. Correlated neuronal activity and the flow of neural information. Nature Reviews Neuroscience. 2001; 2:539-550. DOI | PubMed
- Sarid L, Bruno R, Sakmann B, Segev I, Feldmeyer D. Modeling a layer 4-to-layer 2/3 module of a single column in rat neocortex: interweaving in vitro and in vivo experimental observations. PNAS. 2007; 104:16353-16358. DOI | PubMed
- Scholtens LH, Schmidt R, de Reus MA, van den Heuvel MP. Linking macroscale graph analytical organization to microscale neuroarchitectonics in the macaque connectome. Journal of Neuroscience. 2014; 34:12192-12205. DOI | PubMed
- Sniekers S. Genome-wide association meta-analysis of 78,308 individuals identifies new loci and genes influencing human intelligence. Nature Genetics. 2017; 11DOI
- Spearman C. "General Intelligence," Objectively Determined and Measured. The American Journal of Psychology. 1904; 15DOI
- Strenze T. Intelligence and socioeconomic success: A meta-analytic review of longitudinal research. Intelligence. 2007; 35:401-426. DOI
- Taylor MJ, Heaton RK. Sensitivity and specificity of WAIS-III/WMS-III demographically corrected factor scores in neuropsychological assessment. Journal of the International Neuropsychological Society : JINS. 2001; 7:867-874. PubMed
- Testa-Silva G, Verhoog MB, Goriounova NA, Loebel A, Hjorth J, Baayen JC, de Kock CP, Mansvelder HD. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2010; 2DOI | PubMed
- Testa-Silva G, Verhoog MB, Linaro D, de Kock CP, Baayen JC, Meredith RM, De Zeeuw CI, Giugliano M, Mansvelder HD. High bandwidth synaptic communication and frequency tracking in human neocortex. PLoS Biology. 2014; 12DOI | PubMed
- Trampush JW, Yang ML, Yu J, Knowles E, Davies G, Liewald DC, Starr JM, Djurovic S, Melle I, Sundet K, Christoforou A, Reinvang I, DeRosse P, Lundervold AJ, Steen VM, Espeseth T, Räikkönen K, Widen E, Palotie A, Eriksson JG, Giegling I, Konte B, Roussos P, Giakoumaki S, Burdick KE, Payton A, Ollier W, Horan M, Chiba-Falek O, Attix DK, Need AC, Cirulli ET, Voineskos AN, Stefanis NC, Avramopoulos D, Hatzimanolis A, Arking DE, Smyrnis N, Bilder RM, Freimer NA, Cannon TD, London E, Poldrack RA, Sabb FW, Congdon E, Conley ED, Scult MA, Dickinson D, Straub RE, Donohoe G, Morris D, Corvin A, Gill M, Hariri AR, Weinberger DR, Pendleton N, Bitsios P, Rujescu D, Lahti J, Le Hellard S, Keller MC, Andreassen OA, Deary IJ, Glahn DC, Malhotra AK, Lencz T. GWAS meta-analysis reveals novel loci and genetic correlates for general cognitive function: a report from the COGENT consortium. Molecular Psychiatry. 2017; 22:336-345. DOI | PubMed
- van den Heuvel MP, Scholtens LH, Feldman Barrett L, Hilgetag CC, de Reus MA. Bridging cytoarchitectonics and connectomics in human cerebral cortex. Journal of Neuroscience. 2015; 35:13943-13948. DOI | PubMed
- Verhoog MB, Goriounova NA, Obermayer J, Stroeder J, Hjorth JJ, Testa-Silva G, Baayen JC, de Kock CP, Meredith RM, Mansvelder HD. Mechanisms underlying the rules for associative plasticity at adult human neocortical synapses. The Journal of Neuroscience. 2013; 33:17197-17208. DOI | PubMed
- Verhoog MB, Obermayer J, Kortleven CA, Wilbers R, Wester J, Baayen JC, De Kock CP, Meredith RM, Mansvelder HD. Layer-specific cholinergic control of human and mouse cortical synaptic plasticity. Nature Communications. 2016; 7DOI | PubMed
- Verhoog T, Wilbers R, Heyer D. GitHub. https://github.com/INF-Rene/Morphys; 2018.
- Vernon P. Speed of information processing and general intelligence. Intelligence. 1983; 7:53-70. DOI
- Vetter P, Roth A, Häusser M. Propagation of action potentials in dendrites depends on dendritic morphology. Journal of Neurophysiology. 2001; 85:926-937. DOI | PubMed
- Wechsler D. 2008. Publisher Full Text
Fonte
Goriounova NA, Heyer DB, Wilbers R, Verhoog MB, Giugliano M, et al. () Large and fast human pyramidal neurons associate with intelligence. eLife 7e41714. https://doi.org/10.7554/eLife.41714





