Introduzione
Studi precedenti suggeriscono che i farmaci di uso comune, come gli antipertensivi,1 statine,23 antipsicotici,4 antiretrovirali,5 immunosoppressori,6 e corticosteroidi,7 aumentano il rischio di diabete mellito di tipo 2. Recenti scoperte89 mostrano che anche gli inibitori della 5α-reduttasi steroidi potrebbero essere implicati. Gli inibitori della 5α-reduttasi sono prescritti per il trattamento dell’iperplasia prostatica benigna (IPB), una malattia che colpisce circa il 50% degli uomini anziani. Questi farmaci sono di solito prescritti se gli α bloccanti sono stati inefficaci o se la ghiandola prostatica è sostanzialmente allargata.10 inibitori della 5α-reduttasi impediscono la conversione del testosterone nel più attivo 5α-diidrotestosterone e riducono la crescita della prostata androgena dipendente.11 Sono commercializzati due inibitori della 5α-reduttasi: la finasteride, la prima della classe, che inibisce selettivamente la 5α-reduttasi 2; e la dutasteride, che inibisce la 5α-reduttasi 2 e la 5α-reduttasi 1. Anche se la 5α-reduttasi 2 è altamente espressa nella prostata e nella pelle, la 5α-reduttasi 1 è attiva anche nei tessuti metabolici (fegato, adipe e muscolo scheletrico).8
Un recente studio di medicina sperimentale a breve termine ha dimostrato che la dutasteride induce resistenza all’insulina, un importante fattore di rischio per il diabete di tipo 2; tuttavia, né la finasteride né l’α bloccante tamsulosina hanno avuto questo effetto.8 Inoltre, la dutasteride somministrata per tre settimane promuove la steatosi epatica, anche se questo risultato non è stato trovato per la finasteride.9 Traish e colleghi hanno riferito un aumento della glicemia e dell’emoglobina glicata A1c dopo circa tre anni di trattamento con dutasteride, ma non hanno valutato l’effetto del finasteride.12 Questi risultati sono coerenti con l’aumento della suscettibilità all’obesità indotta dalla dieta, la ridotta tolleranza al glucosio e il fegato grasso riportati nel Srd5a1-/-topi; cambiamenti simili sono stati trovati in ratti obesi che ricevono inibitori della 5α-reduttasi.1314Gli uomini che necessitano di un trattamento farmacologico per l’IPB sono più anziani e più suscettibili al diabete di tipo 2, quindi i trattamenti che aggravano questo rischio dovrebbero essere evitati. Uno studio precedente che riportava un rischio minore di diabete di tipo 2 negli uomini che ricevevano inibitori della 5α-reduttasi non ha tenuto conto delle differenze metaboliche di base.15
Abbiamo indagato se il trattamento con dutasteride o finasteride aumenta il rischio di diabete di tipo 2 rispetto alla sola tamsulosina in due coorti di popolazione. Abbiamo anche confrontato il rischio di sviluppare il diabete di tipo 2 dopo il trattamento con dutasteride e il trattamento con finasteride.
Metodi
Coorte di scoperta
Abbiamo effettuato uno studio di coorte basato sulla popolazione utilizzando i dati del Clinical Practice Research Datalink (CPRD) del Regno Unito. Questo database contiene le cartelle cliniche longitudinali anonime di oltre 500 studi medici di base con 4,4 milioni di pazienti attivi. I dati sono stati raccolti dal 1987 e coprono circa il 7% della popolazione del Regno Unito; questi dati possono essere generalizzati a tutta la popolazione del Regno Unito.16
La nostra popolazione di studio comprendeva uomini di almeno 40 anni con una diagnosi registrata di IPB nelle loro note di medicina generale, o dutasteride, finasteride o tamsulosina prescritte. Questi pazienti sono stati registrati in cure primarie tra il 2003 e il 2014 (Leggere i codici, tabella supplementare S1A). I pazienti sono stati seguiti fino alla fine di dicembre 2014 e sono stati censurati se hanno subito un evento di esito, sono morti, hanno abbandonato la medicina generale durante il periodo di studio o hanno cambiato farmaco. Abbiamo escluso i pazienti che avevano ricevuto la prescrizione di finasteride o tamsulosina prima del 2003 o che avevano avuto una storia di cancro, diabete, abbassamento del glucosio per via orale o trattamento con insulina prima della data di riferimento (data della prima prescrizione di dutasteride, finasteride o tamsulosina).
Il nostro periodo di studio è stato di 11 anni di calendario (2003-14) e abbiamo incluso tre coorti che sono state identificate e seguite in modo simile. La prima coorte comprendeva pazienti che hanno ricevuto almeno due prescrizioni di dutasteride. Questi pazienti sono entrati nello studio alla data della prima prescrizione di dutasteride (data indice) e sono stati inclusi se sono rimasti nel database per almeno 90 giorni. I pazienti che passavano dal dutasteride al finasteride o agli α bloccanti sono stati censurati in quel momento. Abbiamo creato un gruppo separato di pazienti contemporaneamente prescritto dutasteride e tamsulosina, ma questi pazienti sono stati anche inclusi in una coorte “totale” insieme a quelli dutasteride prescritto da solo. Una seconda coorte comprendeva pazienti che hanno ricevuto almeno due prescrizioni di finasteride da soli o come una coorte “totale”, che comprendeva quelli che assumevano finasteride in combinazione con tamsulosina. Questi pazienti sono entrati nello studio alla data della prima prescrizione di finasteride (data indice) e sono stati inclusi se sono rimasti nel database per almeno 90 giorni. Una terza coorte comprendeva pazienti che avevano ricevuto almeno due prescrizioni di tamsulosina da soli. La tamsulosina è stata selezionata come α-bloccante rappresentativo perché è il più comune α-bloccante prescritto per la BPH, che è la sua unica indicazione. Questi pazienti sono entrati nello studio alla data della prima prescrizione di tamsulosina (data indice) e sono stati inclusi se sono rimasti nel database per almeno 90 giorni. Abbiamo escluso i pazienti a cui era stata prescritta la tamsulosina senza un codice di diagnosi registrato per l’IPB (classificazione internazionale delle malattie, nona revisione (ICD-9) codice 600).
Esito primario e covariate
L’esito primario è stato l’incidenza di un nuovo insorgenza di diabete di tipo 2 durante il periodo di follow-up (codici di lettura, tabella supplementare S1B), o la prescrizione di farmaci per l’abbassamento del glucosio per via orale o di insulina. Abbiamo confrontato l’incidenza del nuovo diabete di tipo 2 nella coorte dutasteride e finasteride contro la coorte tamsulosina e l’incidenza nella coorte dutasteride contro la coorte finasteride. I covariati comprendono l’età, lo stato di fumo, il consumo di alcol, l’indice di massa corporea e l’attività fisica alla data di riferimento e la durata dell’IPB; l’anamnesi di ipertensione, dislipidemia e broncopneumopatia cronica ostruttiva; l’uso di bloccanti β, diuretici, inibitori dell’enzima di conversione dell’angiotensina, bloccanti del recettore dell’angiotensina, statine e corticosteroidi orali nei tre anni precedenti; e lo stato di salute valutato dal numero di visite ambulatoriali tre mesi prima e tre mesi dopo la data di riferimento. Abbiamo definito la durata dell’IPB dalla data della prima registrazione dell’IPB alla data dell’indice. Per i pazienti che hanno iniziato il trattamento farmacologico senza una diagnosi di IPB registrata in precedenza, la durata è stata pari a zero.
Analisi dopo la corrispondenza della propensione
Abbiamo calcolato un punteggio di propensione per ogni paziente per ridurre al minimo la confusione per indicazione, quando i pazienti con altri fattori di rischio per il diabete di tipo 2 potrebbero avere maggiori probabilità di ricevere dutasteride. Abbiamo usato la regressione logistica per ottenere il punteggio di propensione, e le covariabili erano le variabili confondenti al basale (età, stato di fumo, consumo di alcol, indice di massa corporea, attività fisica e durata dell’IPB dalla prima diagnosi; storia di malattia polmonare ostruttiva cronica, ipertensione e dislipidemia; stato di salute valutato in base al numero di visite ambulatoriali tre mesi prima e tre mesi dopo la data dell’indice; uso di diuretici, inibitori degli enzimi di conversione dell’angiotensina, bloccanti dei recettori dell’angiotensina, bloccanti dei β, statine e corticosteroidi orali nei tre anni precedenti). Coorti di comparatori abbinati dal punteggio di propensione (entro ±0,05, che comprende fino a due controlli abbinati per ogni paziente esposto al dutasteride) sono stati creati utilizzando pazienti a cui è stata prescritta finasteride o tamsulosina dalla stessa pratica.
Coorte di replicazione
Lo studio è stato replicato utilizzando il National Health Insurance Research Database (NHIRD) di Taiwan, un database convalidato17 con oltre il 99% della popolazione registrata. Il NHIRD include dati demografici, informazioni per gli operatori sanitari e le strutture mediche, le registrazioni dei servizi sanitari e le richieste di rimborso spese per le cure ospedaliere e ambulatoriali e i dati relativi all’erogazione. Altri set di dati includono pazienti affetti da cancro, diabete, problemi dentali, malattie catastrofiche e malattie psichiatriche.
Il periodo di studio va dal 2002 al 2012. Il software ha estratto a caso tre milioni di pazienti dalla popolazione taiwanese totale di 23 milioni di abitanti. Abbiamo usato gli stessi criteri per le coorti, i partecipanti e gli esiti descritti per il database del CPRD. Solo un urologo ha prescritto finasteride e dutasteride, pertanto le registrazioni sul loro uso sono state considerate specifiche per la BPH. Abbiamo escluso i pazienti che hanno prescritto tamsulosina senza un codice di diagnosi registrato per l’IPB (codice ICD-9 600).
Risultato e covariate
Abbiamo definito l’esito del nuovo insorgenza del diabete di tipo 2 con la prima registrazione del diabete di tipo 2 (codici ICD-9 250.x0 o 250.x2) o l’uso di almeno un farmaco orale per il diabete. Abbiamo censurato i pazienti come per il CPRD. Le covariate includevano l’età e la durata dell’IPB dalla prima diagnosi; l’anamnesi di malattia polmonare ostruttiva cronica, ipertensione o dislipidemia; lo stato di salute valutato in base al numero di visite ambulatoriali tre mesi prima e tre mesi dopo la data dell’indice; e l’uso precedente di un anno (valutazione standard del precedente uso di farmaci nel database taiwanese18) di diuretici, statine, inibitori dell’enzima di conversione dell’angiotensina, bloccanti del recettore dell’angiotensina e corticosteroidi orali. Abbiamo eseguito il test di propensione nello stesso modo del database del CPRD, ma senza dati sull’indice di massa corporea, sullo stato del fumo, sul consumo di alcol e sull’attività fisica.
Analisi statistica
Abbiamo riassunto i dati come media (deviazione standard) o mediana (intervallo interquartile) per le variabili continue, e numero (percentuale) per le variabili categoriali. Le distribuzioni dei dati e le ipotesi del modello Cox sono state verificate prima dell’analisi utilizzando test di proporzionalità e grafici log-log. Abbiamo effettuato test χ 2, analisi a senso unico della varianza, e test di Kruskal-Wallis per le caratteristiche della linea di base. Il tempo dell’anno personale per ogni paziente è stato calcolato come il tempo che va dalla data dell’indice alla fine del follow-up. Abbiamo utilizzato modelli di pericolo proporzionali Cox prima e dopo la corrispondenza della propensione. Nel Regno Unito, i dati mancanti per l’indice di massa corporea, lo stato di fumo, il consumo di alcol e l’attività fisica sono stati classificati in un ulteriore gruppo e adattati nel modello finale per includere tutti i pazienti. Abbiamo eseguito trame di incidenza cumulative e test di log rank per confrontare i risultati tra le coorti. Le analisi sono state effettuate utilizzando il software SAS, versione 9.4 (Cary, NC).
Coinvolgimento del paziente e del pubblico
Questa ricerca è stata eseguita senza il coinvolgimento del paziente. Ringraziamo i pazienti per aver permesso che le loro cartelle fossero conservate nei database. Abbiamo incluso i pazienti nella nostra strategia di divulgazione.
Risultati
Coorte di scoperta: CPRD
Un totale di 69-794 pazienti hanno ricevuto almeno due prescrizioni di dutasteride, finasteride o tamsulosina (fig. 1). Dopo che abbiamo applicato le esclusioni, sono rimasti 55-275 partecipanti; 39-005 pazienti che utilizzavano inibitori della 5α-reduttasi sono stati inclusi (8231 dutasteride e 30-774 finasteride) e 16-270 che ricevevano tamsulosina. Al basale, i pazienti che ricevevano dutasteride o finasteride erano più anziani, avevano più comorbidità, ad eccezione della dislipidemia, e usavano più corticosteroidi orali e farmaci cardiovascolari di quelli che ricevevano tamsulosina(tabella 1). Ci sono state meno differenze nelle caratteristiche di base tra i gruppi dutasteride e finasteride, senza differenze nell’indice di massa corporea. Quando abbiamo incluso i pazienti che hanno ricevuto dutasteride combinata con tamsulosina o finasteride combinata con tamsulosina i numeri sono aumentati rispettivamente di 599 e 2622, ma le caratteristiche di base non sono cambiate in modo sostanziale (tabella supplementare S2).
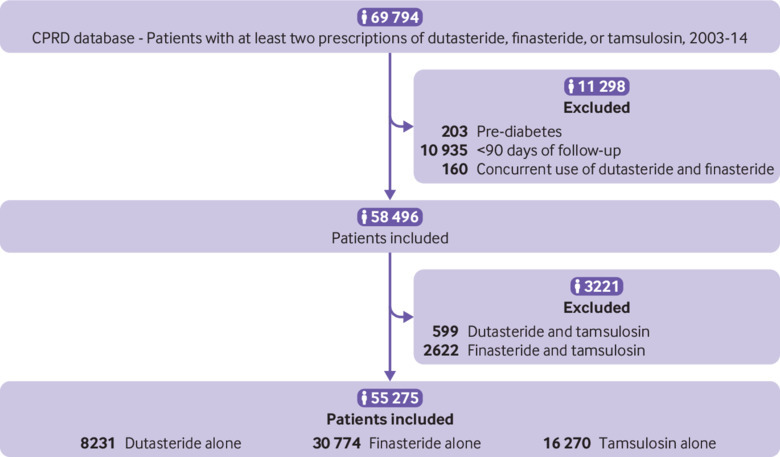
Fig. 1.Diagramma di flusso che mostra le coorti di studio del Regno Unito Clinical Practice Research Datalink (CPRD)
| Caratteristiche | Prima della corrispondenza del punteggio di propensione | Dopo la corrispondenza del punteggio di propensione | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Dutasteride (n=8231) | Finasteride (n=30-774) | Tamsulosina (n=16-270) | Valore P | Dutasteride (n=2090) | Finasteride (n=3445) | Tamsulosina (n=4018) | Valore P | ||
| Età (anni) | 71.9 (9.8) | 72.2 (10.9) | 69.1 (10.3) | <0.01 | 71.3 (9.2) | 72.1 (9.1) | 71.2 (9.3) | <0.01 | |
| Categoria indice di massa corporea*: | |||||||||
| <18.5 | 46 (0.7) | 183 (0.7) | 91 (0.6) | 0.01 | 13 (0.7) | 17 (0.6) | 29 (0.8) | 0.48 | |
| 18.5-25 | 2443 (34.9) | 9028 (34.9) | 4794 (33.6) | 644 (35.3) | 1022 (34.6) | 1231 (35.0) | |||
| 25-30 | 3282 (46.9) | 11 913 (46.1) | 6846 (48.1) | 876 (48.1) | 1423 (48.1) | 1680 (47.7) | |||
| >30 | 1229 (17.5) | 4944 (18.3) | 2518 (17.7) | 290 (15.9) | 496 (16.8) | 581 (16.5) | |||
| Fumatore*: | |||||||||
| Sì | 849 (10.7) | 3292 (11.3) | 1859 (11.8) | <0.01 | 221 (10.9) | 337 (10.3) | 461 (11.9) | 0.08 | |
| No | 3772 (47.6) | 13 356 (45.9) | 7485 (47.4) | 976 (48.3) | 1515 (46.1) | 1810 (46.5) | |||
| Esordiente | 3311 (41.7) | 12 447 (42.8) | 6458 (40.9) | 826 (40.8) | 1431 (43.6) | 1618 (41.6) | |||
| Attività fisica*: | |||||||||
| Inattivo | 378 (9.8) | 1335 (9.8) | 699 (9.6) | <0.01 | 87 (8.6) | 122 (7.7) | 191 (9.6) | 0.04 | |
| Delicato | 1418 (36.8) | 5321 (39.0) | 2636 (34.1) | 358 (35.4) | 628 (39.5) | 709 (35.6) | |||
| Moderato | 1861 (48.2) | 6333 (46.4) | 3917 (50.7) | 508 (50.2) | 764 (48.0) | 965 (48.4) | |||
| Vigoroso | 201 (5.2) | 650 (4.8) | 473 (6.1) | 59 (5.8) | 77 (4.8) | 129 (65) | |||
| Consumo di alcolici*: | <0.01 | ||||||||
| Sì | 5915 (82.2) | 21 879 (82.5) | 12 233 (84.4) | 1563 (84.8) | 2520 (84.0) | 3061 (84.8) | 0.94 | ||
| No | 1061 (14.7) | 3831 (14.4) | 1850 (12.8) | 232 (12.6) | 395 (13.2) | 454 (1267) | |||
| Esordiente | 220 (3.1) | 820 (3.1) | 416 (2.9) | 49 (2.7) | 84 (2.8) | 96 (2.7) | |||
| Durata media (intervallo interquartile) della BPH (giorni)* | 14 (0-1476) | 13 (0-1384) | 56 (27-892) | <0.01 | 16 (0-1521) | 17 (0-1523) | 56 (26-1110) | <0.01 | |
| Anamnesi della malattia (No (%)): | |||||||||
| ■COPD | 633 (7.7) | 2571 (8.4) | 1169 (7.2) | <0.01 | 159 (7.6) | 271 (7.9) | 332 (8.3) | 0.63 | |
| Dislipidemia | 1235 (15.0) | 4294 (14.0) | 2711 (16.7) | <0.01 | 342 (16.4) | 590 (17.1) | 657 (16.4) | 0.62 | |
| Ipertensione | 2820 (34.3) | 1114 (36.1) | 5241 (32.2) | <0.01 | 717 (34.3) | 1217 (35.3) | 1457 (36.3) | 0.30 | |
| Altro uso di droga (No (%))†: | |||||||||
| Bloccante β | 2179 (26.5) | 7662 (24.9) | 3471 (21.3) | <0.01 | 538 (25.7) | 834 (24.2) | 936 (23.3) | 0.11 | |
| STATINO | 3277 (39.8) | 11 704 (38.0) | 5871 (36.1) | <0.01 | 768 (36.7) | 1267 (36.8) | 1551 (38.6) | 0.18 | |
| Inibitore dell’ACE | 2246 (27.3) | 8644 (28.1) | 3844 (23.6) | <0.01 | 524 (25.1) | 913 (26.5) | 1063 (26.5) | 0.43 | |
| AARB | 829 (10.1) | 2848 (9.3) | 1359 (8.4) | <0.01 | 183 (8.8) | 321 (9.3) | 397 (9.9) | 0.35 | |
| Diuretico | 2445 (29.7) | 9315 (30.3) | 3669 (22.6) | <0.01 | 584 (27.9) | 956 (27.8) | 1044 (26.0) | 0.13 | |
| Corticosteroide orale | 886 (10.7) | 3095(10.1) | 1497 (9.2) | <0.01 | 222 (10.6) | 319 (9.3) | 420 (10.5) | 0.15 | |
| Numero di contatti GP‡ | 10.5 (2.2) | 10.2 (2.3) | 10.0 (2.4) | <0.01 | 10.4 (2.3) | 10.1 (2.4) | 10.2 (2.3) | <0.01 | |

Fig. 1.Diagramma di flusso che mostra le coorti di studio del Regno Unito Clinical Practice Research Datalink (CPRD)
Analisi della coorte principale del CPRD
Abbiamo registrato 2081 nuovi eventi di diabete di tipo 2 (368, 1207 e 506 per i gruppi dutasteride, finasteride e tamsulosina, rispettivamente) durante un follow-up medio di 5,2 (SD 3,1) anni (5,9 (3,1), 5,1 (3,2) e 5,2 (3,1) per dutasteride, finasteride e tamsulosina, rispettivamente). Le coorti che ricevono dutasteride combinata con tamsulosina o finasteride combinata con tamsulosina hanno aggiunto altri 27 e 82 eventi, rispettivamente. Pertanto, ci sono stati 395 e 1289 eventi nelle coorti “totali” per la dutasteride e la finasteride, rispettivamente.
Il tasso di eventi è stato di 76,2 per 10.000 anni persona (intervallo di confidenza del 95% da 68,4 a 84,0) per la dutasteride e 76,6 (da 72,3 a 80,9) per la finasteride rispetto a 60,3 (da 55,1 a 65,5) per la tamsulosina. L’incidenza cumulativa di sviluppare il diabete di tipo 2 (P<0,01) è stata maggiore nelle coorti dutasteride e finasteride rispetto alla tamsulosina (fig2). Tassi di eventi simili sono stati osservati nelle coorti “totali”: 76,6 (da 69,0 a 84,1) per la dutasteride totale e 76,1 (da 71,9 a 80,2) per la finasteride totale. Il rischio di sviluppare il diabete di tipo 2 è stato di nuovo più elevato per i pazienti che hanno ricevuto dutasteride o finasteride rispetto alla tamsulosina(tabella 2). L’aumento del rischio di diabete di tipo 2 non è stato diverso tra i pazienti che hanno ricevuto dutasteride o finasteride da soli o quando abbiamo incluso i pazienti che hanno ricevuto questi farmaci in combinazione con la tamsulosina(tabella 2; fig. 2).
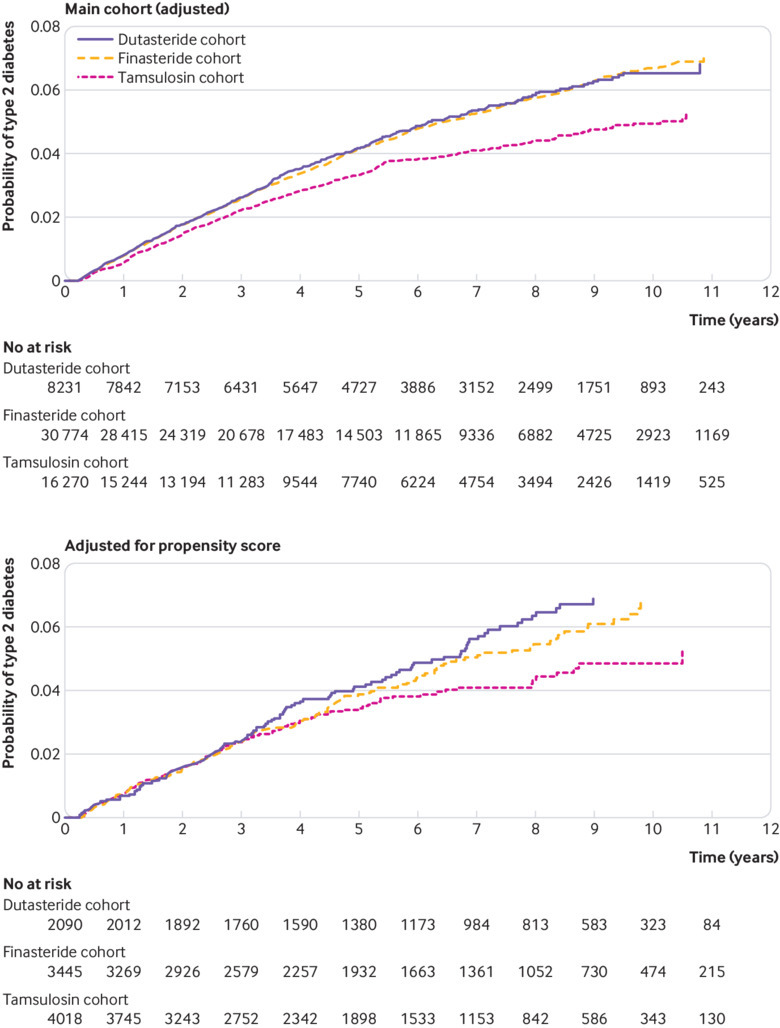
Fig 2.Incidenza cumulativa del diabete di tipo 2 nella coorte dei Datalink della Clinical Practice Research nel periodo di studio: coorte principale (corretta), e corretta per il punteggio di propensione
| Coorte | Analisi primaria | Corrispondente al punteggio di propensione | ||
|---|---|---|---|---|
| Rapporto di pericolo non regolato (95% CI) | Rapporto di pericolo regolato* (95% CI) | Rapporto di pericolo regolato (95% CI) | ||
| CPRD: | ||||
| Finasteride da solo contro tamsulosina da solo. | 1,28 (da 1,15 a 1,42) | 1,26 (da 1,10 a 1,45) | 1,22 (da 0,95 a 1,57) | |
| Solo dutasteride v tamsulosina | 1,29 (da 1,13 a 1,48) | 1,32 (1,08 a 1,61) | 1,34 (1,02 a 1,75) | |
| Solo dutasteride v finasteride | 1,00 (da 0,89 a 1,13) | 1,07 (da 0,87 a 1,31) | 1,08 (0,83 a 1,40) | |
| ■Totale finasteride† v tamsulosina da sola | 1,27 (1,14 a 1,40) | 1,22 (1,07 a 1,39) | 1,32 (1,06 a 1,64) | |
| Totale dutasteride† v tamsulosina da sola | 1,29 (da 1,13 a 1,48) | 1,32 (1,09 a 1,58) | 1,34 (1,05 a 1,71) | |
| ðTotale dutasteride† v finasteride totale† | 1,02 (0,91 a 1,14) | 1,08 (da 0,90 a 1,31) | 1,04 (da 0,82 a 1,31) | |
| NHIRD: | ||||
| Finasteride da solo v tamsulosina da solo | 1,47 (1,36 a 1,59) | 1,49 (1,38 a 1,61) | 1,61 (da 1,46 a 1,80) | |
| Solo dutasteride v tamsulosina | 1,55 (da 1,35 a 1,78) | 1,34 (da 1,17 a 1,54) | 1,18 (da 1,00 a 1,40) | |
| Solo dutasteride v finasteride | 1,06 (da 0,90 a 1,24) | 0,90 (da 0,77 a 1,06) | 0,94 (da 0,80 a 1,11) | |
| ■Totale finasteride† v tamsulosina da sola | 1,49 (da 1,39 a 1,60) | 1,50 (da 1,39 a 1,62) | 1,48 (1,34 a 1,63) | |
| Totale dutasteride† v tamsulosina da sola | 1,32 (da 1,15 a 1,51) | 1,34 (da 1,17 a 1,53) | 1,18 (1,01 a 1,40) | |
| ðTotale dutasteride† v finasteride totale† | 1,05 (da 0,90 a 1,21) | 0,89 (da 0,77 a 1,03) | 0,82 (0,67 a 0,99) | |

Fig. 2.Incidenza cumulativa del diabete di tipo 2 nella coorte Datalink della Clinical Practice Research nel periodo di studio: coorte principale (aggiustata), e aggiustata per il punteggio di propensione
Analisi della corrispondenza del punteggio di propensione
Abbiamo incluso 9553 pazienti (2090 dutasteride, 3445 finasteride e 4018 tamsulosina) nel punteggio di propensione corrispondente e la maggior parte delle caratteristiche di base (in particolare l’indice di massa corporea) non differivano(tabella 1). La durata dell’IPB è stata più lunga per il gruppo tamsulosina che per i gruppi dutasteride e finasteride.
Durante un tempo medio di follow-up di 5,7 (SD 3,2) anni (6,5 (3,1), 5,9 (5,8) e 5,1 (4,7) per dutasteride, finasteride e tamsulosina, rispettivamente), sono stati registrati 105, 127 e 144 nuovi eventi di diabete di tipo 2 di insorgenza. Il tasso di eventi per 10.000 anni per persona è stato di 77,2 (intervallo di confidenza del 95% da 62,5 a 91,9) per la dutasteride, 71,3 (da 59,7 a 82,9) per la finasteride e 62,0 (da 51,2 a 72,7) per la tamsulosina. Il rischio di diabete di tipo 2 è stato maggiore nei pazienti che hanno ricevuto dutasteride rispetto a quelli che hanno ricevuto tamsulosina (aumento dell’incidenza cumulativa; fig. 2), con un rapporto di rischio stimato in punti pari a 1,34 (intervallo di confidenza del 95% da 1,02 a 1,75). Dopo la corrispondenza del punteggio di propensione, il tasso di diabete di tipo 2 nella coorte finasteride non differisce più dal tasso di tamsulosina (1,22; da 0,95 a 1,57; tabella 2). Tuttavia, vi è stato un aumento del rischio di diabete di tipo 2 per il diabete di tipo 2 nella coorte totale. Anche in questo caso, il rischio non è stato diverso tra dutasteride e finasteride quando è stato prescritto da solo (1,08; da 0,83 a 1,40) o quando abbiamo incluso i pazienti che hanno ricevuto questi farmaci in combinazione con la tamsulosina (1,04; da 0,82 a 1,31).
Coorte di replicazione: NHIRD
Lafigura 3 mostra la selezione della coorte per il NHIRD, e la tabella 3 (farmaci singoli prescritti) e la tabella supplementare S3 (coorti totali che ricevono farmaci singoli o trattamento combinato con tamsulosina) presentano le caratteristiche di base. I pazienti taiwanesi erano più giovani dei pazienti britannici e assumevano meno farmaci per le indicazioni cardiovascolari, ma più corticosteroidi per via orale. Analogamente ai pazienti del Regno Unito, i pazienti taiwanesi che ricevono tamsulosina erano leggermente più giovani di quelli che ricevono dutasteride o finasteride. Più pazienti avevano dislipidemia nel gruppo dei dutasteridi.
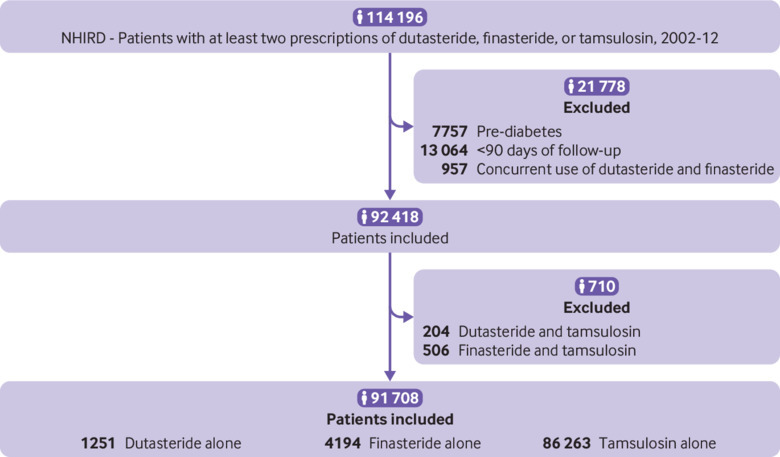
Fig. 3.Diagramma di flusso che mostra le coorti di studio del National Health Insurance Research Database (NHIRD) di Taiwan
| Caratteristiche | Prima della corrispondenza del punteggio di propensione | Dopo la corrispondenza del punteggio di propensione | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Dutasteride (n=1251) | Finasteride (n=4194) | Tamsulosina (n=86-263) | Valore P | Dutasteride (n=1251) | Finasteride (n=2445) | Tamsulosina (n=2502) | Valore P | ||
| Età (anni) | 68.5 (10.1) | 68.3 (10.5) | 65.7 (11.6) | <0.01 | 68.5 (10.1) | 68.4 (10.7) | 68.3 (10.4) | 0.07 | |
| Categoria indice di massa corporea*: | |||||||||
| <18.5 | NA | NA | NA | NA | NA | NA | NA | NA | |
| 18.5-25 | NA | NA | NA | NA | NA | NA | NA | NA | |
| 25-30 | NA | NA | NA | NA | NA | NA | NA | NA | |
| >30 | NA | NA | NA | NA | NA | NA | NA | NA | |
| Stato del fumo*: | |||||||||
| Sì | NA | NA | NA | NA | NA | NA | NA | NA | |
| No | NA | NA | NA | NA | NA | NA | NA | NA | |
| Esordiente | NA | NA | NA | NA | NA | NA | NA | NA | |
| Attività fisica*: | |||||||||
| Inattivo | NA | NA | NA | NA | NA | NA | NA | NA | |
| Delicato | NA | NA | NA | NA | NA | NA | NA | NA | |
| Moderati | NA | NA | NA | NA | NA | NA | NA | NA | |
| Vigoroso | NA | NA | NA | NA | NA | NA | NA | NA | |
| Consumo di alcolici*: | |||||||||
| Sì | NA | NA | NA | NA | NA | NA | NA | NA | |
| No | NA | NA | NA | NA | NA | NA | NA | NA | |
| Esordiente | NA | NA | NA | NA | NA | NA | NA | NA | |
| Durata media (intervallo interquartile) della BPH (giorni)* | 30 (0-250) | 28 (0-212) | 21 (39-724) | <0.01 | 30 (0-250) | 28 (0-161) | 44 (0-372) | <0.01 | |
| Anamnesi della malattia (No (%)) | |||||||||
| ■COPD | 106 (8.5) | 415 (9.9) | 7491 (8.7) | <0.01 | 106 (8.5) | 210 (8.6) | 210 (8.4) | 0.66 | |
| Dislipidemia | 284 (22.7) | 630 (15) | 14 609 (16.9) | <0.01 | 284 (22.7) | 545 (22.3) | 588 (23.5) | 0.61 | |
| Ipertensione | 631 (50.4) | 1829 (43.6) | 36 653 (42.5) | <0.01 | 631 (50.4) | 1269 (51.9) | 1231 (49.2) | 0.11 | |
| Altro uso di droga (No (%))†: | |||||||||
| β bloccante | 328 (26.2) | 1024 (24.4) | 20 868 (24.2) | <0.01 | 328 (26.2) | 645 (26.4) | 668 (26.7) | 0.71 | |
| STATINO | 226 (18.1) | 407 (9.7) | 968 (11.2) | <0.01 | 226 (18.1) | 369 (15.1) | 503 (20.1) | 0.09 | |
| Inibitore dell’ACE | 300 (24.0) | 956 (22.8) | 17 252 (20.0) | <0.01 | 300 (24.0) | 619 (25.3) | 535 (21.4) | 0.12 | |
| AARB | 131 (10.5) | 481 (11.5) | 8799 (10.2) | <0.01 | 131 (10.5) | 276 (11.3) | 270 (10.8) | 0.64 | |
| Diuretico | 168 (13.5) | 620 (14.8) | 12 718 (14.7) | <0.01 | 168 (13.5) | 296 (12.1) | 353 (14.1) | 0.43 | |
| Corticosteroide orale | 342 (27.3) | 1095 (26.1) | 24 177 (28.0) | <0.01 | 342 (27.3) | 719 (29.4) | 681 (27.2) | 0.14 | |
| Numero di visite ambulatoriali‡ | 11.6 (8.8) | 9.9 (9.6) | 10.3 (9.2) | <0.01 | 11.6 (8.8) | 10.2 (10.2) | 11.2 (10.4) | <0.01 | |

Fig. 3.Fig. 3. Diagramma di flusso che mostra le coorti di studio della Banca dati nazionale taiwanese di ricerca sull’assicurazione sanitaria (NHIRD)
Analisi della principale coorte taiwanese
Abbiamo registrato 1028 nuovi eventi di diabete di tipo 2 (21, 68 e 939 per dutasteride, finasteride e tamsulosina, rispettivamente) durante un tempo medio di follow-up di 3,1 (SD 4,5) anni (2,2 (3,2), 3,4 (4,7) e 2,9 (4,5) per dutasteride, finasteride e tamsulosina). Il tasso di evento per 10.000 anni per persona è stato di 152,8 (intervallo di confidenza del 95% da 144,5 a 161,5) per la dutasteride e 109,1 (da 105,9 a 112,5) per la finasteride rispetto a 74,7 (da 74,2 a 75,2) per la tamsulosina. I tassi di evento per le coorti totali sono stati simili (155,2, da 142,1 a 169,1 per la dutasteride combinata con la tamsulosina; 111,3, da 97,1 a 127,7 per la finasteride combinata con la tamsulosina).
Il rischio di sviluppare il diabete di tipo 2(tabella 2) è stato più elevato per i pazienti che hanno ricevuto dutasteride o finasteride rispetto alla tamsulosina (rapporto di rischio corretto 1,34, intervallo di confidenza del 95% da 1,17 a 1,54; e 1,49, da 1,38 a 1,61, rispettivamente), ma il rischio per dutasteride e finasteride non è stato diverso (0,90, da 0,77 a 1,06). La figura 4 mostra l’aumento dell’incidenza cumulativa del diabete di tipo 2. I risultati sono stati simili nelle coorti totali quando abbiamo incluso i pazienti che hanno ricevuto un trattamento combinato(tabella 2).
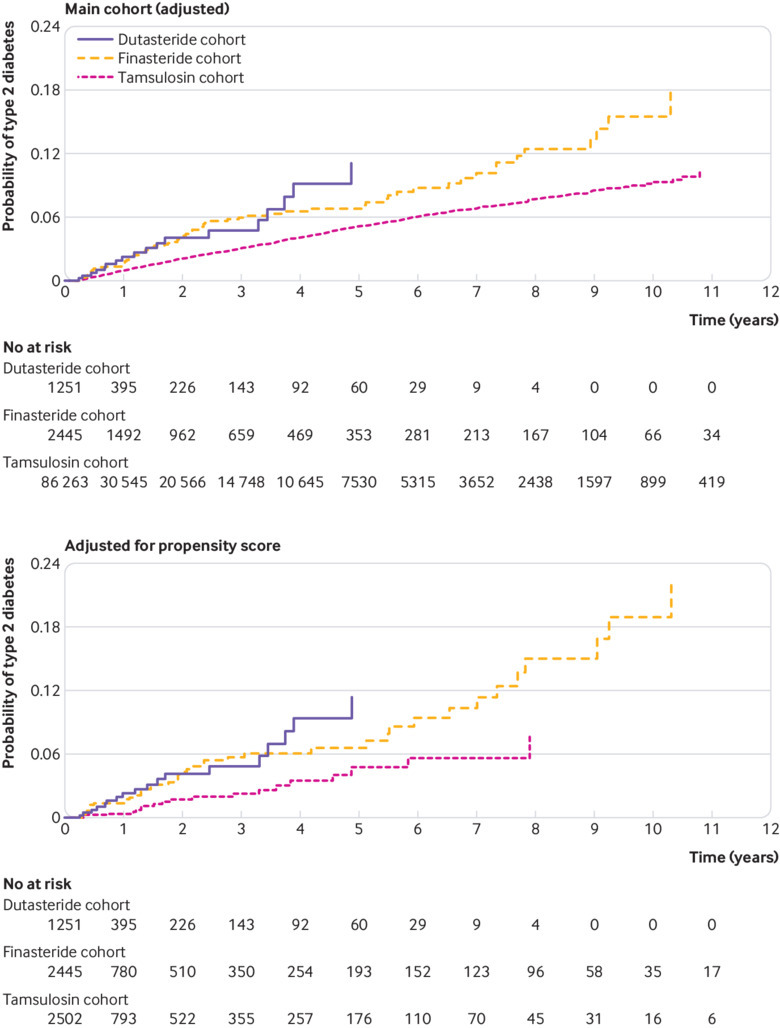
Fig. 4.Incidenza cumulativa del diabete mellito di tipo 2 nella coorte del National Health Insurance Research Database di Taiwan nel periodo di studio: coorte principale (corretto), e corretto per il punteggio di propensione

Fig. 4.Incidenza cumulativa del diabete mellito di tipo 2 nella coorte di ricerca del National Health Insurance Research Database di Taiwan nel periodo di studio: coorte principale (corretto), e corretto per il punteggio di propensione
Analisi della corrispondenza del punteggio di propensione
Abbiamo incluso 6198 pazienti (1251 dutasteride, 2445 finasteride e 2502 tamsulosina) nella corrispondenza del punteggio di propensione. Le caratteristiche di base erano simili tra le coorti(tabella 3).
I tempi medi di follow-up sono stati di 2,9 (SD 3,4) anni (2,2 (3,2), 3,2 (3,5) e 2,9 (3,3) per dutasteride, finasteride e tamsulosina, rispettivamente). I tassi di eventi associati per 10.000 anni per persona per il diabete di tipo 2 sono stati 152,8 (intervallo di confidenza del 95% da 144,5 a 161,5), 111,4 (da 107,1 a 115,8) e 79,7 (da 76,6 a 82,9), con 21, 35 e 25 nuovi eventi di insorgenza registrati. Il rischio di diabete di tipo 2 nei pazienti che hanno ricevuto dutasteride e finasteride è stato maggiore rispetto a quelli che hanno ricevuto tamsulosina: rapporto di rischio 1,18 (intervallo di confidenza del 95% da 1,00 a 1,40) e 1,61 (da 1,46 a 1,80), rispettivamente; tuttavia, il rischio non è stato diverso tra dutasteride e finasteride (0,94, da 0,80 a 1,11; tabella 2). La figura 4 mostra l’aumento dell’incidenza cumulativa del diabete di tipo 2. Questi risultati sono stati corroborati dai risultati per le coorti totali, che includevano anche pazienti che ricevevano trattamenti combinati(tabella 2).
Discussione
Precedenti studi a breve termine suggeriscono che la dutasteride, ma non la finasteride, potrebbe aumentare il rischio di diabete di tipo 2 compromettendo la sensibilità all’insulina e aumentando la steatosi.89131419Le nostre analisi farmacoepidemiologiche mostrano che l’incidenza del diabete di tipo 2 è aumentata nei pazienti con BPH che ricevono dutasteride rispetto alla tamsulosina, ma un rischio maggiore è stato riscontrato anche nei pazienti che ricevono finasteride. Nel Regno Unito, ogni 10.000 anni di trattamento per persona, il diabete di tipo 2 si verifica in 76 pazienti trattati con dutasteride o finasteride, ma solo in 60 pazienti trattati con tamsulosina. Questi dati sono paragonabili all’aumento dell’incidenza del diabete di tipo 2 con l’uso di statina.2 Il rischio che abbiamo identificato è modesto, ma coerente tra le due popolazioni dello studio. Abbiamo eseguito un’analisi di sensibilità per corrispondenza del punteggio di propensione per le differenze nelle variabili di base, tra cui l’indice di massa corporea e l’uso di statina, e l’aumento del rischio di sviluppare il diabete di tipo 2 è rimasto. I nostri risultati sono stati replicati nella coorte taiwanese: abbiamo registrato 78 e 35 eventi extra per ogni 10.000 anni di trattamento per dutasteride e finasteride, rispettivamente, rispetto alla tamsulosina, a fronte di una maggiore incidenza complessiva di diabete di tipo 2 nella popolazione taiwanese. Abbiamo osservato questo aumento del rischio sia che la dutasteride o la finasteride sia stata prescritta da sola o combinata con la tamsulosina.
Punti di forza e di debolezza di questo studio
Uno dei punti di forza di questo studio è stato il disegno della coorte. Abbiamo utilizzato due grandi database sanitari con popolazioni etniche diverse e abbiamo fatto degli aggiustamenti per i noti confonditori. I nostri risultati riflettono la prassi sanitaria abituale nel Regno Unito e possono essere generalizzati ad altre popolazioni. Ciononostante, sono emerse differenze nella pratica tra i due Paesi. Il sistema sanitario di Taiwan non ha divisioni di assistenza primaria e secondaria e pone meno enfasi sullo screening sanitario e sui trattamenti preventivi, come le statine. I tassi complessivi di incidenza del diabete di tipo 2 sono stati più elevati a Taiwan che nel Regno Unito, con pazienti più giovani colpiti. Questo dato è coerente con il fatto che le popolazioni asiatiche hanno tassi di incidenza del diabete di tipo 2 più elevati rispetto alle popolazioni europee.202122Il database taiwanese non contiene dati relativi all’indice di massa corporea, allo stato di fumo e al consumo di alcol, e non siamo riusciti a controllare questi potenziali pregiudizi. L’indice di massa corporea è un potenziale fattore di rischio confondente per il diabete di tipo 2, ma il rischio comparabile per entrambi gli inibitori della 5α-reduttasi persisteva nella coorte del CPRD dopo l’aggiustamento e dopo l’effettiva corrispondenza per punteggio di propensione. Inoltre, abbiamo condotto un’ulteriore analisi di sopravvivenza con una variabile dipendente dal tempo dell’indice di massa corporea e i risultati rimangono simili (tabella supplementare S4). Nel NHIRD mancano anche informazioni dettagliate su fattori socioeconomici, comportamenti di vita, imaging e dati biochimici. Il periodo di follow-up è stato più breve a Taiwan e potrebbe riflettere le differenze nelle pratiche di prescrizione o nell’impostazione dell’assistenza sanitaria. Abbiamo utilizzato il metodo consolidato di raggruppare tutti i dati mancanti in un’unica categoria nel modello finale, piuttosto che l’imputazione multipla; l’imputazione multipla fa presupporre che i dati mancanti siano casuali, il che spesso non è il caso dei dati medici.
Lo studio presentava alcuni punti deboli. Potrebbe esistere una classificazione errata della codifica per le esposizioni, i risultati e le covariate, anche se le prove precedenti attestano l’accuratezza dei dati CPRD16 e NHIRD.172324Le valutazioni sono state effettuate sulla base delle prescrizioni e l’aderenza ai farmaci non è stata monitorata. Abbiamo calcolato la durata della malattia prima della data dell’indice a partire dalla prima registrazione dell’IPB; tuttavia, in alcuni pazienti questo coincideva con l’inizio del trattamento (definito come durata zero), ed è possibile che la malattia fosse presente prima di questo momento. Non è stato possibile valutare una relazione dose-risposta perché gli inibitori della 5α-reduttasi sono usati solo ad una singola dose. Abbiamo censurato i pazienti se sono passati dalla dutasteride alla finasteride, ma non se hanno interrotto il trattamento; tuttavia, questo non farebbe che sottovalutare il rischio. Il presente studio è osservazionale, non randomizzato e non cecato, quindi non abbiamo potuto controllare i fattori di confusione non misurati e i pregiudizi utilizzando la corrispondenza del punteggio di propensione. La pratica generale di prescrizione delle preferenze non era disponibile; queste informazioni potrebbero essere utilizzate in un’analisi delle variabili strumentali, una tecnica che si occupa di fattori di confusione non misurati. Tuttavia, abbiamo previsto che l’impatto dei cofondatori non misurati sarebbe stato ridotto, in linea con le nostre precedenti scoperte per il database dell’Unità di monitoraggio dei medicinali.25
Il potere nello studio CPRD è stato limitato dal numero di pazienti che hanno ricevuto dutasteride. Il finasteride è stato “off patent” per più tempo, mentre il dutasteride generico è disponibile solo dal 2014. Tuttavia, data la sostanziale sovrapposizione dei rischi tra finasteride e dutasteride e la replicazione dei risultati a Taiwan, una differenza di rischio non verrebbe probabilmente scoperta con numeri maggiori. Le caratteristiche della popolazione di controllo più appropriata nell’impostazione del diabete di tipo 2 nell’IPB sono discutibili e i pazienti non trattati non sono disponibili per lo studio in un lasso di tempo adeguato. Ci sono differenze intrinseche nella gravità della malattia nei pazienti che ricevono tamsulosina rispetto a quelli che ricevono inibitori della 5α-reduttasi; gli inibitori della 5α-reduttasi sono prescritti nei pazienti con prostata ingrossata e la tamsulosina è favorita come trattamento di prima linea per i sintomi del tratto urinario inferiore. Queste differenze nelle indicazioni potrebbero differenziare tra due popolazioni di pazienti che hanno una diversa suscettibilità alle malattie metaboliche.
I fattori di rischio più probabili sono i fattori di rischio metabolico, e abbiamo cercato di affrontare questi fattori per quanto possibile attraverso la corrispondenza del punteggio di propensione. Il punteggio con l’indice di massa corporea nei dati del CPRD ha permesso la corrispondenza dell’obesità alla data dell’indice, e questo non ha cambiato l’esito. Tuttavia, una maggiore durata dell’obesità prima del periodo di studio avrebbe potuto portare a un ingrossamento della prostata e quindi a una maggiore probabilità di prescrizione di inibitori della 5α-reduttasi. Abbiamo ulteriormente analizzato i dati con una variabile dipendente dal tempo dell’indice di massa corporea, e i risultati hanno mostrato poca differenza. L’analisi di corrispondenza del punteggio di propensione comprendeva solo un quarto della coorte di pazienti a causa di prevedibili difficoltà di corrispondenza delle variabili di base in queste coorti con alta precisione. Sebbene permangano le possibilità di un meccanismo sconosciuto e di una causalità inversa, i gruppi di pazienti affetti da inibitori della 5α-reduttasi sono a maggior rischio di diabete di tipo 2.
Un’ipotesi alternativa potrebbe essere che la tamsulosina potrebbe proteggere i pazienti dallo sviluppo del diabete di tipo 2 rispetto agli inibitori della 5α-reduttasi accelerando il processo. Tuttavia, poiché la diagnosi di IPB è stata fatta su presentazione dei sintomi e a causa dell’efficacia del trattamento, non è stato possibile studiare i pazienti senza intervento in questo lasso di tempo. Rassicurativamente, i tassi di diabete di tipo 2 nei pazienti che ricevono tamsulosina (circa 60 per 10.000 anni a persona) erano paragonabili a quelli della popolazione generale (42-64 per 10.000 pazienti26). È importante notare che l’inclusione di pazienti che ricevono tamsulosina in combinazione con un inibitore della 5α-reduttasi ha rivelato lo stesso aumento del rischio di diabete di tipo 2 dei pazienti che ricevono un inibitore della 5α-reduttasi da solo. Tuttavia, il numero di pazienti che utilizzano trattamenti combinati era basso, impedendo un’analisi significativa di questi gruppi.
In un’ulteriore analisi, abbiamo confrontato le percentuali di nuovi casi di diabete di tipo 2 con i pazienti sottoposti a trattamento chirurgico: resezione transuretrale della prostata. Abbiamo trovato alcune prove nella coorte NHIRD che i pazienti che ricevevano tamsulosina avevano meno probabilità di sviluppare il diabete di tipo 2 rispetto ai pazienti sottoposti ad intervento chirurgico, ma questo non era evidente nella coorte CPRD (tabelle supplementari S5 e S6). Tuttavia, questi gruppi di pazienti erano mal assortiti, anche dopo il punteggio di propensione. Concludiamo che esiste la possibilità che la tamsulosina offra una certa protezione contro il diabete di tipo 2, ma c’è un effetto negativo degli inibitori della 5α-reduttasi. Per studiare ulteriormente questa ipotesi è necessario uno studio controllato randomizzato.
Punti di forza e di debolezza in relazione ad altri studi
Nelle prove di fase III di dutasteride, non è stata trovata alcuna prova di aumento dei livelli di glucosio nel sangue,2728ma questi studi sono stati solo per due anni e sono stati limitati nella potenza statistica. In questo studio, abbiamo osservato l’aumento del rischio con gli inibitori della 5α-reduttasi dopo circa tre anni di trattamento, il che è coerente con un precedente rapporto della lenta progressione al diabete di tipo 2 con obesità e cambiamenti nel glucosio a digiuno.12 Gli unici studi osservazionali precedenti a lungo termine si sono concentrati sull’insufficienza cardiaca e hanno avuto risultati incoerenti.2930Un precedente studio farmacoepidemiologico condotto nell’arco di cinque anni suggeriva un rischio più basso di diabete di tipo 2, ma aveva un numero minore di pazienti, un gruppo di controllo meno ben caratterizzato e, cosa importante, non includeva l’aggiustamento dell’indice di massa corporea.15
Sulla base di precedenti studi di medicina sperimentale, abbiamo previsto un aumento del rischio di diabete di tipo 2 solo nella coorte dei dutasteridi; il maggiore rischio di diabete di tipo 2 nei pazienti che ricevono finasteride contrasta con la sua mancanza di effetti misurabili sul metabolismo dopo tre mesi di trattamento.8 Tuttavia, sebbene le misure puntuali dei rapporti di rischio suggeriscano un aumento del rischio di circa il 30% nella popolazione del Regno Unito per la dutasteride e la finasteride, il rapporto era più debole con la finasteride.
Nei roditori, la rottura di 5αR1 ma non di 5αR2 causa insulino-resistenza, fegato grasso e suscettibilità alla fibrosi epatica.1314Tuttavia, nel fegato dei roditori è espresso solo 5αR1, mentre nel fegato umano sono presenti entrambi gli isozimi di 5α-riduttasi.8 Profilo degli steroidi urinari in esseri umani ha mostrato robuste riduzioni di 5α ridotto metaboliti steroidei con finasteride e dutasteride,8 anche se dutasteride abbassa diidrotestosterone circolante in misura maggiore di finasteride (circa il 90% v 70% ).31 Pertanto, è plausibile che entrambi i farmaci influenzino il metabolismo del fegato. Tuttavia, i cambiamenti nella sensibilità insulinica con il dutasteride possono essere rilevati prima utilizzando morsetti iperinsulinemici euglicemici sensibili a causa della sua maggiore potenza, mentre l’effetto biochimico più modesto del finasteride ha un rischio accumulato nel tempo.
Significato dello studio
La tamsulosina è raccomandata come trattamento di prima linea per i pazienti con IPB sintomatica.10 inibitori della 5α-reduttasi sono raccomandati soprattutto nei pazienti con protesi più grandi, ma attualmente non sono disponibili indicazioni sulla scelta della dutasteride o della finasteride. In questo studio, il rischio di diabete di tipo 2 era simile per dutasteride e finasteride. I pazienti che ricevono questi farmaci sono più anziani e più suscettibili alle malattie metaboliche. Pertanto, sarà importante considerare il rischio di sviluppo o di esacerbazione del diabete di tipo 2 quando si prescrivono questi farmaci e applicare adeguate strategie di monitoraggio.
Questo studio dovrebbe mettere in guardia i medici sul fatto che i pazienti che iniziano un trattamento con inibitori della 5α-reduttasi potrebbero trarre beneficio dai consigli sullo stile di vita precoce e dal monitoraggio del diabete di tipo 2.
Domande senza risposta e ricerche future
Perché i pazienti che ricevono inibitori della 5α-reduttasi sono maggiormente a rischio di diabete di tipo 2? Le 5α-reduttasi sono altamente espresse nel fegato, ma anche in altri tessuti critici per la sensibilità all’insulina, ad esempio il tessuto adiposo e il muscolo scheletrico. Gli enzimi metabolizzano una serie di steroidi, tra cui testosterone, cortisolo, progesterone e aldosterone. La maggiore suscettibilità al diabete di tipo 2 potrebbe riflettere i cambiamenti in questi ormoni, più plausibilmente androgeni o glucocorticoidi. 5α-diidrotestosterone è un androgeno più attivo del testosterone, quindi inibire la sua formazione con dutasteride o finasteride32 potrebbe indurre caratteristiche di carenza di androgeni, che includono la resistenza all’insulina. Bassi livelli circolanti di testosterone sono associati ad un aumento del rischio di diabete di tipo 233 negli uomini, un rapporto evidente anche dopo la terapia di privazione degli androgeni nel cancro alla prostata.34 È interessante notare che i pazienti che abbiamo studiato avranno un basso 5α-diidrotestosterone, ma i loro livelli di testosterone sono probabilmente più alti; pertanto, sarebbero carenti di androgeni solo a livello tissutale localizzato, dove si esprimono 5α-riduttasi, compresi il fegato e le adiposità.8 È importante notare che la castrazione nei modelli di roditori non ha protetto contro gli effetti metabolici avversi degli inibitori della 5α-reduttasi13 , il che suggerisce che altri fattori sono in gioco. La prevenzione dell’inattivazione del cortisolo da parte del 5α-reduttasi potrebbe portare all’accumulo di glucocorticoidi nei tessuti metabolici, promuovendo di nuovo la resistenza all’insulina.
L’aumento del rischio di diabete di tipo 2 è stato studiato fino a 11 anni e potrebbe continuare ad aumentare; pertanto, i pazienti richiederebbero un follow-up più lungo, in particolare considerando che il trattamento potrebbe durare tutta la vita. Sono ora necessarie ulteriori indagini per scoprire se questi pazienti sono anche più a rischio di complicazioni diabetiche. Infine, ulteriori studi potrebbero esplorare i fattori di confusione non misurati conducendo un’analisi delle variabili strumentali, con la variabile strumentale accuratamente scelta e convalidata.
Conclusione
Gli uomini che utilizzano gli inibitori della 5α-reduttasi steroidi per l’IPB sembrano essere ad un modesto aumento del rischio di sviluppare il diabete di tipo 2. Caveats esistono circa i pregiudizi e confonditori all’interno di studi di coorte di popolazione. Tuttavia, alla luce dei nostri risultati, la decisione di prescrivere inibitori della 5α-reduttasi per gli uomini con malattie metaboliche deve essere considerata attentamente nel contesto di altri fattori di rischio per il diabete di tipo 2. Inoltre, il monitoraggio del glucosio a digiuno potrebbe essere consigliabile.
Ciò che è già noto su questo argomento
- Diversi farmaci comunemente usati aumentano il rischio di diabete mellito di tipo 2
- Recenti studi di medicina sperimentale a breve termine di dutasteride (uno steroide inibitore della 5α-reduttasi usato per trattare la malattia prostatica) hanno dimostrato che induce insulino-resistenza e fegato grasso
- Gli uomini che ricevono regolarmente dutasteride potrebbero essere maggiormente a rischio di diabete di tipo 2 rispetto a quelli che utilizzano trattamenti alternativi
Cosa aggiunge questo studio
- Il rischio di diabete di tipo 2 è stato aumentato di circa il 30% in 11 anni negli uomini con iperplasia prostatica benigna che hanno ricevuto uno degli inibitori della 5α-reduttasi presenti sul mercato, finasteride o dutasteride rispetto alla tamsulosina
- La decisione di prescrivere inibitori della 5α-reduttasi steroide per gli uomini con malattie metaboliche dovrebbe essere presa nel contesto di altri fattori di rischio per il diabete di tipo 2; un ulteriore monitoraggio del glucosio nel sangue potrebbe essere consigliabile
References
- Gress TD, Nieto FJ, Sharar E, Wofford MR, Brancati FL. Hypertension and antihypertensive therapy as risk factors for type 2 diabetes mellitus. Atherosclerosis Risk in Communities Study. N Engl J Med. 2000; 342:905-12. DOI | PubMed
- Sattar N, Preiss D, Murray HM. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010; 375:735-42. DOI | PubMed
- Preiss D, Seshasai SRK, Welsh P. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA. 2011; 305:2556-64. DOI | PubMed
- Holt RIG, Peveler RC. Association between antipsychotic drugs and diabetes. Diabetes Obes Metab. 2006; 8:125-35. DOI | PubMed
- Brown TT, Cole SR, Li X. Antiretroviral therapy and the prevalence and incidence of diabetes mellitus in the multicenter AIDS cohort study. Arch Intern Med. 2005; 165:1179-84. DOI | PubMed
- Heisel O, Heisel R, Balshaw R, Keown P. New onset diabetes mellitus in patients receiving calcineurin inhibitors: a systematic review and meta-analysis. Am J Transplant. 2004; 4:583-95. DOI | PubMed
- Gurwitz JH, Bohn RL, Glynn RJ, Monane M, Mogun H, Avorn J. Glucocorticoids and the risk for initiation of hypoglycemic therapy. Arch Intern Med. 1994; 154:97-101. DOI | PubMed
- Upreti R, Hughes KA, Livingstone DE. 5α-reductase type 1 modulates insulin sensitivity in men. J Clin Endocrinol Metab. 2014; 99:E1397-406. DOI | PubMed
- Hazlehurst JM, Oprescu AI, Nikolaou N. Dual-5α-Reductase Inhibition Promotes Hepatic Lipid Accumulation in Man. J Clin Endocrinol Metab. 2016; 101:103-13. DOI | PubMed
- 2010 NGC-8255.
- Bechis SK, Otsetov AG, Ge R, Olumi AF. Personalized medicine for the management of benign prostatic hyperplasia. J Urol. 2014; 192:16-23. DOI | PubMed
- Traish A, Haider KS, Doros G, Haider A. Long-term dutasteride therapy in men with benign prostatic hyperplasia alters glucose and lipid profiles and increases severity of erectile dysfunction. Horm Mol Biol Clin Investig. 2017; 30:1-16. DOI | PubMed
- Livingstone DE, Barat P, Di Rollo EM. 5α-Reductase type 1 deficiency or inhibition predisposes to insulin resistance, hepatic steatosis, and liver fibrosis in rodents. Diabetes. 2015; 64:447-58. DOI | PubMed
- Dowman JK, Hopkins LJ, Reynolds GM. Loss of 5α-reductase type 1 accelerates the development of hepatic steatosis but protects against hepatocellular carcinoma in male mice. Endocrinology. 2013; 154:4536-47. DOI | PubMed
- Lee SS, Yang YW, Tsai TH. 5-alpha-reductase inhibitors and the risk of diabetes mellitus: A nationwide population-based study. Prostate. 2016; 76:41-7. DOI | PubMed
- Herrett E, Thomas SL, Schoonen WM, Smeeth L, Hall AJ. Validation and validity of diagnoses in the General Practice Research Database: a systematic review. Br J Clin Pharmacol. 2010; 69:4-14. DOI | PubMed
- Cheng CL, Kao YH, Lin SJ, Lee CH, Lai ML. Validation of the National Health Insurance Research Database with ischemic stroke cases in Taiwan. Pharmacoepidemiol Drug Saf. 2011; 20:236-42. DOI | PubMed
- Lai EC, Hsieh CY, Wong MB. Comparative risk of oral ulcerations among antipsychotics users – population-based retrospective cohort study. Pharmacoepidemiol Drug Saf. 2016; 25:123-32. DOI | PubMed
- Livingstone DE, Di Rollo EM, Mak TC, Sooy K, Walker BR, Andrew R. Metabolic dysfunction in female mice with disruption of 5α-reductase 1. J Endocrinol. 2017; 232:29-36. DOI | PubMed
- Chan JCN, Malik V, Jia W. Diabetes in Asia: epidemiology, risk factors, and pathophysiology. JAMA. 2009; 301:2129-40. DOI | PubMed
- Organisation WH. Global Reports on Diabetes.. WHO; 2016.
- Publisher Full Text
- Chen CC, Chen LS, Yen MF, Chen HH, Liou HH. Geographic variation in the age- and gender-specific prevalence and incidence of epilepsy: analysis of Taiwanese National Health Insurance-based data. Epilepsia. 2012; 53:283-90. DOI | PubMed
- Wu CY, Chan FK, Wu MS. Histamine2-receptor antagonists are an alternative to proton pump inhibitor in patients receiving clopidogrel. Gastroenterology. 2010; 139:1165-71. DOI | PubMed
- Wei L, MacDonald TM, Walker BR. Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease. Ann Intern Med. 2004; 141:764-70. DOI | PubMed
- Zghebi SS, Steinke DT, Carr MJ, Rutter MK, Emsley RA, Ashcroft DM. Examining trends in type 2 diabetes incidence, prevalence and mortality in the UK between 2004 and 2014. Diabetes Obes Metab. 2017; 19:1537-45. PubMed
- Schulman C, Pommerville P, Höfner K, Wachs B. Long-term therapy with the dual 5alpha-reductase inhibitor dutasteride is well tolerated in men with symptomatic benign prostatic hyperplasia. BJU Int. 2006; 97:73-9, discussion 79-80. DOI | PubMed
- Andriole GL, Kirby R. Safety and tolerability of the dual 5alpha-reductase inhibitor dutasteride in the treatment of benign prostatic hyperplasia. Eur Urol. 2003; 44:82-8. DOI | PubMed
- Andriole GL, Bostwick DG, Brawley OW, REDUCE Study Group. Effect of dutasteride on the risk of prostate cancer. N Engl J Med. 2010; 362:1192-202. DOI | PubMed
- Loke YK, Ho R, Smith M. Systematic review evaluating cardiovascular events of the 5-alpha reductase inhibitor – Dutasteride. J Clin Pharm Ther. 2013; 38:405-15. DOI | PubMed
- Gisleskog PO. Hermann d, Hammarlund-Udenaes M, Karlsson MO. A model for the turnover of dihydrotestosterone in the presence of the irreversible 5α-reductase inhibitors GII98745 and finasteride. Clin Pharmacol Ther. 1998; 64:636-47. DOI | PubMed
- Clark RV, Hermann DJ, Cunningham GR, Wilson TH, Morrill BB, Hobbs S. Marked suppression of dihydrotestosterone in men with benign prostatic hyperplasia by dutasteride, a dual 5α-reductase inhibitor. J Clin Endocrinol Metab. 2004; 89:2179-84. DOI | PubMed
- Hackett G. Type 2 Diabetes and testosterone therapy. World J Mens Health. 2019; 37:31-44. DOI | PubMed
- Jhan JH, Yeh HC, Chang YH. New-onset diabetes after androgen-deprivation therapy for prostate cancer: A nationwide propensity score-matched four-year longitudinal cohort study. J Diabetes Complications. 2018; 32:688-92. DOI | PubMed
Fonte
Wei L, Lai EC, Kao-Yang Y, Walker BR, MacDonald TM, et al. (2019) Incidence of type 2 diabetes mellitus in men receiving steroid 5α-reductase inhibitors: population based cohort study. The BMJ 365l1204. https://doi.org/10.1136/bmj.l1204





