Abstract
Background
Gli studi epidemiologici hanno dimostrato che le esperienze infantili negative, ovvero le esposizioni come la trascuratezza, gli abusi, le malattie mentali dei caregiver e la violenza familiare o comunitaria, prevedono risultati a lungo termine più sfavorevoli in tutti i settori sanitari e sociali. I risultati associati alle avversità precoci includono un maggiore rischio di diabete di tipo 2, obesità, cardiopatie ischemiche, tumori, depressione, dipendenze e mortalità prematura, così come i risultati sociali, tra cui la disoccupazione e il basso livello di istruzione[1- 8]. Prove particolarmente convincenti provengono da grandi coorti di nascita e da studi prospettici e longitudinali che esplorano le relazioni predittive[3, 5- 9]. Nel frattempo, la ricerca sull’uomo e sugli animali ha fornito informazioni sui meccanismi molecolari candidati attraverso i quali le avversità precoci possono diventare “biologicamente integrate” in una fisiologia perturbata [10]. Tali risultati supportano i modelli di vita della salute umana che descrivono come lo sviluppo fisiologico precoce interagisce nel tempo con il comportamento e gli ambienti a rischio continuo per plasmare i risultati in modo olistico[7].
Tuttavia, le prove sugli effetti patogeni delle avversità psicosociali dell’infanzia non sono state ampiamente applicate nella pratica clinica o nelle iniziative di salute pubblica. Tali conoscenze hanno il potenziale per migliorare le strategie di screening e di intervento che mirano a diminuire l’esposizione alle avversità precoci (prevenzione primaria), a limitare la patologia risultante (prevenzione secondaria) e ad aiutare coloro che già soffrono di effetti (prevenzione e trattamento terziario). Gli sforzi devono abbracciare tutto l’arco della vita, coinvolgendo medici pediatrici e adulti, ricercatori, educatori, operatori della sanità pubblica, famiglie e comunità. La consapevolezza degli effetti delle avversità può inoltre migliorare le indagini sulle radici della malattia umana.
Questa revisione esamina le prove sui meccanismi biologici che si pensa possano collegare le avversità della prima infanzia alle malattie successive. Mentre la letteratura precedente ha descritto prevalentemente i cambiamenti in uno o pochi assi fisiologici, questa revisione riassume i cambiamenti in modo completo attraverso i sistemi corporei, offrendo un orientamento unificato per i medici e i ricercatori. Le domande specifiche affrontate includono (1) Come possono spesso esposizioni precoci limitate nel tempo produrre cambiamenti fisiologici duraturi? (2) Come convergono tali cambiamenti fisiologici per generare malattie? (3) Quali sono i fattori alla base della “suscettibilità differenziale” alle avversità dello sviluppo e come possono gli interventi promuovere la resilienza? Infine, consideriamo come le risposte a queste domande dovrebbero plasmare l’azione in tutti i settori sociali per promuovere il benessere dei bambini e la salute di tutta la vita.
Definire le avversità precoci della vita
In questa recensione, concettualizziamo le avversità infantili come un’esperienza negativa dell’infanzia associata a un aumento del rischio per la salute e dei risultati sociali. La revisione è limitata alle esposizioni postnatali, mentre la letteratura separata copre gli effetti importanti delle avversità prenatali[11]. Consideriamo in particolare le avversità psicosociali, cioè quelle che coinvolgono le relazioni (con chi si prende cura di loro, la famiglia, la comunità, i coetanei) e altre esperienze sociali che interagiscono con i processi psicologici[12]. Esempi di avversità psicosociali includono il maltrattamento dell’infanzia, l’esposizione alla violenza, la psicopatologia del caregiver, gli ambienti di cura instabili o che privano dell’assistenza (per esempio, l’affidamento di bassa qualità o l’assistenza istituzionale), le esposizioni avverse della società come il crimine e la discriminazione, e altre cause di stress psicologico o trauma. Varie avversità infantili sono prevalenti a livello globale. Una recente revisione ha rilevato che almeno il 44% dei bambini nei paesi sviluppati e il 59% nei paesi in via di sviluppo sono stati vittime di violenza fisica, emotiva o sessuale o sono stati testimoni di violenza domestica o comunitaria nell’anno precedente[13]. È comune anche la cattiva salute mentale dei caregiver, con la depressione che attualmente rappresenta la principale causa di disabilità legata alla malattia a livello globale[14].
Per brevità, ci riferiamo alle avversità psicosociali dell’infanzia come “avversità della prima infanzia” (ELA), utilizzando un approccio aggregativo per concettualizzare le esposizioni. Tale approccio facilita la sintesi di prove complesse per l’applicazione, ed è supportato da effetti dose-risposta osservati che collegano le avversità precoci cumulative ai risultati successivi [1, 3, 5 ], e dal paradigma del “carico allostatico” che esplora gli effetti patogeni dello stress cumulativo all-causa [15]. Tali approcci aggregativi richiedono sforzi complementari per differenziare gli effetti delle esposizioni che variano per natura, tempistica e intensità[16]. Qui, non esaminiamo specificamente lo stato socioeconomico infantile basso (SES) come avversità psicosociale, poiché la povertà influenza la salute in parte attraverso percorsi non psicosociali (ad esempio, aumentando l’esposizione ai rischi fisici ambientali). Nel frattempo, alcune famiglie che vivono in povertà forniscono ambienti psicosociali sicuri nonostante le sfide poste dallo svantaggio socioeconomico. Ciononostante, le avversità infantili sono fortemente divise dalla SES e plasmate da disuguaglianze intrecciate alla povertà, come quelle definite dalla razza, dal genere, dallo status di immigrazione, dalla classe e da altri assi di disuguaglianza sociale.
Incorporazione biologica
L’incorporazione biologica descrive i processi attraverso i quali le risposte omeostatiche, inizialmente transitorie, alterano la fisiologia in modo duraturo[10]. Gli eventi all’inizio della vita possono essere incorporati preferibilmente a causa di una preponderanza di periodi sensibili, o di finestre di rapido sviluppo e di accresciuta plasticità (reattività all’esperienza). Mentre tradizionalmente descritti nel neurosviluppo[16], gli effetti del periodo sensibile sono stati suggeriti altrove, anche nei sistemi immunitario[17] e metabolico[18]. I processi epigenetici rappresentano una famiglia chiave di meccanismi che guidano l’incorporazione. Il cambiamento epigenetico comporta un’alterazione stabile dell’espressione genica attraverso meccanismi che comprendono, tra l’altro, l’attaccamento di residui chimici (ad esempio, gruppi metilici) al DNA o a molecole coinvolte nel confezionamento e nel controllo trascrizionale (ad esempio, gli istoni)[19].
Sfide metodologiche
Una sfida metodologica fondamentale è la difficoltà di dimostrazione causale in mezzo alla complessità sociale. Mentre gli studi epidemiologici esplorano statisticamente i percorsi confondenti e mediazionali, gli studi controllati randomizzati – il “gold standard” nell’inferenza causale – sono spesso impossibili o non etici. Questa sfida richiede un uso sostanziale di modelli animali, consentendo la sperimentazione controllata e l’uso di manipolazioni molecolari mirate che chiariscono i percorsi causali. Questi modelli sono considerati in questa revisione quando sono potenzialmente utili per comprendere i processi umani. Un’ulteriore sfida è stata il ricorso all’autodenuncia retrospettiva dell’ELA in molti studi. Tali relazioni possono concordare solo moderatamente con le misure prospettiche e potrebbero essere più inclini a distorsioni, anche se entrambi i tipi di misure tendono a prevedere malattie e risultati sociali simili[20]. Ci concentriamo quindi sulla direzione (rispetto alle dimensioni) degli effetti e sui meccanismi fisiologici, e diamo priorità agli studi che utilizzano disegni prospettici longitudinali.
Strategia di ricerca
Abbiamo identificato la letteratura accademica peer-reviewed da diversi database, tra cui PubMed, Medline e PsycINFO, utilizzando termini di ricerca che specificano i tempi nella prima infanzia (ad esempio, precoce, bambino*, infan*) e le esposizioni avverse (ad esempio, avversario*, stress psicologico, maltrattamento*), così come i termini per specifici assi fisiologici, se del caso. La priorità è stata data a studi più recenti, revisioni importanti e studi prospettici sull’uomo. Sono stati inclusi studi trasversali e studi sugli animali laddove non erano disponibili prove prospettiche sull’uomo.
Incorporazione biologica per asse fisiologico
ELA ha diversi effetti attraverso gli assi microbici neurali, endocrini, immunitari, metabolici e intestinali, come recensito di seguito. La Tabella 1 riassume i risultati chiave, mentre la Fig. 1 fornisce un modello concettuale di lavoro dell’incorporazione biologica di ELA.Tabella 1 Effetti selezionati delle avversità della prima infanzia (ELA) sul funzionamento fisiologico Esempi di cambiamenti fisiologici osservati dopo ELAOverall effetti clinici e funzionaliRiesami chiaveStrutturae attivitàcerebrale Variazione strutturale nella materia grigia e biancaIncremento del rischio di:- Riduzione del funzionamento esecutivo (ad esempio, Memoria di lavoro, controllo cognitivo)- Riduzione della regolazione delle emozioni e delle funzioni sociali – Effetti negativi sull’elaborazione delle ricompense e sulla regolazione dello stress (ad esempio, ippocampo, amigdala, PFC) possono aumentare il rischio di disturbi dell’umore e dell’uso di sostanzeBick & Nelson, 2016 [21]Hart & Rubia, 2012 [24]McEwen, 2013 [50]Nemeroff et al., 2016[25]■ 2016 [25]■1) Cambiamenti nei volumi di materia grigia locali/globali a) Alcune prove di un cambiamento diffuso e globale della materia grigia b) Diminuzione del volume di materia grigia di PFC e ippocampoc) Complesse variazioni volumetriche complesse nell’amigdala2) Variazioni del volume di materia bianca locale/globale e della microstruttura a) Complesse variazioni volumetriche della materia bianca nei lobi frontalib) Variazione microstrutturale in vari tratti di materia bianca che possono compromettere la comunicazione tra le regioni cerebrali Variazione funzionale dell’attività cerebrale e della connettività funzionale 3) Reattività aberrante dell’amigdala agli stimoli emotivi 4) Alterazioni nella connettività dell’amigdala-PFC Metabolismo o produzione dei neurotrasmettitori alterati o produzione 5) Potenziali livelli alterati dei neurotrasmettitori/segnali che coinvolgono le molecole chiave, e.g., serotonina, dopamina, GABA, glutammatoNeuroendocrino(HPA) assi di risposta allo stressHyper-responsiveness-Sia l’iper- o ipo-reattività HPA sono modelli caratteristici che generano un eccesso di “carico allostatico”, legato a malattie cardiovascolari, sindrome metabolica, invecchiamento cellulare accelerato, e varie psicopatologie- Effetti a valle dei livelli di cortisolo aberrante (ad esempio, neurotossicità, aumento dell’infiammazione, disregolazione metabolica) possono guidare la patologia attraverso altri assiDoom & Gunnar, 2015 [36]Heim& Binder, 2012 [87]|1) Miglioramento della risposta dell’ACTH e del cortisolo allo stress/stimolazione2) Evidenza di una ridotta inibizione del feedback GR-mediata da inibizione del feedbackHypo-responsività4) Blunted HPA risposta (ACTH e cortisolo) allo stress / stimolazione 5) Aumento della risposta ACTH con cortisolo smussato in modo inappropriato (normale o basso) Alterato ritmi basali diurni 3) Elevato, o soppresso, cortisolo medio / CRF 6) Modifiche complesse ai ritmi diurni di cortisolo (e.g., calo più basso al mattino e più piatto, o più alto al mattino e più ripido al mattino)Funzionamento autonomo1) Modelli complessi di squilibrio simpatizzante o parasimpatico-predominante della reattività allo stress acuto, con alterazioni nella reattività e nel controllo contro-regolatorio- Entrambi gli squilibri autonomici parasimpatici o simpatizzanti-predominanti sono legati a malattie di elevato “carico allostatico” (discussi sopra)Alkon et al., 2012[55]El-Sheikh et al., 2009[56]|2) Tono basale simpatizzante o parasimpatico elevato o diminuitoImmunitàe infiammazione 1) Soppressione immunitaria sistemica (es, immunitario cellulare compromessa)- Infiammazione cronica legata all’aumento del rischio cardiometabolico e di altre malattie- Immunosoppressione legata alla compromissione del controllo delle minacce infettive/neoplasticheSlopen et al., 2012[66]Baumeister et al., 2016[67]|2) Infiammazione basale cronica (ad es, elevata CRP, TNF- α, IL-6)■3) Aumentata reattività infiammatoriaMetabolismo 1)Ridotta manipolazione periferica del glucosio con resistenza all’insulina – Aumento del rischio di diabete di tipo 2, obesità, iperlipidemia, o altre malattie metabolicheManiam et al., 2014[70]|2) Alterato metabolismo dei grassi con dislipidemiaMicrobiomafunzionante (prove emergenti, modelli animali solo fino ad oggi)|1) Perturbazioni transitorie del microbioma dopo lo stress nell’infanzia legate allo sviluppo immunitario aberrante- Può contribuire all’infiammazione, alla soppressione del sistema immunitario e/o al rischio di sviluppo neurologicoO’Mahony et al., 2015[74]´2) Possibili cambiamenti durevoli del microbioma negli adulti dopo lo stress precocePFC corteccia prefrontale, ACTH ormone adrenocorticotropo adrenocorticotropo, GR recettore glucocorticoide GR, CRF fattore di rilascio della corticotropina, CRP proteina C reattiva, fattore di necrosi tumorale TNF, IL-6 interleuchina-6, HPA ipotalamo-ipofisi-fig. 1Modello concettuale dell’incorporazione biologica delle avversità psicosociali precoci. Adattato da[113].
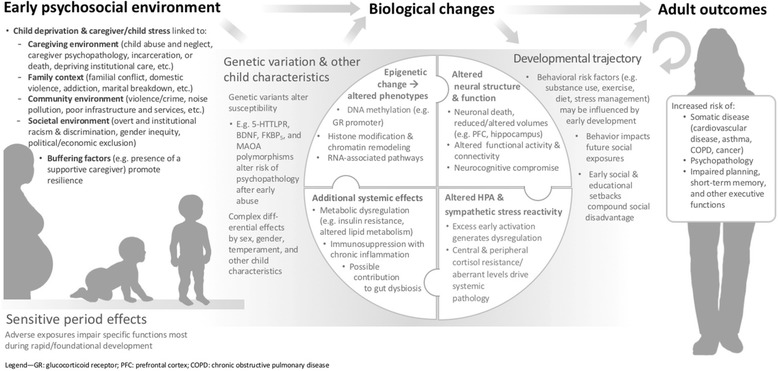
Fig. 1.Modello concettuale dell’incorporazione biologica delle avversità psicosociali precoci. Adattato da[113]
Asse 1: Il cervello
La maturazione del cervello umano è un processo prolungato che inizia nella vita fetale e continua fino all’età adulta[21]. La crescita drammatica della materia grigia e bianca avviene nei primi 2 anni di vita, quando il cervello raggiunge l’80-90% del suo volume adulto prima di continuare a crescere ad un tasso attenuato [22, 23]. Oltre alla crescita, la potatura neurale dipendente dall’esperienza elimina le sinapsi inattive. Anatomicamente, il cervello matura “dal basso verso l’alto”, a partire dalle strutture primitive del tronco encefalico e progredisce anatomicamente nelle direzioni anteriore-posteriore e inferiore-superiore, culminando con la corteccia prefrontale (PFC). Lo sviluppo funzionale progredisce in modo simile dalle capacità sensoriali e motorie di base al successivo linguaggio e al funzionamento esecutivo (ad esempio, il controllo cognitivo, la memoria di lavoro), e in ultima analisi la cognizione superiore[16]. Lo sviluppo neurologico normativo consente quindi l’adattamento ambientale e la cognizione progressivamente complessa, ma lascia il cervello suscettibile di esposizioni negative per un periodo di tempo prolungato.
Un’ampia letteratura collega l’ELA a variazioni pervasive e quantificabili della struttura e della funzione cerebrale[15, 21, 24, 25]. L’indagine ha esaminato preferibilmente le aree “sensibili allo stress” densi di recettori glucocorticoidi, comprese le strutture limbiche (ad esempio, ippocampo e amigdala) chiave per la memoria, l’apprendimento e la regolazione delle emozioni, così come il PFC, fondamentale per la cognizione superiore, il funzionamento esecutivo, e il controllo “dall’alto verso il basso” delle regioni inferiori [26]. Studi su adolescenti e adulti forniscono prove coerenti di volumi di materia grigia più piccoli di PFC dopo l’ELA, mettendo in parallelo i risultati di modelli animali sperimentali progettati per dimostrare la causalità[21, 24, 25]. Volumi ippocampali più piccoli sono stati costantemente osservati negli adulti esposti all’ELA, anche se non nei bambini, riflettendo i potenziali effetti latenti su una struttura a lento sviluppo. Gli effetti volumetrici dell’amigdala sono complessi, compresi sia gli aumenti che le diminuzioni, probabilmente moderati dai tempi e dal tipo di esposizione[21, 27].
Considerando i potenziali meccanismi di incorporazione, l’ipotesi della “neurotossicità” presuppone che l’elevazione precoce dei mediatori di stress, in particolare dei glucocorticoidi, uccida o impedisca la crescita dei neuroni nelle regioni sensibili allo stress attraverso meccanismi che includono il danno ossidativo [28]. I mediatori di stress potenzialmente legati alla neurotossicità nell’uomo includono il cortisolo, le citochine infiammatorie, gli amminoacidi eccitatori (ad esempio, il glutammato) e varie altre molecole (ad esempio, il fattore neurotrofico derivato dal cervello (BDNF) e gli oppioidi endogeni)[29]. Lo stress ossidativo durante lo sviluppo neurologico precoce può anche interrompere (ritardare o estendere) i periodi neurali sensibili[30]. Considerando l’epigenetica, i modelli animali sperimentali mostrano un’espressione alterata dei geni implicati nei processi di base del neurosviluppo (ad esempio, adesione delle cellule, chiusura del periodo sensibile)[31]. Studi umani di ELA mostrano cambiamenti di metilazione a livello genomico, nonché effetti gene-specifici sulle molecole di segnalazione neurali importanti per la salute psicologica e la funzione neurale, per esempio serotonina, glutammato, dopamina, catecolo-O-metil transferasi (COMT), e BDNF[19].
Al di là dello stress eccessivo, la privazione ambientale può anche giocare un ruolo nel compromesso dello sviluppo neurologico, per esempio, tra i bambini in istituti di bassa qualità[32]. In generale, l’assenza di stimoli psicosociali normativi (ad esempio, l’esposizione al linguaggio o l’interazione con il caregiver) durante lo sviluppo dipendente dall’esperienza è proposta per promuovere un’eccessiva potatura sinaptica[33]. In effetti, i bambini cresciuti in istituti di privazione nell’infanzia mostrano una diminuzione globale dello spessore corticale[34], una constatazione forse parallela alla riduzione dell’arboricoltura dendritica a livello cerebrale, della densità della colonna vertebrale e del volume cerebrale nei modelli di privazione precoce dei roditori (ad esempio, l’allevamento in gabbie a occupazione singola)[35]. Tuttavia, le esposizioni “prive” (come l’assenza del caregiver) generalmente evocano potenti risposte di stress [36],mentre i mediatori di stress regolano la plasticità sinaptica [37],complicando gli sforzi per discernere se i cambiamenti strutturali osservati riflettono un eccesso di potatura (rispetto, per esempio, alla neurotossicità dei glucocorticoidi) e se questi meccanismi sono, di fatto, indipendenti dai percorsi mediati dallo stress.
I cambiamenti neurosviluppatori descritti possono avere implicazioni funzionali e sanitarie di vasta portata. Gli studi suggeriscono che i cambiamenti neural-strutturali mediano gli effetti dell’ELA sulla depressione[38], mentre le alterazioni del periodo sensibile possono contribuire alla schizofrenia e alla patogenesi dell’autismo[30, 39]. Gli studi sui cambiamenti funzionali del cervello associati all’ELA mostrano deficit nei processi che includono la regolazione delle emozioni, l’apprendimento della paura e il funzionamento esecutivo[21]. Gli studi di risonanza magnetica funzionale mostrano differenze nell’elaborazione di ricompense guidate centralmente che potrebbero mediare il rischio di psicopatologie correlate all’ELA e di malattie legate all’uso di sostanze[40, 41]. Infine, l’alterazione delle strutture centrali di regolazione dello stress può promuovere l’alterazione neuroendocrina legata a malattie di carico allostatico in eccesso[42], come discusso di seguito.
Asse 2: Regolazione dello stress neuroendocrino
ELA influisce ampiamente sulla reattività allo stress come controllata dagli assi ipotalamo-ipofisi-surrene (HPA) e autonomica (simpatico/parasimpatico). Entrambi gli assi sono sotto controllo centrale da strutture corticolimbiche, tra cui il PFC, ippocampo e amigdala[29], e coinvolgono mediatori molecolari comuni (ad esempio, fattore di rilascio della corticotropina (CRF), un ormone HPA e neurotrasmettitore autonomo)[43], suggerendo potenzialmente sovrapposti percorsi di incorporazione.
Asse HPA
In risposta allo stress, il CRF ipotalamico stimola il rilascio dell’ormone adrenocorticotropo pituitario (ACTH) e, a sua volta, la secrezione corticale surrenale di glucocorticoidi – principalmente cortisolo nell’uomo e corticosterone in molte specie animali. Glucocorticoidi innescare diverse risposte omeostatiche sistemiche diverse, pur esercitando un feedback negativo sull’asse. Negli studi sull’uomo e nella sperimentazione animale, l’ELA prevede costantemente una disregolazione dell’HPA che in genere persiste fino all’età adulta, compresi i modelli di iperreattività, suggerendo una potenziale resistenza acquisita al feedback negativo dei glucocorticoidi[29], o iporeattività, suggerendo una possibile sensibilità attenuata allo stress o un’eccessiva soppressione dell’asse[44]. I modelli differenziali di disregolazione possono riflettere la variazione di fattori quali la tempistica e il tipo di ELA[45], il genotipo[46], l’età attuale[29] e la psicopatologia concomitante[47]. È importante sottolineare che l’iper- e l’iporeattività dell’HPA rappresentano entrambi modelli prototipici associati a un eccesso di carico allostatico, ed entrambi prevedono malattie croniche umane legate allo stress, tra cui malattie cardiovascolari, metaboliche e psichiatriche legate epidemiologicamente all’ELA[15, 29, 48]. La disregolazione dei glucocorticoidi può anche promuovere microambienti oncogeni delle cellule tumorali (in parte attraverso effetti pro-infiammatori, come discusso di seguito), favorendo la crescita, la migrazione, l’invasività e l’angiogenesi[49], contribuendo così potenzialmente ai collegamenti osservati tra ELA e tumori[7].
Considerando i potenziali meccanismi dei cambiamenti dell’HPA, i modelli animali di stress precoce hanno dimostrato un’espressione alterata del recettore dei glucocorticoidi (GR) (coinvolto preferibilmente nella downregulation dell’asse) e dei recettori per CRF, ACTH e altre molecole chiave[50]. In particolare, la segnalazione alterata della serotonina nei ratti che ricevono cure materne sfavorevoli ha dimostrato di indurre l’ipermetilazione (silenziamento) del promotore GR e dei geni correlati[51]. Simile ipermetilazione GR è stato successivamente dimostrato nel tessuto ippocampale[52] e linfociti periferici[53] di esseri umani maltrattati durante l’infanzia. Altri cambiamenti epigenetici mostrati negli animali includono i geni che controllano altri recettori chiave legati allo stress (ad esempio, per CRF) e ormoni (ad esempio, CRF, AVP, ACTH, e cortisolo), così come nei neurotrasmettitori / neuropeptidi nelle regioni cerebrali stress-regolamentari[54].
Asse autonomo
In risposta allo stress, la segnalazione dell’amigdala avvia l’attivazione simpatica attraverso il tronco encefalico, terminando in segnali adrenergici per terminare gli organi (ad esempio, fegato, cuore, tratto digestivo e pancreas) e l’induzione del rilascio di epinefrina midollare surrenale /norepinefrina che produce la risposta prototipica “lotta o fuga”. Il ramo parasimpatico esercita un controllo compensativo, e l’equilibrio dinamico simpatico-parasimpatico modella la fisiologia generale dello stress[55]. Modelli animali sperimentali e studi umani osservazionali hanno costantemente collegato l’ELA alla disregolazione autonomica, includendo sia l’iper- che l’ipo-responsabilità dei percorsi simpatici o parasimpatici. Lo squilibrio in entrambe le direzioni, simpatico o parasimpatico-dominante, rappresenta ancora una volta manifestazioni di eccesso di carico allostatico e predice malattie legate allo stress, tra cui le malattie cardiache, l’obesità, il diabete di tipo 2, i tumori e le psicopatologie[55]. Le associazioni patologiche possono differire in base al modello di squilibrio autonomico. Diversi studi, per esempio, hanno trovato che la reattività simpatica attenuata correlata con il comportamento antisociale con caratteristiche insensibili all’ELA nei ragazzi esposti all’ELA, mentre l’aumentata reattività correlata con il comportamento antisociale senza caratteristiche insensibili all’ELA[56]. Tali risultati rimangono esplorativi, e la direzione dei legami causali, se presenti, non è chiara. Tra i pochi studi che esaminano specificamente i meccanismi dei cambiamenti autonomici, uno ha trovato che i cambiamenti volumetrici nell’amigdala, nell’ippocampo e nel PFC hanno mediato statisticamente i cambiamenti autonomici e il rischio di psicopatologia[57]. La sovrapposizione della regolazione da parte delle strutture corticolimbiche e dei mediatori molecolari del nucleo (ad esempio, CRF) suggerisce che alcune alterazioni legate all’HPA possono anche avere un impatto sul funzionamento autonomo.
Asse 3: Funzionamento immunitario
Le risposte immunitarie innate e adattive lavorano congiuntamente per controllare le minacce esogene (ad es. microbiche) ed endogene (ad es. necrotiche/neoplastiche) nei processi che dipendono dai mediatori infiammatori. Quando sono cronicamente elevati, tuttavia, i mediatori infiammatori contribuiscono all’immunosoppressione e allo stress ossidativo e alla citotossicità[58]. L’ELA è stata collegata negli studi sull’uomo e nella sperimentazione animale all’infiammazione cronica[59] e all’immunosoppressione a basso livello, compresa la compromissione dell’immunità delle mucose nei bambini[60] e dell’immunità cellulare (per esempio, un controllo più scarso dell’infezione virale latente) negli adolescenti[61] e negli adulti[62]. Un lavoro importante ha caratterizzato un “fenotipo pro-infiammatorio”, che comporta una risposta esagerata delle citochine alla sfida batterica e una progressiva desensibilizzazione del recettore dei glucocorticoidi, tra gli individui esposti all’ELA [63]. Considerando i potenziali meccanismi, la resistenza periferica acquisita ai glucocorticoidi può attenuare gli effetti antinfiammatori del cortisolo [18]. Nel frattempo, l’analisi a livello genomico negli individui esposti all’ELA ha mostrato una maggiore espressione dei geni che controllano non solo la produzione di cortisolo, ma anche l’attività di mediatori infiammatori chiave come NF-κβ e interleuchina-6 (IL-6) [64], con potenziali antecedenti che includono la programmazione dello sviluppo dei monociti per risposte infiammatorie eccessive [18, 65]. Infine, la ricerca emergente ipotizza che la disbiosi intestinale correlata all’ELA possa contribuire all’infiammazione cronica, come discusso di seguito.
Le implicazioni sanitarie dell’immunosoppressione includono il controllo compromesso dell’infezione e altre minacce. Nel frattempo, i mediatori infiammatori legati all’ELA (ad esempio, IL-1, IL-6, TNF-alfa, CRP e fibrinogeno) sono implicati nel rischio di malattie cardiovascolari e metaboliche[17, 66, 67]. L’infiammazione è anche un meccanismo proposto per mediare gli effetti dell’ELA sulla depressione successiva, sulle malattie legate all’età[3], sui cambiamenti dello sviluppo neurologico[40], sui tumori [49] e su altri effetti sistemici discussi. Considerando il rischio di cancro in particolare, l’immunosoppressione compromette il controllo dei virus oncogeni latenti[68], mentre l’infiammazione promuove ulteriormente i microambienti tumorali oncogeni in combinazione con i mediatori di stress, come discusso sopra[49].
Asse 4: Salute metabolica
L’interesse per l’integrazione metabolica dell’ELA deriva da studi epidemiologici[1, 69] e clinici[70] che collegano l’ELA all’obesità, alla dislipidemia e al diabete di tipo 2, sollevando domande sulle possibili vie causali. Mentre la ricerca che collega direttamente l’ELA allo sviluppo alterato della fisiologia metabolica rimane emergente (contro chiari impatti indiretti attraverso, ad esempio, l’infiammazione cronica[3]), i potenziali loci di incorporazione sono molteplici. La regolazione dell’alimentazione comporta, tra le altre reti, percorsi di ricompensa dopaminergici sotto controllo dall’alto verso il basso da parte del PFC, e nuclei ipotalamici che integrano i segnali nutritivi per indurre fame o sazietà, e spostamenti sistemici tra catabolismo e anabolismo[71]. Omeostasi energetica periferica comporta un’interazione di segnali anabolici (ad esempio, l’insulina) e catabolici (ad esempio, cortisolo, glucagone, epinefrina, epinefrina /norepinefrina) che promuovono l’aumento della glicemia e la resistenza all’insulina dei tessuti.
Considerando i meccanismi dei potenziali effetti ELA, l’infiammazione cronica, così come l’eccesso di segnalazione catabolica in quelli con ipercortisolemia, sono proposti per guidare la disfunzione metabolica. I modelli preliminari ipotizzano anche che l’ELA possa alterare in modo duraturo l’espressione epatica degli enzimi attivatori e metabolizzanti del cortisolo, migliorando la resistenza insulinica a livello tissutale anche in coloro che in seguito sopprimono l’ipercortisolemia[70]. Inoltre, uno studio precedente ha collegato l’ELA a un’alterazione dell’elaborazione della ricompensa centrale che promuove l’assunzione di cibo in eccesso in alcuni individui[72]. È necessario un ulteriore lavoro per esplorare i percorsi ipotizzati.
Asse 5: Il microbioma
Il microbioma intestinale rappresenta il genoma collettivo di quasi 100 trilioni di microrganismi commensali, tra cui oltre 1000 specie batteriche. La disbiosi, un disturbo patogeno della composizione microbica intestinale o delle interazioni tra microorganismi ospiti, è implicata in malattie come l’obesità, il diabete di tipo 2 e la depressione[73]. Mentre geneticamente influenzata, la composizione microbica dell’intestino risponde a fattori quali lo stress, la dieta, le infezioni, i farmaci e le tossine, rendendo l’intestino un potenziale mediatore tra ambiente e malattia. Vari studi precedenti hanno suggerito profondi effetti microbici sulla funzione neuroendocrina e immunitaria, tali che la disbiosi potrebbe aggravare i cambiamenti correlati all’ELA, tra cui la disregolazione del cortisolo e l’infiammazione cronica[73-77]. Inoltre, la crescente letteratura sull'”asse intestino-cervello” descrive l’influenza microbica sullo sviluppo e sul funzionamento neurale [78]. Le vie di influenza possono includere l’attivazione del nervo vago microbico, la segnalazione neurale da parte di metaboliti microbici o modelli molecolari, l’aumento dell’infiammazione con effetti neurali a valle, e l’induzione di cambiamenti epigenetici[77, 79, 80]. Nella sperimentazione animale e in alcuni piccoli studi sull’uomo, è stato dimostrato che la disbiosi ha anche un impatto sui parametri cerebrali e comportamentali rilevanti, tra cui la regolazione del cortisolo, la sintomatologia depressiva e ansiosa e il funzionamento sociale[77, 79].
Se l’ELA stessa produca la disbiosi è una questione di continuo interesse[74]. Uno studio sui roditori ha scoperto che la separazione materna infantile ha alterato in modo duraturo i microbioti fecali e ha aumentato la reattività infiammatoria successiva[81]. Il lavoro nelle scimmie, nel frattempo, ha trovato che la disbiosi transitoria innescata dalla separazione materna infantile prevedeva una disfunzione immunitaria duratura, sostenendo la possibilità di effetti microbici precoci sullo sviluppo in altri assi[82]. Se la ricerca umana replica tali risultati, le implicazioni per la salute possono essere considerevoli.
Effetti interattivi su tutti gli assi
Le prove di cui sopra illustrano come i cambiamenti fisiologici correlati all’ELA generano sinergie di alimentazione; per esempio, se la tossicità dei glucocorticoidi compromette le regioni cerebrali con il compito di regolare lo stress[29], o l’infiammazione legata allo stress perturba ulteriormente i processi neurali, microbici intestinali e gli assi metabolici per comporre la disregolazione dell’HPA e l’ulteriore infiammazione [83]. Nel frattempo, i cambiamenti funzionali del cervello (ad esempio, le funzioni esecutive alterate e l’elaborazione di ricompense) possono influenzare i comportamenti relativi alla salute e le esposizioni al rischio sociale in corso [84]. Gli effetti sinergici dell’ELA producono quindi cambiamenti fisiologici ad ampio spettro, caratterizzati da funzioni neurali aberranti, attività endocrina, infiammazione cronica, immunosoppressione, resistenza all’insulina e, potenzialmente, disbiosi. Questi cambiamenti sono sostanzialmente mediati da un alterato sviluppo dei sistemi di risposta allo stress; quando è acuta, l’attivazione di questi sistemi genera cambiamenti adattativi attraverso i sistemi del corpo (ad esempio, immunitario, metabolico, cardiovascolare) per affrontare le minacce. Tuttavia, l’attivazione cronica o eccessiva contribuisce al “logorio” fisiologico patogeno descritto nel paradigma del carico allostatico [15, 29]. In pieno, i cambiamenti indotti dall’ELA possono mediare i collegamenti epidemiologici a malattie chiave, tra cui, tra gli altri, l’obesità, dislipidemia, diabete di tipo 2, aterosclerosi, asma, eventi tromboembolici (infarto del miocardio, ictus), l’insorgenza e la progressione del cancro, così come le dipendenze, la psicopatologia e gli esiti sociali negativi[1- 6,18].
Suscettibilità differenziale alle avversità
Nonostante le tendenze descritte, i risultati tra gli individui esposti all’ELA sono molto diversi. Una ricca letteratura descrive questa apparente suscettibilità differenziale alle avversità, come selettivamente rivisto nella Tabella 2 e raccomandato come ulteriore lettura [85,86]. Alcuni dei modificatori osservati degli effetti ELA includono la genetica[25, 87-89], il sesso e/o il sesso infantile [19,90, 91], le caratteristiche dell’esposizione (ad esempio, tempistica, natura e intensità) [21,25], e la presenza di altri rischi o fattori protettivi [36]. Da notare che una letteratura sostanziale suggerisce che il caregiving è un fattore protettivo particolarmente potente che mitiga le associazioni ELA con parametri fisiologici, incluso l’elevato carico allostatico[92, 93], l’infiammazione [94], la reattività al cortisolo [95], e l’invecchiamento cellulare [96]. Considerando lo sviluppo neurologico, uno studio prospettico ha scoperto che i comportamenti di cura hanno mediato l’associazione dello stress socio-economico della prima infanzia con il cambiamento volumetrico dell’ippocampo[97]. Tabella 2Modificatori di effetti selezionatiModificatoreEsemplificatori di risultatiEsemplificazioni di risultatiAltra letturaLa variabilità genetica: polimorfismi genetici trovati per moderare le associazioni tra ELA e vari risultati; Esempi specifici di risultati influenzati da geni implicati includono: o Reattività allo stress emotivo e neuroendocrino: 5-HTTLPRLester et al., 2006 [86] o Risposta infiammatoria allo stress: 5-HTTLPRFredericks et al., 2010[88]o Forme comuni di psicopatologia, tra cui depressione, ADHD e dipendenza da sostanze: NR3C1, CRHR1, OXTR, 5-HTTLPRPR, HTR3A, DRD2, MAOA, BDNF, COMTo rischio di aterosclerosi: MAOANemeroff et al., 2016[25]Heim & Binder, 2012 [87]Zhao et al., 2013 [89]Sesso infantile e differenze di genere – Differenze sessuali complesse nell’HPA e nella disregolazione autonomica dopo lo stress precoce osservato negli animali e nell’uomoEssex et al., 2013[19]- Effetti differenziali dello stress materno vs. paterno sui ragazzi vs. ragazze porta alcuni a postulare la moderazione dell’effetto ELA da ruoli di genere socialmente incorporati- I moderatori genetici degli effetti dell’ELA possono essere il sesso e/o il genere specifico-o La meta-analisi ha trovato un effetto più forte del genotipo MAOA sulla psicopatologia nei ragazzi-o Diversi polimorfismi sul gene 5-HTTLPR sono stati collegati con un aumento del rischio di depressione a seguito di ELA nei maschi vs. femmineKim-Cohen et al., 2006[90]Brummet et al., 2008[91]Altre caratteristiche del bambino – Condizioni di salute preesistenti, ad es. prematurità, cattivo stato di salute fisica, ecc. alterano le conseguenze sociali e fisiologiche di ELADoom & Gunnar, 2015 [36]- Il temperamento del bambino, la sensibilità all’ambiente e l’elaborazione delle emozioni sono associati al rischio per la psicopatologia e possono influenzare i modi in cui i bambini rispondono alle avversitàLester et al., 2006[86]Caratteristiche dell’esposizione – Caratteristiche dell’esposizione, incluso il tipo (ad esempio, abuso sessuale, fisico, emotivo o trascuratezza), la cronicità e l’intensità, modificano le associazioni con i risultati di salute fisica e mentaleNemeroff et al, 2016[25]- Le esposizioni che si verificano durante i primi periodi sensibili possono avere un impatto maggiore su specifici domini dello sviluppo che portano a “effetti temporali” Bick & Nelson, 2016 [21]Contesto sociale e di assistenza – Struttura e stabilità della famiglia, ordine di nascita, stress del caregiver e sostegno sociale, comunità e contesto sociale possono modificare gli effetti di specifiche avversitàDoom & Gunnar, 2015[36]- La presenza di un caregiver affidabile e di supporto può “tamponare” i bambini dagli effetti di un ambiente altrimenti avversoCumulativo – La relazione dose-risposta tra numero di avversità ed effetti sanitari e sociali è osservata in ampi studi epidemiologiciFelitti et al., 1998[1]Danese et al., 2009[3]ADHD disturbo da deficit di attenzione e iperattività, HLA ipotalamo-ipofisi-surrene, ELA avversità nelle prime fasi della vita
Applicazioni cliniche, di ricerca e di sanità pubblica
Le prove che collegano l’ELA alla salute per tutta la vita sono sostanziali, con importanti implicazioni per la pratica clinica e la salute pubblica riassunte nella Tabella 3. In particolare, evidenziamo quattro raccomandazioni. In primo luogo, suggeriamo che lo screening per la ELA dovrebbe diventare una parte di routine dell’assistenza clinica per bambini e adulti. Questo aspetto dell'”anamnesi dello sviluppo” può fornire informazioni sul rischio del paziente di gravi malattie pediatriche e adulte, facilitando il sostegno sociale, l’intervento protettivo e/o le decisioni sullo screening e la prevenzione delle malattie.Tabella 3 Implicazioni cliniche proposte dei risultati della revisione Attività del medicoRaccomandazioniRisorse raccomandateRisorse raccomandateEziologia della malattia e rischio di comprensione eziologia della malattia e rischioConsideriamo come la ELA contribuisce al rischio di problemi di salute comuni del paziente, ad esempio:- Disturbi della salute mentale: Depressione, ansia, disturbi da uso di sostanze, disturbi da stress post-traumatico, psicosi – malattie cardiovascolari: Malattia cardiaca ischemica, ipertensione, aterosclerosi – Patologia metabolica: Obesità, diabete di tipo 2, dislipidemia, sindrome metabolica – Neoplasia: Cancri al seno, al fegato, ai polmoniRisultati di importanti studi epidemiologici che valutano gli effetti sulla salute dell’ELA[1- 6]Ulteriori letture suggerite in tuttoScreening- Schermo per la storia dell’ELA- Valutare le esigenze di servizio sociale e di protezione- Considerare l’anamnesi di ELA nella valutazione del rischio e nello screening per le malattie correlate a ELA o per le esigenze di sviluppoAdverse Childhood Experiences Questionnaire[1]WHO Adverse Childhood Experiences International Questionnaire[104]American Academy of Pediatrics Resilience Project Clinical Screening Tools[105]InterventoPraticageneraleFornisci l’accesso a:- Sanità mentale – Prevenzione precoce e trattamento di altre malattie correlate all’ELA – Servizi sociali e riduzione della povertà – Interventi di prevenzione e risposta alla violenza –Praticapediatrica – Programmi di sostegno allefamigliee ai caregiver – Interventi di sviluppo precoce- Servizi per prevenire o rispondere alle esposizioni ELA, inclusi i servizi di protezione dell’infanziaWHO Guida alla prevenzione del maltrattamento infantile[106]WHO mhGAP Intervention Guide[107]Risorse per interventi a sostegno dello sviluppo di bambini sani da Frontiers of Innovation – Center on the Developing Child at Harvard University [108]Trasformare i modelli di curaAdottare le migliori pratiche dai “modelli di casa medica” per sostenere i pazienti esposti alle ELA, incluse le strategie di promozione:- Cure avvolgenti incentrate sul paziente e sulla famiglia – Competenza culturale – Accesso migliorato e follow-up – Centro nazionale per gli strumenti e le risorse per l’implementazione di case di cura [109]AdvocacyIncorporare le prove sulla ELA nell’attività di advocacy relativa:- Accesso ai servizi di salute mentale – Riduzione della povertà, riforma della giustizia penale e prevenzione della violenza – Congedo parentale equo e assistenza all’infanzia di alta qualità – Politiche per l’immigrazione e per i rifugiati che proteggono i bambini e le famiglieWHO pacchetto di linee guida su Advocacy for Mental Health [110]Fondo delle Nazioni Unite per l’Infanzia e strumenti per i diritti dei bambini [111]Risorse per le campagne del Fondo per la difesa dei bambini [112]ELA early lifeadversity, Organizzazione Mondiale della Sanità dell’OMS
In secondo luogo, lo screening per l’ELA deve essere accompagnato da investimenti per lo scale-up di interventi noti ed efficaci per la promozione della salute, affrontando l’ELA. Le prove evidenti suggeriscono che gli interventi focalizzati sul caregiving, per esempio, possono mitigare gli effetti fisiologici dell’ELA. Alcuni parametri migliorati da interventi focalizzati sul caregiving nella ricerca longitudinale includono l’infiammazione cronica associata all’ELA[98], l’accorciamento dei telomeri (invecchiamento genetico accelerato)[99], e i cambiamenti volumetrici della materia grigia[100]. Allo stesso modo, la reattività al cortisolo sembra essere sensibile agli interventi mirati al caregiver e agli interventi di supporto psicologico con individui esposti all’ELA [101]. Gli investimenti su scala devono includere il monitoraggio della qualità e la valutazione continua dell’impatto su scala. Le valutazioni devono disaggregare gli effetti per sottogruppi di popolazione, ad esempio, come definiti da cultura, SSA, religione, razza o etnia, per identificare i diversi bisogni[102].
In terzo luogo, gli investigatori devono continuare a testare nuove strategie di intervento per prevenire o ridurre gli effetti fisiologici dell’ELA. I nuovi approcci devono essere sempre più mirati (ad esempio, basati sulla variazione della risposta in funzione del genotipo), scalabili, efficaci e basati sull’evidenza, avvalendosi della ricca letteratura sull’incorporazione biologica. In particolare, sono necessari nuovi approcci per raggiungere le famiglie più vulnerabili, spesso meno colpite dalle strategie esistenti[102]. Gli sforzi dovrebbero essere aiutati dal continuo sviluppo di biomarcatori di ELA[103], che possono essere utilizzati per tracciare gli effetti dell’intervento e ottimizzare i tempi e il targeting. Ulteriori priorità di ricerca includono una migliore caratterizzazione dei collegamenti tra biomarcatori ELA e l’uso coerente di misure di ELA potenziali.
Infine, raccomandiamo ai professionisti di diversi settori sociali di riconoscere l’ELA come un terreno comune che dà origine a varie manifestazioni di cattiva salute nel corso della vita, e di allineare meglio le strategie per far progredire il benessere dei bambini e la salute pubblica. I paradigmi di prevenzione delle malattie devono andare oltre la focalizzazione prossimale sui comportamenti a rischio (ad esempio, dieta, uso di sostanze) per specifiche malattie verso modelli di vita che tengano conto delle influenze precoci sulla salute di tutta la vita. Gli sforzi richiedono un coordinamento tra i settori della salute, dei servizi sociali, dell’istruzione, della giustizia, della protezione dell’infanzia e altri settori per migliorare l’allineamento intorno ai bisogni dei bambini. Tra le altre priorità, le priorità rilevanti potrebbero includere il miglioramento dell’accesso ai servizi di salute mentale, l’assistenza all’infanzia e il congedo parentale, l’espansione dei programmi di povertà familiare, la ricerca di pratiche di immigrazione e di giustizia penale che evitino di separare i bambini da chi si prende cura di loro e la lotta contro le disuguaglianze razziali che hanno un impatto sui bambini.
Conclusioni
I risultati qui esaminati esplorano vari meccanismi biologici che possono spiegare i legami tra le esperienze infantili avverse e la malattia. Queste intuizioni possono informare gli sforzi per migliorare la salute in tutto il corso della vita. Poiché l’emergere di nuovi strumenti, come i biomarcatori delle avversità precoci, guida una nuova ondata di ricerca di intervento, è necessaria una forte collaborazione tra medici e operatori sanitari pubblici, famiglie e comunità, basata su un profondo apprezzamento per gli effetti delle avversità precoci. La comprensione della fisiologia dell’incorporazione biologica, come qui esplorato, sostiene gli sforzi di trasformazione della pratica.
References
- Felitti VJ, Anda RF, Nordenberg D, Williamson DF, Spitz AM, Edwards V. Relationship of childhood abuse and household dysfunction to many of the leading causes of death in adults: The Adverse Childhood Experiences (ACE) Study. Am J Prev Med. 1998; 14(4):245-58. DOI | PubMed
- Liu Y, Croft JB, Chapman DP, Perry GS, Greenlund KJ, Zhao G, Edwards VJ. Relationship between adverse childhood experiences and unemployment among adults from five U.S. states. Soc Psychiatry Psychiatr Epidemiol. 2013; 48(3):357-69. DOI | PubMed
- Danese A, Moffitt TE, Harrington H, Milne BJ, Polanczyk G, Pariante CM. Adverse childhood experiences and adult risk factors for age-related disease: depression, inflammation, and clustering of metabolic risk markers. Arch Pediatr Adolesc Med. 2009; 163(12):1135-43. DOI | PubMed
- Giovanelli A, Reynolds AJ, Mondi CF, Ou SR. Adverse childhood experiences and adult well-being in a low-income, urban cohort. Pediatrics. 2016;137(4):e20154016. doi:10.1542/peds.2015-4016.
- Flaherty EG, Thompson R, Dubowitz H. Adverse childhood experiences and child health in early adolescence. JAMA Pediatr. 2013; 167(7):622-9. DOI | PubMed
- Richards M, Wadsworth MEJ. Long term effects of early adversity on cognitive function. Arch Dis Child. 2004; 89(10):922-7. DOI | PubMed
- Kelly-Irving M, Mabile L, Grosclaude P, Lang T, Delpierre C. The embodiment of adverse childhood experiences and cancer development: potential biological mechanisms and pathways across the life course. Int J Public Health. 2013; 58:3-11. DOI | PubMed
- Kelly-Irving M, Lepage B, Dedieu D, Bartley M, Blane D, Grosclaude P, Lang T, Delpierre C. Adverse childhood experiences and premature all-cause mortality. Eur J Epidemiol. 2013; 28:1-14. DOI | PubMed
- Barboza Solís C, Kelly-Irving M, Fantin R, Darnaudéry M, Torrisani J, Lang T, Delpierre C. Adverse childhood experiences and physiological wear-and-tear in midlife: findings from the 1958 British birth cohort. Proc Natl Acad Sci U S A. 2015; 112(7):E738-46. DOI | PubMed
- Hertzman C. Putting the concept of biological embedding in historical perspective. Proc Natl Acad Sci U S A. 2012; 109(Supplement 2):17160-7. DOI | PubMed
- Graignic-Philippe R, Dayan J, Chokron S, Jacquet AY, Tordjman S. Effects of prenatal stress on fetal and child development: a critical literature review. Neurosci Biobehav Rev. 2014; 43:137-62. DOI | PubMed
- Martikainen P, Bartley M, Lahelma E. Psychosocial determinants of health in social epidemiology. Int J Epidemiol. 2002; 31(6):1091-3. DOI | PubMed
- Hillis S, Mercy J, Amobi A, Kress H. Global prevalence of past-year violence against children: a systematic review and minimum estimates. Pediatrics. 2016; 137(3):1-13. DOI
- Moussavi S, Somnath S, Verdes E, Tandon A, Patel V, Ustun B. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Lancet. 2007; 370(9590):851-8. DOI | PubMed
- McEwen BS, Gianaros PJ. Stress- and allostasis-induced brain plasticity. Annu Rev Med. 2011; 62:431-45. DOI | PubMed
- Fox SE, Levitt P, Nelson CA. How the timing and quality of early experiences influence the development of brain architecture. Child Dev. 2010; 81:28-40. DOI | PubMed
- Avitsur R, Levy S, Goren N, Grinshpahet R. Early adversity, immunity and infectious disease. Stress. 2015; 18(3):289-96. DOI | PubMed
- Miller GE, Chen E, Parker KJ. Psychological stress in childhood and susceptibility to the chronic diseases of aging: moving toward a model of behavioral and biological mechanisms. Psychol Bull. 2011; 137:959-97. DOI | PubMed
- Essex MJ, Boyce WT, Hertzman C, Lam LL, Armstrong JM, Neumann SM, Kobor MS. Epigenetic vestiges of early developmental adversity: childhood stress exposure and DNA methylation in adolescence. Child Dev. 2013; 84:58-75. DOI | PubMed
- Reuben A, Moffitt TE, Caspi A, Belsky DW, Harrington H, Schroeder F. Lest we forget: comparing retrospective and prospective assessments of adverse childhood experiences in the prediction of adult health. J Child Psychol Psychiatry. 2016; 57(10):1103-12. DOI | PubMed
- Bick J, Nelson CA. Early adverse experiences and the developing brain. Neuropsychopharmacology. 2016; 41:177-96. DOI | PubMed
- Knickmeyer RC, Gouttard S, Kang C, Evans D, Wilber K, Smith JK. A structural MRI study of human brain development from birth to 2 years. J Neurosci. 2008; 28(47):12176. DOI | PubMed
- Deoni SCL, Dean DC, O’Muircheartaigh J, Dirks H, Jerskey BA. Investigating white matter development in infancy and early childhood using myelin water faction and relaxation time mapping. Neuroimage. 2012; 63(3):1038-53. DOI | PubMed
- Hart H, Rubia K. Neuroimaging of child abuse: a critical review. Front Hum Neurosci. 2012; 6:52. DOI | PubMed
- Nemeroff CB. Paradise lost: the neurobiological and clinical consequences of child abuse and neglect. Neuron. 2016; 89:892-909. DOI | PubMed
- McEwen BS, Nasca C, Gray JD. Stress effects on neuronal structure: hippocampus, amygdala, and prefrontal cortex. Neuropsychopharmacology. 2016; 41:3-23. DOI | PubMed
- Tottenham N, Sheridan MA. A review of adversity, the amygdala and the hippocampus: a consideration of developmental timing. Front Hum Neurosci. 2010; 3:68. PubMed
- Uno H, Eisele S, Sakai A, Shelton S, Baker E, DeJesus O, Holden J. Neurotoxicity of glucocorticoids in the primate brain. Horm Behav. 1994; 28(4):336-48. DOI | PubMed
- Danese A, McEwen BS. Adverse childhood experiences, allostasis, allostatic load, and age-related disease. Physiol Behav. 2012; 106:29-39. DOI | PubMed
- Do KQ, Cuenod M, Hensch TK. Targeting oxidative stress and aberrant critical period plasticity in the developmental trajectory to schizophrenia. Schizophr Bull. 2015; 41(4):835-46. DOI | PubMed
- Sarro EC, Sullivan RM, Barr G. Unpredictable neonatal stress enhances adult anxiety and alters amygdala gene expression related to serotonin and GABA. Neurosci. 2014; 258:147-61. DOI
- Berens AE, Nelson CA. The science of early adversity: is there a role for large institutions in the care of vulnerable children?. Lancet. 2015; 386(9991):388-98. DOI | PubMed
- Knudsen EI. Sensitive periods in the development of the brain and behavior. J Cogn Neurosci. 2004; 16:1412-25. DOI | PubMed
- McLaughlin KA, Sheridan MA, Winter W, Fox NA, Zeanah CH, Nelson CA. Widespread reductions in cortical thickness following severe early-life deprivation: a neurodevelopmental pathway to attention-deficit/hyperactivity disorder. Biol Psychiatry. 2014; 76(8):629-38. DOI | PubMed
- McLaughlin KA, Sheridan MA, Lambert HK. Childhood adversity and neural development: Deprivation and threat as distinct dimensions of early experience. Neurosci Biobehav Rev. 2014; 47:578-91. DOI | PubMed
- Doom JR, Gunnar MR. Stress in infancy and early childhood: effects on development. In: Wright JD, Ed. International Encyclopedia of the Social & Behavioral Sciences. Amsterdam: Elsevier Science & Technology; 2015. Vol. 23. pp. 577–82.
- Liston C, Gan WB. Glucocorticoids are critical regulators of dendritic spine development and plasticity in vivo. Proc Natl Acad Sci U S A. 2011; 108(38):16074-9. DOI | PubMed
- Jensen SK, Dickie EW, Schwartz DH. Effect of early adversity and childhood internalizing symptoms on brain structure in young men. JAMA Pediatr. 2015; 169(10):938-46. DOI | PubMed
- Hensch TK, Bilimoria PM. Re-opening windows: manipulating critical periods for brain development. Cerebrum. 2012; 2012:11. PubMed
- Nusslock R, Miller GE. Early-life adversity and physical and emotional health across the lifespan: a neuroimmune network hypothesis. Biol Psychiatry. 2016; 80:23-32. DOI | PubMed
- Dillon DG, Holmes AJ, Birk JL, Brooks N, Lyons-Ruth K, Pizzagalli DA. Childhood adversity is associated with left basal ganglia dysfunction during reward anticipation in adulthood. Biol Psychiatry. 2009; 66(3):206-13. DOI | PubMed
- Tawakol A, Ishai A, Takx RAP. Relation between resting amygdalar activity and cardiovascular events: a longitudinal and cohort study. Lancet. 2017; 389(10071):834-45. DOI | PubMed
- Meaney MJ. Maternal care, gene expression, and the transmission of individual differences in stress reactivity across generations. Annu Rev Neurosci. 2001; 24:1161-92. DOI | PubMed
- Lovallo WR. Early life adversity reduces stress reactivity and enhances impulsive behavior: Implications for health behaviors. Int J Psychophysiol. 2013; 90:8-16. DOI | PubMed
- Rao U, Hammen C, Ortiz LR, Chen L, Poland RE. Effects of early and recent adverse experiences on adrenal response to psychosocial stress in depressed adolescents. Biol Psychiatry. 2008; 64:521-6. DOI | PubMed
- Tyrka AR, Price LH, Gelernter J, Schepker C, Anderson GM, Carpenter LL. Interaction of childhood maltreatment with the corticotropin-releasing hormone receptor gene: effects on hypothalamic-pituitary-adrenal axis reactivity. Biol Psyc. 2009; 66:681-5. DOI
- Heim C, Newport DJ, Heit S, Graham YP, Wilcox M, Bonsall R. Pituitary-adrenal and autonomic responses to stress in women after sexual and physical abuse in childhood. JAMA. 2000; 284(5):592-7. DOI | PubMed
- Raison CL, Miller AH. When not enough is too much: the role of insufficient glucocorticoid signaling in the pathophysiology of stress-related disorders. Am J Psychiatry. 2003; 160(9):1554-65. DOI | PubMed
- Antoni MH, Lutgendorf SK, Cole SW, Dhabhar FS, Sephton SE, McDonald PG. The influence of bio-behavioural factors on tumour biology: pathways and mechanisms. Nat Rev Cancer. 2006; 6(3):240-8. DOI | PubMed
- McEwen BS. Brain on stress: How the social environment gets under the skin. Proc Natl Acad Sci U S A. 2012; 109:17180-5. DOI | PubMed
- Meaney MJ, Szyf M. Maternal care as a model for experience-dependent chromatin plasticity?. Trends Neurosci. 2005; 28:456-63. DOI | PubMed
- McGowan P, Szyf M. The epigenetics of social adversity in early life: Implications for mental health outcomes. Neurobiol Dis. 2010; 39:66-72. DOI | PubMed
- Perroud N, Paoloni-Giacobino A, Prada P, Olie E, Salzmann A, Nicastro R. Increased methylation of glucocorticoid receptor gene (NR3C1) in adults with a history of childhood maltreatment: a link with the severity and type of trauma. Transl Psychiatry. 2011; 1(12)DOI | PubMed
- McGowan PO, Roth TL. Epigenetic pathways through which experiences become linked with biology. Dev Psychopathol. 2015; 27:637-48. DOI | PubMed
- Alkon A, Wolff B, Boyce WT. Poverty, Stress, and Autonomic Reactivity. The Oxford Handbook of Poverty and Child Development. Oxford University Press: New York, NY; 2012.
- El-Sheikh M, Kouros CD, Erath S, Cummings E, Keller P, Staton L. Marital Conflict and Children’s Externalizing Behavior: Interactions between Parasympathetic and Sympathetic Nervous System Activity. Monographs of the Society for Research in Child Development Series. Wiley; 2009.
- Gatt JM, Nemeroff CB, Dobson-Stone C, Paul RH, Bryant RA, Schofield PR. Interactions between BDNF Val66Met polymorphism and early life stress predict brain and arousal pathways to syndromal depression and anxiety. Mol Psychiatry. 2009; 14:681-95. DOI | PubMed
- Kanterman J, Sade-Feldman M, Baniyash M. New insights into chronic inflammation-induced immunosuppression. Semin Cancer Biol. 2012; 22:307-18. DOI | PubMed
- Fagundes CP, Glaser R, Kiecolt-Glaser JK. Stressful early life experiences and immune dysregulation across the lifespan. Brain Behav Immun. 2013; 27:8-12. DOI | PubMed
- Shirtcliff EA, Coe CL, Pollak SD. Early childhood stress is associated with elevated antibody levels to herpes simplex virus type 1. Proc Natl Acad Sci U S A. 2009; 106(8):2963. DOI | PubMed
- Slopen N, McLaughlin KA, Dunn EC, Koenen KC. Childhood adversity and cell-mediated immunity in young adulthood: does type and timing matter?. Brain Behav Immun. 2013; 28:63-71. DOI | PubMed
- Lemieux A, Coe CL, Carnes M. Symptom severity predicts degree of T cell activation in adult women following childhood maltreatment. Brain Behav Immun. 2008; 22:994-1003. DOI | PubMed
- Miller GE, Chen E. Harsh family climate in early life presages the emergence of a proinflammatory phenotype in adolescence. Psychol Sci. 2010; 21(6):848-56. DOI | PubMed
- Miller GE, Chen E, Fok AK. Low early-life social class leaves a biological residue manifested by decreased glucocorticoid and increased proinflammatory signaling. Proc Natl Acad Sci U S A. 2009; 106(34):14716-21. DOI | PubMed
- Powell ND, Sloan EK, Bailey MT. Social stress up-regulates inflammatory gene expression in the leukocyte transcriptome via β-adrenergic induction of myelopoiesis. Proc Natl Acad Sci U S A. 2013; 110(41):16574-9. DOI | PubMed
- Slopen N, Koenen KC, Kubzansky LD. Childhood adversity and immune and inflammatory biomarkers associated with cardiovascular risk in youth: a systematic review. Brain Behav Immun. 2012; 26:239-50. DOI | PubMed
- Baumeister D, Akhtar R, Ciufolini S, Pariante C, Mondelli V. Childhood trauma and adulthood inflammation: a meta-analysis of peripheral C-reactive protein, interleukin-6 and tumour necrosis factor-alpha. Mol Psychiatry. 2016; 21(5):642-9. DOI | PubMed
- Godbout JP, Glaser R. Stress-induced immune dysregulation: implications for wound healing, infectious disease and cancer. J Neuroimmune Pharmacol. 2006; 1(4):421-7. DOI | PubMed
- Thomas C, Hypponen E, Power C. Obesity and type 2 diabetes risk in midadult life: the role of childhood adversity. Pediatrics. 2008; 121:e1240-9. DOI | PubMed
- Maniam J, Antoniadis C, Morris MJ. Early-life stress, HPA axis adaptation, and mechanisms contributing to later health outcomes. Front Endocrinol. 2014; 5:73. DOI
- Schwartz MW, Woods SC, Porte D, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature. 2000; 404:661-71. PubMed
- Mason SM, Flint AJ, Field AE, Austin SB, Rich‐Edwards JW. Abuse victimization in childhood or adolescence and risk of food addiction in adult women. Obesity. 2013; 21(12):E775-E81. DOI | PubMed
- Moloney RD, Desbonnet L, Clarke G, Dinan TG, Cryan JF. The microbiome: stress, health and disease. Mamm Genome. 2014; 25:49-74. DOI | PubMed
- O’Mahony SM, Clarke G, Dinan TG, Cryan JF. Early-life adversity and brain development: Is the microbiome a missing piece of the puzzle?. Neuroscience. 2017; 342:37-54. DOI | PubMed
- Clarke G, O’Mahony SM, Dinan TG, Cryan JF. Priming for health: gut microbiota acquired in early life regulates physiology, brain and behaviour. Acta Paediatr. 2014; 103:812-9. DOI | PubMed
- Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN. Postnatal microbial colonization programs the hypothalamic–pituitary–adrenal system for stress response in mice. J Physiol. 2004; 558(1):263-75. DOI | PubMed
- Mayer EA, Knight R, Mazmanian SK, Cryan JF, Tillisch K. Gut microbes and the brain: paradigm shift in neuroscience. J Neurosci. 2014; 34(46):15490-6. DOI | PubMed
- Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012; 13:701-12. DOI | PubMed
- Sampson TR, Mazmanian SK. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe. 2015; 17:565-76. DOI | PubMed
- Stilling RM, Dinan TG, Cryan JF. Microbial genes, brain & behaviour: Epigenetic regulation of the gut–brain axis. Genes Brain Behav. 2014; 13(1):69-86. DOI | PubMed
- O’Mahony SM, Marchesi JR, Scully P, Codling C, Ceolho A, Quiggley EM. Early life stress alters behavior, immunity, and microbiota in rats: implications for irritable bowel syndrome and psychiatric illnesses. Biol Psychiatry. 2009; 65:263-7. DOI | PubMed
- Bailey MT, Dowd SE, Galley JD, Hufnagle AR, Allen RG, Lyte M. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation. Brain Behav Immun. 2011; 25:397-407. DOI | PubMed
- Ganguly P, Brenhouse HC. Broken or maladaptive? Altered trajectories in neuroinflammation and behavior after early life adversity. Dev Cogn Neurosci. 2015; 11:18-30. DOI | PubMed
- Hertzman C, Boyce T. How experience gets under the skin to create gradients in developmental health. Annu Rev Public Health. 2010; 31:329-47. DOI | PubMed
- Ellis BJ, Essex MJ, Boyce WT. Biological sensitivity to context: II. Empirical explorations of an evolutionary-developmental theory. Dev Psychopathol. 2005; 17:303-28. DOI | PubMed
- Resilience in Children. Blackwell Publications on behalf of the New York Academy of Sciences: Boston; 2006.
- Heim C, Binder EB. Current research trends in early life stress and depression: Review of human studies on sensitive periods, gene-environment interactions, and epigenetics. Exp Neurol. 2012; 233:102-11. DOI | PubMed
- Fredericks CA, Drabant EM, Edge MD, Tillie JM, Hallmayer J, Ramel W. Healthy young women with serotonin transporter SS polymorphism show a pro-inflammatory bias under resting and stress conditions. Brain Behave Immun. 2010; 24(3):350-7. DOI
- Zhao J, Bremner JD, Goldberg J, Quyyumi AA, Vaccarino V. MAOA genotype, childhood trauma and subclinical atherosclerosis: a twin study. Psychosom Med. 2013; 75(5):471-7. DOI | PubMed
- Kim-Cohen J, Caspi A, Taylor A, Williams B, Newcombe R, Craig IW, Moffitt TE. MAOA, maltreatment, and gene-environment interaction predicting children’s mental health: new evidence and a meta-analysis. Molec Psychiatry. 2006; 11(10):903. DOI | PubMed
- Brummett BH, Boyle SH, Siegler IC. Effects of environmental stress and gender on associations among symptoms of depression and the serotonin transporter gene linked polymorphic region (5-HTTLPR). Behav Genet. 2008; 38(1):34-43. DOI | PubMed
- Evans GW, Kim P, Ting AH, Tesher HB, Shannis D. Cumulative risk, maternal responsiveness, and allostatic load among young adolescents. Dev Psychol. 2007; 43(2):341-51. DOI | PubMed
- Carroll JE, Gruenewald TL, Taylor SE, Janicki-Deverts D, Matthews KA, Seeman TE. Childhood abuse, parental warmth, and adult multisystem biological risk in the Coronary Artery Risk Development in Young Adults study. Proc Natl Acad Sci U S A. 2013; 110(42):17149-53. DOI | PubMed
- Chen E, Miller GE, Kobor MS, Cole SW. Maternal warmth buffers the effects of low early-life socioeconomic status on pro-inflammatory signaling in adulthood. Mol Psychiatry. 2011; 16(7):729-37. DOI | PubMed
- Luecken LJ. Parental caring and loss during childhood and adult cortisol responses to stress. Psychol Health. 2000; 15(6):841-51. DOI
- Brody GH, Yu T, Beach SR. Resilience to adversity and the early origins of disease. Dev Psychopathol. 2016; 28:1347-65. DOI | PubMed
- Luby J, Belden A, Botteron K, Marrus N, Harms M, Babb C. The effects of poverty on childhood brain development: the mediating effect of caregiving and stressful life events. JAMA Pediatr. 2013; 167(12):1135-42. DOI | PubMed
- Miller GE, Brody GH, Yu T, Chen E. A family-oriented psychosocial intervention reduces inflammation in low-SES African American youth. Proc Natl Acad Sci U S A. 2014; 111(31):11287-92. DOI | PubMed
- Drury SS, Theall K, Gleason MM, Smyke AT, De Vivo I, Wong JYY. Telomere length and early severe social deprivation: linking early adversity and cellular aging. Mol Psychiatry. 2012; 17:719-27. DOI | PubMed
- Brody GH, Gray JC, Yu T, Barton AW, Beach SR, Galván A. Protective prevention effects on the association of poverty with brain development. JAMA Pediatr. 2017; 171(1):46-52. DOI | PubMed
- Slopen N, McLaughlin KA, Shonkoff JP. Interventions to improve cortisol regulation in children: a systematic review. Pediatrics. 2014; 133(2):312-26. DOI | PubMed
- Shonkoff JP. Building a new biodevelopmental framework to guide the future of early childhood policy. Child Dev. 2010; 81(1):357-67. DOI | PubMed
- . Accessed 1 Nov 2016.Publisher Full Text
- World Health Organization. Adverse Childhood Experiences International Questionnaire (ACE-IQ). WHO: Geneva; 2014.
- American Academy of Pediatrics. The Resilience Project. American Academy of Pediatrics: Elk Grove Village, IL; 2016.
- World Health Organization. Preventing Child Maltreatment: A Guide to Taking Action and Generating Evidence. WHO: Geneva; 2006.
- World Health Organization. mhGAP Intervention Guide for Mental, Neurological and Substance Use Disorders in Non-specialized Health Settings. WHO: Geneva; 2010.
- Center on the Developing Child at Harvard University. Fronteirs of Innovation: Innovation in Action. Harvard University: Cambridge, MA; 2016.
- National Center for Medical Home Implementation. Tools & Resources. American Academy of Pediatrics: Elk Grove Village, IL; 2016.
- World Health Organization. Advocacy for Mental Health: Mental Health Policy and Service Guidance Package. WHO: Geneva; 2003.
- UNICEF. Policy advocacy and partnerships for children’s rights. UNICEF: New York, NY; 2016.
- Children’s Defense Fund. Children’s Defense Fund Campaigns. Children’s Defense Fund: Washington, DC; 2016.
- Bhutta ZA, Guerrant RL. Nelson 3rd CA. Neurodevelopment, nutrition, and inflammation: the evolving global child health landscape. Pediatrics. 2017; 139(Suppl 1):S12-S22. DOI | PubMed
Fonte
Berens AE, Jensen SKG, Nelson CA (2017) Biological embedding of childhood adversity: from physiological mechanisms to clinical implications. BMC Medicine 15135. https://doi.org/10.1186/s12916-017-0895-4





