Abstract
Introduzione
Negli adulti, la percezione del dolore è modulata dal sistema modulatorio discendente del dolore (DPMS), permettendo a fattori ambientali, contestuali e cognitivi di influenzare le nostre esperienze di dolore(McMahon et al., 2013; Ossipov et al., 2010; Tracey e Mantyh, 2007). Il DPMS comprende una rete di regioni cerebrali corticali e sottocorticali che possono facilitare o inibire l’input cerebrale afferente nocicettivo attraverso i nuclei del tronco encefalico(Ossipov et al., 2010; Tracey, 2010; Zhuo e Gebhart, 1997). La connettività funzionale del DPMS è alterata in condizioni di dolore cronico adulto come emicrania, mal di schiena, fibromialgia e neuropatia diabetica dolorosa(Jensen et al., 2012; Mainero et al., 2011; Segerdahl et al., 2018; Yu et al., 2014), e le alterazioni transitorie nella connettività del DPMS influenzano la percezione del dolore. Ad esempio, la connettività funzionale pre-stimolo tra l’insula anteriore (AI) e il grigio periaqueduttale (PAG) si riferisce alla percezione o meno di uno stimolo nocivo come doloroso(Ploner et al., 2010), e l’attività pre-stimolo nella corteccia cingolata insulare e anteriore (ACC) è predittiva delle valutazioni successive dell’intensità del dolore(Boly et al., 2007). Inoltre, l’attività anticipatrice del tronco encefalico negli adulti ha dimostrato di prevedere i cambiamenti nell’attività insula evocata dalla stimolazione termica nociva(Fairhurst et al., 2007).
I risultati di studi su animali suggeriscono che la modulazione del dolore discendente del neonato è immatura(Hathway et al., 2009). Durante le prime 3 settimane postnatali, le proiezioni anatomiche discendenti al corno dorsale sono fisicamente presenti; tuttavia, l’inibizione fisiologica dell’input nocicettivo è inefficace o assente nei cuccioli di ratto(Hathway et al., 2009; Fitzgerald e Koltzenburg, 1986; Hathway et al., 2006). Inoltre, i nuclei del tronco encefalico nel midollo ventromediale rostrale (RVM), che sono la principale fonte di queste proiezioni, facilitano esclusivamente l’attività nocicettiva della colonna vertebrale, piuttosto che esercitare un controllo nocicettivo più bifasico e facilitatorio, simile a quello degli adulti(Hathway et al., 2009; Schwaller et al., 2017). Nel neonato umano, i riflessi spinali sono scoordinati, esagerati e prolungati(Andrews e Fitzgerald, 1994; Cornelissen et al., 2013; Hartley et al., 2016). I riflessi nocicettivi sono affinati postnatalmente nei neonati nati prematuri e, in base all’età, i riflessi del neonato hanno un’ampiezza e una durata inferiori rispetto ai neonati prematuri(Cornelissen et al., 2013; Hartley et al., 2016). Durante questo periodo di sviluppo, il perfezionamento postnatale dell’eccitabilità del midollo spinale è concomitante con la maturazione dell’attività cerebrale nocicettiva(Hartley et al., 2016), portando alla possibilità che nel neonato a termine, le regioni cerebrali coinvolte nella modulazione del dolore discendente possano influenzare il comportamento e l’esperienza del dolore.
Nel nostro precedente lavoro, abbiamo usato la fMRI per dimostrare che i modelli di attività cerebrale nociva nel neonato sono simili a quelli osservati nell’adulto, e includono sia le regioni cerebrali sensoriali che affettive(Goksan et al., 2015). Dato che non possiamo misurare l’esperienza soggettiva del dolore nei neonati non verbali, ci affidiamo a misure surrogate oggettive come i cambiamenti nell’attività di BOLD nocivo-evocata per fare inferenze sulle esperienze di dolore(Baumgärtner et al., 2010; Lee et al., 2008; Maihöfner e Handwerker, 2005). L’utilizzo di questo approccio offre l’opportunità di indagare se la forza della connettività di rete tra le regioni cerebrali coinvolte nella modulazione del dolore discendente modifica il dolore infantile. Lo scopo di questo studio è stato quello di testare l’ipotesi che nel neonato umano, la grandezza dell’attività cerebrale nociva-evocata registrata utilizzando fMRI in risposta a uno stimolo nocicettivo standardizzato è legata alla connettività funzionale pre-stimolo delle regioni cerebrali note per comprendere il DPMS.
Risultati e discussione
Connettività funzionale pre-stimolo nel DPMS infantile
Lieve stimolazione sperimentale nocivo è stato applicato al piede del bambino utilizzando un 128 mN PinPrick stimolatore PinPrick. Per accertare la connettività funzionale pre-stimolo, abbiamo estratto il segnale BOLD degradato dai tre volumi registrati immediatamente prima dell’applicazione dello stimolo, che sono stati acquisiti entro il periodo di 10 s pre-stimolo (vedi Materiali e metodi e Figura 3-figure supplemento 2A). Abbiamo estratto questi corsi temporali per la Rete DPMS, e per le regioni cerebrali in due reti di controllo – la prima, denominata “Rete di controllo” ha una topografia simile alla Rete DPMS, e la seconda rete è una rete a riposo ben riconosciuta (la Default Mode Network). La rete DPMS Network comprendeva l’IA bilaterale, ACC, amigdala (AMY), RVM, PAG, e il giroscopio frontale medio (mFG) situato all’interno della corteccia prefrontale dorsolaterale(Figura 1A). Questo include le principali strutture cerebrali identificate nel DPMS adulto(McMahon et al., 2013; Schweinhardt e Bushnell, 2010). La rete di controllo comprendeva un insieme di regioni cerebrali che non sono segnalati per essere coinvolti nella modulazione del dolore discendente, ma comprendeva distinte strutture corticali, sottocorticali e del tronco encefalico, e aveva una distribuzione topografica simile alle regioni cerebrali DPMS. Mentre la Control Network non è una rete funzionale nota all’interno del cervello, questa rete controlla i segnali globali, ad esempio quelli respiratori o cardiovascolari. Le regioni cerebrali nella rete di controllo sono le cortecce calcarine bilaterali (CAL), caudato (CAU), ippocampo (HIP), nuclei pontini (PON), giroscopio rettificato (RGY) e le aree motorie supplementari (SMA)(Figura 1C). Come controllo aggiuntivo, la Default Mode Network (una rete consolidata che è stata identificata negli adulti e nei neonati a termine)(Doria et al., 2010; Raichle, 2015) ci ha permesso di testare la specificità della relazione tra la connettività funzionale pre-stimolo del DPMS e l’attività di BOLD nocivo-evocata. Il Default Mode Network comprendeva la corteccia cingolata posteriore (PCC), i lobuli parietali inferiori (IPL) e il giro frontale superiore mediale (mSFG) situato all’interno della corteccia prefrontale mediale (mPFC)(Figura 1E).
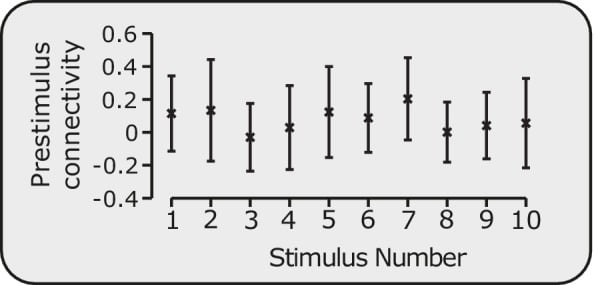
Figura 1-figure supplemento 3.Figura 1—supplemento alla figura 3. Connettività tra le regioni cerebrali nel DPMS e le reti di controllo.tutte le maschere di regione di interesse nello spazio standard.tutte le maschere di regione di interesse nello spazio standard.le maschere di regioni incluse nel DPMS, Control Network e Default Mode Network.la registrazione e i dati delle serie temporali.la connettività pre-stimolo è stabile.Rappresentazione schematica che mostra le posizioni approssimative delle regioni cerebrali in fette sagittali e coronali nella(A) Rete DPMS,(C) Rete di controllo e(E) Rete in modalità predefinita. Ogni regione anatomica di interesse è identificata nella figura 1-figure supplement 1 e i dati di origine sono forniti nella figura 1-source data 1. La Figura 1-figure supplement 2 mostra la registrazione di due maschere di esempio dal modello allo spazio funzionale e alle serie temporali di esempio. Schemi di rete della connettività funzionale media pre-stimolo tra coppie di regioni nella rete(B) DPMS Network,(D) Control Network e(F) Default Mode Network. Per le abbreviazioni vedere il testo principale.10.7554/eLife.37125.006Figure 1-source data 1.All region-of-interest masks in standard space.I numeri in alto a sinistra di ogni immagine trasversale rappresentano le posizioni delle coordinate nello spazio del modello infantile. La posizione di ogni fetta trasversale è dimostrata (linee rosse) sul cervello sagittale del modello sagittale a destra. I dati di origine(Figura 1 – dati di origine 1) contengono tutte le regioni del cervello nello spazio standard per tutte le reti.Registrazione delle maschere da(A) modello a(B) strutturale e infine a(C) spazio funzionale (maschera blu = ACC, maschera gialla = mFG).(D) Esempi delle serie temporali risultanti all’interno dell’ACC (blu) e mFG (giallo). I cerchi neri evidenziano i punti dei dati pre-stimolo.Connettività media di pre-stimolo nella rete DPMS attraverso i neonati prima di ciascuno dei 10 stimoli. Le barre di errore indicano la media e la deviazione standard.
La media complessiva della connettività funzionale pre-stimolo è stata calcolata per ogni rete(Figura 1B,D,F). Ciò non è stato significativamente diverso tra la rete DPMS e la rete di controllo (connettività funzionale media pre-stimolo): Rete DPMS = 0,08 ± 0,10; Rete di controllo = 0,15 ± 0,12). Non sorprende che, dato che la Default Mode Network è una rete canonica che è stata identificata sia nei dati relativi allo stato di riposo degli adulti che dei neonati(Doria et al., 2010; Raichle, 2015), la connettività funzionale della Default Mode Network è stata significativamente maggiore (connettività funzionale media pre-stimolo): Default Mode Network = 0.24 ± 0.18) rispetto alla connettività all’interno del DPMS e della Control Network (p = 0.0014, misure ripetute ANOVA, confronto post-hoc Tukey di DPMS e Control Network: p = 0.06, Default Mode Network e DPMS: p < 0.001, Default Mode Network e Control Network: p = 0.047).

Figura 1-figure supplement 3.Figura 1—supplemento alla figura 3. Connettività tra le regioni cerebrali nel DPMS e le reti di controllo.tutte le maschere di regione di interesse nello spazio standard.tutte le maschere di regione di interesse nello spazio standard.le maschere di regioni incluse nel DPMS, Control Network e Default Mode Network.la registrazione e i dati delle serie temporali.la connettività pre-stimolo è stabile.Rappresentazione schematica che mostra le posizioni approssimative delle regioni cerebrali in fette sagittali e coronali nella(A) Rete DPMS,(C) Rete di controllo e(E) Rete in modalità predefinita. Ogni regione anatomica di interesse è identificata nella figura 1-figure supplement 1 e i dati di origine sono forniti nella figura 1-source data 1. La Figura 1-figure supplement 2 mostra la registrazione di due maschere di esempio dal modello allo spazio funzionale e alle serie temporali di esempio. Schemi di rete della connettività funzionale media pre-stimolo tra coppie di regioni nella rete(B) DPMS Network,(D) Control Network e(F) Default Mode Network. Per le abbreviazioni vedere il testo principale.10.7554/eLife.37125.006Figure 1-source data 1.All region-of-interest masks in standard space.I numeri in alto a sinistra di ogni immagine trasversale rappresentano le posizioni delle coordinate nello spazio del modello infantile. La posizione di ogni fetta trasversale è dimostrata (linee rosse) sul cervello sagittale del modello sagittale a destra. I dati di origine(Figura 1 – dati di origine 1) contengono tutte le regioni del cervello nello spazio standard per tutte le reti.Registrazione delle maschere da(A) modello a(B) strutturale e infine a(C) spazio funzionale (maschera blu = ACC, maschera gialla = mFG).(D) Esempi delle serie temporali risultanti all’interno dell’ACC (blu) e mFG (giallo). I cerchi neri evidenziano i punti dei dati pre-stimolo.Connettività media di pre-stimolo nella rete DPMS attraverso i neonati prima di ciascuno dei 10 stimoli. Le barre di errore indicano la media e la deviazione standard.
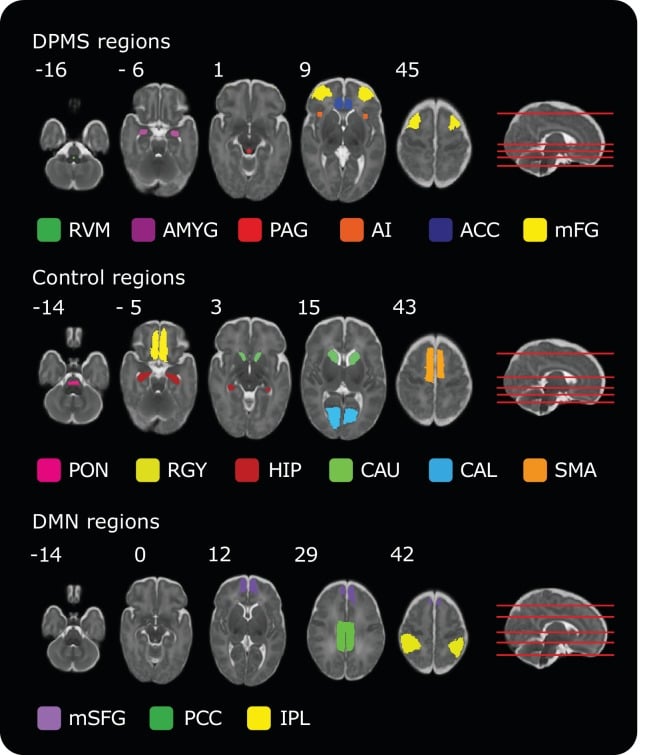
Figura 1-figure supplement 1.Maschere delle regioni incluse nel DPMS, Control Network e Default Mode Network.I numeri in alto a sinistra di ogni immagine trasversale rappresentano le posizioni delle coordinate nello spazio del template infantile. La posizione di ogni fetta trasversale è dimostrata (linee rosse) sul cervello sagittale del modello sagittale a destra. I dati di origine(Figura 1 – dati di origine 1) contengono tutte le regioni del cervello nello spazio standard per tutte le reti.
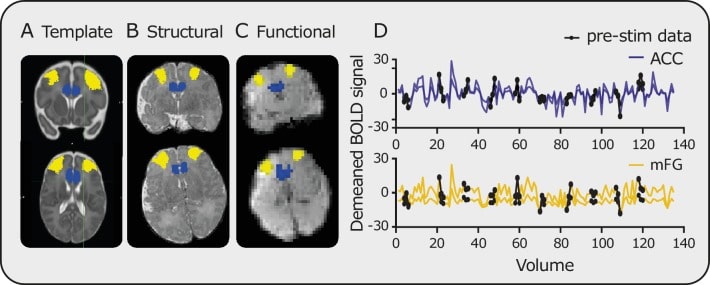
Figura 1-figure supplemento 2.Registrazione e dati delle serie temporali.Registrazione delle maschere da(A) modello a(B) strutturale e infine a(C) spazio funzionale (maschera blu = ACC, maschera gialla = mFG).(D) Esempi delle serie temporali risultanti all’interno dell’ACC (blu) e mFG (giallo). I cerchi neri evidenziano i punti dei dati pre-stimolo.

Figura 1-figure supplement 3.La connettività pre-stimolo è stabile.Connettività media pre-stimolo nella rete DPMS attraverso i neonati prima di ciascuno dei 10 stimoli. Le barre di errore indicano la media e la deviazione standard.
Caratterizzazione dell’attività cerebrale nociva nei neonati
Coerentemente con i rapporti precedenti(Goksan et al., 2015; Williams et al., 2015), abbiamo identificato cluster positivi di attività nocive-evocate BOLD nel giro bilaterale postcentrale (cortecce somatosensoriali), talamo, corteccia cingolata anteriore e corteccia insulare controlaterale posteriore(Figura 2, Tabella 1). Riportiamo una riduzione del numero di regioni cerebrali attive rispetto alla nostra precedente pubblicazione(Goksan et al., 2015), e dimostriamo cluster più altamente localizzati di attività significativa all’interno di regioni anatomiche distinte(Figura 2). Ad esempio, i cluster di attività possono ora essere identificati nella superficie mediale della corteccia somatosensoriale, che codifica la rappresentazione somatotopica del piede(Figura 2 e Figura 2 dati fonte 1). Queste differenze sono sorte a causa di miglioramenti nella pipeline di analisi dei dati per incorporare le recenti raccomandazioni e progressi metodologici. È importante notare che la soglia di definizione dei cluster statistici è aumentata da z = 2,3 a z = 3,1, per tenere conto dell’inflazione potenziale nei tassi di errore familiare che sono stati osservati in una vasta gamma di studi di risonanza magnetica (Eklund et al., 2016). Sono stati inoltre utilizzati un migliore filtraggio dei parametri di movimento della testa utilizzando FIX(Griffanti et al., 2014; Salimi-Khorshidi et al., 2014) e una funzione di risposta emodinamica specifica per i neonati (Arichiet al., 2012)(vedi Materiali e metodi). Le regioni cerebrali identificate in questa analisi più rigorosa rappresentano i cluster più fortemente attivati di attività cerebrale nociva-evocata nel neonato, e sono coerenti con quelli più comunemente riportati negli adulti (Traceye Mantyh, 2007). Il nostro precedente rapporto che il modello infantile di attività cerebrale correlata al dolore è simile a quello osservato negli adulti è qui riconfermato(Goksan et al., 2015).
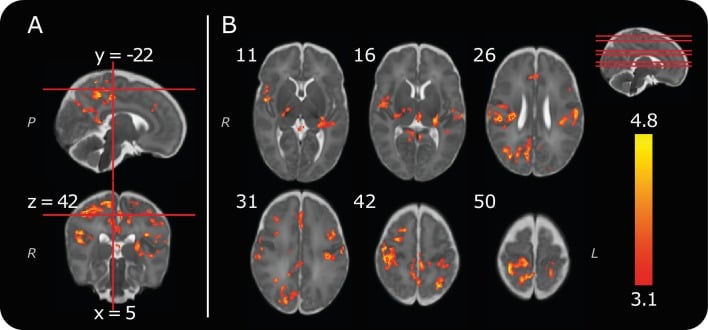
Figura 2 dati fonte 1.Figura 2—dati fonte 1. Attività cerebrale nociva di gruppo.mappa di attività di gruppo con soglia.mappa di attività di gruppo con soglia.(A) Vista sagittale e coronale dell’attività significativa del gruppo dai 13 neonati. Le linee rosse indicano come le due immagini (e l’immagine trasversale a z = 42, in B) si riferiscono l’una all’altra.(B) Immagini trasversali che mostrano l’attività significativa del gruppo. I dati di origine sono forniti in Figura 2 dati di origine 1). I numeri in alto a sinistra di ogni immagine rappresentano le posizioni delle coordinate nello spazio del modello infantile. La posizione di ogni fetta trasversale è dimostrata (linee rosse) sul cervello sagittale modello sagittale in alto a destra. La mappa di attività è sovrapposta su un modello standard di un cervello infantile a 40 settimane di età gestazionale (Seraget al., 2012). Le lettere in corsivo rappresentano le etichette degli assi: L= sinistra, R = destra, P = posteriore. Le mappe statistiche sono di cluster thresholded z-statistiche (z > 3,1, soglia di significatività dei cluster p < 0,05).10.7554/eLife.37125.008Cifra dati a 2 fonti 1.Mappa di attività di gruppo con soglia.
| Descrizione anatomica del luogo dell’attività | Massima z-statistica all’interno del cluster | Coordinate della statistica z massima nello spazio del modello per neonati | |||
|---|---|---|---|---|---|
| X | Y | Z | |||
| Giro post-centrale | Contra | 4.8 | 7.7 | −27.5 | 50.7 |
| Ipsi | 4.7 | −23.2 | −27.5 | 43.8 | |
| Solco cingolato posteriore | Contra | 4.8 | 6.9 | −23.2 | 36.0 |
| Ipsi | 3.8 | −6.0 | −20.6 | 34.3 | |
| Lobulo parietale superiore | Contra | 4.8 | 12.9 | −44.6 | 47.2 |
| Ipsi | 4.7 | −14.6 | −43.8 | 43.8 | |
| Talamo | Contra | 4.7 | 16.3 | −19.7 | 12.0 |
| Ipsi | 4.6 | −13.8 | −24.0 | 16.3 | |
| Giro sopramarginale | Ipsi | 4.7 | −25.8 | −29.2 | 37.8 |
| Contra | 4.6 | 30.1 | −24.9 | 28.3 | |
| Solco frontale superiore | Contra | 4.7 | 16.3 | −4.3 | 44.6 |
| Giro frontale centrale | Ipsi | 4.7 | −27.5 | 0.9 | 30.0 |
| Contra | 4.0 | 24.1 | 5.2 | 33.5 | |
| Cuneus | Contra | 4.7 | 7.7 | −53.2 | 26.6 |
| Ipsi | 4.2 | −5.1 | −50.7 | 23.2 | |
| Lobo parietale superiore / Precuneus | Contra | 4.7 | 5.2 | −35.2 | 39.5 |
| Ipsi | 4.0 | −0.9 | −43.8 | 41.2 | |
| Giro pre-centrale / Solco centrale | Contra | 4.6 | 24.1 | −14.6 | 45.5 |
| Ipsi | 3.9 | −8.6 | −23.2 | 53.2 | |
| Isla posteriore | Contra | 4.6 | 19.0 | −19.7 | 24.0 |
| Opercolo parietale | Ipsi | 4.6 | −34.4 | −21.4 | 18.0 |
| Giro temporale superiore / Opercolo posteriore | Contra | 4.6 | 31.0 | −27.5 | 22.3 |
| Giro occipitale | Ipsi | 4.6 | −12.0 | −63.5 | 21.4 |
| Corteccia cingolata anteriore | Ipsi | 4.2 | −1.7 | 14.7 | 24.0 |
| Contra | 3.9 | 4.3 | 12.1 | 25.7 | |
| Giro temporale superiore | Ipsi | 4.2 | −27.5 | −28.3 | 12.8 |

Figura 2 dati fonte 1.Figura 2—dati di origine 1. Attività cerebrale di gruppo di attività nociva.mappa di attività di gruppo con soglia.mappa di attività di gruppo con soglia.(A) Vista sagittale e coronale dell’attività di gruppo significativa dei 13 neonati. Le linee rosse indicano come le due immagini (e l’immagine trasversale a z = 42, in B) si riferiscono l’una all’altra.(B) Immagini trasversali che mostrano l’attività significativa del gruppo. I dati di origine sono forniti in Figura 2 dati di origine 1). I numeri in alto a sinistra di ogni immagine rappresentano le posizioni delle coordinate nello spazio del modello infantile. La posizione di ogni fetta trasversale è dimostrata (linee rosse) sul cervello sagittale modello sagittale in alto a destra. La mappa di attività è sovrapposta su un modello standard di un cervello infantile a 40 settimane di età gestazionale (Seraget al., 2012). Le lettere in corsivo rappresentano le etichette degli assi: L= sinistra, R = destra, P = posteriore. Le mappe statistiche sono di cluster thresholded z-statistiche (z > 3,1, soglia di significatività dei cluster p < 0,05).10.7554/eLife.37125.008Cifra dati a 2 fonti 1.Mappa di attività di gruppo con soglia.
Relazione tra la connettività funzionale pre-stimolo del DPMS e l’attività cerebrale nociva-evocata
Per ogni neonato, è stata calcolata la connettività funzionale media pre-stimolo attraverso la rete DPMS e le reti di controllo, e relativa alla variazione percentuale media dell’attività di BOLD evocata dalla stimolazione nociva (calcolata per ogni singolo partecipante attraverso tutti i voxel in cui è stata identificata una significativa attività di gruppo). C’è stata una significativa relazione inversa tra l’entità della connettività funzionale DPMS pre-stimolo e la variazione percentuale di attività di BOLD evocata da stimoli nocivi (Pearson coefficiente di correlazione (r) = -0,86, p = 0,0004, stima del parametro (β) = -0,74, modello lineare incluso anche l’età gestazionale in settimane come variabile esplicativa, Figura 3A). I neonati con una maggiore connettività funzionale attraverso la loro rete DPMS prima della stimolazione nociva aveva minore attività cerebrale nociva-evocata. Al contrario, la connettività funzionale media nella rete di controllo e nella rete in modalità predefinita non era correlata alla variazione media dell’attività di BOLD nociva (rete di controllo: r = -0.36, p = 0.26, β = -0.25; Default Mode Network: r = 0.06, p = 0.88, β= -0.03 Figura 3B,C). L’assenza di una relazione significativa tra la connettività funzionale del Default Mode Network e l’attività nociva di BOLD suggerisce che l’influenza del DPMS sull’attività nociva non è generalizzabile in tutte le reti cerebrali consolidate.
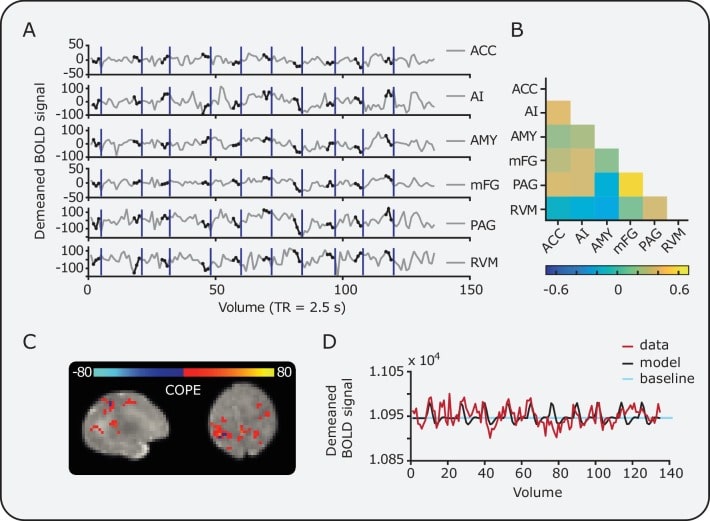
Figura 3-figure supplemento 2.Figura 3—supplemento alla figura 2. Relazione tra l’attività cerebrale nociva e la connettività funzionale pre-stimolo nella rete DPMS e nelle reti di controllo.maschere del tronco cerebrale DPMS individuali nello spazio funzionale.maschere del tronco cerebrale DPMS individuali nello spazio funzionale.relazione tra la variazione percentuale dell’attività cerebrale nociva e la connettività funzionale pre-stimolo nella rete DPMS e nella rete di controllo con le regioni del tronco cerebrale rimosse.dati di esempio di singoli neonati.I modelli di regressione lineare (linee blu) sono stati utilizzati per confrontare la connettività funzionale pre-stimolo (psFC) con la variazione percentuale di attività di BOLD nella(A) rete DPMS,(B) rete di controllo e(C) la rete di modalità predefinita (DMN). Noxious-evoked attività cerebrale per ogni bambino (calcolato all’interno di una maschera dell’attività di gruppo, vedi Figura 2) è stato regolato per l’età gestazionale (in settimane) al momento dello studio. I cerchi colorati rappresentano i dati dei singoli neonati all’interno del DPMS (rosso) e delle reti di controllo (azzurro). La Figura 3 – dati fonte 1 fornisce le maschere funzionali PAG e RVM individuali per ogni neonato. La figura 3-figure supplement 1 mostra la relazione tra la variazione percentuale di attività BOLD e la psFC nella rete DPMS e nella rete di controllo con le regioni del tronco encefalico rimosse.(D) Lo schema cerebrale evidenzia le coppie di regioni cerebrali in cui la psFC è stata significativamente correlata con la variazione percentuale della risposta in BOLD (linee gialle tratteggiate).(E,F,G) Le tre coppie di regioni all’interno della rete DPMS che hanno dimostrato forti correlazioni tra psFC media e attività cerebrale nociva-evocata.10.7554/eLife.37125.013Figure 3-source data 1.Individual DPMS maschere del tronco encefalico nello spazio funzionale.Modello di regressione lineare (linee blu) confronto della connettività funzionale pre-stimolo (psFC) con la variazione percentuale di attività BOLD nella(A) rete DPMS e(B) rete di controllo con le regioni del tronco encefalico rimosso. Il DPMS psFC è stato calcolato tra l’IA, ACC, amigdala e il giroscopio frontale medio, e la rete di controllo psFC è stata calcolata nelle cortecce calcarine bilaterali, caudato, ippocampo, giroscopio rettificato e le aree motorie supplementari. I cerchi colorati rappresentano i dati dei singoli neonati all’interno della rete DPMS (rosso) e della rete di controllo (azzurro).I dati di un singolo neonato mostrano(A) le serie temporali medie all’interno di tutte le regioni cerebrali del DPMS e(B) la matrice di connettività risultante. I cerchi neri sovrapposti sulle serie temporali indicano i punti di pre-stimolo. Le linee verticali blu indicano il punto di stimolazione. L’intervallo minimo inter-stimolo era di 25 s.(C) Esempi di valori COPE statistici relativi all’entità dell’attività cerebrale nociva e(D) la variazione del segnale di BOLD all’interno di un singolo voxel (rosso) tracciata sul modello previsto in forma (nero). La mappa statistica COPE è stata mascherata con la maschera di attività di gruppo (vedi Figura 2); pertanto, le regioni colorate rappresentano i voxel che sopravvivono alla trebbiatura dei grappoli a livello di gruppo. La linea di base (azzurro chiaro) è la media temporale utilizzata per calcolare la variazione percentuale di BOLD.
Per esplorare il contributo relativo delle diverse regioni cerebrali all’interno della rete DPMS, è stata calcolata la relazione tra la connettività funzionale e la variazione media dell’attività di BOLD nociva è stata calcolata per ogni coppia di regioni cerebrali. Aumento della connettività funzionale pre-stimolo tra l’ACC e PAG è stato associato ad una sostanziale riduzione dell’attività di BOLD nocivo-evocate (corretto per l’età, p = 0,0012, β = -0,22, Figura 3E). La connettività funzionale tra l’AI-mFG e l’ACC-AI era anche fortemente correlata al cambiamento dell’attività di BOLD nociva (p = 0,02, β = -0,23 e p = 0,03, β = -0,17 rispettivamente, Figura 3F,G). Per tutte le altre coppie di regioni cerebrali, la forza di connettività funzionale non ha influenzato l’entità dell’attività cerebrale nociva. L’osservazione che un alto grado di connettività funzionale tra ACC e PAG è fortemente associato ad una riduzione dell’attività cerebrale legata al dolore nel neonato è interessante alla luce delle osservazioni negli adulti dove una maggiore co-variazione nell’attività funzionale dell’ACC e PAG rostrale si riferisce ad un aumento dell’efficacia dell’analgesia endogena provocata dal trattamento con placebo(Petrovic et al., 2002). L’anticipazione del placebo è stata associata ad una maggiore attività pre-stimolo nella PAG, e porta ad una riduzione dell’attività cerebrale evocata dal placebo nel talamo e nell’ACC rostrale(Wager et al., 2004). L’importanza del PAG, come parte del DPMS, è stata dimostrata anche in studi su animali, dove la stimolazione diretta del PAG è associata ad una riduzione delle informazioni nocicettive in arrivo dal sistema nervoso periferico(Reynolds, 1969). Nei roditori adulti, la modulazione discendente (evidenziata dall’attivazione del PAG) modula preferenzialmente l’ingresso della fibra C(McMullan e Lumb, 2006; Waters and Lumb, 2008), mentre lo stimolo nocivo applicato in questo studio probabilmente attiva preferenzialmente le fibre A-delta, che possono essere modulate in modo differenziato rispetto all’ingresso della fibra C. Tuttavia, non è noto come altri componenti sopraspinali del DPMS rispondono all’attività in sottoclassi di nocicettori nell’uomo. È necessario un ulteriore lavoro per comprendere la traiettoria di sviluppo dell’asse PAG-RVM nell’uomo e la maturazione delle sue connessioni al midollo spinale.
I neonati umani e non umani mostrano una maggiore sensibilità alla stimolazione nociva, che è stata a lungo attribuita alle reti di riflesso spinale ipereccitabili(Fitzgerald, 2005). Nel roditore neonatale, le strutture cerebrali all’interno del DPMS facilitano, piuttosto che inibire, i comportamenti nocivi mediati per via spinale(Hathway et al., 2009). Durante lo sviluppo umano pretermine, questi riflessi esagerati sono raffinate con durate più brevi, magnitudini più basse, e le soglie di risposta più elevate, e modelli di nocivo-evocate attività cerebrale contemporaneamente maturi(Hartley et al., 2016; Cornelissen et al., 2013; Fabrizi et al., 2011). I dati qui presentati in termini di neonati suggeriscono che le reti cerebrali funzionali DPMS hanno una funzione inibitoria a livello cerebrale, simile a quella osservata nell’adulto(Ossipov et al., 2010). Vi è, tuttavia, una potenziale contraddizione con le osservazioni nei roditori neonatali dove è stata osservata una facilitazione a livello del midollo spinale nelle registrazioni elettrofisiologiche. Ciò potrebbe riflettere le differenze di maturazione nella connettività delle regioni DPMS sopraspinali e la connettività dei percorsi discendenti dalla RVM alla rete del corno dorsale nocicettivo spinale nei neonati. Tuttavia, questa interpretazione si basa su un confronto tra specie diverse, che si basa su una teorica equivalenza di età tra i neonati umani e i cuccioli di ratto neonatale. Alcune reti avranno probabilmente una traiettoria di sviluppo diversa nei roditori rispetto agli esseri umani e la maturazione del SNC non è un processo lineare coordinato, poiché reti diverse maturano probabilmente a ritmi diversi(Clancy et al., 2001). Poiché non abbiamo misurato l’attività nel midollo spinale, non possiamo determinare la relazione tra la connettività funzionale nel DPMS e l’attività spinale nel neonato a termine.
La raccolta di dati di imaging funzionale nel tronco encefalico è una sfida, sia negli adulti che nei neonati, a causa del movimento della testa e del movimento cardiaco e respiratorio(Harita e Stroman, 2017). In questo studio, abbiamo identificato e fatto regredire il rumore fisiologico utilizzando l’analisi indipendente dei componenti(Salimi-Khorshidi et al., 2014; McKeown et al., 2005; McKeown et al., 1998). Come ulteriore conferma dei risultati, abbiamo rivalutato la forza della connettività funzionale pre-stimolo nella rete DPMS e nella rete di controllo, escludendo le regioni del tronco encefalico; in particolare il PAG e l’RVM per la rete DPMS e il PON dalla rete di controllo. La forza della Rete DPMS all’interno delle restanti regioni corticali e sottocorticali, l’ACC, AI, mFG e AMY, era ancora significativamente inversamente legata all’attività cerebrale nociva (r = -0,61, p = 0,04, β = -0,37, Figura 3-figure supplement 1). Come in precedenza, la rete di controllo, escluso il PON, non era significativamente correlata con l’attività cerebrale nociva (r = -0,29, p = 0,36, β = -0,15). Questo suggerisce che è improbabile che i nostri risultati siano guidati dal rumore all’interno del tronco encefalico. Mentre ci sono dei limiti intrinseci in questo studio in termini di risoluzione spaziale che possono essere raggiunti quando si immaginano piccole strutture all’interno del tronco encefalico, crediamo che le maschere PAG e RVM che abbiamo definito individualmente per ogni neonato siano ben localizzate all’interno di queste strutture anatomiche. La figura 3 – dati fonte 1 fornisce le singole maschere funzionali PAG e RVM per ogni neonato.
E’ possibile che l’applicazione dello stimolo nocivo possa influenzare i dati pre-stimolo; tuttavia, la presentazione dello stimolo non era prevedibile, e il periodo di tempo tra gli stimoli era sempre maggiore di 25 s. La connettività funzionale pre-stimolo del DPMS non dipendeva dal numero di stimolo (p = 0,33, misure ripetute ANOVA, vedi Figura 1-figure supplement 3), suggerendo che la connettività funzionale di questa rete è relativamente stabile. Negli adulti, le reti cerebrali funzionali sono anche pensate per essere dominate da caratteristiche individuali stabili, e solo modestamente influenzate da fattori evocati e dalla variabilità quotidiana(Gratton et al., 2018). Per comprendere ulteriormente la relazione tra l’attività cerebrale nociva dei neonati e il DPMS, l’analisi della connettività funzionale dei dati sullo stato di riposo e la connettività strutturale sottostante e l’integrità della fibra della materia bianca tra le regioni DPMS che utilizzano la risonanza magnetica a diffusione è garantita(Gratton et al., 2018; Friston, 2011). Studi di neuroimaging sia nell’uomo che negli animali suggeriscono che le misure di connettività funzionale possono essere utilizzate per capire meglio come le reti delle regioni cerebrali sono coinvolte in funzioni complesse(Cole et al., 2016; Fox et al., 2005; Smith et al., 2013), compreso il dolore(Baliki et al., 2014). Mentre queste misure possono rappresentare una comunicazione diretta o indiretta tra queste regioni cerebrali(Fox et al., 2005; Smith et al., 2013), esse possono anche riflettere cambiamenti sottostanti nell’ampiezza dei segnali neurali, che non sono correlati alla sincronia neurale(Friston, 2011; Cole et al., 2016; Duff et al., 2018) – ulteriori indagini sulla connettività strutturale e funzionale del DPMS possono chiarire questi meccanismi sottostanti.
In sintesi, questo studio suggerisce che nei neonati a termine il DPMS può essere influente nel regolare l’entità dell’attività cerebrale nociva. Negli adulti, una maggiore attività pre-stimolo nelle regioni cerebrali all’interno della rete DPMS sono associati a rapporti di dolore comportamentale più bassi(Ploner et al., 2010; Boly et al., 2007; Fairhurst et al., 2007). Pertanto, una possibile interpretazione dei nostri risultati è che quando le regioni all’interno del DPMS sono più fortemente connesse funzionalmente, i neonati hanno una maggiore capacità di regolare la loro esperienza del dolore e di smorzare la grandezza della loro attività cerebrale in risposta all’input nocicettivo in ingresso. È noto che le lesioni chirurgiche nel periodo neonatale portano a cambiamenti della sensibilità al dolore in tutto il corpo che persistono nell’infanzia(Walker et al., 2009), e questo può dipendere da cambiamenti nella maturazione del DPMS, in particolare della RVM(Walker et al., 2015). Per capire come il DPMS si sviluppa durante la prima infanzia e come è influenzato dalle esperienze della prima infanzia, sono necessarie ulteriori indagini sul DPMS sia nei neonati pretermine più giovani che in quelli più anziani. Per esempio, è stato suggerito che lo sviluppo di una funzione aberrante del DPMS nella prima infanzia può portare a una vulnerabilità a lungo termine verso gli stati di dolore cronico(Denk et al., 2014). La presenza di un sistema di modulazione funzionale sopraspinale in un neonato umano a termine è coerente con la proposta che l’emergere di percorsi inibitori dall’alto verso il basso si sviluppi nei primi anni di vita(Hartley et al., 2016). Concludiamo che la rete DPMS può influenzare l’entità dell’attività cerebrale legata al dolore nei neonati a termine.

Figura 3-figure supplemento 2.Figura 3—supplemento alla figura 2. Relazione tra attività cerebrale nociva e connettività funzionale pre-stimolo nella rete DPMS e nelle reti di controllo.maschere individuali DPMS del tronco cerebrale nello spazio funzionale.maschere individuali DPMS del tronco cerebrale nello spazio funzionale.relazione tra variazione percentuale di attività cerebrale nociva e connettività funzionale pre-stimolo nella rete DPMS e nella rete di controllo con le regioni del tronco cerebrale rimosse.dati di esempio di singoli neonati.I modelli di regressione lineare (linee blu) sono stati utilizzati per confrontare la connettività funzionale pre-stimolo (psFC) con la variazione percentuale di attività di BOLD nella(A) rete DPMS,(B) rete di controllo e(C) la rete di modalità predefinita (DMN). Noxious-evoked attività cerebrale per ogni bambino (calcolato all’interno di una maschera dell’attività di gruppo, vedi Figura 2) è stato regolato per l’età gestazionale (in settimane) al momento dello studio. I cerchi colorati rappresentano i dati dei singoli neonati all’interno del DPMS (rosso) e delle reti di controllo (azzurro). La Figura 3 – dati fonte 1 fornisce le maschere funzionali PAG e RVM individuali per ogni neonato. La figura 3-figure supplement 1 mostra la relazione tra la variazione percentuale di attività BOLD e la psFC nella rete DPMS e nella rete di controllo con le regioni del tronco encefalico rimosse.(D) Lo schema cerebrale evidenzia le coppie di regioni cerebrali in cui la psFC è stata significativamente correlata con la variazione percentuale della risposta in BOLD (linee gialle tratteggiate).(E,F,G) Le tre coppie di regioni all’interno della rete DPMS che hanno dimostrato forti correlazioni tra psFC media e attività cerebrale nociva-evocata.10.7554/eLife.37125.013Figure 3-source data 1.Individual DPMS maschere del tronco encefalico nello spazio funzionale.Modello di regressione lineare (linee blu) confronto della connettività funzionale pre-stimolo (psFC) con la variazione percentuale di attività BOLD nella(A) rete DPMS e(B) rete di controllo con le regioni del tronco encefalico rimosso. Il DPMS psFC è stato calcolato tra l’IA, ACC, amigdala e il giroscopio frontale medio, e la rete di controllo psFC è stata calcolata nelle cortecce calcarine bilaterali, caudato, ippocampo, giroscopio rettificato e le aree motorie supplementari. I cerchi colorati rappresentano i dati dei singoli neonati all’interno della rete DPMS (rosso) e della rete di controllo (azzurro).I dati di un singolo neonato mostrano(A) le serie temporali medie all’interno di tutte le regioni cerebrali del DPMS e(B) la matrice di connettività risultante. I cerchi neri sovrapposti sulle serie temporali indicano i punti di pre-stimolo. Le linee verticali blu indicano il punto di stimolazione. L’intervallo minimo inter-stimolo era di 25 s.(C) Esempi di valori COPE statistici relativi all’entità dell’attività cerebrale nociva e(D) la variazione del segnale di BOLD all’interno di un singolo voxel (rosso) tracciata sul modello previsto in forma (nero). La mappa statistica COPE è stata mascherata con la maschera di attività di gruppo (vedi Figura 2); pertanto, le regioni colorate rappresentano i voxel che sopravvivono alla trebbiatura dei grappoli a livello di gruppo. La linea di base (azzurro chiaro) è la media temporale utilizzata per calcolare la variazione percentuale di BOLD.
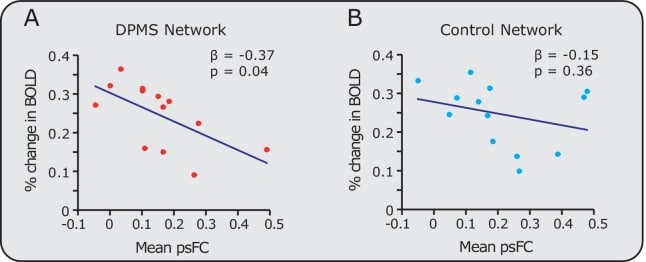
Figura 3-figure supplement 1.Relazione tra la variazione percentuale di variazione percentuale nell’attività cerebrale nociva e la connettività funzionale pre-stimolo nella rete DPMS e nella rete di controllo con le regioni del tronco encefalico rimosse.2. Modello di regressione lineare (linee blu) confronto della connettività funzionale pre-stimolo (psFC) con la variazione percentuale di attività di BOLD nella(A) rete DPMS e(B) rete di controllo con le regioni del tronco encefalico rimosse. Il DPMS psFC è stato calcolato tra l’IA, ACC, amigdala e il giroscopio frontale medio, e la rete di controllo psFC è stata calcolata nelle cortecce calcarine bilaterali, caudato, ippocampo, giroscopio rettificato e le aree motorie supplementari. I cerchi colorati rappresentano i dati dei singoli neonati all’interno della rete DPMS (rosso) e della rete di controllo (azzurro).

Figura 3-figure supplement 2.Dati esemplificativi di singoli neonati.Dati di un singolo neonato che mostrano(A) le serie temporali medie all’interno di tutte le regioni cerebrali del DPMS e(B) la matrice di connettività risultante. I cerchi neri sovrapposti sulle serie temporali indicano i punti di pre-stimolo. Le linee verticali blu indicano il punto di stimolazione. L’intervallo minimo inter-stimolo era di 25 s.(C) Esempi di valori COPE statistici relativi all’entità dell’attività cerebrale nociva e(D) la variazione del segnale di BOLD all’interno di un singolo voxel (rosso) tracciata sul modello previsto in forma (nero). La mappa statistica COPE è stata mascherata con la maschera di attività di gruppo (vedi Figura 2); pertanto, le regioni colorate rappresentano i voxel che sopravvivono alla trebbiatura dei grappoli a livello di gruppo. La linea di base (azzurro chiaro) è la media temporale utilizzata per calcolare la variazione percentuale di BOLD.
Materiali e metodi
Partecipanti
Diciassette neonati a termine sono stati reclutati dall’unità di maternità del John Radcliffe Hospital di Oxford, Regno Unito. Tutti i neonati hanno completato il protocollo di studio completo. Il Servizio nazionale di etica della ricerca ha fornito l’approvazione etica: Riferimento REC 12/SC/0447. Prima di ogni studio è stato ottenuto il consenso scritto informato dei genitori. Lo studio è stato condotto in conformità agli standard stabiliti dalla Dichiarazione di Helsinki e dalle linee guida della Buona Pratica Clinica.
I dati di quattro neonati sono stati esclusi dall’analisi perché la regione più caudale di interesse, il midollo ventrale rostrale del tronco encefalico, non rientrava nel campo visivo. Pertanto, 13 neonati a termine (età gestazionale media (GA) allo studio = 40 settimane, range da 38 a 43 settimane) sono stati inclusi in questa analisi. L’età media postnatale al momento dello studio era di 4 giorni (range da 1 a 8 giorni). Otto dei 13 neonati inclusi in questa analisi sono stati inclusi anche nella nostra precedente pubblicazione(Goksan et al., 2015).
Protocollo di studio
I criteri di reclutamento dei neonati, il disegno dello studio sperimentale e il protocollo di studio della risonanza magnetica erano identici a quelli descritti in precedenza da Goksan et al., 2015. In breve, tutti i neonati sono stati sottoposti a scansione presso il Centre for Functional Magnetic Resonance Imaging of the Brain (FMRIB), John Radcliffe Hospital, Oxford. Prima della scansione i neonati venivano nutriti e fasciati e dotati di tre livelli di protezione dell’orecchio: mastice per le orecchie (Mack’s Kids size earplugs, McKeon Products Inc., MI), cuffie per le orecchie (Minimuffs, Natus Medical Inc., Galway, Irlanda) e difensori dell’udito (Em’s 4 Bubs Baby Earmuffs, Em’s 4 Kids, Brisbane, Australia), con valutazioni di riduzione del rumore rispettivamente di 22 dB, 7 dB e 22 dB. I neonati sono stati poi messi in un materasso sottovuoto e tutte le scansioni sono state effettuate quando i neonati si sono sistemati o si sono addormentati.
Durante tutte le sessioni di risonanza magnetica, sono state raccolte immagini strutturali ponderate T2 prima dell’acquisizione di scansioni di eco planare funzionale (EPI). Durante le scansioni funzionali dei singoli neonati, la stimolazione acuta sperimentale nociva è stata applicata utilizzando uno stimolatore nocicettivo calibrato (forza: 128 mN, PinPrick Stimolatori, sistemi MRC). La stimolazione nociva è stata applicata 10 volte al tallone del piede sinistro dallo stesso sperimentatore e con un intervallo minimo inter-stimolo di 25 s. L’intervallo è stato scelto in base al termine neonatale neonatale funzione di risposta emodinamica infantile termine (HRF) descritto da Arichi et al. (2012) e l’intervallo è stato esteso, se necessario, per garantire il bambino è stato risolto al momento della stimolazione.
Acquisizione della risonanza magnetica
Le immagini sono state raccolte utilizzando uno scanner Siemens 3-Tesla Magnetom Verio (Erlangen, Germania) con una bobina a 32 canali per adulti. Per ogni neonato sono state acquisite scansioni strutturali di eco di rotazione turbo ponderata T2 (parametri di sequenza): tempo di ripetizione / tempo di eco (TR/TE) = 14740/88 ms; angolo di rotazione di 150°; risoluzione 1 mm3; fette =85, campo visivo (FOV) = 192×192 mm, accelerazione = GRAPPA 2, ordine delle fette = interfogliato, senza sovrapposizione delle fette). Le immagini in BOLD sono state acquisite utilizzando un’acquisizione EPI pesata in T2* (parametri di sequenza: TR/TE = 2500/40 ms; angolo di rotazione = 90°; FOV = 192×192 mm; matrice di immagini 64×64; risoluzione 3×3×3 mm; fette = 33, raccolte in ordine decrescente; volumi totali medi = 142). La correzione di acquisizione prospettica per il movimento della testa (PACE) è stata applicata durante tutte le scansioni EPI(Thesen et al., 2000), come descritto in precedenza in Goksan et al., 2015). Le immagini della mappa di campo sono state ottenute per la correzione post-acquisizione degli effetti di campo a gradiente (parametri di sequenza: TR = 400 ms; TE1/TE2 = 5.19/7.65 ms; angolo di rotazione = 60°; FOV = 192×192 mm; matrice di imaging 64×64; risoluzione 3×3 ×3 mm; fette = 36, ordine delle fette = interfogliato; inter-fetta = 0,75 mm). Gli stimoli nocivi sono stati bloccati nel tempo alla registrazione fMRI utilizzando il software Neurobehavioural Systems (Presentation, www.neurobs.com); codificati per rilevare la pressione di un pulsante dello sperimentatore ogni volta che uno stimolo sperimentale è stato applicato al piede del partecipante.
Analisi dei dati
Elaborazione dati MR
Tutte le pre-elaborazioni dei dati MR sono state effettuate utilizzando la FMRIB Software Library (FSL)(www.fmrib.ox.ac.uk/fsl), versioni 5.0.10 e 4.1.9. La versione 5.0.10 è stata utilizzata per preparare le immagini strutturali e le mappe di campo. Il Brain Extraction Tool (BET) di FSL è stato utilizzato per estrarre il segnale del tessuto cerebrale dalle strutture non cerebrali di ogni neonato (Smith,2002). La soglia di intensità frazionaria e i parametri di gradiente di soglia all’interno di BET sono stati regolati al fine di ottenere l’estrazione cerebrale più accurata per soggetto. Una maschera di ogni neonato cervello estratto scansione strutturale è stato registrato alla mappa di campo e utilizzato per guidare la preparazione della mappa di campo. Tutte le registrazioni di dati fMRI sono state effettuate utilizzando FMRI Expert Analysis Tool (FEAT) versione 5.98 (FSL versione 4.1.9) per evitare la registrazione basata sui confini (BBR), a causa della codifica rigida del parametro BBR-slope adatto agli adulti, che non è adatto per i dati fMRI dei neonati. Le immagini funzionali sono state registrate secondo un modello standard per neonati medio (modello GA a 40 settimane; scaricabile da www.brain-development.org). Ogni EPI è stata inizialmente registrata nell’immagine strutturale del neonato (FLIRT: trasformazione del corpo rigido con sei DOF [Jenkinsonet al., 2002; Jenkinson e Smith, 2001]). Successivamente, le immagini nello spazio strutturale sono state registrate in modo non lineare all’immagine del modello neonatale specifico, che corrispondeva al GA del neonato al momento dello studio(Serag et al., 2012) e poi al modello di gestazione standard del neonato di 40 settimane (FNIRT: trasformazione non lineare con dodici DOF).
FEAT (Versione 5.98) è stato utilizzato per eseguire le fasi di pre-elaborazione dei dati funzionali implementate all’interno di FSL; che includevano la correzione del movimento dei dati funzionali utilizzando MCFLIRT(Jenkinson et al., 2002), la correzione della distorsione utilizzando FUGUE, l’estrazione del cervello utilizzando BET, il filtraggio temporale passa alto a 0,01 Hz (periodo di 100 s), e la scala media grande. La lisciatura spaziale è una fase comune di pre-elaborazione che tipicamente filtra i dati con un’estensione del kernel di lisciatura (misurata in piena larghezza alla metà del massimo) più grande di un voxel. Data la nostra risoluzione spaziale, la dimensione dei voxel rispetto al cervello neonatale e l’uso di piccoli ROI del tronco cerebrale, lo smussamento spaziale è stato ritenuto inappropriato e quindi omesso. MELODIC (model-free fMRI analysis usando l’analisi probabilistica indipendente dei componenti) è stato utilizzato per scomporre i dati funzionali in componenti spazialmente indipendenti, che sono stati successivamente etichettati manualmente come segnale o rumore(Griffanti et al., 2017). FIX (Xnoiseifier basato su ICA di FMRIB, v1.065) è stato poi applicato per regredire fuori dalle serie temporali delle componenti di rumore e dalle serie temporali dei 24 parametri di movimento della testa(Griffanti et al., 2014; Salimi-Khorshidi et al., 2014). Mentre la denoising spaziale basata su ICA non rimuove gli artefatti globali del segnale, non abbiamo incluso una fase di pre-elaborazione per affrontare questo aspetto, come la GSR (regressione globale del segnale). Abbiamo affrontato il potenziale problema dei cofondatori di segnale globale nell’analisi principale includendo la nostra rete di controllo.
L’analisi statistica dei dati MR è stata condotta utilizzando FSL (versione 5.0.10). Le statistiche della serie temporale sono state generate utilizzando la modellazione lineare generale (GLM) in FEAT (versione 6.00). Il modello sperimentale è stato creato utilizzando un disegno relativo ad un evento, dove ogni input rappresentava il tempo di ogni stimolo nocivo (durata: circa 1 s), registrato durante la sessione di scansione tramite il codice di presentazione. Il disegno sperimentale è stato concepito con tre funzioni di base ottimali specifiche per il termine “Infant” generate da Arichi e colleghi(Arichi et al., 2012). Le variabili anomale del movimento sono state incluse nel modello identificando i volumi in cui si sono verificati grandi scostamenti nella posizione della testa. Ogni variabile di movimento è stata generata dal comando outlier di movimento di FSL utilizzando l’opzione DVARS; che ha calcolato il tasso di variazione della varianza tra i volumi (Power et al., 2012). Cluster thresholding (con un cluster che definisce la soglia di p = 0,001 (z = 3,1) e una soglia di significato del cluster di p = 0,05) è stato utilizzato per identificare aumenti significativi in BOLD a seguito di stimolazione sperimentale nocivo.
L’analisi di gruppo è stata eseguita in FSL (versione 5.0.10), utilizzando effetti misti FLAME 1 e 2 in FEAT (versione 6.00), con rilevamento automatico degli outlier. Il primo contrasto dell’immagine statistica di stima dei parametri (COPE) di ogni partecipante è stato inserito nell’analisi di gruppo superiore, tenendo conto quindi solo della prima funzione di base descritta da Arichi et al. (2012). Questa funzione assomiglia molto a una funzione a doppia gamma con un picco a 7 s e un rapporto di picco inferiore a quello positivo di 0,49. Due atlanti specifici per il neonato, l’atlante della University of North Carolina (UNC) (Shiet al., 2011) e un atlante dell’Imperial College London (ICL) (Serag et al., 2012), e un atlante per adulti (Maiet al., 2008) sono stati utilizzati per guidare la descrizione dell’attività di gruppo risultante (nella Tabella 1). Sono stati richiesti tre atlanti perché ogni atlante ha fornito diversi livelli di specificità anatomica. L’atlante ICL era il più generale, che descriveva tutti i lobi del cervello, così come alcuni nuclei cerebrali profondi e mappe del liquor, materia grigia e bianca. Nonostante questa ampia etichettatura, l’atlante ICL forniva anche la più accurata suddivisione tra i confini anatomici. L’atlante infantile UNC è stato utilizzato perché conteneva maschere anatomiche più specifiche. Tuttavia, le partizioni tra i confini anatomici erano meno buone; pertanto l’atlante ICL è stato usato in congiunzione per definire i confini. Infine, nel descrivere la posizione anatomica dei picchi all’interno dell’attività di gruppo (vedi Tabella 1), è stato utilizzato un atlante per adulti in quanto forniva ulteriori indicazioni per l’etichettatura di specifici giroscopi e sulci. I cluster che si estendevano su più di una regione cerebrale sono stati descritti separatamente solo quando una regione di attività con un voxel di picco locale separato è stata osservata all’interno della regione cerebrale adiacente. Per tutte le regioni citate nella tabella, le maschere sono state disegnate a mano e miravano ad includere tutti i voxel attivi all’interno di ogni regione, tuttavia, data la natura soggettiva di questo compito, è possibile che siano state trascurate piccole regioni di attività che facevano parte dello stesso cluster. La funzione Cluster, disponibile all’interno di FSL, è stata poi utilizzata per ottenere la statistica z massima e le loro coordinate.
Connettività funzionale pre-stimolo (psFC)
Le serie temporali medie sono state calcolate in 15 regioni cerebrali. Sei regioni sono state identificate come regioni chiave all’interno del DPMS: corteccia cingolata anteriore (ACC), amigdala (AMY), insula anteriore (AI), giro frontale medio (mFG) (una regione all’interno della corteccia prefrontale dorsolaterale – dlPFC); valutato utilizzando i seguenti documenti(Rajkowska e Goldman-Rakic, 1995; Sallet et al., 2013; Stagg et al., 2013), grigio periaqueduttale (PAG) e midollo ventrale rostale (RVM). Altre nove regioni cerebrali, senza un ruolo noto nel DPMS, sono state incluse nelle due reti di controllo. La rete di controllo comprendeva la corteccia calcarica (CAL), il caudato (CAU), l’ippocampo (HIP), il pons (PON), il giroscopio rettificato (RGY) e l’area motoria supplementare (SMA). Tre regioni sono state identificate nel Default Mode Network – la corteccia cingolata posteriore (PCC), i lobuli parietali inferiori (IPL) e il giro frontale mediale superiore superiore (mSFG). Il mSFG è stato scelto al posto della corteccia prefrontale mediale (comunemente riportato come parte del DMN) perché una maschera della corteccia prefrontale mediale non era disponibile come parte della UNC o ICL atlanti infantili; quindi, il mSFG è stato preso come rappresentante di questa regione.
Le regioni cerebrali comunemente segnalate per essere coinvolte nella modulazione del dolore discendente(Schweinhardt e Bushnell, 2010), sono state incluse nella rete DPMS. Tuttavia, questa rete non includeva tutte le regioni del DPMS, poiché, ad esempio, anche l’ipotalamo gioca un ruolo chiave nella modulazione del dolore discendente(Denk et al., 2014; Dafny et al., 1996). La rete DPMS qui riportata include quindi regioni centrali all’interno della rete DPMS per adulti che potrebbero essere identificate e mascherate con sicurezza nel neonato.
Utilizzando i due atlanti neonatali sopra descritti (UNC e ICL), sono state create delle maschere di regione di interesse (ROI). Le maschere ACC, AMY, CAU, HIP e PCC sono state prese direttamente dall’atlante ICL a 40 settimane GA. CAL, IPL, mFG, mFG, mSFG, RGY e SMA erano regioni all’interno dell’atlante infantile UNC. In seguito alla registrazione dell’atlante UNC al cervello modello di 40 settimane, le maschere di tutte e sei le suddette regioni dell’atlante UNC sono state isolate. Successivamente, le maschere dell’atlante UNC sono state attentamente ispezionate per garantire che ogni maschera rientrasse nei confini appropriati dell’atlante ICL (poiché questo atlante è registrato in modo più accurato con l’anatomia del cervello modello). La maschera mFG è stata presa direttamente dall’atlante dell’UNC. Per la maschera CAL, sono stati inclusi i voxel che rientravano nella maschera del lobo occipitale dall’atlante dell’ICL, e i singoli voxel che cadevano al di fuori della corteccia calcarica sono stati rimossi manualmente. Per le maschere RGY e mSFG, sono stati inclusi solo i voxel che cadevano all’interno della maschera del lobo frontale dall’atlante ICL. Per l’IPL, voxel che rientravano all’interno della maschera del lobo parietale dall’atlante ICL sono stati inclusi. Per la SMA, i voxel etichettati come CSF dall’atlante ICL sono stati rimossi.
Quattro regioni cerebrali non sono state incluse come regioni cerebrali indipendenti in entrambi gli atlanti e sono state quindi disegnate a mano. Le maschere AI, PAG, PON e RVM sono state disegnate manualmente in FSLeyes (FSL, versione 5.0.10). Le maschere per adulti dell’IA(Wiech et al., 2014) e PAG(Ezra et al., 2015) sono state utilizzate per guidare il disegno delle maschere sul modello cerebrale infantile. Le maschere PON e RVM sono state disegnate con riferimento all’Atlante di Duvernoy(Duvernoy, 2012). La maschera RVM rientrava nella regione del nucleo ventromediale del tratto solitario, mentre la maschera PON era costituita dai nuclei pontini e dalla parte basilare del pons(Figura 1-figure supplement 1).
Le serie temporali medie sono state calcolate nello spazio EPI (i) registrando le maschere di ogni regione dal modello neonatale standard (40 settimane GA) allo spazio EPI (tramite scansioni strutturali)(Figura 1-figure supplement 2A-C), (ii) verificando che ogni maschera ROI rientrasse nel campo visivo e fosse adeguatamente registrata, (iii) utilizzando la funzione fslmeants , disponibile in FSL, per generare una serie temporale media all’interno di ogni specifico ROI (Figura 1-figuresupplement 2D). Nota, per la RVM (trattandosi di un piccolo ROI), abbiamo estratto una serie temporale ponderata utilizzando i pesi della maschera nello spazio funzionale. Mentre le maschere erano nello spazio strutturale(Figura 1-figure supplement 2B), le segmentazioni delle immagini strutturali dei singoli partecipanti (generate utilizzando una versione beta della pipeline del Progetto Human Connectome Project (dHCP) in sviluppo) sono state utilizzate per rimuovere i voxel classificati come CSF. Infine, sono stati respinti anche i voxel che rientravano nelle regioni di caduta del segnale (cioè dove c’era una perdita di segnale superiore al 10 % nell’immagine funzionale dalla massima intensità del segnale). Ciò è stato fatto utilizzando una maschera – generata automaticamente in FEAT – per identificare e sottrarre i voxel di grande perdita di segnale dalle maschere di ROI.
Tutte le serie temporali medie sono state sminuite e i tre punti di dati pre-stimolo sono stati selezionati identificando i volumi in cui si è verificato lo stimolo nocivo e selezionando i dati dai tre volumi immediatamente prima di ogni stimolo (vedi Figura 3-figure supplement 2A). Il TR era di 2,5 s, quindi il periodo di pre-stimolo aveva una durata di 7,5 s. Poiché gli stimoli potevano essere applicati in qualsiasi momento all’interno di un singolo volume, il punto di inizio del periodo di pre-stimolo si è verificato tra 7,5 e 10 s prima dell’applicazione dello stimolo. Ciò ha portato a 10 serie di 3 punti di dati per serie temporale media per ogni neonato. Successivamente, sono state prese coppie di ROI dai dati di ogni neonato (che siano ROI1 e ROI2). La correlazione complessiva pre-stimolo tra ROI1 e ROI2 è stata calcolata facendo la media delle 10 correlazioni pre-stimolo (uno per stimolo), che erano le correlazioni tra i tre punti pre-stimolo da ROI1 e l’insieme equivalente di punti pre-stimolo da ROI2. Questo metodo è stato ripetuto per tutte le combinazioni di ROI con conseguente matrice di connettività che mostra tutte le correlazioni per bambino(Figura 3-figure supplemento 2B). Infine, la media della connettività funzionale pre-stimolo è stata calcolata per neonato facendo la media dei valori diagonali della matrice di connettività. La connettività media pre-stimolo è stata confrontata con la variazione percentuale media post-stimolo in BOLD (calcolata utilizzando la funzione Featquery, disponibile in FSL) all’interno di una maschera di tutti i voxel significativamente attivi (z > 3,1, p < 0,05) dall’analisi di gruppo.
L’analisi di regressione è stata effettuata utilizzando MATLAB (Mathworks, versione R2017a). La variazione percentuale post-stimolo in BOLD nella maschera di attività di gruppo è stata inserita come variabile di risposta in un modello di regressione lineare, che comprendeva la connettività funzionale media pre-stimolo all’interno della rete e GA del neonato allo studio (in settimane e giorni) come prima e seconda variabile esplicativa rispettivamente. Le stime dei parametri e i valori p del modello sono riportati nei risultati. Infine, il valore r (Coefficiente di Correlazione di Pearson) è stato calcolato tra la variazione percentuale di BOLD e la connettività funzionale pre-stimolo (aggiustato per l’età e ottenuto seguendo il modello di regressione di adattamento).
References
- Andrews K, Fitzgerald M. The cutaneous withdrawal reflex in human neonates: sensitization, receptive fields, and the effects of contralateral stimulation. Pain. 1994; 56:95-101. DOI | PubMed
- Arichi T, Fagiolo G, Varela M, Melendez-Calderon A, Allievi A, Merchant N, Tusor N, Counsell SJ, Burdet E, Beckmann CF, Edwards AD. Development of BOLD signal hemodynamic responses in the human brain. NeuroImage. 2012; 63:663-673. DOI | PubMed
- Baliki MN, Mansour AR, Baria AT, Apkarian AV. Functional reorganization of the default mode network across chronic pain conditions. PLoS ONE. 2014; 9DOI | PubMed
- Baumgärtner U, Iannetti GD, Zambreanu L, Stoeter P, Treede RD, Tracey I. Multiple somatotopic representations of heat and mechanical pain in the operculo-insular cortex: a high-resolution fMRI study. Journal of Neurophysiology. 2010; 104:2863-2872. DOI | PubMed
- Boly M, Balteau E, Schnakers C, Degueldre C, Moonen G, Luxen A, Phillips C, Peigneux P, Maquet P, Laureys S. Baseline brain activity fluctuations predict somatosensory perception in humans. PNAS. 2007; 104:12187-12192. DOI | PubMed
- Clancy B, Darlington RB, Finlay BL. Translating developmental time across mammalian species. Neuroscience. 2001; 105:7-17. DOI | PubMed
- Cole MW, Yang GJ, Murray JD, Repovš G, Anticevic A. Functional connectivity change as shared signal dynamics. Journal of Neuroscience Methods. 2016; 259:22-39. DOI | PubMed
- Cornelissen L, Fabrizi L, Patten D, Worley A, Meek J, Boyd S, Slater R, Fitzgerald M. Postnatal temporal, spatial and modality tuning of nociceptive cutaneous flexion reflexes in human infants. PLoS ONE. 2013; 8DOI | PubMed
- Dafny N, Dong WQ, Prieto-Gomez C, Reyes-Vazquez C, Stanford J, Qiao JT. Lateral hypothalamus: site involved in pain modulation. Neuroscience. 1996; 70:449-460. DOI | PubMed
- Denk F, McMahon SB, Tracey I. Pain vulnerability: a neurobiological perspective. Nature Neuroscience. 2014; 17:192-200. DOI | PubMed
- Doria V, Beckmann CF, Arichi T, Merchant N, Groppo M, Turkheimer FE, Counsell SJ, Murgasova M, Aljabar P, Nunes RG, Larkman DJ, Rees G, Edwards AD. Emergence of resting state networks in the preterm human brain. PNAS. 2010; 107:20015-20020. DOI | PubMed
- Duff EP, Makin T, Cottaar M, Smith SM, Woolrich MW. Disambiguating brain functional connectivity. NeuroImage. 2018; 173:540-550. DOI | PubMed
- Duvernoy HM. The Human Brain Stem and Cerebellum: Surface, Structure, Vascularization, and Three-Dimensional Sectional Anatomy, with MRI. 2012.
- Eklund A, Nichols TE, Knutsson H. Cluster failure: Why fMRI inferences for spatial extent have inflated false-positive rates. PNAS. 2016; 113:7900-7905. DOI | PubMed
- Ezra M, Faull OK, Jbabdi S, Pattinson KT. Connectivity-based segmentation of the periaqueductal gray matter in human with brainstem optimized diffusion MRI. Human Brain Mapping. 2015; 36:3459-3471. DOI | PubMed
- Fabrizi L, Slater R, Worley A, Meek J, Boyd S, Olhede S, Fitzgerald M. A shift in sensory processing that enables the developing human brain to discriminate touch from pain. Current Biology. 2011; 21:1552-1558. DOI | PubMed
- Fairhurst M, Wiech K, Dunckley P, Tracey I. Anticipatory brainstem activity predicts neural processing of pain in humans. Pain. 2007; 128:101-110. DOI | PubMed
- Fitzgerald M, Koltzenburg M. The functional development of descending inhibitory pathways in the dorsolateral funiculus of the newborn rat spinal cord. Developmental Brain Research. 1986; 389:261-270. DOI | PubMed
- Fitzgerald M. The development of nociceptive circuits. Nature reviews. Neuroscience. 2005; 6:507-520. DOI | PubMed
- Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van Essen DC, Raichle ME. The human brain is intrinsically organized into dynamic, anticorrelated functional networks. PNAS. 2005; 102:9673-9678. DOI | PubMed
- Friston KJ. Functional and effective connectivity: a review. Brain Connectivity. 2011; 1:13-36. DOI | PubMed
- Goksan S, Hartley C, Emery F, Cockrill N, Poorun R, Moultrie F, Rogers R, Campbell J, Sanders M, Adams E, Clare S, Jenkinson M, Tracey I, Slater R. fMRI reveals neural activity overlap between adult and infant pain. eLife. 2015; 4DOI
- Gratton C, Laumann TO, Nielsen AN, Greene DJ, Gordon EM, Gilmore AW, Nelson SM, Coalson RS, Snyder AZ, Schlaggar BL, Dosenbach NUF, Petersen SE. Functional brain networks are dominated by stable group and individual factors, not cognitive or daily variation. Neuron. 2018; 98:439-452. DOI | PubMed
- Griffanti L, Douaud G, Bijsterbosch J, Evangelisti S, Alfaro-Almagro F, Glasser MF, Duff EP, Fitzgibbon S, Westphal R, Carone D, Beckmann CF, Smith SM. Hand classification of fMRI ICA noise components. NeuroImage. 2017; 154:188-205. DOI | PubMed
- Griffanti L, Salimi-Khorshidi G, Beckmann CF, Auerbach EJ, Douaud G, Sexton CE, Zsoldos E, Ebmeier KP, Filippini N, Mackay CE, Moeller S, Xu J, Yacoub E, Baselli G, Ugurbil K, Miller KL, Smith SM. ICA-based artefact removal and accelerated fMRI acquisition for improved resting state network imaging. NeuroImage. 2014; 95:232-247. DOI | PubMed
- Harita S, Stroman PW. Confirmation of resting-state BOLD fluctuations in the human brainstem and spinal cord after identification and removal of physiological noise. Magnetic Resonance in Medicine. 2017; 78:2149-2156. DOI | PubMed
- Hartley C, Moultrie F, Gursul D, Hoskin A, Adams E, Rogers R, Slater R. Changing balance of spinal cord excitability and nociceptive brain activity in early human development. Current Biology. 2016; 26:1998-2002. DOI | PubMed
- Hathway G, Harrop E, Baccei M, Walker S, Moss A, Fitzgerald M. A postnatal switch in GABAergic control of spinal cutaneous reflexes. European Journal of Neuroscience. 2006; 23:112-118. DOI | PubMed
- Hathway GJ, Koch S, Low L, Fitzgerald M. The changing balance of brainstem-spinal cord modulation of pain processing over the first weeks of rat postnatal life. The Journal of physiology. 2009; 587:2927-2935. DOI | PubMed
- Jenkinson M, Bannister P, Brady M, Smith S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 2002; 17:825-841. DOI | PubMed
- Jenkinson M, Smith S. A global optimisation method for robust affine registration of brain images. Medical Image Analysis. 2001; 5:143-156. DOI | PubMed
- Jensen KB, Loitoile R, Kosek E, Petzke F, Carville S, Fransson P, Marcus H, Williams SC, Choy E, Mainguy Y, Vitton O, Gracely RH, Gollub R, Ingvar M, Kong J. Patients with Fibromyalgia display less functional connectivity in the brain’s pain inhibitory network. Molecular Pain. 2012; 8DOI
- Lee MC, Zambreanu L, Menon DK, Tracey I. Identifying brain activity specifically related to the maintenance and perceptual consequence of central sensitization in humans. Journal of Neuroscience. 2008; 28:11642-11649. DOI | PubMed
- Mai JK, Paxinos G, Voss T. Atlas of the Human Brain. Academic Press; 2008.
- Maihöfner C, Handwerker HO. Differential coding of hyperalgesia in the human brain: a functional MRI study. NeuroImage. 2005; 28:996-1006. DOI | PubMed
- Mainero C, Boshyan J, Hadjikhani N. Altered functional magnetic resonance imaging resting-state connectivity in periaqueductal gray networks in migraine. Annals of Neurology. 2011; 70:838-845. DOI | PubMed
- McKeown M, Hu YJ, Jane Wang Z. ICA denoising for Event-Related fMRI studies. Conference Proceedings : … Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual Conference. 2005; 1:157-161. DOI | PubMed
- McKeown MJ, Makeig S, Brown GG, Jung TP, Kindermann SS, Bell AJ, Sejnowski TJ. Analysis of fMRI data by blind separation into independent spatial components. Human Brain Mapping. 1998; 6:160-188. DOI | PubMed
- McMahon S, Koltzenburg M, Tracey I, Turk DC. Wall & Melzack’s Textbook of Pain. Elsevier Health Sciences; 2013.
- McMullan S, Lumb BM. Midbrain control of spinal nociception discriminates between responses evoked by myelinated and unmyelinated heat nociceptors in the rat. Pain. 2006; 124:59-68. DOI | PubMed
- Ossipov MH, Dussor GO, Porreca F. Central modulation of pain. Journal of Clinical Investigation. 2010; 120:3779-3787. DOI | PubMed
- Petrovic P, Kalso E, Petersson KM, Ingvar M. Placebo and opioid analgesia– imaging a shared neuronal network. Science. 2002; 295:1737-1740. DOI | PubMed
- Ploner M, Lee MC, Wiech K, Bingel U, Tracey I. Prestimulus functional connectivity determines pain perception in humans. PNAS. 2010; 107:355-360. DOI | PubMed
- Power JD, Barnes KA, Snyder AZ, Schlaggar BL, Petersen SE. Spurious but systematic correlations in functional connectivity MRI networks arise from subject motion. NeuroImage. 2012; 59:2142-2154. DOI | PubMed
- Raichle ME. The brain’s default mode network. Annual Review of Neuroscience. 2015; 38:433-447. DOI | PubMed
- Rajkowska G, Goldman-Rakic PS. Cytoarchitectonic definition of prefrontal Areas in the normal human cortex: ii. variability in locations of Areas 9 and 46 and relationship to the talairach coordinate system. Cerebral Cortex. 1995; 5:323-337. DOI | PubMed
- Reynolds DV. Surgery in the rat during electrical analgesia induced by focal brain stimulation. Science. 1969; 164:444-445. DOI | PubMed
- Salimi-Khorshidi G, Douaud G, Beckmann CF, Glasser MF, Griffanti L, Smith SM. Automatic denoising of functional MRI data: combining independent component analysis and hierarchical fusion of classifiers. NeuroImage. 2014; 90:449-468. DOI | PubMed
- Sallet J, Mars RB, Noonan MP, Neubert FX, Jbabdi S, O’Reilly JX, Filippini N, Thomas AG, Rushworth MF. The organization of dorsal frontal cortex in humans and macaques. Journal of Neuroscience. 2013; 33:12255-12274. DOI | PubMed
- Schwaller F, Kanellopoulos AH, Fitzgerald M. The developmental emergence of differential brainstem serotonergic control of the sensory spinal cord. Scientific Reports. 2017; 7DOI | PubMed
- Schweinhardt P, Bushnell MC. Pain imaging in health and disease–how far have we come?. Journal of Clinical Investigation. 2010; 120:3788-3797. DOI | PubMed
- Segerdahl AR, Themistocleous AC, Fido D, Bennett DL, Tracey I. A brain-based pain facilitation mechanism contributes to painful diabetic polyneuropathy. Brain. 2018; 141:357-364. DOI | PubMed
- Serag A, Aljabar P, Ball G, Counsell SJ, Boardman JP, Rutherford MA, Edwards AD, Hajnal JV, Rueckert D. Construction of a consistent high-definition spatio-temporal atlas of the developing brain using adaptive kernel regression. NeuroImage. 2012; 59:2255-2265. DOI | PubMed
- Shi F, Yap PT, Wu G, Jia H, Gilmore JH, Lin W, Shen D. Infant brain atlases from neonates to 1- and 2-year-olds. PLoS ONE. 2011; 6DOI | PubMed
- Smith SM, Vidaurre D, Beckmann CF, Glasser MF, Jenkinson M, Miller KL, Nichols TE, Robinson EC, Salimi-Khorshidi G, Woolrich MW, Barch DM, Uğurbil K, Van Essen DC. Functional connectomics from resting-state fMRI. Trends in Cognitive Sciences. 2013; 17:666-682. DOI | PubMed
- Smith SM. Fast robust automated brain extraction. Human Brain Mapping. 2002; 17:143-155. DOI | PubMed
- Stagg CJ, Lin RL, Mezue M, Segerdahl A, Kong Y, Xie J, Tracey I. Widespread modulation of cerebral perfusion induced during and after transcranial direct current stimulation applied to the left dorsolateral prefrontal cortex. Journal of Neuroscience. 2013; 33:11425-11431. DOI | PubMed
- Thesen S, Heid O, Mueller E, Schad LR. Prospective acquisition correction for head motion with image-based tracking for real-time fMRI. Magnetic Resonance in Medicine. 2000; 44:457-465. DOI | PubMed
- Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007; 55:377-391. DOI | PubMed
- Tracey I. Getting the pain you expect: mechanisms of placebo, nocebo and reappraisal effects in humans. Nature Medicine. 2010; 16:1277-1283. DOI | PubMed
- Wager TD, Rilling JK, Smith EE, Sokolik A, Casey KL, Davidson RJ, Kosslyn SM, Rose RM, Cohen JD. Placebo-induced changes in FMRI in the anticipation and experience of pain. Science. 2004; 303:1162-1167. DOI | PubMed
- Walker SM, Fitzgerald M, Hathway GJ. Surgical injury in the neonatal rat alters the adult pattern of descending modulation from the rostroventral medulla. Anesthesiology. 2015; 122:1391-1400. DOI | PubMed
- Walker SM, Franck LS, Fitzgerald M, Myles J, Stocks J, Marlow N. Long-term impact of neonatal intensive care and surgery on somatosensory perception in children born extremely preterm. Pain. 2009; 141:79-87. DOI | PubMed
- Waters AJ, Lumb BM. Descending control of spinal nociception from the periaqueductal grey distinguishes between neurons with and without C-fibre inputs. Pain. 2008; 134:32-40. DOI | PubMed
- Wiech K, Jbabdi S, Lin CS, Andersson J, Tracey I. Differential structural and resting state connectivity between insular subdivisions and other pain-related brain regions. Pain. 2014; 155:2047-2055. DOI | PubMed
- Williams G, Fabrizi L, Meek J, Jackson D, Tracey I, Robertson N, Slater R, Fitzgerald M. Functional magnetic resonance imaging can be used to explore tactile and nociceptive processing in the infant brain. Acta Paediatrica. 2015; 104:158-166. DOI | PubMed
- Yu R, Gollub RL, Spaeth R, Napadow V, Wasan A, Kong J. Disrupted functional connectivity of the periaqueductal gray in chronic low back pain. NeuroImage. Clinical. 2014; 6:100-108. DOI | PubMed
- Zhuo M, Gebhart GF. Biphasic modulation of spinal nociceptive transmission from the medullary raphe nuclei in the rat. Journal of Neurophysiology. 1997; 78:746-758. DOI | PubMed
Fonte
Goksan S, Baxter L, Moultrie F, Duff E, Hathway G, et al. () The influence of the descending pain modulatory system on infant pain-related brain activity. eLife 7e37125. https://doi.org/10.7554/eLife.37125





