Abstract
Introduzione
Per decenni si è sospettata una relazione causale tra l’inquinamento atmosferico e alcuni problemi di salute umana. Il particolato (PM) e l’ozono a livello del suolo (O3) sono gli inquinanti più problematici in Europa in termini di danni alla salute umana, seguiti dal benzo (a) pirene (BaP) (un indicatore per gli idrocarburi policiclici aromatici (IPA)) e dal biossido di azoto (NO2)[1]. Le principali fonti di questi inquinanti sono i trasporti e l’energia, seguiti dall’industria. L’inquinamento atmosferico è coinvolto nelle malattie cardiovascolari[2], nell’ictus[3] e nelle malattie respiratorie [4, 5] come il cancro ai polmoni [6], l’asma infantile [7] e la dermatite atopica [8]. Inoltre, è stato dimostrato che l’esposizione perinatale agli idrocarburi policiclici aromatici (IPA), al biossido di azoto (NO2) e al particolato (PM) ha un impatto negativo sullo sviluppo neuropsicologico nei bambini[9]. Uno studio condotto a Sydney ha stimato che la riduzione del particolato (PM2.5) del 10% per 10 anni eviterebbe circa 650 morti premature [10]. Secondo Lelieveld et al., le proiezioni del modello basate su uno scenario di emissioni business-as-usual indicano che il contributo dell’inquinamento dell’aria esterna alla mortalità prematura potrebbe raddoppiare entro il 2050[11].
Diversi meccanismi d’azione possono essere coinvolti in questi impatti sulla salute: (1) Attività dei perturbatori endocrini: Questo è il caso degli IPA e dei metalli pesanti (Cu, Pb, Zn, ecc.) contenuti nel particolato, specialmente dai gas di scarico del diesel[12-15]. Le particelle di scarico del diesel contengono ad esempio sostanze con attività estrogeniche, antiestrogeniche e antiandrogeniche che possono influenzare la steroidogenesi gonadica e la gametogenesi. (2) Generazione di stress ossidativo: NO2, O3 o PM (attraverso i metalli pesanti e gli IPA che contengono) possono generare specie reattive dell’ossigeno (ROS)[16- 18]. Questi causano alterazioni del DNA, proteine e lipidi di membrana[19, 20]. (3) Modifiche del DNA: Attraverso la formazione di addotti del DNA, che portano a modifiche nell’espressione genica e/o alla comparsa di mutazioni epigenetiche o modifiche come un’alterazione della metilazione del DNA[21-23].
Si tratta di meccanismi generali che possono influenzare tutte le funzioni, compresa la procreazione.
Lo scopo di questo studio era di valutare la nostra attuale comprensione dell’impatto dell’inquinamento atmosferico sulle funzioni riproduttive. I risultati di tale revisione potrebbero sensibilizzare la popolazione e le autorità a prendersi cura della qualità dell’aria.
Metodi
Strategia di ricerca
Abbiamo condotto una revisione sistematica della letteratura relativa all’esposizione agli inquinanti atmosferici ambientali e alla fertilità o alla salute riproduttiva. Questa analisi è stata effettuata in conformità con i criteri PRISMA: Voci preferite per le revisioni sistematiche e le meta-analisi[24]. Abbiamo condotto la ricerca nell’aprile 2016 utilizzando il database PubMed. Tutte le ricerche sono state effettuate utilizzando il Advanced Search Builder e le parole chiave sono state ricercate in [Title OR Abstract]. Nel periodo dal 01/01/2000 e 04/01/2016, abbiamo filtrato i risultati selezionando gli articoli scritti in inglese.
Per quanto riguarda la fertilità, abbiamo utilizzato termini completi per ottimizzare la ricerca. Per quanto riguarda la qualità dell’aria, abbiamo optato per una strategia che combinava termini completi e nomi di sostanze inquinanti per non omettere alcun articolo.
Pertanto, la ricerca è stata la seguente:
((((((((((((((((((((((qualità dell’aria [Titolo/Abstract]) O O3[Titolo/Abstract]) O NO2 [Titolo/Astratto]) O ozono[Titolo/Astratto])) OPPURE PM2.5 [Titolo/Astratto]) OR diesel [Titolo/Abstract]) O SO2[Titolo/Astratto])) OR traffico [Titolo/Astratto])) OPPURE PM10 [Titolo/Astratto])) O l’inquinamento atmosferico[Titolo/Astratto])) O inquinanti atmosferici [Titolo/Astratto]) AND (“2000/01/01” [PDat]: “2016/04/01” [PDat]))) E (((((((((((((((ovaio [Titolo/Astratto]) O follicolo*[Titolo/Astratto]) OR follicolare [Titolo/Astratto]) O Ovaie [Titolo/Astratto]) O ovocita*[Titolo/Astratto]) O testicolo [Titolo/Astratto]) O testicolare [Titolo/Astratto]) O sperma [Titolo/Astratto])) OR spermatozoi [Titolo/Astratto]) O la fertilità [Titolo/Astratto]) O infertilità [Titolo/Astratto]) AND (“2000/01/01” [PDat]: “2016/04/01” [PDat]))) NON (((((Cancro [Titolo/Abstract]) O allergia [Titolo/Abstract]) O batteri [Titolo/Astratto]) AND (“2000/01/01” [PDat]: “2016/04/01” [PDat]))) E “inglese” [Lingua].
Criteri di inclusione e di esclusione degli articoli
Abbiamo incluso tutti gli studi sull’uomo e sugli animali derivanti dalla ricerca.
Abbiamo escluso gli articoli che includevano risultati che non riguardavano la fertilità, quelli incentrati sul cancro ovarico, la sindrome dell’ovaio policistico, l’endometriosi o la pubertà precoce. Infine, abbiamo escluso i dati relativi agli animali che non riguardano i mammiferi e gli studi basati sui risultati di una coltura in vitro (Fig. 1). Tuttavia, sono stati inclusi studi non sui mammiferi e studi in vitro per informare i meccanismi di azione degli inquinanti.Fig. 1Cartella di flusso che descrive la selezione degli articoli
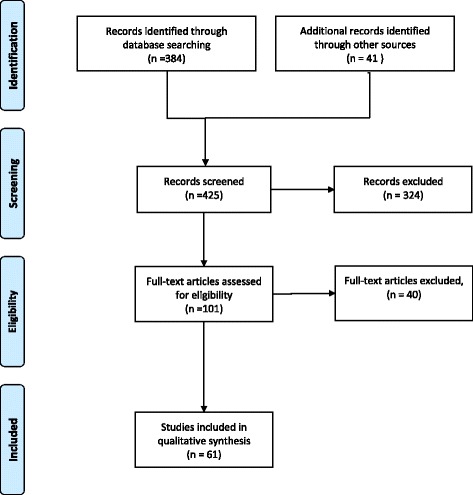
Fig. 1.Diagramma di flusso che descrive la selezione degli articoli
Risultati
Impatto dell’inquinamento atmosferico sulla fertilità spontanea (Tabella 1)
Pochi studi condotti sugli animali suggeriscono un impatto negativo dell’esposizione all’inquinamento atmosferico sulla fertilità spontanea[25, 26]. Due studi sono stati effettuati sui topi nella città di San Paolo del Brasile, che ha un alto livello di inquinamento atmosferico. Mohallem et al. hanno trovato una significativa riduzione del numero di neonati per topo e un significativo aumento del tasso di fallimento dell’impianto embrionale in topi femmina esposti come neonati per 3 mesi all’aria inquinata della città e poi accoppiati con maschi non esposti come adulti [27]. Nessun effetto è stato evidenziato quando l’esposizione si è verificata durante l’età adulta. Veras et al., d’altra parte, hanno riportato un significativo aumento del numero di giorni di estrus nel periodo studiato (media (SD): 56,63 (11,65) vs 34,57 (6,68); p< 0,03), una riduzione del numero di follicoli ovarici antrali (media (SD): 75 (35,2) vs 118,6 (18,4); p < 0.04), un aumento del tempo di accoppiamento così come una significativa diminuzione dell’indice di fertilità (numero di femmine gravide / numero totale di femmine, Tabella 1) nei topi adulti esposti all’inquinamento da traffico automobilistico[28].Tabella 1Effetto degli inquinanti atmosferici sulla fertilità spontaneaPubblicazioneSpecieNumero di soggettiAir pollutant (s) studiatoMethodologyResultsMohallem et al., 2005[27]Mouse104Multipli inquinanti ambientali da traffico automobilisticoMice divisi in 4 gruppi mantenuti in camere per almeno 3 mesi: – Gruppo 1: adulti (di 10 settimane, n = 20) esposti all’aria filtrata – Gruppo 2: adulti (n = 20) esposti agli inquinanti dell’aria ambiente – Gruppo 3: neonati (di 10 giorni, n = 33) esposti all’aria filtrata – Gruppo 4: neonati (n = 31) esposti agli inquinanti dell’aria ambiente Nessun effetto dell’esposizione in età adulta. Nel gruppo 4 rispetto al gruppo 3, è diminuito il numero di neonati per ogni topo (media ± range: 4,0 ± 6,0 vs 6,0 ± 7,0; p< 0,04) e aumento del tasso di fallimento dell’impianto embrionale (3,5 ± 7,0 vs 2,0 ± 8,0; p < 0,05).Veras et al., 2009[28]Mouse60Multipli inquinanti ambientali da traffico automobilisticoMice di seconda generazione (età > 60 giorni) nati da coppie cresciute in camera con aria filtrata (F) o aria non filtrata (NF), suddivisi in 2 categorie: – 10 femmine F e 10 NF utilizzate per la valutazione dei cicli e dei follicoli ovarici – 40 topi accoppiati divisi in 4 gruppi: – F1: topi allevati in F con gravidanza in F – F2: topi allevati in F con gravidanza in NF – NF1: topi allevati in NF con gravidanza in F – NF2: topi allevati in NF con gravidanza in NFIn NF rispetto ai topi F: Aumento del tempo di accoppiamento (giorni medi (SD): 10,65 (5,77) vs 3,5 (1,54); p< 0,0001) Diminuzione dell’indice di fertilità (numero di femmine gravide / numero totale di femmine: 55 vs 95%; p < 0,003). Aumento del tasso di aborto spontaneo nel gruppo NF2 rispetto a F1 (media (SD): 41,7 (5,8) vs 12,1 (5,8); p< 0,005).Dejmek et al., 2000 [29]Humans2585 couplesSO2Retrospective birth cohort study: Esposizione media mensile misurata delle coppie durante i 4 mesi precedenti il 1° ciclo con rapporti sessuali non protetti (sulla base della data di concepimento stimata), rispetto al livello di esposizione alla SO2 di riferimento (<40 pg/m3): Adjusted Odd Ratio per il tasso di fecondabilità: 0,57 (CI, 0,37-0,88) per un’esposizione di medio livello (40-80 pg/m3): 0,49 (CI0,29-0,8 1) per un’esposizione di alto livello (>80 pg/m3): Slama et al., 2013 [30]Humans1916 couplesSO2,NO2, PM2.5, O3, PAHRetrospective birth cohort study: Esposizione media misurata delle coppie durante i primi mesi 2 primi mesi prima del 1 ° ciclo con rapporto di fecondità non protetto.ridurre il rapporto di fecondità regolato (FR [95%CI]) con PM2.5 (0,78 [0.65-0.94]) e livelli di NO2 (0,72 [0.53-0.97]).Nieuwenhuijsen et al., 2014[31]UmaniTutte le donne in età riproduttiva (15-44 anni) che vivono a Barcellona: media (SD) 368,92 (±111,22) donne per tratto di censimento (N = 1061 tratti di censimento)PM10, PM2,5-10, PM2,5, NO2, NOxCross studio sezionale: Livello medio misurato di esposizione delle donne in età riproduttiva (15-44 anni) che vivono a Barcellona, secondo il tratto di censimento di residenza.rapporto di rischio [95% CI] per il tasso di fertilità ridotto (numero di nati vivi per 1000 donne) = 0,87 [0,82-0,94] per intervallo interquartile di PM2.5-10.Mahalingaiah et al., 2016[32]Umani36.294 infermieri di età riproduttivaVivere in prossimità di strade principali; PM10, PM2.5-10, PM2.5Prospettiva studio di coorte: Questionario biennale sulla fertilità Indirizzo residenziale in prossimità di strade principali (2 categorie: 0-199 m e ≥200 m). L’esposizione ambientale prevista a PM10, PM2.5-10 e PM2.5 a indirizzo residenzialeHazard Ratio [95% CI] per l’infertilità: 1.11 (CI: 1.02-1.20) per vivere vicino alle strade principali e 1.10 (0.99-1.22) per ogni 10 mg/m3 di aumento dell’esposizione media cumulativa a PM2.5-10.
Gli studi condotti sull’uomo in diversi paesi hanno prodotto risultati concordanti per quanto riguarda l’impatto dell’aria inquinata sulla fertilità umana, anche se sono discordanti per quanto riguarda il tipo di inquinante dell’aria in questione. A Teplice, un distretto altamente inquinato della Repubblica Ceca, Dejmek e colleghi hanno studiato l’effetto dell’esposizione all’SO2 nei 4 mesi precedenti il concepimento in una coorte di 2585 coppie di genitori. Hanno trovato un impatto significativamente negativo dell’esposizione all’ossido di zolfo (SO2) nel secondo mese prima del concepimento sul tasso di fecondabilità (valutato come i tassi di gravidanza dopo il primo ciclo mestruale senza contraccezione): i rapporti dispari regolati erano 0.57 (CI, 0,37-0,88; p< 0 ,011) in caso di esposizione di medio livello (40-80 pg/m3) e 0,49 (CI 0,29-0,8 1; p< 0,006) in caso di esposizione di alto livello (>80 pg/m3) rispetto all’esposizione di riferimento (<40 pg/m3) [29]. Poiché in questo studio la finestra di esposizione è stata definita retrospettivamente rispetto alla data di concepimento, Slama et al. hanno rianalizzato i dati dopo aver definito la finestra di esposizione rispetto all’inizio del rapporto sessuale non protetto ed hanno esaminato gli effetti di altri inquinanti atmosferici. Slama et al. non hanno confermato l’effetto dell’esposizione all’SO2 prima del concepimento, ma hanno osservato che ogni aumento di 10 μg/m3 nella concentrazione di PM2.5 è stato associato ad una diminuzione della fecondabilità del 22% (95% CI = 6-35%). Tra gli altri inquinanti atmosferici studiati (IPA, O3, NO2), solo i livelli di NO2 sono stati significativamente associati ad una diminuzione della fecondabilità nel primo mese (corretto rapporto di fecondabilità (FR) = 0,71 [95% CI = 0,57-0,87]) e due primi mesi (corretto FR: 0,72 [95% CI: 0,53-0,97]) di rapporti sessuali non protetti [30]. A Barcellona, utilizzando uno studio trasversale basato sui dati del registro a livello di censimento e un approccio di modellazione della regressione dell’uso del suolo, Nieuwenhuijsen et al. hanno riportato un collegamento statisticamente significativo (dettagliato nella Tabella 1) tra una diminuzione del tasso di fertilità (numero di nati vivi ogni 1000 donne) e un aumento del livello di inquinamento atmosferico, in particolare PM2.5-10 [31]. Infine, in un recente studio, Mahalingaiah et al. hanno confrontato il rischio di infertilità in oltre 36.000 infermiere in funzione della loro esposizione all’inquinamento atmosferico nel luogo di residenza. In un’analisi multivariata, hanno osservato un’associazione significativamente positiva tra infertilità e la vicinanza (<200 m) della residenza ad una strada principale (Hazard Ratio [95% CI] per l’infertilità quando vivono chiusi alle strade principali rispetto a più lontano = 1,11 (CI: 1,02-1,20), e tra infertilità e il livello di PM2,5-10. Essi hanno quindi concluso che l’inquinamento dell’aria ha un effetto potenzialmente dannoso sulla fertilità[32].
In conclusione, sia i dati animali che quelli umani non sono abbastanza forti da indicare un singolo inquinante dell’aria come responsabile di una diminuzione della fertilità spontanea. La maggior parte dei dati umani proviene da studi retrospettivi, basati su risposte dichiarative, livelli di esposizione previsti/modellati e non tengono conto di importanti fattori di confusione come l’esposizione al tabacco. Tuttavia, l’unico studio prospettico sull’uomo basato su una vasta popolazione (36.294 donne) e su dati precisi di geolocalizzazione, ha trovato un impatto della vicinanza di un indirizzo residenziale alle strade principali sul rischio di infertilità[32], che conferma i risultati degli studi sui topi[27, 28].
Impatto dei risultati della fecondazione in vitro dell’inquinamento atmosferico (FIV) (Tabella 2)
Lo studio delle popolazioni IVF aiuta a fornire prove sugli effetti dell’inquinamento atmosferico sulla riproduzione umana, poiché consente di cronometrare con precisione gli eventi chiave di ovulazione, fecondazione e impianto. In questa sezione, abbiamo escluso gli studi sull’influenza della qualità dell’aria nei laboratori di FIVET per concentrarci sugli effetti degli inquinanti sui pazienti sottoposti a FIVET. L’influenza dei fattori ambientali sui risultati della tecnologia della riproduzione assistita (ART), e in particolare sulle tecniche di FIVET, è stata sospettata per molti anni[33], ma gli effetti specifici dell’inquinamento dell’aria sulla FIVET sono stati poco studiati in letteratura[26].Tabella 2Effetto degli inquinanti sui risultati della FIVET (ICM: massa cellulare interna; TE: trophectoderm)PubblicazioneSpecieNumero di soggettiAir pollutant (s) studiedMethodologyResultsLegro et al.., 2010[34]Umani7403 pazienti nel primo ciclo di FIVPM2.5, PM10, SO2, NO2, O3Studio di coorte Esaminata associazione tra il tasso di natalità dal vivo e l’esposizione giornaliera prevista di sostanze inquinanti nel luogo di residenza dal primo giorno di stimolazione ovarica al giorno di recupero degli ovociti (T1); dal recupero degli ovociti al trasferimento di embrioni (T2); dal trasferimento di embrioni al test di gravidanza (T3) e dal trasferimento di embrioni al risultato della gravidanza (T4) Odd ratio (95%CI) per la nascita dal vivo associato a 1 incremento SD di ogni sostanza inquinante: NO2 a T1: 0.80 (0.71-0.91) NO2 a T2: 0.87 (0.79-0.96) NO2 a T3: 0.76 (0.66-0.86) O3 a T1: 1.26 (1.10-1.44) O3 a T3: 1.23 (1. 07-1.41) O3 a T4: 0.62 (0.48-0.81)Perin et al., 2010[36]Humans531 donne incintePM10Retrospective matched (studio in sterile (n= 177) e concepimento spontaneo di donne (n = 354). Esposizione media misurata per 14 giorni dopo la data dell’ultimo periodo mestruale e l’associazione con il primo trimestre perdita di gravidanza lossOdd Ratio (95% CI) per aborto spontaneo nel primo trimestre nel quarto quartile del livello di esposizione PM10: -Popolazione totale: 2.58 (95% CI: 1.63-4.07); -nella popolazione infertile: 2.32 (1.00-5.43) -Popolazione di concepimento naturale: 2.72 (1.51-4.89).Perin et al., 2010[35]Umani400 donne nel primo ciclo di FIV per l’infertilità maschilePM10Studio retrospettivo: esposizione media misurata durante i 14 giorni successivi alla data dell’ultimo periodo mestruale e associazione con i risultati di laboratorio (numero di ovociti, tasso di fecondazione, morfologia dell’embrione; n = 348), risultati del trattamento FIV (n = 348) e risultati della gravidanza (n = 189).Nessuna associazione tra l’esposizione ad alte concentrazioni di PM10 e gli esiti del trattamento di laboratorio e della FIVET. Odd ratio (95% CI) per la perdita clinica precoce della gravidanza nel quarto quartile del livello di esposizione al PM10: 5.05 (1.04-24.51).Maluf et al., 2009 [37]Mice112Multiple air pollutants from automobile traffic3 gruppi di femmine vergini esposte al filtraggio (FA) o all’aria ambiente (AA) durante il periodo prenatale (dalla data di accoppiamento efficiente al parto) e/o postnatale (dal parto alle 6 settimane di età): Gruppo FA-FA(n= 40); gruppo FA-AA (n = 36)e gruppo AA-AA (n = 36).Effetto significativo dell’esposizione al PM2.5 sullo sviluppo delle blastocisti..: Il conteggio delle cellule ICM è diminuito: FA-AA: 24,45 ± 5,58 AA-AA: 24,08 ± 4,79 FA-FA: 30,06 ± 6,32 TE conteggio delle cellule è aumentato: FA-AA: 102,60 ± 10,82 AA-AA: 95,43 ± 12,28 FA-FA: 90,64 ± 10,11Januario et al., 2010[42]Mouse225 zigoti (esposizione 1) e 95 zigoti (esposizione 2)Particelle di scarico diesel (DEP)Coltura embrionale in vitro con esposizione 1: 0, 0.2, 2 e 20 μg/cm2 DEP( 10 μg/cm2 relativi alle concentrazioni di aria ambiente) fino al giorno 5 Esposizione 2: 0, 0,2, 2 e 20 μg/cm2 DEP fino al giorno 8Esposizione 1: il conteggio delle cellule ICM è diminuito con l’aumento delle concentrazioni di DEP: 0 μg/cm2:29,9± 2,5 0,2 μg/cm2:18,2 ± 3,5 2 μg/cm2:14,6± 6.5 20 μg/cm2:10,3± 4,1 TE cellule conteggio TE invariato Esposizione 2: Aumento delle cellule apoptotiche al giorno 8 con aumento delle concentrazioni di DEP: 0 μg/cm2: 8,6% 0,2 μg/cm2: 17,2% 2 μg/cm2: 22,1%.
In 7403 donne sottoposte al primo ciclo di FIV, Legro et al. hanno valutato gli effetti di vari inquinanti atmosferici (SO2, NO2, O3, PM2.5 e PM10) lungo 4 diverse fasi della procedura: dal primo giorno di stimolazione ovarica al prelievo degli ovociti (T1); dal prelievo degli ovociti al trasferimento degli embrioni (T2); dal trasferimento degli embrioni al test di gravidanza (T3) e dal trasferimento degli embrioni all’esito della gravidanza (T4)[34]. Hanno trovato impatti negativi di un aumento di una deviazione standard delle concentrazioni di NO2 sui nati vivi in tutte le fasi del ciclo di FIVET tranne T4 (Tabella 2). Tuttavia questo impatto è stato più forte quando l’aumento delle concentrazioni di NO2 si è verificato in T3 (Odd ratio (95%CI) per i nati vivi: 0,76 (0,66-0,86). Anche se, un effetto bifasico di esposizione O3 è stato visto, con un effetto positivo sul parto vivo quando l’esposizione ha avuto luogo prima dell’impianto embrionale e un effetto negativo dopo l’impianto embrionale, non sono stati osservati effetti significativi nel tasso di nascita vivo per altri inquinanti dopo la regolazione per l’esposizione NO2.
Inoltre, nello studio dell’impatto dell’esposizione a breve termine (14 giorni dopo la data dell’ultimo periodo mestruale) al particolato di grandi dimensioni (PM10) sui risultati della FIV in circa 400 donne, Perin et al. non hanno osservato alcuna influenza dell’esposizione al PM10 sui parametri di stimolazione ovarica (numero di giorni di trattamento, risposta ovarica, ecc.), sui parametri biologici (numero di ovociti raccolti, tasso di fecondazione, morfologia dell’embrione, ecc. D’altra parte, hanno riscontrato un aumento statisticamente significativo del 5% del rischio di perdita di gravidanza precoce per unità di aumento dell’esposizione alla fase follicolare PM10, che ha portato ad un aumento del tasso di aborti spontanei precoci tra le donne esposte al quartile più alto di concentrazioni di PM10[35]. In un altro studio su 531 donne in gravidanza, gli stessi autori hanno trovato che le donne esposte ad alte concentrazioni di particolato di grandi dimensioni (PM10) durante la fase follicolare del ciclo ovarico avevano un tasso di aborti spontanei precoci raddoppiato, non importa se il concepimento era naturale o il risultato della FIV[36].
Per quanto riguarda i dati sugli animali, Maluf et al. hanno valutato gli effetti dell’esposizione al particolato fine (PM2.5) del traffico automobilistico sullo sviluppo di embrioni di topo ottenuti attraverso la FIVET da topi femmina esposti o meno a PM2.5 durante il loro periodo pre o postnatale fino alla maturità sessuale[37]. Non hanno trovato alcuna differenza tra topi esposti e non esposti in termini di risposta ovarica alla stimolazione e il numero di blastocisti ottenute. Tuttavia, hanno osservato un effetto significativo dell’esposizione al PM2.5 sulla ripartizione del lignaggio cellulare nella fase di blastocisti tra la massa cellulare interna (ICM cioè le cellule che partecipano all’ontogenesi del futuro feto) e il trophectoderm (TE cioè le cellule che partecipano all’ontogenesi della futura placenta). Infatti, anche se simili numero totale di cellule di blastocisti sono stati trovati, il numero di cellule in ICM sono stati significativamente aumentati in animali non esposti (30,06 ± 6,32) rispetto al pre e postnatale esposti (24,08 ± 4,79) o solo animali postnatale esposti (24,45 ± 5,58). Al contrario, il numero di cellule in TE è stato diminuito in blastocisti da animali non esposti, portando ad un rapporto ICM/TE più debole negli animali esposti di circa il 25%. E ‘ben noto nei topi[38, 39], che un rapporto modificato ICM / TE impatto sul potenziale di impianto di blastocisti e il risultato post-impianto. Negli esseri umani, anche se questo rapporto non può essere implementato in un ambiente clinico, la classificazione morfologica di ICM e TE è legata alla ploidia embrionale[40] e ha un impatto sul potenziale della blastocisti anche nelle blastocisti euploidi[41].
In un altro studio, l’esposizione in vitro di embrioni di topo a particelle di scarico diesel estratte dal tubo di scarico di un autobus della flotta dei trasporti pubblici di San Paolo, ha mostrato un effetto negativo dose-dipendente sullo sviluppo embrionale precoce e sul processo di schiusa, l’allocazione delle cellule di blastocisti, la morfologia dell’ICM e l’apoptosi delle cellule embrionali [42].
Complessivamente, i dati dei 3 studi umani disponibili sulla qualità dell’aria e i risultati della FIVET forniscono un debole livello di evidenza perché consistono in studi retrospettivi, con lunghi periodi di osservazione (7[34] a 10anni[35, 36] durante i quali l’efficacia delle procedure di FIVET può essere migliorata), con esposizioni approssimative basate sui livelli stimati dei modelli nazionali di qualità dell’aria [34] o sull’esposizione media giornaliera di un’intera città[35, 36], senza tenere conto dell’esatto indirizzo di casa [35, 36] o della sua distanza dalla più vicina stazione di monitoraggio [34] o con confusione residua dall’esposizione al tabacco [34]. Inoltre, i risultati di questi studi sono discordanti per quanto riguarda il PM10, l’unico inquinante dell’aria comunemente valutato da questi studi. Ciò potrebbe essere dovuto a grandi differenze nei livelli di PM10 tra i siti di studio. Pertanto sono necessari altri studi, idealmente prospettici, per confermare l’impatto degli inquinanti atmosferici sui risultati dell’ART umana.
Impatto dell’inquinamento atmosferico sul gamete maschile
Negli animali (Tabella 3)
Studi condotti sugli animali hanno dimostrato che varie forme di inquinamento dell’aria hanno effetti nocivi sulla qualità dello sperma. Una diminuzione statisticamente significativa della produzione giornaliera di spermatozoi è stata segnalata insieme ad un aumento delle forme anomale di sperma nei topi e nei ratti esposti ai gas di scarico delle automobili, in particolare dei veicoli diesel[43- 47]. È stato anche riportato un effetto sulla qualità nucleare degli spermatozoi[48]. Yauk et al. hanno osservato un aumento statisticamente significativo della rottura del DNA spermatico e dell’ipermetilazione del DNA spermatico nei topi esposti all’inquinamento dell’aria ambiente in una città canadese[22]. Queste osservazioni sono state associate ad un aumento statisticamente significativo del tasso di mutazioni del DNA spermatico, in particolare sui loci delle ripetizioni delle sequenze di DNA. Quest’ultimo fenomeno aumenta la possibilità di mutazioni genetiche nel DNA delle cellule germinali (in questo caso gli spermatozoi), che sono trasmissibili ai discendenti[49].Tabella 3Effetto degli inquinanti sulla spermatogenesi negli animaliPubblicazioneSpecieNumero di soggettiInquinanti dell’aria studiatiMetodologiaRisultatiIeradi et al., 1996[45]Topi82Multipli inquinanti del traffico automobilistico3 gruppi di topi in 3 siti a Roma esposti a densità di traffico variabile. Campionamenti di spermatozoi epididimali di maschi.aumento delle anomalie morfologiche degli spermatozoi nel gruppo esposto ai più alti livelli di inquinanti.Watanabe e Oonuki, 1999[47]Ratti18Multipli inquinanti da gas di scarico diesel3 gruppi di ratti esposti dalla nascita all’età di 3 mesi: – gruppo 1: esposti ai gas di scarico diesel – gruppo 2: esposti ai gas di scarico diesel filtrati (senza particelle) – gruppo 3: gruppo di controllo non esposti Livelli aumentati di testosterone, estradiolo e FSH in 2 gruppi esposti. Diminuzione del livello di LH nel gruppo 1. Diminuzione della produzione di spermatozoi e dell’attività degli enzimi testicolari in 2 gruppi esposti.Yoshida et al., 1999[43]Mouse80Multipli inquinanti dai gas di scarico dieselTopo maschio diviso in 4 gruppi esposti per 6 mesi: – 3 gruppi con diverse concentrazioni di particelle di scarico diesel (DEP): 0.3, 1.0 e 3.0 mg DEP/m3-1 gruppo di controllo non espostoMorfologia alterata dei tubuli seminiferi, diminuzione dell’mRNA nel recettore LH e diminuzione della produzione giornaliera di spermatozoi in 3 gruppi esposti, in un modo non statisticamente convalidato dipendente dalla dose.Tsukue et al., 2001[51]Rats344Multipli inquinanti da topi diesel di scaricoMaschi divisi in 4 gruppi esposti per 8 mesi: – 3 gruppi con concentrazioni crescenti di gas di scarico diesel – 1 gruppo di controllo non esposto – diminuzione del peso della prostata e della ghiandola coagulante e aumento dei livelli di LH e testosterone nel gruppo esposto a concentrazioni più basse. Aumento del peso della prostata, delle vescicole seminali e delle ghiandole coagulanti e dei livelli di testosterone nel gruppo esposto alla più alta concentrazione.Somers et al., 2002[48]Coppie di topi40 Coppie di topiPiù inquinanti da fonti industriali Coppie di topi divise in 2 gruppi, esposte per 10 settimane: – 1 gruppo in area industriale inquinata – 1 gruppo di confronto non esposto in area rurale Mutazioni delle linee germinali studiate (ESTR loci).aumento del tasso di mutazioni delle linee germinali tra le famiglie di topi nel gruppo esposto. Nessuna differenza nelle mutazioni materne.Inyang et al., 2003[50]Ratti40Benzo (a) pirene (BaP)Maschi divisi in 4 gruppi: – 3 gruppi esposti a dosi crescenti di BaP per 10 giorni – 1 gruppo di controllo non esposto -Decreased percentage of spermatozoi con motilità progressiva in 2 gruppi esposti alle più alte concentrazioni di BaPSomers et al., 2004 [49]Topi168Multipli inquinanti da fonti industriali4 gruppi di 21 coppie di topo di razza: – 2 gruppi esposti in un’area industriale urbana inquinata per 10 settimane: 1 gruppo esposto all’aria ambiente e 1 gruppo esposto all’aria filtrata con un filtro HEPA (filtro antiparticolato). – 2 gruppi esposti in un’area rurale per 10 settimane: 1 gruppo esposto all’aria ambiente e 1 gruppo esposto all’aria filtrata con un filtro HEPA. Il sito di esposizione e la filtrazione HEPA hanno entrambi avuto impatti significativi sulle mutazioni ereditarie paterne nella prole (ANOVA: F = 7,22, p = 0,009 e F = 8,03, p = 0,006 rispettivamente). Nessun effetto sulle mutazioni materne. La progenie di topi esposti all’aria ambiente in aree industriali urbane ha ereditato mutazioni ESTR di origine paterna da 1,9 a 2,1 volte più frequentemente della progenie in altri tre gruppi di trattamento.Watanabe, 2005[44]Ratti156Multipli inquinanti dei gas di scarico dieselLe femmine gravide sono divise in 5 gruppi di esposizione, dal 7° giorno di gestazione al parto: – gruppo 1 esposto ad alta dose totale di scarico non filtrato del motore diesel (alto totale) – gruppo 2 esposto ad alta dose di scarico filtrato senza particelle (alto filtrato) _ gruppo 3 esposto a bassa dose totale di scarico del motore diesel (basso totale) – gruppo 4 esposto a bassa dose di scarico filtrato (basso filtrato) – gruppo 5 esposto ad aria pulita (controllo) Studio di maschi nati da questi gruppi.Diminuzione del numero di cellule di Sertoli, numero di cellule germinali e numero di spermatozoi prodotti giornalmente e aumento dei livelli ormonali follicolo-stimolanti in tutti i gruppi esposti ai gas di scarico dei motori dieselJeng e Yu, 2008[46]Rats20, 5 in ogni gruppoPAHMales suddivisi in 4 gruppi: – 3 gruppi esposti a dosi crescenti di IPAHMales – 1 gruppo di controllo non espostoMinore produzione giornaliera di sperma e mobilità dello sperma nel gruppo esposto. Aumento dei livelli di LH e diminuzione dei livelli di testosterone nel gruppo esposto.Yauk et al., 2008[22]Mice30Multipli inquinanti da fonti industriali e dal traffico automobilisticoI maschi allevati in siti inquinati e divisi in 2 gruppi: – 1 gruppo esposto all’aria ambiente – 1 gruppo esposto all’aria filtrata con un filtro antiparticolato (HEPA) Studio del DNA degli spermatozoi dopo 3, 10 o 16 settimane di esposizione.Aumento della frequenza delle mutazioni del locus ESTR (dopo 16 settimane), numero di rotture del filamento di DNA (dopo 3 e 10 settimane) e aumento della metilazione del DNA (dopo 10 e 16 settimane) nel gruppo esposto all’aria ambiente rispetto all’aria filtrata.
A livello testicolare, Yoshida et al. hanno osservato cambiamenti strutturali nelle cellule di Leydig[43], mentre Watanabe ha riportato una riduzione delle cellule di Sertoli nei ratti esposti ai gas di scarico del diesel[44]. A livello ormonale, Jeng e Yu hanno dimostrato che l’esposizione prolungata agli IPA porta ad una riduzione dei livelli di testosterone nel sangue e ad un aumento dei livelli di LH alla fine del periodo di esposizione[46]. Allo stesso modo, Inyang et al. hanno trovato una diminuzione statisticamente significativa dei livelli di testosterone nel sangue e un aumento dei livelli di LH nei ratti esposti al benzo (a) pirene, un tipo di IPA[50]. D’altra parte, nel loro studio sui ratti, Tsukue et al. hanno descritto modifiche ormonali nel gruppo esposto ai gas di scarico diesel con un aumento statisticamente significativo dei livelli di testosterone nel sangue e dei livelli di LH, associato a variazioni del peso delle ghiandole sessuali accessorie (prostata, vescicole seminali)[51]. Watanabe e Oonuki hanno anche riportato un aumento statisticamente significativo dei livelli di estrogeni e testosterone e una diminuzione significativa dei livelli di LH e FSH in un gruppo di ratti esposti ai gas di scarico diesel. Inoltre, hanno osservato un aumento del numero di cellule degenerative tra gli stadi spermatocitari e spermatici[47].
Negli esseri umani (Tabella 4)
Negli ultimi decenni, nei paesi industrializzati si è osservato un calo della qualità dello sperma[52, 53]. Una possibile ragione di questa alterazione sembra essere l’esposizione a sostanze tossiche nell’ambiente, e in particolare all’inquinamento dell’aria ambiente[54- 56]. È stato infatti dimostrato che le professioni esposte ai gas di scarico, come i collettori di pedaggio che lavorano sulle autostrade, sviluppano più frequentemente anomalie dello sperma[16, 57].Tabella 4Effetto degli inquinanti sulla spermatogenesi nell’uomoPubblicazioneNumero di soggettiAir pollutant (s) studiedMethodologyResultsSelevan et al., 2000[59]272PM10, SO2, CO e NOxCross-sectional study: Confronto tra i parametri dello sperma di uomini sani di 18 anni che vivono in Teplice (area industrializzata nella Repubblica Ceca) e quelli di uomini sani di 18 anni che vivono in Prachatice (area rurale nella Repubblica Ceca). I dati di esposizione per PM10, SO2, CO e NOx sono stati raccolti per 90 giorni prima del prelievo del campione di sperma e classificati in livelli bassi, medi e alti.gli uomini che vivono a Teplice avevano una significativa diminuzione della mobilità dello sperma (media ± SD: 31.6 ± 16,3 vs 36,1 ± 17,9), morfologia spermatica normale (16,6 ± 7,3 vs 19,3 ± 8,6). Nessun effetto sulla conta spermatica o sulla qualità della cromatina spermatica. Qualunque sia il distretto, rispetto al basso livello di esposizione, il livello di esposizione medio è stato associato a una diminuzione della motilità degli spermatozoi (analisi di regressione corretta: β (95CI): -8,03 (-13,57;-2,49)) e della morfologia degli spermatozoi (OR (95CI): -0,54 (-0.86;-0.22)Un alto livello di esposizione è stato associato ad una diminuzione della morfologia spermatica normale (β (95CI): -0.84 (-1.15;-0.53)) e una maggiore proporzione di spermatozoi con cromatina anormale (β (95CI): 0.30 (0.08-0.52).De Rosa et al., 2003[54]170Multiple pollutants from automobile trafficCross sectional study: Confronto tra uomini esposti(n= 85, che lavorano in un casello autostradale) e il gruppo di controllo delle partite di età (n = 85) della stessa area e impiegati come impiegati, autisti, studenti o medici.Nel gruppo esposto rispetto al gruppo di controllo, diminuzione della motilità dello sperma: 34,7 ± 2,2%vs 56.8 ± 0,8 (p < 0,0001)Diminuzione della vitalità: 51,7 ± 2,5% contro 80,7 ± 0,6 (p < 0.0001) Diminuzione dell’integrità del DNA nucleare dello sperma: 48,5 ± 2,2% contro 75,7 ± 0,6 (p< 0,0001) Diminuzione della penetrazione delmuco cervicale: 15,9 ± 1,2 mm vs 30,3 ± 0,2 (p < 0,0001) Nessun effetto sulla conta spermatica e sul volume dello spermaGaspari et al., 2003 [21]182PAHProspective coort study: Studio dei parametri spermatici in uomini italiani infertili con morfologie spermatiche anomale che erano partner di donne senza cause note di infertilità. Correlazione positiva tra il livello di addotti di PAH-DNA e la morfologia anormale delle teste degli spermatozoi(r= 0,3; p = 0,0001 ).Rubes et al., 2005[68]36SO2, NOx e PM10Prospective coort study: giovani uomini sani che vivono a Teplice (zona industrializzata) che hanno somministrato da 3 a 7 campioni di sperma durante l’inverno (aria altamente inquinata) e l’estate (aria meno inquinata). Concentrazioni medie di SO2, NOx e PM10 raccolte in 90 giorni prima di ogni campionamento.associazione positiva tra percentuale di spermatozoi con cromatina anormale e livello di inquinamento dell’aria: β = 0.19 (95% CI: 0.02, 0.36) Nessuna associazione tra esposizione all’inquinamento dell’aria e misure di routine dello sperma o aneuploidia spermatica.Hsu et al., 2006 [65]48PAHsCross studio sezionale: Valutazione dello sperma tra i lavoratori delle cokerie dell’azienda siderurgica di Taiwan. Rispetto al gruppo “topside-oven” (TO, n = 16) più esposto e al gruppo “side-oven” meno esposto (SO, n = 32). Tassi significativamente più elevati di oligospermia (18,8 vs. 0%) e morfologia spermatica anomala (32,3 vs. 14,6%) nei lavoratori TO vs. SO. Nessuna differenza nel volume dello sperma, nella conta degli spermatozoi, nella motilità e nella frequenza dell’astenospermia. Correlazioni positive tra il livello di IPA urinaria e la percentuale di forme spermatiche anomale (β (SE β): 0,107 (0,040); p = 0,012 ) e cromatina spermatica decondensata (β (SE β): 0,235 (0,073); p = 0,003).Sokol et al., 2006[67]48O3, NO2, CO e PM10Studio di coorte retrospettivo: Valutazione della conta spermatica e della motilità dei donatori di sperma(n= 48) che hanno fornito 5134 donazioni di sperma in un periodo di 2 anni. Dati di esposizione per O3, NO2, CO e PM10 dal luogo di residenza del donatore in 3 periodi: 0-9, 10-14 e 70-90 giorni prima di ogni donazione.associazione negativa tra il livello di esposizione a O3 e la conta spermatica totale: Per un ritardo di 0-9 giorni: diminuzione del 4,22% per intervallo interquartile (IQR) di 14,3 ppb di aumento di O3, p = 0,01Per un ritardo di 10-14 giorni: diminuzione del 2,92% per IQR di 14,3 ppb di aumento di O3, p = 0.05) Per 70-90 giorni di ritardo: diminuzione del 3,90% per ogni IQR di 14,3 ppb di aumento di O3, p = 0,05)Nessuna associazione tra il livello di esposizione a O3 e la conta totale degli spermatozoi mobili. Nessuna associazione con altri inquinanti studiati.Guven et al., 2008[57]73Multiple pollutants from diesel exhaustCross sectional study: Confronto tra i parametri seminali di uomini esposti ai gas di scarico dei veicoli diesel(n= 38 uomini che lavorano come esattori di pedaggio sulle autostrade) e uomini che lavorano come personale d’ufficio nella stessa azienda (n = 35). Nessun monitoraggio dei livelli di esposizione.diminuzione significativa della concentrazione di spermatozoi (media ± SD: 44,64 ± 36,26 vs 70,85 ± 50,0), della mobilità (54.76 ± 23,64 vs 70,25 ± 15,5) e sperma con morfologia normale (p = 0,001) nel gruppo esposto rispetto al gruppo non esposto.Hammoud et al., 2010[58]2576 campioniPM2.5Studio retrospettivo di 2 popolazioni in 5 anni: Popolazione 1: uomini che partecipano ad un’analisi dello sperma(n= 1699 campioni, 1,16 ± 0,46 (media ± SD) campioni di sperma per paziente, numero di pazienti non dichiarato) Popolazione 2: uomini che si presentano per l’inseminazione artificiale intrauterina in almeno quattro occasioni (n = 169 pazienti, 877 campioni). Concentrazioni locali medie mensili di PM2.5 in ciascuno dei 4 mesi precedenti il campionamento, sulla base dei dati nazionali.Popolazione 1: PM 2.5 contemporanei correlati negativamente con la morfologia spermatica attuale (r =-0.076;p= 0,018) Correlazione negativa tra PM 2,5 registrato 2 mesi (β = – 0,510; p = 0,01) e 3 mesi (β = – 0,411; p = 0,04) precedentemente e la motilità dello sperma. Popolazione 2: La motilità dello sperma è correlata negativamente con i valori di PM 2,5 registrati 3 mesi prima (β = – 0,407; p = 0,04) Nessuna correlazione tra i parametri dello sperma e i valori di PM 2,5 registrati 1, 3 e 4 mesi prima in entrambe le popolazioni.Jurewicz et al., 2015[70]212O3, CO, SO2, SO2, NOx, PM2.5 e PM10Studio di coorte prospettico: Livello misurato di aneuploidia spermatica negli uomini polacchi consultati per l’infertilità con una conta spermatica normale. I dati di esposizione per la media di CO, SO2, NOx, PM2.5 e PM10 oltre 90 giorni prima del campionamento presso la stazione più vicina al luogo di residenza.associazione positiva tra l’esposizione a PM2.5 e la disomia Y (β = 0.68 (95%CI: 0.55-0.85); p = 0.001), disomia dei cromosomi sessuali (β = 0.78 (95%CI: 0.59-0.).99; p= 0,05), disomia del cromosoma 21 (β = 0,78 (95%CI: 0,62-0,97; p = 0,03). Associazione positiva tra l’esposizione al PM10 e la disomia 21 (β = 0,58 (95%CI: 0,46-0,72; p = 0,02) Nessuna associazione tra aneuploidia spermatica e O3, CO, SO2 e NOx esposizioni.Wijesekara et al., 2015 [62]300Multipli inquinantida esposizioni ambientali e professionaliStudio trasversale: Tra i pazienti normozoospermici (n= 201), gli uomini esposti (n = 115) hanno mostrato, rispetto agli uomini non esposti (n = 86), una significativa diminuzione (media (95%CI)): Morfologia normale (%): 39,03 (36,25-41,81) vs 43,89 (40,54-47,24) Mobilità dello sperma (%): 48,42 (46,57-50,27) vs 52,48 (50,2-54,76) Vitalità dello sperma (%): 56,67 (54,48-58,86) vs 64,71 (62,03-67).39) Tra gli uomini pathozoospermici(n= 99), solo la concentrazione di spermatozoi (16,89 milioni/ml (12,25-21,53) vs 31,94 (23,45-40,43)) e la morfologia dello sperma (forme normali: 21,46% (17,2-25,72) vs 28,00% (23,35-32,65)) sono stati colpiti in uomini esposti vs non esposti.Radwan et al., 2016[66]327PM10, PM2.5, SO2, NOX, studio di coorte CORetrospective: Uomini polacchi con conta spermatica normale trattati per l’infertilità. Ottenuti dati di esposizione per la media di CO, SO2, NOx, PM2.5 e PM10 oltre 90 giorni prima del campionamento dello sperma presso la stazione più vicina al luogo di residenza. Condotta regressione lineare multipla dopo la regolazione per età, fumo, temperatura media dell’aria (oltre 90 giorni prima del campionamento dello sperma), malattie passate, durata dell’astinenza sessuale e stagione.associazioni statisticamente significative tra la morfologia dello sperma e l’esposizione a ciascun inquinante..: PM10: β =32.60; p = 0.0002 PM2.5: β =40.53; p = 0.0001 SO2: β =6.60; p= 0,0001 NOx: β =6,19; p = 0,01 CO: β =24,86; p = 0,0001. Associazioni statisticamente significative tra la percentuale di spermatozoi con cromatina immatura e i livelli di PM2,5 (β =0,31; p = 0,0001) e PM10 (β =0,22; p = 0,02).
La letteratura sull’argomento è ricca, ma gli studi esistenti non sono sempre comparabili perché non riguardano necessariamente gli stessi inquinanti e le loro metodologie spesso differiscono in termini di popolazione di studio, durata e periodo di esposizione. Inoltre, i loro risultati sono talvolta discordanti.
Ciononostante, la maggior parte degli studi trova alterazioni nei parametri dello sperma dopo l’esposizione all’inquinamento atmosferico, fornendo prove di una diminuzione della qualità dello sperma. Queste alterazioni comportano una riduzione della mobilità degli spermatozoi[54, 56-62], o della qualità del loro movimento [54,56]. Si parla anche di un’alterazione della morfologia degli spermatozoi con una riduzione della percentuale di forme normali, in particolare della morfologia della testa[21, 56, 57, 59- 66]. Ci sono risultati discordanti per la conta degli spermatozoi, con alcuni studi che riportano una significativa diminuzione della concentrazione di spermatozoi nel seme dopo l’esposizione a certe forme di inquinamento dell’aria[56, 57, 60, 65, 67], mentre altri non osservano alcun effetto significativo[59, 64, 68]. Lo stesso vale per la percentuale di spermatozoi vivi (vitalità degli spermatozoi), con un piccolo numero di studi che hanno riscontrato un effetto significativamente negativo dell’inquinamento dell’aria su questo parametro[54, 62].
Nel loro studio, Guven et al. hanno confrontato i parametri degli spermatozoi tra gli uomini esposti ai gas di scarico dei veicoli diesel attraverso il loro lavoro nei caselli autostradali e gli uomini non esposti che lavorano come personale d’ufficio nella stessa azienda. Il gruppo esposto ha avuto una diminuzione statisticamente significativa della conta degli spermatozoi, della mobilità degli spermatozoi e della morfologia dello sperma, in particolare dei difetti cefalici[57]. Selevan et al. hanno studiato i parametri dello sperma in giovani uomini sani provenienti da due regioni della Repubblica Ceca, una regione produttrice di carbone con alti livelli di inquinamento atmosferico (Teplice) e una regione meno inquinata (Prachatice). Rispetto al basso livello di esposizione, hanno trovato un impatto negativo statisticamente significativo dell’esposizione a livelli medi e alti di inquinamento atmosferico sulla percentuale di spermatozoi mobili (rispettivamente per bassa, media e alta esposizione: 36,2% ± 17; 27,9% ± 18,1 e 32,5% ± 13,2). Lo stesso valeva per la morfologia dello sperma, in particolare per le teste di sperma. D’altra parte, rispetto al basso livello di esposizione, non hanno evidenziato un effetto di esposizione media o alta all’inquinamento atmosferico sulla conta totale degli spermatozoi (rispettivamente: per bassa, media e alta esposizione: 113,5 ± 130,7 milioni/eiaculato; 100,9 ± 97,6 e 129,1 ± 103,1) [59]. Lo stesso team ha riscontrato un aumento statisticamente significativo della percentuale di spermatozoi con cromatina anormale (anomalie nella compattazione e frammentazione del DNA) negli uomini esposti ad alti livelli di inquinamento atmosferico nel distretto di Teplice nella Repubblica Ceca[68]. Questi studi suggeriscono quindi che l’inquinamento dell’aria può alterare il DNA degli spermatozoi[48, 69].
Oltre a queste osservazioni, altri autori hanno anche riportato un possibile effetto dell’inquinamento dell’aria sul genoma dello sperma a livello cromosomico[60, 70]. Così, Jurewicz et al.[70] hanno misurato il tasso di aneuploidia negli spermatozoi degli uomini polacchi con concentrazioni di spermatozoi normali (> o = 15 milioni/ml) di consulenza per l’infertilità. Dopo l’adeguamento per 12 fattori di confusione come l’età, il fumo, il consumo di alcol, la stagione, le malattie del passato, l’intervallo di astinenza, la distanza dalla stazione di monitoraggio, hanno osservato una significativa associazione tra il tasso di aneuploidia e l’esposizione a determinati inquinanti atmosferici, in particolare la disomia del cromosoma Y e il PM2.5 (β = 0,68 (95% IC: 0,55-0,85)), disomia 21 e PM10 (β = 0,58 (95% IC: 0,46-0,72)) e PM2,5 (β = 0,78 (95% IC: 0,62-0,97)).
Infine, come nel caso degli animali, alcuni autori hanno riportato una variazione dei livelli di ormoni circolanti nell’asse gonadico in seguito all’esposizione all’inquinamento atmosferico. De Rosa et al. hanno paragonato un gruppo di uomini esposti che lavorano in un casello autostradale a un gruppo non esposto che lavora come impiegati, autisti, studenti o medici e che vive nella stessa area geografica. Insieme ad un’alterazione dei parametri dello sperma (oltre al volume di eiaculazione e alla conta degli spermatozoi), hanno osservato un livello significativamente più alto di FSH nel gruppo esposto (media ± SE: 4,1 ± 0,3 UI/l contro 3,2 ± 0,2; p < 0,05), anche se questo è rimasto all’interno dell’intervallo di valori normali [54]. Radwan et al.[66] hanno anche trovato un’associazione negativa tra i livelli di testosterone e l’esposizione ad alcuni inquinanti atmosferici (PM10, PM2.5, CO e NOx).
L’evidenza dell’effetto nocivo dell’inquinamento atmosferico sui parametri riproduttivi maschili è quindi forte. Può anche favorire una diminuzione della fertilità maschile. Tuttavia, la grande maggioranza degli studi sull’uomo sono retrospettivi. La nostra ricerca ha trovato solo uno studio prospettico su un periodo di 2 anni in giovani donatori di sperma sani non fumatori di Los Angeles, California[67]. La popolazione era piuttosto piccola(n= 48) e sono state studiate solo la concentrazione di sperma e la motilità. Tuttavia, ogni donatore ha fornito almeno 10 volte durante il periodo studiato. Solo l’esposizione all’O3 ha mostrato un impatto significativo sui parametri degli spermatozoi tra i 4 inquinanti atmosferici stimati nel luogo di residenza (O3, NO2, CO e PM10) dopo l’aggiustamento per numerosi fattori tra cui il periodo di astinenza e gli altri inquinanti atmosferici. Per l’esposizione fino a 9 giorni prima della raccolta dello sperma, c’è stata una diminuzione del 4,22% della concentrazione di spermatozoi per intervallo interquartile (IQR) di aumento di O3 (p= 0,01). Per l’esposizione 10-14 giorni e 70-90 giorni prima dell’eiaculazione, c’è stata una diminuzione del 2,92% e del 3,90% della concentrazione di spermatozoi per IQR di aumento del O3, rispettivamente (p = 0,05 in entrambi i casi). Sono necessari ulteriori studi longitudinali per confermare l’impatto negativo dell’inquinamento atmosferico sui parametri dello sperma umano.
Impatto dell’inquinamento atmosferico sul gamete femminile (Tabella 5)
Contrariamente all’aspetto maschile, sono stati effettuati pochissimi studi sull’impatto dell’inquinamento atmosferico sui parametri riproduttivi femminili nella fertilità spontanea. Ciò si spiega probabilmente con le difficoltà che tali studi comportano. Infatti, è più facile raccogliere e studiare i gameti maschili. Un piccolo numero di autori ha comunque esaminato questo argomento.Tabella 5Effetto degli inquinanti sulle funzioni ovariche negli animali e nell’uomoPubblicazioneSpecieNumero di soggettiAir pollutant (s) studiedMethodologyResultsOgliari et al., 2013[71]Topi37Multipli inquinanti da gas di scarico diesel4 gruppi di femmine: – gruppo 1 = esposizione intrauterina e postnatale (60 giorni) all’aria filtrata – gruppo 2 = esposizione intrauterina all’aria inquinata dai gas di scarico dei motori diesel ed esposizione postnatale all’aria filtrata – gruppo 3 =esposizione intrauterina all’aria filtrata e postnatale all’aria inquinata – gruppo 4 = esposizione intrauterina e postnatale all’aria inquinata Analisi morfometrica delle ovaie per definire l’area relativa occupata dai follicoli primordiali, primari, secondari e Graaf.Significativa diminuzione dell’area proporzionale occupata dai follicoli primordiali in tutti i topi esposti, sia in utero(p= 0,035), durante il periodo postnatale (p = 0,015) o entrambi (p = 0,004). Proporzioni di follicoli primari(p= 0,04) e follicoli secondari (p = 0,05) sono stati ridotti solo nei topi esposti in utero.Thurston et al., 2000 [72]Humans3343BenzeneCross-sectional study: Usato questionario standardizzato per misurare la lunghezza dei cicli mestruali nelle donne che lavorano nell’industria petrolchimica e determinata associazione con l’esposizione al benzene sulla base di auto-rapporti.dopo 7 anni di lavoro, aumentare il rischio di avere una lunghezza anomala del ciclo mestruale (meno di 21 o più di 35 giorni) con ogni 5 anni di esposizione aggiuntiva benzene: Odds Ratio: 1,71 (95% CI:1,27-2,31).Cho et al., 2001 [73]Humans1408Multiple pollutants from occupational exposure to organic solvents (benzene, toluene, styrene, e/o xilene)Studio in sezione trasversale: Lunghezza misurata dei cicli mestruali basata su un questionario somministrato dall’intervistatore in un gruppo di donne che lavorano nell’industria petrolchimica ed esposte a solventi organici rispetto al gruppo non esposto (basato sulla valutazione qualitativa dell’igiene industriale) che lavora nella stessa azienda.Rispetto al gruppo non esposto, il rapporto di probabilità (95%CI) di oligomenorrea (cicli mestruali superiori a 35 giorni) nel gruppo esposto a: stirene: 1,65 (1,05-2,55) xilene: 1,63 (1,04-2,53) benzene: 1,35 (0,90-2,00) toluene: 1,43 (0,93-2,17) tutti i solventi: 1,76 (1,08-2,82)Tomei et al., 2006 [74]Umani 201Multipli inquinanti da traffico automobilisticoStudio di coorte prospettico: Confronto tra i livelli di 17β-estradiolo nel sangue nelle fasi follicolari, ovulatorie e luteali del ciclo nelle poliziotte assegnate al traffico automobilistico (n = 100) e i livelli nel gruppo di controllo delle poliziotte assegnate alle attività indoor (n = 101). I gruppi corrispondono a numerosi criteri, tra cui il giorno del ciclo. Diminuzione significativa del livello medio (SD) di estradiolo nel gruppo esposto durante la fase follicolare (50,4 (21,1) vs 118.5 (71,1) pg/ml; p< 0,001) e fase luteale (82,3 (33,0) vs 153,9 (57,3) pg/ml; p< 0,001 ), ma non in fase ovulatoria (150,9 (91,6) vs 193,5 (112,5) pg/ml; NS).
Negli animali
Veras et al. hanno confrontato un gruppo di topi esposti all’aria inquinata dal traffico automobilistico di San Paolo con un gruppo di topi esposti ad aria filtrata meno inquinata. Gli autori hanno osservato un significativo allungamento dei cicli e una diminuzione del numero di follicoli antrali nei gruppi esposti rispetto a quelli non esposti, ma non hanno osservato un effetto significativo sui follicoli in altri stadi dello sviluppo follicolare (cioè i follicoli primordiali, primari e secondari)[28], concludendo quindi che l’inquinamento atmosferico ha un effetto potenzialmente tossico sulle ovaie. Tale effetto è stato dimostrato in seguito dallo stesso gruppo confrontando l’istologia ovarica di topi femmine esposte a gas di scarico diesel (in particolare PM2.5) in utero e/o durante il periodo postnatale con topi non esposti[71]. Mentre i livelli di esposizione sono stati considerati accettabili dall’Organizzazione Mondiale della Sanità, le ovaie hanno mostrato una diminuzione statisticamente significativa della proporzione dell’area occupata dai follicoli primordiali nei topi esposti in tutti i periodi di esposizione (esposizione prenatale (dal giorno del tappo vaginale alla nascita); esposizione postnatale (dalla nascita fino alla maturità sessuale definita come giorno 60 post-natale) o entrambi) rispetto ai topi non esposti. Così, gli autori hanno concluso che ci può essere una possibile diminuzione della riserva ovarica e quindi del potenziale riproduttivo dei topi in seguito all’esposizione ai gas di scarico diesel, in particolare PM2.5[71]. Tuttavia, mentre gli investigatori hanno pianificato di mantenere i livelli di esposizione al PM2.5 entro intervalli giornalieri accettabili come definito dall’Organizzazione Mondiale della Sanità (25 μg/m3/d), l’esposizione media giornaliera è stata ottenuta da un’esposizione di 1 h ad un livello molto più alto (660 μg/m3). Una tale esposizione acuta potrebbe avere un impatto drastico sui risultati.
Negli esseri umani
Tra le donne sono stati effettuati solo tre studi. Due studi trasversali hanno osservato la lunghezza dei cicli mestruali in grandi popolazioni di donne che lavoravano nell’industria petrolchimica in Cina e che erano esposte a solventi organici. Thurston et al. hanno studiato l’effetto di un’esposizione professionale al benzene (un idrocarburo aromatico monociclico monociclico altamente volatile) valutato da auto-rapporto. Hanno trovato che le probabilità corrette di anomalie del ciclo mestruale (meno di 21 o più di 35 giorni) non sono cambiate in modo significativo durante i primi 7 anni di esposizione. Tuttavia, dopo 7 anni, il rapporto di probabilità è aumentato a 1,71 (95% CI 1,27-2,31) per ulteriori 5 anni di esposizione [72]. Cho et al. hanno utilizzato una valutazione più obiettiva dell’esposizione basata su una valutazione dell’igiene industriale che classifica ogni luogo di lavoro in base alla presenza o all’assenza di quattro solventi organici (benzene, toluene, stirene e/o xilene) utilizzando le informazioni sulle fasi di produzione nella lavorazione dei prodotti petrolchimici. Hanno descritto una maggiore frequenza di donne con oligomenorrea (cicli mestruali superiori a 35 giorni) nel gruppo esposto a stirene, xilene o a tutti i solventi. Inoltre, un ulteriore anno di esposizione a qualsiasi solvente ha aumentato significativamente il rapporto di probabilità del 7% (CI95%: 1,00-1,14) e una durata del lavoro superiore a 3 anni ha prodotto un rapporto di probabilità corretto per l’oligomenorrea di 1,53 (95% CI:1,00-2,34) [73]. Pertanto, questi due studi sostengono un rapporto di durata dell’esposizione e di risposta per i solventi aromatici.
Tomei et al. hanno studiato l’impatto dell’esposizione alle sostanze inquinanti sulle donne poliziotte assegnate al controllo del traffico a Roma rispetto a un gruppo di donne poliziotte assegnate ad attività al chiuso, come le mansioni amministrative e burocratiche. Hanno trovato un livello medio di estradiolo statisticamente significativamente più basso nel gruppo esposto nella fase follicolare e nella fase luteale del ciclo, ma non nella fase ovulatoria. Sebbene non sia stata rilevata alcuna differenza statisticamente significativa tra i due gruppi in termini di interruzione del ciclo mestruale, gli autori suggeriscono che questi cambiamenti ormonali potrebbero alterare l’ovulazione nelle donne esposte[74].
Sebbene questi tre studi suggeriscano che l’inquinamento dell’aria possa avere un impatto sui parametri riproduttivi femminili, in particolare a livello ovarico, rimangono dubbi sul fatto che gli inquinanti abbiano un effetto diretto o indiretto sulla regolazione ipotalamo-ipofisaria-gonadiale.
Meccanismi di azione degli inquinanti atmosferici
In letteratura sono stati proposti quattro possibili meccanismi per il meccanismo d’azione degli inquinanti atmosferici sulla fertilità: cambiamenti ormonali dovuti all’azione di un perturbatore endocrino, induzione dello stress ossidativo, alterazione del DNA cellulare o modifiche epigenetiche. Gli inquinanti dell’aria possono agire come perturbatori endocrini principalmente attraverso l’attivazione del recettore degli idrocarburi arilici (AhR) o dei recettori degli estrogeni o degli androgeni[75]. Un altro meccanismo cellulare comune con cui la maggior parte degli inquinanti atmosferici esercita i suoi effetti negativi è la loro capacità di agire direttamente come proossidanti di lipidi e proteine o come generatori di radicali liberi, promuovendo lo stress ossidativo e l’induzione di risposte infiammatorie[76]. Alcuni inquinanti possono alterare la molecola del DNA o indurre cambiamenti epigenetici, come la metilazione del DNA e le modifiche dell’istone che possono essere trasmesse alle generazioni future.
Azione come perturbatori endocrini
Gli inquinanti atmosferici, in particolare gli IPA e i metalli pesanti (come Cu, Pb, Zn, ecc.) contenuti nel PM, specialmente dai gas di scarico del diesel[12, 13], sono descritti in letteratura come perturbatori endocrini con attività estrogenica, anti-estrogenica o anti-androgenica[14, 77-81].
Kizu et al. hanno descritto l’attività anti-androgenica di alcuni composti particellari dei gas di scarico del diesel in cellule umane PC3/AR derivate da tumori della prostata[15], mentre Okamura et al. hanno riportato l’attività anti-estrogenica di composti simili in cellule umane MCF-7 da tumori della mammella[14]. Studi in vivo condotti su ratti hanno rilevato cambiamenti significativi nei livelli circolanti di steroidi sessuali e gonadotropine nei gruppi esposti ai gas di scarico diesel, associati ad una diminuzione della produzione giornaliera di spermatozoi, dimostrando una spermatogenesi inibita, così come cambiamenti morfologici delle cellule germinali nei tubuli seminiferi[46, 47, 50, 51]. Allo stesso modo, nel loro studio sui topi, Yoshida et al. hanno riportato una significativa diminuzione del livello di espressione dell’RNA messaggero nei recettori LH delle cellule di Leydig, e un’alterazione della morfologia dei tubuli seminiferi e delle cellule di Leydig nel gruppo esposto ai gas di scarico del diesel[43].
Negli uomini, un piccolo numero di studi descrive un cambiamento nei livelli circolanti di ormoni nell’asse gonadico in seguito all’esposizione all’inquinamento atmosferico. Ad esempio, De Rosa et al. hanno trovato un’alterazione dei parametri degli spermatozoi associata a livelli significativamente più alti di FSH nel gruppo esposto ai gas di scarico, anche se sono rimasti all’interno del range di valori normali[54], mentre Radwan et al. hanno riportato un’associazione negativa tra i livelli di testosterone e l’esposizione a certi inquinanti atmosferici (PM10, PM2.5, CO e NO2)[66].
Questi disturbi ormonali possono essere indotti da inquinanti atmosferici, in particolare gli IPA, che si legano ai recettori degli estrogeni[78, 79, 82, 83] o ai recettori degli androgeni[15, 84] con un effetto agonistico o antagonistico. Essi possono anche essere il risultato dell’attivazione della via AhR. Questo è un fattore di trascrizione attivato da un gran numero di ligandi, compresi gli IPA[82, 83, 85, 86] e coinvolti in molti processi cellulari. Ad esempio, la materia organica estraibile (EOM) da PM2.5 può causare malformazioni cardiache e diminuzione dei battiti cardiaci negli embrioni di pesce zebra attraverso l’AhR, e questi difetti cardiaci sembrano essere contrastati negli embrioni co-esposti all’EOM e ad un antagonista AhR[87, 88]. Per quanto riguarda il sistema riproduttivo maschile, Izawa et al. hanno riportato una diminuzione della produzione giornaliera di spermatozoi, un aumento delle anomalie morfologiche negli spermatozoi, nonché un aumento significativo dei livelli di testosterone nel sangue nel gruppo esposto ai gas di scarico diesel, combinato con un significativo aumento dell’indice di attività AhR[89]. Utilizzando ceppi di topo con diversi indici di attività AhR, hanno mostrato che la diminuzione della produzione giornaliera di spermatozoi dovuta all’esposizione ai gas di scarico diesel è stata correlata negativamente con questo indice(r= -0,593; p = 0,008) [90 ]. Per quanto riguarda il sistema riproduttivo femminile, AhR può regolare la crescita dei follicoli ovarici, modulare la steroidogenesi ovarica e svolgere un ruolo nell’ovulazione[91]. Sembra anche trasmettere la tossicità di alcuni ligandi, come gli IPA, in particolare nel sistema riproduttivo, dove può essere uno dei mediatori nel disturbo ormonale steroideo e quindi nella fertilità[89, 90, 92].
Induzione di specie reattive dell’ossigeno (ROS)
La maggior parte degli inquinanti atmosferici come il NO2are ROSor sono in grado di generarli, come l’O3 o il PM, attraverso i metalli pesanti e gli IPA che contengono. Possono essere trasformati dal CYP450 diidro-deidrogenasi, che produce il chinone redox, catalizzando le reazioni di trasferimento degli elettroni e stimolando così la produzione di ROS[93, 16- 18].
Per i maschi, diversi studi hanno descritto gli effetti potenzialmente dannosi dello stress ossidativo sullo sperma. Mentre una certa quantità di ROS è necessaria per le funzioni fisiologiche degli spermatozoi, in particolare per il processo di fecondazione, una quantità eccessiva può causare danni agli spermatozoi[93]. Infatti, la membrana spermatica è composta da un gran numero di acidi grassi polinsaturi che mantengono la fluidità della membrana, rendendo gli spermatozoi altamente sensibili allo stress ossidativo. La perossidazione di questi acidi grassi può causare una perdita di questa fluidità, nonché una diminuzione dell’attività degli enzimi della membrana e dei canali ionici, e può quindi alterare la mobilità degli spermatozoi e alcuni dei meccanismi necessari per la fecondazione dell’ovocita. Inoltre, la perossidazione delle basi del DNA degli spermatozoi potrebbe portare alla rottura dei filamenti di DNA e a mutazioni genetiche, causando una diminuzione del potenziale di fecondazione degli spermatozoi, insieme ad un’alterazione del successivo sviluppo embrionale. L’ossidazione delle proteine indotta dal ROS può anche alterare le funzioni degli spermatozoi scindendo le catene polipeptidiche e un accumulo di aggregati proteici. Infine, ROS può avviare reazioni a catena che portano all’apoptosi, in particolare alterando l’integrità della membrana mitocondriale. Questo processo potrebbe essere accelerato dal danno al DNA e alla membrana spermatica, che potrebbe portare ad una diminuzione del numero di spermatozoi[94-98].
Per le donne, i ROS sono prodotti durante la follicologenesi e sembrano anche svolgere un ruolo fisiologico, in particolare nella meiosi degli ovociti I rinnovata e nell’indurre l’ovulazione[99, 100]. L’eccesso di ROS, tuttavia, porta ad uno stato di stress ossidativo e sembra essere dannoso per le funzioni ovariche. Nel loro studio sui topi mutati con un deficit di glutatione, l’antiossidante intracellulare più abbondante, Lim et al. hanno descritto una diminuzione più rapida del numero di follicoli ovarici in questi topi mutati, correlata ad un’accelerazione dell’esaurimento dei follicoli primordiali[101]. Hanno anche riportato una percentuale più alta di piccoli follicoli con una forte proliferazione di cellule granulose, che riflette il reclutamento accelerato dei follicoli primordiali. Hanno quindi concluso che lo stress ossidativo nelle ovaie può portare ad una diminuzione della riserva ovarica accelerando l’esaurimento dei follicoli ovarici primordiali aumentando il reclutamento dal pool follicolare e l’apoptosi negli stadi più avanzati dello sviluppo dei follicoli.
Alterazione del DNA cellulare
Il terzo meccanismo riportato in letteratura per spiegare i meccanismi fisiopatologici coinvolti nell’alterazione della fertilità causata dall’inquinamento atmosferico è l’induzione di alterazioni del DNA cellulare.
In primo luogo, queste alterazioni del DNA potrebbero essere collegate allo stress ossidativo indotto, come descritto sopra. Infatti, i processi infiammatori dovuti al ROS possono alterare il DNA, come riportato in uno studio di tassisti[102]. Inoltre, la lunghezza dei telomeri è stata riportata per aumentare con l’aumento dell’esposizione annuale a NOx, PM2.5 e PM10[103].
In secondo luogo, possono verificarsi dopo la formazione di addotti di DNA. Infatti, alcune molecole sono in grado di legarsi ad una base di DNA attraverso un legame covalente, modificando così l’espressione genica. Inoltre, possono verificarsi mutazioni che portano ad un’alterazione del DNA cellulare e ad un aumento del rischio di apoptosi. Alcuni inquinanti atmosferici sono in grado di formare addotti di DNA nelle cellule germinali, in particolare gli IPA contenuti nel PM[21, 46, 68].
Modifiche epigenetiche
Le modifiche epigenetiche, in particolare i cambiamenti nella metilazione del DNA, possono portare ad un’espressione genica anormale. Queste anomalie sono state implicate nell’effetto dell’inquinamento atmosferico sulla cancerogenesi[104] e sull’insufficienza respiratoria[105, 106]. Nei ratti esposti a PM2.5, PM10 e NO2, Ding et al. hanno dimostrato sia l’ipometilazione che l’ipermetilazione di alcuni geni[107]. Questi cambiamenti possono anche influenzare il DNA mitocondriale (mt)[108]. Byun et al. hanno dimostrato che la metilazione di mtDNA nel sangue nel promotore D-loop è stato associato con i livelli di PM2.5[109] alterazioni epigenetiche sono stati anche riportati come coinvolti nel fallimento della spermatogenesi[110]. Nello studio di Stouder et al.[111] somministrazione di alcool in topi gravidi induceva l’ipometilazione del gene impresso H19 e può aver contribuito alla diminuzione della spermatogenesi. In un altro studio[112], Park et al. hanno dimostrato che l’esposizione a lungo termine al butile parabene (BP) può causare l’ipermetilazione del DNA dalla fase mitotica a quella post-meiotica nei testicoli di ratto adulti.
Infine, gli inquinanti atmosferici hanno anche dimostrato di alterare il microRNA (miRNA). Uno studio di Tsamou et al. ha dimostrato che l’espressione placentare di miR-21, miR-146a e miR-222, tre miRNA noti per essere espressi nella placenta e per essere influenzati dall’esposizione all’inquinamento atmosferico nelle cellule del sangue leucocitario, è stato inversamente associato all’esposizione al PM2.5 durante il secondo trimestre di gravidanza[113].
Conclusione
L’inquinamento atmosferico ha un impatto negativo sulla gametogenesi sia maschile che femminile. Questi impatti non solo influenzano la quantità di gameti, ma anche la loro qualità a livello genetico ed epigenetico. Questi impatti alterano anche lo sviluppo dell’embrione.
La maggior parte degli studi precedenti riguarda i gameti maschili, probabilmente per la facilità di ottenerli e analizzarli, e pochi studi precedenti si sono concentrati sugli ovociti e sulla follicologenesi. Gli studi hanno anche mostrato un impatto sullo sviluppo fetale, con un aumento degli aborti spontanei.
Il ruolo individuale di specifici inquinanti è difficile da identificare, dal momento che i soggetti negli studi epidemiologici sono tipicamente esposti a diversi inquinanti contemporaneamente.
La fisiopatologia che porta alla fertilità alterata è poco conosciuta. Disturbi ormonali, induzione dello stress ossidativo, DNA cellulare e alterazioni epigenetiche sono quattro meccanismi proposti in letteratura, che probabilmente lavorano in combinazione, per spiegare questo impatto negativo.
Poiché l’inquinamento atmosferico è onnipresente e ha molte origini, sembra indispensabile sensibilizzare la popolazione e le autorità pubbliche a cercare di limitare il più possibile gli inquinanti atmosferici.
References
- ].Publisher Full Text
- Cosselman KE, Navas-Acien A, Kaufman JD. Environmental factors in cardiovascular disease. Nat Rev Cardiol. 2015; doi:10.1038/nrcardio.2015.152.
- Shah AS, Lee KK, McAllister DA, Hunter A, Nair H, Whiteley W, Langrish JP, Newby DE, Mills NL. Short term exposure to air pollution and stroke: systematic review and meta-analysis. BMJ (Clinical research ed). 2015; doi:10.1136/bmj.h1295.
- Atkinson RW, Kang S, Anderson HR, Mills IC, Walton HA. Epidemiological time series studies of PM2.5 and daily mortality and hospital admissions: a systematic review and meta-analysis. Thorax. 2014; doi:10.1136/thoraxjnl-2013-204492.
- Karakis I, Kordysh E, Lahav T, Bolotin A, Glazer Y, Vardi H, Belmaker I, Sarov B. Life prevalence of upper respiratory tract diseases and asthma among children residing in rural area near a regional industrial park: cross-sectional study. Rural Remote Health. 2009;1092
- Lemjabbar-Alaoui H, Hassan OU, Yang YW, Buchanan P. Lung cancer: biology and treatment options. Biochim Biophys Acta. 2015; doi:10.1016/j.bbcan.2015.08.002.
- Jassal MS. Pediatric asthma and ambient pollutant levels in industrializing nations. Int Health. 2015; doi:10.1093/inthealth/ihu081.
- Ahn K. The role of air pollutants in atopic dermatitis. J Allergy Clin Immunol. 2014; doi:10.1016/j.jaci.2014.09.023.
- Suades-Gonzalez E, Gascon M, Guxens M, Sunyer J. Air pollution and neuropsychological development: a review of the latest evidence. Endocrinology. 2015; doi:10.1210/en.2015-1403.
- Broome RA, Fann N, Cristina TJ, Fulcher C, Duc H, Morgan GG. The health benefits of reducing air pollution in Sydney. Australia Environmental research. 2015; doi:10.1016/j.envres.2015.09.007.
- Lelieveld J, Evans JS, Fnais M, Giannadaki D, Pozzer A. The contribution of outdoor air pollution sources to premature mortality on a global scale. Nature. 2015; doi:10.1038/nature15371.
- Takeda K, Tsukue N, Yoshida S. Endocrine-disrupting activity of chemicals in diesel exhaust and diesel exhaust particles. Environ Sci. 2004;195:11:33–45.
- Wang J, Xie P, Kettrup A, Schramm KW. Inhibition of progesterone receptor activity in recombinant yeast by soot from fossil fuel combustion emissions and air particulate materials. Sci Total Environ. 2005; doi:10.1016/j.scitotenv.2005.01.019.
- Okamura K, Kizu R, Toriba A, Murahashi T, Mizokami A, Burnstein KL, Klinge CM, Hayakawa K. Antiandrogenic activity of extracts of diesel exhaust particles emitted from diesel-engine truck under different engine loads and speeds. Toxicology. 2004;195(2-3):243–54.
- Kizu R, Okamura K, Toriba A, Mizokami A, Burnstein KL, Klinge CM, Hayakawa K. Antiandrogenic activities of diesel exhaust particle extracts in PC3/AR human prostate carcinoma cells. Toxicological sciences : an official journal of the Society of Toxicology. 2003; doi:10.1093/toxsci/kfg230.
- Arbak P, Yavuz O, Bukan N, Balbay O, Ulger F, Annakkaya AN. Serum oxidant and antioxidant levels in diesel exposed toll collectors. J Occup Health. 2004:281–8.
- Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, Singh M, Eiguren-Fernandez A, Froines JR. Redox activity of airborne particulate matter at different sites in the Los Angeles Basin. Environmental Res. 2005; doi:10.1016/j.envres.2005.01.003.
- Sklorz M, Briede JJ, Schnelle-Kreis J, Liu Y, Cyrys J, de Kok TM, Zimmermann R. Concentration of oxygenated polycyclic aromatic hydrocarbons and oxygen free radical formation from urban particulate matter. J Toxicol Environ Health A. 2007; doi:10.1080/15287390701457654.
- Slimen IB, Najar T, Ghram A, Dabbebi H, Ben Mrad M, Abdrabbah M. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage. A review Int J Hyperthermia. 2014; doi:10.3109/02656736.2014.971446.
- Poljsak B, Fink R. The protective role of antioxidants in the defence against ROS/RNS-mediated environmental pollution. Oxidative Med Cell Longev. 2014; doi:10.1155/2014/671539.
- Gaspari L, Chang SS, Santella RM, Garte S, Pedotti P, Taioli E. Polycyclic aromatic hydrocarbon-DNA adducts in human sperm as a marker of DNA damage and infertility. Mutat Res. 2003:155–60.
- Yauk C, Polyzos A, Rowan-Carroll A, Somers CM, Godschalk RW, Van Schooten FJ, Berndt ML, Pogribny IP, Koturbash I, Williams A, et al. Germ-line mutations, DNA damage, and global hypermethylation in mice exposed to particulate air pollution in an urban/industrial location. Proc Natl Acad Sci U S A. 2008; doi:10.1073/pnas.0705896105.
- Gao H, Ma MQ, Zhou L, Jia RP, Chen XG, Hu ZD. Interaction of DNA with aromatic hydrocarbons fraction in atmospheric particulates of Xigu District of Lanzhou, China. J Environ Sci (China). 2007;19:948–54.
- Moher D, Shamseer L, Clarke M, Ghersi D, Liberati A, Petticrew M, Shekelle P, Stewart LA, Group P-P. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P) 2015 statement. Syst Rev. 2015; doi:10.1186/2046-4053-4-1.
- Foster WG, Neal MS, Han MS, Dominguez MM. Environmental contaminants and human infertility: hypothesis or cause for concern? Journal of toxicology and environmental health part B. Critical reviews. 2008; doi:10.1080/10937400701873274.
- Frutos V, Gonzalez-Comadran M, Sola I, Jacquemin B, Carreras R, Checa Vizcaino MA. Impact of air pollution on fertility: a systematic review. Gynecol Endocrinol. 2015; doi:10.3109/09513590.2014.958992.
- Mohallem SV, de Araujo Lobo DJ, Pesquero CR, Assuncao JV, de Andre PA, Saldiva PH, Dolhnikoff M. Decreased fertility in mice exposed to environmental air pollution in the city of Sao Paulo. Environl Res. 2005; doi:10.1016/j.envres.2004.08.007.
- Veras MM, Damaceno-Rodrigues NR, Guimaraes Silva RM, Scoriza JN, Saldiva PH, Caldini EG, Dolhnikoff M. Chronic exposure to fine particulate matter emitted by traffic affects reproductive and fetal outcomes in mice. Environ Res. 2009; doi:10.1016/j.envres.2009.03.006.
- Dejmek J, Jelinek R, Solansky I, Benes I, Sram RJ. Fecundability and parental exposure to ambient sulfur dioxide. Environ Health Perspect. 2000;108:647–54.
- Slama R, Bottagisi S, Solansky I, Lepeule J, Giorgis-Allemand L, Sram R. Short-term impact of atmospheric pollution on fecundability. Epidemiology (Cambridge, Mass). 2013; doi:10.1097/EDE.0b013e3182a702c5.
- Nieuwenhuijsen MJ, Basagana X, Dadvand P, Martinez D, Cirach M, Beelen R, Jacquemin B. Air pollution and human fertility rates. Environ Int. 2014; doi:10.1016/j.envint.2014.05.005.
- Mahalingaiah S, Hart JE, Laden F, Farland LV, Hewlett MM, Chavarro J, Aschengrau A, Missmer SA. Adult air pollution exposure and risk of infertility in the Nurses’ health study II. Human Reprod (Oxford, England). 2016; doi:10.1093/humrep/dev330.
- Younglai EV, Holloway AC, Foster WG. Environmental and occupational factors affecting fertility and IVF success. Human Reprod Update. 2005; doi:10.1093/humupd/dmh055.
- Legro RS, Sauer MV, Mottla GL, Richter KS, Li X, Dodson WC, Liao D. Effect of air quality on assisted human reproduction. Human Reprod (Oxford, England). 2010; doi:10.1093/humrep/deq021.
- Perin PM, Maluf M, Czeresnia CE, Januario DA, Saldiva PH. Impact of short-term preconceptional exposure to particulate air pollution on treatment outcome in couples undergoing in vitro fertilization and embryo transfer (IVF/ET). J Assist Reprod Genet. 2010; doi:10.1007/s10815-010-9419-2.
- Perin PM, Maluf M, Czeresnia CE, Nicolosi Foltran Januario DA, Nascimento Saldiva PH. Effects of exposure to high levels of particulate air pollution during the follicular phase of the conception cycle on pregnancy outcome in couples undergoing in vitro fertilization and embryo transfer. Fertil Steril. 2010; doi:10.1016/j.fertnstert.2009.06.031.
- Maluf M, Perin PM, Foltran Januario DA, Nascimento Saldiva PH. In vitro fertilization, embryo development, and cell lineage segregation after pre- and/or postnatal exposure of female mice to ambient fine particulate matter. Fertil Steril. 2009; doi:10.1016/j.fertnstert.2008.08.081.
- Lane M, Gardner DK. Ammonium induces aberrant blastocyst differentiation, metabolism, pH regulation, gene expression and subsequently alters fetal development in the mouse. Biol Reprod. 2003; doi:10.1095/biolreprod.103.018093.
- Burkus J, Kacmarova M, Kubandova J, Kokosova N, Fabianova K, Fabian D, Koppel J, Cikos S. Stress exposure during the preimplantation period affects blastocyst lineages and offspring development. J Reprod Develop. 2015; doi:10.1262/jrd.2015-012.
- Minasi MG, Colasante A, Riccio T, Ruberti A, Casciani V, Scarselli F, Spinella F, Fiorentino F, Varricchio MT, Greco E. Correlation between aneuploidy, standard morphology evaluation and morphokinetic development in 1730 biopsied blastocysts: a consecutive case series study. Human Reprod (Oxford, England). 2016; doi:10.1093/humrep/dew183.
- Irani M, Reichman D, Robles A, Melnick A, Davis O, Zaninovic N, Xu K, Rosenwaks Z. Morphologic grading of euploid blastocysts influences implantation and ongoing pregnancy rates. Fertil Steril. 2017; doi:10.1016/j.fertnstert.2016.11.012.
- Januario DA, Perin PM, Maluf M, Lichtenfels AJ, Nascimento Saldiva PH. Biological effects and dose-response assessment of diesel exhaust particles on in vitro early embryo development in mice. Toxicol Sci. 2010; doi:10.1093/toxsci/kfq165.
- Yoshida S, Sagai M, Oshio S, Umeda T, Ihara T, Sugamata M, Sugawara I, Takeda K. Exposure to diesel exhaust affects the male reproductive system of mice. Int J Androl. 1999;22:307–15.
- Watanabe N. Decreased number of sperms and Sertoli cells in mature rats exposed to diesel exhaust as fetuses. Toxicol Lett. 2005; doi:10.1016/j.toxlet.2004.08.010.
- Ieradi LA, Cristaldi M, Mascanzoni D, Cardarelli E, Grossi R, Campanella L. Genetic damage in urban mice exposed to traffic pollution. Environ Pollut. 1996:323–8.
- Jeng HA, Yu L. Alteration of sperm quality and hormone levels by polycyclic aromatic hydrocarbons on airborne particulate particles. J Environ Sci Health Part A, Toxic/hazardous Subst Environ Engin. 2008; doi:10.1080/10934520801959815.
- Watanabe N, Oonuki Y. Inhalation of diesel engine exhaust affects spermatogenesis in growing male rats. Environ Health Perspect. 1999;107:539–44.
- Somers CM, Yauk CL, White PA, Parfett CL, Quinn JS. Air pollution induces heritable DNA mutations. Proc National Academy Sci United States Am. 2002; doi:10.1073/pnas.252499499.
- Somers CM, McCarry BE, Malek F, Quinn JS. Reduction of particulate air pollution lowers the risk of heritable mutations in mice. Science. 2004; doi:10.1126/science.1095815.
- Inyang F, Ramesh A, Kopsombut P, Niaz MS, Hood DB, Nyanda AM, Archibong AE. Disruption of testicular steroidogenesis and epididymal function by inhaled benzo (a) pyrene. Reprod Toxicol (Elmsford, NY). 2003;17:527–37.
- Tsukue N, Toda N, Tsubone H, Sagai M, Jin WZ, Watanabe G, Taya K, Birumachi J, Suzuki AK. Diesel exhaust (DE) affects the regulation of testicular function in male Fischer 344 rats. J Toxicol Environ Health A. 2001; doi:10.1080/15287390151126441.
- Rolland M, Le Moal J, Wagner V, Royere D, De Mouzon J. Decline in semen concentration and morphology in a sample of 26,609 men close to general population between 1989 and 2005 in France. Human Reprod (Oxford, England). 2013; doi:10.1093/humrep/des415.
- Auger J, Kunstmann JM, Czyglik F, Jouannet P. Decline in semen quality among fertile men in Paris during the past 20 years. N Engl J Med. 1995; doi:10.1056/NEJM199502023320501.
- De Rosa M, Zarrilli S, Paesano L, Carbone U, Boggia B, Petretta M, Maisto A, Cimmino F, Puca G, Colao A, et al. Traffic pollutants affect fertility in men. Human Reprod (Oxford, England). 2003;18:1055–61.
- Jurewicz J, Hanke W, Radwan M, Bonde JP. Environmental factors and semen quality. Int J Occup Med Environ Health. 2009; doi:10.2478/v10001-009-0036-1.
- Deng Z, Chen F, Zhang M, Lan L, Qiao Z, Cui Y, An J, Wang N, Fan Z, Zhao X, et al. Association between air pollution and sperm quality: a systematic review and meta-analysis. Environ Pollut. 2016; doi:10.1016/j.envpol.2015.10.044.
- Guven A, Kayikci A, Cam K, Arbak P, Balbay O, Cam M. Alterations in semen parameters of toll collectors working at motorways: does diesel exposure induce detrimental effects on semen? Andrologia. 2008; doi:10.1111/j.1439-0272.2008.00867.x.
- Hammoud A, Carrell DT, Gibson M, Sanderson M, Parker-Jones K, Peterson CM. Decreased sperm motility is associated with air pollution in salt Lake City. Fertil Steril. 2010; doi:10.1016/j.fertnstert.2008.12.089.
- Selevan SG, Borkovec L, Slott VL, Zudova Z, Rubes J, Evenson DP, Perreault SD. Semen quality and reproductive health of young Czech men exposed to seasonal air pollution. Environ Health Perspect. 2000;108:887–94.
- Somers CM. Ambient air pollution exposure and damage to male gametes: human studies and in situ ‘sentinel’ animal experiments. Syst Biol Reprod Med. 2011; doi:10.3109/19396368.2010.500440.
- Sram R. Impact of air pollution on reproductive health. Environ Health Perspect. 1999;107:A542–3.
- Wijesekara GU, Fernando DM, Wijerathna S, Bandara N. Environmental and occupational exposures as a cause of male infertility. Ceylon Med J. 2015; doi:10.4038/cmj.v60i2.7090.
- Figa-Talamanca I, Cini C, Varricchio GC, Dondero F, Gandini L, Lenzi A, Lombardo F, Angelucci L, Di Grezia R, Patacchioli FR. Effects of prolonged autovehicle driving on male reproduction function: a study among taxi drivers. Am J Ind Med. 1996; doi:10.1002/(SICI)1097-0274(199612)30:6<750::AID-AJIM12>3.0.CO;2-1.
- Hansen C, Luben TJ, Sacks JD, Olshan A, Jeffay S, Strader L, Perreault SD. The effect of ambient air pollution on sperm quality. Environ Health Perspect. 2010; doi:10.1289/ehp.0901022.
- Hsu PC, Chen IY, Pan CH, Wu KY, Pan MH, Chen JR, Chen CJ, Chang-Chien GP, Hsu CH, Liu CS, et al. Sperm DNA damage correlates with polycyclic aromatic hydrocarbons biomarker in coke-oven workers. Int Arch Occup Environ Health. 2006; doi:10.1007/s00420-005-0066-3.
- Radwan M, Jurewicz J, Polanska K, Sobala W, Radwan P, Bochenek M, Hanke W. Exposure to ambient air pollution-does it affect semen quality and the level of reproductive hormones? Ann Hum Biol. 2016; doi:10.3109/03014460.2015.1013986.
- Sokol RZ, Kraft P, Fowler IM, Mamet R, Kim E, Berhane KT. Exposure to environmental ozone alters semen quality. Environ Health Perspect. 2006;114:360–5.
- Rubes J, Selevan SG, Evenson DP, Zudova D, Vozdova M, Zudova Z, Robbins WA, Perreault SD. Episodic air pollution is associated with increased DNA fragmentation in human sperm without other changes in semen quality. Human Reprod (Oxford, England). 2005; doi:10.1093/humrep/dei122.
- Evenson DP, Wixon R. Environmental toxicants cause sperm DNA fragmentation as detected by the sperm chromatin structure assay (SCSA). Toxicol Appl Pharmacol. 2005; doi:10.1016/j.taap.2005.03.021.
- Jurewicz J, Radwan M, Sobala W, Polanska K, Radwan P, Jakubowski L, Ulanska A, Hanke W. The relationship between exposure to air pollution and sperm disomy. Environ Mol Mutagen. 2015; doi:10.1002/em.21883.
- Ogliari KS, Lichtenfels AJ, de Marchi MR, Ferreira AT, Dolhnikoff M, Saldiva PH. Intrauterine exposure to diesel exhaust diminishes adult ovarian reserve. Fertil Steril. 2013; doi:10.1016/j.fertnstert.2013.01.103.
- Thurston SW, Ryan L, Christiani DC, Snow R, Carlson J, You L, Cui S, Ma G, Wang L, Huang Y, et al. Petrochemical exposure and menstrual disturbances. Am J Indust Med. 2000;38:555–64.
- Cho SI, Damokosh AI, Ryan LM, Chen D, Hu YA, Smith TJ, Christiani DC, Xu X. Effects of exposure to organic solvents on menstrual cycle length. J Occup Environ Med. 2001;43:567–75.
- Tomei G, Ciarrocca M, Fortunato BR, Capozzella A, Rosati MV, Cerratti D, Tomao E, Anzelmo V, Monti C, Tomei F. Exposure to traffic pollutants and effects on 17-beta-estradiol (E2) in female workers. Int Arch Occup Environ Health. 2006; doi:10.1007/s00420-006-0105-8.
- De Coster S, van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action. J Environ Public Health. 2012; doi:10.1155/2012/713696.
- Kampa M, Castanas E. Human health effects of air pollution. Environ Pollut. 2008; doi:10.1016/j.envpol.2007.06.012.
- Han Y, Xia Y, Zhu P, Qiao S, Zhao R, Jin N, Wang S, Song L, Fu G, Wang X. Reproductive hormones in relation to polycyclic aromatic hydrocarbon (PAH) metabolites among non-occupational exposure of males. Sci Total Environ. 2010; doi:10.1016/j.scitotenv.2009.11.021.
- Taneda S, Hayashi H, Sakata M, Yoshino S, Suzuki A, Sagai M, Mori Y. Anti-estrogenic activity of diesel exhaust particles. Biol Pharm Bull. 2000;23:1477–80.
- Oh SM, Ryu BT, Chung KH. Identification of estrogenic and antiestrogenic activities of respirable diesel exhaust particles by bioassay-directed fractionation. Arch Pharm Res. 2008:75–82.
- Noguchi K, Toriba A, Chung SW, Kizu R, Hayakawa K. Identification of estrogenic/anti-estrogenic compounds in diesel exhaust particulate extract. Biomed Chromatogr. 2007; doi:10.1002/bmc.861.
- Yoshida S, Hirano S, Shikagawa K, Hirata S, Rokuta S, Takano H, Ichinose T, Takeda K. Diesel exhaust particles suppress expression of sex steroid hormone receptors in TM3 mouse Leydig cells. Environ Toxicol Pharmacol. 2007; doi:10.1016/j.etap.2007.07.003.
- Meek MD. Ah receptor and estrogen receptor-dependent modulation of gene expression by extracts of diesel exhaust particles. Environ Res. 1998; doi:10.1006/enrs.1998.3870.
- Misaki K, Suzuki M, Nakamura M, Handa H, Iida M, Kato T, Matsui S, Matsuda T. Aryl hydrocarbon receptor and estrogen receptor ligand activity of organic extracts from road dust and diesel exhaust particulates. Arch Environ Contam Toxicol. 2008; doi:10.1007/s00244-007-9110-5.
- Owens CV Jr, Lambright C, Cardon M, Gray LE Jr, Gullett BK, Wilson VS. Detection of androgenic activity in emissions from diesel fuel and biomass combustion. Environ Toxicol Chem / SETAC. 2006;25:2123–31.
- Barouki R, Aggerbeck M, Aggerbeck L, Coumoul X. The aryl hydrocarbon receptor system. Drug Metabol Drug Interact. 2012; doi:10.1515/dmdi-2011-0035.
- Beischlag TV, Luis Morales J, Hollingshead BD, Perdew GH. The aryl hydrocarbon receptor complex and the control of gene expression. Crit Rev Eukaryot Gene Expr. 2008;18:207–50.
- Mesquita SR, van Drooge BL, Oliveira E, Grimalt JO, Barata C, Vieira N, Guimaraes L, Pina B. Differential embryotoxicity of the organic pollutants in rural and urban air particles. Environ Pollut. 2015; doi:10.1016/j.envpol.2015.08.008.
- Zhang H, Yao Y, Chen Y, Yue C, Chen J, Tong J, Jiang Y, Chen T. Crosstalk between AhR and wnt/beta-catenin signal pathways in the cardiac developmental toxicity of PM2.5 in zebrafish embryos. Toxicology. 2016; doi:10.1016/j.tox.2016.05.014.
- Izawa H, Kohara M, Watanabe G, Taya K, Sagai M. Diesel exhaust particle toxicity on spermatogenesis in the mouse is aryl hydrocarbon receptor dependent. J Reprod develop. 2007;53:1069–78.
- Izawa H, Kohara M, Watanabe G, Taya K, Sagai M. Effects of diesel exhaust particles on the male reproductive system in strains of mice with different aryl hydrocarbon receptor responsiveness. J Reprod Develop. 2007;53:1191–7.
- Hernandez-Ochoa I, Karman BN, Flaws JA. The role of the aryl hydrocarbon receptor in the female reproductive system. Biochem Pharmacol. 2009; doi:10.1016/j.bcp.2008.09.037.
- Shanle EK, Xu W. Endocrine disrupting chemicals targeting estrogen receptor signaling: identification and mechanisms of action. Chem Res Toxicol. 2011; doi:10.1021/tx100231n.
- Agarwal A, Allamaneni SS. Free radicals and male reproduction. J Indian Med Assoc. 2011;109:184–7.
- Agarwal A, Sharma RK, Nallella KP, Thomas AJ Jr, Alvarez JG, Sikka SC. Reactive oxygen species as an independent marker of male factor infertility. Fertil Steril. 2006; doi:10.1016/j.fertnstert.2006.02.111.
- Agarwal A, Virk G, Ong C, du Plessis SS. Effect of oxidative stress on male reproduction. World J Mens Health. 2014; doi:10.5534/wjmh.2014.32.1.1.
- Muratori M, Tamburrino L, Marchiani S, Cambi M, Olivito B, Azzari C, Forti G, Baldi E. Investigation on the origin of sperm DNA fragmentation: role of apoptosis, immaturity and oxidative stress. Mol Med. 2015; doi:10.2119/molmed.2014.00158.
- Tvrda E, Knazicka Z, Bardos L, Massanyi P, Lukac N. Impact of oxidative stress on male fertility – a review. Acta Vet Hung. 2011; doi:10.1556/AVet.2011.034.
- Walczak-Jedrzejowska R, Wolski JK, Slowikowska-Hilczer J. The role of oxidative stress and antioxidants in male fertility. Cent European J Urol. 2013; doi:10.5173/ceju.2013.01.art19.
- Agarwal A, Aponte-Mellado A, Premkumar BJ, Shaman A, Gupta S. The effects of oxidative stress on female reproduction: a review. Reprod Biol Endocrinol : RB&E. 2012; doi:10.1186/1477-7827-10-49.
- Ruder EH, Hartman TJ, Blumberg J, Goldman MB. Oxidative stress and antioxidants: exposure and impact on female fertility. Human Reprod Update. 2008; doi:10.1093/humupd/dmn011.
- Lim J, Nakamura BN, Mohar I, Kavanagh TJ, Luderer U. Glutamate Cysteine Ligase modifier subunit (Gclm) null mice have increased ovarian oxidative stress and accelerated age-related ovarian failure. Endocrinol. 2015; doi:10.1210/en.2015-1206.
- Barth A, Brucker N, Moro AM, Nascimento S, Goethel G, Souto C, Fracasso R, Sauer E, Altknecht L, da Costa B, et al. Association between inflammation processes, DNA damage, and exposure to environmental pollutants. Environ Sci Pollut Res Int. 2016; doi:10.1007/s11356-016-7772-0.
- Walton RT, Mudway IS, Dundas I, Marlin N, Koh LC, Aitlhadj L, Vulliamy T, Jamaludin JB, Wood HE, Barratt BM, et al. Air pollution, ethnicity and telomere length in east London schoolchildren: an observational study. Environ Int. 2016; doi:10.1016/j.envint.2016.08.021.
- Cao Y. Environmental pollution and DNA methylation: carcinogenesis, clinical significance, and practical applications. Front Med. 2015; doi:10.1007/s11684-015-0406-y.
- Lepeule J, Bind MA, Baccarelli AA, Koutrakis P, Tarantini L, Litonjua A, Sparrow D, Vokonas P, Schwartz JD. Epigenetic influences on associations between air pollutants and lung function in elderly men: the normative aging study. Environ Health Perspect. 2014; doi:10.1289/ehp.1206458.
- Holloway JW, Savarimuthu Francis S, Fong KM, Yang IA. Genomics and the respiratory effects of air pollution exposure. Respirol. 2012; doi:10.1111/j.1440-1843.2012.02164.x.
- Ding R, Jin Y, Liu X, Zhu Z, Zhang Y, Wang T, Xu Y. Characteristics of DNA methylation changes induced by traffic-related air pollution. Mutat Res Genet Toxicol Environ Mutagen. 2016; doi:10.1016/j.mrgentox.2015.12.002.
- Byun HM, Barrow TM. Analysis of pollutant-induced changes in mitochondrial DNA methylation. Methods Mol Biol (Clifton, NJ). 2015; doi:10.1007/978-1-4939-2288-8_19.
- Byun HM, Colicino E, Trevisi L, Fan T, Christiani DC, Baccarelli AA. Effects of air pollution and blood mitochondrial DNA Methylation on markers of heart rate variability. J Am Heart Assoc. 2016; doi:10.1161/JAHA.116.003218.
- Vecoli C, Montano L, Andreassi MG. Environmental pollutants: genetic damage and epigenetic changes in male germ cells. Environ Sci Pollut Res Int. 2016; doi:10.1007/s11356-016-7728-4.
- Stouder C, Somm E, Paoloni-Giacobino A. Prenatal exposure to ethanol: a specific effect on the H19 gene in sperm. Reprod Toxicol. 2011; doi:10.1016/j.reprotox.2011.02.009.
- Park CJ, Nah WH, Lee JE, Oh YS, Gye MC. Butyl paraben-induced changes in DNA methylation in rat epididymal spermatozoa. Andrologia. 2012; doi:10.1111/j.1439-0272.2011.01162.x.
- Tsamou M, Vrijens K, Madhloum N, Lefebvre W, Vanpoucke C, Nawrot TS. Air pollution-induced placental epigenetic alterations in early life: a candidate miRNA approach. Epigenetics. 2016; doi:10.1080/15592294.2016.1155012.
Fonte
Carré J, Gatimel N, Moreau J, Parinaud J, Léandri R, et al. (2017) Does air pollution play a role in infertility?: a systematic review. Environmental Health 1682. https://doi.org/10.1186/s12940-017-0291-8





