Abstract
Introduzione
Il comportamento del sonno è quasi onnipresente in tutto il regno animale ed è vitale per molti aspetti della funzione biologica(Campbell e Tobler, 1984; Hartmann, 1973; Musiek et al., 2015). Mentre gli animali mostrano una notevole diversità nella durata del sonno e nell’architettura, poco si sa sui principi funzionali ed evolutivi alla base di queste differenze (Alladae Siegel, 2008; Capellini et al., 2008; Siegel, 2005). In precedenza abbiamo scoperto l’evoluzione convergente della perdita di sonno nel pesce cavernicolo cieco messicano, Astyanax mexicanus(Duboué et al., 2011). Rispetto ai conspecifici esistenti che abitano le grotte, le popolazioni di cavernicoli di origine indipendente mostrano una sorprendente riduzione dell’80% del sonno totale senza impatti negativi sulla salute o sullo sviluppo(Duboué et al., 2011). Le robuste differenze nel sonno tra le popolazioni di superficie e quelle delle caverne forniscono un modello unico per indagare le basi genetiche della variazione del sonno e per identificare nuovi meccanismi alla base dell’evoluzione della regolazione del sonno.
Astyanax mexicanus è costituito da popolazioni di superficie occhiate che abitano i fiumi della regione della Sierra del Abra nel nord-est del Messico, e almeno 29 popolazioni distinte di pesci cavernicoli in questa regione(Mitchell et al., 1977). I pesci cavernicoli derivano da antenati di superficie, nati da eventi di colonizzazione che si stima abbiano avuto luogo negli ultimi 2-5 milioni di anni (Gross, 2012; Jeffery , 2009; Keene et al., 2015). Le popolazioni di caverne di A. mexicanus, evolute in modo indipendente, condividono fenotipi morfologici e di sviluppo, tra cui occhi più piccoli o completamente assenti, e perdita di pigmentazione(Borowsky, 2008a; Gross e Wilkens, 2013; Protas et al., 2006). Inoltre, i pesci cavernicoli mostrano una serie di cambiamenti comportamentali, tra cui la riduzione della scolarizzazione, il miglioramento del comportamento di attrazione da vibrazioni, l’iperfagia e la perdita di sonno(Aspiras et al., 2015; Duboué et al., 2011; Kowalko et al., 2013; Yoshizawa et al., 2010). L’evoluzione convergente dei tratti comuni nelle popolazioni di pesci cavernicoli indipendenti, combinata con robuste differenze fenotipiche con le popolazioni di pesci di superficie esistenti, fornisce un sistema per esaminare come le variazioni naturali e l’evoluzione danno forma a tratti biologici complessi.
Mentre i fattori ecologici alla base dei cambiamenti fenotipici nelle popolazioni di pesci cavernicoli non sono chiari, si ipotizza che la disponibilità di cibo e la strategia di foraggiamento siano potenti motori del cambiamento evolutivo che contribuiscono alla variazione della durata del sonno tra le specie animali(Siegel, 2005). Molte acque delle grotte abitate da A. mexicanus sono povere di nutrienti rispetto ai fiumi fuori terra che le circondano(Mitchell et al., 1977), e precedenti studi sul campo suggeriscono che i pesci delle caverne vivono principalmente di guano di pipistrello, piccoli insetti e materia organica portata nella grotta dalle inondazioni stagionali(Keene et al., 2015; Mitchell et al., 1977). A seguito della fame, i pesci delle caverne hanno un tasso più lento di perdita di peso rispetto ai conspecifici di superficie, suggerendo che un metabolismo ridotto può spiegare, in parte, l’adattamento alla vita in grotta (Aspiraset al., 2015). In precedenza abbiamo scoperto che il sonno è aumentato nei pesci cavernicoli durante i periodi di fame prolungata, aumentando la possibilità che i pesci cavernicoli sopprimano il sonno per foraggiarsi durante la stagione umida, quando il cibo è abbondante, e aumentano il sonno per conservare energia durante la stagione secca, quando il cibo è meno abbondante(Jaggard et al., 2017). Pertanto, la perdita di sonno nei pesci cavernicoli sembra essere una conseguenza evoluta dei cambiamenti nella disponibilità di cibo, fornendo un modello per esaminare le interazioni tra sonno e metabolismo.
Nonostante le robuste differenze fenotipiche nel sonno tra la superficie di A. mexicanus e le popolazioni di caverne, si sa poco sui meccanismi neurali alla base dell’evoluzione della perdita di sonno nei pesci cavernicoli. Molti comportamenti che sono alterati nei pesci cavernicoli sono regolati dall’ipotalamo, che è ingrandito nei pesci cavernicoli(Menuet et al., 2007). Qui, indaghiamo il ruolo dell’Ipocretina/Orexina (HCRT), un neuropeptide ipotalamico altamente conservato noto per consolidare la veglia. Le carenze nella segnalazione dell’HCRT sono associate al sonno alterato e ai fenotipi narcolettici associati a diversi organismi vertebrati(Appelbaum et al., 2009; Chemelli et al., 1999; Faraco et al., 2006; Lin et al., 1999; Prober et al., 2006; Yokogawa et al., 2007). Nel pesce zebra, l’HCRT è fondamentale per la normale regolazione del sonno-veglia. L’espressione ectopica di hcrt aumenta l’attività locomotoria, mentre l’ablazione dei neuroni HCRT aumenta il sonno diurno(Elbaz et al., 2012; Prober et al., 2006; Singh et al., 2015). Ora mostriamo che l’espressione dell’HCRT è ridotta nei pesci cavernicoli in risposta alle manipolazioni che favoriscono il sonno, tra cui la fame e l’ablazione della linea laterale(Jaggard et al., 2017). Inoltre, l’interruzione farmacologica o genetica della segnalazione HCRT ripristina selettivamente il sonno ai pesci cavernicoli ma non ai pesci di superficie. Insieme, questi risultati suggeriscono che la plasticità della funzione HCRT contribuisce a differenze evolute nella regolazione del sonno nei pesci cavernicoli messicani.
Risultati
Il sonno è drasticamente ridotto nei pesci cavernicoli adulti di Pachón rispetto ai pesci di superficie (Figura1A,B) (Jaggardet al., 2017; Yoshizawa et al., 2015). Abbiamo confrontato l’omologia delle sequenze tra pesci di superficie e pesci cavernicoli mediante un’analisi bioinformatica delle sequenze del genoma del pesce cavernicolo(McGaugh et al., 2014) e le sequenze trascrittomiche a lunghezza intera disponibili(Gross et al., 2013). L’allineamento del neuropeptide HCRT rivela che A. mexicanus condivide un’elevata somiglianza di sequenza con altre specie di pesci (35-48% di identità) e mammiferi (35% di identità), compresa la conservazione dei domini che danno origine ai neuropeptidi HCRT (Figura 1-figure supplement 1A). Le sequenze peptidiche HCRT dei pesci cavernicoli di superficie e di Pachón sono identiche (100% di identità). Per determinare se l’espressione hcrt è alterata nei pesci cavernicoli adulti, abbiamo misurato i livelli di trascrizione negli estratti del cervello intero con PCR quantitativa in tempo reale (qPCR). L’espressione del gene domestico, GAPDH, era comparabile tra le due forme(Figura 1-figure supplement 1B). Al contrario, l’espressione hcrt è stata significativamente elevata nei pesci cavernicoli di Pachón a più di tre volte i livelli di pesci di superficie, aumentando la possibilità che l’upregulation del hcrt sia alla base dell’evoluzione della perdita di sonno (Figura1C). I livelli di neuropeptidi sono stati quantificati con l’immunomarcatura dei cervelli a sezione seriale, ed esaminando il numero di corpi cellulari HCRT-positivi e la fluorescenza relativa di ogni cellula in condizioni di alimentazione(Figura 1-figure supplement 2A-D). Il numero di corpi cellulari HCRT-positivi era significativamente più alto nei pesci cavernicoli di Pachón rispetto ai pesci di superficie (Figura1D). Inoltre, la quantificazione dell’intensità di fluorescenza delle singole cellule ha rivelato un aumento del neuropeptide HCRT nei pesci cavernicoli(Figura 1E-I). Aumentati livelli di proteina HCRT sono stati osservati anche in cinque giorni dopo la fecondazione (dpf) larve, suggerendo la variazione dei livelli di peptidi erano presenti nel momento in cui i pesci iniziano a consumare cibo(Figura 1-figure supplement 3).
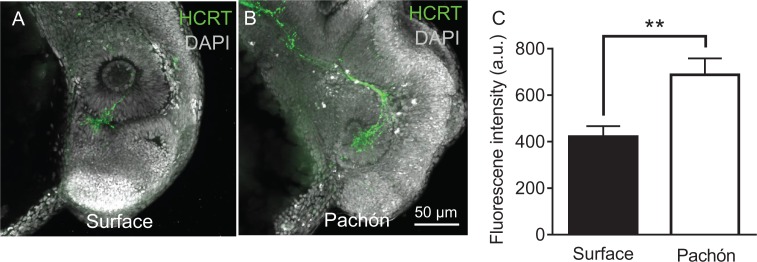
Figura 1-figure supplemento 3.Figura 1—supplemento figura 3. La trascrizione dell’ipocretina e i livelli di peptide sono elevati nel pesce cavernicolo di Pachón.la sequenza HCRT è identica tra il pesce di superficie e il pesce cavernicolo di Pachón.la sequenza HCRT è identica tra il pesce cavernicolo di superficie e il pesce cavernicolo di Pachón.Quantificazione dei geni qPCR e dell’intensità di fluorescenza tra pesci di superficie e pesci cavernicoli.la quantificazione dei geni qPCR e dell’intensità di fluorescenza tra pesci di superficie e pesci cavernicoli.i livelli di peptide HCRT sono aumentati nei pesci cavernicoli di Pachón.i livelli di ipocretina sono aumentati nei primi sviluppi nei pesci cavernicoli di Pachón.(A) Immagini rappresentative di pesci di superficie e pesci cavernicoli Pachón (B) La durata del sonno è significativamente ridotta nei pesci cavernicoli Pachón rispetto alla morfologia di superficie (Unpaired t-test, t = 5,56, n = 26, p<0,0001).(C) L’espressione di hcrt normalizzata da GAPDH negli estratti del cervello intero adulto è significativamente migliorata nei pesci cavernicoli di Pachón rispetto ai pesci di superficie (Unpaired t-test, t = 11,15, n = 8, p<0,0001).(D) Il segnale del neuropeptide HCRT è significativamente aumentato nei pesci cavernicoli di Pachón rispetto ai pesci di superficie (Unpaired t-test, t = 5,94, n = 8, p<0,001). E. Il numero di cellule HCRT-positive nell’ipotalamo è significativamente aumentato nei pesci cavernicoli rispetto ai pesci di superficie (Unpaired t-test, t = 9,984, n = 8, p<0,0001).(F-I) Immagini rappresentative 2 μm confocali da fette coronali di pesce di superficie o cervello di Pachón immunizzato con anti-HCRT (verde) e DAPI (bianco) (F) Fetta coronale del cervello intero di superficie.(G) Pachón fetta coronale del cervello intero.(H) Ipotalamo dorsale di superficie del pesce di superficie contenente cellule positive HCRT(I) Pachón ipotalamo dorsale del pesce cavernicolo contenente neuroni HCRT in vista. La barra di scala indica 500 μm (F,G); 50 μm (H,I).10.7554/eLife.32637.006Figure 1-source data 1.Hypocretin trascrizione e livelli di peptidi sono elevati in Pachón cavefish.Questo file di origine comprende l’analisi per il confronto tra superficie e Pachón cavefish per la durata del sonno (Figura 1B), l’espressione hcrt ( Figura 1C), ilnumero di cellule espressione HCRT (Figura 1D), el’intensità del segnale HCRT (Figura 1E).Questo file sorgente include l’analisi per il confronto tra il pesce cavernicolo di superficie e il pesce cavernicolo di Pachón per la durata del sonno (Figura1B), l’espressione hcrt(Figura1C), il numero di cellule espressione HCRT (Figura1D), e l’intensità del segnale HCRT (Figura1E).Questo file sorgente include l’analisi per il confronto tra il pesce cavernicolo di superficie e il pesce cavernicolo di Pachón per la durata del sonno (Figura1B), l’espressione hcrt(Figura1C), il numero di cellule espressione HCRT (Figura1D), e l’intensità del segnale HCRT (Figura1E).(A) L’allineamento della sequenza per HCRT in A. mexicanus rivela un’omologia del 35-48% di identità rispetto ad altre specie di pesci tra cui zebrafish e medaka, e un 35% di identità conservata rispetto ai mammiferi HCRT.(B) Il gene di Housekeeping usato per tutti gli esperimenti q-PCR non è significativamente alterato tra Surface e Cavefish (Unpaired t-test, p=0.972). L’espressione è stata normalizzata per i pesci di superficie.10.7554/eLife.32637.007Figure 1-figure supplement 1-source data 1.Quantification of qPCR housekeeping genes and fluorescent intensity between surface and cavefish.this source file includes quantification of qPCR differences for the housekeeping gene Gadph ( Figure 1-figuresupplement 1B) and comparison of fluorescence intensity between surface and Pachón fry (Figure 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).(A) Pesce di superficie intero cervello da sagittale 2 μm fetta confocale (B) Pachón pesce cavernicolo intero cervello sagittale 2 μm fetta confocale.(C) Pesce di superficie ipotamo sagittale 2 μm fetta confocale.(D) Pachón pesce cavernicolo ipotalmo 2 μm fetta confocale.(A) Cinque giorni dopo la fecondazione tutto il pesce di superficie di superficie immunizzato con anti-HCRT (verde) e DAPI (bianco).(B) Intero monte quattro dpf Pachón Pachón pesci cavernicoli immunocolori con anti-HCRT (verde) e DAPI (bianco).(C) HCRT livelli di neuropeptidi HCRT sono significativamente aumentati in cinque dpf Pachón larve rispetto alla superficie (Unpaired t-test, t = 3,17, df = 10, p<0,01).
Mentre i mammiferi possiedono due recettori HCRT (HCRTR1 e HCRTR2), i pesci zebra possiedono solo HCRTR2(Prober et al., 2006; Yokogawa et al., 2007). È importante notare che HCRTR2 si propone di essere evolutivamente più antico rispetto a HCRTR1(Wong et al., 2011). Abbiamo eseguito l’analisi del genoma per esplorare quanti geni paralogici HCRTR risiedevano nel genoma di A. mexicanus, e abbiamo scoperto che i genomi dei pesci cavernicoli e dei pesci di superficie codificano solo HCRTR2(McGaugh et al., 2014).
Per valutare più direttamente i contributi della regolazione HCRT nella perdita di sonno, abbiamo misurato l’effetto del blocco del recettore HCRT sul sonno nei pesci adulti di superficie e nei pesci cavernicoli di Pachón. I pesci di entrambe le popolazioni sono stati immersi nell’inibitore farmacologico selettivo HCRTR2, TCSOX229(Kummangal et al., 2013; Plaza-Zabala et al., 2012). Il sonno nei pesci di superficie è rimasto invariato in presenza di 1 μM o 10 μM TCSOX229 (Figura 2A,C). Al contrario, il trattamento di TCSOX229 in pesci cavernicoli Pachón ha aumentato la durata del sonno rispetto ai controlli trattati con solventi (DMSO) (Figura2B,C). Mentre questi risultati non escludono la possibilità che l’HCRT regoli il sonno nei pesci di superficie, l’effetto di promozione del sonno del TCSOX229 nei pesci cavernicoli di Pachón suggerisce che questi pesci sono più sensibili ai cambiamenti nella segnalazione HCRT rispetto ai pesci di superficie. Il trattamento con TCSOX229 non ha avuto alcun effetto sulla velocità di veglia nei pesci di superficie o nei pesci cavernicoli, suggerendo che l’aumentata quiescenza osservata nei pesci cavernicoli dopo il trattamento farmacologico non è dovuta al letargo(Figura 2D). Ulteriori analisi hanno rivelato che gli effetti promotori del sonno di TCSOX229 nei pesci cavernicoli possono essere attribuiti sia ad un aumento del numero di attacchi che della durata degli attacchi, suggerendo che il blocco HCRT influisce sull’insorgenza del sonno e sulla manutenzione(Figura 2E,F). Presi nel loro insieme, questi risultati supportano l’idea che la segnalazione di HCRT elevata nei pesci cavernicoli sia alla base, in parte, dell’evoluzione della perdita di sonno.
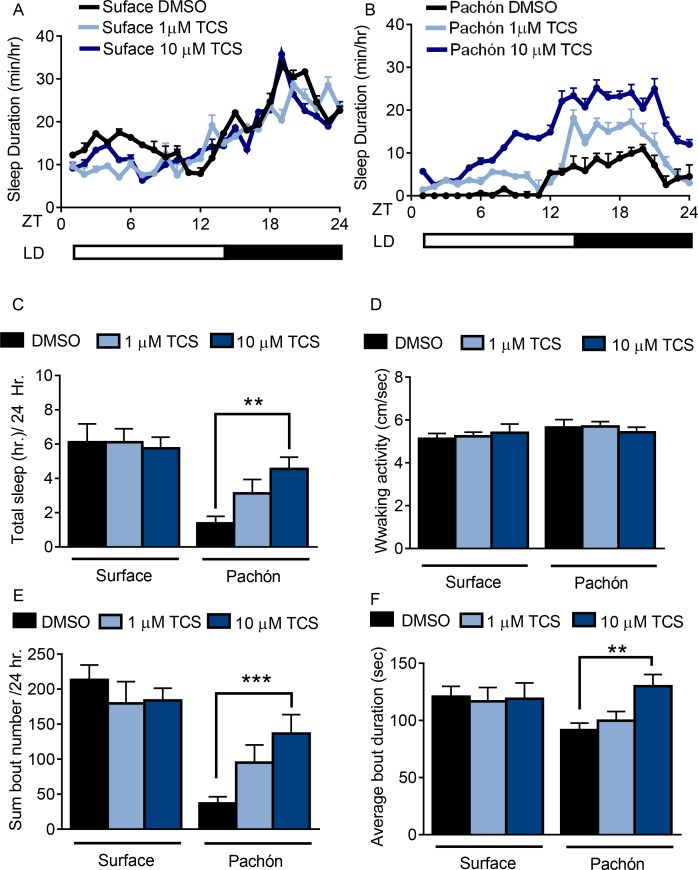
Figura 2 dati fonte 1.Figura 2—dati fonte 1. L’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.l’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.l’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.(A,B) Profilo del sonno di 24 ore nei pesci di superficie(A) Pesci cavernicoli di Pachón (B) trattati con DMSO (nero), 1 μm TCS (azzurro) o 10 μm TCS (blu scuro).(C) Il trattamento TCS non influisce sulla durata totale del sonno nei pesci di superficie (1 μM p>0,999, n = 12, 10 uM P>0,941, n = 12). Pesci cavernicoli di Pachón presi in considerazione con 1 μM TCS tendevano ad aumentare il sonno (p>0,178, n = 12) mentre il trattamento con 10 μM aumentava significativamente il sonno (p<0,01, n = 13; F(1, 73)=25,00,) rispetto al pesce trattato di controllo.(D) L’attività di veglia non è stata significativamente alterata in pesci di superficie o pesci cavernicoli o in risposta al trattamento farmacologico, 2-way ANOVA, (F(1, 73)=2.73, p>0.103, n = 79) (E) Il trattamento con TCS non ha influenzato la durata media del sonno nei pesci di superficie (1 μM TCS, p>0.430, n = 12; 10 μM TCS, p>0.518, n = 12) Il trattamento dei pesci cavernicoli di Pachón con 1 μM TCS tende ad aumentare la durata dell’attacco, p>0,051, n = 12, mentre il trattamento con 10 μM TCS aumenta significativamente la durata dell’attacco nei pesci cavernicoli di Pachón, (p<0,01, n = 13; F(1, 73)=47,42).(F) Il trattamento TCS non ha influito sul numero totale di periodi di sonno nei pesci di superficie 1 μM TCS, p>0,976, n = 12; 10 μM TCS, p>0,998, n = 12). Nel pesce cavernicolo di Pachón, il trattamento con 1 μM TCS non ha influito sul numero di attacchi di sonno (p>0,828, n = 12). Il trattamento con 10 μM TCS aumenta significativamente la durata del combattimento nei pesci cavernicoli di Pachón,(p<0,001, n = 13; 2 vie ANOVA, F(1, 68)=3,309).10.7554/eLife.32637.009Figure 2-figure 2-force data 1.Pharmacological inhibition of HCRT Receptor two promotes sleep in Pachón cavefish.Data analysis comparing the effects of 1 um and 10 um TCS compared to controls in surface fish and cavefish for sleep (Figure 2C), waking activity (Figure 2D), total bout number (Figure 2E),and average bout duration (Figure 2F).Analisi dei dati che confronta gli effetti di 1 um e 10 um di TCS rispetto ai controlli nei pesci di superficie e nei pesci cavernicoli per il sonno (Figura2C), l’attività di veglia (Figura2D), il numero totale di attacchi (Figura2E), e la durata media degli attacchi (Figura2F).Analisi dei dati che confronta gli effetti di 1 um e 10 um di TCS rispetto ai controlli nei pesci di superficie e nei pesci cavernicoli per il sonno (Figura2C), l’attività di veglia (Figura2D), il numero totale di attacchi (Figura2E), e la durata media degli attacchi (Figura2F).
La perdita di sonno nelle popolazioni di pesci cavernicoli A. mexicanus si riscontra in tutti gli stadi di sviluppo, dalle forme larvali e giovanili agli adulti(Duboué et al., 2011; Yoshizawa et al., 2015). Le piccole dimensioni dei giovani avannotti (25 dpf) e la capacità di effettuare analisi di maggiore produttività li rendono un eccellente modello per indagare gli effetti dei farmaci sul sonno. I precedenti screening dei farmaci sono stati effettuati utilizzando larve e giovani pesci zebra e A. mexicanus utilizzando concentrazioni standard tra 1-30 µM per tutti i farmaci (Dubouéet al., 2011; Rihel et al., 2010). Abbiamo quindi selezionato ulteriori modulatori farmacologici di HCRTR2 basati sulla permeabilità alla barriera emato-encefalica e sull’affinità per HCRTR per i test negli avannotti. I pesci di entrambe le popolazioni sono stati immersi negli inibitori farmacologici selettivi di HCRTR2, TCSOX229(Kummangal et al., 2013; Plaza-Zabala et al., 2012), N-etile-2-[(6-metossi-3-piridinil) [(2-metilfenil)sulfonil]ammino] -N-(3-piridinilmetil)-acetammide (EMPA)(Malherbe et al., 2009; Mochizuki et al., 2011), o l’antagonista HCRTR1/2 Suvorexant(Betschart et al., 2013; Hoyer et al., 2013)(Figura 3A). Un dosaggio dose-risposta è stata effettuata in pesci giovani per TCSOX229(Figura 3-figure supplement 2) e ha trovato un effetto significativo in pesci cavernicoli Pachón a concentrazioni che vanno da 1 a 30 µM. Pertanto, tutti e tre gli antagonisti sono stati testati per il loro effetto sul sonno nei pesci di superficie e nei pesci cavernicoli ad una dose di 30 µM. Nessuno dei tre antagonisti ha alterato il sonno nei pesci di superficie, mentre hanno aumentato significativamente il sonno nei pesci cavernicoli(Figura 3B) a questa concentrazione. L’attività di veglia non è stata influenzata dal trattamento antagonista nei pesci di superficie o nei pesci cavernicoli, sostenendo l’idea che gli effetti promotori del sonno sui pesci cavernicoli non sono dovuti all’induzione del letargo(Figura 3C). Inoltre, tutti e tre gli antagonisti HCRT hanno aumentato significativamente il numero e la durata del sonno nei pesci cavernicoli(Figura 3D,E). Mentre questi risultati non escludono la possibilità che l’HCRT regoli il sonno nei pesci di superficie, l’effetto di promozione del sonno degli antagonisti HCRT nei pesci cavernicoli di Pachón suggerisce che questi pesci sono più sensibili ai cambiamenti nella segnalazione HCRT rispetto ai pesci di superficie.
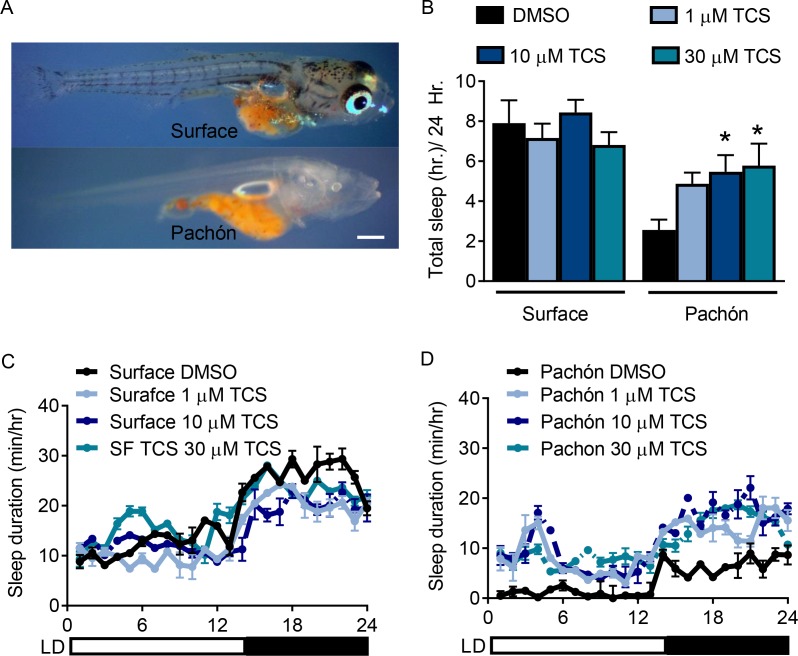
Figura 3-figure supplement 2-source data 2.Il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei pesci cavernicoli giovani.il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei pesci cavernicoli giovani.il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei pesci cavernicoli giovani.l’agonista HCRT altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.L’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.l’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.il blocco HCRTR2 aumenta selettivamente il sonno nei pesci cavernicoli di Pachón.l’agonista HCRT altera parzialmente il comportamento del sonno nei giovani pesci di superficie, ma non nei pesci cavernicoli di Pachón.l’agonista HCRT altera parzialmente il comportamento del sonno nei giovani pesci di superficie, ma non nei pesci cavernicoli di Pachón.(A) Due SORA e un DORA sono stati usati per inibire il legame dell’HCRT al suo recettore.(B) Il sonno totale non è significativamente alterato nei pesci di superficie con il trattamento di antagonisti HCRT (TCS, p = 0,814, n = 18; Suvorexant, p = 0,865, n = 18; EMPA, p = 0,972, n = 19). I pesci cavernicoli di Pachón hanno aumentato significativamente il sonno totale in risposta agli antagonisti HCRT (TCS, p=0,004, n = 18; Suvorexant, p=0,032, n = 19, EMPA, p=0,027, n = 18; ANOVA a 2 vie, F(1, 135)=43,70, p<0,0001).(B) L’attività di veglia non è stata significativamente alterata in nessun pesce o in risposta al trattamento farmacologico, TCS di superficie, p=0,996, n = 18; Suvorexant, p=0.925, n = 18; EMPA, p=0,816, n = 19; Pachón, TCS, p=0,980, n = 18; Suvorexant, p>0,999, n = 19; EMPA, p=0.917, n = 18; ANOVA a 2 vie, (F(1, 135)=7,21, p=0,008) (C) Il numero totale di attacchi di sonno oltre le 24 ore di trattamento farmacologico non ha subito variazioni significative nei pesci di superficie (TCS, p=0.814, n = 18; Suvorexant, p=0,865, n = 18; EMPA, p=0,972, n = 19). Il totale degli attacchi di sonno sono stati significativamente aumentati nei pesci cavernicoli di Pachón con TCS, p=0,002, n = 18; e l’EMPA, p=0,041, n = 18, Suvorexant ha avuto una tendenza verso il significato, p=0,071, n = 19 (ANOVA a 2 vie, F(1, 135)=45,27, p<0,0001).(D) La lunghezza media del periodo di sonno non era significativamente diversa nei pesci di superficie trattati con antagonisti HCRT (TCS, p=0,822, n = 18; Suvorexant, p=0,805, n = 18; EMPA, p=0,236, n = 19). I pesci cavernicoli di Pachón hanno aumentato significativamente la loro lunghezza media di sonno con TCS, p=0,039, N = 18; e con Suvorexant, p=0,009, n = 19. L’EMPA ha avuto una tendenza al significato, p=0,078, n = 18 (ANOVA a 2 vie, F(1, 135)=14,06, p=0,0003).10.7554/eLife.32637.013Figure 3-source data 1.Panel di antagonisti farmacologici HCRT rivela il ruolo di promozione della veglia di HCRT in giovani pesci cavernicoli.Questo file di origine comprende l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS, e EMPA sulla durata totale del sonno (Figura 3B), l’attività di veglia (Figura 3C), il numero totale di attacchi di sonno (Figura3D), e la durata media degli attacchi di sonno (Figura3E).Questo file di origine include l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS ed EMPA sulla durata totale del sonno(Figura 3B), l’attività di veglia (Figura3C), il numero totale di periodi di sonno (Figura3D) e la durata media dei periodi di sonno(Figura 3E).Questo file di origine include l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS ed EMPA sulla durata totale del sonno(Figura 3B), l’attività di veglia (Figura3C), il numero totale di periodi di sonno (Figura3D) e la durata media dei periodi di sonno(Figura 3E).(A) Il sonno totale è stato significativamente ridotto nei pesci di superficie (p=0,001, n = 26), mentre non vi è stato alcun effetto con il trattamento YNT-185 nei pesci cavernicoli di Pachón (p=0.997, n = 16; 2 vie ANOVA, F(1,77)=25,81, p<0001). (B) L’attività di veglia non è stata significativamente alterata tra i pesci di superficie (p=0.228, n = 26) o pesci cavernicoli di Pachon (p=0,716, n = 16) o con trattamento di YNT-185 tra i due gruppi di trattamento (ANOVA a 2 vie, F(1,77)=0.133, p=0,715). (C) Il totale dei periodi di sonno è stato significativamente ridotto nei pesci di superficie con il trattamento YNT-185 (p=0,0005, n = 26). Tuttavia, non c’è stata alcuna alterazione nei periodi di sonno nei pesci cavernicoli di Pachón (p=0,989, n = 16; ANOVA a 2 vie, F(1,77)=14,78, p=0,0002).(D) La durata media del sonno non è stata modificata in modo significativo né nei pesci di superficie (p=0,391, n = 26) né nei pesci cavernicoli di Pachón (p=0,820, n = 16; ANOVA a 2 vie, F(1,77)=2,06, p=0,155).10.7554/eLife.32637.014Figure 3-figure supplement 1-source data 1.Inhibition of HCRT signaling increases sleep in larval cavefish.this source file includes analysis of 1 um and 10 um TCS treatment on total sleep duration in surface fish and Pachón cavefish (Figure 3-figuresupplement 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli Pachón (Figura 3—supplemento a3 cifre 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli di Pachón (Figura 3—supplemento a3 cifre 1B).(A) Immagini rappresentative di pesci di superficie (in alto) e Pachón (in basso) a 25 dpf. (B) Il trattamento TCS non ha influenzato la durata del sonno nei pesci di superficie (1 µM, P=0,782, n=18, 10 µM P=0,891, 30 µM, P=0.791 n=18) mentre i pesci cavernicoli di Pachón hanno aumentato la durata totale del sonno in risposta al trattamento TCS 10 e 30 µM (1 µM, P>0,116, n=17; 10 µM, P<0,031, 30 µM, P=0,02 n=18, ANOVA a 2 vie, F(2,88)=12,178). C-D. Profili di sonno di ventiquattro ore di pesci di superficie (C) e pesci cavernicoli di Pachón (D).10.7554/eLife.32637.015Figure 3-figure supplement 2-source data 2.HCRT agonista altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.Questo file di dati sorgente include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l‘attività di veglia (Figura 3-figure supplement2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).
Per determinare il ruolo della segnalazione HCRTR2 potenziata, abbiamo immerso 25 dpf fry nell’agonista selettivo HCRTR2 YNT-185(Figura 3—supplemento di cifra 1). Mentre l’effetto di questo farmaco sul sonno non è stato precedentemente testato nei pesci, esso consolida attivamente la veglia nei topi(Irukayama-Tomobe et al., 2017; Nagahara et al., 2015). Il trattamento con YNT-185 ha ridotto significativamente il sonno nei pesci di superficie, senza influenzare il sonno nei pesci cavernicoli dove i livelli di HCRT sono naturalmente elevati(Figura 3-figure supplement 1 ). L’attività durante i risvegli non è stata significativamente alterata con il trattamento con YNT-185 sia nei pesci di superficie che nei pesci cavernicoli di Pachón, suggerendo che la riduzione del sonno totale dei pesci di superficie non era dovuta al letargo. Inoltre, il trattamento YNT-185 ha ridotto significativamente il numero totale di attacchi di sonno(Figura 3-figure supplement 1). Presi nel loro insieme, questi risultati supportano l’idea che l’elevata segnalazione HCRT nei pesci cavernicoli larvali e adulti sia alla base dell’evoluzione della perdita di sonno.
Per convalidare i fenotipi del sonno ottenuti con la manipolazione farmacologica della segnalazione HCRT, abbiamo selettivamente abbattuto hcrt e misurato l’effetto sul sonno. Morpholinos (MO) sono stati efficacemente utilizzati nei pesci zebra e A. mexicanus per abbattere la funzione genica(Bilandžija et al., 2013; Bill et al., 2009). L’effetto knock-down dell’iniezione di MO è tipicamente limitato a ~cinque giorni dopo l’iniezione, e abbiamo verificato per la prima volta che le differenze di sonno sono presenti in questa fase iniziale. Abbiamo scoperto che a quattro dpf, il sonno nei pesci cavernicoli di Pachón è significativamente ridotto rispetto a quello dei pesci di superficie che sono stati accoppiati per età (Figura4A). L’iniezione di 0,2 mM hcrt MO migliorato il sonno nei pesci cavernicoli rispetto ai pesci iniettati con controllo MO strapazzato, mentre l’abbattimento di hcrt utilizzando lo stesso MO non ha avuto alcun effetto osservabile sui pesci di superficie(Figura 4A). La mortalità dei pesci iniettati con 0,2 mM di MO hcrt, 0,2 mM di MO strapazzato e controlli non iniettati non differivano, indicando alla concentrazione utilizzata, non vi è alcun effetto generalizzato della procedura di iniezione o del trattamento MO sulla sopravvivenza(Figura 4-figure supplement 1A-B). Anche se questa mortalità di base è superiore a quella del pesce zebra, non differisce dalla mortalità standard A. mexicanus osservata nel nostro laboratorio o in altri, e quindi non sembra esserci un effetto dannoso della procedura di iniezione o del trattamento(Elipot et al., 2014). Il trattamento con morfolino non ha influito sull’attività durante gli attacchi di veglia nei pesci di superficie o nei pesci cavernicoli di Pachón (Figura4B). L’analisi dell’architettura del sonno ha rivelato che l’iniezione di 0,2 mM hcrt MO ha aumentato il numero totale di attacchi di sonno e la durata degli attacchi di sonno nei pesci cavernicoli di Pachón, anche se non a livelli di pesci di superficie (Figura4C; Figura 4D). Pertanto, questi risultati supportano l’idea che livelli elevati di HCRT promuovono il sonno nei pesci cavernicoli di Pachón.
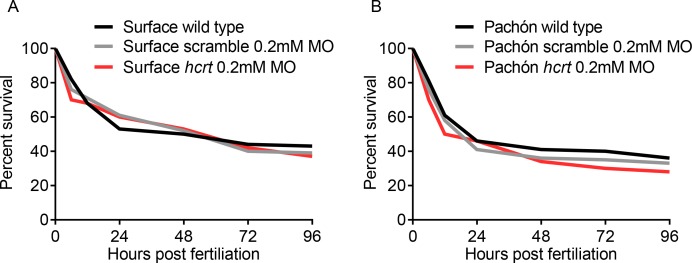
Figura 4-figure supplement 1-source data 1.L’effetto dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie e nei pesci cavernicoli. l’effetto dell ‘ iniezione di morfolino sulla sopravvivenza nei pesci di superficie e nei pesci cavernicoli.(A) L’iniezione di morfolino non altera il sonno totale nei pesci di superficie, p=0,640, n = 34, mentre nei pesci cavernicoli il tempo totale di sonno è stato significativamente aumentato con l’abbattimento di hcrt , p=0,0002, n = 40; ANOVA a 2 vie, F(1.133)=45.82, p<0,0001 (B) L’attività diveglia non è stata significativamente alterata né nei pesci di superficie (p=0,343, n = 34) né nei pesci cavernicoli di Pachón (p=0,084, n = 40; ANOVA a 2 vie, F(1, 133)=5,807).(C) Il numero totale di attacchi di sonno nei pesci di superficie non era significativamente diverso dai controlli iniettati, p=0,459, n = 34. Mentre nei pesci cavernicoli del Pachón, il numero totale di attacchi di sonno oltre le 24 ore è stato significativamente aumentato nei pesci hcrt MO rispetto ai pesci di controllo (p=0,0004, n = 40; ANOVA a 2 vie, F(1.133)=8,295, p=0,004). (D) La durata media degli attacchi di sonno non è stata diversa tra i controlli e i pesci hcrt MO iniettati in superficie (p=0,081, n = 34). C’è stato un significativo aumento della durata media dei bout di Pachón hcrt MO iniettati rispetto ai rispettivi controlli (p=0,004, n = 40; ANOVA a 2 vie, F(1.133)=13,61, p=0,0003).10.7554/eLife.32637.017Figure 4-source data 1.Transient knockdown di hcrt aumenta il sonno in 4 giorni dopo la fecondazione cavefish.this source file include analisi che confrontano gli effetti del trattamento con morfolino hcrt sulla durata del sonno (Figura 3A) attività di veglia (Figura3B), il numero totale di attacchi di sonno (Figura3C), e la durata media degli attacchi di sonno (Figura3D).Questo file sorgente include un’analisi che confronta gli effetti del trattamento con morfolino hcrt sulla durata del sonno(Figura 3A), l’attività di veglia (Figura3B), il numero totale di periodi di sonno (Figura3C) e la durata media dei periodi di sonno (Figura3D).Questo file sorgente include un’analisi che confronta gli effetti del trattamento con morfolino hcrt sulla durata del sonno(Figura 3A), l’attività di veglia (Figura3B), il numero totale di periodi di sonno (Figura3C) e la durata media dei periodi di sonno (Figura3D).(A) Nessuna differenza significativa nella sopravvivenza dei pesci di superficie dall’iniezione embrionale a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,719, Dunn post test, Wild Type vs. Scramble MO, p=0,862, Scramble MO vs. hcrt MO, p=0,701).(B) Sopravvivenza del pesce Pachón da iniezione embrionale rispetto ai controlli fino a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,429, Dunn’s post test, Wild Type vs. Scramble MO,p=0,299, Scramble MO vs. hcrt MO,p=0,206).10.7554/eLife.32637.019Figure 4-figure supplement 1-source data 1.The effect of morpholino injection on survival in surface fish and cavefish.this source file includes data analysis quantifying the effects of morpholino injection on survival in surface fish (Figure 4-figuresupplement 1A), and Pachón cavefish; Figure 4-figure supplement 1B over the first 96 hr post fertilization.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.
Per convalidare ulteriormente un ruolo per l’HCRT nella regolazione del sonno abbiamo cercato di silenziare geneticamente i neuroni HCRT e di valutare il sonno. Il sistema GAL4/UAS è stato ampiamente in Drosophila e zebrafish per manipolare l’espressione genica con specificità spaziale(Asakawa e Kawakami, 2008; Brand e Perrimon, 1993; Scheer e Campos-Ortega, 1999). Nel pesce zebra, la co-iniezione di plasmidi separati GAL4 e UAS affiancati all’elemento trasponibile, Tol2(Kawakami et al., 2000), è stata efficacemente utilizzata per generare un’espressione transitoria o stabile nelle cellule etichettate da entrambi i transgeni(Scott et al., 2007). Per mettere a tacere i neuroni HCRT, abbiamo coiniettato embrioni con hcrt-GAL4 che guida l’espressione in tutti i neuroni HCRT ela tossina UAS-Botulinum(BoTX) che blocca la neurotrasmissione attraverso la scissione delle proteine SNARE necessarie per il rilascio sinaptico(Brunger et al., 2008). Gli embrioni sono stati iniettati, sollevati in condizioni standard, poi testati per il sonno a 25 dpf. A seguito di misurazioni del sonno, i cervelli dei singoli pesci sono stati sezionati e il numero di neuroni HCRT silenziati (identificabili con l’espressione GFP) è stato quantificato. In tutti i casi, non è stata osservata alcuna espressione nei pesci iniettati con UAS-BoTXBLC-GFP da solo, indicando che hcrt-GAL4 è necessario per guidare l’espressione del transgene(Figura 5A,C). Inoltre, tutti i neuroni GFP-positivi sono stati co-etichettati da Anti-HCRT, dimostrando che questo approccio mira specificamente l’espressione del transgene BoTXBLC ai neuroni HCRT(Figura 5B,D). Il sonno totale nei pesci che esprimono hcrt:GAL4; UAS-BoTxTxBLC-GFP sono stati confrontati con pesci di tipo selvatico o pesci iniettati con UAS-BoTxTxBLC-GFP da soli. Il sonno è stato significativamente aumentato nel doppio transgenico sperimentale di pesci cavernicoli Pachón (hcrt:GAL4:UAS-BoTxTxBLC-GFP) rispetto ad entrambi i gruppi di controllo, mentre non vi è stato alcun effetto nei pesci di superficie (Figura5E). La velocità di veglia nei pesci di superficie e nei pesci cavernicoli non è stata modificata tra entrambi i gruppi di controllo e i pesci che esprimono hcrt:GAL4; UAS-BoTxBLC-GFP, suggerendo che l’aumentata quiescenza da silenziamento neuronale non è dovuta al letargo(Figura 5F).
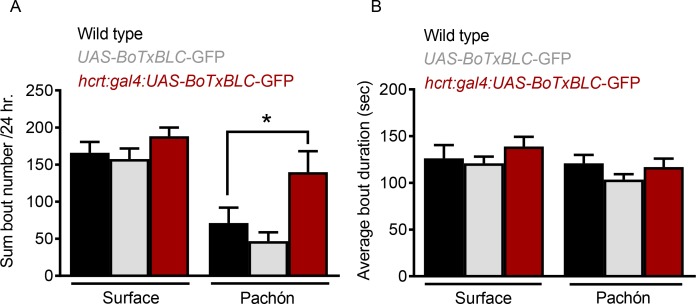
Figura 5-figure supplement 1-source data 1.Il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno in Pachón cavefish.il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno in Pachón cavefish.il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.(A) Superficie UAS-BoTx-BLC-GFP(B)Superficie hcrt:GAL4-UAS-BoTx-BLC-GFP(C) Pachón UAS-BoTx-BLC-GFP (D) Pachón hcrt:GAL4-UAS-BoTx-BLC-GFP (E) Il silenziamento neuronale delle cellule HCRT non ha alterato la durata totale del sonno nei pesci di superficie (Wild Type*UAS-BoTx-BLC-GFP, p=0.989, n = 23; UAS-BoTx-BLC-GFP*hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0,713, n = 14). I pesci cavernicoli di Pachón hanno aumentato il loro sonno totale quando le cellule HCRT sono state messe a tacere (Wild Type*UAS-BoTx-BoTx-BLC-GFP, p=0,667, n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.0426, n = 15; ANOVA a 2 vie, F(1,91)=65,68, p<0,0001). (F) L’attività di veglia non è stata alterata né nei pesci cavernicoli di superficie né in quelli di Pachón con silenziamento neuronale di HCRT (Surface fish Wild Type*UAS-BoTx-BLC-GFP, p=0.616, n = 23; UAS-BoTx-BLC-GFP*hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.642, n = 14; Pachón Wild Type*UAS-BoTx-BLC-GFP, p=0,587 n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP , p=0.612, n = 15; ANOVA a 2 vie, F(1,91)=0,206, p=0,650. (G) L’analisi di regressione ha rivelato una sottile tendenza all’aumento del sonno con più neuroni HCRT silenziati come quantificato con il segnale GFP (R2 = 0,091, p=0,314, n = 14). La stessa analisi di regressione nei pesci cavernicoli di Pachón ha rivelato una correlazione molto più robusta con l’aumento del sonno nelle cellule HCRT più silenziate (R2 = 0,229, p=0,0871, N = 15).10.7554/eLife.32637.022Figure 5-source dati 1.Genetic silenziamento dei sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno in Pachón cavefish.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno (Figura 5E), e l’attività di veglia (Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno(Figura 5E), e l’attività di veglia(Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno(Figura 5E), e l’attività di veglia(Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.(A) La durata totale del sonno non è stata significativamente alterata nei pesci di superficie quando le cellule HCRT sono state messe a tacere (Wild Type*UAS-BoTx-BLC-GFP, p=0,561, n = 23; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP , p=0,636, n= 14). Quando le cellule HCRT sono state messe a tacere nei pesci cavernicoli di Pachón c’è stato un aumento significativo del loro numero totale di attacchi di sonno (Wild Type*UAS-BoTx-BoTx-BLC-GFP, p=0,561, n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0 .031, n = 15; ANOVA a 2 vie, F(1,91)=32,43, p<0,0001). (B) La durata del sonno non è stata modificata né nei pesci di superficie né nei pesci cavernicoli di Pachon quando i neuroni HCRT sono stati messi a tacere (Surface Wild Type*UAS-BoTx-BLC-GFP, p>0.999, n = 21; Surface UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.743, n = 15; Pachón Wild Type*UAS-BoTx-BLC-GFP, p=0.401, n = 21; Pachón UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p>0,999, n = 15;2-way ANOVA, F(1,91)=3,886, p=0,052).10.7554/eLife.32637.023Figure 5-figure supplement 1-source data 1.Genetic silencing di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Questo file di origine contiene l’analisi del numero totale di attacchi (Figura 5-figuresupplement 1A), e la durata degli attacchi (Figura 5-figure supplement1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.
Il silenziamento dei sottoinsiemi di neuroni HCRT ha aumentato il sonno nei pesci cavernicoli di Pachón aumentando il numero di attacchi (Figura 5A-S) senza influenzare la durata degli attacchi (Figura 5B-S). La quantificazione delle cellule etichettate ha rivelato il 10,2% di hcrt:GAL4; UAS-BoTxTxBLC-GFP pesci cavernicoli esprimere GFP in una media di 7,5 cellule per animale che esprime. Allo stesso modo, l’11,5% di hcrt:GAL4; UAS-BoTxTxTxBLC-GFP pesci di superficie esprimere GFP con una media di 6,7 cellule per animale che esprime. Analisi di regressione del numero di neuroni silenziati significativamente correlati con la durata totale del sonno (R2 = 0,229) nei pesci cavernicoli di Pachón, rafforzando l’idea che l’aumento della segnalazione HCRT è associato alla perdita di sonno (Figura 5G). Una debole correlazione tra i neuroni BoTX-espressivi HCRT e la durata del sonno (R2 = 0,091) è stata osservata anche nei pesci di superficie Figura 5G, coerente con l’idea che l’HCRT può anche regolare il sonno nei pesci di superficie, ma i pesci cavernicoli sono più sensibili ai sottili cambiamenti della segnalazione HCRT.
I neuroni ipocretini sono modulati dagli stimoli sensoriali e dallo stato di alimentazione, indicando che sono coinvolti nell’integrazione dei segnali ambientali con la regolazione del sonno(Appelbaum et al., 2007; Mileykovskiy et al., 2005). Il numero di neuromasti meccanosensoriali che compongono la linea laterale, un sistema neuromodulatorio utilizzato per rilevare le prede e il flusso dell’acqua, sono aumentati nei pesci cavernicoli. Questo tratto evoluto è ipotizzato per consentire una maggiore capacità di foraggiamento, rilevamento di oggetti e comportamenti sociali in assenza di occhi(Kowalko et al., 2013; Kulpa et al., 2015; Yoshizawa et al., 2010). Abbiamo precedentemente riportato che l’ablazione della linea laterale restituisce il sonno ai pesci cavernicoli di Pachón senza influenzare il sonno nei pesci di superficie, aumentando la possibilità che l’ingresso della linea laterale moduli la segnalazione HCRT nei pesci cavernicoli per sopprimere il sonno (Jaggardet al., 2017). Per studiare gli effetti dell’ingresso della linea laterale sull’HCRT, abbiamo pretrattato i pesci adulti nella gentamicina antibiotica ototossica, che di fatto abbatte la linea laterale(Van Trump et al., 2010), e saggiato il sonno nei pesci cavernicoli adulti e nei pesci di superficie. In accordo con i risultati precedenti, il trattamento con gentamicina ha completamente abbattuto la linea laterale(Figura 6A-D) e ha ripristinato il sonno nei pesci cavernicoli senza influenzare il sonno nei pesci di superficie (Jaggardet al., 2017). Per determinare l’effetto dell’ablazione della linea laterale sulla regolazione dell’HCRT, abbiamo quantificato l’espressione hcrt o i livelli di neuropeptidi nei pesci cavernicoli adulti e nei pesci di superficie dopo il trattamento con gentamicina. L’analisi quantitativa PCR del trattamento con gentamicina ha rivelato che l’espressione hcrt è stata significativamente ridotta nei pesci cavernicoli a livelli equivalenti a quelli dei pesci di superficie non trattati(Figura 6E). Al contrario, non ci sono stati cambiamenti significativi nell’espressione hcrt dopo il trattamento con gentamicina nei pesci di superficie. Pertanto, il forte effetto di ablazione della linea laterale nei pesci cavernicoli indica che la linea laterale aumenta selettivamente i livelli di HCRT nei pesci cavernicoli. Il confronto e la quantificazione dettagliata dei livelli di neuropeptidi HCRT nell’ipotalamo rivela che l’ablazione laterale non influisce sul numero di neuroni ipotalamici HCRT-positivi, ma riduce selettivamente il livello di HCRT all’interno di ogni cellula nei pesci cavernicoli (Figura 6F-K), sostenendo l’idea che la linea laterale è necessaria per il miglioramento della funzione HCRT nei pesci cavernicoli. Insieme, questi risultati rivelano che l’input sensoriale dalla linea laterale promuove il sonno e l’espressione hcrt nei pesci cavernicoli di Pachón, fornendo un collegamento tra l’input sensoriale e la regolazione trascrizionale di un fattore che favorisce la veglia.
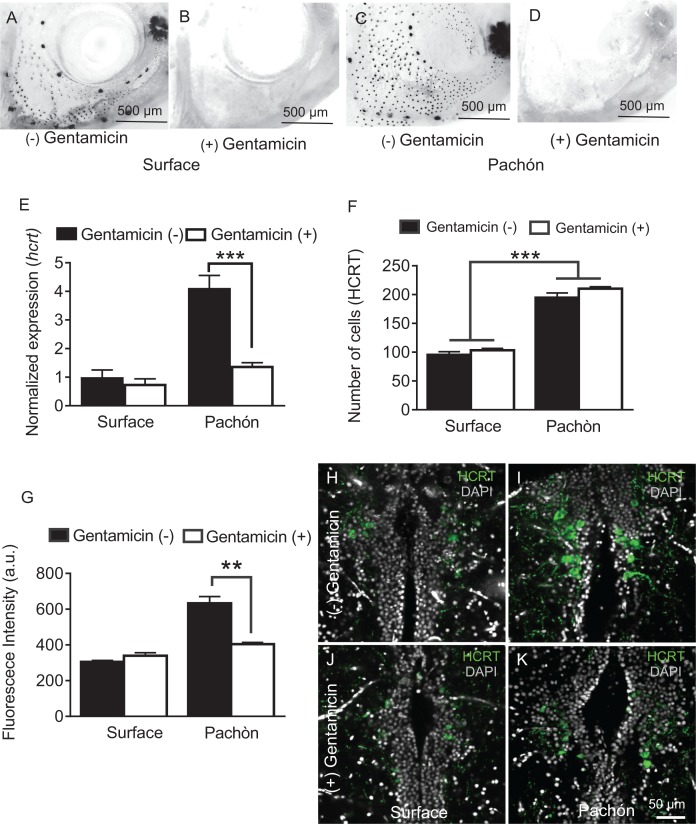
Figura 6 – Dati fonte 1.L’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.l’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.l’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.Le microfotografie delle regioni craniche dei pesci di superficie macchiate con DASPEI per rivelare i neuromasti meccanosensoriali della linea laterale. Il trattamento con gentamicina abbatte i neuromasti della linea laterale nei pesci di superficie(B) e nei pesci cavernicoli di Pachón (D) (E) Il trattamento con gentamicina non ha alcun effetto significativo sull’espressione del hcrt nei pesci di superficie (p>0,635, n = 8) mentre nei pesci cavernicoli di Pachón il trattamento con gentamicina riduce significativamente l’espressione del hcrt, ripristinando i livelli di superficie. (Pachón trattato vs. non trattato, p<0,0001; Pachón trattato vs. non trattato in superficie, p>0,635, n = 8, F(1,28)=21,28).(F) L’intensità di fluorescenza per cellula ipotalamica HCRT-cellula non è stata alterata con il trattamento con gentamicina nei pesci di superficie, p=0,590, n = 4. Nei pesci cavernicoli di Pachón, i livelli di neuropeptidi HCRT sono significativamente più bassi dopo il trattamento con gentamicina (p<0.0001, n = 4; 2 vie ANOVA, F (1, 13)=0,0001 G. Il trattamento con gentamicina non ha alcun effetto sul numero totale di cellule HCRT in superficie o nei pesci cavernicoli di Pachón (p>0,494, n = 8, F (1, 13C)=0,4967).(H-K) Rappresentante 2 μm immagini confocali della regione ipotalamica dorsale nei pesci di superficie e pesci cavernicoli di Pachón immunocolori con HCRT (verde) e DAPI (bianco) (H) Controllo di superficie (I) Controllo di Pachón (J) Gentamicina di superficie K. Pachón gentamicina. Barra di scala = 50 μm.10.7554/eLife.32637.025Figure 6-source data 1.Chemical ablation of mechanosensory lateral line riduce i livelli di HCRT in Pachón cavefish.this source file contiene l’analisi degli effetti di ablazione linea laterale con gentamicina su espressione hcrt (Figura 6E), numero di celluleHCRT(Figura 6F),e livelli di fluorescenza HCRT (Figura 6G).Questo file sorgente contiene l’analisi degli effetti dell’ablazione laterale con gentamicina sull’espressione hcrt (Figura6E), il numero di cellule HCRT (Figura6F) e i livelli di fluorescenza HCRT (Figura6G).Questo file sorgente contiene l’analisi degli effetti dell’ablazione laterale con gentamicina sull’espressione hcrt (Figura6E), il numero di cellule HCRT (Figura6F) e i livelli di fluorescenza HCRT (Figura6G).
Oltre al suo potente ruolo nella regolazione del sonno, hcrt promuove il consumo di cibo nei pesci e nei mammiferi(Penney e Volkoff, 2014; Tsujino e Sakurai, 2013; Yokobori et al., 2011). In precedenza abbiamo riferito che la fame prolungata aumenta il sonno nei pesci cavernicoli senza influenzare il sonno nei pesci di superficie(Jaggard et al., 2017), ma il ruolo dell’HCRT nella modulazione dipendente dallo stato di alimentazione dei cicli sonno-veglia non è stato studiato. L’analisi quantitativa PCR da estratti del cervello intero ha rivelato che la trascrizione hcrt è significativamente ridotta nei pesci cavernicoli dopo 30 giorni di fame; tuttavia, lo stesso trattamento non influisce sulla trascrizione hcrt nei pesci di superficie, indicando che i pesci cavernicoli sono più sensibili ai cambiamenti in HCRT dipendenti dalla fame(Figura 7A). Per determinare se il neuropeptide HCRT è prodotto in un numero maggiore di cellule durante la fame, abbiamo quantificato i neuroni HCRT-positivi in stato di alimentazione e di fame(Figura 7B-G). Simile all’ablazione della linea laterale, la fame ha ridotto i livelli di HCRT in ogni cellula, senza influenzare il numero di neuroni HCRT-positivi. Inoltre, la fame non ha influenzato il numero di cellule HCRT-positive o i livelli di HCRT per cellula nei pesci di superficie(Figura 7B). Questi risultati indicano che la fame modula i livelli di HCRT, piuttosto che il numero di cellule che producono HCRT. La regolazione acuta dell’HCRT attraverso l’alimentazione dello stato di alimentazione e l’input sensoriale dipendente dalla linea laterale dimostra un legame unico tra questi sistemi neuronali e quelli che mediano i cicli sonno/veglia.
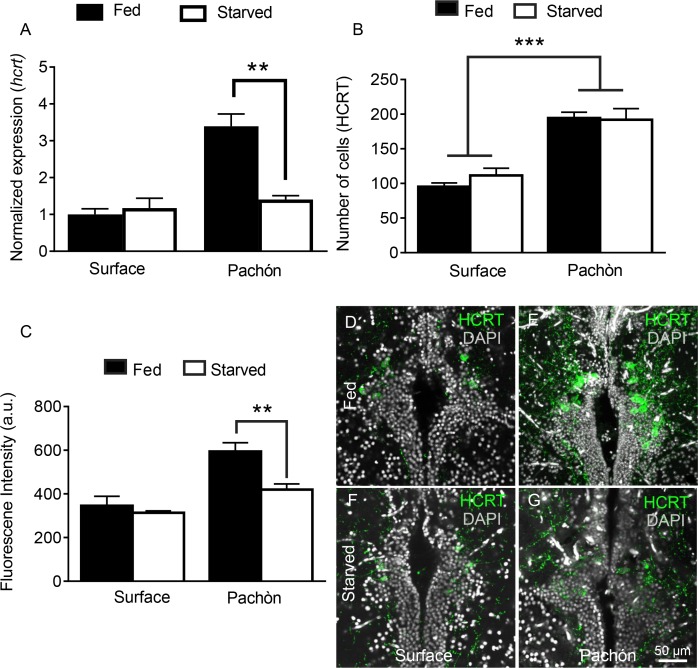
Figura 7 – dati fonte 1.La fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.la fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.la fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.(A) La fame non influenza l’espressione hcrt nei pesci di superficie (p>0.832, n = 4) mentre l’espressione hcrt è significativamente ridotta nei pesci cavernicoli di Pachón (p >0.001, n = 4, ANOVA a 2 vie, F(1,13)=13,54)) (B) L’intensità della fluorescenza nelle cellule HCRT non è stata influenzata da 30 giorni di fame nei pesci di superficie (p>0,788, n = 4). Nei pesci cavernicoli di Pachón, il neuropeptide HCRT è stato significativamente ridotto in seguito alla fame (p<0,004, n = 4, 2 vie ANOVA, F(1,12)=10,17))(C) La fame non ha un effetto significativo sul numero totale di cellule HCRT-positive sia in superficie che nei pesci cavernicoli di Pachón (Superficie, p=0,452, n = 4; Pachón, p>0.979, n = 4, ANOVA a 2 vie, F(1,11)=3,65)) (D) Controllo di superficie (E) Controllo di Pachón (E) Controllo di superficie (F) Pachón affamato (G) Pachón affamato. Barra di scala = 50 μm.10.7554/eLife.32637.027Figure 7-source data 1.Starvation inibisce selettivamente i livelli di HCRT nei pesci cavernicoli. Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt (Figura 7A), sul numero di cellule HCRT (Figura7B) e sui livelli di fluorescenza HCRT (Figura7C).Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt(Figura 7A), il numero di cellule HCRT (Figura7B) e i livelli di fluorescenza HCRT (Figura7C).Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt(Figura 7A), il numero di cellule HCRT (Figura7B) e i livelli di fluorescenza HCRT (Figura7C).

Figura 1-figure supplement 3.Figura 1—supplemento figura 3. Trascrizione dell’ipocretina e livelli di peptide sono elevati nel pesce cavernicolo di Pachón.trascrizione dell’ipocretina e livelli di peptide sono elevati nel pesce cavernicolo di Pachón.la sequenza HCRT è identica tra il pesce di superficie e il pesce cavernicolo di Pachón.Quantificazione dei geni qPCR e dell’intensità di fluorescenza tra pesci di superficie e pesci cavernicoli.la quantificazione dei geni qPCR e dell’intensità di fluorescenza tra pesci di superficie e pesci cavernicoli.i livelli di peptide HCRT sono aumentati nei pesci cavernicoli di Pachón.i livelli di ipocretina sono aumentati nei primi sviluppi nei pesci cavernicoli di Pachón.(A) Immagini rappresentative di pesci di superficie e pesci cavernicoli Pachón (B) La durata del sonno è significativamente ridotta nei pesci cavernicoli Pachón rispetto alla morfologia di superficie (Unpaired t-test, t = 5,56, n = 26, p<0,0001).(C) L’espressione di hcrt normalizzata da GAPDH negli estratti del cervello intero adulto è significativamente migliorata nei pesci cavernicoli di Pachón rispetto ai pesci di superficie (Unpaired t-test, t = 11,15, n = 8, p<0,0001).(D) Il segnale del neuropeptide HCRT è significativamente aumentato nei pesci cavernicoli di Pachón rispetto ai pesci di superficie (Unpaired t-test, t = 5,94, n = 8, p<0,001). E. Il numero di cellule HCRT-positive nell’ipotalamo è significativamente aumentato nei pesci cavernicoli rispetto ai pesci di superficie (Unpaired t-test, t = 9,984, n = 8, p<0,0001).(F-I) Immagini confocali rappresentative 2 μm da fette coronali di pesce di superficie o cervello di Pachón immunizzato con anti-HCRT (verde) e DAPI (bianco) (F) Fetta coronale del cervello intero di superficie.(G) Pachón fetta coronale del cervello intero.(H) Ipotalamo dorsale di superficie del pesce di superficie contenente cellule positive HCRT(I) Pachón ipotalamo dorsale del pesce cavernicolo contenente neuroni HCRT in vista. La barra di scala indica 500 μm (F,G); 50 μm (H,I).10.7554/eLife.32637.006Figure 1-source data 1.Hypocretin trascrizione e livelli di peptidi sono elevati in Pachón cavefish.Questo file di origine comprende l’analisi per il confronto tra superficie e Pachón cavefish per la durata del sonno (Figura 1B), l’espressione hcrt ( Figura 1C), ilnumero di cellule espressione HCRT (Figura 1D), el’intensità del segnale HCRT (Figura 1E).Questo file sorgente include l’analisi per il confronto tra il pesce cavernicolo di superficie e il pesce cavernicolo di Pachón per la durata del sonno (Figura1B), l’espressione hcrt(Figura1C), il numero di cellule espressione HCRT (Figura1D), e l’intensità del segnale HCRT (Figura1E).Questo file sorgente include l’analisi per il confronto tra il pesce cavernicolo di superficie e il pesce cavernicolo di Pachón per la durata del sonno (Figura1B), l’espressione hcrt(Figura1C), il numero di cellule espressione HCRT (Figura1D), e l’intensità del segnale HCRT (Figura1E).(A) L’allineamento della sequenza per HCRT in A. mexicanus rivela un’omologia del 35-48% di identità rispetto ad altre specie di pesci tra cui zebrafish e medaka, e un 35% di identità conservata rispetto ai mammiferi HCRT.(B) Il gene di Housekeeping usato per tutti gli esperimenti q-PCR non è significativamente alterato tra Surface e Cavefish (Unpaired t-test, p=0.972). L’espressione è stata normalizzata per i pesci di superficie.10.7554/eLife.32637.007Figure 1-figure supplement 1-source data 1.Quantification of qPCR housekeeping genes and fluorescent intensity between surface and cavefish.this source file includes quantification of qPCR differences for the housekeeping gene Gadph ( Figure 1-figuresupplement 1B) and comparison of fluorescence intensity between surface and Pachón fry (Figure 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).(A) Pesce di superficie intero cervello da sagittale 2 μm fetta confocale (B) Pachón pesce cavernicolo intero cervello sagittale 2 μm fetta confocale.(C) Pesce di superficie ipotamo sagittale 2 μm fetta confocale.(D) Pachón pesce cavernicolo ipotalmo 2 μm fetta confocale.(A) Cinque giorni dopo la fecondazione tutto il pesce di superficie di superficie immunizzato con anti-HCRT (verde) e DAPI (bianco).(B) Intero monte quattro dpf Pachón Pachón pesci cavernicoli immunocolori con anti-HCRT (verde) e DAPI (bianco).(C) HCRT livelli di neuropeptidi HCRT sono significativamente aumentati in cinque dpf Pachón larve rispetto alla superficie (Unpaired t-test, t = 3,17, df = 10, p<0,01).
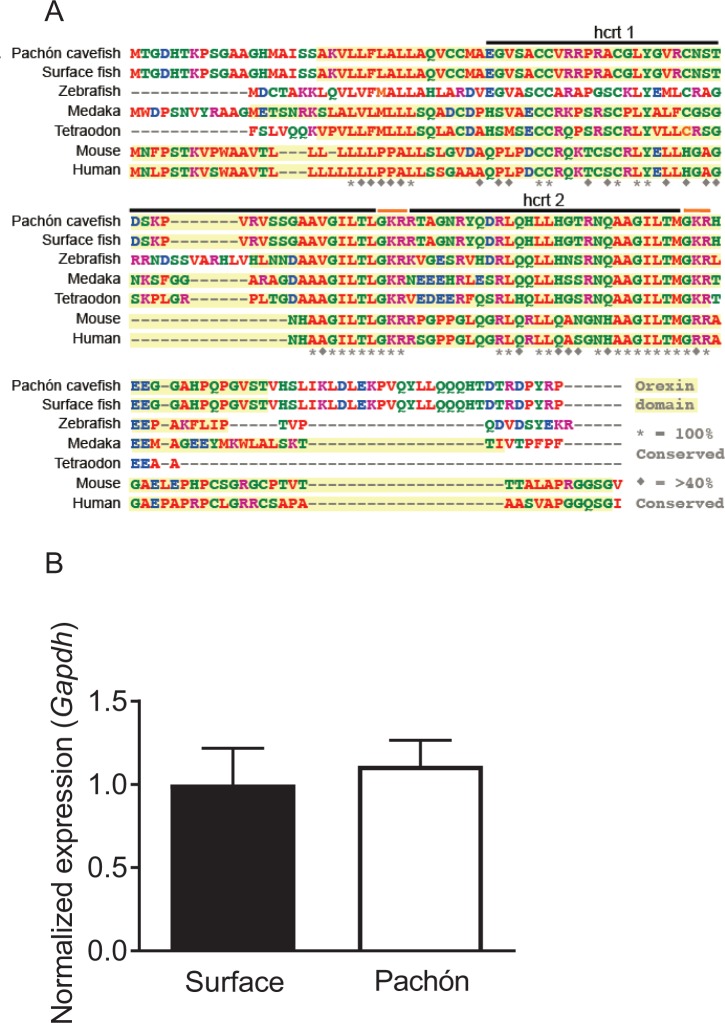
Figura 1-figure supplement 1-source data 1.La sequenza HCRT è identica tra i pesci di superficie e i pesci cavernicoli di Pachón. Quantificazione dei geni qPCR e dell’intensità di fluorescenza tra i pesci di superficie e i pesci cavernicoli.(A) L’allineamento delle sequenze per l’HCRT in A. mexicanus rivela un’omologia del 35-48% di identità rispetto ad altre specie di pesci, inclusi i pesci zebra e i medaka, e un 35% di identità conservata rispetto ai mammiferi HCRT.(B) Il gene di Housekeeping usato per tutti gli esperimenti q-PCR non è significativamente alterato tra Surface e Cavefish (Unpaired t-test, p=0.972). L’espressione è stata normalizzata per i pesci di superficie.10.7554/eLife.32637.007Figure 1-figure supplement 1-source data 1.Quantification of qPCR housekeeping genes and fluorescent intensity between surface and cavefish.this source file includes quantification of qPCR differences for the housekeeping gene Gadph ( Figure 1-figuresupplement 1B) and comparison of fluorescence intensity between surface and Pachón fry (Figure 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).Questo file sorgente include la quantificazione delle differenze qPCR per il gene Gadph(Figura 1-figure supplement 1B) e il confronto dell’intensità di fluorescenza tra superficie e Pachón fry (Figura 1-figuresupplement 3C).

Figura 1-figure supplement 2.I livelli di peptidi HCRT sono aumentati nei pesci cavernicoli di Pachón.(A) Pesce di superficie intero cervello da sagittale 2 μm fetta confocale (B) Pachón pesce cavernicolo intero cervello sagittale 2 μm fetta confocale.(C) Pesce di superficie ipotamo sagittale 2 μm fetta confocale.(D) Pachón pesce cavernicolo ipotalmo 2 μm fetta confocale.

Figura 1-figura supplemento 3.I livelli di ipocretina sono aumentati nei primi anni di sviluppo nei pesci cavernicoli di Pachón.(A) Cinque giorni dopo la fecondazione tutto il pesce di superficie immunizzato con anti-HCRT (verde) e DAPI (bianco).(B) Intero monte quattro dpf Pachón Pachón pesci cavernicoli immunocolori con anti-HCRT (verde) e DAPI (bianco).(C) HCRT livelli di neuropeptidi HCRT sono significativamente aumentati in cinque dpf Pachón larve rispetto alla superficie (Unpaired t-test, t = 3,17, df = 10, p<0,01).

Figura 2 dati fonte 1.L’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.l’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.l’inibizione farmacologica del recettore due dell’HCRT favorisce il sonno nei pesci cavernicoli di Pachón.(A,B) Profilo del sonno di 24 ore nei pesci di superficie(A) Pesci cavernicoli di Pachón (B) trattati con DMSO (nero), 1 μm TCS (azzurro) o 10 μm TCS (blu scuro).(C) Il trattamento TCS non influisce sulla durata totale del sonno nei pesci di superficie (1 μM p>0,999, n = 12, 10 uM P>0,941, n = 12). Pesci cavernicoli di Pachón presi in considerazione con 1 μM TCS tendevano ad aumentare il sonno (p>0,178, n = 12) mentre il trattamento con 10 μM aumentava significativamente il sonno (p<0,01, n = 13; F(1, 73)=25,00,) rispetto al pesce trattato di controllo.(D) L’attività di veglia non è stata significativamente alterata in pesci di superficie o pesci cavernicoli o in risposta al trattamento farmacologico, 2-way ANOVA, (F(1, 73)=2.73, p>0.103, n = 79) (E) Il trattamento con TCS non ha influenzato la durata media del sonno nei pesci di superficie (1 μM TCS, p>0.430, n = 12; 10 μM TCS, p>0.518, n = 12) Il trattamento dei pesci cavernicoli di Pachón con 1 μM TCS tende ad aumentare la durata dell’attacco, p>0,051, n = 12, mentre il trattamento con 10 μM TCS aumenta significativamente la durata dell’attacco nei pesci cavernicoli di Pachón, (p<0,01, n = 13; F(1, 73)=47,42).(F) Il trattamento TCS non ha influito sul numero totale di periodi di sonno nei pesci di superficie 1 μM TCS, p>0,976, n = 12; 10 μM TCS, p>0,998, n = 12). Nel pesce cavernicolo di Pachón, il trattamento con 1 μM TCS non ha influito sul numero di attacchi di sonno (p>0,828, n = 12). Il trattamento con 10 μM TCS aumenta significativamente la durata del combattimento nei pesci cavernicoli di Pachón,(p<0,001, n = 13; 2 vie ANOVA, F(1, 68)=3,309).10.7554/eLife.32637.009Figure 2-figure 2-force data 1.Pharmacological inhibition of HCRT Receptor two promotes sleep in Pachón cavefish.Data analysis comparing the effects of 1 um and 10 um TCS compared to controls in surface fish and cavefish for sleep (Figure 2C), waking activity (Figure 2D), total bout number (Figure 2E),and average bout duration (Figure 2F).Analisi dei dati che confronta gli effetti di 1 um e 10 um di TCS rispetto ai controlli nei pesci di superficie e nei pesci cavernicoli per il sonno (Figura2C), l’attività di veglia (Figura2D), il numero totale di attacchi (Figura2E), e la durata media degli attacchi (Figura2F).Analisi dei dati che confronta gli effetti di 1 um e 10 um di TCS rispetto ai controlli nei pesci di superficie e nei pesci cavernicoli per il sonno (Figura2C), l’attività di veglia (Figura2D), il numero totale di attacchi (Figura2E), e la durata media degli attacchi (Figura2F).

Figura 3-figure supplement 2-figure data 2.Il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei giovani pesci cavernicoli.il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei giovani pesci cavernicoli.il pannello di antagonisti farmacologici HCRT rivela il ruolo di stimolo alla veglia di HCRT nei giovani pesci cavernicoli.l’agonista HCRT altera parzialmente il comportamento del sonno nei giovani pesci di superficie, ma non nei pesci cavernicoli di Pachón.L’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.l’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.il blocco HCRTR2 aumenta selettivamente il sonno nei pesci cavernicoli di Pachón.l’agonista HCRT altera parzialmente il comportamento del sonno nei giovani pesci di superficie, ma non nei pesci cavernicoli di Pachón.l’agonista HCRT altera parzialmente il comportamento del sonno nei giovani pesci di superficie, ma non nei pesci cavernicoli di Pachón.(A) Due SORA e un DORA sono stati usati per inibire il legame dell’HCRT al suo recettore.(B) Il sonno totale non è significativamente alterato nei pesci di superficie con il trattamento di antagonisti HCRT (TCS, p = 0,814, n = 18; Suvorexant, p = 0,865, n = 18; EMPA, p = 0,972, n = 19). I pesci cavernicoli di Pachón hanno aumentato significativamente il sonno totale in risposta agli antagonisti HCRT (TCS, p=0,004, n = 18; Suvorexant, p=0,032, n = 19, EMPA, p=0,027, n = 18; ANOVA a 2 vie, F(1, 135)=43,70, p<0,0001).(B) L’attività di veglia non è stata significativamente alterata in nessun pesce o in risposta al trattamento farmacologico, TCS di superficie, p=0,996, n = 18; Suvorexant, p=0.925, n = 18; EMPA, p=0,816, n = 19; Pachón, TCS, p=0,980, n = 18; Suvorexant, p>0,999, n = 19; EMPA, p=0.917, n = 18; ANOVA a 2 vie, (F(1, 135)=7,21, p=0,008) (C) Il numero totale di attacchi di sonno oltre le 24 ore di trattamento farmacologico non ha subito variazioni significative nei pesci di superficie (TCS, p=0.814, n = 18; Suvorexant, p=0,865, n = 18; EMPA, p=0,972, n = 19). Il totale degli attacchi di sonno sono stati significativamente aumentati nei pesci cavernicoli di Pachón con TCS, p=0,002, n = 18; e l’EMPA, p=0,041, n = 18, Suvorexant ha avuto una tendenza verso il significato, p=0,071, n = 19 (ANOVA a 2 vie, F(1, 135)=45,27, p<0,0001).(D) La lunghezza media del periodo di sonno non era significativamente diversa nei pesci di superficie trattati con antagonisti HCRT (TCS, p=0,822, n = 18; Suvorexant, p=0,805, n = 18; EMPA, p=0,236, n = 19). I pesci cavernicoli di Pachón hanno aumentato significativamente la loro lunghezza media di sonno con TCS, p=0,039, N = 18; e con Suvorexant, p=0,009, n = 19. L’EMPA ha avuto una tendenza al significato, p=0,078, n = 18 (ANOVA a 2 vie, F(1, 135)=14,06, p=0,0003).10.7554/eLife.32637.013Figure 3-source data 1.Panel di antagonisti farmacologici HCRT rivela il ruolo di promozione della veglia di HCRT in giovani pesci cavernicoli.Questo file di origine comprende l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS, e EMPA sulla durata totale del sonno (Figura 3B), l’attività di veglia (Figura 3C), il numero totale di attacchi di sonno (Figura3D), e la durata media degli attacchi di sonno (Figura3E).Questo file di origine include l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS ed EMPA sulla durata totale del sonno(Figura 3B), l’attività di veglia (Figura3C), il numero totale di periodi di sonno (Figura3D) e la durata media dei periodi di sonno(Figura 3E).Questo file di origine include l’analisi del trattamento con gli inibitori HCRTR Suvorexant, TCS ed EMPA sulla durata totale del sonno(Figura 3B), l’attività di veglia (Figura3C), il numero totale di periodi di sonno (Figura3D) e la durata media dei periodi di sonno(Figura 3E).(A) Il sonno totale è stato significativamente ridotto nei pesci di superficie (p=0,001, n = 26), mentre non vi è stato alcun effetto con il trattamento YNT-185 nei pesci cavernicoli di Pachón (p=0.997, n = 16; 2 vie ANOVA, F(1,77)=25,81, p<0001). (B) L’attività di veglia non è stata significativamente alterata tra i pesci di superficie (p=0.228, n = 26) o pesci cavernicoli di Pachon (p=0,716, n = 16) o con trattamento di YNT-185 tra i due gruppi di trattamento (ANOVA a 2 vie, F(1,77)=0.133, p=0,715). (C) Il totale dei periodi di sonno è stato significativamente ridotto nei pesci di superficie con il trattamento YNT-185 (p=0,0005, n = 26). Tuttavia, non c’è stata alcuna alterazione nei periodi di sonno nei pesci cavernicoli di Pachón (p=0,989, n = 16; ANOVA a 2 vie, F(1,77)=14,78, p=0,0002).(D) La durata media del sonno non è stata modificata in modo significativo né nei pesci di superficie (p=0,391, n = 26) né nei pesci cavernicoli di Pachón (p=0,820, n = 16; ANOVA a 2 vie, F(1,77)=2,06, p=0,155).10.7554/eLife.32637.014Figure 3-figure supplement 1-source data 1.Inhibition of HCRT signaling increases sleep in larval cavefish.this source file includes analysis of 1 um and 10 um TCS treatment on total sleep duration in surface fish and Pachón cavefish (Figure 3-figuresupplement 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli di Pachón (Figura 3—supplemento a3 cifre 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli di Pachón (Figura 3—supplemento a3 cifre 1B).(A) Immagini rappresentative di pesci di superficie (in alto) e Pachón (in basso) a 25 dpf. (B) Il trattamento TCS non ha influenzato la durata del sonno nei pesci di superficie (1 µM, P=0,782, n=18, 10 µM P=0,891, 30 µM, P=0.791 n=18) mentre i pesci cavernicoli di Pachón hanno aumentato la durata totale del sonno in risposta al trattamento TCS 10 e 30 µM (1 µM, P>0,116, n=17; 10 µM, P<0,031, 30 µM, P=0,02 n=18, ANOVA a 2 vie, F(2,88)=12,178). C-D. Profili di sonno di ventiquattro ore di pesci di superficie (C) e pesci cavernicoli di Pachón (D).10.7554/eLife.32637.015Figure 3-figure supplement 2-source data 2.HCRT agonista altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.Questo file di dati sorgente include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l‘attività di veglia (Figura 3-figure supplement2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).
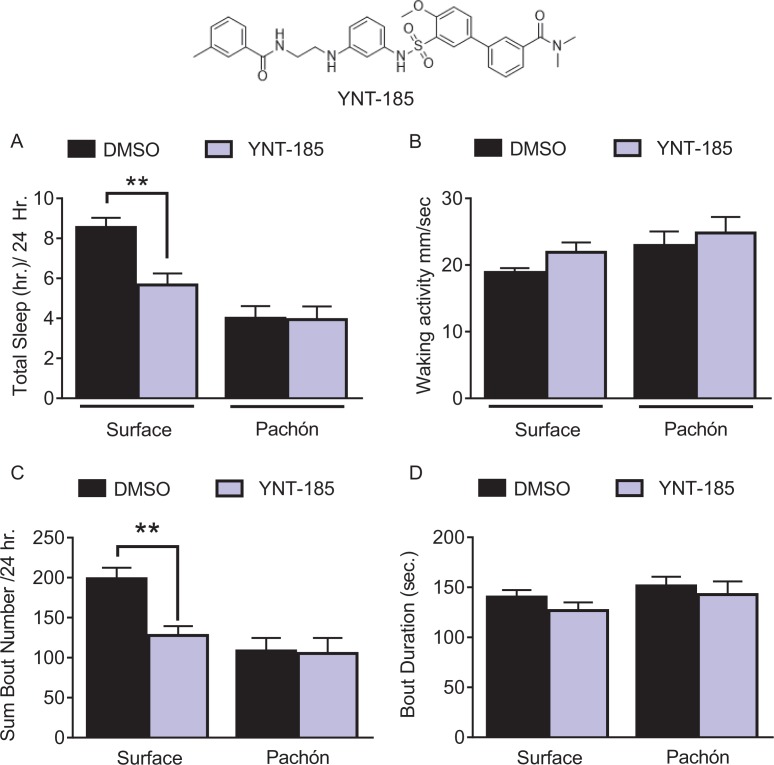
Figura 3-figure supplement 1-source data 1.L’agonista HCRT altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.l’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.l’inibizione della segnalazione HCRT aumenta il sonno nei pesci cavernicoli larvali.(A) Il sonno totale è stato significativamente ridotto nei pesci di superficie (p=0,001, n = 26), mentre non c’è stato alcun effetto con il trattamento YNT-185 nei pesci cavernicoli di Pachón (p=0).997, n = 16; 2 vie ANOVA, F(1,77)=25,81, p<0001). (B) L’attività di veglia non è stata significativamente alterata tra i pesci di superficie (p=0.228, n = 26) o pesci cavernicoli di Pachon (p=0,716, n = 16) o con trattamento di YNT-185 tra i due gruppi di trattamento (ANOVA a 2 vie, F(1,77)=0.133, p=0,715). (C) Il totale dei periodi di sonno è stato significativamente ridotto nei pesci di superficie con il trattamento YNT-185 (p=0,0005, n = 26). Tuttavia, non c’è stata alcuna alterazione nei periodi di sonno nei pesci cavernicoli di Pachón (p=0,989, n = 16; ANOVA a 2 vie, F(1,77)=14,78, p=0,0002).(D) La durata media del sonno non è stata modificata in modo significativo né nei pesci di superficie (p=0,391, n = 26) né nei pesci cavernicoli di Pachón (p=0,820, n = 16; ANOVA a 2 vie, F(1,77)=2,06, p=0,155).10.7554/eLife.32637.014Figure 3-figure supplement 1-source data 1.Inhibition of HCRT signaling increases sleep in larval cavefish.this source file includes analysis of 1 um and 10 um TCS treatment on total sleep duration in surface fish and Pachón cavefish (Figure 3-figuresupplement 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli di Pachón (Figura 3—supplemento a3 cifre 1B).Questo file sorgente include l’analisi del trattamento TCS di 1 um e 10 um sulla durata totale del sonno nei pesci di superficie e nei pesci cavernicoli di Pachón (Figura 3—supplemento a3 cifre 1B).

Figura 3-figure supplement 2 dati fonte 2.Il blocco HCRTR2 aumenta selettivamente il sonno nei pesci cavernicoli di Pachón.L’agonista HCRT altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.L’agonista HCRT altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.(A) Immagini rappresentative di pesci di superficie (in alto) e Pachón (in basso) a 25 dpf. (B) Il trattamento TCS non ha influenzato la durata del sonno nei pesci di superficie (1 µM, P=0,782, n=18, 10 µM P=0,891, 30 µM, P=0.791 n=18) mentre i pesci cavernicoli di Pachón hanno aumentato la durata totale del sonno in risposta al trattamento TCS 10 e 30 µM (1 µM, P>0,116, n=17; 10 µM, P<0,031, 30 µM, P=0,02 n=18, ANOVA a 2 vie, F(2,88)=12,178). C-D. Profili di sonno di ventiquattro ore di pesci di superficie (C) e pesci cavernicoli di Pachón (D).10.7554/eLife.32637.015Figure 3-figure supplement 2-source data 2.HCRT agonista altera parzialmente il comportamento del sonno nei pesci giovani di superficie, ma non nei pesci cavernicoli di Pachón.Questo file di dati sorgente include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l‘attività di veglia (Figura 3-figure supplement2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).Questo file di dati di origine include la quantificazione degli effetti dell’agonista HCRT YNT-185 sulla durata totale del sonno(Figura 3-figure supplement 2A), l’attività di veglia (Figura 3-figure supplement 2B), il numerototale di attacchi (Figura 3-figure supplement2C), e la durata media degli attacchi (Figura 3-figure supplement2D).

Figura 4-figure supplement 1-source data 1.L’effetto dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie e nei pesci cavernicoli. l’effetto dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie e nei pesci cavernicoli.(A) L’iniezione di morfolino non altera il sonno totale nei pesci di superficie, p=0,640, n = 34, mentre nei pesci cavernicoli il tempo totale di sonno è stato significativamente aumentato con l’abbattimento di hcrt , p=0,0002, n = 40; ANOVA a 2 vie, F(1.133)=45.82, p<0,0001 (B) L’attività diveglia non è stata significativamente alterata né nei pesci di superficie (p=0,343, n = 34) né nei pesci cavernicoli di Pachón (p=0,084, n = 40; ANOVA a 2 vie, F(1, 133)=5,807).(C) Il numero totale di attacchi di sonno nei pesci di superficie non era significativamente diverso dai controlli iniettati, p=0,459, n = 34. Mentre nei pesci cavernicoli del Pachón, il numero totale di attacchi di sonno oltre le 24 ore è stato significativamente aumentato nei pesci hcrt MO rispetto ai pesci di controllo (p=0,0004, n = 40; ANOVA a 2 vie, F(1.133)=8,295, p=0,004). (D) La durata media degli attacchi di sonno non è stata diversa tra i controlli e i pesci hcrt MO iniettati in superficie (p=0,081, n = 34). C’è stato un significativo aumento della durata media dei bout di Pachón hcrt MO iniettati rispetto ai rispettivi controlli (p=0,004, n = 40; ANOVA a 2 vie, F(1.133)=13,61, p=0,0003).10.7554/eLife.32637.017Figure 4-source data 1.Transient knockdown di hcrt aumenta il sonno in 4 giorni dopo la fecondazione cavefish.this source file include analisi che confrontano gli effetti del trattamento con morfolino hcrt sulla durata del sonno (Figura 3A) attività di veglia (Figura3B), il numero totale di attacchi di sonno (Figura3C), e la durata media degli attacchi di sonno (Figura3D).Questo file sorgente include un’analisi che confronta gli effetti del trattamento con morfolino hcrt sulla durata del sonno(Figura 3A), l’attività di veglia (Figura3B), il numero totale di periodi di sonno (Figura3C) e la durata media dei periodi di sonno (Figura3D).Questo file sorgente include un’analisi che confronta gli effetti del trattamento con morfolino hcrt sulla durata del sonno(Figura 3A), l’attività di veglia (Figura3B), il numero totale di periodi di sonno (Figura3C) e la durata media dei periodi di sonno (Figura3D).(A) Nessuna differenza significativa nella sopravvivenza dei pesci di superficie dall’iniezione embrionale a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,719, Dunn post test, Wild Type vs. Scramble MO, p=0,862, Scramble MO vs. hcrt MO, p=0,701).(B) Sopravvivenza del pesce Pachón da iniezione embrionale rispetto ai controlli fino a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,429, Dunn’s post test, Wild Type vs. Scramble MO,p=0,299, Scramble MO vs. hcrt MO,p=0,206).10.7554/eLife.32637.019Figure 4-figure supplement 1-source data 1.The effect of morpholino injection on survival in surface fish and cavefish.this source file includes data analysis quantifying the effects of morpholino injection on survival in surface fish (Figure 4-figuresupplement 1A), and Pachón cavefish; Figure 4-figure supplement 1B over the first 96 hr post fertilization.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.

Figura 4-figure supplement 1-source data 1.L’effetto dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie e nei pesci cavernicoli.(A) Nessuna differenza significativa nella sopravvivenza dei pesci di superficie dall’iniezione embrionale fino a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,719, Dunn’s post test, Wild Type vs. Scramble MO, p=0,862, Scramble MO vs. hcrt MO, p=0,701).(B) Sopravvivenza del pesce Pachón da iniezione embrionale rispetto ai controlli fino a 96 ore dopo la fecondazione (Kruskall-Wallis, p=0,429, Dunn’s post test, Wild Type vs. Scramble MO,p=0,299, Scramble MO vs. hcrt MO,p=0,206).10.7554/eLife.32637.019Figure 4-figure supplement 1-source data 1.The effect of morpholino injection on survival in surface fish and cavefish.this source file includes data analysis quantifying the effects of morpholino injection on survival in surface fish (Figure 4-figuresupplement 1A), and Pachón cavefish; Figure 4-figure supplement 1B over the first 96 hr post fertilization.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.Questo file di origine include l’analisi dei dati che quantificano gli effetti dell’iniezione di morfolino sulla sopravvivenza nei pesci di superficie(Figura 4-figure supplement 1A), e Pachón cavefish; Figura 4-figure supplement 1B sulle prime 96 ore dopo la fecondazione.

Figura 5-figure supplement 1-source data 1.Il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno nel pesce cavernicolo di Pachón.Il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno nel pesce cavernicolo di Pachón.Il silenziamento genetico di sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno nel pesce cavernicolo di Pachón.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.(A) Superficie UAS-BoTx-BLC-GFP(B)Superficie hcrt:GAL4-UAS-BoTx-BLC-GFP(C) Pachón UAS-BoTx-BLC-GFP (D) Pachón hcrt:GAL4-UAS-BoTx-BLC-GFP (E) Il silenziamento neuronale delle cellule HCRT non ha alterato la durata totale del sonno nei pesci di superficie (Wild Type*UAS-BoTx-BLC-GFP, p=0.989, n = 23; UAS-BoTx-BLC-GFP*hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0,713, n = 14). I pesci cavernicoli di Pachón hanno aumentato il loro sonno totale quando le cellule HCRT sono state messe a tacere (Wild Type*UAS-BoTx-BoTx-BLC-GFP, p=0,667, n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.0426, n = 15; ANOVA a 2 vie, F(1,91)=65,68, p<0,0001). (F) L’attività di veglia non è stata alterata né nei pesci cavernicoli di superficie né in quelli di Pachón con silenziamento neuronale di HCRT (Surface fish Wild Type*UAS-BoTx-BLC-GFP, p=0.616, n = 23; UAS-BoTx-BLC-GFP*hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.642, n = 14; Pachón Wild Type*UAS-BoTx-BLC-GFP, p=0,587 n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP , p=0.612, n = 15; ANOVA a 2 vie, F(1,91)=0,206, p=0,650. (G) L’analisi di regressione ha rivelato una sottile tendenza all’aumento del sonno con più neuroni HCRT silenziati come quantificato con il segnale GFP (R2 = 0,091, p=0,314, n = 14). La stessa analisi di regressione nei pesci cavernicoli di Pachón ha rivelato una correlazione molto più robusta con l’aumento del sonno nelle cellule HCRT più silenziate (R2 = 0,229, p=0,0871, N = 15).10.7554/eLife.32637.022Figure 5-source dati 1.Genetic silenziamento dei sottoinsiemi di neuroni HCRT aumenta selettivamente il sonno in Pachón cavefish.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno (Figura 5E), e l’attività di veglia (Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno(Figura 5E), e l’attività di veglia(Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.Questo file contiene analisi che quantificano gli effetti del silenziamento dei neuroni HCRT sulla durata totale del sonno(Figura 5E), e l’attività di veglia(Figura 5F). L’analisi di regressione che determina la relazione tra il numero di neuroni HCRT silenziati e la durata totale del sonno è rappresentata nella Figura 5G.(A) La durata totale del sonno non è stata significativamente alterata nei pesci di superficie quando le cellule HCRT sono state messe a tacere (Wild Type*UAS-BoTx-BLC-GFP, p=0,561, n = 23; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP , p=0,636, n= 14). Quando le cellule HCRT sono state messe a tacere nei pesci cavernicoli di Pachón c’è stato un aumento significativo del loro numero totale di attacchi di sonno (Wild Type*UAS-BoTx-BoTx-BLC-GFP, p=0,561, n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0 .031, n = 15; ANOVA a 2 vie, F(1,91)=32,43, p<0,0001). (B) La durata del sonno non è stata modificata né nei pesci di superficie né nei pesci cavernicoli di Pachon quando i neuroni HCRT sono stati messi a tacere (Surface Wild Type*UAS-BoTx-BLC-GFP, p>0.999, n = 21; Surface UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.743, n = 15; Pachón Wild Type*UAS-BoTx-BLC-GFP, p=0.401, n = 21; Pachón UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p>0,999, n = 15;2-way ANOVA, F(1,91)=3,886, p=0,052).10.7554/eLife.32637.023Figure 5-figure supplement 1-source data 1.Genetic silencing di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Questo file di origine contiene l’analisi del numero totale di attacchi (Figura 5-figuresupplement 1A), e la durata degli attacchi (Figura 5-figure supplement1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.

Figura 5-figure supplement 1-source data 1.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Il silenziamento genetico di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.(A) I periodi di sonno totali non sono stati significativamente alterati nei pesci di superficie quando le cellule HCRT sono state messe a tacere (Wild Type*UAS-BoTx-BLC-GFP, p=0,561, n = 23; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP , p=0,636, n= 14). Quando le cellule HCRT sono state messe a tacere nei pesci cavernicoli di Pachón c’è stato un aumento significativo del loro numero totale di attacchi di sonno (Wild Type*UAS-BoTx-BoTx-BLC-GFP, p=0,561, n = 21; UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0 .031, n = 15; ANOVA a 2 vie, F(1,91)=32,43, p<0,0001). (B) La durata del sonno non è stata modificata né nei pesci di superficie né nei pesci cavernicoli di Pachon quando i neuroni HCRT sono stati messi a tacere (Surface Wild Type*UAS-BoTx-BLC-GFP, p>0.999, n = 21; Surface UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p=0.743, n = 15; Pachón Wild Type*UAS-BoTx-BLC-GFP, p=0.401, n = 21; Pachón UAS-BoTx-BLC-GFP* hcrt:GAL4-UAS-BoTx-BLC-GFP, p>0,999, n = 15;2-way ANOVA, F(1,91)=3,886, p=0,052).10.7554/eLife.32637.023Figure 5-figure supplement 1-source data 1.Genetic silencing di sottoinsiemi di HCRT altera l’architettura del sonno in Pachón cavefish.Questo file di origine contiene l’analisi del numero totale di attacchi (Figura 5-figuresupplement 1A), e la durata degli attacchi (Figura 5-figure supplement1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.Questo file di origine contiene l’analisi del numero totale di attacchi(Figura 5-figure supplement 1A), e la durata dell’attacco (Figura 5-figure supplement 1B) in pesci con neuroni HCRT geneticamente silenziati.

Figura 6 – dati fonte 1.L’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.l’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.l’ablazione chimica della linea laterale meccanosensoriale riduce i livelli di HCRT nei pesci cavernicoli di Pachón.Le microfotografie delle regioni craniche dei pesci di superficie macchiate con DASPEI per rivelare i neuromasti meccanosensoriali della linea laterale. Il trattamento con gentamicina abbatte i neuromasti della linea laterale nei pesci di superficie(B) e nei pesci cavernicoli di Pachón (D) (E) Il trattamento con gentamicina non ha alcun effetto significativo sull’espressione del hcrt nei pesci di superficie (p>0,635, n = 8) mentre nei pesci cavernicoli di Pachón il trattamento con gentamicina riduce significativamente l’espressione del hcrt, ripristinando i livelli di superficie. (Pachón trattato vs. non trattato, p<0,0001; Pachón trattato vs. non trattato in superficie, p>0,635, n = 8, F(1,28)=21,28).(F) L’intensità di fluorescenza per cellula ipotalamica HCRT-cellula non è stata alterata con il trattamento con gentamicina nei pesci di superficie, p=0,590, n = 4. Nei pesci cavernicoli di Pachón, i livelli di neuropeptidi HCRT sono significativamente più bassi dopo il trattamento con gentamicina (p<0.0001, n = 4; 2 vie ANOVA, F (1, 13)=0,0001 G. Il trattamento con gentamicina non ha alcun effetto sul numero totale di cellule HCRT in superficie o nei pesci cavernicoli di Pachón (p>0,494, n = 8, F (1, 13C)=0,4967).(H-K) Rappresentante 2 μm immagini confocali della regione ipotalamica dorsale nei pesci di superficie e pesci cavernicoli di Pachón immunocolori con HCRT (verde) e DAPI (bianco) (H) Controllo di superficie (I) Controllo di Pachón (J) Gentamicina di superficie K. Pachón gentamicina. Barra di scala = 50 μm.10.7554/eLife.32637.025Figure 6-source data 1.Chemical ablation of mechanosensory lateral line riduce i livelli di HCRT in Pachón cavefish.this source file contiene l’analisi degli effetti di ablazione linea laterale con gentamicina su espressione hcrt (Figura 6E), numero di celluleHCRT(Figura 6F),e livelli di fluorescenza HCRT (Figura 6G).Questo file sorgente contiene l’analisi degli effetti dell’ablazione laterale con gentamicina sull’espressione hcrt (Figura6E), il numero di cellule HCRT (Figura6F) e i livelli di fluorescenza HCRT (Figura6G).Questo file sorgente contiene l’analisi degli effetti dell’ablazione laterale con gentamicina sull’espressione hcrt (Figura6E), il numero di cellule HCRT (Figura6F) e i livelli di fluorescenza HCRT (Figura6G).

Figura 7 – dati fonte 1.La fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.la fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.la fame inibisce selettivamente i livelli di HCRT nei pesci cavernicoli.(A) La fame non influenza l’espressione hcrt nei pesci di superficie (p>0.832, n = 4) mentre l’espressione hcrt è significativamente ridotta nei pesci cavernicoli di Pachón (p >0.001, n = 4, ANOVA a 2 vie, F(1,13)=13,54)) (B) L’intensità della fluorescenza nelle cellule HCRT non è stata influenzata da 30 giorni di fame nei pesci di superficie (p>0,788, n = 4). Nei pesci cavernicoli di Pachón, il neuropeptide HCRT è stato significativamente ridotto in seguito alla fame (p<0,004, n = 4, 2 vie ANOVA, F(1,12)=10,17))(C) La fame non ha un effetto significativo sul numero totale di cellule HCRT-positive sia in superficie che nei pesci cavernicoli di Pachón (Superficie, p=0,452, n = 4; Pachón, p>0.979, n = 4, ANOVA a 2 vie, F(1,11)=3,65)) (D) Controllo di superficie (E) Controllo di Pachón (E) Controllo di superficie (F) Pachón affamato (G) Pachón affamato. Barra di scala = 50 μm.10.7554/eLife.32637.027Figure 7-source data 1.Starvation inibisce selettivamente i livelli di HCRT nei pesci cavernicoli. Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt (Figura 7A), sul numero di cellule HCRT (Figura7B) e sui livelli di fluorescenza HCRT (Figura7C).Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt(Figura 7A), il numero di cellule HCRT (Figura7B) e i livelli di fluorescenza HCRT (Figura7C).Questo file sorgente contiene analisi che quantificano gli effetti della fame sull’espressione hcrt(Figura 7A), il numero di cellule HCRT (Figura7B) e i livelli di fluorescenza HCRT (Figura7C).
Discussione
I pesci cavernicoli sono un modello unico per lo studio della regolazione neurale e genetica del sonno, soprattutto dal punto di vista evolutivo. Robuste differenze fenotipiche sono state osservate in molteplici popolazioni di pesci cavernicoli, ma i nostri risultati forniscono la prima prova di una regolazione alterata di un peptide neuromodulatore che si associa all’evoluzione della perdita di sonno. L’allineamento delle sequenze hcrt derivate dai pesci cavernicoli di superficie e di Pachón indicano che non ci sono differenze nelle sequenze genomiche all’interno delle regioni di codifica dei due morphs. I nostri risultati, tuttavia, rivelano differenze drammatiche nell’espressione hcrt e nel numero di neuroni tra pesci di superficie e pesci cavernicoli, aumentando la possibilità che la regolazione e lo sviluppo di hcrt sia alterato evolutivamente. Queste osservazioni sono in accordo con i risultati concomitanti che l’aumento dei livelli del fattore di trascrizione omeobox Lhx9 specifica un numero maggiore di neuroni HCRT nei pesci cavernicoli(Alie et al., 2018). Inoltre, le differenze acute nell’espressione hcrt tra pesci di superficie e pesci cavernicoli si verificano probabilmente a livello di cambiamenti negli esaltatori genomici o nella connettività neuronale, che influenzano il funzionamento dell’HCRT. Poiché i nostri risultati rivelano anche un aumento del numero di neuroni HCRT-positivi nei primi anni di sviluppo, è anche probabile che le differenze di sviluppo tra il cervello dei pesci di superficie e quello dei pesci cavernicoli siano alla base delle differenze nella funzione HCRT.
L’esame del numero di cellule del corpo in 6 dpf fry rivela un aumento dei neuroni HCRT-positivi nei pesci cavernicoli, indicando che le differenze HCRT sono presenti durante lo sviluppo precoce. In accordo con questi risultati, ampie differenze anatomiche nella struttura del proencefalo sono state precedentemente documentate tra pesci di superficie e pesci cavernicoli, incluso un ipotalamo espanso(Menuet et al., 2007). Un documento parallelo ha rivelato che i neuroni che esprimono il neuropeptide Y sono aumentati anche nei pesci cavernicoli(Alie et al., 2018). Come l’Hcrt, anche il Neuropeptide Y regola l’alimentazione e il sonno in diverse specie, suggerendo che i cambiamenti nella regolazione ipotalamica del sonno sono, almeno parzialmente, derivati dallo sviluppo e non limitati ai cambiamenti nella funzione Hcrt che abbiamo osservato(Chung et al., 2017; Luquet et al., 2005; Szentirmai e Krueger, 2006; Wu et al., 2003). Pertanto, è probabile che le differenze derivate dallo sviluppo del numero di neuroni HCRT positivi e dei circuiti neurali ipotalamici modificati contribuiscano alla perdita di sonno nei pesci cavernicoli.
Molteplici linee di evidenza qui presentate supportano un ruolo robusto per le differenze evolute nella funzione HCRT nell’evoluzione della perdita di sonno nei pesci cavernicoli di Pachón. L’inibizione farmacologica della segnalazione HCRT con tre diversi antagonisti HCRTR2 ha ripristinato il sonno nei pesci cavernicoli, suggerendo che la segnalazione HCRT è necessaria per almeno una parte della perdita di sonno nei pesci cavernicoli. Gli antagonisti utilizzati non sono stati convalidati nei pesci zebra o A. mexicanus, e quindi è possibile che effetti non specifici contribuiscano al fenotipo del sonno. Il lavoro futuro che caratterizzerà questi inibitori farmacologici in A. mexicanus, sarà utile per convalidare i fenotipi osservati in questo manoscritto. A complemento degli esperimenti farmacologici, l’abbattimento mirato di hcrt con morfolinos, o il silenziamento genetico dei neuroni HCRT promuovono il sonno nei pesci cavernicoli di Pachón senza influenzare significativamente il sonno nei pesci di superficie. Mentre le manipolazioni che inibiscono la segnalazione HCRT hanno potenti effetti sul sonno dei pesci cavernicoli, non esclude un possibile ruolo per la modulazione HCRT del sonno nei pesci di superficie. Tutte e tre le manipolazioni impiegate sono suscettibili di disturbare solo parzialmente la segnalazione HCRTR, ed è probabile che la completa inibizione della segnalazione HCRTR aumenti il sonno nei pesci di superficie. In effetti, l’ipocretina è altamente conservata e ha dimostrato di consolidare la veglia in specie che vanno dal pesce zebra all’uomo(Appelbaum et al., 2009; Chemelli et al., 1999; Mileykovskiy et al., 2005; Prober et al., 2006). Inoltre, il sistema dell’ipocretina è stato caratterizzato in dettaglio nel pesce zebra e funge da mediatore chiave dell’eccitazione(Appelbaum et al., 2009; Elbaz et al., 2012; Kaslin et al., 2004; Prober et al., 2006). I risultati qui presentati estendono gli studi sui modelli dei mammiferi e dei pesci zebra, e suggeriscono che la regolazione della segnalazione HCRT può essere soggetta a pressione evolutiva, e la implicano come un potenziale ‘punto caldo’ per la variazione del sonno in tutto il regno animale.
Mentre i processi neurali che regolano l’attività HCRT non sono pienamente compresi, crescenti evidenze suggeriscono che questi neuroni integrano la regolazione sonno-veglia con le risposte agli stimoli sensoriali(Appelbaum et al., 2007; Mileykovskiy et al., 2005; Woods et al., 2014). Nei topi, i neuroni HCRT sono attivati transitoriamente dal suono, dall’alimentazione e dall’esplorazione della gabbia, suggerendo che i neuroni HCRT sono generalmente regolati da stimoli esterni(Mileykovskiy et al., 2005). Inoltre, nei pesci zebra, l’attivazione dei neuroni HCRT è associata a periodi di veglia e di sovraespressione dell’HCRT migliora la risposta locomotoria a diversi stimoli sensoriali, mentre l’ablazione dei neuroni HCRT riduce la risposta agli stimoli sonori(Elbaz et al., 2012; Naumann et al., 2010; Prober et al., 2006; Woods et al., 2014), suggerendo che i neuroni HCRT mediano la risposta sensoriale e il comportamento sonno-veglia. I nostri risultati rivelano che l’ablazione della linea laterale nei pesci cavernicoli riduce la trascrizione hcrt e l’abbondanza di neuropeptidi HCRT a livelli indistinguibili dai loro conspecifici dei pesci di superficie, indicando che l’input della linea laterale è un potente regolatore della produzione di hcrt nei pesci cavernicoli. Questi risultati supportano l’idea che l’evoluzione dei sistemi sensoriali influenza drammaticamente i processi cerebrali centrali che regolano il comportamento, e forniscono un ulteriore supporto che i neuroni HCRT integrano gli stimoli sensoriali per modulare il sonno e l’eccitazione.
Mentre una piena comprensione dei circuiti neurali che regolano i neuroni HCRT-positivi non è stata determinata, i neuroni HCRT inviano proiezioni a numerose aree coinvolte nella regolazione del comportamento, tra cui l’ipotalamo periventricolare, il rafe e i nuclei talamici(Panula, 2010). Le prove suggeriscono che il ruolo di risveglio-consolidamento dei neuroni HCRT dipende dalla segnalazione della noradrenalina, e l’attivazione optogenetica dei neuroni HCRT attiva il locus coeruleus(Singh et al., 2015), aumentando la possibilità che l’attivazione di questo percorso di eccitazione è migliorata nei pesci cavernicoli di Pachón. I livelli di noradrenalina sono elevati nel cervello dei pesci cavernicoli e il trattamento dei pesci cavernicoli con l’inibitore β-adrenergico propranololo ripristina il sonno nei pesci cavernicoli senza influenzare il sonno nei pesci di superficie.(Bilandžija et al., 2013; Duboué et al., 2012). Pertanto, è possibile che le differenze nella segnalazione della norepinefrina contribuiscano alla perdita di sonno nei pesci cavernicoli dipendente dall’hcrt. Ulteriori indagini sugli effetti sinergici della noradrenalina e dell’hcrt, e sugli effetti della loro presunta interazione sulla regolazione dell’alimentazione e della mediazione sensoriale dell’hcrt, saranno fondamentali per comprendere come i cambiamenti del sonno possano essere guidati da alterazioni dell’ambiente.
La scoperta che l’ablazione della linea laterale o la fame sopprimono la trascrizione hcrt rivela un ruolo per la plasticità della segnalazione HCRT in risposta alle perturbazioni ambientali. Oltre al suo ruolo nella regolazione del sonno-veglia, i neuroni hcrt regolano l’alimentazione e la funzione metabolica, aumentando la possibilità che i neuroni HCRT siano integratori del sonno e dello stato metabolico. I risultati precedenti rivelano che l’iniezione di peptide HCRT aumenta il consumo di cibo nei pesci cavernicoli, suggerendo il comportamento consumatorio indotto da HCRT nei mammiferi è conservato in A. mexicanus(Penney e Volkoff, 2014; Wall e Volkoff, 2013). Studi sui mammiferi e sui pesci zebra suggeriscono che i neuroni HCRT sono regolati dall’ormone peptidico adiposo Leptina(Leinninger et al., 2011; Levitas-Djerbi et al., 2015). I livelli di adiposità nei pesci cavernicoli sono elevati rispetto ai pesci di superficie(Aspiras et al., 2015), ed è possibile che la fame prolungata riduca i livelli di leptina, inibendo così l’espressione hcrt per promuovere il sonno nei pesci cavernicoli. Inoltre, il sistema di linee laterali è intimamente legato al comportamento alimentare dei pesci, e sono state identificate differenze evolute nel sistema di linee laterali tra i pesci di superficie e i pesci cavernicoli(Yoshizawa et al., 2012), forse includendo una maggiore modulazione dei neuroni hcrt. Questi risultati aumentano la possibilità di utilizzare i pesci cavernicoli come modello per esaminare l’asse Leptina-HCRT e, più in generale, le interazioni tra sonno, elaborazione sensoriale e funzione metabolica.
I nostri risultati esaminano specificamente i meccanismi neurali alla base della perdita di sonno nelle popolazioni di caverne di Pachón. Sia i dati morfologici che genomici suggeriscono che i pesci cavernicoli di Pachón sono una delle più antiche e troglomorfiche delle 29 popolazioni di pesci cavernicoli A. mexicanus (Bradicet al., 2012; Dowling et al., 2002; Ornelas-García et al., 2008; Strecker et al., 2003). Abbiamo anche dimostrato una convergenza evolutiva sulla perdita di sonno in altre popolazioni di pesci cavernicoli, tra cui le popolazioni di Molino, Tinaja e Chica(Jaggard et al., 2017). Tuttavia, l’ablazione della linea laterale non ha alcun effetto sul sonno nelle popolazioni di Molino, Tinaja e Chica, suggerendo un meccanismo neurale distinto alla base della perdita di sonno tra i pesci cavernicoli di Pachón e le altre popolazioni di pesci cavernicoli analizzate (Jaggardet al., 2017). Studi futuri riveleranno se il miglioramento della funzione HCRT rappresenta un meccanismo conservato per la perdita di sonno, o se la perdita di sonno in altre popolazioni di pesci è indipendente dall’HCRT.
Presi nel loro insieme, questi studi sollevano la possibilità che le differenze evolute nella funzione HCRT contribuiscano all’evoluzione della perdita di sonno nei pesci cavernicoli. Il sonno è altamente pleiotropico ed è probabile che molti fattori genetici aggiuntivi contribuiscano alle differenze di sonno tra i pesci cavernicoli. I pesci zebra forniscono un modello genetico comparabile che ha coinvolto molti nuovi geni e modulatori nella regolazione del sonno, tra cui l’istamina, l’ormone di rilascio della corticoptropina e la melatonina(Appelbaum et al., 2009; Chiu et al., 2016; Kaslin et al., 2004; Zhdanova et al., 2001). I futuri lavori che esamineranno le differenze funzionali di questi geni potrebbero fornire un meccanismo per identificare ulteriori geni coinvolti nell’evoluzione del sonno. Inoltre, l’interfertilità tra le popolazioni di superficie e le caverne di A. mexicanus permette la mappatura dei QTL e il potenziale per identificare nuovi regolatori genetici del sonno(Gross, 2012; Jeffery, 2009). L’identificazione di differenze evolute nell’HCRT che probabilmente regolano il sonno fornisce un punto di partenza per chiarire le basi genetiche associate all’evoluzione di comportamenti complessi.
Materiali e metodi
Manutenzione e allevamento del pesce
L’allevamento degli animali è stato effettuato come descritto in precedenza(Borowsky, 2008b) e tutti i protocolli sono stati approvati dalla IACUC Florida Atlantic University (Protocolli A15-32 e A16-04). I pesci sono stati alloggiati nelle strutture di base della Florida Atlantic University a 23 ± 1°C a temperatura costante dell’acqua per tutta la durata dell’allevamento per gli esperimenti sul comportamento (Borowsky,2008b). Le luci sono stati tenuti su un 14:10 hr luce-buio ciclo di luce-buio che è rimasto costante per tutta la vita dell’animale. L’intensità della luce è stata mantenuta tra i 25 e i 40 Lux sia per gli esperimenti di allevamento che di comportamento. Tutti i pesci utilizzati per gli esperimenti sono stati allevati fino all’età adulta e alloggiati in vasche standard da 18-37L. Pesci adulti sono stati alimentati con una dieta mista di vermi neri a sazietà due volte al giorno al tempo zeitgeber (ZT) 2 e ZT12, (Aquatic Foods, Fresno, CA,) e cibo standard pesce fiocco durante i periodi in cui i pesci non sono stati utilizzati per esperimenti di comportamento o di allevamento (Tetramine Pro).
Comportamento nel sonno
I pesci adulti sono stati registrati in condizioni standard in vasche da 10 litri con partizioni personalizzate che hanno permesso di alloggiare cinque pesci (2 litri/pesce) in ogni vasca come descritto in precedenza(Yoshizawa et al., 2015). Le camere di registrazione sono state illuminate con una sorgente LED IR progettata su misura (Infrared 850 nm 5050 LED Strip Light, luci ambientali). Dopo un periodo di acclimatazione di 4-5 giorni, il comportamento è stato registrato per 24 ore a partire da ZT0-ZT2. I video sono stati registrati a 15 fotogrammi al secondo utilizzando una webcam USB (LifeCam Studio 1080 p HD Webcam, Microsoft) dotata di un obiettivo zoom (Zoom 7000, Navitar). Un filtro passa-alto IR (Edmund Optics Worldwide) è stato posizionato tra la telecamera e l’obiettivo per bloccare la luce visibile. Per le registrazioni dei pesci larvali, i singoli pesci sono stati collocati in 12 piastre di coltura dei tessuti a pozzetto (BD Biosciences). Le camere di registrazione sono state illuminate con una striscia luminosa a LED IR progettata su misura e posizionata sotto la piattaforma di registrazione. I pesci sono stati autorizzati ad acclimatarsi per 24 ore prima di iniziare le registrazioni comportamentali. I video sono stati registrati utilizzando Virtualdub, un software di cattura video (versione 1.10.4) e sono stati successivamente elaborati con Ethovision XT 9.0 (Noldus, IT). La temperatura dell’acqua e la chimica dell’acqua sono state monitorate durante le registrazioni e mantenute in tutti i casi a condizioni standard. Il tracking Ethovision è stato impostato come descritto in precedenza(Yoshizawa et al., 2015). I dati sono stati poi elaborati utilizzando script Perl (v5.22.0, sviluppato in loco) e macro Excel (Microsoft)(Yoshizawa et al., 2015). Questi dati sono stati utilizzati per calcolare le informazioni sul sonno trovando attacchi di immobilità di 60 s e oltre, che sono altamente correlati con l’aumento della soglia di eccitazione, uno dei segni distintivi del sonno(Yoshizawa et al., 2015). Per gli studi sul trattamento farmacologico, ai pesci sono stati concessi normali periodi di acclimatazione, seguiti da 24 ore di registrazione della linea di base. A ZT0 i pesci sono stati trattati con il solvente di controllo dimetilsolfossido di zolfo (0,1% DMSO) o TCSOX229 (Tocris), EMPA (Tocris), Suvorexant (Adooq), o YNT-185 (Adooq)(Hoyer et al., 2013; Kummangal et al., 2013; Malherbe et al., 2009; Plaza-Zabala et al., 2012) diluito ad una concentrazione finale di 1-30 µM in ogni camera di registrazione e il comportamento è stato registrato per 24 ore.
Procedure di iniezione
La sequenza di morfolino hcrt 5′-TGGGGGCTTGGGTGTGTGTGATCACCTGTCAT-3′ è stata progettata (Gene Tools, LLC) sulla base della sequenza disponibile ENSAMXG0000000000473 (Ensembl). L’hcrt-MO si rivolge ai primi 25 bp del telaio di lettura aperto hcrt (ORF) per bloccare la traslazione attraverso l’ostacolo sterico. Le iniezioni di controllo sono state eseguite utilizzando una sequenza standard criptata 5’CCTCTTACCTTACCTCAGTTACAATTTATA-3′ (Gene Tools, LLC). Embrioni sono stati iniettati in 1-2 cellule con un volume di 1 nl utilizzando un capillare di borosilicato tirato con un picoinjector PLI-A100 (Warner Instruments) per una concentrazione finale di 0,2 mM morfolino, in conformità con i metodi precedentemente pubblicati (Bilandžija etal., 2013; Gross et al., 2009 ). La sopravvivenza di tutti gli embrioni è stata monitorata ogni 6 ore per le prime 96 ore di sviluppo fino a quando il comportamento è stato registrato nelle successive 24 ore hcrt-Gal4:UAS-BoTx-BLC-GFP sono state effettuate le seguenti iniezioni: Il DNA plasmidico per il Gal4 e l’UAS sono stati coniati in embrioni a 1-4 stadi cellulari utilizzando un capillare di borosilicato tirato con picoinjector PLI-A100 (Warner Instruments) alla concentrazione di 25 ng/µL. Tol2 mRNA è stato coniato nel cocktail ad una concentrazione di 25 ng/µL. UAS-BoTx-BLC-GFP è stato iniettato da solo a 25 ng/µL per servire come gruppo di controllo iniettato sia per i pesci cavernicoli di superficie che per quelli di Pachón. Tutti i pesci iniettati sono stati portati a 25 dpf in condizioni standard, quando sono state effettuate le registrazioni comportamentali. I cervelli di tutti i pesci registrati per il comportamento sono stati sezionati ed elaborati per immunoistochimica al fine di quantificare da GFP il numero di cellule silenziate esprimendo hcrt-Gal4:UAS-BoTx-BLC-GFP.
Etichettatura del colorante vitale e l’ablazione della linea laterale
I pesci sono stati trattati con gentamicina solfato allo 0,002% come descritto in precedenza (Sigma Aldrich, Carlsbad, CA 1405-41-0) (Van Trumpet al., 2010). A seguito di registrazione del sonno di base e di imaging neuromast, i pesci sono stati immersi in gentamicina per 24 ore. Dopo il trattamento, è stato somministrato un cambio d’acqua completo e il comportamento è stato nuovamente registrato per 24 ore. I pesci trattati con gentamicina sono stati alloggiati in vasche separate per almeno 1 mese dopo il trattamento, al fine di evitare la contaminazione. La ricrescita della linea laterale è stata misurata con la colorazione DASPEI due settimane dopo l’ablazione per confermare che non ci sono stati effetti a lungo termine dei trattamenti di ablazione.
Analisi della sequenza
Per confrontare Hypocretin/Orexin (HCRT), abbiamo allineato le sequenze proteiche di adesione di A. mexicanus pesci di superficie (SRR639083.116136.2, SRA) e il pesce cavernicolo di Pachón (ENSAMXP0000000000478) a HCRT ortologo nel pesce zebra (ENSDARP00000095322), Medaka (ENSORLP0000000004866), Tetraodon (ENSTNIP0000000014660), topo (ENSMUSP0000000057578) e umano (ENSP00000293330). L’allineamento delle proteine, l’albero di giunzione vicino (cladogramma) e le analisi delle sequenze sono state eseguite con Clustal Omega (v.1.2.1, EMBL-EBI,[Sievers et al., 2011]). I domini HCRT (PF02072/IPR001704) sono stati determinati utilizzando il browser del genoma Ensembl (v.83, EMBL-EBI/Sanger) e PFam/Interpro (v.28.0, EMBL-EBI).
PCR quantitativa (qPCR)
Per misurare i livelli di mRNA hcrt, sono stati estratti cervelli interi di pesci di uno-due anni subito dopo la registrazione del comportamento (ZT2). Dopo l’estrazione, i singoli cervelli sono stati congelati e omogeneizzati in trizolo (QIAGEN, Valencia, CA). L’RNA è stato estratto con un RNeasy Mini Kit (QIAGEN, Valencia,CA). Tutti i campioni di RNA sono stati standardizzati a concentrazioni di 10 ng/µL e la sintesi del cDNA è stata effettuata utilizzando iScript (BioRad, Redmond, WA). RT-qPCR è stata effettuata utilizzando SsoAdvanced Universal SYBR Green Supermix (BioRad, Redmond, WA) con DNasi per eliminare la contaminazione genomica (QIAGEN, Valencia, CA). I primer PCR sono stati utilizzati ad una temperatura di ricottura di 53,3°C; le loro sequenze seguono: hcrt forward 5′-CAT-CTC-CTC-CTC-AGC-CAAA-GGT-TT-3′, hcrt reverse 5′ -TAG-AGT-CCG-TGC-TGC-TGT-TAC-ACC-3′. Gapdh è stato usato come gene di controllo, ed è stato amplificato con il seguente set di primer: forward 5′-TGT-GTC-CGT-GGT-GGT-GGA-TCT-TA -3′, reverse 5′-TGT-CGC-CGC-CAAA-TGA-AGT-CAG-AG-3′. I primer sono stati progettati per abbracciare un limite di esoni per eliminare il potenziale di contaminazione genomica e un’analisi della curva di fusione è stata eseguita dopo l’amplificazione per confermare un singolo amplicone per ogni gene target. Il seguente protocollo qPCR è stato eseguito su un Bio Rad CFX96 con un termociclatore C1000: 95,0°C per 3 minuti seguito da una piastra letta a 95,0°C per 10 s a 53,3°C per 30 s seguita da una piastra letta ripetuta 39 volte. l’efficienza qPCR è stata calcolata al 100% come riportato dal software CFX Manager 3.1, e l’analisi della curva di fusione ha mostrato un singolo picco per ogni gene utilizzato in questo studio. Tutti i campioni sono stati compilati nello studio del gene Bio Rad CFX manager (versione 3.1) per tener conto della calibrazione inter-run. Tutti i campioni sono stati normalizzati a uno (rispetto ai controlli dei pesci di superficie).
Immunoistochimica
In seguito all’eutanasia nella MS-222 (Sigma Aldrich, Carlsbad, CA) e nell’acqua ghiacciata, i cervelli sono stati immediatamente sezionati dagli adulti in PBS ghiacciata e fissati durante la notte in Paraformaldeide al 4% di Paraformaldeide/1x PBS (PFA). I cervelli degli adulti sono stati poi posti in saccarosio al 20% per la crioprotezione durante la notte o fino a quando il cervello non è affondato sul fondo del pozzo(Kaslin et al., 2004). Cervelli interi sono stati poi congelati in flash e montati in composto OCT (23-730-571 Fisher scientifico) per il sezionamento. I cervelli interi sono stati sezionati in serie in fette da 50 µm, tutte le fette sono state fatte galleggiare in PBS per risciacquare la soluzione di incorporazione. Sezioni di fette sono stati poi lavati in 0,5% Triton-X 100/PBS (PBT) per 3 × 15 min e co-incubato in 0,5% PBT e 2% di siero albumina bovina (BSA) (Sigma) con anticorpo primario anti-ORX-A 1:2000 (RRID: AB_2117647EMD Millipore) durante la notte a 4 ° C in. Le fette sono state risciacquate nuovamente in PBT 0,5%, 3X per 15 min e poste in anticorpo secondario 1:600 (Capra anti-coniglio 488; Life Technologies) per 90 min a temperatura ambiente. Le fette sono state montate su vetrini in Vectashield con DAPI (VectorLabs) e riprese al microscopio confocale Nikon A1. Le larve intere sono state fissate durante la notte in PFA al 4%, sciacquate 3 × 15 min in PBT allo 0,5%, poi posizionate in PBT allo 0,5% con BSA al 2% e anticorpo primario anti-ORX-A 1:2000 durante la notte. Dopo il risciacquo 3 × 15 min 0.5% PBT, le larve sono state poste in anticorpo secondario 1:600. Le larve sono state poi collocate in Vectashield con DAPI fino a quando non sono state montate in agarosio a bassa temperatura di fusione al 2% (Sigma Aldrich, Carlsbad, CA) per l’imaging. Tutti i campioni sono stati ripresi in sezioni di 2 μm e sono presentati come la proiezione Z-stack attraverso l’intero cervello. Per la quantificazione dei livelli di HCRT, tutte le fette ipotalamiche sono stati ripresi in 2 sezioni μm, fuse in un unico Z-stack come fluorescenza massima, e la fluorescenza totale del cervello è stata determinata creando ROI individuali per ogni cellula che esprime HCRT.
Statistiche
Sono stati effettuati test ANOVA a due vie per testare gli effetti dei paradigmi farmacologici e della fame tra diversi gruppi e popolazioni sul comportamento. Ciascuno di essi è stato modellato in funzione del genotipo (Surface e Pachón) e del genotipo per interazione di trattamento (TCS, gentamicina, o fame, rispettivamente). Significato per tutti i test è stato fissato a p<0,05. Quando il test ANOVA ha rilevato la significatività, è stato effettuato il confronto multiplo Holm-Sidak post-test per correggere il numero di confronti. Per il confronto di due gruppi di riferimento, sono stati effettuati test t non parametrici per verificare la significatività. Ogni esperimento è stato ripetuto indipendentemente almeno tre volte. Tutte le repliche erano repliche biologiche eseguite indipendentemente l’uno dall’altro. Nessun dato è stato escluso, e nessun outlier statistico è stato rimosso. Tutte le analisi statistiche sono state effettuate utilizzando SPSS (IBM, 22.0) o il software InStat (GraphPad 6.0). Le analisi di potenza sono state effettuate per garantire che avessimo un N sufficiente per rilevare differenze significative ad un minimo dell’80% di potenza alla soglia dello 0,05 utilizzando Graphpad InStat.
References
- Alie A, Devos L, Torres-Pas J, Prunier L, Boulet F, Blin M, Elipot Y, Reteaux S. Developmental evolution of the forebrain in cavefish: from natural variations in neuropeptides to behavior. eLife. 2018; 7DOI | PubMed
- Allada R, Siegel JM. Unearthing the phylogenetic roots of sleep. Current Biology. 2008; 18:R670-R679. DOI | PubMed
- Appelbaum L, Skariah G, Mourrain P, Mignot E. Comparative expression of p2x receptors and ecto-nucleoside triphosphate diphosphohydrolase 3 in hypocretin and sensory neurons in zebrafish. Brain Research. 2007; 1174:66-75. DOI | PubMed
- Appelbaum L, Wang GX, Maro GS, Mori R, Tovin A, Marin W, Yokogawa T, Kawakami K, Smith SJ, Gothilf Y, Mignot E, Mourrain P. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish. PNAS. 2009; 106:21942-21947. DOI | PubMed
- Asakawa K, Kawakami K. Targeted gene expression by the Gal4-UAS system in zebrafish. Development, Growth & Differentiation. 2008; 50:391-399. DOI | PubMed
- Aspiras AC, Rohner N, Martineau B, Borowsky RL, Tabin CJ. Melanocortin 4 receptor mutations contribute to the adaptation of cavefish to nutrient-poor conditions. PNAS. 2015; 112:9668-9673. DOI | PubMed
- Betschart C, Hintermann S, Behnke D, Cotesta S, Fendt M, Gee CE, Jacobson LH, Laue G, Ofner S, Chaudhari V, Badiger S, Pandit C, Wagner J, Hoyer D. Identification of a novel series of orexin receptor antagonists with a distinct effect on sleep architecture for the treatment of insomnia. Journal of Medicinal Chemistry. 2013; 56:7590-7607. DOI | PubMed
- Bilandžija H, Ma L, Parkhurst A, Jeffery WR. A potential benefit of albinism in Astyanax cavefish: downregulation of the oca2 gene increases tyrosine and catecholamine levels as an alternative to melanin synthesis. PLoS One. 2013; 8DOI | PubMed
- Bill BR, Petzold AM, Clark KJ, Schimmenti LA, Ekker SC. A primer for morpholino use in zebrafish. Zebrafish. 2009; 6:69-77. DOI | PubMed
- Borowsky R. Restoring sight in blind cavefish. Current Biology. 2008a; 18:R23-R24. DOI | PubMed
- Borowsky R. Handling Astyanax mexicanus Eggs and Fry. Cold Spring Harbor Protocols. 2008b; 2008DOI | PubMed
- Bradic M, Beerli P, García-de León FJ, Esquivel-Bobadilla S, Borowsky RL. Gene flow and population structure in the Mexican blind cavefish complex (Astyanax mexicanus). BMC Evolutionary Biology. 2012; 12DOI | PubMed
- Brand AH, Perrimon N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 1993; 118:401-415. PubMed
- Brunger AT, Jin R, Breidenbach MA. Highly specific interactions between botulinum neurotoxins and synaptic vesicle proteins. Cellular and Molecular Life Sciences. 2008; 65:2296-2306. DOI | PubMed
- Campbell SS, Tobler I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience & Biobehavioral Reviews. 1984; 8:269-300. DOI | PubMed
- Capellini I, Barton RA, McNamara P, Preston BT, Nunn CL. Phylogenetic analysis of the ecology and evolution of mammalian sleep. Evolution. 2008; 62:1764-1776. DOI | PubMed
- Chemelli RM, Willie JT, Sinton CM, Elmquist JK, Scammell T, Lee C, Richardson JA, Williams SC, Xiong Y, Kisanuki Y, Fitch TE, Nakazato M, Hammer RE, Saper CB, Yanagisawa M. Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation. Cell. 1999; 98:437-451. DOI | PubMed
- Chiu CN, Rihel J, Lee DA, Singh C, Mosser EA, Chen S, Sapin V, Pham U, Engle J, Niles BJ, Montz CJ, Chakravarthy S, Zimmerman S, Salehi-Ashtiani K, Vidal M, Schier AF, Prober DA. A zebrafish genetic screen identifies neuromedin u as a regulator of sleep/wake states. Neuron. 2016; 89:842-856. DOI | PubMed
- Chung BY, Ro J, Hutter SA, Miller KM, Guduguntla LS, Kondo S, Pletcher SD. Drosophila neuropeptide f signaling independently regulates feeding and sleep-wake behavior. Cell Reports. 2017; 19:2441-2450. DOI | PubMed
- Dowling TE, Martasian DP, Jeffery WR. Evidence for multiple genetic forms with similar eyeless phenotypes in the blind cavefish, Astyanax mexicanus. Molecular Biology and Evolution. 2002; 19:446-455. DOI | PubMed
- Duboué ER, Borowsky RL, Keene AC. β-adrenergic signaling regulates evolutionarily derived sleep loss in the Mexican cavefish. Brain, Behavior and Evolution. 2012; 80:233-243. DOI | PubMed
- Duboué ER, Keene AC, Borowsky RL. Evolutionary convergence on sleep loss in cavefish populations. Current Biology. 2011; 21:671-676. DOI | PubMed
- Elbaz I, Yelin-Bekerman L, Nicenboim J, Vatine G, Appelbaum L. Genetic ablation of hypocretin neurons alters behavioral state transitions in zebrafish. Journal of Neuroscience. 2012; 32:12961-12972. DOI | PubMed
- Elipot Y, Legendre L, Père S, Sohm F, Rétaux S. Astyanax transgenesis and husbandry: how cavefish enters the laboratory. Zebrafish. 2014; 11:291-299. DOI | PubMed
- Faraco JH, Appelbaum L, Marin W, Gaus SE, Mourrain P, Mignot E. Regulation of hypocretin (orexin) expression in embryonic zebrafish. Journal of Biological Chemistry. 2006; 281:29753-29761. DOI | PubMed
- Gross JB, Borowsky R, Tabin CJ. A novel role for Mc1r in the parallel evolution of depigmentation in independent populations of the cavefish Astyanax mexicanus. PLoS Genetics. 2009; 5DOI | PubMed
- Gross JB, Furterer A, Carlson BM, Stahl BA. An integrated transcriptome-wide analysis of cave and surface dwelling Astyanax mexicanus. PLoS One. 2013; 8DOI | PubMed
- Gross JB, Wilkens H. Albinism in phylogenetically and geographically distinct populations of Astyanax cavefish arises through the same loss-of-function Oca2 allele. Heredity. 2013; 111:122-130. DOI | PubMed
- Gross JB. The complex origin of Astyanax cavefish. BMC Evolutionary Biology. 2012; 12DOI | PubMed
- Hartmann EL. The Functions of Sleep. Yale University Press; 1973.
- Hoyer D, Dürst T, Fendt M, Jacobson LH, Betschart C, Hintermann S, Behnke D, Cotesta S, Laue G, Ofner S, Legangneux E, Gee CE. Distinct effects of IPSU and suvorexant on mouse sleep architecture. Frontiers in Neuroscience. 2013; 7DOI | PubMed
- Irukayama-Tomobe Y, Ogawa Y, Tominaga H, Ishikawa Y, Hosokawa N, Ambai S, Kawabe Y, Uchida S, Nakajima R, Saitoh T, Kanda T, Vogt K, Sakurai T, Nagase H, Yanagisawa M. Nonpeptide orexin type-2 receptor agonist ameliorates narcolepsy-cataplexy symptoms in mouse models. PNAS. 2017; 114:5731-5736. DOI | PubMed
- Jaggard J, Robinson BG, Stahl BA, Oh I, Masek P, Yoshizawa M, Keene AC. The lateral line confers evolutionarily derived sleep loss in the Mexican cavefish. The Journal of Experimental Biology. 2017; 220:284-293. DOI | PubMed
- Jeffery WR. Regressive evolution in Astyanax cavefish. Annual Review of Genetics. 2009; 43:25-47. DOI | PubMed
- Kaslin J, Nystedt JM, Ostergård M, Peitsaro N, Panula P. The orexin/hypocretin system in zebrafish is connected to the aminergic and cholinergic systems. Journal of Neuroscience. 2004; 24:2678-2689. DOI | PubMed
- Kawakami K, Shima A, Kawakami N. Identification of a functional transposase of the Tol2 element, an Ac-like element from the Japanese medaka fish, and its transposition in the zebrafish germ lineage. PNAS. 2000; 97:11403-11408. DOI | PubMed
- Keene A, Yoshizawa M, McGaugh S. Biology and Evolution of the Mexican Cavefish. Academic Press: New York; 2015.
- Kowalko JE, Rohner N, Rompani SB, Peterson BK, Linden TA, Yoshizawa M, Kay EH, Weber J, Hoekstra HE, Jeffery WR, Borowsky R, Tabin CJ. Loss of schooling behavior in cavefish through sight-dependent and sight-independent mechanisms. Current Biology. 2013; 23:1874-1883. DOI | PubMed
- Kulpa M, Bak-Coleman J, Coombs S. The lateral line is necessary for blind cavefish rheotaxis in non-uniform flow. Journal of Experimental Biology. 2015; 218:1603-1612. DOI | PubMed
- Kummangal BA, Kumar D, Mallick HN. Intracerebroventricular injection of orexin-2 receptor antagonist promotes REM sleep. Behavioural Brain Research. 2013; 237:59-62. DOI | PubMed
- Leinninger GM, Opland DM, Jo YH, Faouzi M, Christensen L, Cappellucci LA, Rhodes CJ, Gnegy ME, Becker JB, Pothos EN, Seasholtz AF, Thompson RC, Myers MG. Leptin action via neurotensin neurons controls orexin, the mesolimbic dopamine system and energy balance. Cell Metabolism. 2011; 14:313-323. DOI | PubMed
- Levitas-Djerbi T, Yelin-Bekerman L, Lerer-Goldshtein T, Appelbaum L. Hypothalamic leptin-neurotensin-hypocretin neuronal networks in zebrafish. Journal of Comparative Neurology. 2015; 523:831-848. DOI | PubMed
- Lin L, Faraco J, Li R, Kadotani H, Rogers W, Lin X, Qiu X, de Jong PJ, Nishino S, Mignot E. The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin (orexin) receptor 2 gene. Cell. 1999; 98:365-376. DOI | PubMed
- Luquet S, Perez FA, Hnasko TS, Palmiter RD. NPY/AgRP neurons are essential for feeding in adult mice but can be ablated in neonates. Science. 2005; 310:683-685. DOI | PubMed
- Malherbe P, Borroni E, Gobbi L, Knust H, Nettekoven M, Pinard E, Roche O, Rogers-Evans M, Wettstein JG, Moreau JL. Biochemical and behavioural characterization of EMPA, a novel high-affinity, selective antagonist for the OX(2) receptor. British Journal of Pharmacology. 2009; 156:1326-1341. DOI | PubMed
- McGaugh SE, Gross JB, Aken B, Blin M, Borowsky R, Chalopin D, Hinaux H, Jeffery WR, Keene A, Ma L, Minx P, Murphy D, O’Quin KE, Rétaux S, Rohner N, Searle SM, Stahl BA, Tabin C, Volff JN, Yoshizawa M, Warren WC. The cavefish genome reveals candidate genes for eye loss. Nature Communications. 2014; 5DOI | PubMed
- Menuet A, Alunni A, Joly JS, Jeffery WR, Rétaux S. Expanded expression of Sonic hedgehog in astyanax cavefish: multiple consequences on forebrain development and evolution. Development. 2007; 134:845-855. DOI | PubMed
- Mileykovskiy BY, Kiyashchenko LI, Siegel JM. Behavioral correlates of activity in identified hypocretin/orexin neurons. Neuron. 2005; 46:787-798. DOI | PubMed
- Mitchell RW, Russell WH, Elliott WR. Mexican Eyeless Characin Fishes, Genus Astyanax: Environment, Distribution, and Evolution. Texas Tech Press: Texas; 1977.
- Mochizuki T, Arrigoni E, Marcus JN, Clark EL, Yamamoto M, Honer M, Borroni E, Lowell BB, Elmquist JK, Scammell TE. Orexin receptor 2 expression in the posterior hypothalamus rescues sleepiness in narcoleptic mice. PNAS. 2011; 108:4471-4476. DOI | PubMed
- Musiek ES, Xiong DD, Holtzman DM. Sleep, circadian rhythms, and the pathogenesis of Alzheimer disease. Experimental & Molecular Medicine. 2015; 47DOI | PubMed
- Nagahara T, Saitoh T, Kutsumura N, Irukayama-Tomobe Y, Ogawa Y, Kuroda D, Gouda H, Kumagai H, Fujii H, Yanagisawa M, Nagase H. Design and synthesis of non-peptide, selective orexin receptor 2 Agonists. Journal of Medicinal Chemistry. 2015; 58:7931-7937. DOI | PubMed
- Naumann EA, Kampff AR, Prober DA, Schier AF, Engert F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 2010; 13:513-520. DOI | PubMed
- Ornelas-García CP, Domínguez-Domínguez O, Doadrio I. Evolutionary history of the fish genus Astyanax Baird & Girard (1854) (Actinopterygii, Characidae) in Mesoamerica reveals multiple morphological homoplasies. BMC Evolutionary Biology. 2008; 8DOI | PubMed
- Panula P. Acta Physiologica. 2010.
- Penney CC, Volkoff H. Peripheral injections of cholecystokinin, apelin, ghrelin and orexin in cavefish (Astyanax fasciatus mexicanus): effects on feeding and on the brain expression levels of tyrosine hydroxylase, mechanistic target of rapamycin and appetite-related hormones. General and Comparative Endocrinology. 2014; 196:34-40. DOI | PubMed
- Plaza-Zabala A, Flores Á, Maldonado R, Berrendero F. Hypocretin/orexin signaling in the hypothalamic paraventricular nucleus is essential for the expression of nicotine withdrawal. Biological Psychiatry. 2012; 71:214-223. DOI | PubMed
- Prober DA, Rihel J, Onah AA, Sung RJ, Schier AF. Hypocretin/orexin overexpression induces an insomnia-like phenotype in zebrafish. Journal of Neuroscience. 2006; 26:13400-13410. DOI | PubMed
- Protas ME, Hersey C, Kochanek D, Zhou Y, Wilkens H, Jeffery WR, Zon LI, Borowsky R, Tabin CJ. Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics. 2006; 38:107-111. DOI | PubMed
- Rihel J, Prober DA, Arvanites A, Lam K, Zimmerman S, Jang S, Haggarty SJ, Kokel D, Rubin LL, Peterson RT, Schier AF. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 2010; 327:348-351. DOI | PubMed
- Scheer N, Campos-Ortega JA. Use of the Gal4-UAS technique for targeted gene expression in the zebrafish. Mechanisms of Development. 1999; 80:153-158. DOI | PubMed
- Scott EK, Mason L, Arrenberg AB, Ziv L, Gosse NJ, Xiao T, Chi NC, Asakawa K, Kawakami K, Baier H. Targeting neural circuitry in zebrafish using GAL4 enhancer trapping. Nature Methods. 2007; 4:323-326. DOI | PubMed
- Siegel JM. Clues to the functions of mammalian sleep. Nature. 2005; 437:1264-1271. DOI | PubMed
- Sievers F, Wilm A, Dineen D, Gibson TJ, Karplus K, Li W, Lopez R, McWilliam H, Remmert M, Söding J, Thompson JD, Higgins DG. Fast, scalable generation of high-quality protein multiple sequence alignments using Clustal Omega. Molecular Systems Biology. 2011; 7DOI | PubMed
- Singh C, Oikonomou G, Prober DA. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. eLife. 2015; 4DOI
- Strecker U, Bernatchez L, Wilkens H. Genetic divergence between cave and surface populations of Astyanax in Mexico (Characidae, Teleostei). Molecular Ecology. 2003; 12:699-710. DOI | PubMed
- Szentirmai E, Krueger JM. Central administration of neuropeptide Y induces wakefulness in rats. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2006; 291:R473-R480. DOI | PubMed
- Tsujino N, Sakurai T. Role of orexin in modulating arousal, feeding, and motivation. Frontiers in Behavioral Neuroscience. 2013; 7DOI | PubMed
- Van Trump WJ, Coombs S, Duncan K, McHenry MJ. Gentamicin is ototoxic to all hair cells in the fish lateral line system. Hearing Research. 2010; 261:42-50. DOI | PubMed
- Wall A, Volkoff H. Effects of fasting and feeding on the brain mRNA expressions of orexin, tyrosine hydroxylase (TH), PYY and CCK in the Mexican blind cavefish (Astyanax fasciatus mexicanus). General and Comparative Endocrinology. 2013; 183:44-52. DOI | PubMed
- Wong KK, Ng SY, Lee LT, Ng HK, Chow BK. Orexins and their receptors from fish to mammals: a comparative approach. General and Comparative Endocrinology. 2011; 171:124-130. DOI | PubMed
- Woods IG, Schoppik D, Shi VJ, Zimmerman S, Coleman HA, Greenwood J, Soucy ER, Schier AF. Neuropeptidergic signaling partitions arousal behaviors in zebrafish. Journal of Neuroscience. 2014; 34:3142-3160. DOI | PubMed
- Wu Q, Wen T, Lee G, Park JH, Cai HN, Shen P. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 2003; 39:147-161. DOI | PubMed
- Yokobori E, Kojima K, Azuma M, Kang KS, Maejima S, Uchiyama M, Matsuda K. Stimulatory effect of intracerebroventricular administration of orexin A on food intake in the zebrafish, Danio rerio. Peptides. 2011; 32:1357-1362. DOI | PubMed
- Yokogawa T, Marin W, Faraco J, Pézeron G, Appelbaum L, Zhang J, Rosa F, Mourrain P, Mignot E. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biology. 2007; 5DOI | PubMed
- Yoshizawa M, Goricki S, Soares D, Jeffery WR. Evolution of a behavioral shift mediated by superficial neuromasts helps cavefish find food in darkness. Current Biology. 2010; 20:1631-1636. DOI | PubMed
- Yoshizawa M, Robinson BG, Duboué ER, Masek P, Jaggard JB, O’Quin KE, Borowsky RL, Jeffery WR, Keene AC. Distinct genetic architecture underlies the emergence of sleep loss and prey-seeking behavior in the Mexican cavefish. BMC Biology. 2015; 13DOI | PubMed
- Yoshizawa M, Yamamoto Y, O’Quin KE, Jeffery WR. Evolution of an adaptive behavior and its sensory receptors promotes eye regression in blind cavefish. BMC Biology. 2012; 10DOI | PubMed
- Zhdanova IV, Wang SY, Leclair OU, Danilova NP. Melatonin promotes sleep-like state in zebrafish. Brain Research. 2001; 903:263-268. DOI | PubMed
Fonte
Jaggard JB, Stahl BA, Lloyd E, Prober DA, Duboue ER, et al. () Hypocretin underlies the evolution of sleep loss in the Mexican cavefish. eLife 7e32637. https://doi.org/10.7554/eLife.32637





