Introduzione
Le lesioni al cervello innescano una cascata di processi degenerativi e protettivi legati alla plasticità. La degenerazione della materia grigia a distanza e la perdita di connettività anatomica delle aree di materia grigia non direttamente interessate dalla lesione sono conseguenze anatomiche comuni di una lesione (Catani e ffytche, 2005; Zaczek et al., 1980). Inoltre, l’estensione della disconnessione funzionale delle regioni intatte è associata al grado di compromissione comportamentale a seguito di una lesione (Corbetta et al., 2005; He et al., 2007) anche se le aree rimangono strutturalmente connesse (van Meer et al., 2010). Al contrario, alcune aree cerebrali si adattano alterando i loro modelli di connettività e aumentando le loro connessioni con altre aree spesso non interessate (Yogarajah et al., 2010). È quindi importante essere in grado di prevedere le aree che subiranno una relativa disconnessione funzionale a seguito di una lesione, e di prevedere quali aree possono adattarsi funzionalmente al fine di identificare le potenziali vie per guidare la plasticità adattiva. Attualmente, non esiste un modo quantitativo per prevedere come le aree cerebrali non lesionate si adatteranno alla lesione altrove.
Il recupero a seguito di una lesione cerebrale è altamente variabile e avviene per fasi. Molto recupero si verifica nelle prime settimane dopo una lesione, ma i miglioramenti funzionali possono continuare fino a molto più tardi (Berthier et al., 2011; Smania et al., 2010). Studi sui roditori hanno dimostrato che le conseguenze microstrutturali di un danno cerebrale possono variare drasticamente in tempi diversi a seguito di un trauma, il che potrebbe avere gravi implicazioni per le potenziali strategie di trattamento (Hoskison et al., 2009). Tuttavia, i modelli animali di piccole dimensioni di lesioni cerebrali non sono ottimali per indagare i cambiamenti plastici cronici, a causa della breve durata della vita dei roditori che porta a una conflazione della plasticità della lesione e dello sviluppo neurologico o dell’invecchiamento. Negli studi sull’uomo, le scansioni pre-lesione sono rare e sono per lo più disponibili in pazienti con anomalie cerebrali preesistenti, come i pazienti affetti da epilessia. Negli studi su esseri umani con lesioni cerebrali, la presenza di una possibile patologia pre-lesione, combinata con la natura non specifica delle lesioni naturali, complica l’interpretazione. Di conseguenza, si sa poco di come la plasticità che si verifica nella fase cronica successiva alla lesione possa differire da quella che si verifica nella fase acuta, e quando possono verificarsi particolari adattamenti funzionali e strutturali.
Il rapido progresso degli strumenti di misurazione della struttura e della funzione cerebrale ha portato ad un grande aumento del numero di predittori potenzialmente informativi della plasticità a seguito della lesione. Recentemente è stato proposto che la mappatura di una lesione su un atlante delle connessioni potrebbe prevedere le aree remote interessate e forse le conseguenze comportamentali di una lesione (Kuceyeski et al., 2014; Thiebaut de Schotten et al., 2015). Anche se questo approccio potrebbe essere molto informativo, non è ancora chiaro quali aree remote possono subire le conseguenze negative permanenti di una lesione, e quali possono adattarsi e riprendersi. Altri studi hanno suggerito che il ruolo delle regioni cerebrali all’interno dell’intera architettura cerebrale può essere informativo per la vulnerabilità alla lesione, con le regioni centrali apparentemente più suscettibili di essere colpite in una varietà di disturbi cerebrali (Crossley et al., 2014). Questo suggerisce l’ipotesi che le regioni centrali possano distribuire le risorse a seguito di una lesione cerebrale per aiutare il recupero nelle aree che sono principalmente colpite dalla lesione (Achard et al., 2012). Non è chiaro come questo possa accadere a livello microstrutturale.
Recentemente, c’è stata una rinascita dell’interesse per i gradienti su larga scala nell’organizzazione corticale (Beul et al., 2017; Burt et al., 2018; Goulas et al., 2018; Margulies et al., 2016; Markov et al., 2014; Sanides, 1962), e come questo possa permettere alle aree corticali di specializzarsi per funzioni cognitive distinte (Chaudhuri et al., 2015). Tuttavia, è stata prestata poca attenzione al fatto che i gradienti corticali di quantità microstrutturali, come le densità neuronali, o le densità gliali possano anche imporre limiti critici alla capacità di un’area di adattarsi alle lesioni. Le densità neuronali variano uniformemente attraverso la superficie corticale, con la corteccia prefrontale che ha meno della metà della densità neuronale di V1 (Collins et al., 2010). Le cellule non neuronali come gli astrociti e la microglia possono avere effetti sia benefici che dannosi sulla plasticità post-lesione (Anderson et al., 2003; Loane e Kumar, 2016), e l’esatta distribuzione di queste cellule nel cervello può anche limitare o modulare la risposta di una regione alla lesione.
Ci siamo posti l’obiettivo di indagare se è possibile prevedere i cambiamenti plastici in seguito a una lesione discreta e specifica, utilizzando una lesione eccitotossica bilaterale dell’ippocampo. L’ippocampo è una parte fondamentale del circuito della memoria episodica, ma l’impatto delle lesioni limitate all’ippocampo stesso non è sempre grande (Malkova e Mishkin, 2003; Zola-Morgan e Squire, 1986). A causa della natura diffusa del circuito di memoria episodica (Aggleton e Brown, 1999), abbiamo ipotizzato che ciò possa essere dovuto alla plasticità funzionale sotto forma di regioni cerebrali intatte che compensano l’area danneggiata (un processo che in precedenza abbiamo dimostrato essere criticamente dipendente dagli ingressi colinergici alla corteccia temporale inferiore in seguito alla disconnessione dell’ippocampo (Browning et al., 2010; Croxson et al., 2012).
Abbiamo acquisito le scansioni di risonanza magnetica nelle scimmie macacche prima e in due punti temporali dopo lesioni ippocampali bilaterali eccitotossiche e abbiamo scoperto che il cervello reagisce alle lesioni in modo altamente dinamico, che è in parte prevedibile sulla base della connettività funzionale pre-lesione e dell’anatomia micro e macro-strutturale. Le aree che erano più collegate all’ippocampo prima della lesione hanno ridotto la loro connettività funzionale con le aree in altri moduli nella fase acuta, e hanno mostrato una maggiore perdita di volume di materia grigia durante la fase cronica. Tuttavia, hanno aumentato la loro connettività funzionale con altre aree nello stesso modulo durante la fase cronica, suggerendo che i processi altamente dinamici di degenerazione e plasticità si verificano in parallelo nel corso dell’anno successivo alla lesione. Al contrario, le regioni hub hanno subito una perdita generale di connettività funzionale sia nella fase acuta che in quella cronica. Le aree con una maggiore densità di neuroni hanno perso la connettività con aree all’interno dello stesso modulo durante il periodo cronico, mentre quelle con una maggiore densità di cellule non neuronali (comprese le cellule di supporto glia e cardiovascolari) hanno aumentato significativamente la loro connettività funzionale tra i moduli nello stesso periodo, suggerendo che un’alta densità di queste cellule può essere importante per il processo di recupero plastico. Questo è il primo studio che dimostra quantitativamente una relazione tra la connettività funzionale pre-lesione e il decorso dinamico della plasticità a seguito di una lesione e mostra che le informazioni su una serie di scale spaziali possono aiutare a prevedere il processo di recupero plastico a seguito di una lesione.
Risultati
Le lesioni ippocampali erano precise ed estese
C’è stata una significativa riduzione del volume dell’ippocampo bilateralmente durante la fase acuta misurata con scansioni pesate in T2 (Figura 1A), istologicamente (Figura 1B) e morfometria basata sulla deformazione delle scansioni MRI strutturali pesate in T1 (Figura 1C-D). Tutti e tre i metodi di analisi hanno dato risultati coerenti. Le lesioni erano per lo più bilaterali ed estese, anche se c’era qualche apparente risparmio dell’ippocampo destro posteriormente attraverso le cinque scimmie (Figura 1; Tabella 1). Tuttavia, questo è probabilmente una sottovalutazione della quantità di danni nella parte posteriore dell’ippocampo, che è più stretto e quindi più suscettibile di effetti di volume parziale con i tessuti vicini.
| Monkey | Volume rimanente dell’emisfero sinistro | Volume rimanente dell’emisfero destro | Volume rimanente bilaterale | Lesione dell’emisfero sinistro %. | Lesione dell’emisfero destro %. | Lesione totale % |
|---|---|---|---|---|---|---|
| Atlante | 268144 | 268665 | 536809 | |||
| Significato | 149379 | 121895 | 271274 | 44.29 | 54.63 | 49.46 |
| E | 184498 | 146047 | 330545 | 31.19 | 45.64 | 38.42 |
| M | 129741 | 84877 | 214618 | 51.62 | 68.41 | 60.02 |
| N | 159535 | 158787 | 318322 | 40.50 | 40.90 | 40.70 |
| S | 94769 | 89512 | 184281 | 64.66 | 66.68 | 65.67 |
| T | 178354 | 130254 | 308608 | 33.49 | 51.52 | 42.51 |
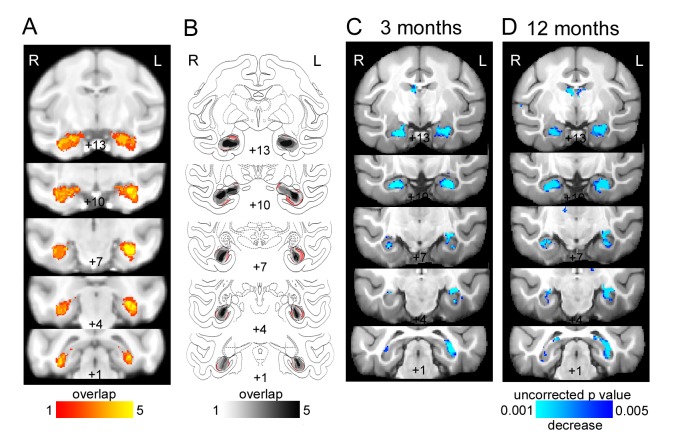
Figura 1.Lesioni ippocampali bilaterali.(A) T2-ponderata ipersignazione 6 giorni dopo l’intervento chirurgico che indica l’infiammazione locale nell’ippocampo; sovrapposizione è mostrato per le cinque scimmie. (B) Schizzo delle dimensioni dell’ippocampo in base alla istologia (sezioni colorate Nissl) sovrapposti su sezioni dell’atlante. Il volume dell’ippocampo unleso è mostrato in rosso. Sovrapposizione del volume ippocampale rimanente è mostrato per le cinque scimmie che indicano il restringimento dell’ippocampo bilateralmente in tutte le scimmie. (C-D) Risultati dell’analisi morfometrica basata sulla deformazione che mostra l’atrofia dell’ippocampo (C) 3 mesi dopo la lesione e (D) 12 mesi dopo la lesione.

Figura 1.Lesioni ippocampali bilaterali.(A) T2-ponderata ipersignazione 6 giorni dopo l’intervento chirurgico che indica l’infiammazione locale nell’ippocampo; sovrapposizione è mostrato per le cinque scimmie. (B) Schizzo delle dimensioni dell’ippocampo in base alla istologia (sezioni colorate Nissl) sovrapposti su sezioni dell’atlante. Il volume dell’ippocampo unleso è mostrato in rosso. Sovrapposizione del volume ippocampale rimanente è mostrato per le cinque scimmie che indicano il restringimento dell’ippocampo bilateralmente in tutte le scimmie. (C-D) Risultati dell’analisi morfometrica basata sulla deformazione che mostra l’atrofia dell’ippocampo (C) 3 mesi dopo la lesione e (D) 12 mesi dopo la lesione.
Misure funzionali e strutturali di plasticità
Abbiamo misurato i cambiamenti strutturali e funzionali in tutto il cervello utilizzando la risonanza magnetica ad alta risoluzione in tre punti temporali: pre-lesione, 3 mesi dopo la lesione e 12 mesi dopo la lesione in cinque scimmie macachiate. Le scansioni pre-lesione includevano anche i dati di tre ulteriori animali di controllo che non hanno ricevuto lesioni. Per chiarezza, ci riferiamo alle seguenti fasi: acuta (pre-lesione vs. 3 mesi dopo la lesione) e cronica (3 mesi vs. 12 mesi dopo la lesione). Non facciamo alcuna affermazione in merito ai diversi tassi di recupero comportamentale durante queste fasi, e riconosciamo che il recupero cognitivo può avvenire in entrambe le fasi a seguito di un insulto cerebrale (Berthier et al., 2011; Lazar e Antoniello, 2008).
In tutte le connessioni a coppie tra regioni cerebrali, c’è stato un aumento complessivo della forza di connettività funzionale nella fase acuta (t6318 = 9,37, p = 1×10-22), e una diminuzione nella fase cronica (t6318 = -16,85, p = 2×10-62). Al fine di comprendere i cambiamenti regionali specifici che stavano guidando questi effetti globali, abbiamo prima diviso il cervello in più ‘moduli’, basati sui dati di connettività funzionale dello stato di riposo utilizzando l’algoritmo di Lovanio (Blondel et al., 2008). Qui un “modulo” è un insieme di regioni cerebrali che hanno una connettività funzionale più elevata con le altre regioni cerebrali all’interno dell’insieme rispetto alle regioni cerebrali al di fuori dell’insieme. Abbiamo studiato i cambiamenti plastici della connettività funzionale media all’interno del modulo per ogni area cerebrale e il coefficiente di partecipazione alla rete, che è una misura di come le connessioni di un’area cerebrale sono distribuite in modo uniforme in tutti i moduli del cervello. Così le regioni cerebrali che hanno una bassa proporzione delle loro connessioni con le regioni cerebrali al di fuori del modulo locale hanno un basso coefficiente di partecipazione alla rete, mentre le regioni cerebrali che sono fortemente connesse con le regioni al di fuori del modulo locale hanno un alto coefficiente di partecipazione alla rete. Su questa base, il coefficiente di partecipazione alla rete è stato proposto come marcatore di hub di connettori (Power et al., 2013). Analizzando la connettività funzionale all’interno dei moduli e il coefficiente di partecipazione alla rete, possiamo costruire un quadro dei cambiamenti nell’elaborazione all’interno e tra i moduli funzionali nel tempo. Poiché questi metodi dipendono dalla definizione dei moduli, che a sua volta dipende da una scelta piuttosto arbitraria di un parametro di risoluzione (lambda), riportiamo risultati che sono stati robusti su tutto il range testato (gamma minima = 0,8, corrispondente a due moduli cerebrali, gamma massima = 1,4, corrispondente a una sola regione cerebrale per modulo). Inoltre, utilizzando la morfometria basata sulla deformazione, abbiamo valutato le variazioni di volume della materia grigia nelle fasi acuta e cronica.
Predittori anatomici e funzionali della plasticità
Abbiamo identificato quattro fattori che abbiamo ipotizzato essere potenziali predittori di plasticità a seguito della lesione.
In primo e secondo luogo, a livello cellulare, la plasticità post-lesione dipende dalla capacità dei neuroni di formare nuove connessioni sinaptiche, e dalle cellule gliali (in particolare astrociti e microglia) e da altre cellule di supporto cardiovascolare per aiutare la creazione e il mantenimento di tali sinapsi. Abbiamo così indagato se il gradienti di densità delle cellule neuronali e non neuronali attraverso la corteccia sono stati associati con modelli di plasticità nelle fasi acute e croniche. Per fare questo, abbiamo mappato le densità delle cellule neuronali e non neuronali da uno studio anatomico macaco (Collins et al., 2010) sul modello macroscopico Mappa Regionale (Kötter e Wanke, 2005) (Figura 2A,B).
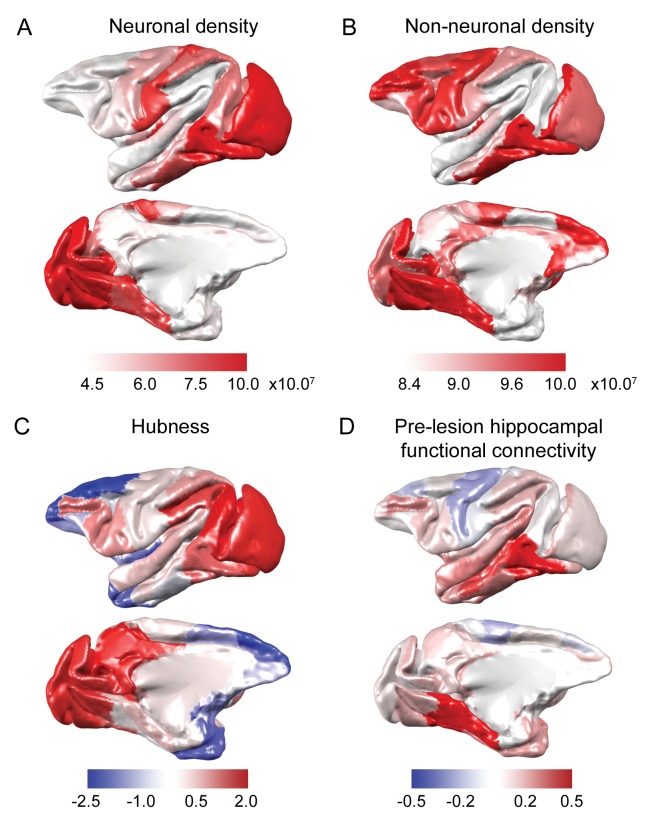
Figura 2.Predittori anatomici e funzionali della plasticità.(A-B) Le densità delle cellule neuronali e non neuronali sono state mappate da Collins et al., 2010. (C) Hubness è stato calcolato come proiezione di ogni area sulla prima componente principale della forza del nodo e dei dati del coefficiente di partecipazione della rete. (D) La connettività funzionale ippocampale pre-lesione è stata fortemente correlata con la connettività anatomica derivata dall’atlante di tracciamento del tratto del CoCoMac (r = 0,54, p = 2,2×10-7) e versioni potenziate dell‘atlante del CoCoMac (r = 0,60, p = 3,6×10-9). L’ippocampo era fortemente collegato alle strutture ventrali del lobo temporale…
In terzo luogo, gli studi sull’uomo hanno suggerito che le regioni del centro sono fortemente colpite a seguito di una serie di disturbi neurologici e psichiatrici, e che queste regioni sono radicalmente riorganizzate a seguito di lesioni (Achard et al., 2012; Crossley et al., 2014). Abbiamo quindi indagato se le proprietà simili a quelle di un hub di un’area possano prevedere le sue alterazioni plastiche a seguito di una lesione dell’ippocampo.
Abbiamo creato una misura continua del grado in cui le aree cerebrali erano dei centri (alias ‘.hubness“) utilizzando il seguente metodo. Poiché sia il coefficiente di partecipazione della rete che la forza del nodo sono misure proposte di hubness, e sono positivamente correlati, abbiamo eseguito un’analisi delle componenti principali sui dati di forza e coefficiente di partecipazione, e abbiamo preso la prima componente principale, che ha spiegato il 73,19% della varianza nella forza e coefficiente di partecipazione per essere la nostra stima di hubness (Figura 2C).
Quarto, abbiamo ragionato che la forza di connettività funzionale pre-lesione con l’ippocampo (la regione lesionata) dovrebbe influenzare il grado in cui altre regioni del cervello riorganizzano plasticamente la loro connettività funzionale in seguito alla lesione, con regioni che erano altamente connesse funzionalmente con l’ippocampo probabilmente più fortemente colpite dalla lesione, e di conseguenza più bisognose di riorganizzazione plastica.
Abbiamo valutato la connettività funzionale dell’ippocampo pre-lesione con tutte le altre regioni corticali sulla base delle scansioni fMRI pre-lesione a riposo e della media tra ippocampo destro e sinistro. La connettività funzionale ippocampale media è mostrata nella Figura 2D. La connettività funzionale più forte era con le regioni temporali mediali e ventrali che si trovano in prossimità dell’ippocampo. Al contrario, le regioni dorsali frontali hanno mostrato una leggera correlazione negativa con l’ippocampo. Al fine di testare la validità anatomica di questi modelli di connettività funzionale, li abbiamo confrontati con le misure di connettività anatomica delle versioni originali (Stephan et al., 2001) e ‘migliorata’ (Deco et al., 2014) dell’atlante di tracciamento del tratto del CoCoMac. La versione migliorata si adattava meglio alle misure di connettività funzionale rispetto alla versione con valore discreto dell’atlante per il tracciamento del tratto (Deco et al., 2014; Grayson et al., 2016). La connettività funzionale ippocampale misurata nello studio attuale è stata altamente correlata con le misure di connettività anatomica sia nella versione originale (r = 0,54, p = 2,2×10-7) sia nella versione migliorata dell’atlante del CoCoMac (r = 0,60, p = 3,6×10-9).

Figura 2.Predittori anatomici e funzionali della plasticità.(A-B) Le densità delle cellule neuronali e non neuronali sono state mappate da Collins et al., 2010. (C) Hubness è stato calcolato come proiezione di ogni area sulla prima componente principale della forza del nodo e dei dati del coefficiente di partecipazione della rete. (D) La connettività funzionale ippocampale pre-lesione è stata fortemente correlata con la connettività anatomica derivata dall’atlante di tracciamento del tratto del CoCoMac (r = 0,54, p = 2,2×10-7) e versioni potenziate dell‘atlante del CoCoMac (r = 0,60, p = 3,6×10-9). L’ippocampo era fortemente collegato alle strutture ventrali del lobo temporale…
Hubness, e la connettività funzionale dell’ippocampo pre-lesione prevedono un calo acuto della partecipazione alla rete.
Siamo entrati nella densità neuronale, densità cellulare non neuronale, hubness e connettività funzionale ippocampale pre-lesione come predittori di cambiamenti acuti nel coefficiente di partecipazione della rete in una regressione graduale (Figura 3A). Il modello ha previsto in modo significativo il modello a livello di corteccia di cambiamenti acuti nel coefficiente di partecipazione della rete, spiegando oltre la metà della varianza (F2,75 = 42,24, p = 5×10-13, r2 = 0,53, Figura 3B). Hubness (t73 = -5,70, p = 2×10-7), e connettività funzionale ippocampale pre-lesione (t73 = -5,25, p = 1×10-6) sono stati significativamente associati ad un calo del coefficiente di partecipazione alla rete nella fase acuta (Figura 3C). Né la densità neuronale (t73 = -1,04, p = 0,29) né la densità cellulare non neuronale hanno mostrato un’associazione significativa (t73 = -0,55, p = 0,59).
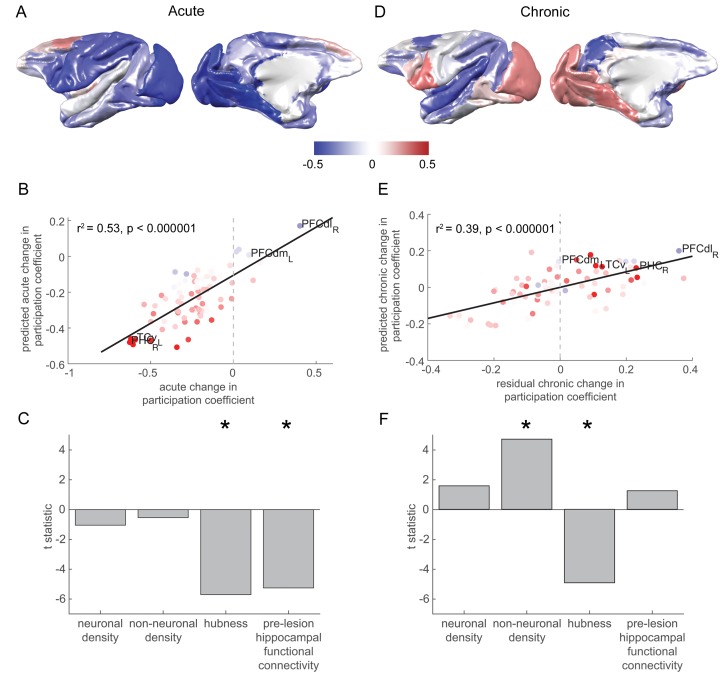
Figura 3.I cambiamenti nella partecipazione alla rete sono fortemente previsti dall’anatomia pre-lesionistica e dalla connettività funzionale.(A) La maggior parte delle regioni cerebrali ha mostrato un calo nella partecipazione alla rete nella fase acuta. (B-C) Il grado in cui le singole regioni cerebrali hanno ridotto la loro partecipazione alla rete nella fase acuta è stato ben previsto dalla loro connettività pre-lesione all’ippocampo e la misura in cui hanno agito come hub nella rete pre-lesione (‘hubness’). (B) Un diagramma di dispersione dei cambiamenti di fase acuta al coefficiente di partecipazione della rete per ogni regione cerebrale, rispetto alle previsioni del modello. Le regioni cerebrali sono colorati in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la figura 2D). (D-F) Come in (A-C), ma per i cambiamenti cronici dello stadio di partecipazione alla rete. Si noti che le aree con una maggiore densità di cellule non neuronali hanno mostrato il maggiore aumento del coefficiente di partecipazione alla rete rispetto allo stadio cronico. Si noti che (D) mostra le variazioni complessive del coefficiente di partecipazione all’interno della rete per lo stadio cronico, mentre le previsioni del modello e i dati mostrati in (E-F) corrispondono alle variazioni residue dello stadio cronico all’interno del coefficiente di partecipazione alla rete, dopo la regressione delle variazioni acute dello stadio. * significa che questi predittori erano significativi e inclusi nel modello finale.

Figura 3.I cambiamenti nella partecipazione alla rete sono fortemente previsti dall’anatomia pre-lesionistica e dalla connettività funzionale.(A) La maggior parte delle regioni cerebrali ha mostrato un calo nella partecipazione alla rete nella fase acuta. (B-C) Il grado in cui le singole regioni cerebrali hanno ridotto la loro partecipazione alla rete nella fase acuta è stato ben previsto dalla loro connettività pre-lesione all’ippocampo e la misura in cui hanno agito come hubs nella rete pre-lesione (‘hubness’). (B) Un diagramma di dispersione dei cambiamenti di fase acuta al coefficiente di partecipazione della rete per ogni regione cerebrale, rispetto alle previsioni del modello. Le regioni cerebrali sono colorati in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la figura 2D). (D-F) Come in (A-C), ma per i cambiamenti cronici dello stadio di partecipazione alla rete. Si noti che le aree con una maggiore densità di cellule non neuronali hanno mostrato il maggiore aumento del coefficiente di partecipazione alla rete rispetto allo stadio cronico. Si noti che (D) mostra le variazioni complessive del coefficiente di partecipazione all’interno della rete per lo stadio cronico, mentre le previsioni del modello e i dati mostrati in (E-F) corrispondono alle variazioni residue dello stadio cronico all’interno del coefficiente di partecipazione alla rete, dopo la regressione delle variazioni acute dello stadio. * significa che questi predittori erano significativi e inclusi nel modello finale.
La densità delle cellule non neuronali prevede un aumento cronico della partecipazione allo stadio di rete
Poiché sia il calcolo dei cambiamenti di fase acuti che cronici conteneva il punto temporale di tre mesi, non erano indipendenti. Al fine di identificare i cambiamenti di stadio cronici che erano indipendenti dai cambiamenti di stadio acuto, abbiamo costruito un modello lineare generale, utilizzando i cambiamenti di stadio acuto per prevedere i cambiamenti di stadio cronici. La relazione tra i cambiamenti acuti e cronici dello stadio e il coefficiente di partecipazione alla rete non differisce dal caso (p = 0,66, corretto per il punto di tempo condiviso, vedi Materiali e metodi), suggerendo che i distinti processi degenerativi e plastici hanno influenzato la partecipazione alla rete nei due stadi. I residui di questo modello sono stati presi come i cambiamenti cronici dello stadio che erano indipendenti dai cambiamenti acuti dello stadio.
Abbiamo usato gli stessi predittori che durante lo stadio acuto per prevedere i cambiamenti cronici dello stadio nel coefficiente di partecipazione alla rete (Figura 3D). Il modello ha previsto in modo significativo il modello a livello di corteccia di cambiamenti cronici in fase di stadio di rete cronica del coefficiente di partecipazione (F2,75 = 24,3, p = 7×10-9, r2 = 0,39, Figura 3E). La densità delle cellule non neuronali è stata associata in modo significativo ad un aumento del coefficiente di partecipazione della rete nella fase cronica (t73 = 4,70, p = 1×10-5). Come nella fase acuta, l’hubness è stato significativamente associato a un calo del coefficiente di partecipazione alla rete durante la fase cronica (t73 = -4,93, p – 4 × 10-6) (Figura 3F). Né la densità neuronale (t73 = 1,57, p = 0,12) né la connettività funzionale ippocampale (t73 = 1,24, p = 0,22) sono stati significativi predittori di cambiamenti di partecipazione della rete in fase cronica.
Il mozzo è associato ad un calo acuto di fase nella connettività funzionale all’interno del modulo
Un modello con hubness come il predittore solitario (identificato con regressione graduale) ha previsto in modo significativo il modello a livello della corteccia di cambiamenti di fase acuta all’interno della connettività funzionale del modulo (Figura 4B; Figura 4C, F1,76 = 10,25, p = 0,002, r2 = 0.12, hubness t73 = -3,20, p = 0,002, densità neuronale t73 = -1,39, p = 0.168, densità cellulare non neuronale t73 = -0,92, p = 0,359, connettività funzionale ippocampale pre-lesione t73 = -0,28, p = 0,782).
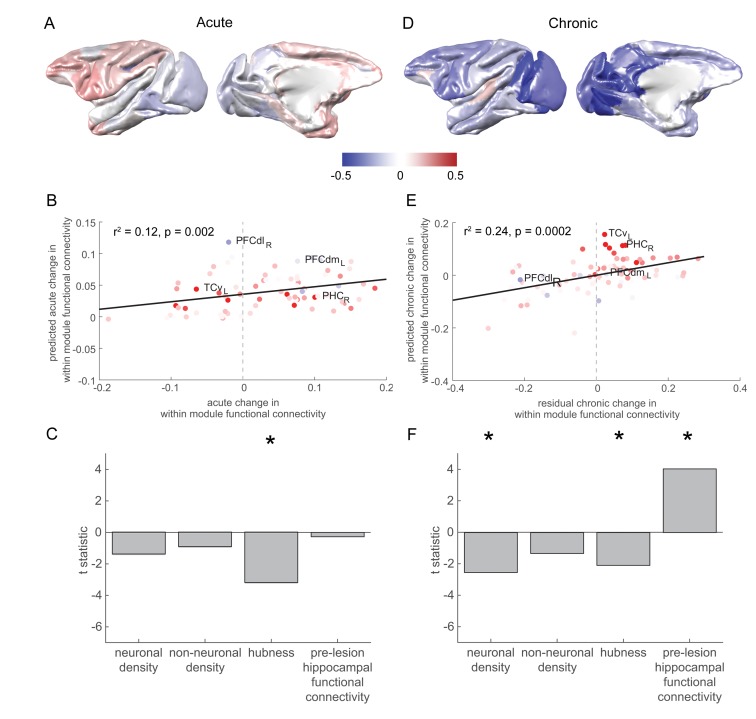
Figura 4.La connettività ippocampale pre-lesione è associata ad un aumento della connettività all’interno del modulo nella fase cronica.(A) Il modello di fase acuta aumenta e diminuisce a connettività all’interno del modulo. (B-C) Il grado in cui le singole regioni cerebrali hanno cambiato la loro connettività all’interno del modulo nella fase acuta è stato significativamente associato con la misura in cui hanno agito come hub nella rete pre-lesione (“hubness”). Trama di dispersione in (B) mostra le regioni cerebrali colorate in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la figura 2D). (D-F) Come in (A-C), ma per i cambiamenti cronici di fase di connettività all’interno del modulo. Si noti che (D) mostra il complessivo all’interno del modulo-connettività cambiamenti all’interno di cambiamenti di connettività per la fase cronica, mentre le previsioni del modello e dati mostrati in (E-F) corrispondeva ai cambiamenti residui fase cronica all’interno del modulo-connettività, dopo la regressione fuori cambiamenti di fase acuta. * significa che questi predittori erano significativi e inclusi nel modello finale.

Figura 4.Figura 4. Connettività ippocampale pre-lesione è associata ad un aumento della connettività all’interno del modulo nella fase cronica.(A) Il modello di fase acuta aumenta e diminuisce a connettività all’interno del modulo. (B-C) Il grado in cui le singole regioni cerebrali hanno cambiato la loro connettività all’interno del modulo nella fase acuta è stato significativamente associato con la misura in cui hanno agito come hub nella rete pre-lesione (“hubness”). Trama di dispersione in (B) mostra le regioni cerebrali colorate in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la figura 2D). (D-F) Come in (A-C), ma per i cambiamenti cronici di fase di connettività all’interno del modulo. Si noti che (D) mostra il complessivo all’interno del modulo-connettività cambiamenti all’interno di cambiamenti di connettività per la fase cronica, mentre le previsioni del modello e dati mostrati in (E-F) corrispondeva ai cambiamenti residui fase cronica all’interno del modulo-connettività, dopo la regressione fuori cambiamenti di fase acuta. * significa che questi predittori erano significativi e inclusi nel modello finale.
Una maggiore connettività funzionale ippocampale pre-lesione è associata ad un aumento cronico della connettività funzionale all’interno del modulo.
I cambiamenti nella fase acuta (Figura 4A) e cronica (Figura 4D) della connettività all’interno del modulo sono stati associati in modo più forte e positivo di quanto previsto per caso (p < 0,001, corretto per il punto di tempo condiviso, vedi Materiali e metodi), suggerendo che potrebbe esserci stata una continuazione di processi degenerativi o plastici dalla fase acuta a quella cronica. I residui di questo modello sono stati utilizzati per identificare i cambiamenti indipendenti dello stadio cronico all’interno del modulo.
Il modello di regressione graduale prevedeva in modo significativo il modello a livello della corteccia di cambiamenti cronici di fase all’interno della connettività funzionale all’interno del modulo (F3,74 = 7,68, p = 0,0002, r2 = 0,24, Figura 4E). Densità neuronale (t73 = -2,54, p = 0,013) è stato un significativo predittore di un calo della connettività funzionale all’interno del modulo durante la fase cronica. Al contrario, la connettività funzionale ippocampale pre-lesione è stata associata ad un aumento cronico della connettività funzionale all’interno del modulo (t73 = 4,04, p = 0,0001). La densità delle cellule non neuronali non è stata inclusa nel modello finale (t73 = -1,33, p = 0,19). Hubness (t73 = -2,08, p = 0,04) è stato un significativo predittore di una diminuzione cronica fase di una diminuzione all’interno del modulo di connettività funzionale all’interno della maggior parte (lambda = 0,8-1 e 1,3-1.4), ma non tutte (lambda = 1,1, p = 0,053, lambda = 1,2, p = 0,075) le ripetizioni dell’analisi con diversi parametri di risoluzione (lambda), e quindi possono essere considerate come un risultato marginale (Figura 4F).
Più alta connettività funzionale ippocampale pre-lesione è associata ad un calo cronico stadio di volume di materia grigia
Nessuno dei quattro predittori ha previsto in modo significativo i cambiamenti di stadio acuto nel volume della materia grigia (densità neuronale: t73 = 1,10, p = 0,27, densità cellulare non neuronale: t73 = 0.40, p = 0,69, hubness: t73 = 1,27, p = 0,21, connettività funzionale ippocampale: t73 = -0,11, p = 0,91) (Figura 5A-C).
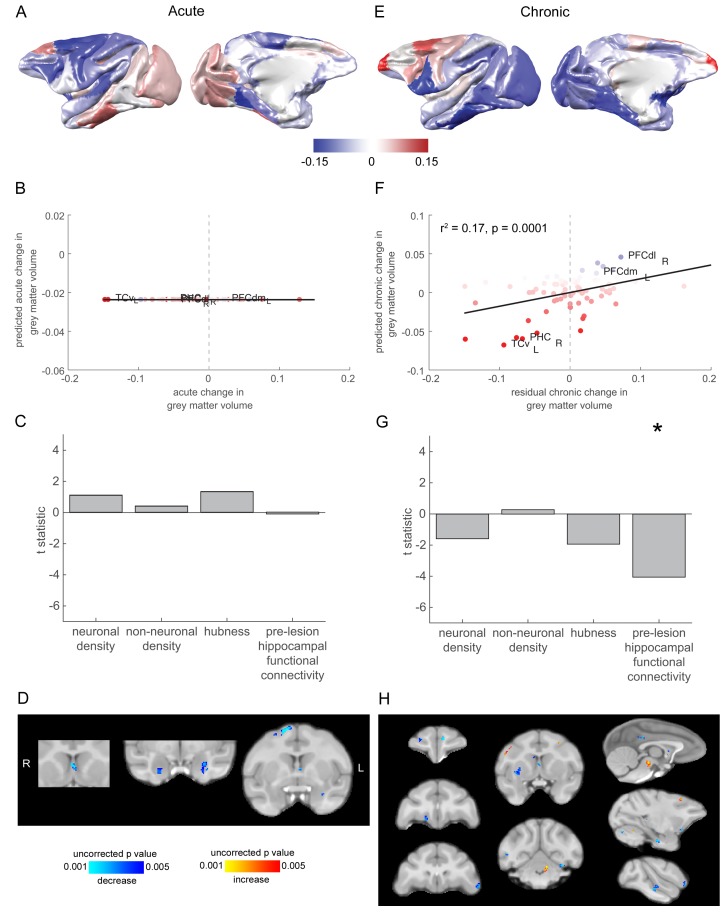
Figura 5.Figura 5. La perdita di materia grigia nella fase cronica è stata più evidente nelle regioni corticali che erano fortemente connesse con l’ippocampo.(A) Il modello di fase acuta aumenta e diminuisce al volume della materia grigia corticale. (B-C) Non sono stati identificati predittori significativi di cambiamenti di materia grigia corticale in fase acuta stadio corticale. (D) L’analisi voxelwise cervello intero cervello ha rivelato diminuzioni volumetriche molto limitate nel setto mediale, amigdala e corteccia premotoria dorsale. (E) Come in (A), ma per i cambiamenti di stadio cronici a livello corticale corticale grigio-materia volume. (E-F). Il grado in cui le singole regioni corticali hanno cambiato il loro volume di materia grigia durante lo stadio cronico è stato significativamente associato con la misura in cui erano funzionalmente connessi con l’ippocampo prima della lesione. Trama di dispersione in (B) mostra le regioni cerebrali colorate in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la Figura 2D). Si noti che (E) mostra il complessivo all’interno del modulo-connettività cambiamenti per la fase cronica, mentre le previsioni del modello e dati mostrati in (F-G) corrispondeva ai cambiamenti residui fase cronica all’interno del modulo-connettività, dopo la regressione fuori cambiamenti di fase acuta. * significa che questo predittore era significativo e incluso nel modello finale. (H) L’analisi voxelwise del cervello intero ha rivelato una gamma più ampia di diminuzioni di volume di materia grigia durante lo stadio cronico. Ci sono stati anche aumenti volumetrici nel cervelletto, mesencefalo e corteccia premotoria. Questi risultati non sono sopravvissuti alla correzione dei confronti multipli.
Cambiamenti stadio acuto e cronico al volume della materia grigia corticale sono stati più fortemente associati positivamente di quanto previsto dal caso (p = 0,01, corretto per il punto di tempo condiviso, vedi Materiali e metodi), suggerendo che ci può essere stata una continuazione della perdita degenerativa di materia grigia dalla fase acuta a quella cronica. I residui di questo modello sono stati utilizzati per identificare i cambiamenti indipendenti dello stadio cronico indipendente del volume di materia grigia corticale.
Il modello di regressione graduale per i cambiamenti di fase cronica al volume della materia grigia includeva solo la connettività funzionale ippocampale pre-lesione nel modello finale (F1,76 = 16,39, r2 = 0,17, t73 = -4,05, p = 0,0001). Densità neuronale (t73 = 1,58, p = 0,118), densità cellulare non neuronale (t73 = 0,28, p = 0.779) e hubness (t73 = -1,92, p = 0,058) non ha fatto il cut-off per l’inclusione nel modello (Figura 5E-G).

Figura 5.Figura 5. La perdita di materia grigia nella fase cronica è stata più evidente nelle regioni corticali che erano fortemente connessi con l’ippocampo.(A) Il modello di fase acuta aumenta e diminuisce al volume di materia grigia corticale. (B-C) Non sono stati identificati predittori significativi di cambiamenti di materia grigia corticale in fase acuta stadio corticale. (D) L’analisi voxelwise cervello intero cervello ha rivelato diminuzioni volumetriche molto limitate nel setto mediale, amigdala e corteccia premotoria dorsale. (E) Come in (A), ma per i cambiamenti di stadio cronici a livello corticale corticale grigio-materia volume. (E-F). Il grado in cui le singole regioni corticali hanno cambiato il loro volume di materia grigia durante lo stadio cronico è stato significativamente associato con la misura in cui erano funzionalmente connessi con l’ippocampo prima della lesione. Trama di dispersione in (B) mostra le regioni cerebrali colorate in base alla loro connettività pre-lesione con l’ippocampo (confrontare con la Figura 2D). Si noti che (E) mostra il complessivo all’interno del modulo-connettività cambiamenti per la fase cronica, mentre le previsioni del modello e dati mostrati in (F-G) corrispondeva ai cambiamenti residui fase cronica all’interno del modulo-connettività, dopo la regressione fuori cambiamenti di fase acuta. * significa che questo predittore era significativo e incluso nel modello finale. (H) L’analisi voxelwise del cervello intero ha rivelato una gamma più ampia di diminuzioni di volume di materia grigia durante lo stadio cronico. Ci sono stati anche aumenti volumetrici nel cervelletto, mesencefalo e corteccia premotoria. Questi risultati non sono sopravvissuti alla correzione dei confronti multipli.
Il volume della materia grigia è stato ridotto in un piccolo numero di aree nella fase acuta, con ulteriori riduzioni nella fase cronica
Al fine di indagare le variazioni di volume della materia grigia nel cervello intero (non limitato alla corteccia), abbiamo eseguito un’analisi morfometrica basata sulla deformazione delle variazioni di volume della materia grigia utilizzando un modello lineare misto. I risultati sono mostrati in Figura 5D,H, soglia a p < 0,005 e una dimensione minima del cluster di 5 mm3 (Sallet et al., 2011).
Durante la fase acuta, ci sono state diminuzioni volumetriche molto limitate nel setto mediale, amigdala e corteccia premotoria dorsale. Nessun aumento è sopravvissuto alla trebbiatura (Figura 5D). Nella fase cronica, abbiamo ancora visto diminuzioni del setto mediale, ma anche una gamma più ampia di diminuzioni. Alcuni di questi erano anche in aree che sono monosinapticamente connessi con l’ippocampo: la corteccia orbito-frontale mediale, la corteccia cingolata posteriore e la corteccia parahippocampale posteriore. Ci sono state anche diminuzioni volumetriche più estese, nella corteccia prefrontale anteriore (mediale e laterale), nella corteccia prefrontale ventrolaterale, striato dorsale, corteccia visiva e corteccia temporale superiore. Ci sono stati anche aumenti volumetrici nel cervelletto, mesencefalo e corteccia premotoria. Questi risultati non sono sopravvissuti alla correzione dei confronti multipli (forse a causa della nostra piccola dimensione del campione), quindi questi cambiamenti dovrebbero essere visti con questo avvertimento in mente.
La modularità è influenzata da lesioni dell’ippocampo
Abbiamo indagato l’effetto che le lesioni ippocampali hanno avuto sulla struttura della macroconnettività esaminando i cambiamenti nei singoli moduli, che insieme ai nodi sono considerati le forme canoniche di integrazione e segregazione, e i segni distintivi dei connectomi interareali (Rubinov, 2016).
Abbiamo stimato i moduli sulla base dei dati pre-lesionali, ripetuti 10.000 volte. I moduli più affidabili sono mostrati nella Figura 6A. Quattro moduli sono stati identificati, la corteccia orbito-frontale / lobo temporale anteriore, posteriore temporale, parieto-occipitale e dorsale frontale. La connettività funzionale relativa di questi moduli all’interno della rete pre-lesione è mostrato in Figura 6B (colori come in 6A). In queste rappresentazioni grafiche a forza, la connettività funzionale agisce come una forza attrattiva tra due nodi, quindi i nodi che sono più vicini tra loro sono più altamente connessi. Il modulo parieto-occipitale (arancione) è altamente connesso agli altri tre moduli.
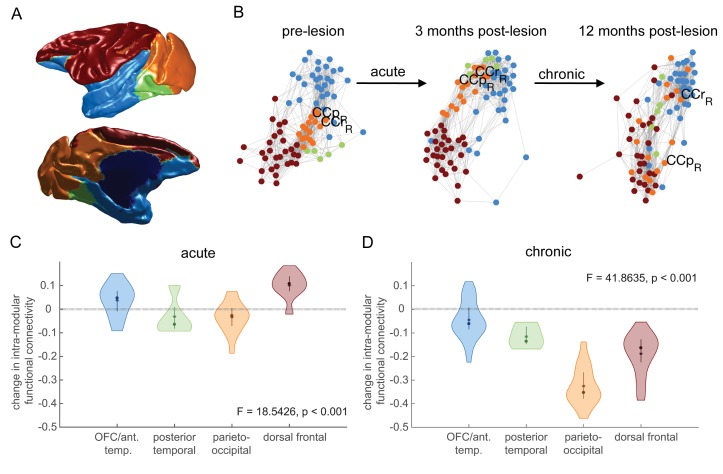
Figura 6.Effetti delle lesioni dell’ippocampo sulla struttura del modulo.I moduli più coerenti pre-operatori definiti sono mostrati anatomicamente (A) e utilizzando una rappresentazione grafica diretta a forza (B) in cui le regioni cerebrali altamente funzionalmente collegate sono tracciate vicine tra loro. Prima della lesione, il modulo parieto-occipitale (arancione) è altamente collegato agli altri tre moduli. A 3 mesi dopo la lesione, la rete ha un aspetto molto simile, anche se potrebbe esserci stata una certa dispersione. A 12 mesi dopo la lesione, invece, il modulo parieto-occipitale è completamente disperso, con una certa dispersione degli altri moduli. (C-D) Abbiamo quantificato questa dispersione con la variazione media della connettività funzionale all’interno del modulo per ogni modulo. C’è un effetto significativo del modulo sulla dispersione dei nodi sia nella fase acuta (C – pre-lesione vs. 3 mesi dopo la lesione) che in quella cronica (D – 3 mesi vs. 12 mesi dopo la lesione).
Seguendo il modulo parieto-occipitale arancione attraverso il tempo (Figura 6B), tre mesi dopo la lesione il modulo parieto-occipitale è ancora relativamente strettamente connesso sia con se stesso che con le altre tre reti (anche se i suoi nodi si sono un po’ dispersi). A 12 mesi dalla lesione, tuttavia, questo modulo (arancione) diventa drammaticamente disperso.
Abbiamo quantificato questa dispersione come il calo medio della connettività funzionale all’interno del modulo all’interno del modulo nelle fasi acute e croniche (Figura 6C-D). Durante lo stadio acuto, (Figura 6C), non c’è un grande calo nella connettività funzionale all’interno del modulo, anche se c’è una differenza significativa tra i moduli (F3,76 = 19,54, p = 4×10-9), con il modulo parieto-occipitale che si disperde un po’, e i moduli dorsale frontale e OFC/anteriore temporale che aumentano la loro connettività funzionale all’interno del modulo.
Durante la fase cronica (Figura 6D), c’è un calo nella connettività funzionale all’interno del modulo attraverso tutti i moduli, con la dispersione di gran lunga maggiore che si verifica nel modulo parieto-occipitale (F3,76 = 41,86, p = 4×10-16).
La dispersione del modulo parieto-occipitale, che in precedenza fungeva da collegamento tra gli altri moduli, ha portato anche ad un calo della connettività tra i moduli, come si è visto da un aumento della modularità durante la fase cronica (pre-lesione: 0,33, 3 mesi dopo la lesione: 0,34, 12 mesi dopo la lesione: 0,49; F2,297=60230, p~0). A 12 mesi dalla lesione c’erano sempre meno moduli a 12 mesi dalla lesione rispetto alla scansione pre-lesione, a tutti i valori di lambda testati (range 0,8-1,4).

Figura 6.Effetti delle lesioni dell’ippocampo sulla struttura del modulo.I moduli più coerenti pre-operatori definiti sono mostrati anatomicamente (A) e utilizzando una rappresentazione grafica orientata alla forza (B) dove le regioni cerebrali altamente funzionalmente collegate sono tracciate da vicino. Prima della lesione, il modulo parieto-occipitale (arancione) è altamente collegato agli altri tre moduli. A 3 mesi dopo la lesione, la rete ha un aspetto molto simile, anche se potrebbe esserci stata una certa dispersione. A 12 mesi dopo la lesione, invece, il modulo parieto-occipitale è completamente disperso, con una certa dispersione degli altri moduli. (C-D) Abbiamo quantificato questa dispersione con la variazione media della connettività funzionale all’interno del modulo per ogni modulo. C’è un effetto significativo del modulo sulla dispersione dei nodi sia nella fase acuta (C – pre-lesione vs. 3 mesi dopo la lesione) che in quella cronica (D – 3 mesi vs. 12 mesi dopo la lesione).
Relazione tra densità cellulare e nodi
In un’analisi esplorativa abbiamo effettuato una regressione graduale per valutare la relazione tra densità delle cellule e “hubness”. Un modello contenente sia la densità delle cellule neuronali e non neuronali densità delle cellule significativamente previsto hubness (F2,75 = 6,18, r2 = 0,14, p = 0,003). La densità neuronale è stata associata positivamente all’hubness (t = 3,49, p = 0,008), mentre la densità cellulare non neuronale è stata associata negativamente all’hubness (t = -2,19, p = 0,032).
Confronto statistico tra il set di dati completo e il set di dati a due scimmie
Per verificare se i risultati di cui sopra sono dovuti al fatto che, in alcuni casi, sono state utilizzate scansioni di diverse scimmie in momenti diversi, abbiamo ripetuto tutte le analisi con i dati di due scimmie con un set completo di scansioni pre- e post-lesione. Abbiamo verificato se i valori beta delle quattro variabili indipendenti (densità delle cellule neuronali e non neuronali, hubness e connettività ippocampale pre-lesionale) per ciascuna delle suddette analisi di regressione differivano significativamente tra i due set di dati utilizzando statistiche non parametriche (vedi Materiali e metodi). Dei 24 valori beta valutati, sono state osservate le seguenti differenze nei valori beta tra i dataset. Connettività ippocampale come predittore di cambiamenti cronici nel coefficiente di partecipazione (p = 0,034), hubness come predittore di cambiamenti acuti nella connettività all’interno del modulo (p = 0,0004) e hubness come predittore di cambiamenti cronici nel volume della materia grigia (p = 0,019). In tutti e tre questi casi il significato del risultato, e quindi l’interpretazione non è cambiata; cioè, l’hubness è rimasto un significativo predittore di cambiamenti acuti nella connettività all’interno del modulo nel set di dati completo e in quello a due scimmie, e gli altri due predittori sono rimasti non significativi.
Discussione
Qui dimostriamo che, a seguito di una lesione eccitotossica dell’ippocampo, i cambiamenti funzionali e strutturali avvengono in modo dinamico nel tempo. Il modello di connettività funzionale dell’ippocampo prima di una lesione può prevedere in modo significativo le aree cerebrali che mostreranno i cambiamenti di connettività funzionale e la perdita di volume della materia grigia dopo la lesione. Le aree che erano altamente connesse con l’ippocampo prima della lesione hanno mostrato un calo della partecipazione alla rete durante la fase acuta e una perdita di volume di materia grigia durante la fase cronica. Tuttavia, hanno anche aumentato la loro connettività funzionale con altre aree dello stesso modulo durante lo stadio cronico. Ciò può indicare che la risonanza magnetica è sensibile a distinti processi di plasticità su microscala che si verificano durante lo stadio acuto e lo stadio cronico post-lesione. Ciò è stato supportato da associazioni contrastanti tra misure di densità delle cellule neuronali e non neuronali con cambiamenti della connettività funzionale. La densità neuronale è stata associata ad una maggiore perdita di connettività funzionale all’interno del modulo durante la fase cronica, mentre la densità delle cellule non neuronali è stata associata ad un aumento della partecipazione alla rete durante lo stesso stadio. Gli hub di rete hanno mostrato un modello distintivo di alterazioni post-lesione, che ha suggerito che sono più vulnerabili agli effetti della lesione. Più una regione ha agito come un hub nella rete pre-lesione, maggiore è la riduzione della connettività funzionale sia nella fase acuta che in quella cronica.
La connettività funzionale pre-lesione prevede alterazioni dinamiche della partecipazione alla rete
I cambiamenti nell’attivazione in regioni cerebrali distanti sono ampiamente concordati per essere tra i primi adattamenti successivi a lesioni cerebrali prima di un ritorno a modelli di attivazione più normali, che appaiono nel tessuto risparmiato vicino al sito interessato (Cramer, 2008). Recentemente negli esseri umani, le informazioni connettivologiche derivate da database di esseri umani sani sono state utilizzate per identificare le aree remote che possono essere interessate da una lesione (Kuceyeski et al., 2014; Thiebaut de Schotten et al., 2015), ma la relazione tra il profilo di connettività del cervello e la dinamica della plasticità non era stata precedentemente studiata. Qui dimostriamo che la connettività funzionale può essere altamente predittiva dei cambiamenti plastici dinamici sia nella fase acuta che in quella cronica.
Una più forte connettività funzionale pre-lesione dell’ippocampo è stata associata ad un calo della partecipazione alla rete nella fase acuta e del volume della materia grigia corticale nella fase cronica. La forza della connettività con l’ippocampo è stata anche associata ad un aumento della connettività all’interno del modulo nella fase cronica. Una possibilità intrigante che dovrebbe essere studiata in studi futuri più ampi è che la perdita di connettività funzionale e il recupero può corrispondere alla linea temporale della perdita e del recupero della funzione comportamentale a seguito di una lesione.
Con sole tre scansioni nell’arco di un anno, siamo stati in grado di rilevare interessanti dinamiche di plasticità locale e globale. Questo porta alla domanda: in quale fase dell’anno successivo alla lesione si verificano la maggior parte dei cambiamenti? In un recente studio, Grayson e colleghi hanno esaminato i cambiamenti di rete nella connettività funzionale durante la soppressione chemiogenetica reversibile dell’attività dell’amigdala (Grayson et al., 2016). Nei minuti e nelle ore successive alla soppressione dell’amigdala, sono già stati in grado di rilevare alcuni cambiamenti di rete, con una forte riduzione della connettività funzionale dell’amigdala e dei suoi moduli locali. Dal confronto visivo tra le trame grafiche a forza diretta dello studio attuale (Figura 6) e lo studio di Grayson et al. (loro Figura 7), sembra che la struttura globale della rete sia meglio conservata a seguito di una perturbazione chemiogenetica dell’amigdala, piuttosto che a seguito di lesioni permanenti dell’ippocampo. Questo non è particolarmente sorprendente in quanto le lesioni permanenti hanno maggiori probabilità di indurre plasticità su larga scala, sui tempi del presente studio. In tale studio non hanno esplicitamente calcolato i cambiamenti nella connettività funzionale dell’hub o altre proprietà grafico-teoriche qui presentate, limitando la possibilità di confrontare direttamente i risultati. Tuttavia, gli studi futuri che combinano le inattivazioni chemiogenetiche e le lesioni permanenti delle stesse regioni cerebrali con più punti temporali di scansione hanno il potenziale di scoprire la linea temporale a grana fine delle alterazioni cerebrali globali dopo l’interruzione delle regioni cerebrali, e di distinguere come questi due metodi per interferire con la funzione di un’area possono indurre diverse alterazioni della connettività funzionale del cervello e della plasticità.
I nostri risultati hanno anche implicazioni per la comprensione del ruolo delle strutture del lobo temporale mediale nella funzione della memoria. Mentre le lesioni dell’ippocampo sono state implicate nell’amnesia umana per decenni (Corkin et al., 1997; Scoville e Milner, 1957), è anche chiaro che anche il danno ippocampale focale ha conseguenze diffuse al di là del danno funzionale immediato, e che la memoria è un processo distribuito che contiene sia la segregazione che la sovrapposizione delle funzioni (Gaffan, 2002). Questo concetto di diaschisi connettiva (Carrera e Tononi, 2014) è stato identificato anche in pazienti umani con danno ippocampale focale, dove le alterazioni funzionali di una rete si estendono ben oltre il danno strutturale (Henson et al., 2016). Abbiamo esteso in modo significativo questi risultati prevedendo quantitativamente i cambiamenti nella connettività funzionale dell’intero cervello e nel volume della materia grigia dalla connettività funzionale dell’ippocampo pre-lesione, dai gradienti microstrutturali e dalle misure cerebrali basate sulla rete.
I processi alla base del meccanismo di una lesione eccitotossica sono in parte sovrapposti a quelli coinvolti in lesioni cerebrali umane. La fase iniziale di un evento ischemico, per esempio, porta alla morte eccitotossica attraverso l’attivazione dei recettori del glutammato, come nella nostra lesione NMDA deliberata, ma questo è solo uno di una cascata di processi (Cramer, 2008). I meccanismi coinvolti in una lesione cerebrale traumatica sono meno simili alle nostre lesioni eccitotossiche, a partire dall’edema cerebrale e dall’aumento della pressione intracranica, seguiti da una serie di altri fattori di cui l’eccitotossicità del glutammato è solo uno (Kinoshita, 2016). La forza di una specifica lesione indotta da NMDA, che risparmia le fibre di passaggio all’interno o adiacenti all’area (Coffey et al., 1988; Köhler e Schwarcz, 1983) è che possiamo studiare l’effetto del danno a una specifica area sul resto del cervello.
La perdita di volume della materia grigia si verifica in aree collegate della rete di memoria episodica
Nessuno dei nostri fattori ha previsto la perdita di materia grigia durante lo stadio acuto, ma le aree che erano altamente connesse con l’ippocampo prima della lesione hanno subito una maggiore perdita di volume di materia grigia durante lo stadio cronico. Abbiamo osservato una diminuzione del volume del setto mediale, dell’amigdala e della corteccia parahippocampale posteriore. Queste regioni e i tratti di materia bianca che le collegano all’ippocampo sono colpiti anche in soggetti umani con amnesia dello sviluppo (Dzieciol et al., 2017; Olsen et al., 2013) e in persone nate molto pretermine (Ball et al., 2012; Caldinelli et al., 2017; Froudist-Walsh et al., 2017; Salvan et al., 2014; Tseng et al., 2017). Sebbene le gravi anomalie strutturali associate all’amnesia dello sviluppo portino a danni apparentemente permanenti alla memoria episodica (Vargha-Khadem et al., 2001), danni più lievi a questo circuito possono consentire cambiamenti plastici nella connettività funzionale corticale per compensare parzialmente i danni al circuito di memoria episodica del nucleo (Isaacs et al., 2003; Nosarti e Froudist-Walsh, 2016). Nel presente studio, i danni incompleti alle strutture subcorticali come i corpi mammillari, i fornix e le subregioni talamiche collegate in combinazione con le modifiche plastiche alle aree risparmiate possono essere cruciali per la conservazione o il recupero o le capacità di memoria anterograda (Baxter, 2013; Froudist-Walsh et al., 2018; Mitchell et al., 2008). Tuttavia, riconosciamo un limite dello studio è che il nostro progetto non riesce a distinguere tra la plasticità compensativa e quella disadattiva.
Le densità delle cellule neuronali e non neuronali prevedono diversi aspetti della plasticità post-lesione
Non abbiamo visto una relazione significativa tra la densità neuronale o non neuronale e la plasticità post-lesione acuta. Densità delle cellule neuronali è stata associata in modo significativo con la diminuzione della connettività funzionale all’interno del modulo durante la fase cronica. Le dimensioni dell’albero dendritico e il conteggio della colonna vertebrale tendono a mostrare gradienti opposti alla densità neuronale, con valori più bassi nella corteccia visiva precoce e picchi nelle aree di associazione superiore (Elston et al., 2010; Scholtens et al., 2014). Così la perdita di connettività in aree con maggiore densità neuronale può riflettere altri fattori, come la mancanza di spine dendritiche che possono essere cruciali per la plasticità sinaptica. In effetti, è stato osservato un rimodellamento locale e a distanza delle spine e degli alberi dendritici in seguito a ictus (Brown et al., 2007; Brown et al., 2010; Nudo, 2013).
Abbiamo scoperto che la densità cellulare non neuronale è stata associata in modo significativamente positivo all’aumento della partecipazione alla rete durante la fase cronica. Sebbene la plasticità sinaptica sia tradizionalmente considerata come un’iniziazione neuronale, è ora chiaro che gli astrociti e la microglia possono modificare la connettività sinaptica in vari modi (Ben Achour e Pascual, 2010; Allen e Barres, 2005; Araque et al., 1999; Ullian et al., 2004) e possono persino alterare la forza sinaptica in assenza di attività neuronale (Clark et al., 2015). Astrociti e microglia possono avere effetti sia benefici che dannosi sulla plasticità post-lesione (Anderson et al., 2003; Loane e Kumar, 2016) e sono emersi come candidati promettenti per il trattamento a seguito di lesioni cerebrali acquisite nell’uomo (Barreto et al., 2011; Loane e Kumar, 2016). La nostra scoperta che la densità delle cellule non neuronali è positivamente correlata con l’aumento del coefficiente di partecipazione della rete durante la fase cronica fornisce un nuovo collegamento tra il ruolo locale della glia alla sinapsi e la plasticità dei modelli di connettività funzionale su larga scala.
I mozzi sono preferibilmente affetti da lesioni dell’ippocampo
Abbiamo scoperto che le regioni hub avevano maggiori probabilità di perdere la connettività funzionale con altre regioni (che si riflette in un calo sia della connettività funzionale all’interno del modulo che della partecipazione alla rete) a seguito di una lesione. Questo supporta l’idea che gli hub sono generalmente colpiti a seguito di una lesione o di un disturbo cerebrale. Crossley et al. (2014) hanno avanzato due ipotesi sul perché le regioni hub hanno maggiori probabilità di soffrire di patologia nei disturbi cerebrali (Crossley et al., 2014). La prima ipotesi affermava che le regioni centrali hanno un valore funzionale maggiore, e quindi i danni alle regioni centrali hanno più probabilità di essere sintomatici rispetto ai danni che si verificano altrove. Qui si dimostra che le regioni hub hanno in realtà maggiori probabilità di subire una perdita di connettività funzionale, anche se il sito primario del danno – l’ippocampo – non è di per sé un hub. Questo coincide in misura maggiore con la seconda ipotesi di Crossley et al., ovvero che gli hub sono biologicamente costosi, e quindi più vulnerabili a vari processi patogeni. Un’estensione di tale ipotesi è che i nodi sono più probabilmente collegati al sito di insulto primario (in questo caso l’ippocampo), e più probabilmente soffrono di diaschisi come risultato.
Abbiamo dimostrato che l'”hubness” è un predittore indipendente di perdite strutturali e funzionali a seguito di una lesione, anche dopo aver tenuto conto degli effetti della connettività funzionale all’area lesionata. Il degrado degli hub è stato anche associato a una distruzione della struttura complessiva della rete nella fase cronica. A 12 mesi dalla lesione, l’intera rete cerebrale si era separata in un numero minore di moduli debolmente interconnessi. Questo dimostra gli effetti che le lesioni focali possono avere sulle funzioni cerebrali globali.
Il meccanismo alla base della vulnerabilità degli hub alla lesione richiede ulteriori studi. Speculativamente, in un’analisi esplorativa, abbiamo trovato un neurone relativamente alto: un rapporto di cellule non neuronali nei poli, che forse indica una mancanza di cellule gliali di supporto per ogni neurone. Questo può significare che i nuclei sono meno in grado di adattarsi alle lesioni rispetto alle aree non-hub. Diversi studi hanno recentemente esaminato le relazioni tra le densità delle cellule e le proprietà dei nuclei, ma non sono ancora emerse relazioni coerenti, forse a causa dell’uso di diverse tecniche sperimentali e definizioni di nuclei in diverse specie (Beul et al., 2015; Beul et al., 2017; van den Heuvel et al., 2015; Rubinov et al., 2015; Scholtens et al., 2014).
Grotte e direzioni future
Dato che abbiamo scoperto che la plasticità in seguito a una lesione dipende fortemente dalla composizione cellulare delle diverse regioni cerebrali, può darsi che la specifica composizione cellulare dell’ippocampo possa aver giocato un ruolo anche nei modelli di plasticità che vediamo qui. La connettività unica dell’ippocampo rispetto ad altre regioni cerebrali può anche essere un fattore importante. Questo suggerisce che possiamo vedere modelli molto diversi di plasticità a seguito di lesioni ad altre regioni cerebrali. Saranno necessari studi futuri per determinare se le relazioni tra i modelli di connettività, i gradienti di microstruttura e i modelli di plasticità che seguono le lesioni cerebrali possono essere generalizzati alle lesioni di altre regioni cerebrali o sono specifici dell’ippocampo.
Conclusioni
Combinando precise lesioni anatomiche con scansioni multiple e multimodali per un periodo di un anno dopo una lesione, siamo stati in grado di dare tre contributi alla letteratura. In primo luogo, abbiamo dimostrato che i cambiamenti funzionali e strutturali possono essere molto diversi tra fasi acute e croniche. Questo evidenzia l’importanza di considerare attentamente il tempo trascorso dalla lesione quando si studia la plasticità post-lesione e il recupero comportamentale. Sosteniamo, ove possibile, la raccolta di dati in più punti temporali successivi alla lesione, al fine di mappare accuratamente il processo di recupero dinamico. In secondo luogo, mentre è noto da tempo che le aree collegate a una regione cerebrale lesa sono più suscettibili di essere influenzate dalla lesione rispetto alle aree non collegate, a nostra conoscenza questo è il primo studio che mostra quantitativamente che i modelli di plasticità post-lesione dipendono dalla connettività funzionale pre-lesione. Infine, ci colleghiamo attraverso scale spaziali e mostriamo come i gradienti microstrutturali e le misure di rete macrostrutturali possano fornire ulteriore valore predittivo e approfondimenti sul processo di plasticità.
Materiali e metodi
Questo studio è stato condotto in modo etico, umano e in conformità alle norme federali e alle linee guida contenute nella Guida del Consiglio Nazionale delle Ricerche per la cura e l’uso degli animali da laboratorio. Tutti gli animali sono stati trattati secondo un protocollo approvato dal Comitato per la cura e l’uso degli animali (IACUC) presso la Scuola di Medicina Icahn del Monte Sinai. L’istituzione è anche pienamente accreditata dall’Associazione per la valutazione e l’accreditamento della cura degli animali da laboratorio internazionale (AAALAC – #00002) dal 1967.
Dati
I dati sono disponibili per il download presso l’INDI PRIMatE Data Exchange (Milham et al., 2018): https://www.nitrc.org/account/login.php?return_to=http://fcon_1000.projects.nitrc.org/indi/PRIMEdownloads.html: Mount Sinai Philips Achieva 3T dataset. Gli utenti dovranno prima effettuare il login al NITRC e dovranno registrarsi al sito web del Progetto 1000 Functional Connectomes su NITRC (http://fcon_1000.projects.nitrc.org/indi/PRIME/mssm1.html) per accedere ai dataset PRIME-DE.
Il codice utilizzato per l’analisi è stato reso disponibile su Github: https://github.com/seanfw/froudist-walsh-et-al-elife-2018 (Froudist-Walsh, 2018; copia archiviata su https://github.com/elifesciences-publications/froudist-walsh-et-al-elife-2018).
Soggetti
I soggetti sono stati sette scimmie maschio macaco rhesus (Macaca mulatta; età media all’inizio dell’esperimento 3,5 anni, range 2,9-4 anni, peso medio all’inizio della scansione 6,0 kg, range 4,7-7,2 kg), e una scimmia femmina macaco cynomolgus (Macaca fascicularis; 8 anni all’inizio dell’esperimento, 4,7 kg all’inizio della scansione). 4 delle scimmie maschio e la scimmia femmina hanno ricevuto lesioni ippocampali neurotossiche bilaterali come descritto di seguito. Gli animali erano giovani adulti al momento della lesione (età media per i maschi, 4,4 anni, range 3,7-4,75 anni; età femminile 8 anni). Gli altri tre maschi hanno agito come controlli non operati, insieme ai dati pre-lesione acquisiti prima delle lesioni nelle altre scimmie. Sono stati scannerizzati nello stesso punto dello studio comportamentale dei maschi operati. Non erano disponibili set di dati completi per ogni scimmia poiché, a causa della difficoltà di acquisire dati ad alta risoluzione dalle scimmie, alcuni set di dati non erano di qualità sufficiente. I dati acquisiti per ogni scimmia sono riportati nella Tabella 2.
| T1-pesato | Stato di riposo | ||||||
|---|---|---|---|---|---|---|---|
| Scimmia | Gruppo | Pre | 3 mesi | 1 anno | Pre | 3 mesi | 1 anno |
| E | Lesion | X | X | X | X | ||
| M | Lesion | X | X | X | X | X | X |
| N | Lesion | X | X | X | X | ||
| S | Lesion | X | X | X | X | X | |
| T | Lesion | X | X | X | X | X | X |
| C | Controllo | X | X | ||||
| L | Controllo | X | X | ||||
| W | Controllo | X | X | ||||
| Totale | 8 | 5 | 4 | 6 | 4 | 4 | |
Comportamento
Tutte le scimmie, tranne la femmina cynomolgus, sono state testate su un test di memoria episodica, il compito di apprendimento della scena oggetto sul posto. I risultati comportamentali di queste scimmie M, N, S e T sono descritti altrove (H1-H4 in Froudist-Walsh et al., 2018). Le scimmie hanno avuto un deterioramento della memoria retrograda, ma nessun deterioramento della memoria anterograda sul compito di memoria episodica.
Lesioni ippocampali
Le scimmie hanno ricevuto lesioni ippocampali bilaterali neurotossiche neurotossiche guidate da risonanza magnetica con i metodi descritti da Hampton et al. (Hampton et al., 2004). Le procedure neurochirurgiche sono state eseguite in una sala operatoria dedicata in condizioni asettiche. In breve, le scimmie sono stati sedati con un cocktail di dex-medetomidina (0,01 mg / kg), buprenorfina (0,01 mg / kg) e midazolam (0,1 mg / kg) dato i.m.. Se necessario, sono state somministrate ricariche di dex-medetomidina (0,003 mg/kg) e midazolam (0,1 mg/kg) senza buprenorfina (per evitare un’eccessiva depressione respiratoria) ed eventuali ulteriori ricariche di dex-medetomidina (0,003 mg/kg) solo se necessario. Questo protocollo è stato scelto per evitare l’uso dell’antagonista NMDA ketamina, che potrebbe potenzialmente contrastare gli effetti della NMDA usata come eccitotossina (Hampton et al., 2004).
Le scimmie sono state intubate, è stato inserito un catetere endovenoso e l’anestesia è stata mantenuta con sevoflurano (1,5-4%, per effetto, in ossigeno al 100%). Le scimmie sono stati dati glicopirronio (0,01 mg / kg i.m.), antibiotici (Cefazolina, 25 mg / kg i.m.), steroidi (metilprednisolone, 20 mg / kg i.v.), non steroidei anti-infiammatori (meloxicam, 0.2 mg/kg i.v.), e un antagonista del recettore H2 (ranitidina, 1 mg/kg, i.v.) per prevenire l’ulcerazione gastrica dopo la somministrazione sia di steroidi che di antinfiammatori non steroidei. Atipamezolo è stato utilizzato per invertire l’agonista α2-adrenergico, se necessario, una volta che l’anestesia è stato stabilizzato. Le scimmie hanno ricevuto fluidi i.v. durante l’intera procedura (5 ml/kg/hr i.v.).
La scimmia è stata collocata in un telaio stereotassico nella stessa posizione della scansione MRI strutturale pre-operatoria (utilizzando un marker dentale; Saunders et al., 1990). La testa è stata pulita con un detergente antimicrobico e la pelle e le galee sottostanti sono state aperte a strati. Sono stati praticati piccoli fori sui punti di ingresso dell’iniezione: uno dorsale e posteriore all’asse lungo dell’ippocampo e uno dorsale all’unco in ogni emisfero (vedi Hampton et al. (2004) per i dettagli). Due micromanipolatori (Kopf Instruments, Tujunga, CA) sono stati dotati di siringhe a tenuta di gas (Hamilton, Reno, NV) con un ago da 28 ga, punto stile 4, utilizzando misure ottenute dalla scansione preoperatoria ponderata T1 all’estensione più anteriore dell’ippocampo e iniezioni di N-metil D-aspartato (NMDA; 0,3 M in soluzione fisiologica sterile) sono state effettuate da anteriore a posteriore, distanziate di 1,5 mm. Ogni iniezione è stata di 3 μl di volume, fatta ad una velocità di 0,5 μl / min, con 1 min tra i bersagli. Dopo l’iniezione finale l’ago è stato sollevato 0,5 mm e sono trascorsi 10 minuti prima di essere estratto. Per le iniezioni di uncus sono state effettuate due iniezioni per emisfero, 3 μl in volume, effettuate ad una velocità di 0,5 μl/min, con 3 min tra i bersagli. Propanololo (0,5 ml di 1 mg / ml per dose) è stato somministrato immediatamente prima delle iniezioni NMDA e ri-amministrati come necessario (fino a quattro volte) per prevenire la tachicardia durante le iniezioni a causa di effetti non specifici di NMDA. Una scimmia ha ricevuto propofol (4,0 ml totali in boli di 0,5-1,0 ml di una soluzione di 10 mg / ml) per integrare l’anestesia, a causa della tachipnea, anche probabile che sia un effetto non specifico della NMDA. Una volta che la lesione è stata completata la pelle e galea sono stati cuciti a strati.
Quando la lesione era completa, le scimmie hanno ricevuto 0,2 mg / kg metoclopramide (i.m.) per prevenire il vomito postoperatorio. Le scimmie hanno ricevuto anche 0,1 mg / kg di midazolam (i.m.) per prevenire le convulsioni. Essi sono stati estubati quando un riflesso di deglutizione era evidente, tornato alla gabbia di casa, e monitorato continuamente fino a quando la postura normale è stato riconquistato. Le scimmie post-operatorie sono state trattate con antibiotici, steroidi e analgesia per 3-5 giorni. Le scimmie operate sono state restituite ai loro gruppi sociali entro 3 giorni dall’intervento.
Dopo il primo intervento abbiamo valutato l’estensione della lesione con una scansione pesata in T2 (Málková et al., 2001) e abbiamo usato il risultato per pianificare il secondo intervento, mirando le coordinate dell’iniezione alle regioni con bassa iperestesia. Tutte le scimmie hanno ricevuto due interventi chirurgici per lesioni, tranne la scimmia E, che ne ha richiesto solo uno.
I dati della risonanza magnetica funzionale di BOLD a livello cerebrale sono stati raccolti per 40 minuti utilizzando una sequenza tridimensionale con i seguenti parametri: 40 fette assiali; dimensioni 1,5 × 1,5 × 1,5 × 1,5 mm; TR, 2600 ms; TE, 19 ms; 988 volumi, fattore di accelerazione = 2. Una scansione strutturale (tre medie) è stata acquisita per ogni scimmia utilizzando una T1-ponderata magnetizzazione preparato rapida sequenza di acquisizione gradiente di eco gradiente (0,5 × 0,5 × 0,5 × 0,5 mm). Un ulteriore scansione pesata T1 e una scansione pesata T2 (0,5 × 0,5 × 0,5 × 0,5 mm) sono stati acquisiti 6 giorni dopo l’intervento per valutare l’estensione della lesione. Per le scansioni fMRI a riposo, i livelli di isoflurano sono stati mantenuti al minimo per garantire la conservazione delle reti a riposo: isoflurano medio 1,2%, range 1,0-1,6% (Hutchison et al., 2014; Vincent et al., 2007). La fMRI a riposo è stata effettuata almeno 2 ore dopo la somministrazione di ketamina, per ridurre gli effetti dannosi della ketamina sulle reti dello stato di riposo (Bonhomme et al., 2016). La CO2 end-tidal è stata mantenuta in un range normocapnico, ove possibile, per evitare effetti di ipercapnia sul segnale BOLD: CO2 media 39 mmHg, range 33-45 mmHg (Bandettini e Wong, 1997; Kastrup et al., 1999; Rostrup et al., 2000).
Istologia
Alla fine dello studio, le scimmie sono state profondamente anestetizzate con ketamina (10 mg / kg), intubate e dato barbiturico di sodio (pentobarbital di sodio, 100 mg / kg) per via endovenosa. Sono state poi perfuse transcardialmente con 0,9% di soluzione salina seguita da 4% di parafomaaldeide. I cervelli sono stati post-fissati in paraformaldeide durante la notte e poi crioprotetti in soluzione di saccarosio al 30% in soluzione salina allo 0,9% e tagliati in sezioni di 50 μm coronalmente su un microtomo di congelamento. 1 in cinque sezioni è stato macchiato con violetto di cresile per i corpi cellulari. Le sezioni contenenti l’ippocampo sono state fotografate utilizzando un microscopio ottico Nikon Eclipse 80i con un obiettivo 4x. La riduzione volumetrica dell’ippocampo è stata effettuata alle Fiji, una versione del programma di analisi delle immagini ImageJ (https://imagej.nih.gov/ij/). Il volume dell’ippocampo è stato delineato manualmente sulle sezioni dell’atlante delle scimmie ‘Rosso’ (utilizzando i criteri di Málková et al., 2001) e il restante volume dell’ippocampo dell’ippocampo è stato delineato manualmente sulle immagini delle sezioni di cresyl violet. Le sezioni sono state poi deformate in modo non lineare all’atlante utilizzando la funzione bUnwarpJ e il volume di ogni sezione dell’ippocampo calcolato come percentuale del volume normale dell’ippocampo (Tabella 1). La sovrapposizione tra il volume ippocampale rimanente attraverso tutte e cinque le scimmie e il volume normale dell’ippocampo è mostrato in Figura 1B.
Analisi dei dati della risonanza magnetica
Valutazione delle lesioni ippocampali e delle alterazioni strutturali nelle aree collegate
Pre-elaborazione strutturale dei dati
Questa analisi ha comportato scansioni strutturali da punti temporali pre-operatori (n = 8), 3 mesi (n = 5) e 12 mesi (n = 4). Le tre immagini strutturali sono state mediate insieme per produrre un’immagine con un elevato rapporto segnale/rumore.
Valutazione della lesione ippocampale
La scansione ponderata T2 post-operatoria è stata registrata linearmente alla scansione ponderata T1 pre-operatoria utilizzando lo strumento FSL FLIRT. Le scansioni preoperatorie ponderate T1 sono state poi registrate in modo non lineare nello spazio MNI della scimmia utilizzando lo strumento FSL FNIRT ed è stato calcolato anche l’inverso della trasformazione. Abbiamo definito manualmente una regione di interesse dell’ippocampo (ROI) sul cervello MNI secondo i criteri descritti in Málková et al. (2001), l’abbiamo registrata di nuovo all’immagine preoperatoria T1 pesata della singola scimmia e l’abbiamo modificata manualmente per la precisione. Dopo aver trebbiato l’immagine pesata T2 per ogni scimmia all’85% della sua massima intensità e aver combinato le due immagini (per il primo e il secondo intervento) per le scimmie M, N, S e T, abbiamo calcolato la sovrapposizione con il ROI dell’ippocampo per ogni scimmia. Il volume di T2 ipersignetico rispetto al volume di ROI dell’ippocampo è mostrato nella Tabella 3. La sovrapposizione T2 per tutte le scimmie è mostrato in Figura 1A.
| Ippocampo | A sinistra | A destra | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Scimmia | Tentativi di lesione | Volume | Lesion | % | Volume | Lesion | % | Volume | Lesion | % |
| E | 1 | 821.38 | 244.13 | 29.72 | 429.25 | 94.88 | 22.10 | 392.13 | 149.25 | 38.06 |
| M | 2 | 1019.75 | 563.38 | 55.25 | 516.63 | 190.50 | 36.87 | 503.13 | 372.88 | 74.11 |
| N | 2 | 1161.38 | 179.50 | 15.46 | 607.63 | 109.38 | 18.00 | 553.75 | 70.13 | 12.66 |
| S | 2 | 979.24 | 706.49 | 72.15 | 484.12 | 398.37 | 82.29 | 495.12 | 308.12 | 62.23 |
| T | 2 | 937.38 | 690.63 | 73.68 | 442.88 | 364.00 | 82.19 | 494.50 | 326.63 | 66.05 |
Analisi morfometrica basata sulla deformazione
I dati strutturali sono stati analizzati per la prima volta utilizzando un’analisi in stile VBM come impiegata da Sallet et al. (Sallet et al., 2011), utilizzando gli strumenti FNIRT e Randomise (Jenkinson et al., 2012; Winkler et al., 2014). In primo luogo, tutti i cervelli sono stati deformati sul modello dell’atlante macaco MNI rhesus (Frey et al., 2011) utilizzando lo strumento di registrazione lineare affine FLIRT e poi lo strumento di registrazione non lineare FNIRT per produrre un’immagine di modello specifica per lo studio. Poiché la quantità di deformazione attesa dai punti di tempo pre-operatori a 3 mesi e 12 mesi era sproporzionatamente grande a causa delle lesioni, abbiamo incluso nel template tutto il cervello, non solo i dati di controllo (Reuter e Fischl, 2011; Reuter et al., 2012). L’ordito non lineare è stato sottoposto a cinque iterazioni, ognuna con un’ordito a più alta risoluzione e un crescente affinamento del template, con l’ordito finale che utilizzava una risoluzione di ordito (spaziatura dei nodi delle linee b cubiche) di 1 mm isotropa. E’ stato estratto il log determinante ristretto del Jacobian del campo di ordito per ogni cervello al template. Questo è il valore scalare della quantità di allungamento direzionale necessario per allineare ogni immagine strutturale con la sagoma.
L’analisi Voxelwise è stata effettuata su un’area limitata da una maschera di materia grigia estratta utilizzando la segmentazione automatica con FAST sul modello MNI macaco rhesus (Frey et al., 2011). Le variazioni longitudinali del volume di materia grigia sono state valutate utilizzando un modello lineare ad effetti misti, implementato in Matlab con la funzione FreeSurfer lme_mass_fit_vw per l’analisi del modello lineare misto univario di massa (Bernal-Rusiel et al., 2013) (https://surfer.nmr.mgh.harvard.edu/fswiki/LinearMixedEffectsModels). Per coerenza, sono stati analizzati solo i punti di tempo e le scimmie per le quali avevamo dati di stato a riposo. Le regioni sono state designate come significative se hanno superato una soglia di p < 0,005, con una soglia di estensione del cluster di 5 mm3 voxel (Sallet et al., 2011).
Cambiamenti di rete a seguito di lesioni dell’ippocampo
Pre-elaborazione funzionale dei dati
I dati fMRI a riposo sono stati analizzati utilizzando gli strumenti della FMRIB Software Library (FSL) (Jenkinson et al., 2012) e MATLAB (Mathworks, Natick, MA, USA). Ogni set di dati funzionali è stato dapprima strippato con BET (Smith, 2002) e corretto manualmente per assicurarsi che tutte le aree cerebrali fossero incluse. Gli artefatti del movimento della testa sono stati rimossi con la regressione lineare (MCFLIRT), è stata applicata la levigatura spaziale gaussiana (FWHM 3 mm) e il filtraggio passa alto (0,01 Hz) è stato applicato per ridurre il rumore da deriva dello scanner. Gli artefatti della vascolarizzazione, della respirazione e del movimento della testa sono stati identificati utilizzando un’analisi indipendente dei componenti limitata a 40 componenti (MELODIC) (Beckmann e Smith, 2004) e rimossi mediante regressione lineare.
Dati di tracciamento del tratto e atlante
I dati di connettività strutturale sono stati ricavati dal database CoCoMac di esperimenti di tracciamento del tratto, originariamente descritto da Stephan et al. (Stephan et al., 2001), così come una versione ‘migliorata’ dell’atlante, che è stato recentemente sviluppato da Deco e colleghi (Deco et al., 2014). Questa versione migliorata dell’atlante è stata sviluppata ri-pondando iterativamente i punti di forza della connessione, e ha portato a un drastico miglioramento degli adattamenti ai dati della risonanza magnetica funzionale a riposo. I dati sono stati utilizzati in combinazione con l’atlante della mappa regionale (Kötter e Wanke, 2005), che è stato sviluppato dallo stesso gruppo che ha originariamente sviluppato il CoCoMac, per l’uso con il database, ed è stato mappato con il modello standard di scimmia F99 da Shen e colleghi (Shen et al., 2012). La mappa regionale contiene 82 regioni principalmente corticali, e comprende l’ippocampo e l’amigdala. Le regioni cerebrali utilizzate, insieme alle loro abbreviazioni, sono mostrate nella Tabella 4.
| Abbreviazione della mappa regionale | Area del cervello |
|---|---|
| A1 | Corteccia uditiva primaria |
| A2 | Corteccia uditiva secondaria |
| Ia | Isla anteriore |
| Ip | Isla posteriore |
| Amyg | Amygdala |
| CCa | Corteccia cingolata anteriore |
| CCp | Corteccia cingolata posteriore |
| CCr | Corteccia retrospleniale |
| CCs | Corteccia cingolata sottogenuale |
| FEF | Campo visivo frontale |
| G | Area gustativa |
| HC | Ippocampo |
| M1 | Corteccia motoria primaria |
| PFCcl | Corteccia prefrontale centro-laterale |
| PFCdl | Corteccia prefrontale dorsolaterale |
| PFCdm | Corteccia prefrontale dorsomediale |
| PFCm | Corteccia prefrontale mediale |
| PFCoi | Corteccia prefrontale orbitale intermedia |
| PFCol | Corteccia prefrontale orbitolaterale |
| PFCom | Corteccia prefrontale orbitomediale |
| PFCvl | Corteccia prefrontale ventrolaterale |
| PFCpol | Corteccia prefrontale polare |
| PHC | Corteccia parahippocampale |
| PMCdl | Corteccia premotoria dorsolaterale |
| PMCm | Mediale (supplementare) corteccia premotoria |
| PMCvl | Corteccia premotoria ventrolaterale |
| S1 | Corteccia somatosensoriale primaria |
| S2 | Corteccia somatosensoriale secondaria |
| PCi | Corteccia parietale inferiore |
| PCip | Corteccia del solco intraparietale |
| PCm | Corteccia parietale mediale |
| PC | Corteccia parietale superiore |
| TCc | Corteccia temporale centrale |
| TCi | Corteccia temporale inferiore |
| TCs | Corteccia temporale superiore |
| TCpol | Corteccia temporale polare |
| TCv | Corteccia temporale ventrale |
| V1 | Corteccia visiva primaria |
| V2 | Corteccia visiva secondaria |
| VACd | Corteccia visiva anteriore dorsale |
| VACv | Corteccia visiva anteriore ventrale |
Un ordito è stato calcolato dal cervello F99 al cervello MNI delle scimmie utilizzando il software di normalizzazione ANTs (He et al., 2007) ed è stato applicato all’atlante della mappa regionale utilizzando l’interpolazione del vicino più vicino per ottenere l’atlante nello spazio (MNI delle scimmie) in cui risiedono i dati funzionali della risonanza magnetica.
Costruzione della matrice di connettività
Sono stati estratti i tempi di attività ippocampale sulle scansioni pre-lesionali. È stata calcolata la connettività funzionale dell’ippocampo sinistro e destro con tutte le altre regioni dalle scansioni pre-lesionali ed è stata calcolata la media dei dati per l’ippocampo sinistro e destro. La connettività dell’ippocampo pre-lesione è stata poi utilizzata come predittore dei cambiamenti plastici tra i punti temporali. L’ippocampo e l’amigdala bilateralmente sono stati esclusi dai calcoli della rete (se non diversamente specificato) al fine di mantenere un numero costante di nodi nella rete e consentire il confronto con le densità delle cellule corticali dallo studio di Collins et al. (2010). Le cronologie di ciascuna delle regioni dell’atlante rimanenti sono state poi estratte da ogni scansione dello stato di riposo. Per ogni scansione è stata costruita una matrice di connettività funzionale 78 × 78. Tutte le analisi, ad eccezione di quelle relative alle rappresentazioni grafiche orientate alla forza, sono state effettuate sulle matrici di connettività funzionale continua senza soglia, per evitare di scegliere soglie arbitrarie (Karolis et al., 2016). Le matrici di connettività funzionale sono state mediate su tutte le scimmie in ogni punto temporale.
Preparazione della materia grigia corticale
Abbiamo poi cercato di prevedere le alterazioni strutturali in tutto il cervello durante le fasi acute e croniche utilizzando gli stessi predittori delle analisi di connettività funzionale sopra descritte. Per fare questo, abbiamo usato gli orditi di ogni scansione originale pre- e post-lesione al modello. In particolare, abbiamo estratto il valore log-giacobiano per ogni area della mappa regionale, per ogni ordito. Il log-giacobiano è un valore che rappresenta la quantità di contrazione (per i numeri negativi) o di espansione (numeri positivi) che ha avuto luogo in modo che la regione cerebrale originale corrisponda strettamente alla stessa regione cerebrale sull’atlante. Se una regione si è ridotta di volume durante la fase acuta, allora questo sarà rappresentato come valore negativo quando si sottrae il log-giacobiano della regione alla scansione pre-lesione dal valore equivalente alla scansione di 3 mesi. Al contrario, un aumento di volume porterebbe ad un valore positivo. La stessa logica vale per la fase cronica, quando si confrontano le scansioni a 3 e 12 mesi.
Visualizzazione della connettività funzionale dell’ippocampo e confronto con il CoCoMac
La connettività funzionale dell’ippocampo è stata visualizzata in superficie utilizzando il Connectome Workbench (www.humanconnectome.org/software/connectome-workbench).
Dopo aver estratto la connettività funzionale dell’ippocampo con il resto del cervello, l’abbiamo confrontata con la connettività strutturale dell’ippocampo sulla base degli atlanti originali e potenziati del CoCoMac, utilizzando le correlazioni di Pearson.
Analisi della densità cellulare
Al fine di mappare i dati di densità neuronale e gliale sull’atlante utilizzato nello studio attuale, due autori (SFW e PLC) hanno eseguito una mappatura di consenso delle aree descritte nello studio anatomico di Collins et al. (Collins et al., 2010) sulla mappa regionale (Kötter e Wanke, 2005). Se più aree della mappa di Collins si riferiscono ad una singola area nella mappa regionale, allora è stata presa una semplice media di tutte le aree rilevanti per rappresentare la densità neuronale (o gliale) in quell’area.
Misure di connettività funzionale
Al fine di valutare in modo parsimonioso come il profilo di connettività funzionale di ogni regione cerebrale è stato influenzato dalla lesione dell’ippocampo, abbiamo valutato due misure di connettività funzionale. All’interno del modulo la connettività funzionale è la connettività funzionale media di un nodo con tutti gli altri nodi all’interno del suo modulo locale (alias modulo). Abbiamo anche analizzato le modifiche al coefficiente di partecipazione alla rete, che valuta quanto fortemente le connessioni funzionali di un nodo sono distribuite in tutti i moduli del cervello, ed è stato proposto come misura dei nodi di connessione nel cervello (Power et al., 2013).
Per valutare la connettività funzionale del cervello in questo modo, abbiamo definito i moduli del cervello (moduli) utilizzando l’algoritmo di rilevazione del modulo di Lovanio (Blondel et al., 2008), come implementato nel Brain Connectivity Toolbox (Rubinov e Sporns, 2010). Il rilevamento del modulo è stato ripetuto 10000 volte, e i moduli più coerenti sono stati utilizzati nel resto del manoscritto.
Il rilevamento del modulo utilizzando l’algoritmo di Lovanio dipende dalla scelta di un parametro di risoluzione (lambda). In generale i risultati presentati nel manoscritto principale utilizzano il valore del parametro predefinito (1), se non diversamente specificato. Tuttavia, abbiamo ripetuto tutte le analisi utilizzando un intervallo di valori (tra 0,8 e 1,4). Questi valori sono stati scelti perché rappresentavano gli estremi del rilevamento dei moduli, con solo due moduli rilevati a lambda = 0,8, e moduli di singole aree cerebrali rilevati a lambda = 1,4.
Mozzi e modularità
Poiché sia l’alta resistenza del nodo che l’alto coefficiente di partecipazione della rete sono proposti come identificatori degli hub di rete, e le due metriche sono state positivamente correlate nei dati attuali, abbiamo eseguito un’analisi dei componenti principali sulla matrice 78 × 2 che rappresentava un coefficiente di resistenza del nodo e di partecipazione della rete per ogni regione di materia grigia. Abbiamo trovato che la prima componente principale spiegava il 73,19% della varianza nei dati sulla forza del nodo e sul coefficiente di partecipazione della rete. Questa prima componente principale è poi diventata la nostra misura continua di “hubness”.
Utilizzando la precedente definizione di moduli, abbiamo poi valutato le variazioni longitudinali nella connettività funzionale all’interno del modulo. Un calo nella connettività funzionale all’interno del modulo può essere visto sulla rappresentazione grafica della matrice come dispersione dei moduli nel tempo (Figura 6). Le differenze di dispersione tra i moduli nelle fasi acuta e cronica sono state valutate utilizzando ANOVA unidirezionale.
Abbiamo poi ripetuto la stessa analisi, ma invece di valutare il calo di connettività funzionale all’interno del modulo per ogni modulo, abbiamo confrontato hub con regioni non-hub, sempre utilizzando un ANOVA unidirezionale.
Previsione della plasticità nelle fasi acute e croniche
La relazione tra densità neuronale, densità cellulare non neuronale, hubness, connettività ippocampale pre-lesione e le nostre misure di plasticità (connettività funzionale all’interno del modulo, partecipazione alla rete e volume di materia grigia corticale) è stata valutata utilizzando una serie di modelli di regressione graduale.
Per i cambiamenti di fase acuta, è stata eseguita una semplice regressione graduale con densità neuronale, densità cellulare non neuronale, hubness, connettività ippocampale pre-lesione-ippocampale come predittori e cambiamenti di fase acuta sia all’interno del modulo di connettività funzionale, partecipazione alla rete e volume di materia grigia corticale come variabile dipendente.
Poiché la definizione dei cambiamenti di stadio acuti e cronici ha condiviso la scansione di 3 mesi, non erano indipendenti. Al fine di identificare i cambiamenti cronici dello stadio che erano indipendenti dai cambiamenti acuti dello stadio, abbiamo prima valutato la relazione tra i due utilizzando un modello lineare generale con i cambiamenti acuti dello stadio come variabile indipendente e i cambiamenti cronici dello stadio come variabile dipendente. I residui di questa analisi sono stati considerati come i cambiamenti indipendenti dello stadio cronico.
Per i cambiamenti cronici dello stadio, è stata poi eseguita una regressione graduale, sempre con densità neuronale, densità cellulare non neuronale, hubness, connettività ippocampale pre-lesione come predittori e i cambiamenti cronici residui fase cronica sia all’interno del modulo di connettività funzionale, la partecipazione alla rete e il volume di materia grigia corticale come variabile dipendente.
Poiché, per definizione, gli stadi acuti (3 mesi – 0 mesi) e cronici (1 anno – 3 mesi) condividono un punto temporale comune (la scansione a 3 mesi), ci si aspetterebbe una correlazione negativa tra le regioni in base alla progettazione. Per valutare se la relazione tra i cambiamenti di fase acuta e cronica è diversa da quella prevista per caso, abbiamo creato una distribuzione nulla come segue. Su ciascuna delle 1000 simulazioni, sono stati disegnati 234 numeri casuali e divisi casualmente in tre gruppi di 78, che corrispondono al numero di regioni cerebrali extra-hippocampali registrate rispettivamente alla prelesione, allo stadio acuto e allo stadio cronico. Per ogni simulazione sono state poi calcolate le misure di “cambiamento” dello stadio acuto (3 mesi – 0 mesi) e cronico (12 mesi – 3 mesi) generate in modo casuale e per ogni simulazione è stato costruito un modello lineare generale con la misura dello stadio acuto casuale come predittore dei cambiamenti casuali dello stadio cronico attraverso le 78 “regioni”. Per ciascuna delle 1000 simulazioni, è stata salvata una t-statistica per il predittore dello stadio acuto casuale. Queste t-statistiche sono diventate la nostra distribuzione nulla, alla quale la nostra t-statistica osservata sperimentalmente poteva essere confrontata. La relazione sperimentale è stata considerata significativa se il valore era all’interno del 2,5% dei coefficienti di correlazione simulati.
Relazione tra le misure di connettività su micro e macro scala
Abbiamo effettuato un’analisi esplorativa, dove abbiamo analizzato la relazione tra le misure di densità cellulare e l’hubness. Abbiamo usato le densità delle cellule neuronali e non neuronali come predittori dell’hubness in una regressione graduale.
Confronto statistico tra il set di dati completo e il set di dati a due scimmie
Abbiamo testato le differenze tra i valori beta nelle regressioni per il set di dati completo e per i set di dati a due scimmie utilizzando statistiche non parametriche come segue. Nell’ipotesi nulla, non c’è alcuna differenza tra il dataset completo e quello a due scimmie. Pertanto dovremmo ottenere gli stessi valori beta per le nostre regressioni nella fase acuta e in quella cronica, indipendentemente dal fatto che i dati delle variabili dipendenti (ad esempio la variazione acuta del coefficiente di partecipazione) per ogni regione siano presi dal dataset completo o da quello a due scimmie. Abbiamo così creato una distribuzione nulla come segue. Per ciascuna delle 78 regioni cerebrali, la variazione acuta del coefficiente di partecipazione è stata presa casualmente dal dataset completo o da due serie di dati di scimmie. Abbiamo poi eseguito la regressione acuta per gradi, come nell’analisi originale. I valori beta per le quattro variabili indipendenti (densità neuronale, densità cellulare non neuronale, hubness e connettività ippocampale) per la regressione originale (dati completi) sono stati poi sottratti dai valori beta per la regressione con i dati disegnati in modo casuale, e questa differenza nei valori beta è stata salvata. Questo processo è stato ripetuto 10.000 volte con diverse estrazioni casuali. Infine, per ottenere un valore p a due code, la differenza tra i valori beta per la regressione sui dati a due scimmie dai valori beta per la regressione dei dati completi per ogni variabile indipendente è stata confrontata con la distribuzione nulla. Se la differenza tra i dati completi e quelli a due scimmie si trovava al di fuori del 95% della distribuzione nulla, allora i valori beta erano diversi a livello p < 0,05 (a due code).
Questo processo è stato ripetuto per ognuna delle sei variabili dipendenti riportate nel documento (cambiamenti acuti/cronici di fase nel coefficiente di partecipazione, connettività all’interno del modulo e volume di materia grigia).
References
- Achard S, Delon-Martin C, Vértes PE, Renard F, Schenck M, Schneider F, Heinrich C, Kremer S, Bullmore ET. Hubs of brain functional networks are radically reorganized in comatose patients. PNAS. 2012; 109:20608-20613. DOI | PubMed
- Aggleton JP, Brown MW. Episodic memory, amnesia, and the hippocampal-anterior thalamic axis. Behavioral and Brain Sciences. 1999; 22:425-444. DOI | PubMed
- Allen NJ, Barres BA. Signaling between glia and neurons: focus on synaptic plasticity. Current Opinion in Neurobiology. 2005; 15:542-548. DOI | PubMed
- Anderson MF, Blomstrand F, Blomstrand C, Eriksson PS, Nilsson M. Astrocytes and stroke: networking for survival?. Neurochemical Research. 2003; 28:293-305. DOI | PubMed
- Araque A, Parpura V, Sanzgiri RP, Haydon PG. Tripartite synapses: glia, the unacknowledged partner. Trends in Neurosciences. 1999; 22:208-215. DOI | PubMed
- Ball G, Boardman JP, Rueckert D, Aljabar P, Arichi T, Merchant N, Gousias IS, Edwards AD, Counsell SJ. The effect of preterm birth on thalamic and cortical development. Cerebral Cortex. 2012; 22:1016-1024. DOI | PubMed
- Bandettini PA, Wong EC. A hypercapnia-based normalization method for improved spatial localization of human brain activation with fMRI. NMR in Biomedicine. 1997; 10:197-203. DOI | PubMed
- Barreto G, White RE, Ouyang Y, Xu L, Giffard RG. Astrocytes: targets for neuroprotection in stroke. Central Nervous System Agents in Medicinal Chemistry. 2011; 11:164-173. DOI | PubMed
- Baxter MG. Mediodorsal thalamus and cognition in non-human primates. Frontiers in Systems Neuroscience. 2013; 7DOI | PubMed
- Beckmann CF, Smith SM. Probabilistic independent component analysis for functional magnetic resonance imaging. IEEE Transactions on Medical Imaging. 2004; 23:137-152. DOI | PubMed
- Ben Achour S, Pascual O. Glia: the many ways to modulate synaptic plasticity. Neurochemistry International. 2010; 57:440-445. DOI | PubMed
- Bernal-Rusiel JL, Greve DN, Reuter M, Fischl B, Sabuncu MR, Initiative ADN, Alzheimer’s Disease Neuroimaging Initiative. Statistical analysis of longitudinal neuroimage data with Linear Mixed Effects models. NeuroImage. 2013; 66:249-260. DOI | PubMed
- Berthier ML, García-Casares N, Walsh SF, Nabrozidis A, Ruíz de Mier RJ, Green C, Dávila G, Gutiérrez A, Pulvermüller F. Recovery from post-stroke aphasia: lessons from brain imaging and implications for rehabilitation and biological treatments. Discovery Medicine. 2011; 12:275-289. PubMed
- Beul SF, Grant S, Hilgetag CC. A predictive model of the cat cortical connectome based on cytoarchitecture and distance. Brain Structure and Function. 2015; 220:3167-3184. DOI | PubMed
- Beul SF, Barbas H, Hilgetag CC. A predictive structural model of the primate connectome. Scientific Reports. 2017; 7DOI | PubMed
- Blondel VD, Guillaume J-L, Lambiotte R, Lefebvre E. Fast unfolding of communities in large networks. Journal of Statistical Mechanics: Theory and Experiment. 2008; 2008:P10008. DOI
- Bonhomme V, Vanhaudenhuyse A, Demertzi A, Bruno MA, Jaquet O, Bahri MA, Plenevaux A, Boly M, Boveroux P, Soddu A, Brichant JF, Maquet P, Laureys S. Resting-state network-specific breakdown of functional connectivity during ketamine alteration of consciousness in volunteers. Anesthesiology. 2016; 125:873-888. DOI | PubMed
- Brown CE, Li P, Boyd JD, Delaney KR, Murphy TH. Extensive turnover of dendritic spines and vascular remodeling in cortical tissues recovering from stroke. Journal of Neuroscience. 2007; 27:4101-4109. DOI | PubMed
- Brown CE, Boyd JD, Murphy TH. Longitudinal in vivo imaging reveals balanced and branch-specific remodeling of mature cortical pyramidal dendritic arbors after stroke. Journal of Cerebral Blood Flow & Metabolism. 2010; 30:783-791. DOI | PubMed
- Browning PG, Gaffan D, Croxson PL, Baxter MG. Severe scene learning impairment, but intact recognition memory, after cholinergic depletion of inferotemporal cortex followed by fornix transection. Cerebral Cortex. 2010; 20:282-293. DOI | PubMed
- Burt JB, Demirtaş M, Eckner WJ, Navejar NM, Ji JL, Martin WJ, Bernacchia A, Anticevic A, Murray JD. Hierarchy of transcriptomic specialization across human cortex captured by structural neuroimaging topography. Nature Neuroscience. 2018; 21:1251-1259. DOI | PubMed
- Caldinelli C, Froudist-Walsh S, Karolis V, Tseng CE, Allin MP, Walshe M, Cuddy M, Murray RM, Nosarti C. White matter alterations to cingulum and fornix following very preterm birth and their relationship with cognitive functions. NeuroImage. 2017; 150:373-382. DOI | PubMed
- Carrera E, Tononi G. Diaschisis: past, present, future. Brain. 2014; 137:2408-2422. DOI | PubMed
- Catani M, ffytche DH. The rises and falls of disconnection syndromes. Brain. 2005; 128:2224-2239. DOI | PubMed
- Chaudhuri R, Knoblauch K, Gariel MA, Kennedy H, Wang XJ. A large-scale circuit mechanism for hierarchical dynamical processing in the primate cortex. Neuron. 2015; 88:419-431. DOI | PubMed
- Clark AK, Gruber-Schoffnegger D, Drdla-Schutting R, Gerhold KJ, Malcangio M, Sandkühler J. Selective activation of microglia facilitates synaptic strength. Journal of Neuroscience. 2015; 35:4552-4570. DOI | PubMed
- Coffey PJ, Perry VH, Allen Y, Sinden J, Rawlins JN. Ibotenic acid induced demyelination in the central nervous system: a consequence of a local inflammatory response. Neuroscience Letters. 1988; 84:178-184. DOI | PubMed
- Collins CE, Airey DC, Young NA, Leitch DB, Kaas JH. Neuron densities vary across and within cortical areas in primates. PNAS. 2010; 107:15927-15932. DOI | PubMed
- Corbetta M, Kincade MJ, Lewis C, Snyder AZ, Sapir A. Neural basis and recovery of spatial attention deficits in spatial neglect. Nature Neuroscience. 2005; 8:1603-1610. DOI | PubMed
- Corkin S, Amaral DG, González RG, Johnson KA, Hyman BT. H. M.’s medial temporal lobe lesion: findings from magnetic resonance imaging. The Journal of Neuroscience. 1997; 17:3964-3979. DOI | PubMed
- Cramer SC. Repairing the human brain after stroke: I. Mechanisms of spontaneous recovery. Annals of Neurology. 2008; 63:272-287. DOI | PubMed
- Crossley NA, Mechelli A, Scott J, Carletti F, Fox PT, McGuire P, Bullmore ET. The hubs of the human connectome are generally implicated in the anatomy of brain disorders. Brain. 2014; 137:2382-2395. DOI | PubMed
- Croxson PL, Browning PG, Gaffan D, Baxter MG. Acetylcholine facilitates recovery of episodic memory after brain damage. Journal of Neuroscience. 2012; 32:13787-13795. DOI | PubMed
- Deco G, McIntosh AR, Shen K, Hutchison RM, Menon RS, Everling S, Hagmann P, Jirsa VK. Identification of optimal structural connectivity using functional connectivity and neural modeling. Journal of Neuroscience. 2014; 34:7910-7916. DOI | PubMed
- Dzieciol AM, Bachevalier J, Saleem KS, Gadian DG, Saunders R, Chong WKK, Banks T, Mishkin M, Vargha-Khadem F. Hippocampal and diencephalic pathology in developmental amnesia. Cortex. 2017; 86:33-44. DOI | PubMed
- Elston GN, Okamoto T, Oga T, Dornan D, Fujita I. Spinogenesis and pruning in the primary auditory cortex of the macaque monkey (Macaca fascicularis): an intracellular injection study of layer III pyramidal cells. Brain Research. 2010; 1316:35-42. DOI | PubMed
- Frey S, Pandya DN, Chakravarty MM, Bailey L, Petrides M, Collins DL. An MRI based average macaque monkey stereotaxic atlas and space (MNI monkey space). NeuroImage. 2011; 55:1435-1442. DOI | PubMed
- Froudist-Walsh S, Bloomfield MA, Veronese M, Kroll J, Karolis VR, Jauhar S, Bonoldi I, McGuire PK, Kapur S, Murray RM, Nosarti C, Howes O. The effect of perinatal brain injury on dopaminergic function and hippocampal volume in adult life. eLife. 2017; 6DOI | PubMed
- Froudist-Walsh S, Browning PGF, Croxson PL, Murphy KL, Shamy JL, Veuthey TL, Wilson CRE, Baxter MG. The rhesus monkey hippocampus critically contributes to scene memory retrieval, but not new learning. The Journal of Neuroscience. 2018; 38:7800-7808. DOI | PubMed
- Froudist-Walsh S. GitHub. 2018. Publisher Full Text
- Gaffan D. Against memory systems. Philosophical Transactions of the Royal Society B: Biological Sciences. 2002; 357:1111-1121. DOI | PubMed
- Goulas A, Zilles K, Hilgetag CC. Cortical Gradients and Laminar Projections in Mammals. Trends in Neurosciences. 2018; 41:775-788. DOI | PubMed
- Grayson DS, Bliss-Moreau E, Machado CJ, Bennett J, Shen K, Grant KA, Fair DA, Amaral DG. The rhesus monkey connectome predicts disrupted functional networks resulting from pharmacogenetic inactivation of the amygdala. Neuron. 2016; 91:453-466. DOI | PubMed
- Hampton RR, Hampstead BM, Murray EA. Selective hippocampal damage in rhesus monkeys impairs spatial memory in an open-field test. Hippocampus. 2004; 14:808-818. DOI | PubMed
- He BJ, Snyder AZ, Vincent JL, Epstein A, Shulman GL, Corbetta M. Breakdown of functional connectivity in frontoparietal networks underlies behavioral deficits in spatial neglect. Neuron. 2007; 53:905-918. DOI | PubMed
- Henson RN, Greve A, Cooper E, Gregori M, Simons JS, Geerligs L, Erzinçlioğlu S, Kapur N, Browne G. The effects of hippocampal lesions on MRI measures of structural and functional connectivity. Hippocampus. 2016; 26:1447-1463. DOI | PubMed
- Hoskison MM, Moore AN, Hu B, Orsi S, Kobori N, Dash PK. Persistent working memory dysfunction following traumatic brain injury: evidence for a time-dependent mechanism. Neuroscience. 2009; 159:483-491. DOI | PubMed
- Hutchison RM, Hutchison M, Manning KY, Menon RS, Everling S. Isoflurane induces dose-dependent alterations in the cortical connectivity profiles and dynamic properties of the brain’s functional architecture. Human Brain Mapping. 2014; 35:5754-5775. DOI | PubMed
- Isaacs EB, Vargha-Khadem F, Watkins KE, Lucas A, Mishkin M, Gadian DG. Developmental amnesia and its relationship to degree of hippocampal atrophy. PNAS. 2003; 100:13060-13063. DOI | PubMed
- Jenkinson M, Beckmann CF, Behrens TE, Woolrich MW, Smith SM. FSL. NeuroImage. 2012; 62:782-790. DOI | PubMed
- Kastrup A, Krüger G, Glover GH, Neumann-Haefelin T, Moseley ME. Regional variability of cerebral blood oxygenation response to hypercapnia. NeuroImage. 1999; 10:675-681. DOI | PubMed
- Kinoshita K. Traumatic brain injury: pathophysiology for neurocritical care. Journal of Intensive Care. 2016; 4:29. DOI | PubMed
- Köhler C, Schwarcz R. Comparison of ibotenate and kainate neurotoxicity in rat brain: a histological study. Neuroscience. 1983; 8:819-835. DOI | PubMed
- Kötter R, Wanke E. Mapping brains without coordinates. Philosophical Transactions of the Royal Society B: Biological Sciences. 2005; 360:751-766. DOI | PubMed
- Kuceyeski A, Kamel H, Navi BB, Raj A, Iadecola C. Predicting future brain tissue loss from white matter connectivity disruption in ischemic stroke. Stroke. 2014; 45:717-722. DOI | PubMed
- Lazar RM, Antoniello D. Variability in recovery from aphasia. Current Neurology and Neuroscience Reports. 2008; 8:497-502. DOI | PubMed
- Loane DJ, Kumar A. Microglia in the TBI brain: The good, the bad, and the dysregulated. Experimental Neurology. 2016; 275 Pt 3:316-327. DOI | PubMed
- Málková L, Lex CK, Mishkin M, Saunders RC. MRI-Based evaluation of locus and extent of neurotoxic lesions in monkeys. Hippocampus. 2001; 11:361-370. DOI | PubMed
- Malkova L, Mishkin M. One-trial memory for object-place associations after separate lesions of hippocampus and posterior parahippocampal region in the monkey. The Journal of Neuroscience. 2003; 23:1956-1965. DOI | PubMed
- Margulies DS, Ghosh SS, Goulas A, Falkiewicz M, Huntenburg JM, Langs G, Bezgin G, Eickhoff SB, Castellanos FX, Petrides M, Jefferies E, Smallwood J. Situating the default-mode network along a principal gradient of macroscale cortical organization. PNAS. 2016; 113:12574-12579. DOI | PubMed
- Markov NT, Vezoli J, Chameau P, Falchier A, Quilodran R, Huissoud C, Lamy C, Misery P, Giroud P, Ullman S, Barone P, Dehay C, Knoblauch K, Kennedy H. Anatomy of hierarchy: feedforward and feedback pathways in macaque visual cortex. Journal of Comparative Neurology. 2014; 522:225-259. DOI | PubMed
- Milham MP, Ai L, Koo B, Xu T, Amiez C, Balezeau F, Baxter MG, Blezer ELA, Brochier T, Chen A, Croxson PL, Damatac CG, Dehaene S, Everling S, Fair DA, Fleysher L, Freiwald W, Froudist-Walsh S, Griffiths TD, Guedj C, Hadj-Bouziane F, Ben Hamed S, Harel N, Hiba B, Jarraya B, Jung B, Kastner S, Klink PC, Kwok SC, Laland KN, Leopold DA, Lindenfors P, Mars RB, Menon RS, Messinger A, Meunier M, Mok K, Morrison JH, Nacef J, Nagy J, Rios MO, Petkov CI, Pinsk M, Poirier C, Procyk E, Rajimehr R, Reader SM, Roelfsema PR, Rudko DA, Rushworth MFS, Russ BE, Sallet J, Schmid MC, Schwiedrzik CM, Seidlitz J, Sein J, Shmuel A, Sullivan EL, Ungerleider L, Thiele A, Todorov OS, Tsao D, Wang Z, Wilson CRE, Yacoub E, Ye FQ, Zarco W, Zhou YD, Margulies DS, Schroeder CE. An open resource for non-human primate imaging. Neuron. 2018; 100:61-74. DOI | PubMed
- Mitchell AS, Browning PG, Wilson CR, Baxter MG, Gaffan D. Dissociable roles for cortical and subcortical structures in memory retrieval and acquisition. Journal of Neuroscience. 2008; 28:8387-8396. DOI | PubMed
- Nosarti C, Froudist-Walsh S. Alterations in development of hippocampal and cortical memory mechanisms following very preterm birth. Developmental Medicine & Child Neurology. 2016; 58 Suppl 4:35-45. DOI | PubMed
- Nudo RJ. Recovery after brain injury: mechanisms and principles. Frontiers in Human Neuroscience. 2013; 7DOI | PubMed
- Olsen RK, Palombo DJ, Rabin JS, Levine B, Ryan JD, Rosenbaum RS. Volumetric analysis of medial temporal lobe subregions in developmental amnesia using high-resolution magnetic resonance imaging. Hippocampus. 2013; 23:855-860. DOI | PubMed
- Power JD, Schlaggar BL, Lessov-Schlaggar CN, Petersen SE. Evidence for hubs in human functional brain networks. Neuron. 2013; 79:798-813. DOI | PubMed
- Reuter M, Fischl B. Avoiding asymmetry-induced bias in longitudinal image processing. NeuroImage. 2011; 57:19-21. DOI | PubMed
- Reuter M, Schmansky NJ, Rosas HD, Fischl B. Within-subject template estimation for unbiased longitudinal image analysis. NeuroImage. 2012; 61:1402-1418. DOI | PubMed
- Rostrup E, Law I, Blinkenberg M, Larsson HB, Born AP, Holm S, Paulson OB. Regional differences in the CBF and BOLD responses to hypercapnia: a combined PET and fMRI study. NeuroImage. 2000; 11:87-97. DOI | PubMed
- Rubinov M, Sporns O. Complex network measures of brain connectivity: uses and interpretations. NeuroImage. 2010; 52:1059-1069. DOI | PubMed
- Rubinov M, Ypma RJ, Watson C, Bullmore ET. Wiring cost and topological participation of the mouse brain connectome. PNAS. 2015; 112:10032-10037. DOI | PubMed
- Rubinov M. Constraints and spandrels of interareal connectomes. Nature Communications. 2016; 7DOI | PubMed
- Sallet J, Mars RB, Noonan MP, Andersson JL, O’Reilly JX, Jbabdi S, Croxson PL, Jenkinson M, Miller KL, Rushworth MF. Social network size affects neural circuits in macaques. Science. 2011; 334:697-700. DOI | PubMed
- Salvan P, Froudist Walsh S, Allin MP, Walshe M, Murray RM, Bhattacharyya S, McGuire PK, Williams SC, Nosarti C. Road work on memory lane–functional and structural alterations to the learning and memory circuit in adults born very preterm. NeuroImage. 2014; 102 Pt 1:152-161. DOI | PubMed
- Sanides F. Architectonics of the human frontal lobe of the brain. With a demonstration of the principles of its formation as a reflection of phylogenetic differentiation of the cerebral cortex. Monographien Aus Dem Gesamtgebiete Der Neurologie Und Psychiatrie. 1962; 98:1-201. PubMed
- Saunders RC, Aigner TG, Frank JA. Magnetic resonance imaging of the rhesus monkey brain: use for stereotactic neurosurgery. Experimental Brain Research. 1990; 81:443-446. DOI | PubMed
- Scholtens LH, Schmidt R, de Reus MA, van den Heuvel MP. Linking macroscale graph analytical organization to microscale neuroarchitectonics in the macaque connectome. Journal of Neuroscience. 2014; 34:12192-12205. DOI | PubMed
- Scoville WB, Milner B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery & Psychiatry. 1957; 20:11-21. DOI | PubMed
- Shen K, Bezgin G, Hutchison RM, Gati JS, Menon RS, Everling S, McIntosh AR. Information processing architecture of functionally defined clusters in the macaque cortex. Journal of Neuroscience. 2012; 32:17465-17476. DOI | PubMed
- Smania N, Gandolfi M, Aglioti SM, Girardi P, Fiaschi A, Girardi F. How long is the recovery of global aphasia? Twenty-five years of follow-up in a patient with left hemisphere stroke. Neurorehabilitation and Neural Repair. 2010; 24:871-875. DOI | PubMed
- Smith SM. Fast robust automated brain extraction. Human Brain Mapping. 2002; 17:143-155. DOI | PubMed
- Stephan KE, Kamper L, Bozkurt A, Burns GA, Young MP, Kötter R. Advanced database methodology for the collation of connectivity data on the macaque brain (CoCoMac). Philosophical Transactions of the Royal Society B: Biological Sciences. 2001; 356:1159-1186. DOI | PubMed
- Thiebaut de Schotten M, Dell’Acqua F, Ratiu P, Leslie A, Howells H, Cabanis E, Iba-Zizen MT, Plaisant O, Simmons A, Dronkers NF, Corkin S, Catani M. From phineas gage and monsieur leborgne to h.m.: revisiting disconnection syndromes. Cerebral Cortex. 2015; 25:4812-4827. DOI | PubMed
- Tseng CJ, Froudist-Walsh S, Brittain PJ, Karolis V, Caldinelli C, Kroll J, Counsell SJ, Williams SC, Murray RM, Nosarti C. A multimodal imaging study of recognition memory in very preterm born adults. Human Brain Mapping. 2017; 38:644-655. DOI | PubMed
- Ullian EM, Christopherson KS, Barres BA. Role for glia in synaptogenesis. Glia. 2004; 47:209-216. DOI | PubMed
- van den Heuvel MP, Scholtens LH, Feldman Barrett L, Hilgetag CC, de Reus MA. Bridging Cytoarchitectonics and Connectomics in Human Cerebral Cortex. Journal of Neuroscience. 2015; 35:13943-13948. DOI | PubMed
- van Meer MP, van der Marel K, Wang K, Otte WM, El Bouazati S, Roeling TA, Viergever MA, Berkelbach van der Sprenkel JW, Dijkhuizen RM. Recovery of sensorimotor function after experimental stroke correlates with restoration of resting-state interhemispheric functional connectivity. Journal of Neuroscience. 2010; 30:3964-3972. DOI | PubMed
- Vargha-Khadem F, Gadian DG, Mishkin M. Dissociations in cognitive memory: the syndrome of developmental amnesia. Philosophical Transactions of the Royal Society B: Biological Sciences. 2001; 356:1435-1440. DOI | PubMed
- Vincent JL, Patel GH, Fox MD, Snyder AZ, Baker JT, Van Essen DC, Zempel JM, Snyder LH, Corbetta M, Raichle ME. Intrinsic functional architecture in the anaesthetized monkey brain. Nature. 2007; 447:83-86. DOI | PubMed
- Winkler AM, Ridgway GR, Webster MA, Smith SM, Nichols TE. Permutation inference for the general linear model. NeuroImage. 2014; 92:381-397. DOI | PubMed
- Yogarajah M, Focke NK, Bonelli SB, Thompson P, Vollmar C, McEvoy AW, Alexander DC, Symms MR, Koepp MJ, Duncan JS. The structural plasticity of white matter networks following anterior temporal lobe resection. Brain. 2010; 133:2348-2364. DOI | PubMed
- Zaczek R, Simonton S, Coyle JT. Local and distant neuronal degeneration following intrastriatal injection of kainic acid. Journal of Neuropathology and Experimental Neurology. 1980; 39:245-264. DOI | PubMed
- Zola-Morgan S, Squire LR. Memory impairment in monkeys following lesions limited to the hippocampus. Behavioral Neuroscience. 1986; 100:155-160. DOI | PubMed
Fonte
Froudist-Walsh S, Browning PG, Young JJ, Murphy KL, Mars RB, et al. () Macro-connectomics and microstructure predict dynamic plasticity patterns in the non-human primate brain. eLife 7e34354. https://doi.org/10.7554/eLife.34354





