Abstract
Dichiarazione di rilevanza
Il fattore neurotrofico mesencefalico di origine astrocitaria (MANF) è una proteina neuroprotettiva e la sua espressione è elevata nella corteccia in via di sviluppo. Tuttavia, il suo ruolo nella neurogenesi dei mammiferi è sconosciuto. Qui dimostriamo che il MANF è altamente espresso nelle cellule del lignaggio neurale, comprese le cellule staminali neurali (NSC) della zona subventricolare (SVZ) nel cervello del topo in via di sviluppo. A differenza di altri fattori neurotrofici, la rimozione di MANF non altera la proliferazione delle cellule staminali. Tuttavia, la rimozione di MANF disturba la crescita dei neuroni e la migrazione dei neuroni in via di sviluppo nella corteccia. I dati nel manoscritto attuale suggeriscono che il MANF endogeno è coinvolto nell’estensione dei neuroni, in quanto la rimozione del MANF nelle NSC porta alla riduzione della sintesi proteica de novo e all’attivazione della risposta proteica dispiegata (UPR) sulla differenziazione.
Introduzione
La neocorteccia è composta da vari tipi di cellule con morfologia, posizione, modello e proprietà fisiologiche distinte(Sato et al., 2012; Woodworth et al., 2012; Greig et al., 2013). La differenziazione delle cellule staminali neurali (NSC) o delle cellule progenitrici neurali (NPC) in sottotipi neuronali distinti e la loro migrazione(Greig et al., 2013) richiede l’attivazione spazio-temporale di complesse cascate molecolari e proteostasi. Studi sullo sviluppo nella neocorteccia dei mammiferi hanno dimostrato che i fattori intrinseci, compresi i fattori di trascrizione specifici, sono necessari per la specificazione e la differenziazione del tipo di cellula(Grove e Fukuchi-Shimogori, 2003; Molyneaux et al., 2007; O’Leary e Sahara , 2008). I fattori di trascrizione Tbr1, CTIP2, e Cux1, espressi in diversi strati della corteccia in sviluppo, contribuiscono alla determinazione del destino laminare(Alcamo et al., 2008; Chen et al., 2008; Cubelos et al., 2008; Bedogni et al., 2010). Inoltre, fattori estrinseci, come il fattore neurotrofico derivato dalla linea cellulare gliale e il fattore neurotrofico derivato dal cervello, regolano anche la proliferazione, la specificazione del tipo di cellula, la differenziazione e la migrazione dei neuroni corticali(Ferri e Levitt, 1995; McAllister et al., 1995; Canty et al., 2009). In precedenza, il fattore neurotrofico mesencefalico di origine astrocitaria (MANF) e il fattore neurotrofico della dopamina cerebrale sono stati identificati come una nuova famiglia di fattori neurotrofici(Petrova et al., 2003; Lindholm et al., 2007) che protegge i neuroni della dopamina nei modelli animali del morbo di Parkinson (Voutilainen et al.,2009; Airavaara et al., 2012). Abbiamo dimostrato che la MANF è neuroprotettiva contro i neuroni corticali nelle lesioni cerebrali ischemiche transitorie(Airavaara et al., 2009; Airavaara et al., 2010). Inoltre, abbiamo recentemente dimostrato che la MANF intracellulare protegge i neuroni primari in vitro solo quando sono localizzati al reticolo endoplasmatico (ER; Hellman et al., 2011; Mätlik et al., 2015). Nel cervello del topo, alti livelli di mRNA Manf vengono rilevati nella corteccia cerebrale, nell’ippocampo e nel cervelletto(Lindholm et al., 2008). Nel cervello di ratto, MANF è regolata per lo sviluppo nella corteccia, dove sono presenti livelli elevati nei primi giorni postnatali, e la sua espressione diminuisce man mano che la corteccia matura(Wang et al., 2014). Questi risultati indicano che la MANF è spazio-temporalmente espressa nella corteccia e suggeriscono che può avere un ruolo nella maturazione dei neuroni corticali. Tuttavia, i fenotipi cerebrali di topi knockout MANF e come la delezione di MANF influisce sulla neurogenesi nella corteccia cerebrale in via di sviluppo non sono stati studiati.
In questo studio, abbiamo voluto indagare la relazione causale tra la neurogenesi corticale dei mammiferi e l’omeostasi ER durante la differenziazione neuronale utilizzando topi MANF carenti come sistema modello(Lindahl et al., 2014). Questi studi sono necessari perché il meccanismo d’azione per la MANF è irrisolto e il suo recettore (s) sconosciuto. Inoltre, abbiamo usato topi MANF-deficient per convalidare la specificità dell’anticorpo MANF per studiare la localizzazione della proteina MANF nel cervello in via di sviluppo. Abbiamo studiato il ruolo del MANF nella neurogenesi, la differenziazione neuronale, la crescita dei neuroni e la migrazione neuronale. In questo rapporto, forniamo prove sperimentali per un nuovo ruolo funzionale del MANF nel cervello dei mammiferi in via di sviluppo. Studi meccanicistici in vitro mostrano il ruolo del MANF nella sintesi proteica de novo e l’attivazione della risposta proteica dispiegata (UPR) durante la differenziazione neuronale. I nostri risultati suggeriscono che il MANF è un fattore cruciale che regola l’omeostasi ER nei neuroni per sostenere la crescita neuronale e la successiva migrazione neuronale nello sviluppo della corteccia.
Materiali e metodi
Animali
La generazione dei topi knockout MANF(Manf-/-) era come descritto in precedenza(Lindahl et al., 2014). Brevemente, Manf-/- I topi sono topi knockout convenzionali completi privi di mRNA MANF e proteine in tutti i tessuti attraverso lo splicing efficiente dell’esone 2 ad un gene reporter(Lindahl et al., 2014). Il giorno del tappo vaginale è stato designato come giorno embrionale (E)0,5. Tutte le procedure sperimentali sono state eseguite secondo i principi 3R della direttiva UE 2010/63/UE sulla cura e l’uso degli animali da esperimento, e le leggi e i regolamenti locali [legge finlandese sulla protezione degli animali utilizzati a fini scientifici o educativi (497/2013) e decreto governativo sulla protezione degli animali utilizzati a fini scientifici o educativi (564/2013)].
Isolamento e coltivazione di NSC embrionali di Manf-/- e Manf+/+ NSC
I telencefali insieme al ventricolo laterale di E13.5 wild-type (WT) e Manf-/- I topi sono stati isolati e triturati nella soluzione salina bilanciata di Hanks (Invitrogen) mediante una leggera pipettatura con puntali per pipette da 1 ml. Le cellule dissociate sono state coltivate in terreno di crescita NSC contenente DMEM/F12 (Gibco) integrato con B27 (20 µl/ml), fattore di crescita epidermico (EGF; 20 ng/ml), fattore di crescita dei fibroblasti-2 (FGF-2; 20 ng/ml; Gibco), GlutaMAX (10 µl/ml; Gibco), e penicillina-streptomicina (50 U/ml). Le cellule vitali dissociate ad una densità di 5 × 105 cellule / 10 ml in mezzo di crescita NSC sono stati seminati in matracci di coltura T75 non rivestiti a 37 ° C con il 95% di aria atmosferica / 5% di CO2. La metà del mezzo è stato sostituito ogni due giorni. Dopo 5-7 d di cultura, le neurosfere sono stati dissociati dalla triturazione e la digestione in soluzione di Accutase (Gibco) per 10 minuti a 37 ° C, le cellule sono state poi centrifugate e risospesi in mezzo di crescita NSC. Neurosfere sono state passate ogni 7-10 d. Numeri NSC Viable sono stati analizzati da colorazione con 0,5% trypan blu e contato in un contatore di cellule (Bio-Rad). Il passaggio primario di NSC non era puro e conteneva una popolazione di cellule miste. Dopo il passaggio 10, le NSC coltivate cominciano a mostrare segni di ridotta vitalità e differenziazione. Abbiamo usato NSC dai passaggi 3 a 10.
Saggio di auto-rinnovamento
Per valutare la capacità di auto-rinnovamento delle NSC coltivate, abbiamo utilizzato una colonia clonale per misurare la proporzione di cellule in grado di produrre neurosfere(Kerosuo et al., 2010). Singole colture di NSC dissociate da cellule singole sono state placcate in piastre a 96 pozzetti con 10-15 cellule per pozzetto, e il numero di neurosfere formate è stato contato dopo 7 d. Il numero di neurosfere (>20 cellule strettamente attaccate l’una all’altra) è stato diviso per il numero di cellule inizialmente placcate dando la percentuale di cellule di auto-rinnovamento.
Saggio di proliferazione cellulare BrdU
Per misurare la proliferazione, la percentuale di NSC in fase S, gli NSC sono stati incubati con BrdU (1 mM, 5-bromo-2′-deossiuridina; Sigma-Aldrich) per 12-16 h, centrifugati su vetrini di vetro con una citocentrifuga, fissati e colorati con anticorpo anti-BrdU. I vetrini sono stati montati con un mezzo di montaggio VectaShield contenente 4′-6-diamidino-2-fenilindolo (DAPI; Vector Laboratories). Un totale di 12-18 immagini di ogni gruppo è stato acquisito con la microscopia a epifluorescenza e analizzato dal software Image Pro Plus (Media Cybernetics). La percentuale di cellule proliferanti è stata stimata dividendo il numero di cellule BrdU-positive per il numero di nuclei colorati con DAPI.
Differenziazione in vitro e test di apoptosi
Per indurre la differenziazione, NSC dissociati (105 cellule / ml) sono stati placcati su vetri di copertura o piastre a quattro pozzetti rivestiti con 0,5 µg / ml laminina / 10 µg / ml poli-L-ornitina e coltivate in mezzo di crescita NSC per 1 d. Il giorno successivo, il mezzo è stato sostituito con mezzo di differenziazione [penicillina-streptomicina (50 U / ml), B27 supplemento (Gibco), 2 mM GlutaMAX (Gibco) in mezzo neurobasale (Gibco)], e le cellule sono stati autorizzati a differenziare per 7 d (vedi Figura 3A). Il MANF umano ricombinante (rhMANF; 200 ng/ml; Icosagen) è stato dato nel Manf-/- cellule al giorno in vitro (DIV)1. Cellule differenziate sono state immunocoloriti con anticorpi specifici per le cellule, seguiti da microscopia a fluorescenza. Per stimare il numero di cellule apoptotiche dopo la differenziazione NSC, le cellule (105 cellule / ml) sono state fissate con il 4% di paraformaldeide (PFA) ed etichettate per la deossinucleotidil transferasi dUTP nick end etichettatura (TUNEL; Roche), secondo le istruzioni del produttore. Uno scanner nel vicino infrarosso è stato utilizzato per misurare l’intensità del segnale a 700 nm (Li-Cor Biosciences, Odyssey). La quantificazione è stata eseguita con Image Studio Software per l’Odyssey. Il segnale delle cellule apoptotiche è stato quantificato da pozzi triplicati, e ogni esperimento è stato ripetuto da tre a sei volte.
Colorazione ad immunofluorescenza
Le NSC cresciute su vetrate di vetro sono state fissate con il 4% di PFA per 15 minuti a temperatura ambiente (RT) e lavate tre volte con PBS. Le cellule sono state bloccate in tampone di blocco (5% siero albumina bovina, 0,3% Triton X-100 in PBS) per 1 h a RT. Le cellule sono state poi incubate con i seguenti anticorpi primari durante la notte a 4°C: coniglio anti-MANF (1:400, Icosagen, catatog 310-100), topo anti-Nestin (1:500; Millipore, catatog MAB353), capra anti-doppiocortina (DCX; 1:200 Santa Cruz Biotechnology, catatog sc-8066), coniglio anti-β-tubulina III (Tuj1; 1:1000, BioLegend, catatog 802001), topo anti-GFAP (1:1000, Millipore, catalogo MAB360), o coniglio anti-MAP2 (1:500, Millipore, catatog AB5622). Per la microscopia a fluorescenza sono stati utilizzati anticorpi secondari appropriati coniugati con Alexa Fluor 488 o 568, (1:500, Life Technologies). Infine, i vetrini coprioggetto sono stati lavati tre volte in PBS, colorati con DAPI (Sigma-Aldrich) 5 µg/ml in PBS e montati in un mezzo di montaggio a fluorescenza (SHANDON, ThermoFisher Scientific). Le immagini in fluorescenza sono state catturate con il microscopio a epifluorescenza Zeiss AxioImager M2 482 equipaggiato con una fotocamera AxioCam HRm 483. Le immagini sono state acquisite con il software AxioVision4. Le percentuali di cellule DCX-, Tuj1-, MAP2-, e GFAP-positive sono state determinate come il rapporto tra numeri di cellule positive e nuclei colorati DAPI da quattro diversi campi visivi selezionati in modo casuale su ogni coprioggetti. Esperimenti di differenziazione in vitro sono stati eseguiti e analizzati in quadruplicato.
Analisi immunoblot
Le cellule sono state omogeneizzate in tampone di lisi NP-40 (50 mM Tris-HCl, pH 7,4, 0,15 M NaCl, 1,0 mM EDTA, e 1% NP-40) appena integrate con cocktail di fosfatasi e inibitore delle proteasi (Complete, Mini, EDTA-free, Roche Life Science), incubate su ghiaccio per 15-30 min e centrifugate a 13.000 rpm per 10 min. Le proteine sono state separate dall’8% o 15% di SDS-PAGE e trasferite su membrane di nitrocellulosa. Analisi immunoblot utilizzando anticorpi anti-Nestin (1:500, Millipore, catatog MAB353), anti-DCX (1:500, Santa Cruz Biotechnology, catatog sc-8066), anti-TuJ1 (1:1000), anti-GFAP (1:1000, Millipore, catatog MAB360), anti-MAP2 (1:500, Millipore, catatog AB5622), anti-neurofilamento (1:750, NF-200, Sigma-Aldrich, catatog N0142), anti-EIF2α (1:1000, Tecnologia del segnale cellulare, catatog 9721), anti-fosfo (p)-EIF2α (1:1000, Tecnologia del segnale cellulare, catatog 9722S), anti-α-tubulina (1:2000, LI-COR, catatog 926-42213), e anti-GAPDH (1:2000, Millipore, catatog MAB374). Le membrane sono state lavate due volte per 10 minuti ciascuna in PBS contenente lo 0,1% di Tween (PBS-T) e poi sondate con anticorpi IR-Dye 670 o 800 anticorpi secondari IR-Dye 670 o 800 (LI-COR Biotechnology) in tampone bloccante del latte (5%) con lo 0,1% di Tween per 1 ora a RT. Dopo l’etichettatura con anticorpi secondari, i lavaggi sono stati ripetuti due volte per 10 minuti con PBS-T, e poi le membrane sono state messe in acqua. Membrane sono stati ripresi utilizzando un LI-COR Odyssey scanner (LI-COR).
Analisi della crescita dei neuroni
Le immagini di 20-50 neuroni da tre vetrini da microscopio di ogni esperimento sono state prese con un microscopio a epifluorescenza Zeiss AxioImager M2 482. Cellule rappresentative con forte immunoreattività TUJ1 nei processi neuritari sono stati analizzati. Neurite con lunghezze di almeno il doppio del diametro del corpo cellulare sono stati misurati. Lunghezze di neurite dal soma sono stati tracciati e misurati utilizzando il software ImageJ.
Isolamento dell’RNA, trascrizione inversa e qPCR
RNA da NSC e cellule differenziate in ogni punto temporale sono stati isolati utilizzando TriReagent (Centro di ricerca molecolare). è stato prodotto cDNA da 2 µg di RNA totale (RevertAid Premium Reverse Transcriptase, Thermo Fisher Scientific.; dNTP mix, ThermoFisher Scientific; oligo(dT)15Primer, 500 µg/ml, Promega). qPCR è stato eseguito utilizzando LightCycler 480 SYBR Green I Master mix (Roche Diagnostics GmbH) e Roche LightCycler 480. I livelli relativi di espressione genica sono stati normalizzati a β-actina in ogni campione. I primer utilizzati in qPCR per Grp78, Xbp1t, Xbp1s, Atf4 e Chop sono sequenze pubblicate(Lindahl et al., 2014).
Istologia e immunoistochimica
Embrioni di topo interi o cervelli isolati da E13,5 al giorno postnatale (P)7 sono stati fissati in PFA al 4% a 4°C per almeno 3 d e poi incorporati in paraffina e sezionati. Cinque micrometri sezioni coronali sono stati tagliati dalle piastre cerebrali (corteccia cerebrale futuro) lungo il corno anteriore del ventricolo laterale da Manf-/- topi e i loro cuccioli WT. I vetrini sono stati deparaffinati e idratati, quindi sottoposti a recupero di antigene in 10 mM tampone citrato di sodio, pH 6,0, o 0,05% tampone di anidride citraconica, pH 7,4, a 120 ° C per 10 min. L’immunoistochimica è stata eseguita utilizzando i seguenti anticorpi: coniglio anti-MANF (1:1000, Icosagen, catatog 310-100), capra anti-DCX (1:400, Santa Cruz Biotechnology, catatog sc-8066), coniglio anti-Tbr1 (Abcam, 1:500, catatog ab31940), ratto anti-CTIP2 (1:400, Abcam, catatog ab18465), coniglio anti-CUX1 (Millipore, 1:100), coniglio anti-PAX6 (1:100, Abcam, catatog ab5790), coniglio anti-Tbr2 (1:500, Abcam, catatog ab75720), coniglio anti-phospho-histone H3 (pH3; 1:200, Millipore, catatog 06-570), mouse anti-Nestin (1:400, Millipore, catatog MAB353), mouse anti-NeuN (1:400, Millipore, catatog MAB377), mouse anti-GFAP (1:500, Millipore, catalogo MAB 360), mouse anti-NF-200 (1:1000, Sigma-Aldich, catatog N0142), coniglio anti-MAP2 (1:400, Millipore, catatog AB5622), coniglio anti-Reelin (1:300, Santa Cruz Biotechnology, catatog sc-5578), e coniglio anti-attivato caspasi III (1:200, Cell Signaling, catatog 9664) a 4°C durante la notte. Per la microscopia a fluorescenza, sono stati utilizzati anticorpi secondari appropriati coniugati con Alexa Fluor 488 o 568 (1:500; Invitrogen) per la visualizzazione. Per la rilevazione di un segnale al microscopio a luce, sono stati utilizzati anticorpi secondari biotinilati e perossidasi-coniugati con streptavidina Vectastain ABC-detection system (Vector Laboratories). Le sezioni sono state sviluppate con il kit di substrato di perossidasi della diaminobenzidina Vector (Vector Laboratories). Gli strati corticali sono stati definiti con colorazione violetto cresile.
Etichettatura e analisi BrdU in vivo
Per l’esperimento di divisione cellulare, Manfincinta+/- topi femmine (a E13,5 e E15,5) o la loro progenie (P1) sono stati iniettati per via intraperitoneale con BrdU (50 mg / kg), che è stato sciolto in soluzione salina sterilizzata ad una concentrazione di 10 mg / ml. Le iniezioni sono state somministrate tre volte con intervalli di 3 ore, e il cervello è stato raccolto 30 minuti dopo l’ultima iniezione. Per lo studio di datazione alla nascita, BrdU (100 mg / kg) è stato dato in una singola iniezione intraperitoneale ad un topo incinto a E13,5 o E15,5, e gli embrioni sono stati sezionati 4 d dopo (E17 o E19, rispettivamente). Le sezioni cerebrali con paraffina sono stati decerati in xilene, reidratati, trattati per il recupero dell’antigene con 10 mM tampone citrato (pH 6,0) e poi immunostained con un topo anti-BrdU (1:200, Abcam, catatog ab1893) durante la notte a 4 ° C seguita da anticorpi secondari coniugati con Alexa Fluor 488 (1:500; Invitrogen) per 2 ore a RT. Per la quantificazione delle cellule progenitrici di fase S, il numero di cellule BrdU + nella zona subventricolare (SVZ) è stato contato a E13,5, E15,5, e P1 in ogni campo sotto 10 × ingrandimento. Per lo studio della datazione alla nascita della migrazione radiale a E17, la distribuzione delle cellule marcate BrdU è stata analizzata nella zona ventricolare (VZ)/SVZ, zona intermedia (IZ), sottopiastra (SP), e piastra corticale (CP), rispettivamente. A E19, per quantificare la distribuzione dei nuclei BrdU-positivi, la CP dal lato pial al lato ventricolare è stata divisa in SVZ, IZ, strato corticale V/VI, strato corticale IV, e strato corticale II/III.
Omopropargylglycine (HPG) etichettatura e fare clic su chimica
Per il rilevamento e la caratterizzazione delle proteine di nuova sintesi durante la differenziazione neuronale, abbiamo ottimizzato i protocolli per l’incorporazione di HPG e il rilevamento della fluorescenza. NSC dissociati (105 cellule / ml) sono stati placcati su piastre a 96 pozzetti rivestiti con 0,5 µg / ml laminina / 10 µg / ml poli-L-ornitina e coltivate in mezzo di crescita NSC per 1 d. Il giorno successivo, il mezzo è stato sostituito con mezzo di differenziazione. A volte indicato, il mezzo è stato rimosso e sostituito con L-metionina senza DMEM (Sigma-Aldrich) per 45 minuti per esaurire la metionina prima dell’aggiunta di HPG (Invitrogen) ad una concentrazione finale di 50 µM per 1 h in L-metionina senza DMEM. I campioni sono stati fissati con 4% PFA per 15 min e sottoposti a Click-iT cocktail di reazione, che contiene 10 µM di Fluor Alexa 488-azide, 1 mM CuSO4, 1× Click-iT HPG buffer di reazione, e 1× Click-iT HPG buffer additivo. La reazione è stata lasciata procedere per 40 minuti a RT al buio. Dopo la rimozione del cocktail di reazione, le cellule sono state lavate in Click-iT tampone di reazione Click-iT risciacquo tampone e poi macchiato con DAPI. Le immagini in fluorescenza sono state catturate con Cellomics CellInsight (Thermo Scientific) dotato di Olympus LUCPlanFL N 20×/0.45 obiettivi. Le immagini sono state analizzate con CellProfiler.
Imaging e l’analisi dei dati di imaging
Per l’imaging in campo luminoso è stato utilizzato uno scanner per diapositive 3D-Histech(http://www.biocenter.helsinki.fi/bi/histoscanner/index.html). L’analisi delle immagini è stata eseguita con Image-Pro Analyzer 7.0. Le immagini in fluorescenza o in microscopia leggera sono state acquisite con un microscopio luminoso Olympus BX61 dotato di una fotocamera digitale a colori ad alta risoluzione e del software Cell Life Science Microscopy (Olympus Soft Imaging Solution) o utilizzando un microscopio a epifluorescenza Zeiss AxioImager M2 482 dotato di una fotocamera AxioCam 483 HRm. Le immagini sono state acquisite con il software AxioVision4. Per la ripresa dei video è stato utilizzato il Cell-IQ.
I conteggi delle cellule nella neocorteccia dorsolaterale sono stati fatti come descritto in precedenza(Fukumitsu et al., 2006). Le cellule sono state analizzate da un’area della parete neocorticale dorsomediale sopra la parte mediale del ventricolo laterale, che corrisponde alla futura rappresentazione somatosensoriale primaria. Sei a 12 sezioni coronali della corteccia somatosensoriale da tre a sei animali sono stati analizzati. Dopo la colorazione immunofluorescente, le cellule sono state contate da immagini ottenute con microscopia a epifluorescenza in un settore corticale che vanno dalla superficie del pial al ventricolo laterale, 450 × 350 µm a E13,5 e E15,5; 1000 × 600 µm a E18,5, E19, e l’età postnatale. Il numero di topi in ogni punto temporale era di almeno quattro per genotipo. Sono state analizzate quattro diverse sezioni cerebrali per ogni topo. Per la misurazione dell’intensità della fluorescenza, sono state scattate immagini in scala di grigi a 8 bit con ingrandimento 10×. Valori medi di fluorescenza sono stati misurati nella CP a E19 o corteccia cerebrale a P7 e dopo la sottrazione di sfondo, i valori per Manf-/- i topi sono stati normalizzati a quelli dei controlli WT in base all’età.
Analisi statistica
Tutti i grafici e i calcoli statistici sono stati eseguiti in GraphPad Prism 6.0. Per testare la significatività statistica è stato condotto un test t di Student’s t o ANOVA seguito da un test di correzione Bonferroni. Tutti i dati sono stati testati per la normalità. Tutti i valori e i grafici in tutte le figure sono stati mostrati come media ± SEM. I risultati con p < 0,05 sono stati considerati statisticamente significativi.
Risultati
Tipi di cellule che esprimono il MANF nella corteccia del topo in via di sviluppo
MANF mRNA e proteine si trovano nei neuroni nel cervello dei roditori in via di sviluppo e adulti(Lindholm et al., 2008; Wang et al., 2014). I neuroni corticali esprimono MANF negli strati II-VI del cervello di topo adulto e la corteccia neopallidale nell’embrione E12.5 (Lindholmet al., 2008). Abbiamo analizzato l’espressione di MANF da immunoistochimica durante lo sviluppo della corteccia del topo da E13,5 a P7. La specificità dell’anticorpo MANF è stata convalidata confrontando WT e Manf-/- sezioni cerebrali corticali. L’immunoreattività MANF non è stata osservata in Manf-/- topi con gli anticorpi utilizzati in questo studio(Fig. 1A). Abbiamo osservato alti livelli di immunoreattività MANF nella CP del cervello di topo E13.5 e E15.5(Fig. 1B). A E18.5, quando la struttura laminata della corteccia cerebrale si sviluppa, è stata trovata una maggiore immunoreattività del MANF nello strato intermedio del CP(Fig. 1B, inserti) rispetto ad altri strati. A P1, mentre MANF è stato espresso in tutti gli strati della corteccia, i neuroni a strati IV / V della corteccia ha mostrato una maggiore immunoreattività MANF(Fig. 1B, inserto, freccia). È interessante notare che la proteina MANF è stata conservata nelle cellule nelle aree neurogeniche, VZ e SVZ, in tutti i punti di tempo(Fig. 1B). Per identificare le cellule che esprimono MANF nel cervello in via di sviluppo, abbiamo usato una doppia colorazione immunofluorescente con anticorpi contro Nestin e DCX, che sono marcatori ampiamente utilizzati per NSC e NPC, rispettivamente. BrdU è stato utilizzato per etichettare le cellule progenitrici della fase S. MANF è stato colocalizzato con Nestin(Fig. 1C) e MANF è stato trovato in cellule BrdU-positive(Fig. 1D) in VZ/SVZ del cervello E18,5. Inoltre, MANF è stato trovato in cellule DCX-positive a E18,5(Fig. 1E) e nelle cellule NeuN-positive, ma non nelle cellule GFAP-positive a P7(Fig. 1F,G) nella corteccia del mouse. Questi risultati hanno dimostrato che la MANF non si esprime solo nei neuroni postmitotici, ma anche nelle NSC mitotiche nel cervello in via di sviluppo. Alti livelli di espressione di MANF nella CP e VZ / SVZ durante lo sviluppo embrionale suggerisce che MANF può avere più funzioni durante lo sviluppo corticale.
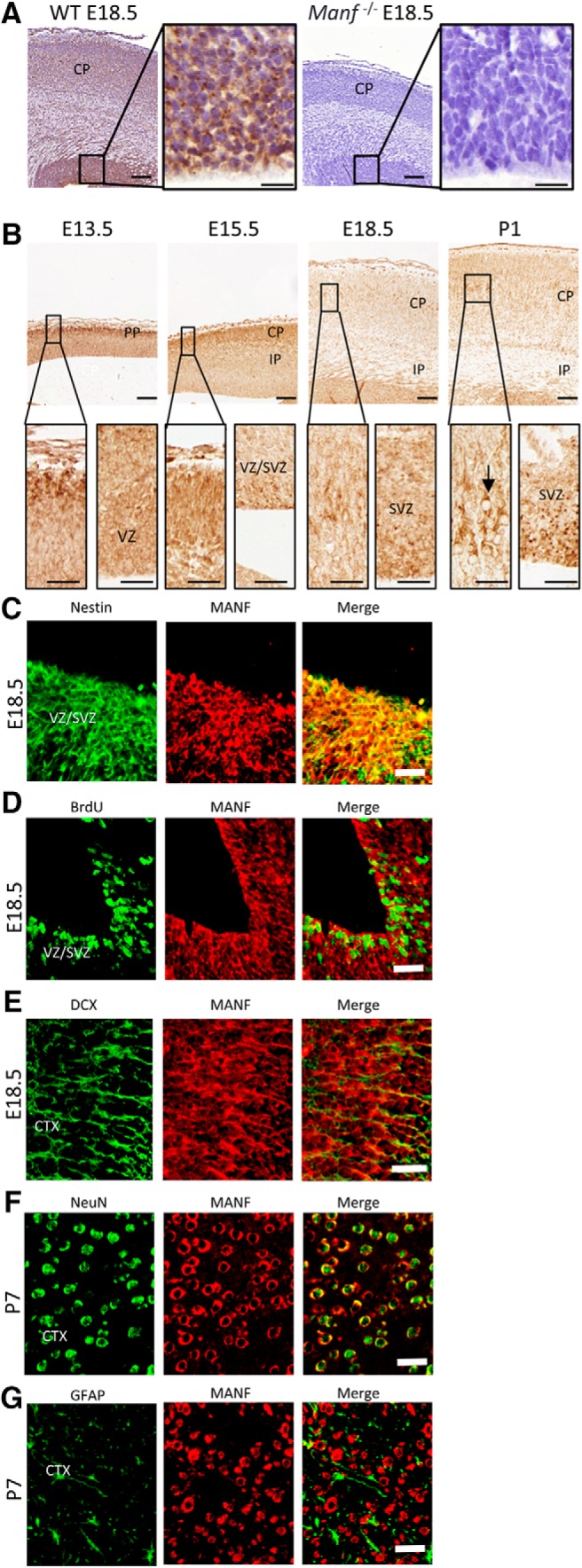
Figura 1.MANF espressione nella corteccia cerebrale in via di sviluppo. A, sezioni corticali corticali da E18,5 WT e Manf-/- cervello colorato con l’anticorpo MANF. Gli inserti mostrano le microfotografie della VZ/SVZ con un ingrandimento maggiore. BNel cervello E13.5 e E15.5 il MANF è prevalentemente localizzato in cellule del PP/CP e modestamente localizzato nella VZ/SVZ. Con E18,5, forte espressione MANF è visto nella VZ / SVZ e CP (inset). Con P1, il MANF è altamente espresso negli strati VZ/SVZ e centrale del CP (inset). A E18.5, VZ/SVZ è stato doppiamente colorato per gli anticorpi Nestin (verde) e MANF (rosso) (C) e per gli anticorpi BrdU (verde) e MANF (rosso) (D). E, Sezione della corteccia cerebrale da E18,5 topi E18,5 doppio tinto con DCX (verde) e MANF (rosso) anticorpi. F, Sezione della corteccia cerebrale da topi P7 doppio tinto con NeuN (verde) e MANF (rosso) anticorpi. GSezione della corteccia cerebrale di topi P7 con doppia colorazione con anticorpi GFAP (verde) e MANF (rosso); barre di scala: 100 µm (A, B), 20 µm (A, B inserto), 50 µm (C-G). PP, prepiastra; CP, piastra cerebrale; IP, piastra intermedia.

Figura 1.MANF espressione nella corteccia cerebrale in via di sviluppo. A, sezioni corticali corticali da E18,5 WT e Manf-/- cervello colorato con l’anticorpo MANF. Gli inserti mostrano le microfotografie della VZ/SVZ con un ingrandimento maggiore. BNel cervello E13.5 e E15.5 il MANF è prevalentemente localizzato in cellule del PP/CP e modestamente localizzato nella VZ/SVZ. Con E18,5, forte espressione MANF è visto nella VZ / SVZ e CP (inset). Con P1, il MANF è altamente espresso negli strati VZ/SVZ e centrale del CP (inset). A E18.5, VZ/SVZ è stato doppiamente colorato per gli anticorpi Nestin (verde) e MANF (rosso) (C) e per gli anticorpi BrdU (verde) e MANF (rosso) (D). E, Sezione della corteccia cerebrale da E18,5 topi E18,5 doppio tinto con DCX (verde) e MANF (rosso) anticorpi. F, Sezione della corteccia cerebrale da topi P7 doppio tinto con NeuN (verde) e MANF (rosso) anticorpi. GSezione della corteccia cerebrale di topi P7 con doppia colorazione con anticorpi GFAP (verde) e MANF (rosso); barre di scala: 100 µm (A, B), 20 µm (A, B inserto), 50 µm (C-G). PP, prepiastra; CP, piastra cerebrale; IP, piastra intermedia.
La mancanza di MANF non influisce sulla proliferazione di NSC, sull’auto-rinnovamento o sulla redditività
Successivamente, abbiamo studiato il ruolo della MANF nelle NSC stabilendo culture NSC dal cervello di topo E13.5. Le NSC sono multipotenti e si auto-rinnovano per formare neurosfere in coltura. Abbiamo scoperto che la maggior parte delle NSC WT esprimono la proteina MANF mentre Manf-/- Le NSC erano negative per l’immunofluorescenza MANF(Fig. 2A). Utilizzando un test di auto-rinnovamento, in cui le neurosfere sono dissociate in singole cellule e la loro capacità di formare nuove neurosfere viene misurata, non è stata trovata alcuna differenza tra i due genotipi(Fig. 2B). Successivamente, abbiamo studiato se la delezione MANF influisce sulla popolazione eterogenea di NSC e di WT e Manfcolorate-/- celle con il marcatore NSC Nestin, e il marcatore NPC DCX. Non c’era alcuna differenza nel numero di cellule Nestin-positive o DCX-positive tra i due genotipi(Fig. 2C-F). Inoltre, l’analisi Western blot non ha mostrato alcuna differenza tra i genotipi di Nestin, GFAP, o livelli DCX misurati da neurosfere(Fig. 2G,H). Successivamente, abbiamo misurato se la delezione del MANF influisce sulla vitalità delle NSC e abbiamo trovato che il numero di cellule morte macchiate di blu di tripan era simile tra i genotipi(Fig. 2I). Anche il tasso di proliferazione delle cellule, espresso dal rapporto tra le cellule BrdU+ e il numero totale di cellule era simile tra i due gruppi(Fig. 2J,K). In breve, la carenza di MANF non ha influito sulla capacità di auto-rinnovamento, sulla vitalità, sulla proliferazione, né sui livelli di Nestin, DCX e GFAP nelle NSC coltivate.
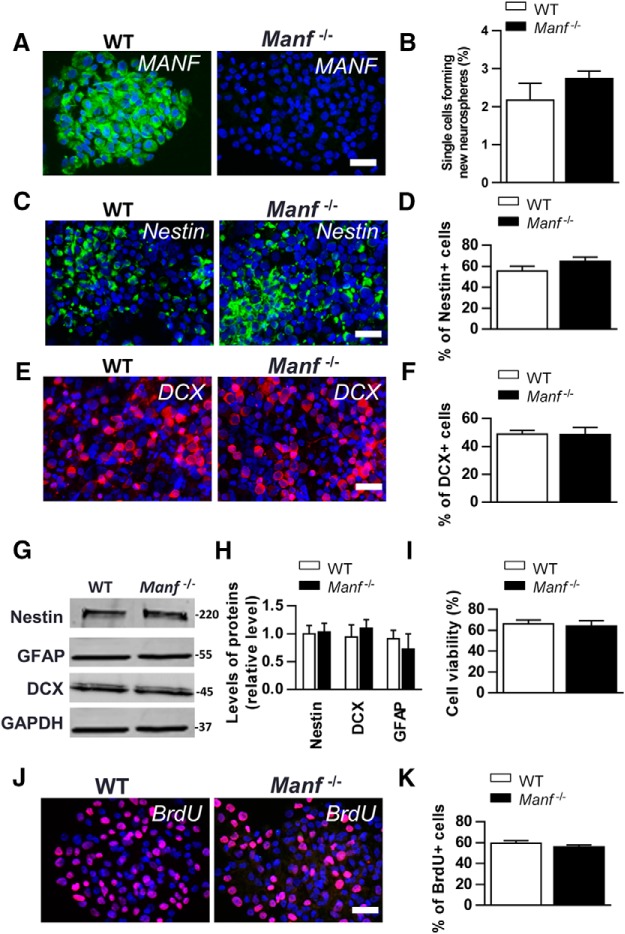
Figura 2.Caratterizzazionein vitro di WT e Manfcoltivati-/- NSC. A, La colorazione immunofluorescente con l’anticorpo MANF (verde) mostra un’alta espressione nelle neurosfere WT, e nessun segnale in Manf-/- neurosfere. BNon c’è stata alcuna differenza nel saggio di auto-rinnovamento in NSC di Manf-/- e gruppi WT(p = 0,25, n = 4). Colorazione immunofluorescente con Nestin (verde, C), DCX (rosso, E) anticorpi e contatori colorati con DAPI (blu) in WT e Manf-/- NSC. La percentuale di Nestin-positivi NSC (D) e DCX-positivo (F) cellule precursori neuronali in WT e Manf-/- Le colture NSC sono state analizzate contando il rapporto tra cellule Nestin- o DCX-positive e nuclei DAPI-positivi, n = 3-5. Le NSC sono state analizzate tramite Western blotting per Nestin, DCX, GFAP in WT e Manf-/- NSC (G). Dati quantitativi da Western blottings (H) sono presentati come livelli relativi a GAPDH, n = 3-5. I numeri a destra mostrano il peso molecolare come kDa. La vitalità cellulare non differisce tra WT e Manf-/- NSC (I). J, K, NSC proliferazione valutata da cellule BrdU-positive (rosso) come rapporto da nuclei DAPI-positivi (blu) da colture NSC, n = 5-6; barra di scala: 50 µm.

Figura 2.Caratterizzazionein vitro di WT e Manfcoltivati-/- NSC. A, La colorazione immunofluorescente con l’anticorpo MANF (verde) mostra un’alta espressione nelle neurosfere WT, e nessun segnale in Manf-/- neurosfere. BNon c’è stata alcuna differenza nel saggio di auto-rinnovamento in NSC di Manf-/- e gruppi WT(p = 0,25, n = 4). Colorazione immunofluorescente con Nestin (verde, C), DCX (rosso, E) anticorpi e contatori colorati con DAPI (blu) in WT e Manf-/- NSC. La percentuale di Nestin-positivi NSC (D) e DCX-positivo (F) cellule precursori neuronali in WT e Manf-/- Le colture NSC sono state analizzate contando il rapporto tra cellule Nestin- o DCX-positive e nuclei DAPI-positivi, n = 3-5. Le NSC sono state analizzate tramite Western blotting per Nestin, DCX, GFAP in WT e Manf-/- NSC (G). Dati quantitativi da Western blottings (H) sono presentati come livelli relativi a GAPDH, n = 3-5. I numeri a destra mostrano il peso molecolare come kDa. La vitalità cellulare non differisce tra WT e Manf-/- NSC (I). J, K, NSC proliferazione valutata da cellule BrdU-positive (rosso) come rapporto da nuclei DAPI-positivi (blu) da colture NSC, n = 5-6; barra di scala: 50 µm.
La perdita di MANF interferisce con la differenziazione neuronale e compromette la crescita dei neuroni
Per indagare se il MANF è coinvolto nella differenziazione neuronale e nella crescita dei neuroni in vitro, agli NSC è stato permesso di differenziare in medium senza mitogeni (EGF, FGF-2) per 8 d(Fig. 3A). Inizialmente, i cambiamenti nella morfologia dei neuroni differenziati da DIV1 a DIV4(Video 1, WT; Video 2, Manf-/-) sono stati studiati e le cellule sono state colorate con un anticorpo TuJ1, un marcatore per i neuroni immaturi postmitotici(Fig. 3B). A DIV1, il WT e Manf-/- le cellule mostravano una morfologia leggermente asimmetrica. A DIV2, le cellule WT hanno mostrato una chiara crescita dei neurite e un aumento delle estensioni dei neurite a DIV4. Al contrario, Manf-/- le cellule non mostravano l’escrescenza di neurite a DIV2, e a DIV4 la lunghezza del neurite era diminuita rispetto a WT(Fig. 3B,C), indicando che la perdita di MANF interrompe la crescita dei neuroni. Pertanto, abbiamo indagato se la diminuzione della crescita dei neurite, causata dalla perdita di MANF, può essere migliorata dalla somministrazione di rhMANF (200 ng/ml). Infatti, una singola applicazione di rhMANF potrebbe indurre la crescita dei neurite in Manf-/- cellule a DIV2, ma non ha continuato a promuovere l’estensione dei neuroni a DIV4(Fig. 3B,C), suggerendo che la MANF extracellulare non ha completamente recuperato un deficit di crescita neurita dalla perdita di MANF endogeno. A DIV8, abbiamo trovato che il numero di cellule DCX-positive era simile tra i genotipi, ma c’erano meno cellule TuJ1- e MAP2-positive in Manf-/- gruppo rispetto al gruppo WT(Fig. 3D-F p < 0,01, Test dello studente) . Il numero e la morfologia delle cellule GFAP-positive non differiscono tra i due gruppi(Fig. 3E,F), il che implica che la perdita di MANF disturba solo la differenziazione neuronale in vitro. Inoltre, all’analisi DIV8 della lunghezza totale dei neuroni ha rivelato che Tuj1-positivo Manf-/- le cellule visualizzate neurite significativamente più corte rispetto ai neuroni WT(Fig. 3G,H). In linea con la colorazione immunocitochimica, Western blotting ha rivelato una diminuzione dei livelli di TuJ1 e MAP2, ma non DCX o GFAP, nel Manf-/- gruppo(Fig. 3I,J p < 0,05, p < 0,01, rispettivamente, Test dello studente). Questi risultati indicano che il MANF svolge un ruolo significativo nella differenziazione neuronale e nella crescita dei neuroni.
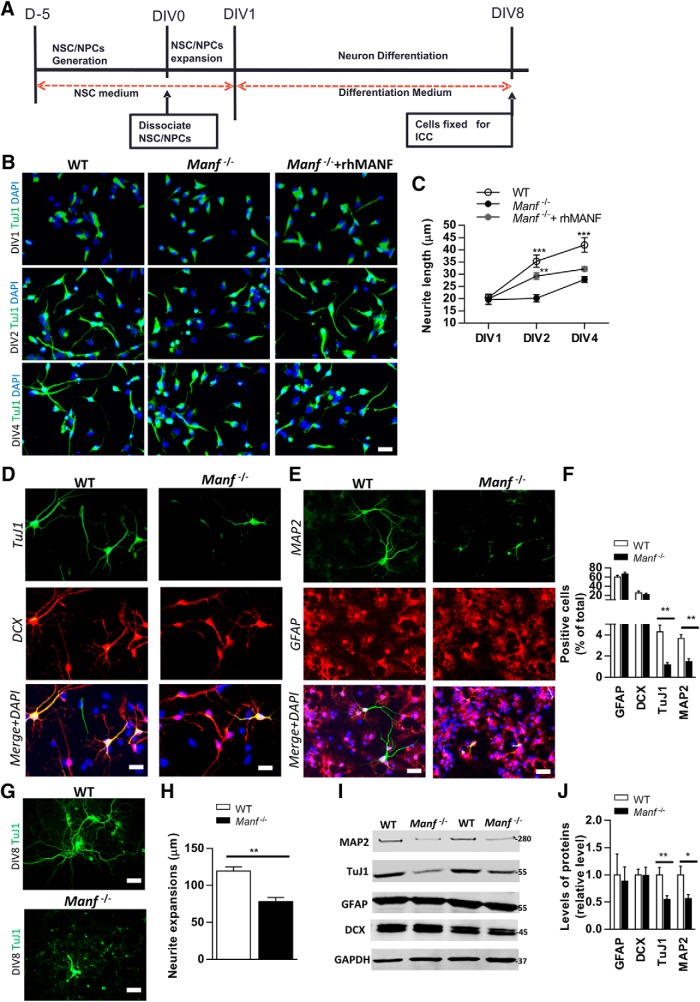
Figura 3.Effetti del MANF sulla differenziazione neuronale. A, Linea temporale della differenziazione delle NSC. L’espansione delle NSC è stata fatta per 1 d in condizioni di galleggiamento. Al giorno 1, la differenziazione è iniziata senza FEG e FGF-2 per 7 d in condizioni di aderenza. BA DIV1, DIV2 e DIV4, le cellule differenziate sono state colorate con anticorpi contro i marcatori neuronali TuJ1; barra graduata; 50 µm. C, Lunghezza dei neuroni sono stati misurati da TuJ1 cellule positive. Manf-/- le cellule visualizzate neurite di lunghezza significativamente più corta. Esogeno rhMANF indotto neurite crescita neurita a DIV2 ma non a DIV4 di Manf-/- celle, ANOVA bidirezionale, test Bonferroni post hoc; **p < 0,01, ***p < 0,001; barra graduata: 50 µM. D, EFotomicrografie rappresentative di cellule differenziate con doppia colorazione per TuJ1 (verde), DCX (rosso), MAP2 (verde) e GFAP (rosso) e nuclei colorati con DAPI (blu); barra della scala: 50 µM. F, Rapporti di GFAP-, DCX-, TuJ1-, TuJ1-, e MAP2-positivi in relazione ai nuclei DAPI +(n = 9). G, HA DIV8, l’estensione del neurite è stata misurata da cellule TuJ1-positive. Manf-/- Le celle visualizzate mostrano processi significativamente più brevi rispetto alle celle WT(n = 9); barra della scala: 20 µM. I, lisati da WT e Manf-/- Le cellule dopo la differenziazione sono state immunoblotate con anticorpi MAP2, TuJ1, GFAP, DCX e GAPDH. J, I livelli di proteine sono stati quantificati in relazione ai livelli di GAPDH, una proteina domestica, n = 9; *p < 0,05, **p < 0,01, Student’s t test.

Video 1.2. Video delle celle WT.

Video 2.3. Video delle celle MANF-/-.

Figura 3.Effetti del MANF sulla differenziazione neuronale. A, Linea temporale della differenziazione degli NSC. L’espansione delle NSC è stata fatta per 1 d in condizioni di galleggiamento. Al giorno 1, la differenziazione è iniziata senza FEG e FGF-2 per 7 d in condizioni di aderenza. BA DIV1, DIV2 e DIV4, le cellule differenziate sono state colorate con anticorpi contro i marcatori neuronali TuJ1; barra graduata; 50 µm. C, Lunghezza dei neuroni sono stati misurati da TuJ1 cellule positive. Manf-/- le cellule visualizzate neurite di lunghezza significativamente più corta. Esogeno rhMANF indotto neurite crescita neurita a DIV2 ma non a DIV4 di Manf-/- celle, ANOVA bidirezionale, test Bonferroni post hoc; **p < 0,01, ***p < 0,001; barra graduata: 50 µM. D, EFotomicrografie rappresentative di cellule differenziate con doppia colorazione per TuJ1 (verde), DCX (rosso), MAP2 (verde) e GFAP (rosso) e nuclei colorati con DAPI (blu); barra della scala: 50 µM. F, Rapporti di GFAP-, DCX-, TuJ1-, TuJ1-, e MAP2-positivi in relazione ai nuclei DAPI +(n = 9). G, HA DIV8, l’estensione del neurite è stata misurata da cellule TuJ1-positive. Manf-/- Le celle visualizzate mostrano processi significativamente più brevi rispetto alle celle WT(n = 9); barra della scala: 20 µM. I, lisati da WT e Manf-/- Le cellule dopo la differenziazione sono state immunoblotate con anticorpi MAP2, TuJ1, GFAP, DCX e GAPDH. J, I livelli di proteine sono stati quantificati in relazione ai livelli di GAPDH, una proteina domestica, n = 9; *p < 0,05, **p < 0,01, Student’s t test.

Video 1.2. Video delle celle WT.

Video 2.3. Video delle celle MANF-/-.
3. Spessore alterato della corteccia cerebrale nel MANF-/- topi
Dato l’effetto osservato del knockout del MANF sulla differenziazione neuronale in vitro, abbiamo studiato se l’eliminazione del MANF influisce sullo sviluppo della neocorteccia. Abbiamo misurato lo spessore di WT e Manf-/- strutture corticali dopo la colorazione Nissl durante la corticogenesi embrionale e postnatale. A E13,5, l’aspetto istologico della parete cerebrale nei mutanti e nei loro lettiera WT era simile(Fig. 4A,B). A E15,5, IZ e CP della neocorteccia era più sottile a Manf-/- embrioni che nei lettiera WT(Fig. 4C,DN,O). A E18,5, il CP era più sottile nel Manf-/- gruppo, e lo spessore di IZ era simile tra i genotipi(Fig. 4E,FN,O). Tuttavia, le densità delle cellule nella IZ e CP del cervello mutante erano più elevate(Fig. 4K,Q). A P1 e P7, lo spessore del Manf-/- corteccia cerebrale è stato ridotto, in particolare gli strati II-IV e V, rispetto alla stessa area nella corteccia WT (Fig.4G-J,N). Inoltre, la corrispondente maggiore densità cellulare corrispondente nello strato II-IV è stata osservata nella corteccia mutante a P7 (Fig.4L,Q). Al contrario, lo strato VI era di dimensioni normali. I risultati indicano che la perdita di MANF in vivo non influisce sulle dimensioni della VZ/SVZ, ma causa uno sviluppo anomalo della corteccia cerebrale.
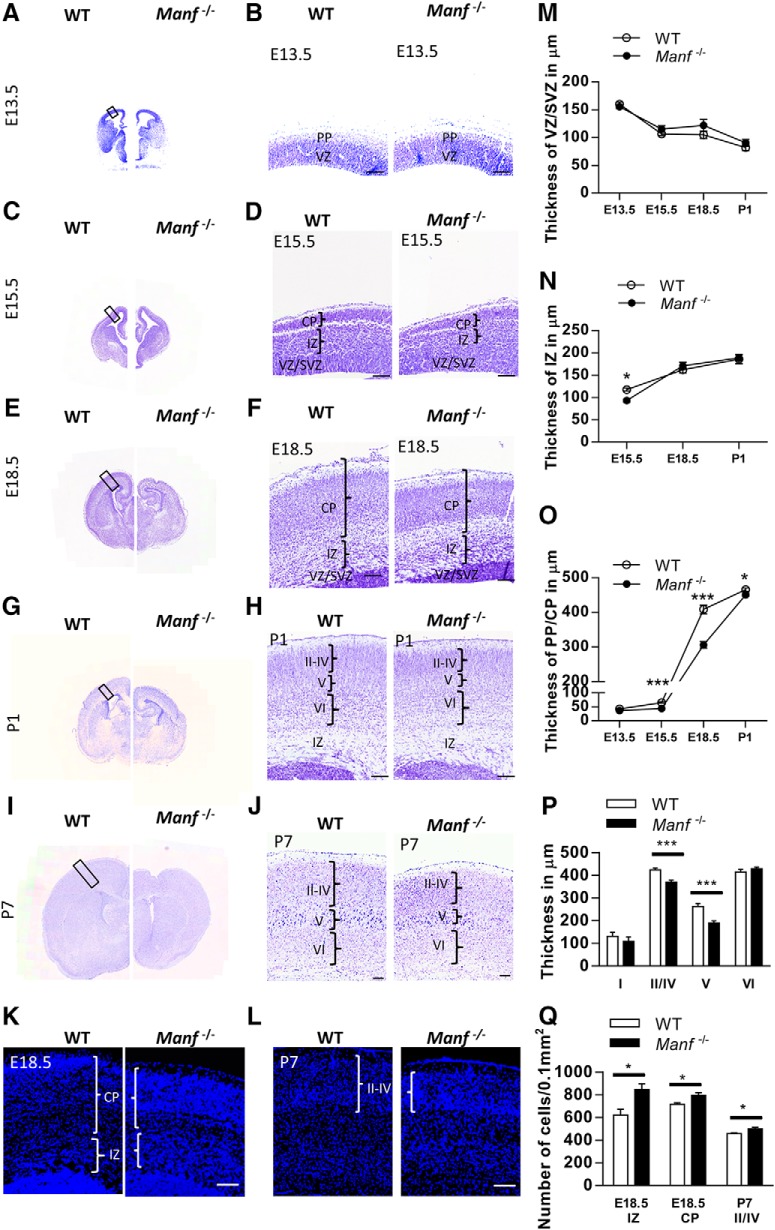
Figura 4.Alterazione morfologica della corteccia embrionale e precoce della corteccia postnatale in WT e Manf-/- topi. A-J, Sezioni coronali della corteccia in via di sviluppo colorate con Nissl. A, BNon c’è differenza nell’aspetto complessivo della corteccia tra WT e Manf-/- topi a E13,5. C, DA E15,5, l’IZ e il CP sono più sottili nel Manf-/- topi che in WT littermates, ma lo spessore di SVZ/VZ non è cambiato. E, FA E18,5, il CP è più sottile a Manf-/- topi rispetto ai topi WT. G-JA P1 e P7, lo strato della corteccia è più sottile, in evidenza allo strato II-V in Manf-/- topi rispetto ai controlli. KA E18,5, la densità delle cellule nel CP è più alta nel Manf-/- topi rispetto ai topi WT (blu, DAPI). LA P7, i nuclei DAPI+ nella corteccia Lo strato II-IV è più alto in Manf-/- topi rispetto ai topi WT. MNon c’è stata alcuna differenza di spessore VZ/SVZ tra WT e Manf-/- embrioni o cuccioli in qualsiasi punto dello studio. NLo spessore di IZ è stato significativamente ridotto a E15,5 nel Manf-/-, ma recuperato da E18,5 (L, *p < 0,05, Test dello studente) . O, Lo spessore di PP/CP è stato significativamente ridotto a E15,5, E18,5 e P1 in Manf-/- rispetto ai lettiera WT (M***p < 0,001, **p < 0,001, *p < 0, 05, rispettivamente, Test dello studente). P, Lo spessore degli strati corticali è stato misurato a P7, e abbiamo osservato strati II/IV e V significativamente più sottili in Manf-/- topi in confronto ai test WT (***p < 0,001, Test dello studente) . Q, Quantificazione dei nuclei DAPI+; barre di scala: 100 µm.
Per determinare se la perdita di Manf-/- sviluppo neocorticale è causato da una diminuzione del tasso di proliferazione in NSC, abbiamo iniettato in gravidanza Manfeterozigote eterozigote+/- topi o cuccioli di P1 con BrdU e tessuti cerebrali raccolti 30 minuti dopo. BrdU immunofluorescenza è stata eseguita su sezioni cerebrali da E13,5, 15,5, e animali P1 per analizzare le cellule in fase S (sintesi del DNA). immunofluorescenza pH3 è stata condotta a E15,5 per analizzare le cellule in fase M (mitosi). Il numero di cellule in fase S o M quantificata da sezioni coronali era simile nel Manf-/- corteccia rispetto ai lettiera WT(Fig. 5A-D). Inoltre, la quantificazione del numero di cellule neuroepiteliali, e cellule progenitrici intermedie, colorate con PAX6 e TBR2, rispettivamente, nel VZ / SVZ a E15,5, non ha rivelato alcuna differenza tra il WT e Manf-/- gruppo(Fig. 5E-H). Per analizzare la morte cellulare programmata, abbiamo eseguito l’immunoistochimica per la caspase-3 attivata. Come illustrato nella figura 5I,Jabbiamo trovato pochissime cellule morenti nelle sezioni di WT e Manf-/- neocorteccia. Questi dati suggeriscono che i deficit nel Manf-/- Lo sviluppo neocorticale non è dovuto al numero di NSC/NPC, al tasso di proliferazione cellulare o alla morte cellulare programmata.
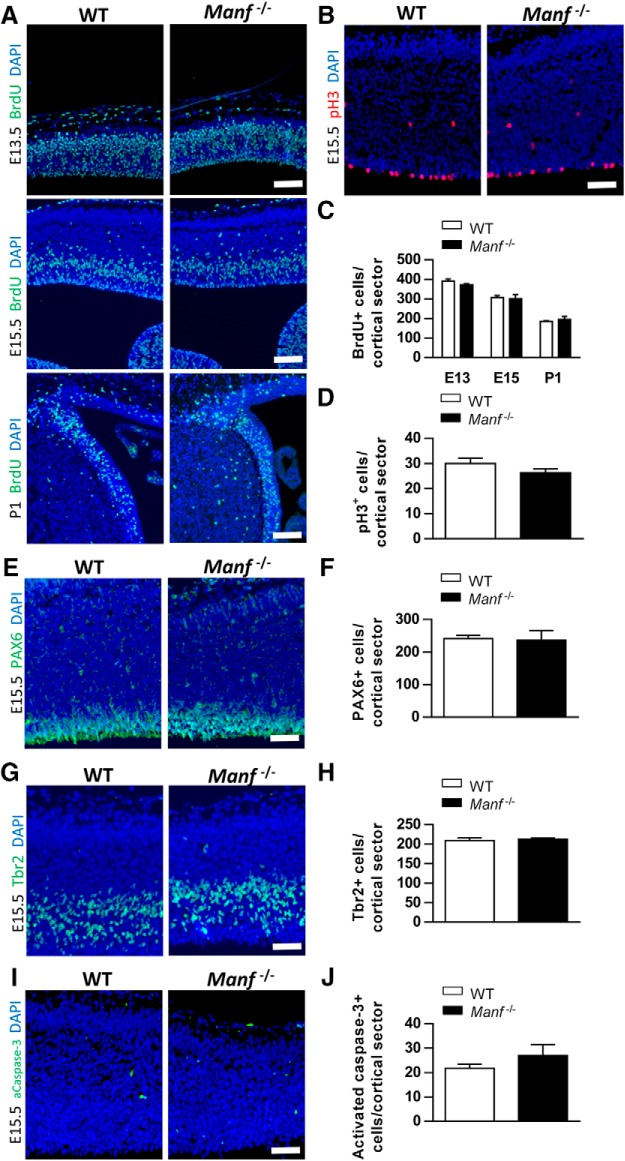
Figura 5.La perdita di MANF non influisce sulla proliferazione o sulla sopravvivenza dei precursori neurali. A, C, Analisi delle cellule progenitrici di fase S mediante l’etichettatura dell’impulso BrdU di WT e Manf-/- embrioni a E13,5, E15,5 e P1. Un numero simile di cellule di fase S sono nel Manf-/- corteccia rispetto alle lettiere WT. Il numero medio di cellule marcate BrdU nella SVZ è stato calcolato a E13,5, E15,5 e P1. B, D, Il numero di cellule pH3-positive nella VZ/SVZ di E15.5 Manf-/- I topi non sono diversi dai cuccioli di WT. Il numero di cellule PAX6-positive (E, F) o cellule Tbr2-positive (G, H) nella corteccia non differivano tra WT e Manf-/- cervello. I, J, Molto poche cellule apoptotiche sono state trovate nella corteccia cerebrale da E15.5 WT così come Manf-/- topi immunizzati con caspase-3 attivato. I nuclei cellulari sono stati contrastati con DAPI (blu). I dati sono espressi come media ± SEM, n = 3-4; barre della scala: 50 µm (A) e 100 µm (B, E, G, I).

Figura 4.Alterazione morfologica della corteccia embrionale e della corteccia postnatale precoce in WT e Manf-/- topi. A-J, Sezioni coronali della corteccia in via di sviluppo colorate con Nissl. A, BNon c’è differenza nell’aspetto complessivo della corteccia tra WT e Manf-/- topi a E13,5. C, DA E15,5, l’IZ e il CP sono più sottili nel Manf-/- topi che in WT littermates, ma lo spessore di SVZ/VZ non è cambiato. E, FA E18,5, il CP è più sottile a Manf-/- topi rispetto ai topi WT. G-JA P1 e P7, lo strato della corteccia è più sottile, in evidenza allo strato II-V in Manf-/- topi rispetto ai controlli. KA E18,5, la densità delle cellule nel CP è più alta nel Manf-/- topi rispetto ai topi WT (blu, DAPI). LA P7, i nuclei DAPI+ nella corteccia Lo strato II-IV è più alto in Manf-/- topi rispetto ai topi WT. MNon c’è stata alcuna differenza di spessore VZ/SVZ tra WT e Manf-/- embrioni o cuccioli in qualsiasi punto dello studio. NLo spessore di IZ è stato significativamente ridotto a E15,5 nel Manf-/-, ma recuperato da E18,5 (L, *p < 0,05, Test dello studente) . O, Lo spessore di PP/CP è stato significativamente ridotto a E15,5, E18,5 e P1 in Manf-/- rispetto ai lettiera WT (M***p < 0,001, **p < 0,001, *p < 0, 05, rispettivamente, Test dello studente). P, Lo spessore degli strati corticali è stato misurato a P7, e abbiamo osservato strati II/IV e V significativamente più sottili in Manf-/- topi in confronto ai test WT (***p < 0,001, Test dello studente) . Q, Quantificazione dei nuclei DAPI+; barre di scala: 100 µm.

Figura 5.La perdita di MANF non influisce sulla proliferazione o sulla sopravvivenza dei precursori neurali. A, C, Analisi delle cellule progenitrici di fase S mediante l’etichettatura dell’impulso BrdU di WT e Manf-/- embrioni a E13,5, E15,5 e P1. Un numero simile di cellule di fase S sono nel Manf-/- corteccia rispetto alle lettiere WT. Il numero medio di cellule marcate BrdU nella SVZ è stato calcolato a E13,5, E15,5 e P1. B, D, Il numero di cellule pH3-positive nella VZ/SVZ di E15.5 Manf-/- I topi non sono diversi dai cuccioli di WT. Il numero di cellule PAX6-positive (E, F) o cellule Tbr2-positive (G, H) nella corteccia non differivano tra WT e Manf-/- cervello. I, J, Molto poche cellule apoptotiche sono state trovate nella corteccia cerebrale da E15.5 WT così come Manf-/- topi immunizzati con caspase-3 attivato. I nuclei cellulari sono stati contrastati con DAPI (blu). I dati sono espressi come media ± SEM, n = 3-4; barre della scala: 50 µm (A) e 100 µm (B, E, G, I).
La distribuzione delle cellule CTIP2+, Tbr1+ e Cux1+ è alterata nella neocorteccia dell’uomo.
Per studiare come la carenza di MANF influenza lo sviluppo della corteccia, sezioni corticali da WT e Manf-/- topi sono stati colorati con CTIP2, Tbr1, e Cux1: marcatori per la specifica neuronale in diversi strati durante lo sviluppo della corteccia(Molyneaux et al., 2007; Bedogni et al., 2010). Come previsto, a E15,5, le cellule CTIP2 + sono state trovate in tutta la CP mentre le cellule Tbr1 + sono state trovate principalmente nella parte inferiore in entrambi i genotipi(Fig. 6A,B). Inoltre, i numeri dei neuroni CTIP2+ e Tbr1+ erano simili in WT e Manf-/- embrioni(Fig. 6G,H). A E18,5, notevoli Tbr1 + neuroni corticali Tbr1 + accompagnato da scarsa CTIP2 + neuroni sono stati trovati nello strato inferiore della corteccia in embrioni WT. Al contrario, in Manf-/- embrioni, c’erano meno neuroni Tbr1 + neuroni, ma più neuroni di proiezione subcerebrale CTIP2 + allo strato inferiore della corteccia(Fig. 6A,B,G,H). Inoltre, le distribuzioni dei neuroni CTIP2+ e Tbr1+ sono parzialmente mescolati nella CP mutante(Fig. 6D), a differenza degli embrioni WT, che sono divisi in diversi strati, il che implica che molti neuroni subcerebrali in Manf-/- Gli embrioni non sono migrati verso le posizioni destinate o non hanno ancora acquisito l’identificazione specifica dello strato. A P1 e P7, il numero totale di neuroni CTIP2+ e Tbr1+ negli strati V/VI erano simili tra i due genotipi.
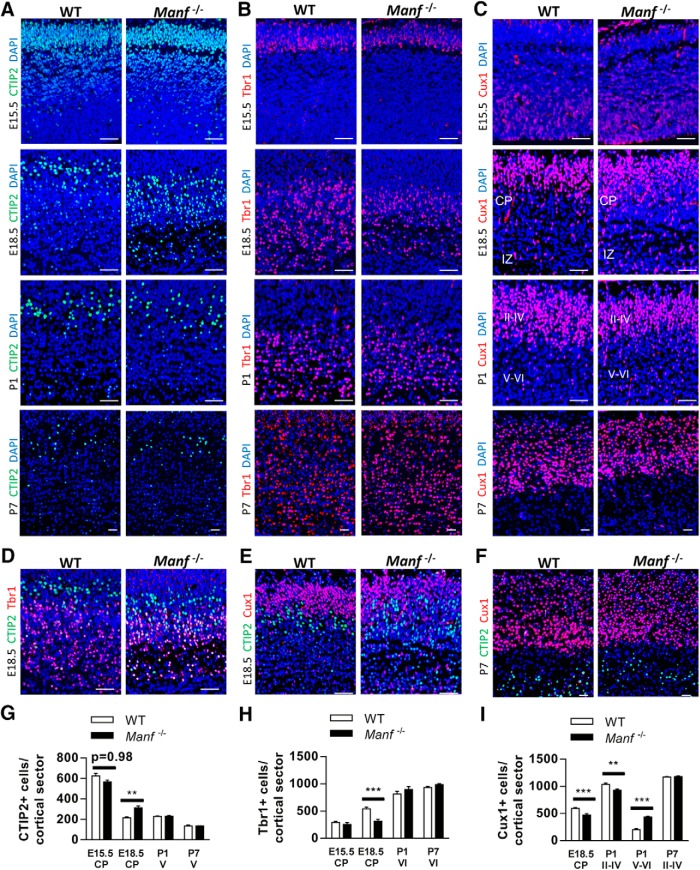
Figura 6.Distribuzione dei marcatori dello strato corticale CTIP2, TBR1 e Cux1. AIl numero di celle CTIP2+ a E15,5 è simile tra WT e Manf-/- in PC. A E18,5, c’è un aumento significativo della densità dei neuroni CTIP2+ a strati profondi di CP nel Manf-/- rispetto ai termini di litteratura WT, ma non c’è alcuna differenza a P1 e P7. BTbr1 si trova al CP inferiore nei controlli WT e Manf-/- topi a E15,5. Nel Manf-/- cervello, c’è una significativa diminuzione del numero di neuroni Tbr1+ nello strato profondo del CP a E18,5 rispetto ai controlli WT, ma c’è un recupero completo da P1 e P7. CA E15.5, Cux1 si trova a VZ/SVZ, ma è assente nel CP in WT e Manf-/- cervello. Ci sono meno neuroni Cux1+ nella CP superficiale a E18.5 e gli strati II-IV a P1 di Manf-/- cervello che nei controlli WT. Nel Manf-/- cervello di topo, più neuroni Cux1-positivi sono rimasti nella IZ a E18,5 e nei livelli V e VI a P1. A P7, non c’è differenza nei neuroni Cux1-positivi nella corteccia tra i genotipi. D, Fotomicrografie rappresentative di E18,5 CP colorate per Tbr1 (rosso), CTIP2 (verde), e nuclei (DAPI, blu). E, Fotomicrografie rappresentative di E18,5 CP colorate per Cux1 (rosso), CTIP2 (verde) e nuclei (DAPI, blu). D, Fotomicrografie rappresentative della corteccia P7 colorata per Tbr1 (rosso), CTIP2 (verde) e nuclei (DAPI, blu). G, Il numero di cellule CTIP2 + nella CP a E15,5 e E18,5 e lo strato V a P1 e P7(n = 3; **p < 0,01). H, Il numero di neuroni Tbr1+ nella CP a E15,5 e E18,5 e nello strato VI a P1 e P7(n = 3; ***p < 0,001). I, Il numero di neuroni Cux1+ nel CP a E18,5; strati II-VI, V-VI a P1 e P7 (n = 3;**p < 0,01, ***p < 0,001); barra di scala: 100 µm.
Abbiamo poi analizzato i neuroni Cux1 + nello sviluppo della corteccia. Cux1 + cellule si trovano in SVZ da E14,5 in poi, e durante i giorni postnatali, le cellule Cux1 + migrano nello strato II-IV (Cubeloset al., 2010). A E15,5, c’erano pochi neuroni Cux1+ nella CP sia in WT che in Manf-/- embrioni(Fig. 6C). A E18,5, molti dei neuroni Cux1+ sono stati trovati nello strato superiore del CP nei topi WT. Tuttavia, in Manf-/- topi, c’erano meno neuroni Cux1+ nella CP rispetto ai neuroni WT(Fig. 6C,I). Inoltre, a differenza del gruppo WT, con una chiara distribuzione dei neuroni sottotipo, negli embrioni mutanti i neuroni Cux1+ e CTIP+ sono stati dispersi nella CP, rivelando una disposizione neuronale disordinata(Fig. 6E). A P1, più neuroni Cux1+ sono stati trovati negli strati più profondi di Manf-/- di topi che nei cuccioli di WT, il che implica che Manf-/- i neuroni hanno avuto un ritardo nella migrazione radiale(Fig. 6C,I). A P7, il numero totale di neuroni Cux1+ era simile tra i genotipi e la disposizione di Manf-/- neuroni corticali è stato completamente recuperato a causa della maggiore densità delle cellule osservate a strati II-IV a causa di una corteccia più sottile nei topi mutanti. Presi insieme, questi risultati suggeriscono che il CP più sottile accompagnato dalla distribuzione anomala di marcatori dello strato corticale in Manf-/- embrioni potrebbero essere causati da una migrazione neuronale più lenta e da una specifica neuronale sottotipo disturbata.

Figura 6.Distribuzione dei marcatori dello strato corticale CTIP2, TBR1 e Cux1. A, Il numero di celle CTIP2 + a E15,5 sono simili tra WT e Manf-/- in PC. A E18,5, c’è un aumento significativo della densità dei neuroni CTIP2+ a strati profondi di CP nel Manf-/- rispetto ai termini di litteratura WT, ma non c’è alcuna differenza a P1 e P7. BTbr1 si trova al CP inferiore nei controlli WT e Manf-/- topi a E15,5. Nel Manf-/- cervello, c’è una significativa diminuzione del numero di neuroni Tbr1+ nello strato profondo del CP a E18,5 rispetto ai controlli WT, ma c’è un recupero completo da P1 e P7. CA E15.5, Cux1 si trova a VZ/SVZ, ma è assente nel CP in WT e Manf-/- cervello. Ci sono meno neuroni Cux1+ nella CP superficiale a E18.5 e gli strati II-IV a P1 di Manf-/- cervello che nei controlli WT. Nel Manf-/- cervello di topo, più neuroni Cux1-positivi sono rimasti nella IZ a E18,5 e nei livelli V e VI a P1. A P7, non c’è differenza nei neuroni Cux1-positivi nella corteccia tra i genotipi. D, Fotomicrografie rappresentative di E18,5 CP colorate per Tbr1 (rosso), CTIP2 (verde), e nuclei (DAPI, blu). E, Fotomicrografie rappresentative di E18,5 CP colorate per Cux1 (rosso), CTIP2 (verde) e nuclei (DAPI, blu). D, Fotomicrografie rappresentative della corteccia P7 colorata per Tbr1 (rosso), CTIP2 (verde) e nuclei (DAPI, blu). G, Il numero di cellule CTIP2 + nella CP a E15,5 e E18,5 e lo strato V a P1 e P7(n = 3; **p < 0,01). H, Il numero di neuroni Tbr1+ nella CP a E15,5 e E18,5 e nello strato VI a P1 e P7(n = 3; ***p < 0,001). I, Il numero di neuroni Cux1+ nel CP a E18,5; strati II-VI, V-VI a P1 e P7 (n = 3;**p < 0,01, ***p < 0,001); barra di scala: 100 µm.
Migrazione neuronale ritardata in embrioni carenti di MANF
Per esaminare se la MANF regola la migrazione neuronale nella corteccia cerebrale, abbiamo usato la datazione alla nascita BrdU. Abbiamo prima etichettato i neuroni generati precocemente iniettando Manfincinta+/- topi con BrdU a E13,5 e analizzato gli embrioni a E17(Fig. 7A). Sezioni corticali da embrioni E17 sono stati colorati con anticorpi BrdU, e il numero di cellule BrdU + sono stati quantificati in ogni strato corticale. Il numero di cellule BrdU+ rilevate nella CP e SP di Manf-/- gli embrioni sono stati significativamente ridotti rispetto ai lettiera WT(Fig. 7A,B). Al contrario, il numero di celle BrdU+ in VZ/SVZ di Manf-/- gli embrioni sono stati significativamente aumentati rispetto al WT. Successivamente, abbiamo etichettato i neuroni generati in seguito, somministrando BrdU a Manfincinta+/- le femmine a E15,5 e i nuclei marcati BrdU sono stati esaminati nella CP a E19(Fig. 7C,D). La maggior parte dei nuclei marcati BrdU si trovavano nello strato II/III della corteccia WT. Tuttavia, in Manf-/- corteccia, più nuclei marcati BrdU sono stati trovati negli strati IV e V/VI(Fig. 7C,D). Così, questi due esperimenti indicano che la migrazione radiale di entrambi i neuroni, sia di quelli iniziali che di quelli successivi, è compromessa in Manf-/- embrioni. Inoltre, abbiamo esaminato l’architettura complessiva delle fibre gliali radiali della colorazione Nestin e i modelli di espressione della Reelin, una glicoproteina a matrice che regola la migrazione e il posizionamento neuronale. Abbiamo trovato che l’immunofluorescenza di Nestin e Reelin sono simili in WT e Manf-/- cortecce a E15,5(Fig. 7E,F) suggerendo che i deficit di migrazione e posizionamento neuronale sono caratteristici dell’immaturo Manf-/- neuroni. Nel complesso, questi risultati suggeriscono che la MANF è essenziale per la migrazione dei neuroni nella corteccia embrionale.
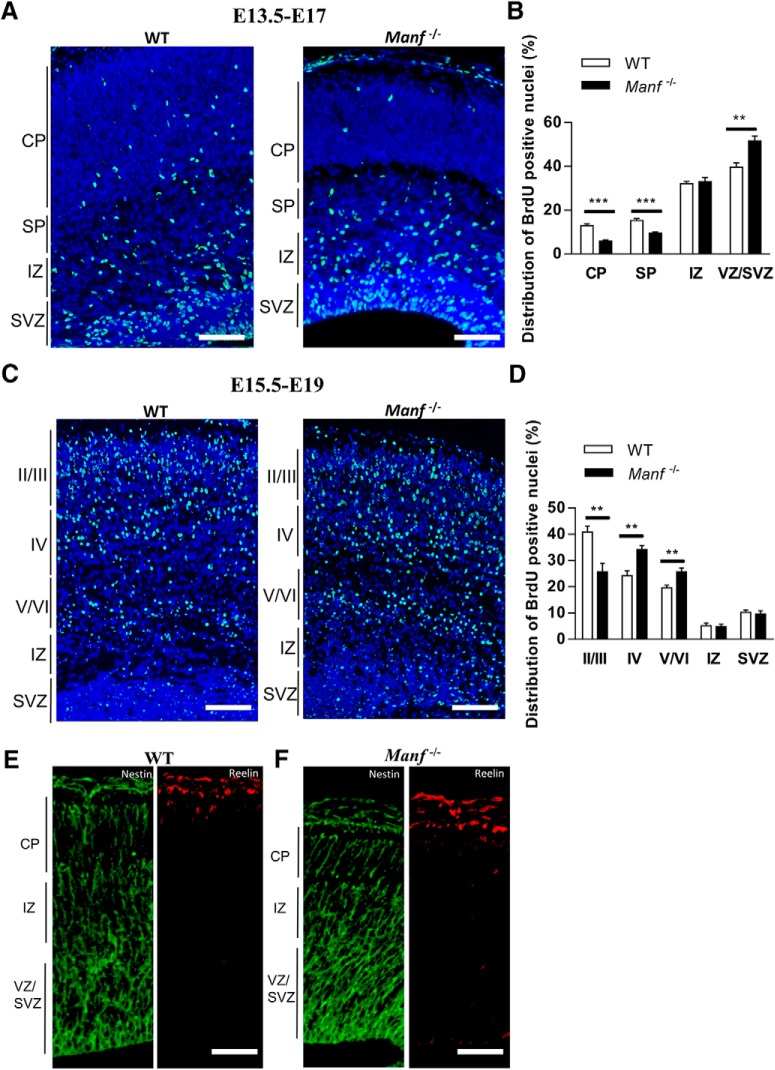
Figura 7.Migrazione radiale di neuroni nati precocemente (E13,5) e successivamente (E15,5) nelle regioni neocorticali con datazione di nascita BrdU. A, BrdU colorazione immunofluorescenza BrdU della corteccia E17 (BrdU somministrato a Manfincinta+/- topi a E13,5). BIl numero di cellule etichettate BrdU in ogni strato è stato contato e mostrato come percentuale del numero totale di cellule etichettate nella neocorteccia. Il numero relativo di cellule BrdU-positive sono stati trovati per essere diminuito in CP e SP di Manf-/-topi rispetto a WT littermates, e aumentato i livelli in VZ / SVZ(n = 3; **p < 0,01, ***p<0,001). C, BrdU è stato somministrato a E15,5 e la distribuzione delle cellule etichettate è stata esaminata a E19. Nella corteccia WT, un numero maggiore di cellule etichettate (verde) sono stati trovati nel II / III strati rispetto a quello in Manf-/- corteccia. Al contrario, l’aumento del numero di cellule BrdU-positive sono stati trovati negli strati corticali IV e V/VI nel Manf-/- topi rispetto ai topi WT. DPer quantificare la distribuzione dei nuclei BrdU-positivi, la corteccia cerebrale è stata divisa in cinque aree dal lato piale al lato ventricolare. Il numero di cellule etichettate in ogni contenitore è stato contato e mostrato come percentuale del numero totale di cellule etichettate nel CP(n = 3, *p < 0,05, ***p < 0,001 per Manf-/- topi rispetto a WT). I nuclei sono stati contrastati con DAPI (blu). E, F, Colorazione immunofluorescente di sezioni coronali di neocorteccia con anticorpi anti-Nestina e anti-Reelina. L’architettura radiale gliale e l’espressione di Reeling in erano simili in WT e nei mutanti; barre di scala: 50 µm (A, C) e 25 µm (E, F).

Figura 7.Migrazione radiale di neuroni nati precocemente (E13,5) e successivamente (E15,5) nelle regioni neocorticali con datazione di nascita BrdU. A, BrdU colorazione immunofluorescenza BrdU della corteccia E17 (BrdU somministrato a Manfincinta+/- topi a E13,5). BIl numero di cellule etichettate BrdU in ogni strato è stato contato e mostrato come percentuale del numero totale di cellule etichettate nella neocorteccia. Il numero relativo di cellule BrdU-positive sono stati trovati per essere diminuito in CP e SP di Manf-/-topi rispetto a WT littermates, e aumentato i livelli in VZ / SVZ(n = 3; **p < 0,01, ***p<0,001). C, BrdU è stato somministrato a E15,5 e la distribuzione delle cellule etichettate è stata esaminata a E19. Nella corteccia WT, un numero maggiore di cellule etichettate (verde) sono stati trovati nel II / III strati rispetto a quello in Manf-/- corteccia. Al contrario, l’aumento del numero di cellule BrdU-positive sono stati trovati negli strati corticali IV e V/VI nel Manf-/- topi rispetto ai topi WT. DPer quantificare la distribuzione dei nuclei BrdU-positivi, la corteccia cerebrale è stata divisa in cinque aree dal lato piale al lato ventricolare. Il numero di cellule etichettate in ogni contenitore è stato contato e mostrato come percentuale del numero totale di cellule etichettate nel CP(n = 3, *p < 0,05, ***p < 0,001 per Manf-/- topi rispetto a WT). I nuclei sono stati contrastati con DAPI (blu). E, F, Colorazione immunofluorescente di sezioni coronali di neocorteccia con anticorpi anti-Nestina e anti-Reelina. L’architettura radiale gliale e l’espressione di Reeling in erano simili in WT e nei mutanti; barre di scala: 50 µm (A, C) e 25 µm (E, F).
Diminuzione dell’estensione neuronale e architettura neuronale anormale nella corteccia dell’uomo.
Considerando che la perdita di MANF ha causato una riduzione dello spessore dello strato corticale, abbiamo indagato se la mancanza di MANF diminuisce il numero di neuroni o cellule gliali a E19 e P7. A E19 quando la laminazione corticale è in fase di sviluppo, pochi neuroni NeuN-positivi e dendriti MAP2-positivi si trovavano nella CP(Fig. 8A,B). Le intensità di segnale fluorescente di NeuN e MAP2 in relazione all’area di CP non hanno mostrato differenze significative tra i due genotipi(Fig. 8C), suggerendo che la perdita di MANF non influisce sulla generazione di neuroni corticali. Allo stesso modo, l’analisi Western blot ha mostrato che i livelli di NeuN e MAP2 dai tessuti E19 CP erano simili tra i genotipi(Fig. 8D,E). Inoltre, i livelli di GFAP erano simili tra i genotipi, ma sorprendentemente, il livello di neurofilamento (NF200) era significativamente più basso in Manf-/- CP. Poiché il neurofilamento esercita una funzione regolatrice nella struttura cellulare, nel trasporto assonale e nella stabilizzazione(Lariviere e Julien, 2004), questi dati potrebbero supportare il ruolo del MANF nella crescita assonale durante il successivo sviluppo corticale. A P7 non abbiamo trovato alcuna differenza nel numero di neuroni NeuN+ tra i due genotipi(Fig. 8F). Tuttavia, quando si indaga la distribuzione neuronale nella corteccia, abbiamo trovato un aumento della densità NeuN negli strati II-V, ma non nello strato VI, del Manf-/- corteccia(Fig. 8F,G). Inoltre, l’intensità di fluorescenza del GFAP era simile nei due genotipi(Fig. 8H). Mentre non c’era differenza nell’intensità di fluorescenza del MAP2 tra i due genotipi(Fig. 8I,J), Manf-/- i neuroni mostravano estensioni di dendriti più corte in MAP2 rispetto a quelle del WT(Fig. 8J). Inoltre, gli assoni di Manf-/- corteccia colorata meno intensamente con il marcatore del neurofilamento rispetto agli assoni WT(Fig. 8K,L). In linea con i risultati di cui sopra, i livelli di GFAP, MAP2, e NeuN in Western blotting erano simili tra i due genotipi(Fig. 8M,N). Il livello NF200 è stato ridotto a Manf-/- corteccia rispetto a WT a P7(Fig.8M,N). Nel complesso, questi risultati suggeriscono che la perdita di MANF non diminuisce il numero di neuroni corticali o cellule gliali, ma si traduce in una diminuzione dell’estensione dei neuroni così come assoni specifici livelli di proteine citoscheletriche, e la densità neuronale anomala nella corteccia in via di sviluppo.
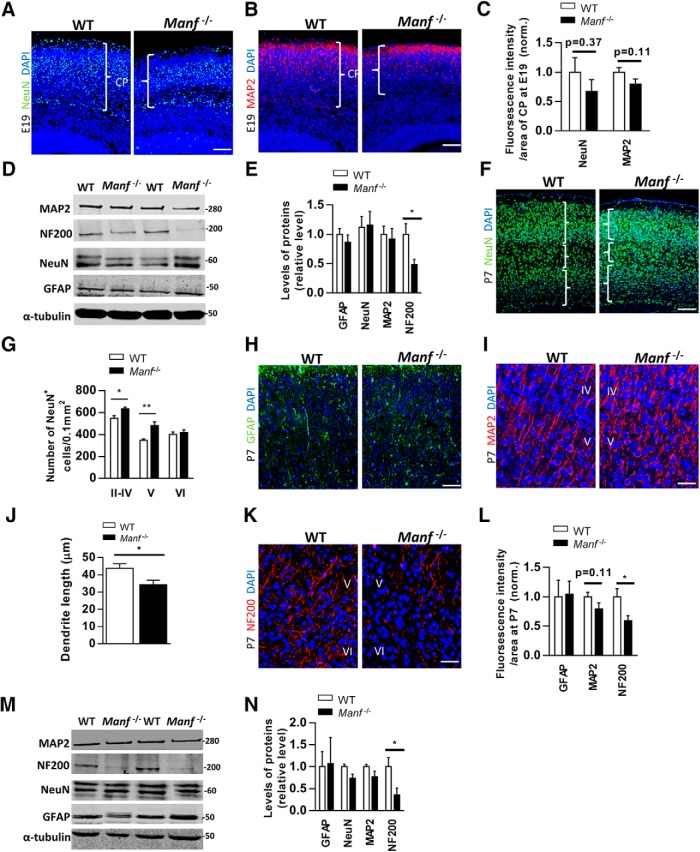
Figura 8.NeuN, GFAP, MAP2, e NF200 espressione nella corteccia in via di sviluppo. A, B, Fotografie rappresentative di WT e Manf-/- sezioni corticali colorate con NeuN (A) o MAP2 (B) alla E19, e contatore con DAPI (blu) alla E19. CLe intensità di fluorescenza divise per l’area di CP. Non c’è differenza tra WT e Manf-/- embrioni nel NeuN e MAP2 intensità fluorescenti / area di CP(n = 3). D, E, Western blotting da E19 lisati corticali colorati con anticorpi contro NeuN, MAP2, GFAP, e NF200(n = 4, *p < 0,05). F, Fotomicrografie rappresentative di sezioni corticali anti-NeuN (verde) colorate con anticorpi di WT e Manf-/- topi al P7, contrassegnati con DAPI (blu). GLa densità dei neuroni NeuN-positivi negli strati corticali a P7. Nel Manf-/- cervello di topo c’è un aumento significativo della densità neuronale NeuN-positivo negli strati II-IV e V a P7 (n =3, *p <0,05, **p < 0,01 ). H, Fotomicrografie rappresentative di WT e Manf-/- sezioni corticali colorate con GFAP. I, Fotografie rappresentative di WT e Manf-/- sezioni corticali colorate con MAP2. JI dendriti più corti macchiati di MAP2 sono stati trovati a Manf-/- neuroni corticali allo strato IV/V della corteccia rispetto a quelli del WT(n = 3, *p < 0,05). K, Strato V/VI della corteccia da Manf-/- e WT litterati colorati con l’anticorpo del neurofilamento (NF200). I nuclei cellulari sono stati contrastati con DAPI. LA P7, non vi è alcuna differenza di intensità di immunofluorescenza di MAP2 e GFAP macchiato sezioni corticali tra i gruppi. Tuttavia, vi è stata una significativa diminuzione della immunoreattività assone-specifica neurofilamento in Manf-/- corteccia(n = 3, *p < 0,05). M, N, Western blotting da lisati corticali P7 sondati con anticorpi gliali e neurone-specifici. Livelli diminuiti di NF200 è stato rilevato negli estratti corticali di Manf-/- topi(n = 4, *p < 0,05); barre della scala: 50 µm (A, B, F, H) e 25 µm (I, K).

Figura 8.NeuN, GFAP, MAP2, e NF200 espressione nella corteccia in via di sviluppo. A, B, Fotografie rappresentative di WT e Manf-/- sezioni corticali colorate con NeuN (A) o MAP2 (B) alla E19, e contatore con DAPI (blu) alla E19. CLe intensità di fluorescenza divise per l’area di CP. Non c’è differenza tra WT e Manf-/- embrioni nel NeuN e MAP2 intensità fluorescenti / area di CP(n = 3). D, E, Western blotting da E19 lisati corticali colorati con anticorpi contro NeuN, MAP2, GFAP, e NF200(n = 4, *p < 0,05). F, Fotomicrografie rappresentative di sezioni corticali anti-NeuN (verde) colorate con anticorpi di WT e Manf-/- topi al P7, contrassegnati con DAPI (blu). GLa densità dei neuroni NeuN-positivi negli strati corticali a P7. Nel Manf-/- cervello di topo c’è un aumento significativo della densità neuronale NeuN-positivo negli strati II-IV e V a P7 (n =3, *p <0,05, **p < 0,01 ). H, Fotomicrografie rappresentative di WT e Manf-/- sezioni corticali colorate con GFAP. I, Fotografie rappresentative di WT e Manf-/- sezioni corticali colorate con MAP2. JI dendriti più corti macchiati di MAP2 sono stati trovati a Manf-/- neuroni corticali allo strato IV/V della corteccia rispetto a quelli del WT(n = 3, *p < 0,05). K, Strato V/VI della corteccia da Manf-/- e WT litterati colorati con l’anticorpo del neurofilamento (NF200). I nuclei cellulari sono stati contrastati con DAPI. LA P7, non vi è alcuna differenza di intensità di immunofluorescenza di MAP2 e GFAP macchiato sezioni corticali tra i gruppi. Tuttavia, vi è stata una significativa diminuzione della immunoreattività assone-specifica neurofilamento in Manf-/- corteccia(n = 3, *p < 0,05). M, N, Western blotting da lisati corticali P7 sondati con anticorpi gliali e neurone-specifici. Livelli diminuiti di NF200 è stato rilevato negli estratti corticali di Manf-/- topi(n = 4, *p < 0,05); barre della scala: 50 µm (A, B, F, H) e 25 µm (I, K).
La perdita di MANF comporta un UPR attivato ma non un aumento dell’apoptosi durante la differenziazione NSC
Studi precedenti hanno indicato che la MANF è upregolata in condizioni di stress in vitro(Apostolou et al., 2008; Glembotski et al., 2012) e la mancanza di MANF porta all’attivazione cronica della UPR nelle isole pancreatiche in vivo(Lindahl et al., 2014). È stato anche dimostrato che la disregolazione della RPU può causare difetti nella neurogenesi e nella maturazione neuronale e che questi meccanismi potrebbero essere alla base di disturbi dello sviluppo neurologico(Godin et al., 2016). Pertanto, abbiamo voluto indagare se l’aumento dello stress da ER e la UPR attivata compaiono anche in Manf-/- NSC e misurato i livelli di espressione dei geni UPR Grp78, Atf4, Atf6a, Xbp1 giuntato e Chop, che sono noti per aumentare in condizioni di stress ER. Nelle NSC indifferenziate non c’è stata alcuna differenza nei livelli di mRNA per Chop, Xbp1 giuntato, Xbp1 totale, Atf4, Atf6a, e Grp78 (alias Bip) tra il Manf-/- controlli di gruppo e WT(Fig. 9A). Tuttavia, a DIV1, il livello di espressione dell’mRNA Xbp1 mRNA giuntato era più alto nel Manf-/- gruppo, seguito da un aumento del Grp78 al DIV4(p < 0,05, Test dello studente; Fig. 9B,C). Al DIV8, sono stati trovati livelli significativi di mRNA per Grp78, Atf4, e Xbp1 impiombato in Manf-/- celle differenziate(Fig. 9D). Inoltre, la quantificazione delle intensità di banda p-eIF2α rispetto ai livelli totali di (t)eIF2α mediante analisi Western blot ha rivelato un livello più elevato di p-eIF2α rispetto al totale di EIF2α in Manf-/- NSC a DIV8(Fig. 9E,F). Collettivamente, questi studi dimostrano che quando Manf-/- NSC iniziano a differenziare, Grp78 e Xbp1 mRNA giuntato Xbp1 mRNA nella via dell’enzima 1 che richiede inositolo (IRE1) sono upregulated, seguito da una maggiore fosforilazione della proteina eIF2α e Atf4 mRNA che dimostra l’attivazione della proteina chinasi RNA-come la via ER chinasi (PERK). Nel frattempo, i livelli di mRNA Atf6a o Chop mRNA non sono stati alterati durante Manf-/- differenziazione neuronale.
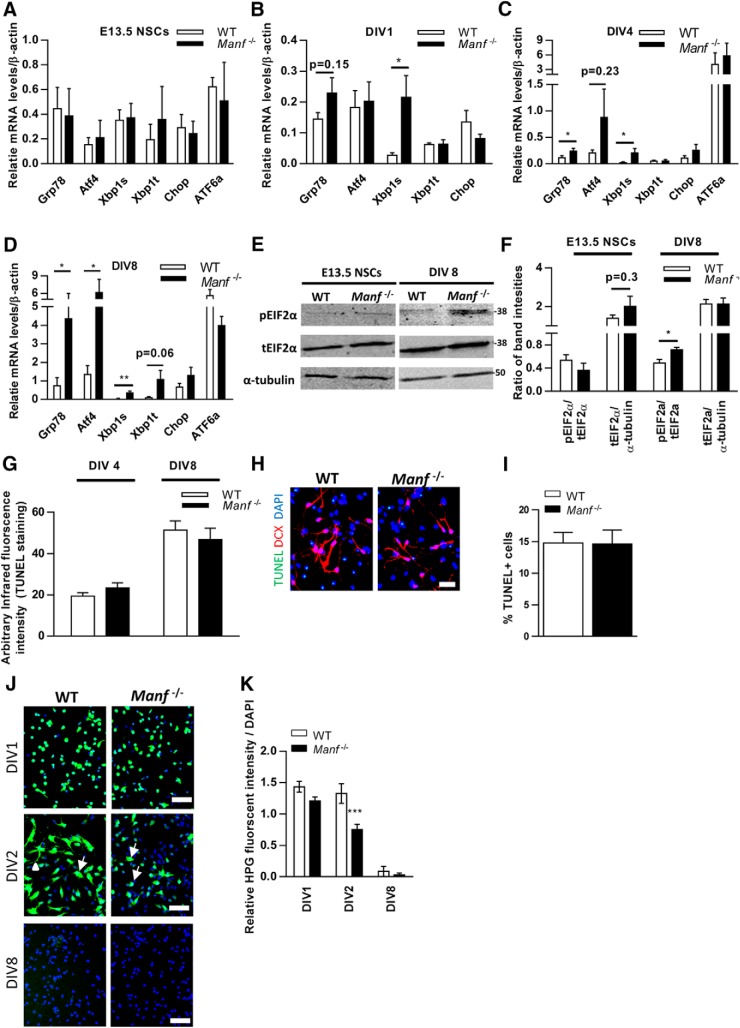
Figura 9.I geni della proteina risposta aperta sono upregulated, e l’aumento dei livelli di proteina p-eIF2α si trova nel Manf-/- NSC durante la differenziazione. A-D, qPCR analisi dei geni UPR Atf4, Grp78, Chop, Xbp1s, Xbp1t in WT e Manf-/- NSC (A), e cellule differenziate a DIV1 (B), DIV4 (C), e DIV 8 (D), n = 8-11, *p < 0,05, **p < 0,01, Test dello studente. E, Western blotting da NSC e cellule differenziate a DIV8. F, Intensità quantitative di bande di Western blotting occidentale di p-eIF2α è stato confrontato alla quantità totale di (t) eIF2α e teIF2α a intensità di α-tubulina, n = 4, *p < 0,05, Student t test. G, Le intensità di fluorescenza infrarossa TUNEL erano simili da colture ottenute da Manf-/- e cellule differenziate WT a DIV4 e DIV8. H, rappresentative fotomicrografie di cellule differenziate colorate per TUNEL (verde), DCX (rosso), e nuclei sono stati contornati con DAPI (blu); barra della scala: 50 µM. I, NSC differenziate al decesso DIV8 valutate con colorazione TUNEL. J, WT e Manf-/- NSC a DIV1, DIV2 e DIV8 incubati in HPG. Le frecce diagonali indicano la localizzazione citoplasmatica delle proteine sintetizzate e la punta della freccia indica le proteine di nuova sintesi diffuse ai neurite in crescita. K, Rapporto quantificato di fluorescenza Click-iT HPG a intensità di fluorescenza DAPI in WT e Manf-/- cellule, ANOVA a due vie, p < 0,01, test post hoc di Bonferroni, ***p < 0,001.
Successivamente, utilizzando TUNEL colorazione TUNEL In-Cell Westerns test e analisi in immunofluorescenza abbiamo confrontato il tasso apoptotico di cellule differenziate tra WT e Manf-/- gruppo. Con il saggio In-Cell Westerns, abbiamo osservato livelli simili di intensità di fluorescenza infrarossa TUNEL in WT e Manf-/- NSC a DIV4 o DIV8(Fig. 9G). Di conseguenza, la quantificazione delle cellule TUNEL+ ha rivelato livelli uguali di cellule apoptotiche in WT e Manf-/- NSC a DIV8(Fig. 9H,I). Pertanto, suggeriamo che la perdita di MANF si traduce in un aumento dell’attivazione UPR, che non porta alla morte cellulare, ma piuttosto potrebbe essere alla base dei difetti di differenziazione neuronale visti in Manf-/- NSC.

Figura 9.Unfolded proteina-geni risposta sono upregulated, e l’aumento dei livelli di p-eIF2α proteina si trova nel Manf-/- NSC durante la differenziazione. A-D, qPCR analisi dei geni UPR Atf4, Grp78, Chop, Xbp1s, Xbp1t in WT e Manf-/- NSC (A), e cellule differenziate a DIV1 (B), DIV4 (C), e DIV 8 (D), n = 8-11, *p < 0,05, **p < 0,01, Test dello studente. E, Western blotting da NSC e cellule differenziate a DIV8. F, Intensità quantitative di bande di Western blotting occidentale di p-eIF2α è stato confrontato alla quantità totale di (t) eIF2α e teIF2α a intensità di α-tubulina, n = 4, *p < 0,05, Student t test. G, Le intensità di fluorescenza infrarossa TUNEL erano simili da colture ottenute da Manf-/- e cellule differenziate WT a DIV4 e DIV8. H, rappresentative fotomicrografie di cellule differenziate colorate per TUNEL (verde), DCX (rosso), e nuclei sono stati contornati con DAPI (blu); barra della scala: 50 µM. I, NSC differenziate al decesso DIV8 valutate con colorazione TUNEL. J, WT e Manf-/- NSC a DIV1, DIV2 e DIV8 incubati in HPG. Le frecce diagonali indicano la localizzazione citoplasmatica delle proteine sintetizzate e la punta della freccia indica le proteine di nuova sintesi diffuse ai neurite in crescita. K, Rapporto quantificato di fluorescenza Click-iT HPG a intensità di fluorescenza DAPI in WT e Manf-/- cellule, ANOVA a due vie, p < 0,01, test post hoc di Bonferroni, ***p < 0,001.
La perdita di MANF diminuisce la sintesi proteica de novo all’inizio della differenziazione NSC
Gli esperimenti sopra descritti indicano che la perdita di MANF aumenta lo stress ER e la segnalazione UPR, e quindi disturba l’omeostasi ER durante la differenziazione neuronale. Dal momento che l’attivazione del PERK e IRE-1 via regolano direttamente la sintesi delle proteine, abbiamo voluto studiare se la carenza di MANF disturba ulteriormente la sintesi proteica o l’elaborazione quando NSCs differenziare. Abbiamo implementato un saggio basato su HPG per il rilevamento della sintesi proteica nascente. A DIV1, la maggior parte di WT e Manf-/- Le NSC hanno mostrato forti segnali derivati da HPG(Fig. 9J). Dopo la differenziazione, a DIV2, la maggior parte delle cellule WT ha mostrato un’intensa fluorescenza nella cellula soma e nei neurite(Fig. 9J). Questi segnali sono suscettibili di riflettere la presenza di proteine di nuova sintesi localizzate nel soma neuronale (frecce) e diffuse ai neuroni in crescita (punta di freccia). Tuttavia, Manf-/- Le cellule avevano meno segnale derivato da HPG rispetto al WT. Inoltre, i segnali in Manf-/- cellule erano limitate a soma, il che potrebbe spiegare i difetti di germinazione del neurite in Manf-/- le cellule non hanno ancora sviluppato la germinazione del neurite. La quantificazione delle intensità del segnale ha rivelato un’intensità significativamente inferiore nella differenziazione di Manf-/- NSC (DIV2; Fig. 9K). Questi risultati suggeriscono che la carenza di MANF si traduce in una riduzione delle proteine di nuova sintesi all’inizio della differenziazione cellulare. Quando abbiamo analizzato le proteine di nuova sintesi a DIV8, il segnale di fluorescenza molto debole è stato trovato sia in WT e Manf-/- celle(Fig. 9K), indicando che dopo la differenziazione ci sono meno proteine di nuova sintesi necessarie.
Discussione
Studi precedenti hanno dimostrato che il MANF aggiunto esogeneamente ha proprietà neuroprotettive e neurorestaurative(Airavaara et al., 2009; Voutilainen et al., 2009; Yang et al., 2014; Neves et al., 2016), e la localizzazione in vitro ER è necessaria per la neuroprotezione(Hellman et al., 2011; Mätlik et al., 2015). Nel nostro studio che utilizza l’anticorpo MANF convalidato su tessuti knockout MANF, abbiamo scoperto che il MANF non si esprime solo nei neuroni postmitotici maturi, ma anche ad alti livelli nelle NSC mitotiche. Dimostriamo per la prima volta che il MANF è altamente espresso nelle aree neurogeniche del cervello dei mammiferi. Pertanto, ci siamo concentrati sullo studio del suo ruolo nelle NSC in vitro e in vivo, utilizzando colture di neurosfere carenti di MANF e sviluppando la corteccia del topo, rispettivamente.
Isolando le NSC da Manf-/- embrioni, abbiamo scoperto che, quando sono stati coltivati in vitro, le NSC con deficit di MANF hanno compromesso la crescita dei neuroni, e questo è stato ulteriormente verificato nello sviluppo della corteccia dei mammiferi in vivo. Questi risultati sollevano la questione del perché la perdita di MANF influenza la crescita dei neurite, ma non compromette la proliferazione cellulare o la sopravvivenza cellulare. Recenti studi hanno indicato che la MANF è una proteina luminale ER, e interagisce con l’accompagnatore GRP78, ed è secreta in risposta allo stress ER in vitro(Mizobuchi et al., 2007; Apostolou et al., 2008; Glembotski et al., 2012; Mätlik et al., 2015; Lindahl et al., 2017). Tre rami di UPR che vengono avviati da distinti trasduttori di stress ER situati sulla membrana ER: PERK, IRE1, e l’attivazione del fattore di trascrizione 6 (ATF6). In condizioni basali, queste proteine sono legate dall’accompagnatore ER Grp78 (noto anche come Bip) e mantenute in stato inattivo(Bertolotti et al., 2000). Quando si sviluppa lo stress ER, il GRP78 viene sequestrato dai polipeptidi mal piegati e, di conseguenza, rilasciato dalle tre proteine del sensore, che innesca l’attivazione dei rami UPR (Hetz, 2012). L’UPR ripristina l’omeostasi delle proteine sopprimendo la traduzione delle proteine, inducendo gli accompagnatori molecolari correlati all’ER a promuovere il ripiegamento delle proteine dispiegate, rimuovendo le proteine dispiegate attivando il sistema di degradazione delle proteine associate all’ER e promuovendo la sopravvivenza delle cellule. Se l’UPR non riesce a ripristinare l’omeostasi proteica nella cellula, lo stress ER prolungato e non attenuato porta alla morte cellulare CHOP-mediata. Durante la differenziazione neurale, i dendriti acquisiscono la loro morfologia attraverso la germinazione di rami, che è accompagnata da una maggiore necessità di sintesi proteica(Ramírez e Couve, 2011). L’aumento della sintesi proteica può innescare UPR, un percorso omeostatico di segnalazione per far fronte all’aumento della domanda di ripiegamento delle proteine(Torre e Steward, 1996; Ju et al., 2004; Murakami et al., 2007; Ramírez e Couve , 2011). Tuttavia, lo stress prolungato del Pronto Soccorso quando l’UPR non riesce a ripristinare la normale funzione del Pronto Soccorso provoca una differenziazione neuronale aberrante, un ritardo nella crescita dei neuroni o addirittura la morte cellulare(Kitao et al., 2004; Galehdar et al., 2010; Lin et al., 2012; Zhao et al., 2013; Kawada et al., 2014). Mentre gli obiettivi a valle del percorso UPR non sono ben studiati nella differenziazione dei neuroni, l’aumento della fosforilazione eIF2α è noto per portare a una diminuzione globale dell’inizio della traduzione dell’mRNA e dell’upregulation ATF4, che perturba le risposte indotte dal cAMP e interferisce con la differenziazione neuronale (Roffé et al., 2013). In vitro, il trattamento rhMANF potrebbe ripristinare la crescita dei neuroni all’inizio della differenziazione, anche se non ha migliorato l’estensione dei neuroni in Manf-/- cellule in punti successivi. Va notato che rhMANF è stato somministrato una sola volta, e più somministrazioni avrebbero potuto causare un effetto riparativo più robusto. Poiché nei neuroni postmitotici non è stato dimostrato che il MANF in vitro si leghi ai recettori superficiali delle cellule o protegga le cellule(Hellman et al., 2011), i nostri risultati suggeriscono che il MANF ha effetti diversi sulle cellule indifferenziate. Se l’effetto sia mediato da MANF che funziona specificamente nel Pronto Soccorso rimane sconosciuto. Tuttavia, questa constatazione implica che il MANF extracellulare modula l’UPR per salvare parzialmente la crescita dei neuroni quando le cellule mutanti iniziano a differenziarsi. Inoltre, a seguito di una maggiore necessità di sintesi proteica e di elaborazione, Manf-/- Le cellule sembrano avere difficoltà a far fronte all’aumento del carico di proteine dispiegate, che aumenta ulteriormente lo stress ER e di conseguenza compromette la differenziazione neuronale che porta ad estensioni neuronali più brevi. I livelli di CHOP e ATF6 non sono aumentati significativamente durante la differenziazione neuronale e la mancanza di aumento può spiegare perché la perdita di MANF non compromette la sopravvivenza delle cellule. Considerando che ∼30% delle proteine di nuova sintesi sono piegate male durante la differenziazione (Schwarz et al., 2004), è probabile che la mancanza di MANF, interferendo con l’omeostasi ER, causi deficit nel trattamento delle proteine, nel trasporto e nella secrezione necessaria per i cambiamenti morfologici durante la crescita dei neuroni.
Gli embrioni diDrosophila melanogaster privi sia della DmMANF materna che di quella zigotica dimostrano che esistono forti deficit nell’arboricoltura assonale dei neuroni della dopamina(Palgi et al., 2009). Tuttavia, è importante notare che la DmMANF è espressa in modo dominante nelle cellule gliali che circondano i neuroni dopaminergici, il che suggerisce che il fattore di maturazione neuronale che promuove la mosca ha origine dalle cellule gliali. Inoltre, l’abbattimento dell’espressione MANF con gli oligonucleotidi anti-senso che bloccano il morfolino in Danio rerio ha rivelato che il MANF è necessario per lo sviluppo dei neuroni dopaminergici(Chen et al., 2012). Sorprendentemente, l’eliminazione del MANF nei topi porta a una progressiva riduzione postnatale delle cellule β del pancreas seguita da diabete insulino-deficiente (Lindahlet al., 2014). A differenza delle specie di invertebrati(Palgi et al., 2009), la proteina MANF nel cervello dei mammiferi è ampiamente localizzata nelle cellule neurali del lignaggio, suggerendo che la MANF ha funzioni importanti nello sviluppo neuronale. Durante la differenziazione neuronale, la crescita dei neuroni è un passo cruciale e regolato da molteplici percorsi di segnalazione. Nella corteccia in via di sviluppo, la cancellazione del MANF disturba la crescita dei neuroni. Tuttavia, non vi è alcuna diminuzione del numero di neuroni nella corteccia mutante, che è stato osservato negli esperimenti in vitro. Questa discrepanza può essere il risultato degli ambienti distintivi tra in vitro e in vivo. La perturbazione dell’ambiente tridimensionale, i contatti cellula-cellula e l’ambiente extracellulare sono limitazioni negli esperimenti in vitro(Gordon et al., 2013). Pertanto, Manfcoltivato-/- Le NSC, che sopportano un crescente stress da ER in un ambiente non fisiologico, hanno difficoltà a differenziarsi in neuroni mentre, in vivo, l’ambiente extracellulare e le connessioni cellula-cellula possono supportare Manf-/- cellule precursori neurali durante la differenziazione. Per il resto, i nostri dati sono di difficile interpretazione per quanto riguarda la recente scoperta del sistema immunitario modulante MANF(Neves et al., 2016). Presi insieme, i nostri risultati dimostrano un ruolo del MANF nel regolare le estensioni neuronali durante lo sviluppo della corteccia cerebrale.
Nella corteccia in sviluppo, la migrazione delle cellule neonatali è diretta lontano dalla VZ/SVZ e la migrazione radiale è il meccanismo principale che crea la struttura di strato dei neuroni eccitatori nella neocorteccia. In questo studio, un Manf-/- a E18,5 ha avuto a strato più sottile CP probabilmente perché i neuroni primitivi e tardivi non erano ancora arrivati alle loro posizioni destinate. A seguito della migrazione dei neuroni ai loro strati specifici della corteccia, il deficit è parzialmente recuperato nelle fasi postnatali. Inoltre, sulla base della nostra analisi della nascita neuronale datazione, Manf-/- i neuroni corticali del topo non mostravano un modello di formazione laminare invertito (esterno-in). Questa differenza nei difetti migratori suggerisce che il meccanismo in Manf-/- I topi sono distinti da quelli visti nell’avvolgitore e nei topi mutanti correlati(Mimura et al., 2008). Un’altra spiegazione è che l’organizzazione troncata o ridotta delle cellule gliali radiali è responsabile della migrazione neuronale perturbata(Noctor et al., 2004). Tuttavia, in Manf-/- topi, l’impalcatura radiale gliale, che è stata colorata da Nestin, non è stata alterata. In realtà, abbiamo scoperto che la perdita di MANF causa estensioni del neurite più brevi e livelli più bassi di NF200. È stato dimostrato che quando le cellule neurali precursori cominciano ad uscire dalla VZ/SVZ, sviluppano processi di conduzione e di trascinamento per esercitare la migrazione cellulare(Hirai et al., 2006). Inoltre, i processi assonali continuerebbero a crescere durante la migrazione radiale dei neuroni piramidali neocorticali(Hatanaka e Murakami, 2002). Diversi studi hanno dimostrato che gli assoni in via di sviluppo subiscono una stabilizzazione sequenziale neurofilamento-mediata in modo prossimale-distale, che supporta la continua crescita assonale(Lariviere e Julien, 2004; Yuan et al., 2012; Lee e Shea, 2014). Di conseguenza, la migrazione neuronale e la crescita neuronale sono correlate e possono dipendere dagli stessi meccanismi molecolari(Yamasaki et al., 2011). Data l’importanza del MANF nella crescita dei neuroni, non sorprende che il MANF svolga un ruolo significativo nella regolazione della migrazione neuronale.
Tuttavia, la perdita di MANF, disturbando il processo di estensione e maturazione dei neuroni, può anche interferire con il corso temporale della generazione di sottotipi di neuroni a proiezione subcerebrale e portare all’architettura compattata con una maggiore densità neuronale nella fase postnatale. Negli embrioni di topo, l’espressione di CTIP2, un fattore di trascrizione del dito di zinco, si osserva nei giovani neuroni già a partire da E11,5, quando vengono generati neuroni subcerebrali(Leone et al., 2008). Poi, quando i neuroni dello strato più profondo acquisiscono le specifiche di sottotipi distinti, i neuroni SP e i neuroni dello strato VI (neuroni corticotalamici) sono caratterizzati da alti livelli di espressione Tbr1, ma bassa espressione CTIP2(Morimoto-Suzki et al., 2014). Altrimenti, i neuroni dello strato V sono rappresentati dal marcatore CTIP2. In un punto successivo dello stadio embriogenico, quando vengono generati i neuroni dello strato superiore, Cux1 è per lo più espresso nei neuroni di proiezione corticocorticale dello strato II-IV (Cubeloset al., 2010). I nostri risultati indicano che la specifica del sottotipo è interrotta in Manf-/- topi, ma il motivo rimane sconosciuto. Saranno necessari ulteriori studi per indagare se il MANF influisce sui fattori di trascrizione che regolano la produzione di sottotipi neuronali in modo spazio-temporale(Alcamo et al., 2008; Chen et al., 2008; Bedogni et al., 2010), se il MANF controlla direttamente la generazione dei neuroni di livello V o VI e la loro distribuzione durante lo sviluppo.
Abbiamo già dimostrato che Manf-/- i topi soffrono di un grave difetto di crescita(Lindahl et al., 2014). Tuttavia, per quanto riguarda il rapporto tra il peso del cervello e quello del corpo, non abbiamo trovato differenze nel peso del cervello/corpo (%) tra i genotipi a P56 (maschi): WT 1,9 ± 0,0, n = 4; Manf-/- 2,4 ± 0,2, n = 4 e femmine: WT 2,5 ± 0,1, n = 7; Manf-/- 2.8 ± 0.2, n = 7) . In particolare, i topi adulti MANF-KO convenzionali sviluppano il diabete(Lindahl et al., 2014). Al P28 i livelli di insulina sierica sono già notevolmente diminuiti nei topi mutanti. Nonostante non ci siano stati cambiamenti nei livelli di glucosio nel sangue alimentati in modo casuale in Manf-/- topi a P14, è stata riscontrata una diminuzione della tolleranza al glucosio(Lindahl et al., 2014). Come alti livelli di glucosio nel sangue sono implicati nel influenzare lo sviluppo di diverse parti del cervello(Tayman et al., 2014), abbiamo usato i cervelli da Manfembrionale e precoce postnatale-/- topi per indagare le differenze di spessore dello strato corticale in funzione del tempo. Così, gli strati corticali più sottili in embrioni mutanti e cuccioli sono attribuiti alla migrazione neuronale ritardata e alla densità neuronale aberrante. Cervello-specifici Nestin-Cre±::Manffl /fltopi sono vitali e non mostrano alcun difetto lordo (Lindahlet al., 2014; Pakarinen e Lindahl, risultati non pubblicati). Tuttavia, poiché il MANF è ancora espresso in alcune cellule del cervello di Nestin-Cre±::Manffl/flcervello (Pakarinen e Lindahl, risultati non pubblicati), non abbiamo trovato questo modello adatto al nostro studio.
Il nostro studio dimostra che la MANF non si esprime solo nei neuroni postmitotici, ma anche nelle NSC mitotiche nel cervello dei mammiferi. Dimostriamo che la MANF non influisce sulla capacità di auto-rinnovamento o sulla proliferazione delle NSC e suggeriamo che la MANF è dispensabile per la neurogenesi. Tuttavia, MANF gioca un ruolo significativo nella crescita dei neuroni nel processo di differenziazione neuronale e questo, a sua volta, è probabilmente la causa del ritardo della migrazione neuronale. Questo studio è il primo a dimostrare che la MANF regola l’estensione neuronale nei neuroni dei mammiferi ed è diminuita nella sintesi proteica de novo e nello stress cronico ER sulla differenziazione. In conclusione, questi risultati suggeriscono che il MANF ha un ruolo fondamentale nell’omeostasi ER durante la crescita dei neuroni e la migrazione neuronale.
References
- Mesencephalic astrocyte-derived neurotrophic factor reduces ischemic brain injury and promotes behavioral recovery in rats. J Comp Neur. 2009; 515:116-124. DOI | PubMed
- Widespread cortical expression of MANF by AAV serotype 7: localization and protection against ischemic brain injury. Exp Neurol. 2010; 225:104-113. DOI | PubMed
- CDNF protects the nigrostriatal dopamine system and promotes recovery after MPTP treatment in mice. Cell Transplant. 2012; 21:1213-1223. DOI | PubMed
- Satb2 regulates callosal projection neuron identity in the developing cerebral cortex. Neuron. 2008; 57:364-377. DOI | PubMed
- Armet, a UPR-upregulated protein, inhibits cell proliferation and ER stress-induced cell death. Exp Cell Res. 2008; 314:2454-2467. DOI | PubMed
- Tbr1 regulates regional and laminar identity of postmitotic neurons in developing neocortex. Proc Natl Acad Sci USA. 2010; 107:13129-13134. DOI | PubMed
- Dynamic interaction of BiP and ER stress transducers in the unfolded-protein response. Nat Cell Biol. 2000; 2:326-332. DOI | PubMed
- Regionalized loss of parvalbumin interneurons in the cerebral cortex of mice with deficits in GFRalpha1 signaling. J Neurosci. 2009; 29:10695-10705. DOI | PubMed
- The Fezf2-Ctip2 genetic pathway regulates the fate choice of subcortical projection neurons in the developing cerebral cortex. Proc Natl Acad Sci USA. 2008; 105:11382-11387. DOI | PubMed
- MANF regulates dopaminergic neuron development in larval zebrafish. Dev Biol. 2012; 370:237-249. DOI | PubMed
- Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 2008; 18:1758-1770. DOI | PubMed
- Cux1 and Cux2 regulate dendritic branching, spine morphology, and synapses of the upper layer neurons of the cortex. Neuron. 2010; 66:523-535. DOI | PubMed
- Regulation of regional differences in the differentiation of cerebral cortical neurons by EGF family-matrix interactions. Development. 1995; 121:1151-1160. PubMed
- Brain-derived neurotrophic factor participates in determination of neuronal laminar fate in the developing mouse cerebral cortex. J Neurosci. 2006; 26:13218-13230. DOI | PubMed
- Neuronal apoptosis induced by endoplasmic reticulum stress is regulated by ATF4-CHOP-mediated induction of the Bcl-2 homology 3-only member PUMA. J Neurosci. 2010; 30:16938-16948. DOI | PubMed
- Mesencephalic astrocyte-derived neurotrophic factor protects the heart from ischemic damage and is selectively secreted upon sarco/endoplasmic reticulum calcium depletion. J Biol Chem. 2012; 287:25893-25904. DOI | PubMed
- Emerging roles for the unfolded protein response in the developing nervous system. Trends Neurosci. 2016; 39:394-404. DOI | PubMed
- General overview of neuronal cell culture. Methods Mol Biol. 2013; 1078:1-8. DOI | PubMed
- Molecular logic of neocortical projection neuron specification, development and diversity. Nat Rev Neurosci. 2013; 14:755-769. DOI | PubMed
- Generating the cerebral cortical area map. Annu Rev Neurosci. 2003; 26:355-380. DOI | PubMed
- In vitro analysis of the origin, migratory behavior, and maturation of cortical pyramidal cells. J Comp Neur. 2002; 454:1-14. DOI | PubMed
- Mesencephalic astrocyte-derived neurotrophic factor (MANF) has a unique mechanism to rescue apoptotic neurons. J Biol Chem. 2011; 286:2675-2680. DOI | PubMed
- The unfolded protein response: controlling cell fate decisions under ER stress and beyond. Nat Rev Mol Cell Biol. 2012; 13:89-102. DOI | PubMed
- The c-Jun N-terminal kinase activator dual leucine zipper kinase regulates axon growth and neuronal migration in the developing cerebral cortex. J Neurosci. 2006; 26:11992-12002. DOI | PubMed
- Activity-dependent regulation of dendritic synthesis and trafficking of AMPA receptors. Nat Neurosci. 2004; 7:244-253. DOI | PubMed
- Aberrant neuronal differentiation and inhibition of dendrite outgrowth resulting from endoplasmic reticulum stress. J Neurosci Res. 2014; 92:1122-1133. DOI | PubMed
- CIP2A increases self-renewal and is linked to Myc in neural progenitor cells. Differentiation. 2010; 80:68-77. DOI | PubMed
- ORP150/HSP12A regulates Purkinje cell survival: a role for endoplasmic reticulum stress in cerebellar development. J Neurosci. 2004; 24:1486-1496. DOI | PubMed
- Functions of intermediate filaments in neuronal development and disease. J Neurobiol. 2004; 58:131-148. DOI | PubMed
- The high molecular weight neurofilament subunit plays an essential role in axonal outgrowth and stabilization. Biol Open. 2014; 3:974-981. DOI | PubMed
- The determination of projection neuron identity in the developing cerebral cortex. Curr Opin Neurobiol. 2008; 18:28-35. PubMed
- Endoplasmic reticulum stress stimulates p53 expression through NF-κB activation. PLoS One. 2012; 7:e39120.. DOI | PubMed
- MANF is indispensable for the proliferation and survival of pancreatic β cells. Cell Rep. 2014; 7:366-375. DOI | PubMed
- Unconventional neurotrophic factors CDNF and MANF: structure, physiological functions and therapeutic potential. Neurobiol Dis. 2017; 97:90-102. DOI | PubMed
- Novel neurotrophic factor CDNF protects and rescues midbrain dopamine neurons in vivo. Nature. 2007; 448:73-77. DOI | PubMed
- MANF is widely expressed in mammalian tissues and differently regulated after ischemic and epileptic insults in rodent brain. Mol Cell Neurosci. 2008; 39:356-371. DOI | PubMed
- Role of two sequence motifs of mesencephalic astrocyte-derived neurotrophic factor in its survival-promoting activity. Cell Death Dis. 2015; 6:e2032. DOI | PubMed
- Neurotrophins regulate dendritic growth in developing visual cortex. Neuron. 1995; 15:791-803. PubMed
- Altered quality control in the endoplasmic reticulum causes cortical dysplasia in knock-in mice expressing a mutant BiP. Mol Cell Biol. 2008; 28:293-301. DOI | PubMed
- ARMET is a soluble ER protein induced by the unfolded protein response via ERSE-II element. Cell Struct Funct. 2007; 32:41-50. PubMed
- Neuronal subtype specification in the cerebral cortex. Nat Rev Neurosci. 2007; 8:427-437. DOI | PubMed
- The polycomb component Ring1B regulates the timed termination of subcerebral projection neuron production during mouse neocortical development. Development. 2014; 141:4343-4353. PubMed
- Endoplasmic reticulum stress response in dendrites of cultured primary neurons. Neuroscience. 2007; 146:1-8. DOI | PubMed
- Immune modulation by MANF promotes tissue repair and regenerative success in the retina. Science. 2016; 353:aaf3646.. DOI | PubMed
- Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat Neurosci. 2004; 7:136-144. DOI | PubMed
- Genetic regulation of arealization of the neocortex. Curr Opin Neurobiol. 2008; 18:90-100. PubMed
- Evidence that DmMANF is an invertebrate neurotrophic factor supporting dopaminergic neurons. Proc Natl Acad Sci USA. 2009; 106:2429-2434. DOI | PubMed
- MANF: a new mesencephalic, astrocyte-derived neurotrophic factor with selectivity for dopaminergic neurons. J Mol Neurosci. 2003; 20:173-188. PubMed
- The endoplasmic reticulum and protein trafficking in dendrites and axons. Trends Cell Biol. 2011; 21:219-227. DOI | PubMed
- IMPACT is a developmentally regulated protein in neurons that opposes the eukaryotic initiation factor 2α kinase GCN2 in the modulation of neurite outgrowth. J Biol Chem. 2013; 288:10860-10869. DOI | PubMed
- Thalamus-derived molecules promote survival and dendritic growth of developing cortical neurons. J Neurosci. 2012; 32:15388-15402. DOI | PubMed
- Unchanged scrapie pathology in brain tissue of tyrosine kinase Fyn-deficient mice. Neurodegener Dis. 2004; 1:266-268. DOI | PubMed
- Effects of hyperglycemia on the developing brain in newborns. Pediatr Neurol. 2014; 51:239-245. DOI | PubMed
- Protein synthesis within dendrites: glycosylation of newly synthesized proteins in dendrites of hippocampal neurons in culture. J Neurosci. 1996; 16:5967-5978. PubMed
- Mesencephalic astrocyte-derived neurotrophic factor is neurorestorative in rat model of Parkinson’s disease. J Neurosci. 2009; 29:9651-9659. DOI | PubMed
- Spatiotemporal expression of MANF in the developing rat brain. PLoS One. 2014; 9:e90433.. DOI | PubMed
- SnapShot: cortical development. Cell. 2012; 151:918-918.e1. DOI | PubMed
- Stress-activated protein kinase MKK7 regulates axon elongation in the developing cerebral cortex. J Neurosci. 2011; 31:16872-16883. DOI | PubMed
- Age-dependent decrease in chaperone activity impairs MANF expression, leading to Purkinje cell degeneration in inducible SCA17 mice. Neuron. 2014; 81:349-365. DOI | PubMed
- Neurofilaments at a glance. J Cell Sci. 2012; 125:3257-3263. PubMed
- Mesencephalic astrocyte-derived neurotrophic factor inhibits oxygen-glucose deprivation-induced cell damage and inflammation by suppressing endoplasmic reticulum stress in rat primary astrocytes. J Mol Neurosci. 2013; 51:671-678. DOI | PubMed
Fonte
Tseng K, Danilova T, Domanskyi A, Saarma M, Lindahl M, et al. (2017) MANF Is Essential for Neurite Extension and Neuronal Migration in the Developing Cortex. eNeuro 4(5): ENEURO.0214-17.2017. https://doi.org/10.1523/ENEURO.0214-17.2017





