Abstract
Introduzione
Recenti rapporti(Aspelund et al., 2015; Louveau et al., 2015b) hanno descritto l’esistenza di una rete di veri vasi linfatici all’interno della dura madre dei mammiferi che corre lungo i vasi sanguigni, in particolare i seni superiori sagittali e trasversi. I vasi linfatici durali mostrano i tipici marcatori immunoistochimici che identificano i vasi linfatici in altre parti del corpo. Essi forniscono un condotto alternativo per il drenaggio delle cellule immunitarie e del liquido cerebrospinale (CSF) dal cervello, oltre le vie di flusso precedentemente descritte: attraverso granulazioni aracnoidi nei seni venosi durali, e attraverso la piastra cribriforme nella regione etmoide(Weller et al., 2009). Sebbene i primi rapporti, basati su iniezioni di inchiostro di china nella cisterna magna del ratto, suggerivano che il percorso durale rappresentasse solo una minoranza del drenaggio(Kida et al., 1993), gli studi più recenti(Aspelund et al., 2015; Louveau et al., 2015b), che si basano su iniezioni di traccianti fluorescenti e microscopia in vivo, indicano che il sistema durale può essere sostanzialmente più importante per il drenaggio di macromolecole e cellule immunitarie rispetto a quanto precedentemente realizzato.
Non si sa se una rete simile di linfatici durali sia presente nei primati. Inoltre, la visualizzazione non invasiva dei linfatici durali – un primo passo necessario per capire la loro fisiologia normale e le potenziali aberrazioni nelle malattie neurologiche – non è stato segnalato. Abbiamo quindi verificato patologicamente l’esistenza di una rete linfatica durale nei primati umani e non umani (comuni scimmie marmoset) e valutato due tecniche di risonanza magnetica per immagini (MRI) che potrebbero consentire la sua visualizzazione in vivo. In primo luogo, la sequenza di impulsi di recupero dell’inversione di disattenuazione dei fluidi ponderata T2 (T2-FLAIR), che è lo standard clinico per il rilevamento delle lesioni all’interno del parenchima cerebrale, è altamente sensibile alla presenza di mezzi di contrasto a base di gadolinio nel liquor(Mamourian et al., 2000; Mathews et al., 1999; Absinta et al., 2015). In secondo luogo, le sequenze di imaging ‘black-blood’, tipicamente utilizzate per la misurazione dello spessore della parete vascolare o per il rilevamento della placca aterosclerotica, vengono messe a punto per scurire il contenuto dei vasi sanguigni (anche quando contengono un mezzo di contrasto a base di gadolinio), ma nel processo le immagini possono evidenziare i vasi con altri contenuti e proprietà di flusso (Mandellet al., 2017). Per confronto, abbiamo anche acquisito una sequenza MRI di acquisizione rapida preparata per l’acquisizione rapida di echi graduali (MPRAGE), che è ampiamente implementata per l’imaging strutturale del cervello e rappresenta un miglioramento avido della dura madre e dei vasi sanguigni, ma che non dovrebbe discriminare i vasi linfatici.
Risultati e discussione
I vasi sanguigni cerebrali hanno una barriera emato-encefalica altamente regolata, che protegge il neuropilo da molti contenuti del sangue in circolazione. In condizioni fisiologiche, la barriera emato-encefalica impedisce ai chelati a base di gadolinio nell’uso clinico standard di passare negli spazi perivascolari Virchow-Robin e nel parenchima, in modo che queste strutture non migliorino con la risonanza magnetica. D’altra parte, i vasi sanguigni durali sono privi di una barriera emato-meningea, che consente la fuoriuscita di fluidi circolanti e di piccole sostanze, compresi i composti a base di gadolinio. Questo spiega il sottile, anche se spesso incompleto, potenziamento durale che si vede sulle scansioni di risonanza magnetica convenzionale ponderata T1 in condizioni fisiologiche(Figura 1), così come il suo anormale ispessimento diffuso o localizzato in una varietà di condizioni patologiche(Smirniotopoulos et al., 2007; Antony et al., 2015). Utilizzando ad alta risoluzione (risoluzione in piano 270 × 270 μm o più fine) T2-FLAIR e T1 pesate immagini RMN a sangue nero, ottenute dopo l’iniezione endovenosa di materiale di contrasto standard approvato dalla FDA (gadobutrolo), siamo stati in grado di visualizzare la raccolta di gadolinio interstiziale all’interno dei vasi linfatici durali (diametro massimo apparente ~ 1 mm) in 5/5 volontari umani sani e 3/3 comuni scimmie marmoset (Figura 1). I nostri risultati suggeriscono che nella dura madre, simile a molti altri organi in tutto il corpo, piccole molecole intravascolari si estraggono nell’interstizio e poi, sotto un gradiente di pressione idrostatica, si raccolgono nei capillari linfatici attraverso un endotelio linfatico sciolto(Sharma et al., 2008).
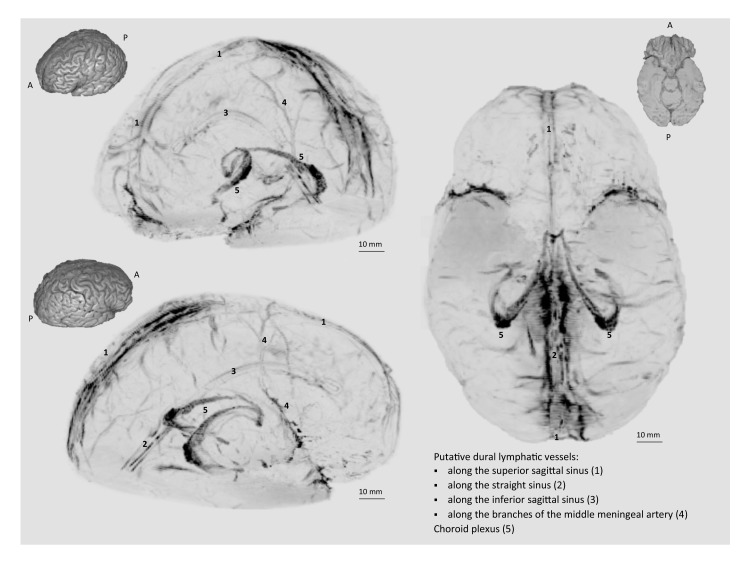
Figura 1-figure supplement 1.Figura 1—figura 1. Visualizzazione MRI dei vasi linfatici durali nei primati umani e non umani.rendering 3D dei linfatici durali umani.In entrambe le specie, la RM convenzionale post-gadobutrolo coronale ponderata T1 non è in grado di discriminare i vasi linfatici a causa del diffuso potenziamento fisiologico della dura (frecce) e dei vasi sanguigni, compresi il seno sagittale superiore e il seno dritto (frecce). Sul post-gadobutrolo coronale T2-FLAIR e sulle immagini di sottrazione, la dura non migliora, e i vasi linfatici (frecce rosse), che corrono lungo i seni venosi durali e all’interno del falx cerebri, possono essere apprezzati. I numeri si riferiscono a minuti dopo la somministrazione endovenosa di gadobutrolo.Rendering 3D di linfatici durali putativi (neri) in una donna di 47 anni, derivati dalla sottrazione cranica T1 – immagini di sangue nero (stesso caso del Video 1). Le miniature sono rendering 3D del parenchima cerebrale per facilitare la visualizzazione dell’orientamento dell’immagine.
Per testare ulteriormente questa ipotesi, sono stati valutati anche i linfatici meningei utilizzando un secondo mezzo di contrasto a base di gadolinio, gadofosveset, un mezzo di contrasto a pozza di sangue adatto per l’angiografia(Lauffer et al., 1998). Il gadofosveset si lega in modo reversibile all’albumina del siero, aumentando il suo peso molecolare da 0,9 a 67 kDa. In condizioni fisiologiche, l’albumina ha un basso tasso di scambio transcapillare nel compartimento interstiziale, stimato nell’ordine del 5% all’ora, il che spiega la propensione del gadofosveset a rimanere all’interno dei vasi sanguigni(Richardson et al., 2015). In entrambe le specie, il gadofosveset non ha rivelato linfatici durali, soprattutto sulle immagini di sangue nero T1(Figura 2 e Figura 2-figure supplement 1). Come previsto, sulle immagini MPRAGE ponderate T1, il gadofosveset ha fornito un miglioramento intravascolare superiore, sia nei vasi sanguigni meningei che parenchimali, rispetto al gadobutrolo(Figura 2).
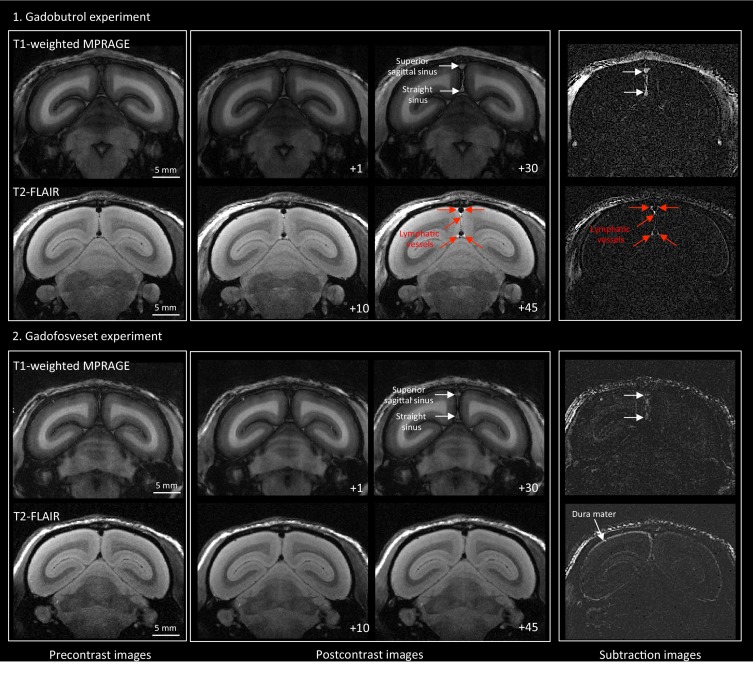
Figura 2-figure supplemento 1.Gadobutrolo vs. gadofosveset nella visualizzazione MRI dei vasi linfatici durali.visualizzazione MRI dei vasi linfatici durali in un marmoset sano con diversi mezzi di contrasto.Le immagini di sangue nero pesate con T1 coronale sono state acquisite dopo l’iniezione endovenosa di due diversi mezzi di contrasto a base di gadolinio (31 minuti dopo il gadobutrolo e 42 minuti dopo il gadofosveset), durante due sessioni di risonanza magnetica separate da una settimana. I linfatici durali (frecce rosse nelle caselle di visualizzazione ingrandite) sono stati meglio individuati utilizzando il gadobutrolo (mezzo di contrasto standard per la risonanza magnetica, che entra prontamente nella dura madre) rispetto al gadofosveset (mezzo di contrasto sierico legante l’albumina, che rimane in gran parte intravascolare) e sono stati localizzati intorno ai seni durali, all’arteria meningea media e alla piastra cribriforme (frecce bianche). In particolare, il plesso coroideale (frecce bianche) è migliorato meno con il gadofosveset rispetto al gadobutrolo, mentre i vasi sanguigni meningei e parenchimali (sia vene che arterie) non sono migliorati con alcun mezzo di contrasto e sono apparsi neri. Sulle immagini MPRAGE convenzionali ponderate T1, i vasi sanguigni meningei e parenchimali sono stati migliorati con entrambi i mezzi di contrasto, più chiaramente con il gadofosveset.In un marmoset comune sano di 11 anni, ad alta risoluzione (150 × 150 μm in piano) MPRAGE coronale ponderato T1 e T2-FLAIR sono stati acquisiti prima e in diversi punti temporali dopo l’iniezione di due diversi mezzi di contrasto (dose singola di gadobutrolo e gadofosveset), a una settimana di distanza l’uno dall’altro. (1) Esperimento di Gadobutrolo. I vasi linfatici durali sono discriminati sul post-contrasto T2-FLAIR e sulle immagini di sottrazione (immagini post vs. precontrasto), ma non sul post-contrasto 3D T1-ponderato MPRAGE. (2) Esperimento di Gadofosveset. Gadofosveset, che lega l’albumina sierica e quindi rimane in gran parte all’interno dei vasi sanguigni (frecce bianche su immagini postcontrasto T1-MPRAGE e sottrazione), anche nei tessuti (come la dura madre) che mancano di una barriera emato-encefalica, è approvato dalla FDA per l’angiografia a risonanza magnetica. I vasi linfatici durali non sono visibili su immagini post-gadofosveset T2-FLAIR e relative immagini di sottrazione, anche in caso di acquisizione ritardata (45 minuti dopo l’iniezione), nonostante il miglioramento preservato dei seni venosi durali. I numeri si riferiscono a minuti dopo la somministrazione endovenosa del mezzo di contrasto.
Su 3D-rendering di immagini MRI sottrazione(Video 1- 2, Figura 1-figure supplemento 1), linfatici durali sono visti in esecuzione parallela ai seni venosi durali, in particolare i seni superiori sagittale e seni dritti, e accanto a rami dell’arteria meningea media. La topografia dei linfatici meningei si adatta alla rete precedentemente descritta nei roditori così come i nostri dati neuropatologici(figure 3 e 4). Vale la pena notare che i linfatici visualizzati dalla risonanza magnetica sono grandi dotti linfatici a flusso lento, mentre i piccoli capillari linfatici ciechi e i piccoli capillari, chiaramente visibili dall’istopatologia(Figura 3 e Figura 3-figure supplement 1), difficilmente saranno rivelati dalla risonanza magnetica. L’induzione dell’encefalomielite autoimmune sperimentale (EAE) non ha influito sul rilevamento dei vasi linfatici durali in uno dei due animali che abbiamo testato (non mostrato).
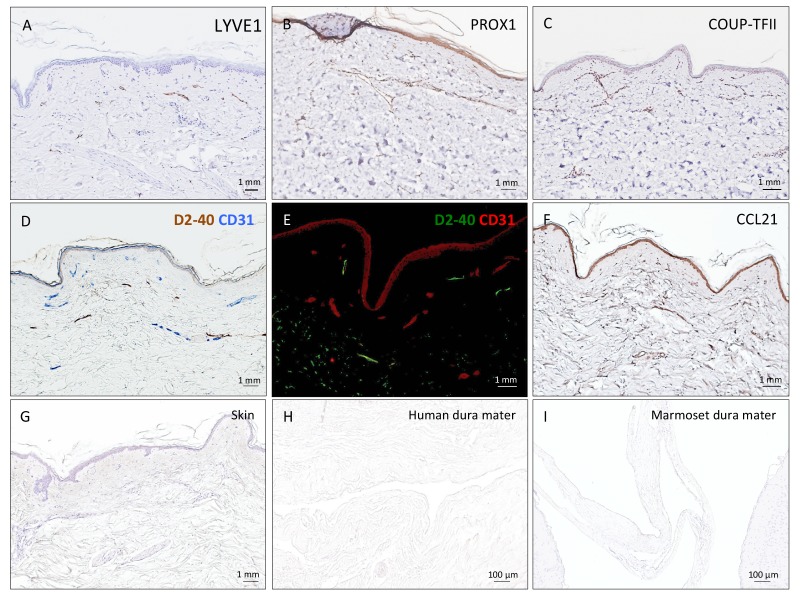
Figura 3-figure supplemento 2.Istopatologia dei vasi linfatici durali umani.Tabella di campionamento dei tessuti umani.Tabella di campionamento dei tessuti umani.Istopatologia dei vasi linfatici durali umani.colorazione di controllo positiva e negativa per i vasi linfatici.(A-B) Visione della dura madre umana atutto campo e coronale prima del campionamento per l’analisi istologica. La linea tratteggiata in A mostra dove il seno sagittale superiore corre all’interno degli strati durali.(C) Sezione coronale della dura madre umana colorata con H ed E per evidenziare le caratteristiche anatomiche di interesse, tra cui il falx cerebri e il seno venoso durale. Si noti la distorsione della dura madre dopo l’incorporazione della paraffina rispetto a B.(D, F, G) All’interno della dura madre, i vasi linfatici e sanguigni possono essere differenziati utilizzando immunocolorazione doppia per PROX1 (un fattore di trascrizione coinvolto nella linfangiogenesi, colorazione nucleare) e CD31 (un marcatore cellulare endoteliale vascolare).(E, H-K) Allo stesso modo, i vasi linfatici e sanguigni possono essere differenziati usando l’immunoistochimica (E, H, I) e l’immunofluorescenza (J, K) doppia colorazione per podoplanina (D2-40, colorazione della membrana endoteliale) e CD31. I globuli rossi si vedono all’interno dei vasi sanguigni, ma non nei vasi linfatici. Gli inserti(F-I) sono stati ruotati rispetto alle figure originali in D e E. Abbreviazioni : H ed E: ematossilina ed eosina; LV: vasi linfatici; BV: vasi sanguigni.10.7554/eLife.29738.010Figure 3-source data 1.Table of human tissue sampling.Vasi linfatici (marrone, frecce) in diversi campioni di dura madre umana visualizzati con doppia immunocolorazione (PROX1/CD31, D2-40 podoplanin/CD31, PROX1/D2-40 podoplanina).(A-F) 5 sezioni di paraffina μm della pelle umana sono stati implementati come controlli positivi per la valutazione dei marcatori delle cellule linfatiche dell’endotelio.(G-I) colorazione controllo negativo (solo anticorpi secondari, lo sviluppo di DAB, e l’ematossilina) di 5 sezioni di paraffina μm paraffina della pelle umana, dura madre umana, e cervello marmoset, rispettivamente. Nessuna colorazione di fondo o legame non specifico è stato visto in qualsiasi tessuto.
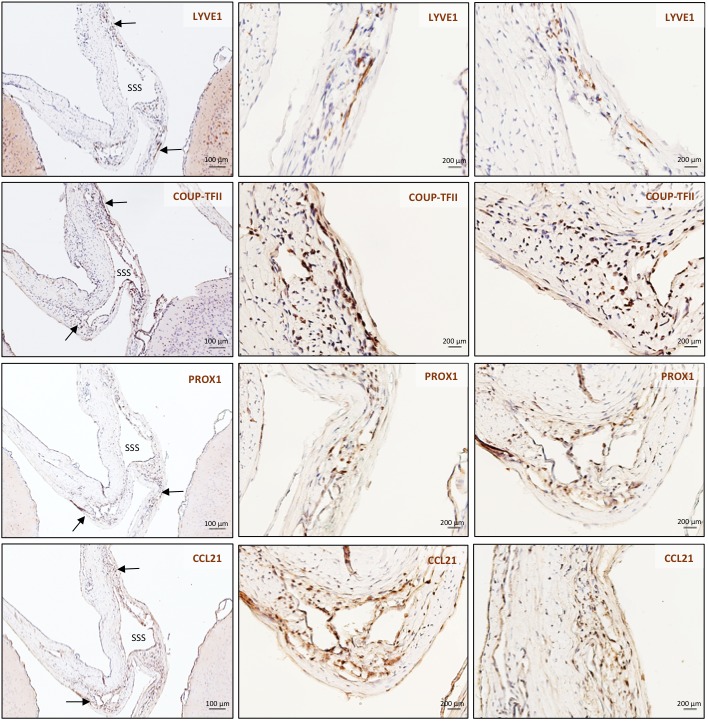
Figura 4-figure supplemento 1.Figura 4— figura 1. Istopatologia dei vasi linfatici durali nei marmoset comuni.tabella di campionamento dei tessuti di marmoset.tabella di campionamento dei tessuti di marmoset.istopatologia dei vasi linfatici durali di marmoset.Correlazione istopatologica della risonanza magnetica in un uistitì di 4,4 anni (A-F).(A, B) Postcontrasto coronale T2-FLAIR che mostra tre vasi linfatici di potenziamento all’interno della dura, e la corrispondente sezione H ed E per il riferimento anatomico (area di interesse nel riquadro).(C-F) Tre gruppi di cellule (cerchi), che circondano l’SSS e sono positivi per i marcatori cellulari endoteliali linfatici, corrispondono alle tre aree di potenziamento viste sulla risonanza magnetica(A). LYVE-1 è un marcatore di cellule endoteliali linfatiche (colorazione della membrana), PROX1 e COUP-TFII sono fattori di trascrizione coinvolti nella linfangiogenesi (colorazione nucleare), e CCL21 è una chemochina implicata nella trasmigrazione linfatica. Ingrandimenti più elevati sono mostrati in Figura 4-figure supplement 1. 10,3 anni marmoset (G-I).(G) H e E sezione coronale che mostra il parenchima cerebrale, meningi, e l’area di interesse per i linfatici per riferimento anatomico (box). Questo animale non ha recuperato dopo aver subito l’anestesia generale per il test della tubercolosi del sangue, e all’autopsia è stato identificato un ictus in un emisfero (asterisco). (H-I) Linfatico (cerchi) e vasi sanguigni sono stati differenziati utilizzando doppia colorazione per podoplanina (D2-40, colorazione membrana endoteliale) e vascolare marker cellulare endoteliale (CD31), rispettivamente. 3,7 anni marmoset (J-L).(J) Intera montatura della marmoset dura, compreso l’SSS. Si può apprezzare l’alto livello di vascolarizzazione della dura. La freccia indica l’area mostrata in K e L.(K, L) Doppia colorazione per la podoplanina D2-40 per i linfatici, e CD31 per le cellule endoteliali vascolari, mostrano la presenza di una struttura vascolare lineare parallela all’SSS, positiva per la podoplanina D2-40 ma non CD31. L’SSS è positivo per entrambi i marcatori, probabilmente a causa dell’intrappolamento di anticorpi durante la colorazione di immunofluorescenza della durabilità dell’intero supporto. Abbreviazioni: H ed E: ematossilina ed eosina; LV: vasi linfatici; SSS: seno sagittale superiore.10.7554/eLife.29738.013Cifre 4 dati fonte 1.Tabella di campionamento dei tessuti di uistitì.2. Ingrandimento elevato degli inserti C-F da Figura 4.

Video 1.3.3D-rendering di linfatico durale (verde) in una donna di 47 anni da una donna di 47 anni da sottrazione cranica T1-sottrazione T1-immagini di sangue nero (vista orizzontale, 180 gradi, 7 fotogrammi al minuto).

Video 2.3D-rendering di linfatici durali (verde) in una marmoset comune di 6,7 anni da immagini di sottrazione cranica T2-FLAIR (vista orizzontale, 180 gradi, 7 fotogrammi al minuto).
Per supportare i nostri risultati di imaging in vivo, abbiamo ulteriormente studiato l’esistenza e la topografia dei linfatici nelle sezioni coronali e longitudinali della dura madre umana e della marmosa. Per ottenere questo risultato, abbiamo testato una varietà di marcatori endoteliali linfatici putativi e abbiamo trovato che la doppia immunocolorazione selettiva per D2-40 podoplanina/CD31 e per PROX1/CD31 era la strategia più efficace per discriminare i vasi sanguigni linfatici rispetto a quelli venosi nei campioni di dura mater – un compito impegnativo poiché i linfatici germogliano dalla transdifferenziazione dell’endotelio venoso (Nyet al., 2005; Yaniv et al., 2006; Srinivasan et al., 2007; Aspelund et al., 2014; Lowe et al., 2015) e condividono persistentemente alcuni marcatori endoteliali. Una rete ramificata di linfatici è stata chiaramente vista all’interno della dura madre. Su D2-40 podoplanin/CD31 doppia colorazione, abbiamo identificato un totale di 93 linfatici umani durali; la maggior parte sono stati collassati, spiegando l’ampia gamma di diametri trasversali massimi (range = 7-842 μm, media = 125 μm, deviazione standard = 161 μm). La densità dei linfatici durali era più alta intorno ai seni venosi che nelle aree più laterali della dura, e più alta all’interno dello strato meningeo rispetto allo strato periostale della dura. Come previsto, i globuli rossi non sono stati visti all’interno dei linfatici. Nelle uistitì, è stato effettuato un confronto diretto tra risonanza magnetica in vivo e istopatologia(Absinta et al., 2014; Guy et al., 2016; Luciano et al., 2016). Come mostrato in Figura 4 e Figura 4-figure supplement 1, i tre vasi durali rilevati sul postcontrasto coronale T2-FLAIR e sulle immagini di sottrazione si colocalizzano con tre cluster di cellule durali che esprimono l’intero pannello di marcatori endoteliali linfatici (LYVE-1, D2-40 podoplanina, PROX1, COUP-TFII) e CCL21, una chemochina implicata nella trasmigrazione linfatica.
Nel dibattito in corso sulla localizzazione precisa dei linfatici all’interno delle meningi (completamente all’interno della dura o “condivisa” tra la dura e l’aracnoide) (Kipnis,2016; Raper et al., 2016), i nostri dati patologici mostrano chiaramente che almeno alcuni linfatici sono contenuti interamente all’interno della dura (Figure3 e 4). In base a una valutazione limitata, non siamo stati in grado di visualizzare i linfatici all’interno dei leptomeningi, ma sono necessari ulteriori studi dedicati, idealmente con metodi non convenzionali di preparazione dei tessuti, per esplorare appieno questa possibilità. Una mappa completa della rete linfatica meningea avrebbe implicazioni per svelare i modi in cui i linfatici meningei partecipano alla rimozione dei rifiuti e al traffico di cellule immunitarie all’interno del sistema nervoso centrale(Louveau et al., 2015a; Kipnis, 2016; Raper et al., 2016).
In condizioni patologiche infiammatorie, la migrazione cellulare verso i linfatici durali potrebbe essere profondamente migliorata da una specifica segnalazione e plasticità linfatica(Alitalo et al., 2005; Kim et al., 2012; Stacker et al., 2014). Degni di nota in questo contesto sono i cluster di linfociti extravascolari CD3+ e di macrofagi fagocitici meningei CD68+ che abbiamo osservato nella durata di diverse autopsie di sclerosi multipla (non mostrate), a conferma di un intenso traffico di cellule immunitarie e della comunicazione. Infatti, senza un adeguato confronto normativo, non possiamo escludere che l’ampia presenza di piccoli linfatici osservati nei campioni di sclerosi multipla dura sia il risultato di una linfoangiogenesi mediata dall’infiammazione. D’altra parte, la disfunzione linfatica potrebbe compromettere la rimozione dei rifiuti nelle malattie neurodegenerative e nell’invecchiamento, in linea con la recente deposizione di β-amiloide nella dura dura umana in persone anziane (Kovacset al., 2016).
A differenza degli esperimenti che implementavano iniezioni di traccianti all’interno delle strutture cerebrali, qui abbiamo mirato principalmente all’immagine dei vasi linfatici durali nei primati umani e non umani, ma non abbiamo potuto dimostrare se i vasi linfatici durali drenano le cellule immunitarie, il liquor o altre sostanze dal cervello ai linfonodi cervicali profondi, né abbiamo potuto valutare alcun legame con il sistema linfatico(Iliff et al., 2012; Xie et al., 2013; Iliff et al., 2013). Una tale analisi richiederebbe probabilmente l’iniezione di specifici traccianti rilevabili a risonanza magnetica e l’acquisizione di serie temporali di risonanza magnetica (non esplorati in modo approfondito nel lavoro attuale), un’importante direzione di ricerca futura per il lavoro sui primati non umani.
Nel complesso, i nostri dati dimostrano chiaramente e costantemente l’esistenza di vasi linfatici all’interno della dura madre dei primati umani e non umani. Insieme ai recenti studi sui roditori, i nostri risultati mostrano che il sistema linfatico meningeo è evolutivamente conservato nei mammiferi e confermano, dopo esattamente due secoli, ciò che l’anatomista italiano Paolo Mascagni ipotizzava fossero i vasi linfatici alla superficie del cervello umano(Mascagni e Bellini, 1816). La capacità di immaginare i linfatici meningei in modo non invasivo suggerisce immediatamente la possibilità di studiare potenziali anomalie nei disturbi neurologici umani.

Figura 1-figure supplemento 1.Figura 1—figura 1. Visualizzazione MRI dei vasi linfatici durali nei primati umani e non umani.3D rendering dei linfatici durali umani.In entrambe le specie, la RM convenzionale post-gadobutrolo coronale ponderata T1 non è in grado di discriminare i vasi linfatici a causa del diffuso potenziamento fisiologico della dura (frecce) e dei vasi sanguigni, compresi il seno sagittale superiore e il seno dritto (frecce). Sul post-gadobutrolo coronale T2-FLAIR e sulle immagini di sottrazione, la dura non migliora, e i vasi linfatici (frecce rosse), che corrono lungo i seni venosi durali e all’interno del falx cerebri, possono essere apprezzati. I numeri si riferiscono a minuti dopo la somministrazione endovenosa di gadobutrolo.Rendering 3D di linfatici durali putativi (neri) in una donna di 47 anni, derivati dalla sottrazione cranica T1 – immagini di sangue nero (stesso caso del Video 1). Le miniature sono rendering 3D del parenchima cerebrale per facilitare la visualizzazione dell’orientamento dell’immagine.

Figura 1-figure supplement 1.Rendering 3D dei linfatici durali umani.Rendering 3D di linfatici durali putativi (neri) in una donna di 47 anni, derivati dalla sottrazione cranica T1 – immagini di sangue nero (stesso caso del Video 1). Le miniature sono rendering 3D del parenchima cerebrale per facilitare la visualizzazione dell’orientamento dell’immagine.

Figura 2-figure supplemento 1.Gadobutrolo vs. gadofosveset nella visualizzazione della RMN dei vasi linfatici durali.visualizzazione della RMN dei vasi linfatici durali in un marmoset sano con diversi mezzi di contrasto.Le immagini di sangue nero pesate con T1 coronale sono state acquisite dopo l’iniezione endovenosa di due diversi mezzi di contrasto a base di gadolinio (31 minuti dopo il gadobutrolo e 42 minuti dopo il gadofosveset), durante due sessioni di risonanza magnetica separate da una settimana. I linfatici durali (frecce rosse nelle caselle di visualizzazione ingrandite) sono stati meglio individuati utilizzando il gadobutrolo (mezzo di contrasto standard per la risonanza magnetica, che entra prontamente nella dura madre) rispetto al gadofosveset (mezzo di contrasto sierico legante l’albumina, che rimane in gran parte intravascolare) e sono stati localizzati intorno ai seni durali, all’arteria meningea media e alla piastra cribriforme (frecce bianche). In particolare, il plesso coroideale (frecce bianche) è migliorato meno con il gadofosveset rispetto al gadobutrolo, mentre i vasi sanguigni meningei e parenchimali (sia vene che arterie) non sono migliorati con alcun mezzo di contrasto e sono apparsi neri. Sulle immagini MPRAGE convenzionali ponderate T1, i vasi sanguigni meningei e parenchimali sono stati migliorati con entrambi i mezzi di contrasto, più chiaramente con il gadofosveset.In un marmoset comune sano di 11 anni, ad alta risoluzione (150 × 150 μm in piano) MPRAGE coronale ponderato T1 e T2-FLAIR sono stati acquisiti prima e in diversi punti temporali dopo l’iniezione di due diversi mezzi di contrasto (dose singola di gadobutrolo e gadofosveset), a una settimana di distanza l’uno dall’altro. (1) Esperimento di Gadobutrolo. I vasi linfatici durali sono discriminati sul post-contrasto T2-FLAIR e sulle immagini di sottrazione (immagini post vs. precontrasto), ma non sul post-contrasto 3D T1-ponderato MPRAGE. (2) Esperimento di Gadofosveset. Gadofosveset, che lega l’albumina sierica e quindi rimane in gran parte all’interno dei vasi sanguigni (frecce bianche su immagini postcontrasto T1-MPRAGE e sottrazione), anche nei tessuti (come la dura madre) che mancano di una barriera emato-encefalica, è approvato dalla FDA per l’angiografia a risonanza magnetica. I vasi linfatici durali non sono visibili su immagini post-gadofosveset T2-FLAIR e relative immagini di sottrazione, anche in caso di acquisizione ritardata (45 minuti dopo l’iniezione), nonostante il miglioramento preservato dei seni venosi durali. I numeri si riferiscono a minuti dopo la somministrazione endovenosa del mezzo di contrasto.

Figura 2-figure supplemento 1.Visualizzazione MRI dei vasi linfatici durali in un marmoset sano con diversi mezzi di contrasto.In una marmoset comune sana di 11 anni, ad alta risoluzione (150 × 150 μm in piano) sono stati acquisiti prima e in diversi punti temporali dopo l’iniezione di due diversi mezzi di contrasto (dose singola di gadobutrolo e gadofosveset), a una settimana di distanza l’uno dall’altro. (1) Esperimento di gadobutrolo. I vasi linfatici durali sono discriminati sul post-contrasto T2-FLAIR e sulle immagini di sottrazione (immagini post vs. precontrasto), ma non sul post-contrasto 3D T1-ponderato MPRAGE. (2) Esperimento di Gadofosveset. Gadofosveset, che lega l’albumina sierica e quindi rimane in gran parte all’interno dei vasi sanguigni (frecce bianche su immagini postcontrasto T1-MPRAGE e sottrazione), anche nei tessuti (come la dura madre) che mancano di una barriera emato-encefalica, è approvato dalla FDA per l’angiografia a risonanza magnetica. I vasi linfatici durali non sono visibili su immagini post-gadofosveset T2-FLAIR e relative immagini di sottrazione, anche in caso di acquisizione ritardata (45 minuti dopo l’iniezione), nonostante il miglioramento preservato dei seni venosi durali. I numeri si riferiscono a minuti dopo la somministrazione endovenosa del mezzo di contrasto.

Figura 3-figure supplemento 2.Istopatologia dei vasi linfatici durali umani.tabella di campionamento dei tessuti umani.tabella di campionamento dei tessuti umani.istopatologia dei vasi linfatici durali umani.colorazione di controllo positivo e negativo per i vasi linfatici.(A-B) Visione della dura madre umana atutto campo e coronale prima del campionamento per l’analisi istologica. La linea tratteggiata in A mostra dove il seno sagittale superiore corre all’interno degli strati durali.(C) Sezione coronale della dura madre umana colorata con H ed E per evidenziare le caratteristiche anatomiche di interesse, tra cui il falx cerebri e il seno venoso durale. Si noti la distorsione della dura madre dopo l’incorporazione della paraffina rispetto a B.(D, F, G) All’interno della dura madre, i vasi linfatici e sanguigni possono essere differenziati utilizzando immunocolorazione doppia per PROX1 (un fattore di trascrizione coinvolto nella linfangiogenesi, colorazione nucleare) e CD31 (un marcatore cellulare endoteliale vascolare).(E, H-K) Allo stesso modo, i vasi linfatici e sanguigni possono essere differenziati usando l’immunoistochimica (E, H, I) e l’immunofluorescenza (J, K) doppia colorazione per podoplanina (D2-40, colorazione della membrana endoteliale) e CD31. I globuli rossi si vedono all’interno dei vasi sanguigni, ma non nei vasi linfatici. Gli inserti(F-I) sono stati ruotati rispetto alle figure originali in D e E. Abbreviazioni : H ed E: ematossilina ed eosina; LV: vasi linfatici; BV: vasi sanguigni.10.7554/eLife.29738.010Figure 3-source data 1.Table of human tissue sampling.Vasi linfatici (marrone, frecce) in diversi campioni di dura madre umana visualizzati con doppia immunocolorazione (PROX1/CD31, D2-40 podoplanin/CD31, PROX1/D2-40 podoplanina).(A-F) 5 sezioni di paraffina μm della pelle umana sono stati implementati come controlli positivi per la valutazione dei marcatori delle cellule linfatiche dell’endotelio.(G-I) colorazione controllo negativo (solo anticorpi secondari, lo sviluppo di DAB, e l’ematossilina) di 5 sezioni di paraffina μm paraffina della pelle umana, dura madre umana, e cervello marmoset, rispettivamente. Nessuna colorazione di fondo o legame non specifico è stato visto in qualsiasi tessuto.
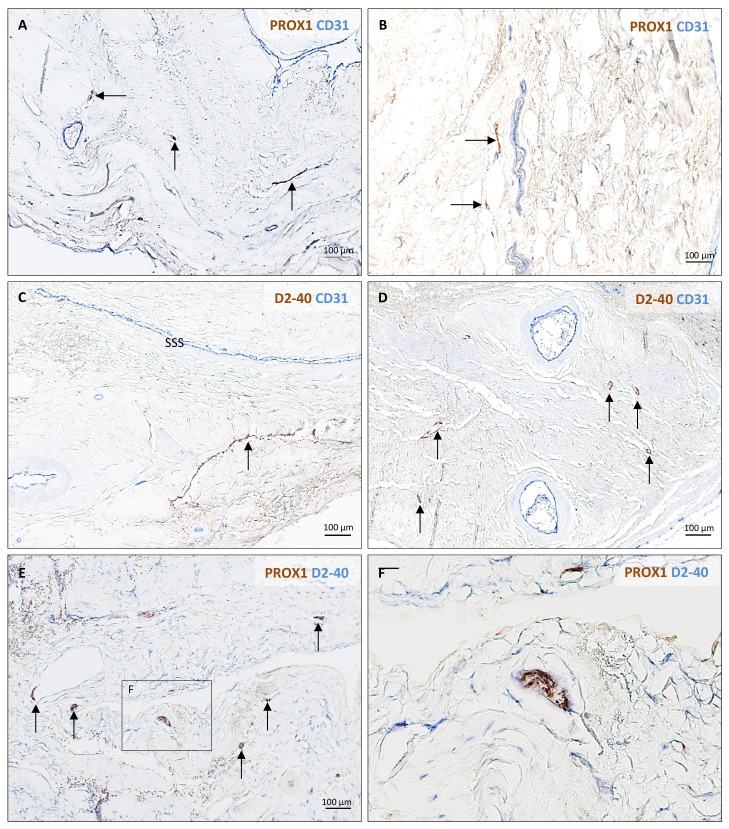
Figura 3-figure supplemento 1.1. Istopatologia dei vasi linfatici durali umani.Vasi linfatici (marrone, frecce) in diversi campioni di dura madre umana visualizzati con doppia immunocolorazione (PROX1/CD31, D2-40 podoplanin/CD31, PROX1/D2-40 podoplanina).

Figura 3-figure supplement 2.Colorazione di controllo positivo e negativo per vasi linfatici.(A-F) 5 sezioni di paraffina μm della pelle umana sono stati implementati come controlli positivi per la valutazione dei marcatori delle cellule linfatiche dell’endotelio.(G-I) colorazione controllo negativo (solo anticorpi secondari, lo sviluppo di DAB, e l’ematossilina) di 5 sezioni di paraffina μm paraffina della pelle umana, dura madre umana, e cervello marmoset, rispettivamente. Nessuna colorazione di fondo o legame non specifico è stato visto in qualsiasi tessuto.

Figura 4-figure supplemento 1.Figura 4— figura 1. Istopatologia dei vasi linfatici durali nei marmoset comuni.tabella di campionamento dei tessuti di marmoset.tabella di campionamento dei tessuti di marmoset.istopatologia dei vasi linfatici durali di marmoset.Correlazione istopatologica della risonanza magnetica in un uistitì di 4,4 anni (A-F).(A, B) Postcontrasto coronale T2-FLAIR che mostra tre vasi linfatici di potenziamento all’interno della dura, e la corrispondente sezione H ed E per il riferimento anatomico (area di interesse nel riquadro).(C-F) Tre gruppi di cellule (cerchi), che circondano l’SSS e sono positivi per i marcatori cellulari endoteliali linfatici, corrispondono alle tre aree di potenziamento viste sulla risonanza magnetica(A). LYVE-1 è un marcatore di cellule endoteliali linfatiche (colorazione della membrana), PROX1 e COUP-TFII sono fattori di trascrizione coinvolti nella linfangiogenesi (colorazione nucleare), e CCL21 è una chemochina implicata nella trasmigrazione linfatica. Ingrandimenti più elevati sono mostrati in Figura 4-figure supplement 1. 10,3 anni marmoset (G-I).(G) H e E sezione coronale che mostra il parenchima cerebrale, meningi, e l’area di interesse per i linfatici per riferimento anatomico (box). Questo animale non ha recuperato dopo aver subito l’anestesia generale per il test della tubercolosi del sangue, e all’autopsia è stato identificato un ictus in un emisfero (asterisco). (H-I) Linfatico (cerchi) e vasi sanguigni sono stati differenziati utilizzando doppia colorazione per podoplanina (D2-40, colorazione membrana endoteliale) e vascolare marker cellulare endoteliale (CD31), rispettivamente. 3,7 anni marmoset (J-L).(J) Intera montatura della marmoset dura, compreso l’SSS. Si può apprezzare l’alto livello di vascolarizzazione della dura. La freccia indica l’area mostrata in K e L.(K, L) Doppia colorazione per la podoplanina D2-40 per i linfatici, e CD31 per le cellule endoteliali vascolari, mostrano la presenza di una struttura vascolare lineare parallela all’SSS, positiva per la podoplanina D2-40 ma non CD31. L’SSS è positivo per entrambi i marcatori, probabilmente a causa dell’intrappolamento di anticorpi durante la colorazione di immunofluorescenza della durabilità dell’intero supporto. Abbreviazioni: H ed E: ematossilina ed eosina; LV: vasi linfatici; SSS: seno sagittale superiore.10.7554/eLife.29738.013Cifre 4 dati fonte 1.Tabella di campionamento dei tessuti di uistitì.2. Ingrandimento elevato degli inserti C-F da Figura 4.

Figura 4-figure supplement 1.1. Istopatologia dei vasi linfatici durali dell’uistitìo.2. Ingrandimento elevato degli inserti C-F della Figura 4.

Video 1.3D-rendering di linfatico durale (verde) in una donna di 47 anni da sottrazione cranica T1-sottrazione T1-immagini di sangue nero (vista orizzontale, 180 gradi, 7 fotogrammi al minuto).

Video 2.3D-rendering di linfatici durali (verde) in una marmoset comune di 6,7 anni da immagini di sottrazione cranica T2-FLAIR (vista orizzontale, 180 gradi, 7 fotogrammi al minuto).
Materiali e metodi
Approvazioni
Abbiamo condotto studi sull’uomo secondo un protocollo(NCT02504840) approvato dal NIH Institutional Review Board. È stato ottenuto il consenso informato di tutti i partecipanti. I cervelli umani fissati in formalina sono stati ottenuti in autopsia dopo aver ottenuto il consenso del parente più prossimo. Gli studi sugli animali sono stati eseguiti secondo un protocollo approvato dal Comitato Istituzionale per la cura e l’uso degli animali.
Immagine umana
Abbiamo studiato cinque volontari sani (tre donne, fascia d’età 28-53 anni) e abbiamo ottenuto scansioni su un’unità di risonanza magnetica a 3 tesla (Skyra, Siemens Healthcare, Erlangen, Germania), utilizzando la bobina del corpo per la trasmissione a radiofrequenza e una bobina ad array di fase a 32 elementi per la ricezione.
Prima dell’iniezione del mezzo di contrasto a base di gadolinio, sono state raccolte le seguenti sequenze di risonanza magnetica ad alta risoluzione:
- T1-Magnetizzazione Cervello Intero Preparato Acquisizione Rapida di Echi Gradienti (MPRAGE, sequenza turbo-veloce 3D sagittale a basso angolo di scatto [TFL], matrice di acquisizione 256 × 256, risoluzione isotropa 1 mm, 176 fette, tempo di ripetizione [TR]/tempo di eco [TE]/tempo di inversione [TI]=3000/3/900 ms, angolo di ribaltamento 9, tempo di acquisizione 5 min 38 s);
- Recupero dell’inversione dell’attenuazione del fluido ponderato T2 limitato (FLAIR, acquisizione 2D coronale sul seno sagittale superiore, campo visivo 256 × 256, 22 fette, risoluzione ricostruita in piano 0,25 mm x 0.25 mm, 42 fette contigue da 3 mm, TR/TE/TI = 6500/93/2100 ms, lunghezza del treno di eco 17, larghezza di banda 80 Hz/pixel, tempo di acquisizione 5 min), ottimizzato per il rilevamento del mezzo di contrasto a base di gadolinio nello spazio subaracnoideo (Absinta etal., 2015);
- Black-blood scan (acquisizione coronale 2D, Perfezione di campionamento con l’applicazione di contrasti ottimizzati con l’uso di diversi angoli di ribaltamento sequenza Evolution [SPAZIO], campo visivo 174 × 174, matrice 320 × 320, risoluzione ricostruita in piano 0,27 × 0,27 mm, 64 sezioni contigue da 0,5 mm, TR/TE = 938/22 ms, lunghezza del treno di eco 35, larghezza di banda 434 Hz/pixel, tempo di acquisizione 7 min 50 s). Una serie di 2 o tre acquisizioni coronali sovrapposte sono state acquisite per coprire la maggior parte degli emisferi cerebrali;
- Scansione cerebrale completa T2-FLAIR (acquisizione 3D coronale, sequenza SPACE, campo visivo 235 × 235, matrice 512 × 512, risoluzione ricostruita in piano 0,46 × 0,46 mm, 176 sezioni da 1 mm, TR/TE/TI = 4800/354/1800 ms, impulso di inversione non selettivo, lunghezza del treno di eco 298, larghezza di banda 780 Hz/pixel, fattore di accelerazione 2, tempo di acquisizione 14 min);
- Whole-brain T1-SPACE (acquisizione 3D assiale, matrice di acquisizione 256 × 256, risoluzione isotropa 0,9 mm, 112 sezioni, TR/TE = 600/20 ms, angolo di rotazione 120, lunghezza eco-treno 28, tempo di acquisizione 10 min).
Abbiamo ripetuto queste acquisizioni dopo l’iniezione di gadobutrolo (Gadavist, Bayer HealthCare, Whippany, NJ) in tutti e cinque i partecipanti. In 2 dei partecipanti abbiamo anche ripetuto l’intero protocollo prima e dopo l’iniezione endovenosa di gadofosveset(Lauffer et al., 1998) (Ablavar, Lantheus Medical Imaging, N Billerica, MA). Le iniezioni hanno seguito il dosaggio suggerito dal produttore (0,1 mmol/kg per il gadobutrolo, 0,03 mmol/kg per il gadofosveset).
Immagini di uistitì
Abbiamo studiato tre uistitì comuni adulti sani(Callithrix jacchus) (una femmina, due maschi, fascia d’età 4-11 anni). Dopo la risonanza magnetica di base, l’encefalomielite autoimmune sperimentale (EAE) è stata indotta in 2 uistitì con 0,2 mg di materia bianca umana omogenea surgelata come descritto in precedenza(Gaitán et al., 2014). Le uistitì sono state collocate in posizione sfinge all’interno del magnete e le scansioni sono state ottenute su un’unità di risonanza magnetica a 7 tesla (Avance AVIII, Bruker BioSpin, Billerica, MA, USA). L’acquisizione dei dati è stata effettuata in modalità di sola trasmissione/ricezione utilizzando una bobina di gabbia per uccelli lineare fatta in casa (120 mm di diametro interno) come trasmettitore a radiofrequenza e un gruppo di bobine di ricezione a 8 canali a radiofrequenza di superficie a 8 canali posto sopra la testa dell’animale. Prima dell’iniezione del mezzo di contrasto, abbiamo raccolto:
- Scansione MPRAGE ponderata T1 del cervello intero (acquisizione 3D coronale, sequenza Modified Driven Equilibrium Fourier Transform [MDEFT], voxel in piano di dimensioni 0,15 mm x 0,15 mm, 36 sezioni contigue da 1 mm, TR/TE/TI = 12,5/4/1200 ms, angolo di ribaltamento di 12 gradi, 2 segmenti di 1800 ms, tempo di acquisizione 7 min);
- Scansione del cervello intero T2-FLAIR (acquisizione 2D coronale, sequenza Rapid Acquisition with Relaxation Enhancement [RARE], dimensione voxel 0,15 mm x 0,15 mm, 36 sezioni contigue da 1 mm, TR/TE/TI = 10.000/36/2500 ms, angolo di ribaltamento 90-180 gradi, 2 medie, tempo di acquisizione 13 min).
Abbiamo eseguito le stesse scansioni dopo l’iniezione endovenosa di gadobutrolo e gadofosveset, in due diverse sessioni di risonanza magnetica. Le iniezioni utilizzate sono singole (0,1 mmol/kg per il gadobutrolo, 0,03 mmol/kg per il gadofosveset) o triplicano il dosaggio umano raccomandato (0,3 mmol/kg per il gadobutrolo, 0,09 mmol/kg per il gadofosveset).
Elaborazione dell’immagine
Le immagini DICOM generate dallo scanner sono state convertite in file NIFTI per la post-elaborazione. Utilizzando il software MIPAV(https://mipav.cit.nih.gov), le scansioni precontrasto sono state rigidamente registrate per le scansioni postcontrasto e sono state create immagini di sottrazione per l’identificazione anatomica dei vasi linfatici durali. Le immagini di sottrazione con teschio 3D sono state poi importate nel software Osirix per il rendering 3D MIP (Maximum Intensity Projection). La stessa post-elaborazione è stata eseguita per le scansioni acquisite dopo l’iniezione di gadofosveset, ed è stato fatto un confronto diretto tra i due mezzi di contrasto a base di gadolinio.
Valutazione neuropatologica dei vasi linfatici durali umani e dei primati
La valutazione neuropatologica si è concentrata su campioni di dura madre del cervello umano e di marmoset. Più campioni di dura madre umana sono stati ottenuti da 2 cervelli fissati in formalina (60 e 77 anni con sclerosi multipla progressiva di lunga data) e da un 33-year-old con epilessia refrattaria in fase di lobectomia temporale anteriore(Figura 3-source dati 1). Campioni di primati sono stati ottenuti da 3 marmoset adulti comuni (2 con EAE)[Figura 4 dati fonte 1]. Dopo l’anestesia generale e la perfusione transcardica del 4% di paraformaldeide, i cervelli di uistitì sono stati estratti e conservati in formalina al 10%. Per i cervelli di primati, sono state eseguite sezioni istologiche corrispondenti alla risonanza magnetica attraverso la risonanza magnetica 7T del cervello fisso e il successivo sezionamento lordo con una scatola da taglio personalizzata, progettata per la risonanza magnetica, stampata in 3D, come descritto in precedenza(Absinta et al., 2014; Guy et al., 2016; Luciano et al., 2016).
Le sezioni coronali e longitudinali da 3 a 7 μm di paraffina della dura madre sono state colorate con ematossilina ed eosina (H ed E). Analisi immunoistochimiche e immunofluorescenti per marcatori cellulari endoteliali linfatici classici [recettore ialuronico endoteliale dei vasi linfatici 1 (LYVE-1), podoplanina (D2-40), proteina omeobox 1 (PROX1), fattore di trascrizione COUP 2 (COUP-TFII) e CCL21], sono state eseguite su vetrini rappresentativi. La doppia colorazione selettiva per i marcatori endoteliali linfatici vs. vascolari (D2-40/CD31 e PROX1/CD31) è stata eseguita anche su sezioni rappresentative e implementata per la quantificazione istologica; il diametro massimo è stato registrato per ogni vaso linfatico e sono state calcolate statistiche descrittive. Abbiamo anche colorato per i linfociti (CD3) e per i monociti/macrofagi (CD68). Cinque sezioni di paraffinaμm della pelle umana sono stati utilizzati come controlli positivi per la valutazione dei marcatori delle cellule linfatiche dell’endotelio (Figura 3-figure supplement 2). Per confronto, 10 blocchi di tessuto cerebrale umano di paraffina, selezionati per la presenza di architettura leptomeningea quasi intatta, sono stati implementati per valutare la presenza di linfatici all’interno dello spazio subaracnoideo e del parenchima cerebrale.
Anticorpi
La fonte, il tipo di anticorpo e la diluizione sono indicati in sequenza come segue: LIVE-1 (Abcam, UK, coniglio policlonale, 1:200); podoplanina D2-40 (AbD Serotec, Hercules, CA, topo monoclonale, 1:50); PROX-1 (AngioBio, San Diego, CA, coniglio policlonale, 1:50); COUP TFII (R&D Systems, Minneapolis, MN, mouse monoclonale, 1:200); CCL21 (Abcam, coniglio policlonale, 1:200); CD31 (Abcam, rabbit polyclonal, 1:50); CD68 KP1 (Thermofisher, Waltham, MA, mouse monoclonal, 1:100); CD3 (Dako, Santa Clara, CA, rabbit polyclonal, 1:200); capra anti-topo Alexafluor 488 IgG (Invitrogen, Carlsbad, CA, 1:250) e capra anti-coniglio Alexafluor 594 IgG anticorpi IgG (Invitrogen, 1:250).
Immunoistochimica
L’immunocolorazione è stata eseguita su sezioni consecutive di paraffina di spessore da 3 a 7 μm con anticorpi contro LYVE1, D2-40 podoplanina, PROX1, COUP-TFII, CCL21, CD31, CD68, CD3 e visualizzata con 3,3′-diamminobenzidina (DAB). In breve, dopo la deparaffinizzazione, le sezioni sono state risciacquate in soluzione salina tamponata con trifosfato (TBS) per 10 minuti ciascuna, trattate per il recupero dell’antigene, e trattate con perossido di idrogeno al 3% per 10 minuti. Le sezioni sono state bloccate con una soluzione proteica-bloccante per 20 min e incubate con gli anticorpi primari durante la notte a 4°C o 1 ora a temperatura ambiente, poi risciacquate e incubate con anticorpi secondari per 30 min. L’immunoreazione è stata visualizzata con DAB. Dopo il lavaggio, le sezioni sono stati contrastati con il 10% di ematossilina. Le sezioni colorate sono state visualizzate e digitalizzate (Axio Observer Z.1, Carl Zeiss Microscopy, NY, USA). Doppia colorazione selettiva per marcatori linfatici e vascolari dell’endotelio (D2-40 podoplanin/CD31, PROX1/CD31), così come la doppia colorazione per D2-40 podoplanin/PROX1, sono stati eseguiti anche su sezioni rappresentative. La doppia colorazione è stata eseguita utilizzando, in sequenza, i metodi della perossidasi di rafano DAB (HRP) e della fosfatasi alcalina Vector Blue (AP). Come controllo negativo, sezioni di pelle umana, dura madre umana, e cervello marmoset sono stati colorati senza gli anticorpi primari, nessuna colorazione di fondo e / o legame non specifico è stato notato(Figura 3-figure supplemento 2).
Immunofluorescenza
Dopo la deparaffinizzazione, le sezioni sono state trattate con lo stesso metodo descritto sopra. Le sezioni sono state incubate con un cocktail di anticorpi contro D2-40 podoplanina e CD31 per 2 ore a temperatura ambiente, poi risciacquate e incubate con anticorpi secondari con Alexafluor 488 di capra anti-topo (Invitrogen, diluizione 1:250) e Alexafluor 594 di capra anti coniglio IgG anticorpi (Invitrogen, diluizione 1:250), rispettivamente, per 30 minuti a temperatura ambiente. Dopo il lavaggio, le sezioni sono state montate con DAPI Immuno Mount. Le sezioni macchiate sono state visualizzate e digitalizzate (Axio Observer Z.1, Carl Zeiss Microscopy, NY, USA).
References
- Absinta M, Nair G, Filippi M, Ray-Chaudhury A, Reyes-Mantilla MI, Pardo CA, Reich DS. Postmortem magnetic resonance imaging to guide the pathologic cut: individualized, 3-dimensionally printed cutting boxes for fixed brains. Journal of Neuropathology and Experimental Neurology. 2014; 73:780-788. DOI | PubMed
- Absinta M, Vuolo L, Rao A, Nair G, Sati P, Cortese IC, Ohayon J, Fenton K, Reyes-Mantilla MI, Maric D, Calabresi PA, Butman JA, Pardo CA, Reich DS. Gadolinium-based MRI characterization of leptomeningeal inflammation in multiple sclerosis. Neurology. 2015; 85:18-28. DOI | PubMed
- Alitalo K, Tammela T, Petrova TV. Lymphangiogenesis in development and human disease. Nature. 2005; 438:946-953. DOI | PubMed
- Antony J, Hacking C, Jeffree RL. Pachymeningeal enhancement-a comprehensive review of literature. Neurosurgical Review. 2015; 38:649-659. DOI | PubMed
- Aspelund A, Tammela T, Antila S, Nurmi H, Leppänen VM, Zarkada G, Stanczuk L, Francois M, Mäkinen T, Saharinen P, Immonen I, Alitalo K. The Schlemm’s canal is a VEGF-C/VEGFR-3-responsive lymphatic-like vessel. Journal of Clinical Investigation. 2014; 124:3975-3986. DOI | PubMed
- Aspelund A, Antila S, Proulx ST, Karlsen TV, Karaman S, Detmar M, Wiig H, Alitalo K. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. The Journal of Experimental Medicine. 2015; 212:991-999. DOI | PubMed
- Gaitán MI, Maggi P, Wohler J, Leibovitch E, Sati P, Calandri IL, Merkle H, Massacesi L, Silva AC, Jacobson S, Reich DS. Perivenular brain lesions in a primate multiple sclerosis model at 7-tesla magnetic resonance imaging. Multiple Sclerosis Journal. 2014; 20:64-71. DOI | PubMed
- Guy JR, Sati P, Leibovitch E, Jacobson S, Silva AC, Reich DS. Custom fit 3D-printed brain holders for comparison of histology with MRI in marmosets. Journal of Neuroscience Methods. 2016; 257:55-63. DOI | PubMed
- Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, Benveniste H, Vates GE, Deane R, Goldman SA, Nagelhus EA, Nedergaard M. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Science Translational Medicine. 2012; 4DOI | PubMed
- Iliff JJ, Lee H, Yu M, Feng T, Logan J, Nedergaard M, Benveniste H. Brain-wide pathway for waste clearance captured by contrast-enhanced MRI. Journal of Clinical Investigation. 2013; 123:1299-1309. DOI | PubMed
- Kida S, Pantazis A, Weller RO. CSF drains directly from the subarachnoid space into nasal lymphatics in the rat. Anatomy, histology and immunological significance. Neuropathology and Applied Neurobiology. 1993; 19:480-488. DOI | PubMed
- Kim H, Kataru RP, Koh GY. Regulation and implications of inflammatory lymphangiogenesis. Trends in Immunology. 2012; 33:350-356. DOI | PubMed
- Kipnis J. Multifaceted interactions between adaptive immunity and the central nervous system. Science. 2016; 353:766-771. DOI | PubMed
- Kovacs GG, Lutz MI, Ricken G, Ströbel T, Höftberger R, Preusser M, Regelsberger G, Hönigschnabl S, Reiner A, Fischer P, Budka H, Hainfellner JA. Dura mater is a potential source of Aβ seeds. Acta Neuropathologica. 2016; 131:911-923. DOI | PubMed
- Lauffer RB, Parmelee DJ, Dunham SU, Ouellet HS, Dolan RP, Witte S, McMurry TJ, Walovitch RC. MS-325: albumin-targeted contrast agent for MR angiography. Radiology. 1998; 207:529-538. DOI | PubMed
- Louveau A, Harris TH, Kipnis J. Revisiting the Mechanisms of CNS Immune Privilege. Trends in Immunology. 2015a; 36:569-577. DOI | PubMed
- Louveau A, Smirnov I, Keyes TJ, Eccles JD, Rouhani SJ, Peske JD, Derecki NC, Castle D, Mandell JW, Lee KS, Harris TH, Kipnis J. Structural and functional features of central nervous system lymphatic vessels. Nature. 2015b; 523:337-341. DOI | PubMed
- Lowe KL, Finney BA, Deppermann C, Hägerling R, Gazit SL, Frampton J, Buckley C, Camerer E, Nieswandt B, Kiefer F, Watson SP. Podoplanin and CLEC-2 drive cerebrovascular patterning and integrity during development. Blood. 2015; 125:3769-3777. DOI | PubMed
- Luciano NJ, Sati P, Nair G, Guy JR, Ha SK, Absinta M, Chiang WY, Leibovitch EC, Jacobson S, Silva AC, Reich DS. Utilizing 3D printing technology to merge mri with histology: a protocol for brain sectioning. Journal of Visualized Experiments. 2016; 118DOI | PubMed
- Mamourian AC, Hoopes PJ, Lewis LD. Visualization of intravenously administered contrast material in the CSF on fluid-attenuated inversion-recovery MR images: an in vitro and animal-model investigation. AJNR. American Journal of Neuroradiology. 2000; 21:105-111. PubMed
- Mandell DM, Mossa-Basha M, Qiao Y, Hess CP, Hui F, Matouk C, Johnson MH, Daemen MJ, Vossough A, Edjlali M, Saloner D, Ansari SA, Wasserman BA, Mikulis DJ, Vessel Wall Imaging Study Group of the American Society of Neuroradiology. Intracranial Vessel Wall MRI: Principles and Expert Consensus Recommendations of the American Society of Neuroradiology. American Journal of Neuroradiology. 2017; 38:218-229. DOI | PubMed
- Mascagni P, Bellini GB. Istoria Completa Dei Vasi Linfatici. Presso Eusebio Pacini e Figlio: Florence; 1816.
- Mathews VP, Caldemeyer KS, Lowe MJ, Greenspan SL, Weber DM, Ulmer JL. Brain: gadolinium-enhanced fast fluid-attenuated inversion-recovery MR imaging. Radiology. 1999; 211:257-263. DOI | PubMed
- Ny A, Koch M, Schneider M, Neven E, Tong RT, Maity S, Fischer C, Plaisance S, Lambrechts D, Héligon C, Terclavers S, Ciesiolka M, Kälin R, Man WY, Senn I, Wyns S, Lupu F, Brändli A, Vleminckx K, Collen D, Dewerchin M, Conway EM, Moons L, Jain RK, Carmeliet P. A genetic Xenopus laevis tadpole model to study lymphangiogenesis. Nature Medicine. 2005; 11:998-1004. DOI | PubMed
- Raper D, Louveau A, Kipnis J. How do meningeal lymphatic vessels drain the cns?. Trends in Neurosciences. 2016; 39:581-586. DOI | PubMed
- Richardson OC, Bane O, Scott ML, Tanner SF, Waterton JC, Sourbron SP, Carroll TJ, Buckley DL. Gadofosveset-based biomarker of tissue albumin concentration: technical validation in vitro and feasibility in vivo. Magnetic Resonance in Medicine. 2015; 73:244-253. DOI | PubMed
- Sharma R, Wendt JA, Rasmussen JC, Adams KE, Marshall MV, Sevick-Muraca EM. New horizons for imaging lymphatic function. Annals of the New York Academy of Sciences. 2008; 1131:13-36. DOI | PubMed
- Smirniotopoulos JG, Murphy FM, Rushing EJ, Rees JH, Schroeder JW. Patterns of contrast enhancement in the brain and meninges. RadioGraphics. 2007; 27:525-551. DOI | PubMed
- Srinivasan RS, Dillard ME, Lagutin OV, Lin FJ, Tsai S, Tsai MJ, Samokhvalov IM, Oliver G. Lineage tracing demonstrates the venous origin of the mammalian lymphatic vasculature. Genes & Development. 2007; 21:2422-2432. PubMed
- Stacker SA, Williams SP, Karnezis T, Shayan R, Fox SB, Achen MG. Lymphangiogenesis and lymphatic vessel remodelling in cancer. Nature Reviews Cancer. 2014; 14:159-172. DOI | PubMed
- Weller RO, Djuanda E, Yow HY, Carare RO. Lymphatic drainage of the brain and the pathophysiology of neurological disease. Acta Neuropathologica. 2009; 117:1-14. DOI | PubMed
- Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donnell J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M. Sleep drives metabolite clearance from the adult brain. Science. 2013; 342:373-377. DOI | PubMed
- Yaniv K, Isogai S, Castranova D, Dye L, Hitomi J, Weinstein BM. Live imaging of lymphatic development in the zebrafish. Nature Medicine. 2006; 12:711-716. DOI | PubMed
Fonte
Absinta M, Ha S, Nair G, Sati P, Luciano NJ, et al. () Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife 6e29738. https://doi.org/10.7554/eLife.29738





