Abstract
Introduzione
La sindrome dell’intestino irritabile (SII) è un disturbo intestinale funzionale definito dalla presenza di episodi ricorrenti di dolore addominale associati ad abitudini intestinali alterate. I criteri di Roma IV, recentemente aggiornati, sono ampiamente considerati il gold standard dei criteri basati sui sintomi1 (Figura 1). La SII è uno dei problemi gastrointestinali (IG) più comunemente riscontrati nella pratica clinica; la prevalenza è del 12% nella popolazione generale2. Come misurato da strumenti di indagine convalidati come lo Short Form-36 (SF-36), l’IBS ha un impatto negativo sulla qualità di vita di un paziente colpito3. Infatti, l’IBS riduce la qualità della vita in relazione alla salute (HRQOL) misurata con SF-36 in misura maggiore rispetto al diabete mellito o alla malattia renale allo stadio finale. Inoltre, i pazienti affetti da IBS sono responsabili di un maggiore utilizzo delle risorse e di una minore produttività rispetto alle persone sane. Ogni anno, la SII costa al sistema sanitario statunitense oltre 30 miliardi di dollari4.
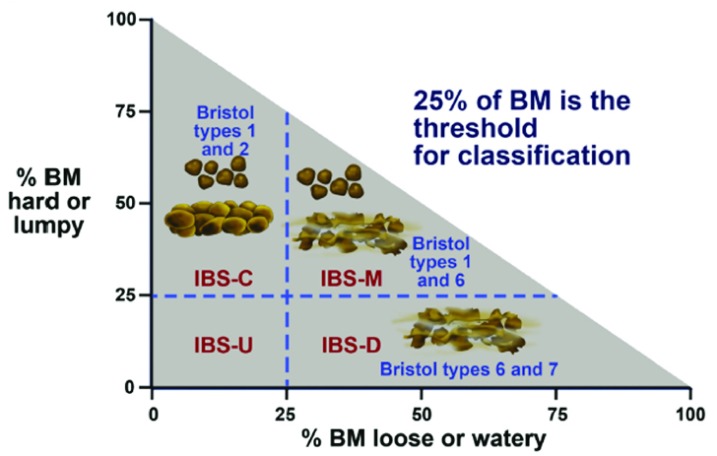
Figura 1.Criteri di Roma IV per la sindrome dell’intestino irritabile.▪ Presenza di dolori addominali almeno 1 giorno alla settimana negli ultimi 6 mesi associati a defecazione o a un cambio di abitudine intestinale.Il dolore addominale deve soddisfare almeno due dei tre criteri:1. Relativo alla defecazione2. Associato ad un cambiamento di frequenza delle feci3. Associato ad un cambiamento di forma (aspetto) dello sgabelloI sottogruppi della sindrome dell’intestino irritabile (IBS) si basano sulla consistenza delle feci misurata dalla Bristol Stool Form Scale:Quelli con feci dure o grumose per più del 25% del tempo hanno la IBS con stitichezza, o IBS-C. Quelli con feci sciolte o acquose per più del 25% del tempo hanno IBS con diarrea, o IBS-D. Quelli con una miscela di sgabelli duri o grumosi e sgabelli sciolti o acquosi hanno IBS con intestino misto, o IBS-M. BM, movimento intestinale. Da1.
La SII è un disturbo della patogenesi eterogenea e del fenotipo clinico. Classicamente, la fisiopatologia per IBS è stato pensato per derivare da interazioni anomale cervello-intestino, ipersensibilità viscerale, alterata motilità intestinale, e fattori di stress psicologici. Tuttavia, prove recenti implicano una serie di altri fattori potenzialmente importanti per la SII, tra cui le alterazioni dell’attivazione immunitaria intestinale, la permeabilità intestinale e il microbioma intestinale. Questo aggiornamento esaminerà brevemente i dati che riguardano il ruolo emergente del microbioma intestinale nella patogenesi della SII e come questo database in rapida espansione potrebbe fornire il substrato per nuove strategie diagnostiche e di trattamento.

Figura 1.Criteri di Roma IV per la sindrome dell’intestino irritabile.▪ Presenza di dolore addominale almeno 1 giorno alla settimana negli ultimi 6 mesi associato a defecazione o a un cambio di abitudine intestinale.Il dolore addominale deve soddisfare almeno due dei tre criteri:1. Relativo alla defecazione2. Associato ad un cambiamento di frequenza delle feci3. Associato ad un cambiamento di forma (aspetto) dello sgabelloI sottogruppi della sindrome dell’intestino irritabile (IBS) si basano sulla consistenza delle feci misurata dalla Bristol Stool Form Scale:Quelli con feci dure o grumose per più del 25% del tempo hanno la IBS con stitichezza, o IBS-C. Quelli con feci sciolte o acquose per più del 25% del tempo hanno IBS con diarrea, o IBS-D. Quelli con una miscela di sgabelli duri o grumosi e sgabelli sciolti o acquosi hanno IBS con intestino misto, o IBS-M. BM, movimento intestinale. Da1.
Il microbioma intestinale
I microrganismi che popolano il tratto gastrointestinale umano sono fino a 100 trilioni e la maggior parte abita l’intestino tenue distale e il colon. Anche se molta attenzione è stata posta sui batteri, è importante ricordare che anche virus, funghi, arcaie ed eucarioti contribuiscono alle comunità che abitano il microambiente del tratto gastrointestinale.5–7. Gli studi hanno dimostrato più di 2.000 specie diverse di batteri da 12 phyla, e il 93,5% delle specie sono da quattro phyla dominanti: Firmicuti, Batteroidi, Proteobatteri e Actinobatteri8,9. Recenti ricerche suggeriscono che fattori ambientali come la dieta, i farmaci e lo stile di vita esercitano una maggiore influenza sul microbioma intestinale rispetto alla genetica. Inoltre, il microbioma intestinale può possedere una maggiore capacità di prevedere il fenotipo clinico e le variabili metaboliche rispetto alla genetica.10.
I batteri sono fondamentali per il normale sviluppo intestinale e la salute. Ad esempio, gli animali privi di germi dimostrano lo svuotamento gastrico ritardato e il transito intestinale, la riduzione del ciclo e della propagazione del complesso motorio migrante e la riduzione dell’espressione del geneGABA eVAP-33 per il sistema nervoso enterico rispetto agli animali allevati in un normale ambiente di laboratorio.11. I batteri contribuiscono anche alla salute dell’ospite, fornendo aminoacidi essenziali, vitamine e acidi grassi a catena corta, oltre a promuovere il normale sviluppo e la funzione del sistema immunitario intestinale.
Microbioma alterato e sindrome dell’intestino irritabile
L’ipotesi prevalente è che uno squilibrio nelle comunità batteriche intestinali, o “disbiosi”, porta all’attivazione del sistema immunitario intestinale e ad una potenziale infiammazione di basso grado.12. Un argomento chiave a sostegno di questa ipotesi è il rischio drammaticamente aumentato di sviluppare la SII dopo una gastroenterite acuta.13. L’aumento del rischio di sviluppare la cosiddetta “post-infezione” IBS è agnostico al tipo di infezione (batteri, virus o parassiti).14. Questo sostiene che una serie di trigger infettivi può attivare il sistema immunitario in un individuo con la giusta combinazione di fattori di suscettibilità. Inoltre, diversi studi hanno dimostrato differenze nella composizione del microbioma intestinale all’interno di un sottoinsieme di pazienti con SII rispetto ai controlli sani.15,16. Un lavoro recente che utilizzava il pirosequenziamento ribosomiale 16S con RNA a bersaglio ribosomiale e l’apprendimento macchina ha trovato una firma microbicrobica intestinale che si identificava con una grave IBS17. Inoltre, la diversità e la stabilità del microbiota intestinale può essere ridotta nei pazienti con SII18,19. Dati recenti suggeriscono che la comunità dei funghi o “micobiomi” è alterata anche nei pazienti affetti da IBS e può essere associata allo sviluppo di ipersensibilità viscerale.20.
Crescita batterica intestinale ridotta e sindrome dell’intestino irritabile
La crescita eccessiva di batteri intestinali piccoli (SIBO) può indurre una vasta gamma di manifestazioni cliniche che vanno dai sintomi GI lievi e vaghi al malassorbimento franco attraverso gli effetti sulla motilità GI21,22, sensazione viscerale23, attivazione del sistema immunitario, digestione e assorbimento dei carboidrati24, metabolismo degli acidi biliari25,26e la permeabilità epiteliale intestinale27,28. Poiché molte di queste anomalie sono state implicate anche nella patogenesi della SIBO, la possibilità di un’associazione tra SIBO e SIBO è abbastanza intuitiva. La mancanza di un gold standard adeguatamente validato per la diagnosi di SIBO rende difficile fornire una stima precisa della prevalenza nei pazienti con SIBO. Gli studi hanno rilevato che i pazienti con IBS hanno una maggiore conta batterica nell’intestino tenue prossimale mediante coltura quantitativa rispetto ai controlli sani. Sappiamo anche che i pazienti con IBS hanno più probabilità dei volontari sani di avere un test dell’alito anomalo per la SIBO29. Ciò che rimane sconosciuto è se la SIBO sia una causa o una conseguenza della IBS – o entrambe le cose. In altre parole, è biologicamente plausibile suggerire che la SIBO possa causare sintomi di SIBO in alcuni, ma che, in altri, alterazioni della motilità, della funzione immunitaria intestinale o della predisposizione microbica allo sviluppo della SIBO. Se questo è vero, non è difficile immaginare come una mano possa alimentare l’altra, portando ad un circolo vizioso (Figura 2). L’efficacia degli antibiotici non assorbibili in un sottoinsieme di pazienti affetti da IBS fornisce un’evidenza indiretta della relazione tra SIBO e IBS. Un’evidenza più diretta e quindi più convincente di questa associazione è fornita da studi recenti che riportano una probabilità significativamente maggiore di risposta clinica agli antibiotici orali nei pazienti con IBS con un aspirato duodenale positivo piuttosto che negativo per la coltura quantitativa o il test dell’alito di lattulosio (16,17; vedere la sezione “Antibiotici” più avanti).
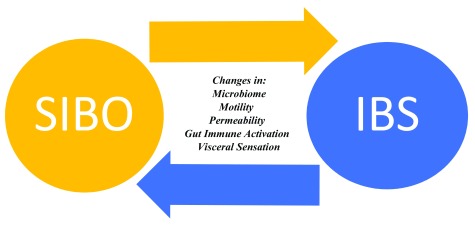
Figura 2.Crescita batterica intestinale piccola: la gallina o l’uovo?IBS, sindrome dell’intestino irritabile; SIBO, proliferazione batterica dell’intestino tenue.

Figura 2.Figura 2. Crescita batterica dell’intestino tenue: la gallina o l’uovo?IBS, sindrome dell’intestino irritabile; SIBO, proliferazione batterica dell’intestino tenue.
Trattamenti a base di microbi per la sindrome dell’intestino irritabile
Prebiotici
I prebiotici sono oligosaccaridi e polisaccaridi non digeribili e polisaccaridi – fruttooligosaccaridi o galattooligosaccaridi (GOS) – che promuovono la crescita o l’attività (o entrambi) dei batteri che conferiscono un beneficio per la salute dell’ospite. I primi lavori hanno dimostrato che alcuni prebiotici selezionati hanno promosso la crescita di bifidobatteri potenzialmente benefici inibendo la crescita di batterioidi, Clostrida o Coliformi potenzialmente dannosi.30. Uno studio di Olesen e Gudmand-Hoyer ha valutato l’effetto dell’inulina ad alto dosaggio (20 g/giorno) rispetto al placebo per 12 settimane in pazienti con IBS31. Il trattamento iniziale con inulina ha peggiorato i sintomi della SII in tutti i pazienti; tuttavia, dopo 12 settimane di trattamento, i sintomi sono migliorati nel 58% del gruppo inulina contro il 65% del gruppo placebo e i sintomi sono peggiorati nell’8% del gruppo inulina contro il 13% del gruppo placebo, suggerendo un certo livello di adattamento nel gruppo inulina. Diversi altri studi che utilizzano diversi prebiotici hanno dimostrato un beneficio rispetto al placebo in pazienti con SII. Paineauetal. ha eseguito uno studio in doppio cieco, controllato con placebo in 105 soggetti affetti da SII con un fructan di tipo inulina a catena corta dosato a 5 g/giorno nel corso di 6 settimane.32. Il trattamento con il prebiotico ha ridotto l’intensità dei sintomi della SII e migliorato la qualità della vita rispetto al placebo. Utilizzando GOS, Silketal. ha assegnato in modo casuale 44 pazienti con IBS in tre gruppi: ricevendo 7 g/giorno GOS, 3,5 g/giorno GOS e 3,5 g/giorno placebo, o 7 g/giorno placebo per 6 settimane33. Il prebiotico ha migliorato significativamente il punteggio del sintomo composito, il gonfiore e la flatulenza e la valutazione globale del soggetto. In quei pazienti che ricevono GOS, la proporzione di bifidobatteri è aumentata nei campioni fecali. In un altro studio, un nuovo dispositivo medico contenente un agente filmogeno reticolato proteico e una miscela prebiotica di oligosaccaridi e polisaccaridi vegetali è stato testato in uno studio multicentrico, randomizzato, controllato con placebo34. I ricercatori hanno trovato una riduzione del dolore addominale (p = 0,017) e della flatulenza (p = 0,037) con un miglioramento della qualità della vita dei pazienti che ricevono il trattamento attivo (p < 0,0001). Pertanto, l’insieme delle prove a sostegno del ruolo dei prebiotici come trattamento per la SII è in crescita. La chiave sarà comprendere la dose e la durata della terapia prebiotica che favorisce gli effetti desiderati sul microbioma e migliora i sintomi della SII senza provocare sintomi significativi.
Probiotici
I probiotici sono microrganismi vivi o attenuati che alterano le comunità microbiche intestinali in un modo che conferisce un beneficio alla salute dell’ospite. Nel caso della SII, i probiotici sono stati suggeriti per ridurre l’ipersensibilità viscerale o per esercitare effetti antinfiammatori35–37. I probiotici sono stati ampiamente studiati nei pazienti affetti da SII con effetti variabili sui sintomi intestinali. La più recente meta-analisi di Fordetal. ha dimostrato l’efficacia nei pazienti affetti da IBS per il miglioramento dei sintomi globali, dolore addominale, gonfiore e flatulenza con un numero necessario per il trattamento (NNT) di sette38. Il rischio relativo per i sintomi persistenti della SII per i probiotici rispetto al placebo era di 0,79 (intervallo di confidenza del 95% [CI] 0,70-0,89). Tuttavia, questa meta-analisi ha notato che le prove disponibili non potevano supportare le raccomandazioni per specifiche specie / ceppi o combinazioni di probiotici per il trattamento della SII.
I pazienti affetti da SII hanno spesso un disagio psicologico co-morboso, come la depressione o l’ansia. Studi recenti suggeriscono che la SII e la depressione condividono anomalie in patofisiologia, tra cui disbiosi, alterata permeabilità intestinale e attivazione immunitaria intestinale.39. Una serie di studi hanno riportato effetti benefici dei probiotici sui sintomi psicologici in individui sani40. Un recente studio randomizzato controllato ha scoperto che un “psicobiotico” contenenteBifidobacteriumlongum per 6 settimane ha migliorato la depressione ma non l’ansia o i sintomi gastrointestinali nei pazienti con SII in misura maggiore rispetto al placebo.41. Miglioramenti nella depressione sono stati associati a cambiamenti nel modello di attivazione cerebrale da risonanza magnetica funzionale nel gruppo “psicobiotico”.
Sono necessarie ulteriori ricerche per stabilire i probiotici ottimali a singolo e multiplo ceppo per l’IBS. È quasi certo che le caratteristiche dell’ospite influenzeranno la probabilità che un determinato probiotico vada a beneficio di un determinato paziente affetto da IBS. La comprensione e lo sfruttamento di tali predittori di risposta saranno fondamentali per ottimizzare i benefici dei probiotici per i pazienti con IBS.
I fornitori e i pazienti devono essere consapevoli del fatto che, a seconda delle affermazioni di un produttore, i probiotici possono essere regolamentati negli Stati Uniti come alimento, integratore alimentare, alimento medico o farmaco. Ciò ha implicazioni per quanto riguarda la purezza e la probabilità che il prodotto contenga organismi vitali al momento dell’acquisto. Ad esempio, gli integratori alimentari non sono necessari per dimostrare la sicurezza o l’efficacia e non è necessaria l’approvazione della Food and Drug Administration (FDA) statunitense prima dell’introduzione sul mercato. D’altra parte, gli alimenti e i farmaci medici richiedono un livello più elevato di prove per ottenere l’approvazione regolamentare da parte della FDA.
Antibiotici
Il concetto di Yin e Yang sembra applicarsi al ruolo degli antibiotici nella SII. Da un lato, gli antibiotici ad ampio spettro hanno dimostrato di avere un impatto negativo sul microbiota intestinale riducendo la diversità e batteri potenzialmente benefici42,43. Inoltre, esiste un’associazione tra l’uso precedente di macrolidi (p = 0,036) e tetraciclina (p < 0,025) entro 12 mesi e una nuova diagnosi di IBS44.
D’altra parte, vi è un solido corpo di prove che suggeriscono che gli antibiotici non assorbibili portano a un significativo miglioramento dei sintomi in un sottoinsieme di pazienti affetti da SII. In una meta-analisi di cinque studi e 1.803 partecipanti, Meneesetal. ha dimostrato che la rifaximina è stata più efficace del placebo per il miglioramento globale dei sintomi della SII (odds ratio [OR] = 1,57, 95% CI = 1,22-2,01, guadagno terapeutico = 9,8%, NNT = 10,2) e gonfiore (OR = 1,55, 95% CI = 1,23-1,96, guadagno terapeutico = 9,9%, NNT = 10,1).45. Lo studio Target 3, pubblicato più di recente, ha riportato che il 44% di 2.438 pazienti affetti da IBS-diarrea (IBS-D) trattati con rifaximina a marchio aperto (550 mg tre volte al giorno per 14 giorni) ha registrato un significativo miglioramento dei sintomi della SII. Di quei pazienti che hanno risposto alla rifaximina, quasi il 60% ha sviluppato sintomi ricorrenti di SII nell’arco di 18 settimane. In quei pazienti che si sono ripresentati, il ritrattamento con rifaximina (possibili due cicli di trattamento) ha portato a una proporzione significativamente maggiore di rispondenti rispetto al placebo46,47. Nel complesso, il profilo degli eventi avversi a breve termine con rifaximina è simile a quello del placebo, e le analisi delle feci dello studio Target 3 dimostrano una depressione a breve termine della diversità e della ricchezza.48 attraverso una vasta gamma di microbi che è stata in gran parte invertita alla fine dello studio.
Gli studi randomizzati ci insegnano che un corso empirico di rifaximina porterà a un miglioramento in meno della metà dei pazienti affetti da IBS-D con un NNT di 10. Inoltre, la maggior parte degli intervistati ricorrerà entro una mediana di 10 settimane, rendendo necessari ripetuti cicli ripetuti di rifaximina46. Infine, la copertura assicurativa variabile e l’elevato costo di acquisizione creano ulteriori barriere all’uso della rifaximina. Date queste problematiche, un biomarcatore che potrebbe arricchire in modo significativo la probabilità di risposta dei pazienti affetti da IBS-D alla rifaximina sarebbe il benvenuto32. Studi recenti suggeriscono che l’identificazione di pazienti affetti da IBS con contaminazione batterica dell’intestino tenue, attraverso l’aspirazione di colture quantitative o il test dell’alito di lattulosio, può aumentare sostanzialmente la probabilità di risposta agli antibiotici per via orale.49–51. Anche se questi studi dovrebbero essere considerati preliminari e generare ipotesi, essi forniscono la prova che almeno una parte dei benefici degli antibiotici per via orale deriva da effetti nell’intestino tenue.
Dieta
C’è stato un aumento di interesse negli interventi dietetici per ridurre i sintomi della SII. Anche se i benefici sono stati attribuiti in gran parte alla riduzione della fermentazione del colon o alla diminuzione dell’attivazione dell’antigene del sistema immunitario intestinale, è importante considerare che la dieta ha un impatto significativo sulla composizione del microbioma intestinale.52–54. Ad esempio, la riduzione dell’assunzione di alimenti ad alto contenuto di oligosaccaridi fermentabili, disaccaridi, monosaccaridi e polioli (FODMAP) riduce i sintomi GI e migliora la qualità di vita specifica della malattia nei pazienti con SII55–58. Una recente revisione della terapia dietetica low-FODMAP suggerisce che almeno il 50% dei pazienti con SII riporta un beneficio sintomatico59.
I meccanismi con cui la dieta low-FODMAP migliora i sintomi della SII sono probabilmente molteplici; tuttavia, ci sono prove che le alterazioni del microbioma intestinale possono giocare un ruolo. Zhouetal. ha dimostrato che i ratti alimentati FODMAPs sviluppato cambiamenti nel microbiota intestinale, la permeabilità intestinale, ei livelli di lipopolisaccaridi fecali che sono stati associati con lo sviluppo di ipersensibilità viscerale. Queste anomalie sono state invertite da una dieta a basso contenuto di FODMAP60. D’altra parte, alcuni ricercatori hanno espresso preoccupazioni circa l’impatto della dieta a basso contenuto di DODMAP sul microbioma intestinale. Recenti studi hanno dimostrato la riduzione dei livelli di bifidobatteri fecali e butirrato potenzialmente benefici nei pazienti affetti da SII con una dieta a basso contenuto di DODMAP.61. Chiaramente, sono necessari ulteriori studi che valutino l’impatto a lungo termine di una dieta a basso contenuto di FODMAP sul microbioma intestinale nei pazienti affetti da SII. Nel frattempo, è fondamentale che i fornitori che raccomandano una dieta a basso contenuto di DODMAP ricordino che l’eliminazione è il primo di un piano di dieta in tre fasi. La fase di eliminazione del piano dietetico deve essere considerata come un test diagnostico per identificare i pazienti sensibili ai FODMAP. Coloro che rispondono ad una prova di 2-6 settimane di esclusione FODMAP dovrebbero essere istruiti a reintrodurre alimenti contenenti FODMAP individuali per determinare la loro sensibilità e consentire la diversificazione della loro dieta nella speranza di migliorare l’aderenza e ridurre al minimo gli effetti sul microbioma. Studi recenti suggeriscono che la somministrazione contemporanea di probiotici può ridurre gli effetti sui livelli di bifidobatteri fecali38 e che l’uso di integratori di α-galattosidasi può permettere ad alcuni pazienti con IBS di tollerare il GOS62.
Trapianto microbico fecale
Il successo di ristabilire l’omeostasi intestinale con il trapianto microbico fecale (FMT) nell’infezione ricorrente da Clostridiumdifficile ha ispirato gli investigatori interessati alla SII. Il primo studio monocentrico a marchio aperto ha coinvolto 13 pazienti affetti da IBS secondo i criteri di Roma III che sono stati sottoposti a esofagogastroduodenoscopia (EGD) per avere 50-100 ml di feci di donatori infuse nel duodeno distale o nel digiuno prossimale.63. Un totale del 70% dei partecipanti ha riferito la risoluzione o il miglioramento dei sintomi con un evento avverso di flatus aumentato in modo transitorio. Holvoetetal. ha eseguito uno studio FMT monocentrico a marchio aperto (via sconosciuta) in 12 pazienti con SII refrattaria (criteri di Roma III) con diarrea intermittente e grave gonfiore64. Un totale del 75% ha ottenuto un adeguato sollievo dai sintomi della SII a livello globale, e il 78% degli intervistati ha continuato a segnalare un sollievo significativo a 1 anno. L’analisi microbica fecale ha dimostrato una tendenza verso una maggiore conta di streptococco al basale nei donatori rispetto ai pazienti (p = 0,011). C’è stata anche una tendenza verso una maggiore conta basale di streptococco nei donatori di successo rispetto ai donatori non riusciti e un maggiore arricchimento microbicota negli intervistati. Nell’ultimo studio open-label single-center, Mizunoetal. ha arruolato 10 pazienti affetti da SII (criteri di Roma III) che sono stati sottoposti a FMT tramite colonscopia65. Il punto finale primario è stato un cambiamento nella scala della forma delle feci di Bristol, e una risposta clinica è stata definita come normalizzazione ai tipi 3 o 4. Un totale del 60% dei partecipanti ha sperimentato una risposta clinica, e i campioni fecali dei rispondenti hanno mostrato una maggiore diversità microbica. È interessante notare che gli autori hanno trovato che l’abbondanza diBifidobacterium dei donatori era correlata all’efficacia terapeutica dell’FMT, ma un simile aumento del partecipanteBifidobacterium non era correlato al successo dell’FMT. Più recentemente, Johnsenetal. ha completato il primo studio in doppio cieco, randomizzato, controllato con placebo, in un solo centro, in partecipanti IBS-D o IBS-M (criteri di Roma III) da moderati a gravi (n = 83).66. Il punto finale primario è stato il sollievo dai sintomi di oltre 75 punti valutati dal sistema di valutazione della gravità IBS 3 mesi dopo l’FMT. Con feci di donatori freschi o congelati per il trattamento attivo o feci del partecipante per il placebo, l’FMT è stato somministrato tramite colonscopia. Un totale del 65% dei partecipanti che ricevevano un trattamento attivo contro il 43% che riceveva il placebo ha dimostrato una risposta a 3 mesi (p = 0,049); 12 mesi dopo l’FMT, il 56% dei partecipanti che ricevevano un trattamento attivo contro il 36% dei 28 che ricevevano il placebo ha avuto una risposta durevole (p = 0,075). Non sono stati attribuiti all’FMT eventi avversi gravi. Tuttavia, non era disponibile un’analisi di valutazione dei microbioti per questo studio. Più recentemente, alla Settimana delle Malattie Digestive 2018 sono stati presentati i risultati preliminari di 3 ulteriori studi randomizzati e controllati. Uno studio condotto in un unico centro dal Belgio su 64 pazienti affetti da SII con gonfiore significativo ha riportato un beneficio statisticamente significativo della somministrazione di feci da parte del nasojejunal da parte del donatore rispetto alle feci del paziente stesso per l’esito primario di un adeguato sollievo della SII e dei sintomi del gonfiore a 12 settimane (49% vs. 29%, p=0,004).67. Sfortunatamente, altri 2 studi randomizzati e controllati hanno riportato risultati negativi68,69. Uno studio multicentrico condotto negli Stati Uniti che ha confrontato l’ingestione orale di feci incapsulate da donatori sani o placebo in pazienti affetti da IBS-D non ha riscontrato alcuna differenza nel tasso di risposta clinica tra i gruppi alla 12a settimana (FMT 48% vs. placebo 63%, p=0,32)68. Uno studio finale su 52 pazienti affetti da SII provenienti dalla Danimarca non ha riportato alcun beneficio statisticamente significativo nei sintomi della SII da feci di donatori incapsulate, somministrate per via orale contro placebo a 12 settimane.69. Pertanto, l’efficacia dell’FMT per l’IBS rimane da stabilire chiaramente. Molte questioni, tra cui il meccanismo d’azione, la corretta selezione dei donatori, la via di somministrazione, la durata della risposta e la sicurezza a breve e lungo termine, richiedono ulteriori studi prima che l’FMT possa essere considerato un trattamento tradizionale per la SII.
Conclusioni
Un lavoro recente ha evidenziato il ruolo del microbioma intestinale nella normale maturazione e nel funzionamento del tratto gastrointestinale. Vi è un numero crescente di prove a sostegno dell’ipotesi che gli squilibri nelle comunità microbiche (disbiosi) abbiano un ruolo nella fisiopatologia di un sottogruppo di persone affette da IBS. Un numero crescente di interventi per la SII che colpiscono il microbioma intestinale, tra cui prebiotici, probiotici, antibiotici non assorbibili, dieta e FMT, sono in fase di valutazione in studi clinici. Non diversamente dalle terapie farmacologiche tradizionali, i trattamenti mirati al microbioma hanno mostrato benefici modesti ma statisticamente significativi per i sintomi della SII rispetto al placebo. Alcuni hanno suggerito che i risultati riflettono un’intrinseca mancanza di efficacia dei trattamenti. Tuttavia, un altro modo di vedere i risultati è che la SII è un disturbo basato sui sintomi di una fisiopatologia eterogenea. Pertanto, la SII rappresenta probabilmente una serie di malattie diverse che si presentano con gli stessi sintomi. In questo caso, i singoli trattamenti, che si rivolgono a percorsi o meccanismi specifici, dovrebbero migliorare i sintomi solo in un sottoinsieme di persone affette da SII. D’ora in poi, sarà fondamentale identificare i biomarcatori che possono essere aggiunti ai sintomi quando si diagnostica e si sceglie il trattamento per i pazienti affetti da SII. Ciò consentirà di sottogruppare i pazienti sulla base della fisiopatologia piuttosto che dei soli sintomi e permetterà una maggiore probabilità di scegliere la terapia giusta per il paziente giusto. Il microbioma fornisce forse l’obiettivo più promettente per una tale strategia diagnostica e terapeutica basata su biomarcatori. Recenti studi randomizzati controllati hanno scoperto che le caratteristiche del microbioma intestinale di base hanno identificato i pazienti affetti da IBS che hanno maggiori probabilità di rispondere alla dieta a basso contenuto di FODMAP70. Altri hanno riportato risultati promettenti che riguardano il metabolismo o la misurazione dei composti organici volatili delle feci, che potrebbero essere sfruttati per sviluppare una diagnostica che identifichi i pazienti affetti da SII in cui i trattamenti dietetici specifici potrebbero essere più vantaggiosi.71,72. Una chiave per decifrare ciò che è anormale sarà capire meglio ciò che costituisce un microbioma “sano”. La maggior parte dei profili di disbiosi pubblicati si basano sull’analisi non supervisionata del sequenziamento 16S, spesso con scarsa separazione tra i gruppi. Trovare soluzioni clinicamente impattanti richiederà un’analisi funzionale meticolosa e multidisciplinare del microbioma utilizzando lo stato dell’arte delle analisi metagenomiche, trascrittomiche, proteomiche e metabolomiche. Questo lavoro fondamentale sarebbe rilevante non solo per la ricerca sulla SII, ma anche per una vasta gamma di altre aree, tra cui la sindrome metabolica, le malattie del fegato e le malattie infiammatorie intestinali, per citarne alcune.
Abbreviazioni
CI, intervallo di confidenza; FDA, US Food and Drug Administration; FMT, trapianto microbico fecale; FODMAP, oligosaccaridi fermentabili, disaccaridi e monosaccaridi e polioli; GI, gastrointestinale; GOS, galattooligosaccaridi; IBS, sindrome dell’intestino irritabile; IBS-D, sindrome dell’intestino irritabile – diarrea; NNT, numero necessario per il trattamento; OR, rapporto di probabilità; SF-36, forma breve-36; SIBO, proliferazione batterica intestinale piccola.
References
- Mearin F, Lacy BE, Chang L. Bowel Disorders.. Gastroenterology.. 2016; 150(6):1393-1407.e5. DOI | PubMed
- Lovell RM, Ford AC. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis.. Clin Gastroenterol Hepatol.. 2012; 10(7):712-721.e4. DOI | PubMed
- Gralnek IM, Hays RD, Kilbourne A. The impact of irritable bowel syndrome on health-related quality of life.. Gastroenterology.. 2000; 119(3):654-60. DOI | PubMed
- Lembo AJ. The Clinical and Economic Burden of Irritable Bowel Syndrome.. Pract Gastroenterol.. 2007; 31:3-9.
- Turnbaugh PJ, Ley RE, Hamady M. The human microbiome project.. Nature.. 2007; 449(7164):804-10. DOI | PubMed
- Marchesi JR. Prokaryotic and eukaryotic diversity of the human gut.. Adv Appl Microbiol.. 2010; 72:43-62. DOI | PubMed
- Breitbart M, Haynes M, Kelley S. Viral diversity and dynamics in an infant gut.. Res Microbiol.. 2008; 159(5):367-73. DOI | PubMed
- Hugon P, Dufour JC, Colson P. A comprehensive repertoire of prokaryotic species identified in human beings.. Lancet Infect Dis.. 2015; 15(10):1211-9. DOI | PubMed
- Li J, Jia H, Cai X. An integrated catalog of reference genes in the human gut microbiome.. Nat Biotechnol.. 2014; 32(8):834-41. DOI | PubMed
- Rothschild D, Weissbrod O, Barkan E. Environment dominates over host genetics in shaping human gut microbiota.. Nature.. 2018; 555(7695):210-5. Publisher Full Text | DOI | PubMed
- Barbara G, Feinle-Bisset C, Ghoshal UC. The Intestinal Microenvironment and Functional Gastrointestinal Disorders.. Gastroenterology.. 2016; 150(6):1305-1318.e8. Publisher Full Text | DOI | PubMed
- Ohman L, Simrén M. Pathogenesis of IBS: role of inflammation, immunity and neuroimmune interactions.. Nat Rev Gastroenterol Hepatol.. 2010; 7(3):163-73. DOI | PubMed
- Halvorson HA, Schlett CD, Riddle MS. Postinfectious irritable bowel syndrome–a meta-analysis.. Am J Gastroenterol.. 2006; 101(8):1894-9. DOI | PubMed
- Klem F, Wadhwa A, Prokop LJ. Prevalence, Risk Factors, and Outcomes of Irritable Bowel Syndrome After Infectious Enteritis: A Systematic Review and Meta-analysis.. Gastroenterology.. 2017; 152(5):1042-1054.e1. Publisher Full Text | DOI | PubMed
- Labus JS, Hollister EB, Jacobs J. Differences in gut microbial composition correlate with regional brain volumes in irritable bowel syndrome.. Microbiome.. 2017; 5(1):49. Publisher Full Text | DOI | PubMed
- Jeffery IB, O’Toole PW, Öhman L. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota.. Gut.. 2012; 61(7):997-1006. Publisher Full Text | DOI | PubMed
- Tap J, Derrien M, Törnblom H. Identification of an Intestinal Microbiota Signature Associated With Severity of Irritable Bowel Syndrome.. Gastroenterology.. 2017; 152(1):111-123.e8. Publisher Full Text | DOI | PubMed
- Carroll IM, Ringel-Kulka T, Keku TO. Molecular analysis of the luminal- and mucosal-associated intestinal microbiota in diarrhea-predominant irritable bowel syndrome.. Am J Physiol Gastrointest Liver Physiol.. 2011; 301(5):G799-807. DOI | PubMed
- Carroll IM, Ringel-Kulka T, Siddle JP. Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome.. Neurogastroenterol Motil.. 2012; 24(6):521-30, e248. DOI | PubMed
- Botschuijver S, Roeselers G, Levin E. Intestinal Fungal Dysbiosis Is Associated With Visceral Hypersensitivity in Patients With Irritable Bowel Syndrome and Rats.. Gastroenterology.. 2017; 153(4):1026-39. Publisher Full Text | DOI | PubMed
- Justus PG, Fernandez A, Martin JL. Altered myoelectric activity in the experimental blind loop syndrome.. J Clin Invest.. 1983; 72(3):1064-71. DOI | PubMed
- Vantrappen G, Janssens J, Hellemans J. The interdigestive motor complex of normal subjects and patients with bacterial overgrowth of the small intestine.. J Clin Invest.. 1977; 59(6):1158-66. DOI | PubMed
- Coelho AM, Fioramonti J, Buéno L. Systemic lipopolysaccharide influences rectal sensitivity in rats: role of mast cells, cytokines, and vagus nerve.. Am J Physiol Gastrointest Liver Physiol.. 2000; 279(4):G781-90. DOI | PubMed
- Giannella RA, Rout WR, Toskes PP. Jejunal brush border injury and impaired sugar and amino acid uptake in the blind loop syndrome.. Gastroenterology.. 1974; 67(5):965-74. PubMed
- Hofmann AF, Poley JR. Role of bile acid malabsorption in pathogenesis of diarrhea and steatorrhea in patients with ileal resection. I. Response to cholestyramine or replacement of dietary long chain triglyceride by medium chain triglyceride.. Gastroenterology.. 1972; 62(5):918-34. PubMed
- Hajjar JJ, Khuri RN, Bikhazi AB. Effect of bile salts on amino acid transport by rabbit intestine.. Am J Physiol.. 1975; 229(2):518-23. DOI | PubMed
- Deitch EA, Specian RD, Berg RD. Endotoxin-induced bacterial translocation and mucosal permeability: role of xanthine oxidase, complement activation, and macrophage products.. Crit Care Med.. 1991; 19(6):785-91. PubMed
- Riordan SM, McIver CJ, Thomas DH. Luminal bacteria and small-intestinal permeability.. Scand J Gastroenterol.. 1997; 32(6):556-63. DOI | PubMed
- Ghoshal UC, Shukla R, Ghoshal U. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome: A Bridge between Functional Organic Dichotomy.. Gut Liver.. 2017; 11(2):196-208. Publisher Full Text | DOI | PubMed
- Wang X, Gibson GR. Effects of the
in vitro fermentation of oligofructose and inulin by bacteria growing in the human large intestine.. J Appl Bacteriol.. 1993; 75(4):373-80. DOI | PubMed - Olesen M, Gudmand-Hoyer E. Efficacy, safety, and tolerability of fructooligosaccharides in the treatment of irritable bowel syndrome.. Am J Clin Nutr.. 2000; 72(6):1570-5. DOI | PubMed
- Paineau D, Payen F, Panserieu S. The effects of regular consumption of short-chain fructo-oligosaccharides on digestive comfort of subjects with minor functional bowel disorders.. Br J Nutr.. 2008; 99(2):311-8. DOI | PubMed
- Silk DB, Davis A, Vulevic J. Clinical trial: the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome.. Aliment Pharmacol Ther.. 2009; 29(5):508-18. Publisher Full Text | DOI | PubMed
- Alexea O, Bacarea V, Piqué N. The combination of oligo- and polysaccharides and reticulated protein for the control of symptoms in patients with irritable bowel syndrome: Results of a randomised, placebo-controlled, double-blind, parallel group, multicentre clinical trial.. United European Gastroenterol J.. 2016; 4(3):455-65. Publisher Full Text | DOI | PubMed
- O’Mahony L, McCarthy J, Kelly P. Lactobacillus and
bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles.. Gastroenterology.. 2005; 128(3):541-51. Publisher Full Text | DOI | PubMed - Verdú EF, Bercik P, Verma-Gandhu M. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice.. Gut.. 2006; 55(2):182-90. DOI | PubMed
- Kamiya T, Wang L, Forsythe P. Inhibitory effects of
Lactobacillus reuteri on visceral pain induced by colorectal distension in Sprague-Dawley rats.. Gut.. 2006; 55(2):191-6. DOI | PubMed - Ford AC, Quigley EM, Lacy BE. Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: systematic review and meta-analysis.. Am J Gastroenterol.. 2014; 109(10):1547-61. DOI | PubMed
- Dinan TG, Cryan JF. The Microbiome-Gut-Brain Axis in Health and Disease.. Gastroenterol Clin North Am.. 2017; 46(1):77-89. Publisher Full Text | DOI | PubMed
- McKean J, Naug H, Nikbakht E. Probiotics and Subclinical Psychological Symptoms in Healthy Participants: A Systematic Review and Meta-Analysis.. J Altern Complement Med.. 2017; 23(4):249-58. Publisher Full Text | DOI | PubMed
- Pinto-Sanchez MI, Hall GB, Ghajar K. Probiotic
Bifidobacterium longum NCC3001 Reduces Depression Scores and Alters Brain Activity: A Pilot Study in Patients With Irritable Bowel Syndrome.. Gastroenterology.. 2017; 153(2):448-459.e8. Publisher Full Text | DOI | PubMed - Dethlefsen L, Huse S, Sogin ML. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing.. PLoS Biol.. 2008; 6(11):e280. Publisher Full Text | DOI | PubMed
- Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation.. Proc Natl Acad Sci U S A.. 2011; 108 Suppl 1:4554-61. DOI | PubMed
- Villarreal AA, Aberger FJ, Benrud R. Use of broad-spectrum antibiotics and the development of irritable bowel syndrome.. WMJ.. 2012; 111(1):17-20. PubMed
- Menees SB, Maneerattannaporn M, Kim HM. The efficacy and safety of rifaximin for the irritable bowel syndrome: a systematic review and meta-analysis.. Am J Gastroenterol.. 2012; 107(1):28-35; quiz 36. DOI | PubMed
- Lembo A, Pimentel M, Rao SS. Repeat Treatment With Rifaximin Is Safe and Effective in Patients With Diarrhea-Predominant Irritable Bowel Syndrome.. Gastroenterology.. 2016; 151(6):1113-21. DOI | PubMed
- Schoenfeld P, Pimentel M, Chang L. Safety and tolerability of rifaximin for the treatment of irritable bowel syndrome without constipation: a pooled analysis of randomised, double-blind, placebo-controlled trials.. Aliment Pharmacol Ther.. 2014; 39(10):1161-8. DOI | PubMed
- Fodor AA, Pimentel M, Chey WD. Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome.. Gut Microbes.. 2018;1-28. DOI | PubMed
- Gupta A, Chey WD. Breath Testing for Small Intestinal Bacterial Overgrowth: A Means to Enrich Rifaximin Responders in IBS Patients?. Am J Gastroenterol.. 2016; 111(3):305-6. DOI | PubMed
- Ghoshal UC, Srivastava D, Misra A. A proof-of-concept study showing antibiotics to be more effective in irritable bowel syndrome with than without small-intestinal bacterial overgrowth: a randomized, double-blind, placebo-controlled trial.. Eur J Gastroenterol Hepatol.. 2016; 28(3):281-9. Publisher Full Text | DOI | PubMed
- Rezaie A. Lactulose Breath Testing Predicts the Response to Rifaximin.. Am J Gastroenterol.. 2017; 112(S1):S227.
- David LA, Maurice CF, Carmody RN. Diet rapidly and reproducibly alters the human gut microbiome.. Nature.. 2014; 505(7484):559-63. Publisher Full Text | DOI | PubMed
- Muegge BD, Kuczynski J, Knights D. Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans.. Science.. 2011; 332(6032):970-4. Publisher Full Text | DOI | PubMed
- Singh RK, Chang HW, Yan D. Influence of diet on the gut microbiome and implications for human health.. J Transl Med.. 2017; 15(1):73. Publisher Full Text | DOI | PubMed
- Austin GL, Dalton CB, Hu Y. A very low-carbohydrate diet improves symptoms and quality of life in diarrhea-predominant irritable bowel syndrome.. Clin Gastroenterol Hepatol.. 2009; 7(6):706-708.e1. Publisher Full Text | DOI | PubMed
- Shepherd SJ, Parker FC, Muir JG. Dietary triggers of abdominal symptoms in patients with irritable bowel syndrome: randomized placebo-controlled evidence.. Clin Gastroenterol Hepatol.. 2008; 6(7):765-71. DOI | PubMed
- Shepherd SJ, Gibson PR. Fructose malabsorption and symptoms of irritable bowel syndrome: guidelines for effective dietary management.. J Am Diet Assoc.. 2006; 106(10):1631-9. DOI | PubMed
- Staudacher HM, Whelan K, Irving PM. Comparison of symptom response following advice for a diet low in fermentable carbohydrates (FODMAPs) versus standard dietary advice in patients with irritable bowel syndrome.. J Hum Nutr Diet.. 2011; 24(5):487-95. DOI | PubMed
- Staudacher HM, Whelan K. The low FODMAP diet: recent advances in understanding its mechanisms and efficacy in IBS.. Gut.. 2017; 66(8):1517-27. Publisher Full Text | DOI | PubMed
- Zhou S, Eswaran SL, Wu X. Low FODMAP diet modulates visceral nociception by changing gut microbiota and intestinal permeability in IBS.. Gastroenterology.. 2016; 150(4):S63-S64. DOI
- Halmos EP, Christophersen CT, Bird AR. Diets that differ in their FODMAP content alter the colonic luminal microenvironment.. Gut.. 2015; 64(1):93-100. Publisher Full Text | DOI | PubMed
- Tuck CJ, Taylor KM, Gibson PR. Increasing Symptoms in Irritable Bowel Symptoms With Ingestion of Galacto-Oligosaccharides Are Mitigated by α-Galactosidase Treatment.. Am J Gastroenterol.. 2018; 113(1):124-34. Publisher Full Text | DOI | PubMed
- Pinn DM, Aroniadis OC, Brandt LJ. Is fecal microbiota transplantation the answer for irritable bowel syndrome? A single-center experience.. Am J Gastroenterol.. 2014; 109(11):1831-2. DOI | PubMed
- Holvoet T, Joossens M, Wang J. Assessment of faecal microbial transfer in irritable bowel syndrome with severe bloating.. Gut.. 2017; 66(5):980-2. Publisher Full Text | DOI | PubMed
- Mizuno S, Masaoka T, Naganuma M. Bifidobacterium-Rich Fecal Donor May Be a Positive Predictor for Successful Fecal Microbiota Transplantation in Patients with Irritable Bowel Syndrome.. Digestion.. 2017; 96(1):29-38. Publisher Full Text | DOI | PubMed
- Johnsen PH, Hilpüsch F, Cavanagh JP. Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial.. Lancet Gastroenterol Hepatol.. 2018; 3(1):17-24. Publisher Full Text | DOI | PubMed
- Holvoet T, Joossens M, Boelens J. 617 – Fecal Microbiota Transplantation in Irritable Bowel Syndrome with Predominant Abdominal Bloating: Results from a Double Blind, Placebo-Controlled Clinical Trial.. Gastroenterology.. 2018; 154(6 Supplement 1):S-130. DOI
- Aroniadis OC, Brandt LJ, Oneto C. 742 – A Double-Blind, Randomized, Placebo-Controlled Trial of Fecal Microbiota Transplantation Capsules (FMTC) for the Treatment of Diarrhea-Predominant Irritable Bowel Syndrome (IBS-D).. Gastroenterology.. 2018; 154(6 Supplement 1):S-154-S-155. DOI
- Halkjaer S, Christiensen A, Lo B. 914 – Fecal Microbiota Transplantation Alters Gut Microbiota in Patients with Irritable Bowel Syndrome: Results from a Randomized, Double-Blind Placebo Controlled Study.. Gastroenterology.. 2018; 154(6 Supplement 1):S-181. DOI
- Chumpitazi BP, Cope JL, Hollister EB. Randomised clinical trial: gut microbiome biomarkers are associated with clinical response to a low FODMAP diet in children with the irritable bowel syndrome.. Aliment Pharmacol Ther.. 2015; 42(4):418-27. Publisher Full Text | DOI | PubMed
- McIntosh K, Reed DE, Schneider T. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial.. Gut.. 2017; 66(7):1241-51. Publisher Full Text | DOI | PubMed
- Rossi M, Aggio R, Staudacher HM. Volatile Organic Compounds in Feces Associate With Response to Dietary Intervention in Patients With Irritable Bowel Syndrome.. Clin Gastroenterol Hepatol.. 2018; 16(3):385-391.e1. Publisher Full Text | DOI | PubMed
Fonte
Menees S, Chey W (2018) The gut microbiome and irritable bowel syndrome. F1000Research 7F1000 Faculty Rev-1029. https://doi.org/10.12688/f1000research.14592.1





