Introduzione
I livelli di ossigeno nei tessuti sono mantenuti entro un intervallo ristretto e vitale attraverso le azioni coordinate del flusso di ossigeno attraverso la respirazione, il carico e scarico dei globuli rossi e la circolazione attraverso il pompaggio del cuore. Questa omeostasi cardiorespiratoria vitale è servita dall’interazione di circuiti neurali che devono funzionare in modo affidabile per tutta la durata della vita ex utero di un organismo. Durante i primi anni di vita neonatale, i mammiferi sono particolarmente vulnerabili ai danni omeostatici, data la loro riserva di ossigeno relativamente più bassa a causa del volume polmonare più piccolo e la diminuzione più rapida dei livelli di ossigeno nel sangue durante le condizioni di ipossia a causa della cinetica ripida desaturazione dell’ossiemoglobina fetale ancora in carica(Fewell, 2005). Paradossalmente, i giovani mammiferi, compresi i neonati umani, subiscono interruzioni più frequenti della respirazione, chiamate apnee, che sono tipicamente associate a rallentamento della frequenza cardiaca, bradicardie(Daily et al., 1969; Fewell et al., 2005; Kelly et al., 1985; Southall et al., 1980). Allo stesso tempo, i mammiferi neonatali hanno una risposta omeostatica particolarmente robusta e protettiva – chiamata auto-rianimazione – che utilizza il respiro affannoso dopo un’apnea per aumentare i livelli di ossigeno nel sangue per facilitare il ripristino della frequenza cardiaca e della respirazione eufneica (Gershan et al.,1992; Guntheroth e Kawabori, 1975; Jacobi et al., 1991; Saiki et al., 2001). Qui presentiamo i progressi nel delineare gli aspetti della neurobiologia di base, interrogando l’importanza neonatale per i neuroni del lignaggio Pet1, in gran parte serotoninergici (5-idrossitriptamina, 5-HT produzione di 5-HT), nella risposta di recupero dell’apnea.
La trasmissione serotoninergica è stata implicata nella risposta di auto-rianimazione nei roditori(Barrett et al., 2016; Cummings et al., 2011a; Erickson e Sposato, 2009; Sridhar et al., 2003) e nella modulazione cardiorespiratoria negli esseri umani e nei roditori, compresa la sindrome della morte infantile improvvisa (SIDS)(Duncan et al., 2010; Feldman et al., 2003; Hodges e Richerson, 2010; Kinney e Thach, 2009; Peña e Ramirez, 2002; Ptak et al., 2009; Ray et al., 2011 ). Nei topi, la disabilitazione cronica della neurotrasmissione vescicolare da neuroni 5-HT (“silenziarli”) a partire dalla metà dell’embriogenesi risulta in cuccioli con ridotta capacità di recupero dall’apnea asfissiante indotta (Barrettet al., 2016). Impairment è stato osservato in cuccioli attraverso postnatale (P) giorni 5-8, ma non più da P12, suggestivo di un periodo neonatale di maggiore vulnerabilità alle disfunzioni neurologiche e fattori di stress cardiorespiratori. I cuccioli di roditori con una riduzione dell’80-90% del contenuto di 5-HT midollare, derivante dalla perturbazione chimica [trattamento con 5,7-diidrossitriptamina (Cummingset al., 2011b)] o geneticamente [delezione del gene Pet-1 della linea germinale (Cummings et al.,2011a; Erickson e Sposato, 2009; Erickson et al., 2007) o delezione del triptofano idrossilasi 2 ( Tph2) (Chenet al., 2013)] hanno mostrato anche una ridotta capacità di recupero da problemi apneici. Questi dati sui roditori costruiscono una plausibilità meccanicistica per i risultati associati alla SIDS di anomalie neuronali post-mortem del tronco encefalico 5-HT(Duncan et al., 2010; Paterson et al., 2006), tracciamenti cardiorespiratori che mostrano eventi apneici e bradicardici prolungati e più frequenti associati alla progressione che portano alla morte(Meny et al.,1994; Poets et al., 1999; Sridhar et al., 2003), e la determinazione epidemiologica di un periodo critico postneonatale di elevato rischio di SIDS (2-4 mesi di età) (American Academy of Pediatrics Task Force on Sudden Infant Death Syndrome, 2005). Tuttavia, mancano ancora prove di un ruolo acuto e in tempo reale dei neuroni serotoninergici postneonatali nella modulazione della risposta di auto-rianimazione. Gli studi hanno in gran parte coinvolto manipolazioni croniche o estese del sistema 5-HT che abbracciano l’embrione(Barrett et al., 2016; Chen et al., 2013; Cummings et al., 2011a; Erickson e Sposato, 2009) e/o lo sviluppo postneonatale(Yang e Cummings, 2013) in cui possono verificarsi cambiamenti di rete secondari e compensativi in aggiunta all’anomalia neuronale serotoninergica primaria e ingegnerizzata. Qui riportiamo i progressi in questo settore attraverso studi in cui abbiamo indotto acutamente Pet1 perturbazione neuronale in vivo a P8 e misurato l’esito cardiorespiratorio e il recupero attraverso una catena di apnee indotte da asfissia.
Abbiamo usato una strategia di inibizione neuronale inducibile (clozapina N-ossido (CNO)-triggered) (Ray et al., 2011) che coinvolge il cognato, sintetico inibitorio G proteina inibitoria accoppiato recettore hM4Di (indicato anche comeDi)(Armbruster et al., 2007) per interrompere a P8 l’attività di una popolazione di neuroni raphe definito dall’espressione di un transgene Pet1 BAC transgene. L’espressione del gene Pet1 serve in gran parte come marcatore serotoninergico(Fyodorov et al., 1998), con il Pet1 BAC come driver che offre accesso genetico ai neuroni 5-HT (5-HT+, Pet1+, triptofano idrossilasi 2 (Tph2+) cellule), più un piccolo sottoinsieme di neuroni di rafe che sono negativi per 5-HT e comunque positivi per l’espressione Pet1 (5-HT-, Tph2basso, Animale domestico1+(Barrettet al., 2016; Okaty et al., 2015; Pelosi et al. , 2014; Sos et al., 2017). I nostri risultati suggeriscono che l’attività del Pet1-neurone è richiesta a livello neonatale per mantenere la frequenza cardiaca di base e la ventilazione e per i normali tassi di sopravvivenza in risposta alle apnee. Infatti, la perturbazione CNO-Di-mediata dei neuroni Pet1+a P8 rende i cuccioli significativamente più probabili di morire dopo un’apnea rispetto ai controlli dei fratelli trattati con CNO. Inoltre, abbiamo scoperto che questa manipolazione acuta dei neuroni Pet1+ha colpito principalmente le componenti respiratorie del recupero dell’apnea, risparmiando gran parte della risposta cardiaca – un disaccoppiamento cardiorespiratorio non previsto da precedenti studi di perturbazione cronica (Barrettet al., 2016; Cummings et al. , 2011a; Cummings et al., 2011b) e che è in contrasto con la relazione lineare tra respirazione e recupero della frequenza cardiaca presente nei cuccioli di controllo. Inoltre, abbiamo scoperto che una risposta disordinata di gasp alla prima apnea ha caratterizzato i cuccioli che hanno ceduto ad una successiva apnea nel saggio. Inoltre, le analisi post hoc hanno identificato specifiche caratteristiche respiratorie associate all’insuccesso dell’auto-rianimazione. Questi risultati supportano un modello in cui l’attività dei pet1-neuroni è richiesta a livello neonatale per un robusto recupero dell’apnea e può, per estensione, informare le strategie per l’autoresuscitazione pediatrica e la prevenzione della SIDS.
Risultati
I neonati del mouse P8 mostrano parametri cardiorespiratori di base alterati in risposta alla perturbazione Di-mediata dei neuroni Pet1
Per studiare Pet1+ neuroni neonatalmente, abbiamo perseguito una strategia di Di chemiogenetica che consente una perturbazione neuronale non invasiva, inducibile, mirata e adatta alle piccole dimensioni dei cuccioli di topo P8 e ai vincoli fisici e temporali del nostro saggio pletismografico di apnea-induzione-recupero (auto-rianimazione). Abbiamo applicato il driver transgenico BAC Pet1-Flpe(Jensen et al., 2008), ricombinase-codifica BAC, che agisce sull’allele Flp-responsive ROSA26 (R26) designato Gt(ROSA)26Sortm(CAG-FSF-CHRM4*(Di))Dym(indicato per facilità in mano breve come RC-FDi)(Brust et al., 2014; Ray et al., 2011) per guidare in Pet1 espressione neuroni di Di(Armbruster et al., 2007), il Gi / O proteina accoppiato recettore con selettività ingegnerizzato per il ligando sintetico iniettabile CNO. Stabilito in precedenza, CNO-triggering di segnalazione Di in Pet1-lineage neuroni utilizzando questo approccio transgenico si traduce in iperpolarizzazione e diminuita eccitabilità in vivo e in vitro(Brust et al., 2014; Ray et al., 2011; Teissier et al., 2015). Inoltre, è stato dimostrato che la segnalazione CNO-triggered Di inibisce la trasmissione sinaptica(Stachniak et al., 2014). Il transgene Pet1-Flpe guida l’espressione del Flpe dalla metà dell’embriogenesi in poi nella maggior parte dei neuroni post-mitotici che esprimono Pet1(Jensen et al., 2008) e media in modo affidabile la ricombinazione di RC-FDi(Ray et al., 2011) e di altri alleli ingegnerizzati R26 (Brust et al., 2014; Jensen et al., 2008). Così il doppio transgenico Pet1-Flpe, cuccioli RC-FDi permettono di acuta, perturbazione inducibile dei neuroni Pet1 per lo studio funzionale neonatale, intero animale prima e dopo la somministrazione intraperitoneale (i.p.) CNO. Immunohistochemically-stained sezioni del raphe da P8 doppio transgenico Pet1-Flpe, RC-FDi cuccioli di topo, di cui Pet1-Di cuccioli, ha confermato l’espressione proteica del recettore HA-tagged Di in serotoninergico (Tph2 +) neuroni(Figura 1A-C”’ ), coerente con la specificità del driver precedentemente pubblicato Pet1-Flpe in cuccioli neonatali (Barrett et al.,2016). La posizione raphe, la proporzione e l’intensità del segnale di immunodeficienza HA-Di era qualitativamente simile in tutti i cuccioli Pet1-Di da cucciolate indipendenti(Figura 1-figure supplement 1). Nei cuccioli transgenici RC-FDi di controllo fratelli singoli, denominati cuccioli di controllo-Di (che ospitano l’allele RC-FDi non combinato e quindi negativo per la trascrizione Di ), non è stato rilevato alcun segnale immunodepressivo HA-Di(Figura 1D-F).
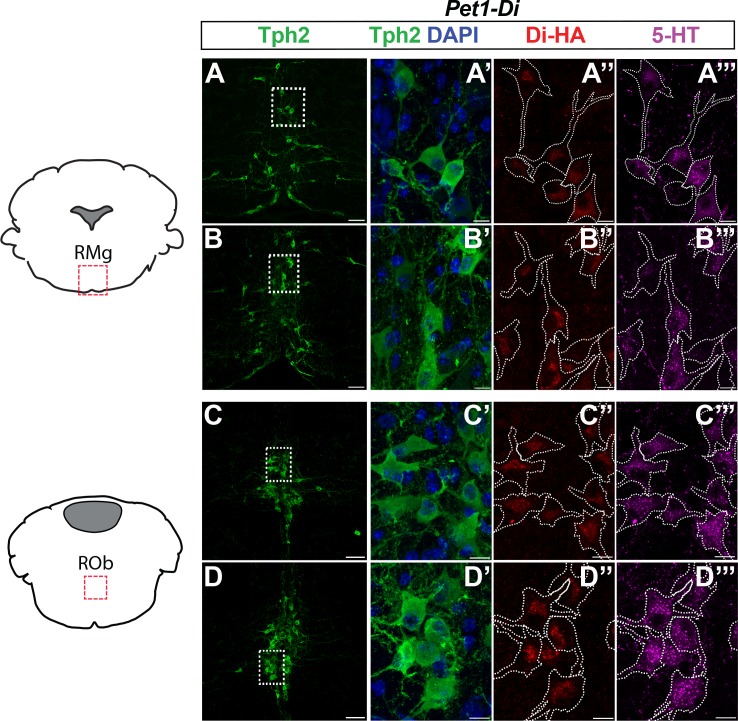
Figura 1-figure supplement 1.Ulteriori esempi di espressione di HA-Di nel tessuto cerebrale midollare dei cuccioli di Pet1-Di provenienti da cucciolate indipendenti.(A-C”‘ ) Espressione del recettoreHA-tagged Di mirata ai neuroni serotoninergici Pet1-raphe in Pet1-Flpe a doppio transgenico; RC-FDi ( denominato Pet1-Di) cuccioli a P8, come mostrato in precedenza nei topi adulti (Brust et al., 2014).(A-C) Vista a basso ingrandimento della sezione coronale di 20 µm che mostra i neuroni immunopositivi per triptofano idrossilasi 2 (Tph2), identificando i neuroni serotoninergici nel nucleo del rafe dorsale (DRN) (A), nel nucleo del rafe magnus (RMg) (B) e nel rafe oscuro (ROb) (C). I campi delimitati da rettangoli tratteggiati in A-C sono mostrati a maggiore ingrandimento in A ‘-C'” , con l’immunoreattività Tph2 di nuovo in verde (A’-C’) ), immunopositività HA-Di in rosso(A”-C” ), immunopositività dellaserotonina(5-HT) in magenta (A”‘-C“‘ ), e contorni di cellule tratteggiate come grossolanamente determinato dal segnale di immunodeficienza Tph2. La posizione raphe, la proporzione e l’intensità del segnale di immunodeficienza HA-Di era qualitativamente simile tra i cuccioli di Pet1-Di da cucciolate indipendenti(Figura 1-figure supplement 1).(D-F) Campi rappresentativi di controllo negativo da transgenici singoli transgenici che ospitano l’allele non combinato RC-FDi (denominato Control-Di), che non mostra alcun HA-Di rilevabile, in linea con la precedente convalida che la Di-espressione da RC-FDi richiede Flpe-recombinazione. Gli inserti mostrano l’immunodeficienza Tph2 dei neuroni serotoninergici in questi campi. Le barre di scala in A-C sono pari a 50 µm, e in A’-C ” e D-F, 10 µm.(G-H) Schema di apnea indotta da asfissia ripetuta e recupero auto-rianimato, durante il quale le dimensioni del respiro e la frequenza cardiaca sono continuamente monitorati.(G) Pletismografo camera di ossigeno (O2) per cento attraverso il tempo di saggio, a partire da ~ 20 minuti di acclimatazione del cucciolo all’aria della camera (21% O2) compresa l’estrazione dei valori cardiorespiratori di base cardiorespiratori durante la finestra temporale indicata dal rettangolo aperto a. I.P. iniezione di CNO immediatamente successivo; rettangolo rosso indica finestra di esposizione CNO. Gli attacchi di asfissia e apnea sono indicati dai quattro periodi (b-e) di ~0% O2 (97% N2, 3% CO2) indicati in grigio.(H) Vista ampliata temporalmente di un incontro di asfissia e apnea che include un esempio di tracciamento delle dimensioni del respiro (e della frequenza respiratoria calcolata, BR) e della frequenza cardiaca (HR) nel tempo. I primitivi (b’ e in modo simile per c-e) indicano l’iniezione di base specifica del bout dopo l’iniezione di CNO immediatamente precedente l’asfissia. La finestra grigia indica il periodo di asfissia che ha indotto l’apnea, seguito da un immediato ritorno al 21% di O2 durante il quale avviene il recupero dell’auto-rianimazione. Le barre nere dopo l’asfissia indicano τf o τ HR(τ definito come il 63% del valore di base prima di quello specifico attacco asfistico). La casella grigio chiaro indica il periodo di asfissia (97% N 3%CO2) utilizzato per indurre l’apnea.(A-D”‘ ) Espressione del recettoreHA-tagged Di mirata ai neuroni serotoninergici Pet1-raphe in Pet1-Flpe a doppio transgenico; cuccioli RC-FDi ( denominati Pet1-Di) a P8, come mostrato in Figura 1. A-A”’ e C-C ”” sono dello stesso cucciolo, che è distinto dalla fonte del cucciolo (e della cucciolata) per il tessuto in B-B”’ e D-D”’, e da quello in Figura 1.(A-D) Vista a basso ingrandimento di 20 µm sezione coronale che mostra i neuroni immunopositivi per triptofano idrossilasi 2 (Tph2), identificando i neuroni serotoninergici nel nucleo del rafe magnus (RMg) (A-B)e il raphe obscurus (ROb) (C-D). I rettangoli tratteggiati in A-D sono mostrati a maggiore ingrandimento in A’-D'” , con immunoreattività Tph2 in verde (A’-D’ ),immunopositività HA-Di in rosso (A”-D” ), immunopositività dellaserotonina(5-HT) in magenta (A“‘-D”‘ ), e contorni di cellule tratteggiate(bianco) come determinato dal segnale Tph2. Barre di scala: A-D, 50 µm; A’-D ”’ , 10 µm.
Per analizzare la funzione cardiorespiratoria nei cuccioli di mouse P8 in condizioni di aria ambiente (RA)(Figura 1G, rettangolo aperto a) e poi in condizioni di apnea, asfissia(Figura 1G, rettangoli riempiti b-e), abbiamo usato la pletismografia a testa in fuori e l’ECG con registrazione continua della respirazione (frequenza f, respiri – min-1; e le variazioni di pressione associate all’attività respiratoria utilizzate per calcolare il volume corrente VT,ml– g-1), la frequenza cardiaca(HR), il consumo di ossigeno (V˙O2; ml – min-1 – g-1), e la temperatura corporea mantenendo la termoneutralità del cucciolo (TB a 36 ± 0.05°C) attraverso la regolazione della temperatura della camera (TAa 35-36 ± 0,05°C). Da queste misurazioni insieme alla massa corporea (g), sono stati determinati i valori per la ventilazione minuta (V˙E; ml – min-1– g-1) e gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2).
Per valutare se i neuroni Pet1 a P8 modulano i parametri cardiorespiratori RA, le misurazioni sono state raccolte prima e durante la perturbazione neuronale(Figura 1G, rettangolo aperto a contro il rettangolo riempito b’ della Figura 1H, rispettivamente). Le caratteristiche omeostatiche iniziali della linea di base non hanno mostrato alcuna differenza significativa tra Pet1-Di e controllo-di cuccioli, indicando che la mera espressione di Di nelle cellule di lineage Pet1(non ancora innescato da CNO) così come il porto e l’espressione del transgene Pet1-Flpe transgenico erano neutri in questo saggio(Tabella 1).
| RC-FDi(Control-Di)n=15 | Pet1-Flpe;RC-FDi(Pet1-Di)n=22 | ||||
|---|---|---|---|---|---|
| Caratteristiche di base del mouse | Significato | SD | Significato | SD |
t-test p valore |
| Peso (BW) (g) | 5.503 | 1.115 | 5.04 | 1.275 | 0.2616 |
| Frequenza di respirazione (ƒ) (respiri – min-1) | 241.6 | 26.87 | 246.3 | 30.93 | 0.6406 |
| Volume di marea (VT) (ml – g-1) | 4.51 | 1.034 | 4.757 | 1.784 | 0.6322 |
| Ventilazione minuta (V˙E) (ml – min-1– g-1) | 1070 | 169.9 | 1139 | 331.9 | 0.4618 |
| Frequenza cardiaca (FC) (bpm) | 634.6 | 40.88 | 612.8 | 42.01 | 0.1271 |
| Consumo di ossigeno (V˙O2) (ml – min-1– g-1) | 77.43 | 19.19 | 71.25 | 14.39 | 0.2705 |
| Equivalenti ventilatori (V˙E/V˙O2) | 14.33 | 2.989 | 16.13 | 3.741 | 0.1281 |
Dopo l’iniezione di CNO(Figura 1H, rettangolo riempito b’ ), i cuccioli di Pet1-Di doppio transgenico (denominato Pet1-Di-CNO) hanno mostrato diminuzioni statisticamente significative in V˙E e HR (p=0,04 ep=0,02 rispettivamente, Figura 2A ‘ e B’ ) non osservate nei cuccioli di controllo-Di (denominato controllo-Di-CNO, Figura 2A e B ) . I calcoli del coefficiente di variazione per la respirazione f e HR suggeriscono una dispersione comparabile dei dati ottenuti durante l’esposizione al CNO rispetto alla linea di base prima dell’iniezione del CNO(Figura 2-figure supplement 1).
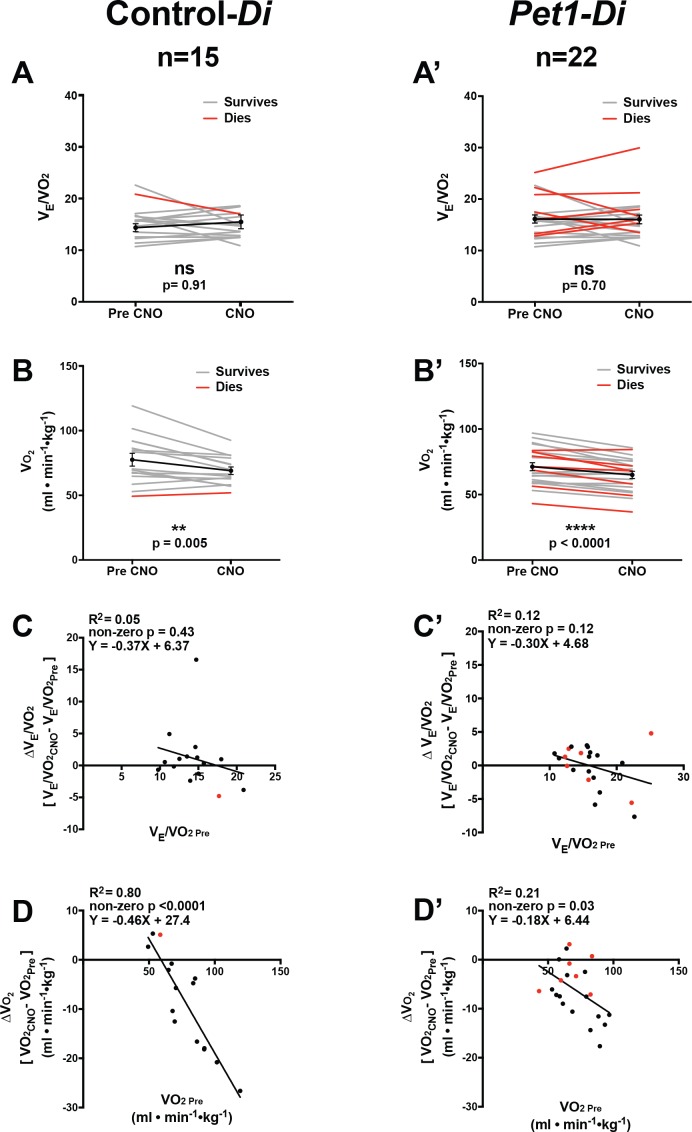
Figura 2-figure supplemento 3.Figura 2. Perturbazione acuta dei neuroni Pet1 altera i valori cardiorespiratori della linea di base.variazione della frequenza cardiaca e della frequenza respiratoria.variazioni della frequenza cardiaca di base in relazione alla ventilazione.analisi degli equivalenti ventilatori per l’ossigeno e il consumo di ossigeno prima e durante l’esposizione a CNO.(A-B’ ) A e B rappresentano la ventilazione minuta (V˙E, ml min-1 -kg-1) e la frequenza cardiaca(HR, battiti al minuto, bpm), rispettivamente, nei controlli fratelli che ospitano l’allele RC-FDi non combinato (non-Di-expressors denominato Control-Di) prima e durante l’esposizione alla CNO. Nessun cambiamento rilevabile è stato osservato in V˙E o HR prima e durante l’esposizione al CNO.(A’ e B’ ) mostrano V˙E e HR, rispettivamente prima e durante l’interruzione indotta da CNO di Pet1-neuroni incuccioli di Pet1-Flpe, RC-FDi (Di-expressori, indicati come Pet1-Di) . Coefficiente di variazione dei calcoli per la respirazione f e HR durante l’esposizione CNO rispetto alla linea di base prima dell’iniezione di CNO sono presentati in Figura 2-figure supplemento 1.(C-C’ ) Regressionelineare di pre-CNO V˙E tracciata contro la variazione in V˙E per i cuccioli di controllo-Di (C) (correlazionep=0,47 e R2 = 0,04) ePet1-Di cuccioli (C’ ) ( correlazione p<0,0001e R2= 0,76).(D-D’ ) Regressionelineare dell’HR pre-CNO tracciata contro la variazione dell’HR per i cuccioli di controllo-Di(D ) (correlazione p=0,52 e R2 = 0,03) e i cuccioli di Pet1-Di (D’) ( correlazionep=0,45 e R2 = 0,03). Abbreviazione VE˙ Pre (ventilazione prima dell’iniezione di CNO), V˙E CNO (ventilazione durante l’esposizione a CNO), HRPre (frequenza cardiacaprima dell’iniezione di CNO), HRCNO (frequenza cardiaca durante l’esposizione a CNO), bpm (battiti al minuto), mL (millilitri), min (minuti), kg (chilogrammi). Il termine “muore” si riferisce ai cuccioli che muoiono nei futuri attacchi – linee rosse (A-B’ )e cerchi rossi (C-D’ ), “sopravvive” si riferisce ai cuccioli che sopravvivono all’intera serie di sfide asfittiche-apnea – linee grigie (A-B’ ) e cerchi neri (C-D’ ). La regressione lineare del pre-CNO V˙E tracciata contro il cambiamento delle risorse umane, e il cambiamento in V˙E tracciata contro il cambiamento delle risorse umane sono presentati nella figura 2-figure supplement 2. Gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e il consumo di ossigeno V˙O2 i dati pre- versus durante l’esposizione al CNO sono mostrati nella figura 2-figure supplement 3.(A-A’ ) Coefficiente di variazione della frequenza respiratoria determinato attraverso la traccia stabile di 30 s analizzata nella Figura 2 (e descritta nella sezione Metodi) per l’esposizione pre- versus CNO (finestra di misurazione a versus b’illustrata nella Figura 1G e H) per i cuccioli di controllo-Di(A) e Pet1-Di ( A ‘ ).(B-B’ ) Coefficiente di variazione tracciato per la frequenza cardiaca attraverso la traccia stabile di 30 s analizzata nella Figura 2 per l ‘esposizione pre- versus CNO per i cuccioli controlDi (B ) e Pet1-Di ( B’ ). I punti grigi rappresentano i cuccioli che sono sopravvissuti a tutti e quattro i quattro attacchi di apnea indotta da asfissia. I punti rossi rappresentano i cuccioli che vanno a morire. Il punto nero rappresenta la media di tutti i cuccioli di quella coorte.(A-A’ ) Regressionelineare della ventilazione minuta pre-CNO (V˙E-min-1-kg-1) tracciata contro il cambiamento della frequenza cardiaca (HR, bpm) per icuccioli controlDi (A) e Pet1-Di (A’).(B-B’ ) Regressionelineare di ΔV˙E (durante rispetto a prima dell’esposizione al CNO) tracciata contro la variazione della frequenza cardiaca (ΔHR, bpm) per i cuccioli controlDi (B) e Pet1-Di (B‘). Abbreviazioni: VE˙ Pre (ventilazione prima di CNO), VE˙ CNO (ventilazione durante l’esposizione CNO), HRPre (frequenza cardiacaprima di CNO), HRCNO (frequenza cardiaca durante l’esposizione CNO), bpm (battiti al minuto), mL (millilitri), min (minuti), kg (chilogrammi). I punti rossi rappresentano i cuccioli che muoiono nei futuri attacchi; i punti neri rappresentano i cuccioli che sopravvivono.(A-B’ ) A e B rappresentano gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e il consumo massimo di ossigeno (V˙O2, ml – min-1 – g-1), rispettivamente, nei controlli fratelli che ospitano l’allele RC-FDi non combinato (non-Di-expressori, denominati Control-Di) prima e durante l’esposizione al CNO; A’ e B’ rappresentano tali misurazioni per i cuccioli Pet1-Flpe , RC-FDi(Di-expressori, denominati Pet1-Di) . V˙E/V˙O2before rispetto all’esposizione CNO non ha mostrato differenze statisticamente significative per icuccioli di Control-Di (A)oPet1-Di (A’ ). I valori di V˙O2 sono generalmente diminuiti a seguito di CNO e ritornano alla camera del pletismografo per entrambi i genotipi (B, B’ ).(C-C’ ) Regressionelineare deicuccioli pre-CNO7/V˙O2 (asse x) tracciata contro il cambiamento in V˙E/V˙O2for control-Di (C) (correlazione p=0.43 e R2 = 0.05) e Pet1-Di (C’ ) (correlazione p=0.12 e R2= 0.12).(D-D’ ) Regressionelineare di pre-CNO V˙O2 tracciata contro il cambiamento in V˙O2 per i cuccioli di controllo-Di (D) (correlazionep<0,0001 e R2 = 0,80) e i cuccioli di Pet1-Di (D’ ) (correlazione p=0,030e R2 = 0,21). Abbreviazione V˙E/V˙O2 Pre (equivalenti ventilatori per l’ossigeno prima dell’iniezione di CNO), V˙E/V˙O2 CNO (equivalenti ventilatori per l’ossigeno durante l’esposizione a CNO), V˙O2 Pre (consumo massimo di ossigeno prima dell’iniezione di CNO), V˙O2 CNO (consumo massimo di ossigeno durante l’esposizione a CNO). Il termine “muore” si riferisce a cuccioli che muoiono in attacchi futuri – linee rosse (A-B’ )e cerchi rossi (C-D’ ), “sopravvive” si riferisce a cuccioli che sopravvivono all’intera serie di sfide asfittiche-apnea – linee grigie (A-B’ ) e cerchi neri (C-D’ ).
Pet1-Di-CNOcuccioli con il più alto V˙E prima dell’iniezione di CNO hanno mostrato il più grande V˙E goccia sulla somministrazione di CNO e quelli con il più basso V˙E prima di CNO hanno mostrato aumenti modesti, anche se non statisticamente significativi (Figura 2A’e e C’ ). Questo suggerisce che il neurocircuito ventilatorio può coinvolgere i neuroni Pet1 per consentire una maggiore deviazione da un set point omeostatico standard, in modo tale che quando i neuroni Pet1 sono inibiti il range dinamico ventilatorio si restringe nel complesso. Una spiegazione tecnica alternativa, più complessa e probabilmente meno probabile, presuppone che i cuccioli con i valori più alti della linea di base V˙E siano cuccioli con i più alti livelli di espressione Di (all’interno della distribuzione determinata dalla variazione di espressione R26/CAG) in modo tale che l’attivazione del CNO determini una maggiore perturbazione cellulare e circuitale che si riflette in ultima analisi in maggiori diminuzioni in V˙E. Tuttavia, i risultati HR non supportano quest’ultima spiegazione, dato che tale correlazione non era presente tra l’entità delle variazioni di HR durante la somministrazione di CNO rispetto a HR pre-CNO, pre-CNO V˙E, o la variazione in V˙E (Figura2D’ , Figura 2-figure supplement 2).
In contrasto con questi effetti specifici di Pet1-Di-CNO, non sono stati osservati effetti statisticamente significativi sugli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) per entrambi i gruppi (control-Di-CNOe Pet1-Di-CNO ) (Figura 2-figuresupplement 3A,A’,C,C,C’ ). Entrambi i gruppi però hanno mostrato una sottile diminuzione del consumo di ossigeno dopo il CNO e il ritorno alla camera del pletismografo(Figura 2—figura supplemento 3B,B,B’ ).

Figura 1-figura supplemento 1.Figura 1—figura 1. Modello di topo genetico e test di auto-rianimazione postneonatale.ulteriori esempi di espressione di HA-Di nel tessuto cerebrale midollare dei cuccioli di Pet1-Di provenienti da cucciolate indipendenti.(A-C”‘ ) Espressione del recettoreHA-tau Di mirata ai neuroni serotoninergici Pet1-raphe in Pet1-Flpe a doppio transgenico; RC-FDi ( indicato come Pet1-Di) cuccioli a P8, come mostrato in precedenza nei topi adulti (Brust et al., 2014).(A-C) Vista a basso ingrandimento della sezione coronale di 20 µm che mostra i neuroni immunopositivi per triptofano idrossilasi 2 (Tph2), identificando i neuroni serotoninergici nel nucleo del rafe dorsale (DRN) (A), nel nucleo del rafe magnus (RMg) (B) e nel rafe oscuro (ROb) (C). I campi delimitati da rettangoli tratteggiati in A-C sono mostrati a maggiore ingrandimento in A ‘-C'” , con l’immunoreattività Tph2 di nuovo in verde (A’-C’) ), immunopositività HA-Di in rosso(A”-C” ), immunopositività dellaserotonina(5-HT) in magenta (A”‘-C“‘ ), e contorni di cellule tratteggiate come grossolanamente determinato dal segnale di immunodeficienza Tph2. La posizione raphe, la proporzione e l’intensità del segnale di immunodeficienza HA-Di era qualitativamente simile tra i cuccioli di Pet1-Di da cucciolate indipendenti(Figura 1-figure supplement 1).(D-F) Campi rappresentativi di controllo negativo da transgenici singoli transgenici che ospitano l’allele non combinato RC-FDi (denominato Control-Di), che non mostra alcun HA-Di rilevabile, in linea con la precedente convalida che la Di-espressione da RC-FDi richiede Flpe-recombinazione. Gli inserti mostrano l’immunodeficienza Tph2 dei neuroni serotoninergici in questi campi. Le barre di scala in A-C sono pari a 50 µm, e in A’-C ” e D-F, 10 µm.(G-H) Schema di apnea indotta da asfissia ripetuta e recupero auto-rianimato, durante il quale le dimensioni del respiro e la frequenza cardiaca sono continuamente monitorati.(G) Pletismografo camera di ossigeno (O2) per cento attraverso il tempo di saggio, a partire da ~ 20 minuti di acclimatazione del cucciolo all’aria della camera (21% O2) compresa l’estrazione dei valori cardiorespiratori di base cardiorespiratori durante la finestra temporale indicata dal rettangolo aperto a. I.P. iniezione di CNO immediatamente successivo; rettangolo rosso indica finestra di esposizione CNO. Gli attacchi di asfissia e apnea sono indicati dai quattro periodi (b-e) di ~0% O2 (97% N2, 3% CO2) indicati in grigio.(H) Vista ampliata temporalmente di un incontro di asfissia e apnea che include un esempio di tracciamento delle dimensioni del respiro (e della frequenza respiratoria calcolata, BR) e della frequenza cardiaca (HR) nel tempo. I primitivi (b’ e in modo simile per c-e) indicano l’iniezione di base specifica del bout dopo l’iniezione di CNO immediatamente precedente l’asfissia. La finestra grigia indica il periodo di asfissia che ha indotto l’apnea, seguito da un immediato ritorno al 21% di O2 durante il quale avviene il recupero dell’auto-rianimazione. Le barre nere dopo l’asfissia indicano τf o τ HR(τ definito come il 63% del valore di base prima di quello specifico attacco asfistico). La casella grigio chiaro indica il periodo di asfissia (97% N 3%CO2) utilizzato per indurre l’apnea.(A-D”‘ ) Espressione del recettoreHA-tagged Di mirata ai neuroni serotoninergici Pet1-raphe in Pet1-Flpe a doppio transgenico; cuccioli RC-FDi ( denominati Pet1-Di) a P8, come mostrato in Figura 1. A-A”’ e C-C ”” sono dello stesso cucciolo, che è distinto dalla fonte del cucciolo (e della cucciolata) per il tessuto in B-B”’ e D-D”’, e da quello in Figura 1.(A-D) Vista a basso ingrandimento di 20 µm sezione coronale che mostra i neuroni immunopositivi per triptofano idrossilasi 2 (Tph2), identificando i neuroni serotoninergici nel nucleo del rafe magnus (RMg) (A-B)e il raphe obscurus (ROb) (C-D). I rettangoli tratteggiati in A-D sono mostrati a maggiore ingrandimento in A’-D'” , con immunoreattività Tph2 in verde (A’-D’ ),immunopositività HA-Di in rosso (A”-D” ), immunopositività dellaserotonina(5-HT) in magenta (A“‘-D”‘ ), e contorni di cellule tratteggiate(bianco) come determinato dal segnale Tph2. Barre di scala: A-D, 50 µm; A’-D ”’ , 10 µm.

Figura 1-figure supplement 1.Ulteriori esempi di espressione di HA-Di nel tessuto cerebrale midollare dei cuccioli di Pet1-Di da cucciolate indipendenti.(A-D”‘ ) HA-tagged Di espressione del recettore Di mirata ai neuroni serotoninergici Pet1-raphe in Pet1-Flpe a doppio transgenico; RC-FDi ( denominato Pet1-Di) cuccioli a P8, come mostrato in Figura 1. A-A”’ e C-C ”” sono dello stesso cucciolo, che è distinto dalla fonte del cucciolo (e della cucciolata) per il tessuto in B-B”’ e D-D”’, e da quello in Figura 1.(A-D) Vista a basso ingrandimento di 20 µm sezione coronale che mostra i neuroni immunopositivi per triptofano idrossilasi 2 (Tph2), identificando i neuroni serotoninergici nel nucleo del rafe magnus (RMg) (A-B)e il raphe obscurus (ROb) (C-D). I rettangoli tratteggiati in A-D sono mostrati a maggiore ingrandimento in A’-D'” , con immunoreattività Tph2 in verde (A’-D’ ),immunopositività HA-Di in rosso (A”-D” ), immunopositività dellaserotonina(5-HT) in magenta (A“‘-D”‘ ), e contorni di cellule tratteggiate(bianco) come determinato dal segnale Tph2. Barre di scala: A-D, 50 µm; A’-D ”’ , 10 µm.

Figura 2-figure supplement 3.Figura 2—figura 3. Perturbazione acuta dei neuroni Pet1 altera i valori cardiorespiratori di base.variazione della frequenza cardiaca e della frequenza respiratoria.variazioni della frequenza cardiaca di base in relazione alla ventilazione.analisi degli equivalenti ventilatori per l’ossigeno e il consumo di ossigeno prima e durante l’esposizione a CNO.(A-B’ ) A e B rappresentano la ventilazione minuta (V˙E, ml min-1 -kg-1) e la frequenza cardiaca(HR, battiti al minuto, bpm), rispettivamente, nei controlli fratelli che ospitano l’allele RC-FDi non combinato (non-Di-expressors denominato Control-Di) prima e durante l’esposizione alla CNO. Nessun cambiamento rilevabile è stato osservato in V˙E o HR prima e durante l’esposizione al CNO.(A’ e B’ ) mostrano V˙E e HR, rispettivamente prima e durante l’interruzione indotta da CNO di Pet1-neuroni incuccioli di Pet1-Flpe, RC-FDi (Di-expressori, indicati come Pet1-Di) . Coefficiente di variazione dei calcoli per la respirazione f e HR durante l’esposizione CNO rispetto alla linea di base prima dell’iniezione di CNO sono presentati in Figura 2-figure supplemento 1.(C-C’ ) Regressionelineare di pre-CNO V˙E tracciata contro la variazione in V˙E per i cuccioli di controllo-Di (C) (correlazionep=0,47 e R2 = 0,04) ePet1-Di cuccioli (C’ ) ( correlazione p<0,0001e R2= 0,76).(D-D’ ) Regressionelineare dell’HR pre-CNO tracciata contro la variazione dell’HR per i cuccioli di controllo-Di(D ) (correlazione p=0,52 e R2 = 0,03) e i cuccioli di Pet1-Di (D’) ( correlazionep=0,45 e R2 = 0,03). Abbreviazione VE˙ Pre (ventilazione prima dell’iniezione di CNO), V˙E CNO (ventilazione durante l’esposizione a CNO), HRPre (frequenza cardiacaprima dell’iniezione di CNO), HRCNO (frequenza cardiaca durante l’esposizione a CNO), bpm (battiti al minuto), mL (millilitri), min (minuti), kg (chilogrammi). Il termine “muore” si riferisce ai cuccioli che muoiono nei futuri attacchi – linee rosse (A-B’ )e cerchi rossi (C-D’ ), “sopravvive” si riferisce ai cuccioli che sopravvivono all’intera serie di sfide asfittiche-apnea – linee grigie (A-B’ ) e cerchi neri (C-D’ ). La regressione lineare del pre-CNO V˙E tracciata contro il cambiamento delle risorse umane, e il cambiamento in V˙E tracciata contro il cambiamento delle risorse umane sono presentati nella figura 2-figure supplement 2. Gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e il consumo di ossigeno V˙O2 i dati pre- versus durante l’esposizione al CNO sono mostrati nella figura 2-figure supplement 3.(A-A’ ) Coefficiente di variazione della frequenza respiratoria determinato attraverso la traccia stabile di 30 s analizzata nella Figura 2 (e descritta nella sezione Metodi) per l’esposizione pre- versus CNO (finestra di misurazione a versus b’illustrata nella Figura 1G e H) per i cuccioli di controllo-Di(A) e Pet1-Di ( A ‘ ).(B-B’ ) Coefficiente di variazione tracciato per la frequenza cardiaca attraverso la traccia stabile di 30 s analizzata nella Figura 2 per l ‘esposizione pre- versus CNO per i cuccioli controlDi (B ) e Pet1-Di ( B’ ). I punti grigi rappresentano i cuccioli che sono sopravvissuti a tutti e quattro i quattro attacchi di apnea indotta da asfissia. I punti rossi rappresentano i cuccioli che vanno a morire. Il punto nero rappresenta la media di tutti i cuccioli di quella coorte.(A-A’ ) Regressionelineare della ventilazione minuta pre-CNO (V˙E-min-1-kg-1) tracciata contro il cambiamento della frequenza cardiaca (HR, bpm) per icuccioli controlDi (A) e Pet1-Di (A’).(B-B’ ) Regressionelineare di ΔV˙E (durante rispetto a prima dell’esposizione al CNO) tracciata contro la variazione della frequenza cardiaca (ΔHR, bpm) per i cuccioli controlDi (B) e Pet1-Di (B‘). Abbreviazioni: VE˙ Pre (ventilazione prima di CNO), VE˙ CNO (ventilazione durante l’esposizione CNO), HRPre (frequenza cardiacaprima di CNO), HRCNO (frequenza cardiaca durante l’esposizione CNO), bpm (battiti al minuto), mL (millilitri), min (minuti), kg (chilogrammi). I punti rossi rappresentano i cuccioli che muoiono nei futuri attacchi; i punti neri rappresentano i cuccioli che sopravvivono.(A-B’ ) A e B rappresentano gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e il consumo massimo di ossigeno (V˙O2, ml – min-1 – g-1), rispettivamente, nei controlli fratelli che ospitano l’allele RC-FDi non combinato (non-Di-expressori, denominati Control-Di) prima e durante l’esposizione al CNO; A’ e B’ rappresentano tali misurazioni per i cuccioli Pet1-Flpe , RC-FDi(Di-expressori, denominati Pet1-Di) . V˙E/V˙O2before rispetto all’esposizione CNO non ha mostrato differenze statisticamente significative per icuccioli di Control-Di (A)oPet1-Di (A’ ). I valori di V˙O2 sono generalmente diminuiti a seguito di CNO e ritornano alla camera del pletismografo per entrambi i genotipi (B, B’ ).(C-C’ ) Regressionelineare deicuccioli pre-CNO7/V˙O2 (asse x) tracciata contro il cambiamento in V˙E/V˙O2for control-Di (C) (correlazione p=0.43 e R2 = 0.05) e Pet1-Di (C’ ) (correlazione p=0.12 e R2= 0.12).(D-D’ ) Regressionelineare di pre-CNO V˙O2 tracciata contro il cambiamento in V˙O2 per i cuccioli di controllo-Di (D) (correlazionep<0,0001 e R2 = 0,80) e i cuccioli di Pet1-Di (D’ ) (correlazione p=0,030e R2 = 0,21). Abbreviazione V˙E/V˙O2 Pre (equivalenti ventilatori per l’ossigeno prima dell’iniezione di CNO), V˙E/V˙O2 CNO (equivalenti ventilatori per l’ossigeno durante l’esposizione a CNO), V˙O2 Pre (consumo massimo di ossigeno prima dell’iniezione di CNO), V˙O2 CNO (consumo massimo di ossigeno durante l’esposizione a CNO). Il termine “muore” si riferisce a cuccioli che muoiono in attacchi futuri – linee rosse (A-B’ )e cerchi rossi (C-D’ ), “sopravvive” si riferisce a cuccioli che sopravvivono all’intera serie di sfide asfittiche-apnea – linee grigie (A-B’ ) e cerchi neri (C-D’ ).
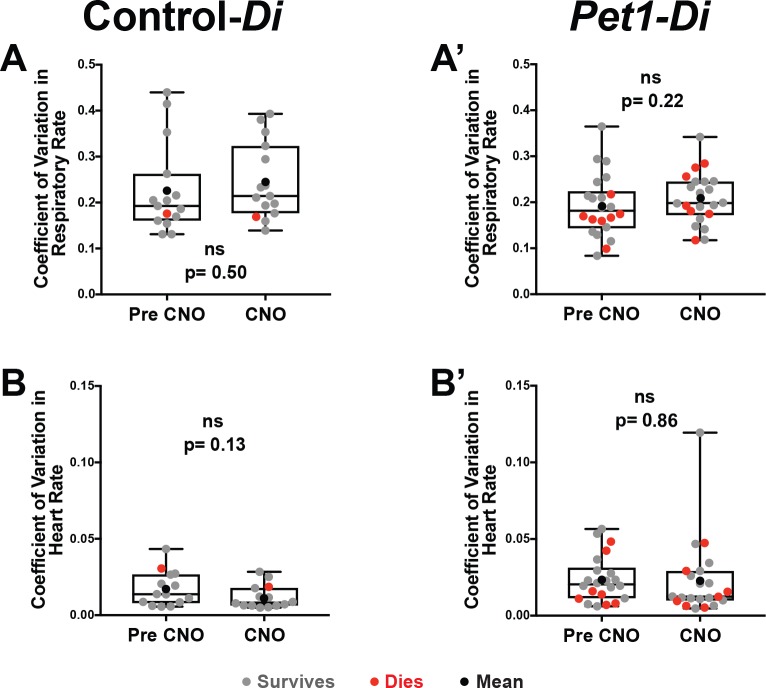
Figura 2-figure supplemento 1.Variazione della frequenza cardiaca e della frequenza respiratoria.(A-A’ ) Coefficiente di variazione tracciato per la frequenza respiratoria determinato attraverso la traccia stabile di 30 s analizzata nella Figura 2 (e descritta nella sezione Metodi) per l’esposizione pre- versus CNO (finestra di misurazione a versus b’illustrata nella Figura 1G e H) per i cuccioli di controllo-Di(A) e Pet1-Di (A’ ).(B-B’ ) Coefficiente di variazione tracciato per la frequenza cardiaca attraverso la traccia stabile di 30 s analizzata nella Figura 2 per l ‘esposizione pre- versus CNO per i cuccioli controlDi (B ) e Pet1-Di ( B’ ). I punti grigi rappresentano i cuccioli che sono sopravvissuti a tutti e quattro i quattro attacchi di apnea indotta da asfissia. I punti rossi rappresentano i cuccioli che vanno a morire. Il punto nero rappresenta la media di tutti i cuccioli di quella coorte.
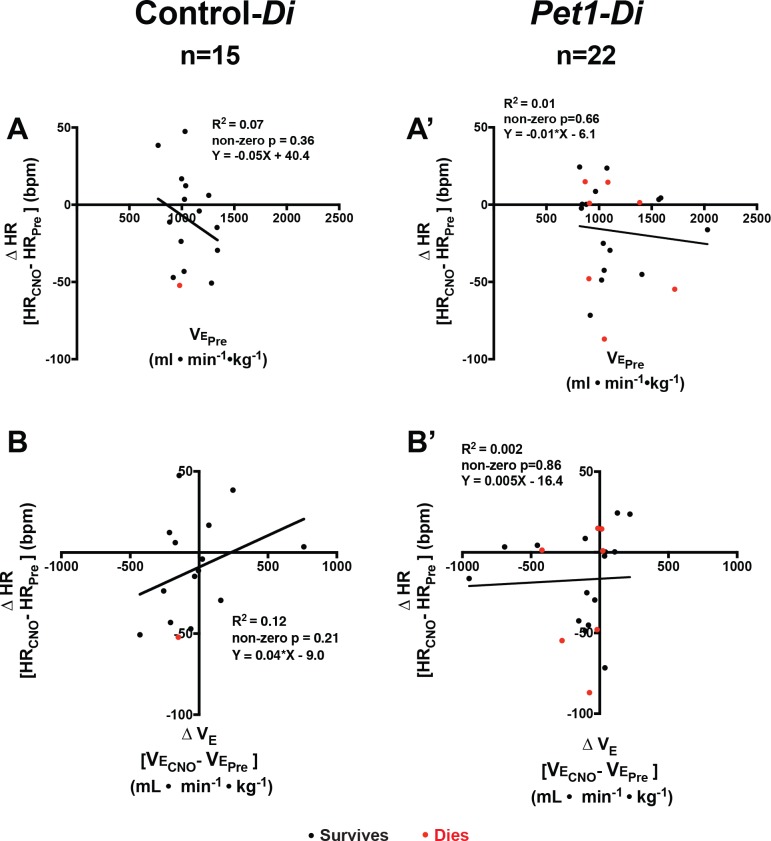
Figura 2-figure supplemento 2.Cambiamenti nella frequenza cardiaca di base in relazione alla ventilazione.(A-A’ ) Regressionelineare della ventilazione minuta pre-CNO (V˙E-min-1-kg-1) tracciata contro le variazioni della frequenza cardiaca (HR, bpm) per icuccioli controlDi (A) e Pet1-Di (A’).(B-B’ ) Regressionelineare di ΔV˙E (durante rispetto a prima dell’esposizione al CNO) tracciata contro la variazione della frequenza cardiaca (ΔHR, bpm) per i cuccioli controlDi (B) e Pet1-Di (B‘). Abbreviazioni: VE˙ Pre (ventilazione prima di CNO), VE˙ CNO (ventilazione durante l’esposizione CNO), HRPre (frequenza cardiacaprima di CNO), HRCNO (frequenza cardiaca durante l’esposizione CNO), bpm (battiti al minuto), mL (millilitri), min (minuti), kg (chilogrammi). I punti rossi rappresentano i cuccioli che muoiono nei futuri attacchi; i punti neri rappresentano i cuccioli che sopravvivono.

Figura 2-figure supplemento 3.Analisi degli equivalenti ventilatori per il consumo di ossigeno e di ossigeno prima e durante l’esposizione al CNO.(A-B’ ) A e B rappresentano gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e il consumo massimo di ossigeno (V˙O2, ml – min-1 – g-1), rispettivamente, nei controlli fratelli che ospitano l’allele RC-FDi non combinato (non-Di-expressori, denominati Control-Di) prima e durante l’esposizione al CNO; A’ e B’ rappresentano tali misurazioni per i cuccioli Pet1-Flpe , RC-FDi(Di-expressori, denominati Pet1-Di) . V˙E/V˙O2before rispetto all’esposizione CNO non ha mostrato differenze statisticamente significative per icuccioli di Control-Di (A)oPet1-Di (A’ ). I valori di V˙O2 sono generalmente diminuiti a seguito di CNO e ritornano alla camera del pletismografo per entrambi i genotipi (B, B’ ).(C-C’ ) Regressionelineare deicuccioli pre-CNO7/V˙O2 (asse x) tracciata contro il cambiamento in V˙E/V˙O2for control-Di (C) (correlazione p=0.43 e R2 = 0.05) e Pet1-Di (C’ ) (correlazione p=0.12 e R2= 0.12).(D-D’ ) Regressionelineare di pre-CNO V˙O2 tracciata contro il cambiamento in V˙O2 per i cuccioli di controllo-Di (D) (correlazionep<0,0001 e R2 = 0,80) e i cuccioli di Pet1-Di (D’ ) (correlazione p=0,030e R2 = 0,21). Abbreviazione V˙E/V˙O2 Pre (equivalenti ventilatori per l’ossigeno prima dell’iniezione di CNO), V˙E/V˙O2 CNO (equivalenti ventilatori per l’ossigeno durante l’esposizione a CNO), V˙O2 Pre (consumo massimo di ossigeno prima dell’iniezione di CNO), V˙O2 CNO (consumo massimo di ossigeno durante l’esposizione a CNO). Il termine “muore” si riferisce a cuccioli che muoiono in attacchi futuri – linee rosse (A-B’ )e cerchi rossi (C-D’ ), “sopravvive” si riferisce a cuccioli che sopravvivono all’intera serie di sfide asfittiche-apnea – linee grigie (A-B’ ) e cerchi neri (C-D’ ).
Ridotta risposta di recupero dell’apnea e ridotta sopravvivenza del cucciolo a seguito di un’interruzione acuta dell’attività del Pet1-neurone
Ci siamo poi chiesti se la perturbazione CNO-Di-mediata dei neuroni di Pet1 a P8 abbia alterato il recupero del cucciolo da apnee ripetute, episodiche, indotte da asfissia (paradigma sperimentale schematizzato nella Figura 1G e H , modificato da studi precedenti(Barrett et al., 2016; Cummings et al., 2011a; Erickson e Sposato , 2009). Abbiamo trovato che l’auto-rianimazione è meno efficace nei cuccioli di Pet1-Di-CNOrispetto ai cuccioli di controllo-Di-CNO, con un conseguente significativo aumento della mortalità(Figura 3A, Fisher Exact Test a una coda con correzione di Lancaster Mid-P p = 0,04). Il rapporto di probabilità calcolato per la morte del cucciolo come risultato di apnea asfissiante di fronte a Pet1-Di-CNOcontro il controllo-Di-CNO è 6,5, suggerendo un sostanziale aumento della vulnerabilità alle apnee quando l’attività neuronale Pet1 è acutamente perturbata. HR e le risposte respiratorie durante un’auto-rianimazione di successo contro un’auto-rianimazione fallita sono mostrate nelle Figure 1H e 3B, rispettivamente. In generale, l’auto-rianimazione riuscita è caratterizzata da una breve apnea primaria e da un rapido recupero del FC normale e della respirazione eufneica dopo l’inizio del respiro affannoso(Figura 1H), mentre l’auto-rianimazione fallita è caratterizzata da un’apnea primaria prolungata (respiro affannoso ritardato) e dall’incapacità di recuperare la respirazione eufneica nonostante il respiro affannoso e, in ultima analisi, dal mancato mantenimento del FC a un livello recuperato o quasi recuperato(Figura 3B). Sette dei ventidue cuccioli di Pet1-Di-CNOrispetto a uno dei quindici cuccioli di controllo-Di-CNO non sono riusciti a ripristinare il ritmo respiratorio eufneico con conseguente morte(Figura 3A).
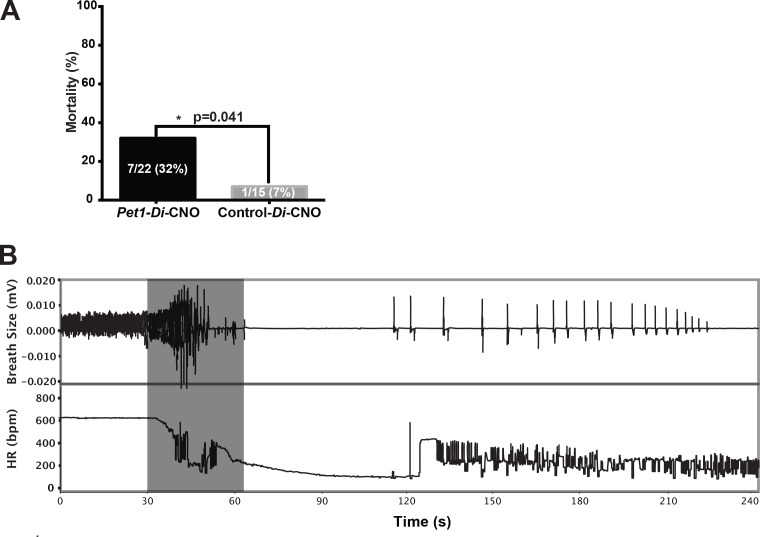
Figura 3.Figura 3. L’attività del Pet1-neuroneche disturba gravemente l’attività del Pet1-neurone compromette la capacità del cucciolo di recuperare da apnee multiple.(A) Mortalità percentuale dopo ripetute apnee indotte da asfissia tracciate in funzione del genotipo (Test Esatto di Fisher su un lato con correzione P media di Lancaster p = 0,041).(B) Esempio di respirazione e di traccia della risposta della frequenza cardiaca da un cucciolo di Pet1-Di-CNOche non è riuscito a riprendersi. La casella grigia indica la finestra di condizioni asfittiche (97% N 3%CO2). n = 15 per i cuccioli di controllo-Di-CNO,n = 22 per i cuccioli Pet1-Di-CNO.

Figura 3.Figura 3. L’attività dei cuccioli Pet1-neuroniche perturbano gravemente l’attività di Pet1-neuronicompromette la capacità del cucciolo di riprendersi da apnee multiple.(A) Mortalità percentuale dopo ripetute apnee indotte da asfissia tracciate in funzione del genotipo (test esatto di Fisher su un solo lato con correzione P media di Lancaster p = 0,041).(B) Esempio di respirazione e di traccia della risposta della frequenza cardiaca da un cucciolo di Pet1-Di-CNOche non è riuscito a riprendersi. La casella grigia indica la finestra di condizioni asfittiche (97% N 3%CO2). n = 15 per i cuccioli di controllo-Di-CNO,n = 22 per i cuccioli Pet1-Di-CNO.
Pet1-neuroni postneonatale Pet1-neurone disturbo della respirazione compromessa ma non il recupero della frequenza cardiaca in auto-rianimazione
Per interrogare i componenti della risposta di auto-rianimazionee la loro possibile dipendenza dalla normale attività del Pet1-neurone, abbiamo esaminato il recupero da ogni attacco di asfissia(Figura 4), determinando il tempo di latenza di recupero (τ) per ottenere almeno 3 s di frequenza respiratoria f o HR a livelli ≥ 63% dell’eupnea f e HR osservata come linea di base immediatamente precedente la sfida apneica data (Figura 4A,a‘-d’; Figura 1G e H). Il tempo fino al 63% di recupero è stato scelto per l’analisi a causa della sensibilità probabilmente offerta dal campionamento di quella parte della risposta di recupero che mostra la maggiore quantità di cambiamento del sistema (recupero del sistema), come previsto dalla costante di tempo (τ) di un sistema di primo ordine, lineare e invariante nel tempo; mentre i sistemi di recupero della respirazione e della frequenza cardiaca effettivi possono essere più complessi, il campionamento τ (a differenza di altri punti di tempo) è la nostra migliore previsione per rilevare al massimo le differenze di recupero. Poiché non tutti i cuccioli sono sopravvissuti all’intera sequenza di 4-asfisici(Figura 4B e D), abbiamo anche analizzato separatamente le caratteristiche dell’ultimo combattimento sopravvissuto per ogni cucciolo(Figura 4C ed E). In particolare, ci sono stati alcuni casi in cui il combattimento mortale è stato comunque associato ad un recupero transitorio di HR che soddisfaceva le condizioni τ (HR ≥63% della linea di base pre-bout sostenuta per ≥3 s), quindi questi valori sono stati utilizzati nel calcolo della media τHR per il particolare incontro(Figura 4D, la loro inclusione è indicata dai simboli grigi nella parte superiore del grafico), e sono stati inclusi nel grafico di dispersione dell’ultimo τ HR registrato per ogni cucciolo (Figura 4E, simboli grigi). A differenza dell’HR, gli attacchi mortali non sono mai stati trovati associati ad un recupero transitorio della respirazione f che soddisfaceva le condizioni τ (f≥ 63% della linea di base pre-bout sostenuta per ≥3 s).
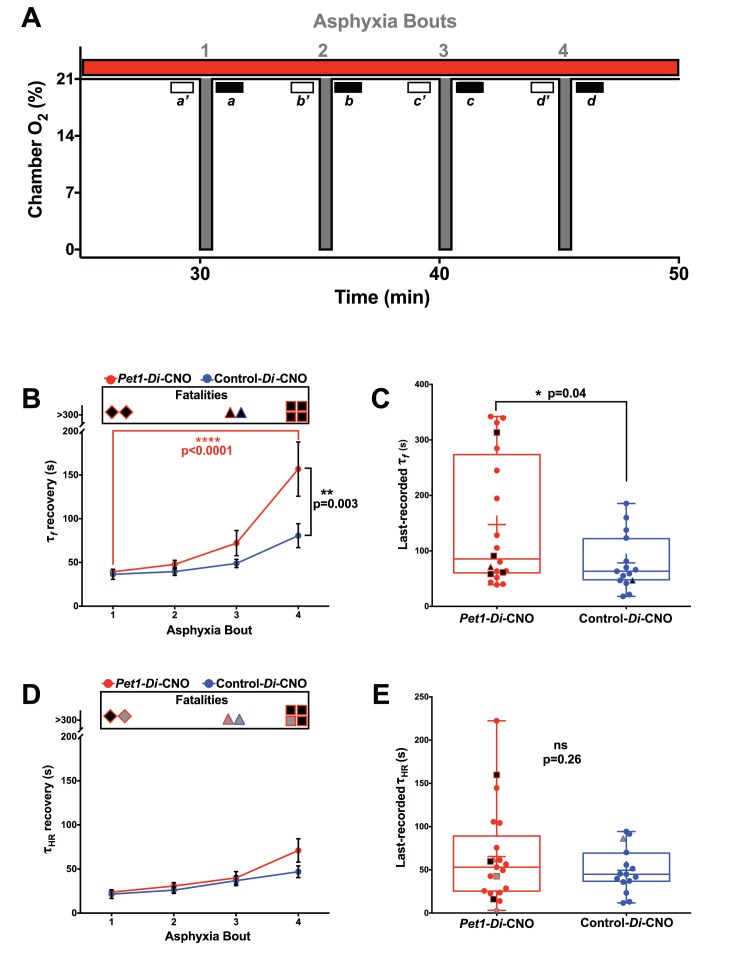
Figura 4.Figura 4. Perturbazione acuta dell’attività del Pet1-neurone Pet1colpisce principalmente i componenti respiratori durante il recupero dell’apnea(A) Schema compresso della linea temporale del test di auto-rianimazione che indica i periodi di asfissia e di apnea e le finestre di estrazione dei dati; le finestre aperte a’-d’ riflettono le misurazioni della linea di base specifica del periodo di apnea, le finestre riempite a-d riflettono temporalmente quando il recupero al 63% dei valori della linea di base è stato determinato (τf e τ HR).(B e D)τf(B) o τ HR(D ) attraverso gli attacchi, con il rettangolo aperto ‘Fatalities’ sopra ogni grafico che denota gli animali morti durante il test; le forme contenute rappresentano l’attacco di apnea mortale – diamante (circa 1), triangolo (circa 3), quadrato (circa 4) – mentre il riempimento nero riflette la mortalità durante la risposta di recupero. Pet1-Di-CNO cuccioli indicati in rosso (n = 22), control-Di-CNO cuccioli(fratelli non-Di-espressori), in blu (n = 15).(C ed E) τf(C) o τ HR(E ) durante l’ultimo incontro recuperato (incontro finale durante il quale un cucciolo è stato in grado di raggiungere il 63% della caratteristica di base). Il riempimento nero continua a riflettere la mortalità, la forma riflette l’incontro che è stato fatale. Le forme piene di grigio riflettono gli animali che hanno recuperato il 63% della linea di base, anche se sono morti durante l’apnea, nonostante il rispetto dei criteri di τ HR. I cerchi tracciati riflettono i cuccioli che sono sopravvissuti a tutti gli attacchi; +indica la media; il grafico box-whisker mostra la mediana come linea orizzontale, il primoe il terzoquartile come ‘box’, e i valori massimo e minimo come ‘baffi’.
L’analisi di τ f attraverso gli attacchi di asfissia ha mostrato un significativo allungamento tra il primo e il quarto attacco per i cuccioli Pet1-Di-CNO, ma non per i cuccioli di controllo-Di-CNO (Figura 4B, interazione ANOVA bidirezionale p=0,027 test di confronto multiplo del Tukey post hoc p< 0,0001(Pet1-Di-CNO) e p=0,3063 (controllo-Di-CNO)). Questo τ f prolungamento associato a ripetute sfide apneiche nei cuccioli di Pet1-Di-CNO, come calcolato, è una sottovalutazione dato che gli animali morti (infinito tentativo di recupero della frequenza respiratoria, se volete) non potevano essere inclusi. Questo sottolinea ulteriormente l’importanza dei neuroni del Pet1 nel consentire una rapida risposta di recupero respiratorio. Inoltre, la media τ fnei cuccioli di Pet1-Di-CNO durante l’attacco #4 è stata significativamente prolungata rispetto a quella dei topi di controlloDi-CNO (Figura 4Bposthoc Tukey test di confronto multiplo p=0,003), indicando che, nonostante la sopravvivenza, la risposta dei cuccioli di Pet1-Di-CNO era anormale.
Nell’analizzare l’ultimo incontro recuperato per tutti i cuccioli Pet1-Di-CNO, τf è stato nuovamente trovato essere prolungato(Figura 4C, p = 0,04. Si noti che uno dei cuccioli di Pet1-Di-CNO sopravvissuti, durante il periodo 4, non ha raggiunto il 63% del loro pre-bout f entro il tempo di registrazione assegnato (330 s) e quindi è stato assegnato un τ fdi 331 s – ancora una volta, portando a sottovalutare l’effetto Pet1-Di-CNO e quindi l’importanza dell’attività neuronale Pet1 per il recupero respiratorio.
A differenza di τ f,τ il recupero delle risorse umane non ha mostrato un’interazione con l’incontro di asfissia per i cuccioli Pet1-Di-CNO né con i cuccioli di controlloDi-CNO, (Figura4D, interazione ANOVAbidirezionale p=0,335). Inoltre, in contrasto con i forti effetti su τ f osservati nei cuccioli di Pet1-Di-CNO, l’HR τ non è stato significativamente diverso da quello dei cuccioli di controlloDi-CNO in qualsiasi punto durante il saggio, compreso l’ultimo combattimento recuperato (Figura4E p=0, 255). Dei sette cuccioli Pet1-Di-CNO morti durante il test, tre hanno comunque raggiunto il 63% della loro linea di base HR durante l’incontro fatale prima di soccombere all’insufficienza cardiaca, e quindi potrebbero essere inclusi nell’analisi τ HR per quell’incontro (indicato come simboli pieni di grigio nella parte superiore della Figura 4D e nel grafico di dispersione di 4E). Gli altri quattro non lo hanno fatto (indicati come simboli pieni di nero nella parte superiore di 4D e nel grafico di 4E), e quindi i loro valori τ HR sono stati necessariamente esclusi, sottolineando ancora una volta l’effetto della funzione Pet1-neurone nel recupero HR. Anche il cucciolo di controllo-Di-CNO che è morto ha raggiunto il 63% dell’HR di base durante l’attacco terminale ed è stato quindi incluso nelle analisi τ HR (simboli grigi e blu delineati in figura 4D ed E).
Successivamente, abbiamo tracciato τ f contro τ HR per ogni cucciolo in tutti gli attacchi per esaminare la loro relazione, dato che il silenziamento del Pet1-neurone sembrava influenzare in modo differenziato la respirazione rispetto al recupero della frequenza cardiaca. Applicando un modello di regressione lineare ai valori generati da controllo-Di-CNO cuccioli ha identificato una relazione non casuale, lineare tra τ HR e τ f, se l’analisi di tutti i recuperi asfissianti bout (Figura5A blu e blu estratto trama blu mostrato separatamente in 5A’, Run deviazione lineare di prova p = 0.36, R2 = 0,84, e pendenza non zero p<0,0001) o la risposta di recupero ad ogni singolo attacco di asfissia (Figura 5B-Eblu e il grafico blu estratto mostrato separatamente in 5B’-5E’). Questi risultati di controllo suggeriscono che le caratteristiche di risposta cardiorespiratoria dei cuccioli di topo P8 interagiscono in modo diretto, linearmente correlato, riflettendo una respirazione ben coordinata e il recupero della frequenza cardiaca, probabilmente importante per mantenere una perfusione adeguata. Al contrario nei cuccioli di Pet1-Di-CNO, la natura lineare di questa relazione appare disordinata(Figura 5A rosso ed estratto grafico rosso mostrato separatamente in 5A’, deviazione lineare del test di Run p< 0,0001, R2 = 0,73, e non zero pendenza p<0,0001), con il recupero di HR procedendo nei casi senza il grado di commisurato aumento della frequenza respiratoria f visto nei controlli. A guidare una parte di queste differenze sono i cuccioli Pet1-Di-CNO che vanno a morire (simboli rossi pieni di nero). A causa della loro futura mortalità, abbandonano gli attacchi successivi e come tali sono sotto campionamento quando tutti gli attacchi asfissianti vengono analizzati. Dato questo, abbiamo anche applicato il modello di regressione lineare ad ogni risposta di recupero degli attacchi asfissianti(Figura 5B-E” ). È interessante notare che, durante il recupero iniziale asfissia bout, abbiamo trovato che i cuccioli di Pet1-Di-CNO hanno una correlazione più debole tra τ HR e τ f (Figura5B rosso ed estratto trama rosso mostrato separatamente in 5B ‘correlazione p = 0,08, R2 = 0.17, deviazione lineare p=0,68), che differisce da controllo-Di-CNO cuccioli(Figura 5B blu e blu estratto grafico mostrato separatamente in 5B’ Run 5B’ Deviazione lineare di prova p = 0,76, R2 = 0,93, e non zero pendenza p<0,0001). Ciò è stato ulteriormente evidenziato dalle differenze di pendenza(Figura 5B p=0,001). Simile all’analisi di recupero che include tutti i bout, la nostra analisi delle risposte di recupero solo al primo bout ha mostrato che i cuccioli Pet1-Di-CNO che vanno a morire(Figura 5B e B” , simboli pieni di nero) avevano il massimo disaccoppiamento della cinetica di recupero HR e della respirazione f. È interessante notare che questo disaccoppiamento è meno evidente nella risposta di recupero ai bout #2 e #3, ma pronunciato di nuovo nel bout #4. Nel complesso, la perturbazione dei neuroni Pet1 può risultare in un disaccoppiamento dei componenti cardiaci e respiratori centrale per una risposta di auto-rianimazione robusta (esempi di tracciati illustrativi in Figura 5-figure supplement 1).
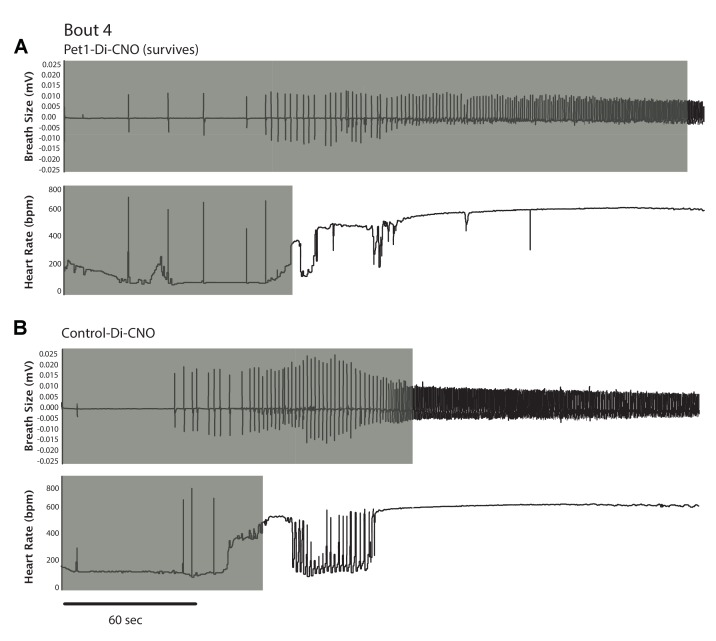
Figura 5-figure supplement 1.I cuccioliPet1-Di-CNOmostrano un disaccoppiamento dei tempi di recupero della frequenza cardiaca e della frequenza respiratoria. Tracce di esempio che mostrano le risposte differenziali di respirazione e di recupero dell’FC all’apnea indotta da asfissia in un cucciolo Pet1-Di-CNO(A) rispetto al controllo(B).(A-A” ) Traccia didispersione del recupero τ f (secondi, s) rispetto a τ HR (s) che include tutti i possibili recuperi di apnea di entrambi i gruppi, con i punti dati dei cuccioli Pet1-Di-CNO in rosso, e dei cucciolidi controlloDi-CNO in blu, sovrapposti per facilitare il confronto. Per maggiore chiarezza, i risultati di ciascun gruppo sono presentati separatamente in A’ , controllo-Di-CNO; e A” , Pet1-Di-CNO .Trame di dispersione simili, ma che includono solo i dati di recupero dal primo incontro di asfissia-apnea(B-B” ), dal secondo incontro (C-C” ),dalterzo incontro (D-D” ), e dalquarto incontro (E-E” ). Le linee solide riflettono una regressione lineare con linee tratteggiate che denota intervalli di confidenza del 95%. Le forme riempite di nero rappresentano gli attacchi fatali – diamante (circa 1), triangolo (circa 3), quadrato (circa 4). I cerchi riflettono i cuccioli che sono sopravvissuti a tutti gli attacchi. ** (p<0.01). I tracciati illustrativi della respirazione e del recupero delle risorse umane da un cucciolo Pet1-Di-CNOe da un cucciolo Control-Di-CNO sono presentati nella Figura 1, supplemento a 5 cifre.In ogni pannello(A, B), la traccia in alto riflette la risposta respiratoria espressa come il tracciato grezzo con millivolt (mV) che riflette la dimensione del respiro; la traccia in basso riflette l’HR in battiti al minuto (bpm). L’estensione in grigio riflette la durata del recupero per raggiungere il 63% del livello di base pre-bout.

Figura 4.Figura 4. L’attività del Pet1-neuroneche perturba fortemente l’attività del Pet1colpisce principalmente i componenti respiratori durante il recupero dell’apnea(A) Schema compresso della linea temporale del test di auto-rianimazione che indica gli attacchi di asfissia-apnea e le finestre di estrazione dati; le finestre aperte a’-d’ riflettono le misure di base specifiche dell’attacco, le finestre riempite a-d riflettono temporalmente quando il recupero al 63% dei valori della linea di base è stato determinato (τf e τ HR).(B e D)τf(B) o τ HR(D ) attraverso gli attacchi, con il rettangolo aperto ‘Fatalities’ sopra ogni grafico che denota gli animali morti durante il test; le forme contenute rappresentano l’attacco di apnea mortale – diamante (circa 1), triangolo (circa 3), quadrato (circa 4) – mentre il riempimento nero riflette la mortalità durante la risposta di recupero. Pet1-Di-CNO cuccioli indicati in rosso (n = 22), control-Di-CNO cuccioli(fratelli non-Di-espressori), in blu (n = 15).(C ed E) τf(C) o τ HR(E ) durante l’ultimo incontro recuperato (incontro finale durante il quale un cucciolo è stato in grado di raggiungere il 63% della caratteristica di base). Il riempimento nero continua a riflettere la mortalità, la forma riflette l’incontro che è stato fatale. Le forme piene di grigio riflettono gli animali che hanno recuperato il 63% della linea di base, anche se sono morti durante l’apnea, nonostante il rispetto dei criteri di τ HR. I cerchi tracciati riflettono i cuccioli che sono sopravvissuti a tutti gli attacchi; +indica la media; il grafico box-whisker mostra la mediana come linea orizzontale, il primoe il terzoquartile come ‘box’, e i valori massimo e minimo come ‘baffi’.

Figura 5-figure supplement 1.I cuccioliPet1-Di-CNOmostrano un disaccoppiamento dei tempi di recupero della frequenza cardiaca e della frequenza respiratoria.tracce di esempio che mostrano le risposte differenziali di respirazione e di recupero dell’FC all’apnea indotta da asfissia in un cucciolo Pet1-Di-CNO(A) rispetto al controllo(B).(A-A” ) Traccia didispersione del recupero τ f (secondi, s) rispetto a τ HR (s) che include tutti i possibili recuperi di apnea di entrambi i gruppi, con i punti dati dei cuccioli Pet1-Di-CNO in rosso, e dei cucciolidi controlloDi-CNO in blu, sovrapposti per facilitare il confronto. Per maggiore chiarezza, i risultati di ciascun gruppo sono presentati separatamente in A’ , controllo-Di-CNO; e A” , Pet1-Di-CNO .Trame di dispersione simili, ma che includono solo i dati di recupero dal primo incontro di asfissia-apnea(B-B” ), dal secondo incontro (C-C” ),dalterzo incontro (D-D” ), e dalquarto incontro (E-E” ). Le linee solide riflettono una regressione lineare con linee tratteggiate che denota intervalli di confidenza del 95%. Le forme riempite di nero rappresentano gli attacchi fatali – diamante (circa 1), triangolo (circa 3), quadrato (circa 4). I cerchi riflettono i cuccioli che sono sopravvissuti a tutti gli attacchi. ** (p<0.01). I tracciati illustrativi della respirazione e del recupero delle risorse umane da un cucciolo Pet1-Di-CNOe da un cucciolo Control-Di-CNO sono presentati nella Figura 1, supplemento a 5 cifre.In ogni pannello(A, B), la traccia in alto riflette la risposta respiratoria espressa come il tracciato grezzo con millivolt (mV) che riflette la dimensione del respiro; la traccia in basso riflette l’HR in battiti al minuto (bpm). L’estensione in grigio riflette la durata del recupero per raggiungere il 63% del livello di base pre-bout.

Figura 5-figure supplement 1.Tracce di esempio che mostrano la respirazione differenziale e le risposte di recupero dell’HR all’apnea indotta da asfissia in un cucciolo Pet1-Di-CNO(A) rispetto al controllo(B).In ogni pannello(A, B), la traccia in alto riflette la risposta respiratoria espressa come il tracciato grezzo con millivolt (mV) che riflette la dimensione del respiro; la traccia in basso riflette l’HR in battiti al minuto (bpm). L’estensione in grigio riflette la durata del recupero per raggiungere il 63% del livello di base pre-bout.
Caratteristiche di risposta al gasp dei cuccioli di Pet1-Di-CNO traccia con la mortalità
Poiché i cuccioli di Pet1-Di-CNO erano meno capaci di riprendersi da apnee ripetute, abbiamo cercato di determinare se particolari risposte cardiorespiratorie intorno ad un’apnea tracciata con la mortalità successiva. Abbiamo esaminato l’apnea indotta iniziale(Figura 4A riempito finestra a) in modo da concentrarsi su caratteristiche indipendenti dagli effetti di dimensioni successive associati ad apnee ripetute. Abbiamo trovato che i cuccioli di Pet1-Di-CNO che sono morti, rispetto ai fratelli di controllo-Di-CNO che sono sopravvissuti (14 di 15), hanno mostrato una risposta più disordinata gasp (Figura 6A) caratterizzata da un primo gasp più piccolo(Figura 6B, One-way ANOVA p = 0.047, test di confronto multiplo di Tukey post hoc p=0,04 per Pet1-Di-CNO muore e il controllo-Di-CNO sopravvive), una latenza più lunga a quel primo sussulto(Figura 6C, ANOVA unidirezionale p=0,013, test di confronto multiplo di Tukey post hoc p=0.02 per Pet1-Di-CNO sopravvive contro Pet1-Di-CNO muore, e p=0,02 per Pet1-Di-CNOmuore contro il controllo-Di-CNO), e intervalli inter-gasp prolungati(Figura 6D, Genotipo ANOVA bidirezionale ANOVA/sovravvivenza p< 0,0001, test di confronto multiplo dei mezzi di Tukey post hoc p< 0.0001 e p< 0,0001 per Pet1-Di-CNO muore contro il controllo-Di-CNO sopravvive, e Pet1-Di-CNO muore contro Pet1-Di-CNO sopravvive, rispettivamente) durante il recupero dalla prima apnea indotta da asfissia. Come misura indiretta dell’efficacia del gaspare, abbiamo esaminato l’aumento transitorio caratteristico dell’HR tra un gaspare e l’altro, necessario per il recupero dell’omeostasi. Anche in questo caso abbiamo osservato che i cuccioli di Pet1-Di-CNOche sono andati a morire avevano un HR medio più basso tra ogni gasp mentre il treno di gasp progrediva rispetto ai cuccioli Pet1-Di-CNO sopravvissuti e ai cuccioli di controlloDi-CNO(Figura 6E, genotipo a due vie ANOVA / sopravvivenza p=0,012 e interazione p=0.043, test di confronto multiplo post hoc Tukey p=0,042 e p=0,067 (intervallo gasp III) e p=0,044 e p=0,036 (intervallo gasp IV) per i cuccioli Pet1-Di-CNO muore contro il controllo-Di-CNO sopravvive, e Pet1-Di-CNO muore contro Pet1-Di-CNO sopravvive, rispettivamente). Questi risultati suggeriscono che le caratteristiche di gasp dei cuccioli di Pet1-Di-CNO che sono andati a morire non erano così efficaci nell’aumentare le risorse umane. Così, ansimare in modo disordinato dopo il primo attacco di apnea associato ad un aumento del rischio di mortalità futura intorno alle successive sfide di asfissia-apnea.

Figura 6-figure supplemento 2.Figura 6—supplemento alla figura 2. I cuccioli diPet1-Di-CNOdimostrano una risposta disordinata al bout iniziale asfissiante e all’apnea indotta.Variabilità per l’intervallo di interbreath dell’aria della stanza di base nei cuccioli di Control-Di e Pet1-Di prima e durante l’esposizione al CNO.Variabilità per l’intervallo di interbreath dell’aria della stanza di base nei cuccioli di Control-Di e Pet1-Di prima e durante l’esposizione al CNO.(A) Tracce respiratorie di esempio immediatamente dopo la prima apnea indotta da asfissia: traccia superiore, da un cucciolo Pet1-Di-CNO che continua a morire durante un successivo incontro; traccia inferiore, da un cucciolo Control-Di-CNO (non-Di-expressor). Sono illustrate le differenze nelle caratteristiche di gasp e nei componenti che sono tracciate in B-D.(B) Prima dimensione del gasp (normalizzato al peso corporeo).(C) Tempo al primo sussulto durante l’apnea iniziale. (D) Differenza di tempo (s, secondi) tra gli intervalli di gasp. (E) Frequenza cardiaca media (HR) tra gli intervalli di gasp.(F) Equivalenti ventilatori di base per ossigeno, V˙E/V˙O2, prima della somministrazione di CNO in relazione al genotipo accoppiato con l’esposizione a CNO (perturbazione neuronale) e il test di sopravvivenza. Abbreviazioni: (I-IV) – differenza di tempo (s) tra la 1a e la2a (I), la 2a e la3a (II), la 3a e la4a (III), o la 4a e la5a (IV) ansima, rispettivamente. Rosso * o staffa confronta i cuccioli Pet1-Di-CNO che vanno a morire contro i cuccioli Pet1-Di-CNO che sopravvivono. Blu * o staffa confronta i cuccioli di Pet1-Di-CNO che muoiono contro i cuccioli di controllo-Di-CNO che sopravvivono. Forme che rappresentano l’incontro fatale – diamante (circa 1), triangolo (circa 3), quadrato (circa 4). I cerchi rappresentano i cuccioli che sono sopravvissuti a tutti gli attacchi. * (p<0,05) e **** (p< 0,0001). Variabilità della respirazione di base e HR pre- versus durante l’esposizione CNO (prima di qualsiasi sfida asfittica-apnea) per Pet1-Di e controllo-Di cuccioli è analizzato in Figura 6-figure supplemento 1 e Figura 6-figure supplemento 2, rispettivamente.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotta da asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per i topi Pet1-Di(A’ e B’ anche quando si limitano le analisi agli animali morti) sono state rilevate differenze significative prima e durante l’esposizione al CNO.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotta da asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per entrambi i genotipi non sono state rilevate differenze significative prima e durante l’esposizione al CNO.

Figura 6-figure supplemento 2.Figura 6—supplemento alla figura 2.Pet1-Di-CNOcuccioli dimostrano una risposta gasp disordinata al bout asfissiante iniziale e apnea indotta.Variabilità per l’intervallo di interbreath aria ambiente di base in Control-Di e Pet1-Di cuccioli prima e durante l’esposizione CNO.Variabilità per l’intervallo di interbreath aria ambiente di base in Control-Di e Pet1-Di cuccioli prima e durante l’esposizione CNO.(A) Tracce respiratorie di esempio immediatamente dopo la prima apnea indotta da asfissia: traccia superiore, da un cucciolo Pet1-Di-CNO che continua a morire durante un successivo incontro; traccia inferiore, da un cucciolo Control-Di-CNO (non-Di-expressor). Sono illustrate le differenze nelle caratteristiche di gasp e nei componenti che sono tracciate in B-D.(B) Prima dimensione del gasp (normalizzato al peso corporeo).(C) Tempo al primo sussulto durante l’apnea iniziale. (D) Differenza di tempo (s, secondi) tra gli intervalli di gasp. (E) Frequenza cardiaca media (HR) tra gli intervalli di gasp.(F) Equivalenti ventilatori di base per ossigeno, V˙E/V˙O2, prima della somministrazione di CNO in relazione al genotipo accoppiato con l’esposizione a CNO (perturbazione neuronale) e il test di sopravvivenza. Abbreviazioni: (I-IV) – differenza di tempo (s) tra la 1a e la2a (I), la 2a e la3a (II), la 3a e la4a (III), o la 4a e la5a (IV) ansima, rispettivamente. Rosso * o staffa confronta i cuccioli Pet1-Di-CNO che vanno a morire contro i cuccioli Pet1-Di-CNO che sopravvivono. Blu * o staffa confronta i cuccioli di Pet1-Di-CNO che muoiono contro i cuccioli di controllo-Di-CNO che sopravvivono. Forme che rappresentano l’incontro fatale – diamante (circa 1), triangolo (circa 3), quadrato (circa 4). I cerchi rappresentano i cuccioli che sono sopravvissuti a tutti gli attacchi. * (p<0,05) e **** (p< 0,0001). Variabilità della respirazione di base e HR pre- versus durante l’esposizione CNO (prima di qualsiasi sfida asfittica-apnea) per Pet1-Di e controllo-Di cuccioli è analizzato in Figura 6-figure supplemento 1 e Figura 6-figure supplemento 2, rispettivamente.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotta da asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per i topi Pet1-Di(A’ e B’ anche quando si limitano le analisi agli animali morti) sono state rilevate differenze significative prima e durante l’esposizione al CNO.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotta da asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per entrambi i genotipi non sono state rilevate differenze significative prima e durante l’esposizione al CNO.
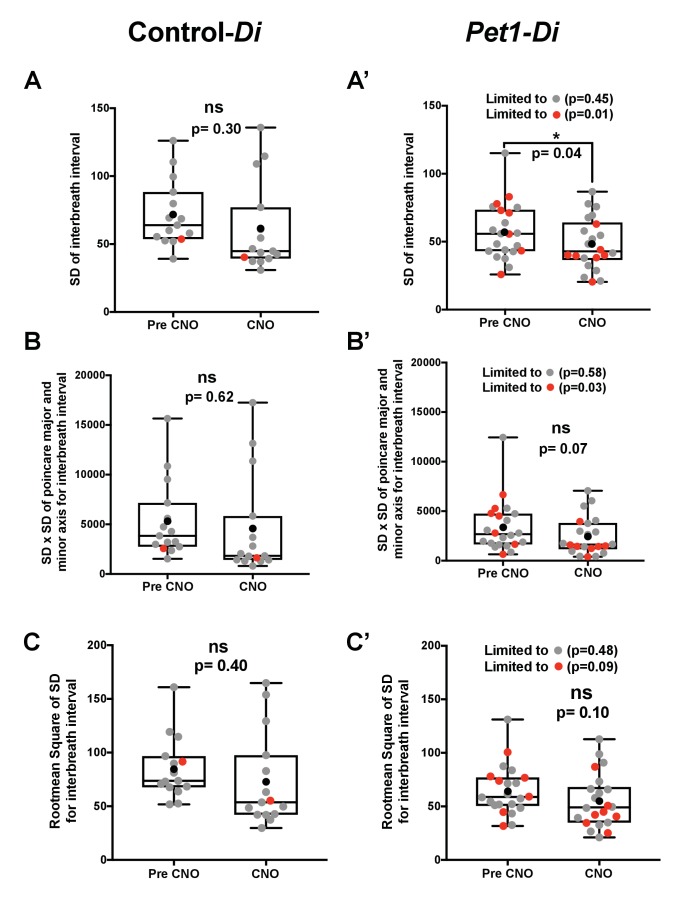
Figura 6-figure supplemento 1.Figura 6—supplemento figura 1. Variabilità per l’intervallo di interbreath dell’aria della stanza di base in Control-Di e Pet1-Di cuccioli prima e durante l’esposizione a CNO.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotte dall’asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per i topi Pet1-Di(A’ e B’ anche quando si limitano le analisi agli animali morti) sono state rilevate differenze significative prima e durante l’esposizione al CNO.

Figura 6-figure supplemento 2.Figura 6—supplemento di figura 2. Variabilità per l’intervallo di interbattimento dell’aria della stanza di base in Control-Di e Pet1-Di cuccioli prima e durante l’esposizione a CNO.(A-C)Cuccioli Control-Di; (A‘-C’ ) Cuccioli Pet1-Di; i punti grigi riflettono i cuccioli che sono sopravvissuti a tutte e quattro le sfide di apnea indotte dall’asfissia; i punti rossi, cuccioli morti durante il test; i punti neri riflettono la media; il grafico box-whisker mostra la mediana come linea orizzontale, il 1° e il 3° quartile come ‘box’, e i valori massimo e minimo come ‘baffi’.La variabilità espressa come (A, A‘ ) la deviazione standard (SD) dell’intervallo di interbeat, (B, B’) il prodotto della lunghezza per la larghezza della distribuzione del grafico Poincare, e (C, C’ )il quadratomedio delle differenze successive (RMSSD). Per entrambi i genotipi non sono state rilevate differenze significative prima e durante l’esposizione al CNO.
Caratteristiche omeostatiche prima della perturbazione acuta Pet1-neurone e probabilità di rischio di mortalità
Per determinare se particolari caratteristiche omeostatiche di base hanno aumentato la probabilità di mortalità futura quando ci si trova ad affrontare una sfida asfissiante di fronte all’inibizione acuta di Pet1-neuroni, abbiamo eseguito analisi logistiche di regressione utilizzando come variabile indipendente l’HR di base, V˙E, V˙O2, o V˙E/V˙O2 (punti di dati ottenuti dal punto temporale indicato dalla finestra aperta a, Figura 1G ) e l’esito dell’auto-rianimazione– morte contro sopravvivenza – come variabili dipendenti. Questo approccio ci permetterebbe di rendere conto dello stato della rete omeostatica prima della perturbazione acuta. Di queste variabili di input, solo V˙E/V˙O2resulted in un rapporto di probabilità statisticamente significativo (Tabella 2,p=0.027, rapporto di probabilità di 1.399), con valori più alti per V˙E/V˙O2 correlati con l’aumento del rischio di morte futura nei cuccioli di Pet1-Di-CNO. Non sono state trovate differenze tra V˙E/V˙O2 valori medi e valori di varianza tra i cuccioli Pet1-Di-CNO e control-Di-CNO(p=0,128 e p=0,392, rispettivamente). Quando i cuccioli di Pet1-Di-CNO sono separati dalla mortalità, osserviamo analogamente che i cuccioli di Pet1-Di-CNOche vanno a morire hanno una V˙E/V˙O2when significativamente più alta rispetto aicuccioli di controlloDi-CNO che sopravvivono (Figura 6F, ANOVA asenso unico p=0,018 con il test di confronto multiplo di Tukey p=0,01). Così, l’inibizione dei neuroni di Pet1 nei cuccioli di topo il cui valore di base V˙E/V˙O2 risiede all’estremità superiore della distribuzione V˙E/V˙O2, aumenta la probabilità che essi continuino a morire quando si trovano di fronte a ripetute apnee indotte da asfissia.
| Caratteristica di base | Rapporto di probabilità | Intervallo di fiducia | p-valore* | |
|---|---|---|---|---|
| Frequenza cardiaca | 1.017 | 0.994 | 1.040 | 0.15 |
| Ventilazione | 1.001 | 0.999 | 1.004 | 0.38 |
| Consumo massimo di ossigeno | 0.965 | 0.907 | 1.026 | 0.25 |
| Equivalenti ventilatori | 1.399 | 1.039 | 1.883 | 0.027 |
Abbiamo anche esplorato la variabilità della respirazione di base(Figura 6-figure supplement 1) e HR (Figura 6-figure supplement 2) pre- versus durante l’esposizione CNO (prima di qualsiasi sfida asfittica-apnea) per Pet1-Di e controllo-Di cuccioli valutando la deviazione standard (SD) degli intervalli interbreath e interbeat, l’asse SDxSD di Poincare prima trama di ritorno per l’intervallo interbreath e interbeat, e il quadrato medio radice delle differenze successive (RMSSD). Risultati significativi sono stati limitati ai parametri di intervallo interbreath, in particolare per Pet1-Di cuccioli di Pet1-Di pre- versus durante l’esposizione al CNO che andrebbe a morire nel saggio(Figura 6-figure supplement 1), con l’esposizione al CNO (e quindi Pet1 perturbazione neuronale perturbazione) che si associa ad una diminuzione della SD e la diminuzione dell’area stimata del grafico di primo ritorno Poincare, entrambi suggeriscono una diminuzione della variabilità dell’intervallo interbreath nel dominio del tempo.
Discussione
Strategia
L’omeostasi cardiorespiratoria coinvolge i circuiti neurali centrali e periferici che lavorano in concerto per percepire e rispondere alle condizioni tissutali di ipercapnia, ipossia e acidosi. Questi circuiti nei neonati sono di nuova attivazione per la vita ex utero, compreso il recupero da apnee, che si verificano più frequentemente durante l’infanzia. Sulla base di recenti modelli di topo genetici che implicano l’espressione di neuroni serotoninergici Pet1 nell’omeostasi cardiorespiratoria(Barrett et al., 2016; Brust et al., 2014; Cummings et al., 2011a; Cummings et al., 2013; Erickson e Sposato, 2009; Erickson et al., 2007; Ray et al., 2011), abbiamo ipotizzato che anche nei neonati Pet1 i neuroni giocano un ruolo importante e in tempo reale, anche nella risposta di recupero alle apnee. Per testare questo senza ambiguità associata a perturbazioni croniche e di sviluppo e ad eventi compensativi potenzialmente nascosti(Barrett et al., 2016; Erickson et al., 2007; Erickson e Sposato, 2009), abbiamo applicato una strategia di inibizione neuronale acuta inducibile, che prevede l’espressione mirata di hM4Di nei neuroni Pet1, come si è ottenuto nei cuccioli di Pet1-Flpe, RC-FDi, con il cognato ligando CNO iniettato per via intraperitoneale a P8 per innescare l’inibizione neuronale Pet1. In presenza o meno di questa perturbazione acuta, abbiamo saggiato la funzione cardiorespiratoria al basale e durante l’induzione dell’apnea e il recupero, quest’ultimo permette di esplorare la risposta del respiro e la capacità di ripristinare rapidamente la respirazione eufneica e HR.
Principali risultati
Tra i risultati significativi vi sono i seguenti: (1) Le ripetute apnee indotte da asfissia durante l’esposizione al CNO hanno portato ad una maggiore frequenza di auto-rianimazione fallita nei cuccioli Pet1-Di-CNO(7 di 22 cuccioli Di-espressivi) rispetto ai cuccioli di controlloDi-CNO (1 di 15 cuccioli non-Di-espressivi, RC-FDi-harboring). (2) La funzione cardiorespiratoria dell’aria della stanza di base (V˙E e HR) è stata modestamente ma statisticamente significativamente alterata a seguito di una perturbazione acuta, CNO-Di-mediata dei neuroni Pet1 nei cuccioli P8 (cuccioli Pet1-Di-CNO); questo contrasta con i controlli dei fratelli trattati con CNO (cuccioli control-Di-CNO) che non hanno mostrato cambiamenti rilevabili in queste proprietà di base. I risultati suggeriscono che i neuroni Pet1 possono normalmente consentire una maggiore gamma dinamica cardiorespiratoria, che si restringe su Pet1-neuroni inibizione. (3) Pet1-Di-CNOcuccioli durante il loro ultimo combattimento asfissiante recuperato apnea indotta, sia il saggio, compreso il quarto combattimento (per i cuccioli che sono sopravvissuti) o il combattimento appena prima del combattimento fatale fallito, ha richiesto molto più tempo per recuperare al 63% della respirazione eupneica pre-bout di base rispetto ai controlli. (4) In contrasto con la compromissione del recupero respiratorio che caratterizza i cuccioli Pet1-Di-CNO, il tempo di recupero delle risorse umane al 63% della linea di base pre-bout era indistinguibile da quello dei cuccioli di controllo-Di-CNO. (5) Una relazione lineare tra FC e recupero respiratorio ƒ è stata osservata nella risposta di auto-rianimazione dei cuccioli di controlloDi-CNO, ma è stata disaccoppiata nei cuccioli di Pet1-Di-CNO. (6) La risposta al gasp iniziale, sopravvissuto alla sfida apneica iniziale, è stata disordinata nei cuccioli Pet1-Di-CNOche sarebbero andati a morire durante una successiva apnea; il primo gasp era più piccolo, la latenza al primo gasp più lungo, inter-gasp intervalli prolungati, e l’aumento di HR è diventato più piccolo con il progredire del treno di gasp. (7) I cuccioli che mostravano una modesta iperventilazione – all’interno dell’estremità alta della distribuzione prima di qualsiasi perturbazione neuronale – avevano una maggiore probabilità di fallimento auto-rianimazione se sottoposti ai fattori di stress combinati di inibizione acuta Pet1-neuroni e sfida apneica.
Pet1 neuroni forma i neuroni neonatali P8 cardiorespiratorio omeostatico set point omeostatico e gamma dinamica
Qui forniamo la prova attraverso la perturbazione neuronale selettiva e, importante, acuta per sostenere l’ipotesi che i neuroni Pet1 a P8 giocano un ruolo attivo nel plasmare il set point omeostatico cardiorespiratorio neonatale e la capacità di montare una robusta risposta di auto-rianimazione. Abbiamo esplorato per la prima volta le proprietà cardiorespiratorie di base dei cuccioli di topo P8 e se sono cambiati a seguito di perturbazione acuta dei neuroni Pet1. I valori cardiorespiratori iniziali erano indistinguibili tra i cuccioli Pet1-Di-espressivi(Pet1-Flpe, RC-FDi doppi transgenici) e i controlli dei fratelli (RC-FDi singoli transgenici)(Tabella 1) che suggeriscono la neutralità relativa intorno all’espressione del recettore Di non innescato nei neuroni Pet1. Dopo la somministrazione di CNO, Di-espressione doppia transgenica esposto cambiamenti cardiorespiratori, in particolare una diminuzione complessiva, anche se sottile, in V˙E e HR (Figura 2A,A’ e B,B’ , rispettivamente). Ciò è coerente con i neuroni Pet1 che svolgono un ruolo attivo nei neonati nel mantenimento del tono respiratorio e cardiaco.
Studi precedenti che coinvolgevano l’interruzione cronica dello sviluppo dei neuroni Pet1 hanno mostrato solo una diminuzione delle risorse umane di P8, con livelli di V˙E indistinguibili dalla coorte di controllo (Barrettet al., 2016; Cummings et al. , 2011a; Cummings et al., 2013). Questa mancanza di effetto rilevabile V˙E in condizioni di perturbazione cronica Pet1-neuroni potrebbe riflettere la plasticità del circuito di compensazione intorno alla ventilazione, ma che si verifica in misura minore intorno al controllo delle risorse umane. E ‘anche possibile che l’approccio inducibile, perturbazione neuronale acuta offre una maggiore sensibilità e quindi la capacità di scoprire fenotipi più estesi: come applicato in questo caso, ha permesso a ciascun animale di servire come proprio controllo, consentendo il confronto all’interno di animali all’interno di misure pre e durante la perturbazione, riducendo al minimo la variabilità tra gli animali. Un ulteriore vantaggio dell’approccio di perturbazione inducibile è che la variazione del peso corporeo tra i cuccioli è stata trascurabile, riducendo la variabilità tecnica associata all’acquisizione di misurazioni pletismografiche su cuccioli particolarmente piccoli; al contrario, le perturbazioni croniche dello sviluppo dei neuroni di Pet1 si traducono in una crescita ridotta e in una diminuzione del peso corporeo(Barrett et al., 2016; Cummings et al., 2011a; Cummings et al., 2013; Erickson et al., 2007; Pelosi et al., 2014; Yang e Cummings, 2013).
Anche univocamente scoperto utilizzando un approccio di manipolazione inducibile è stata la scoperta che lo stato V˙E dell’animale prima della manipolazione monitorato con la dimensione del cambiamento V˙E durante la perturbazione. Inoltre, abbiamo osservato che la perturbazione dell’attività dei neuroni di Pet1 ha portato ad una regressione verso un comune set point V˙E. Questo può indicare che l’attività del neurone Pet1 è un componente importante che permette lo stato di eccitazione interna dell’animale per alterare VE in preparazione per un fattore di stress che richiede una maggiore ventilazione. Collettivamente, i nostri risultati di HR diminuito e V˙E immediatamente dopo CNO-Di-mediata perturbazione mediata CNO dei neuroni Pet1 fornisce la prova che, anche senza un fattore di stress esterno come l’asfissia indotta da apnea o l’esposizione a CO2, i topineonatali utilizzano i neuroni Pet1 per formare un set point omeostatico.
Baseline V˙O2 misure sono state meno semplici, mostrando in entrambi i genotipi una sottile diminuzione a seguito di CNO e ritorno alla camera pletismografica. Si ipotizza che questo effetto non specifico di V˙O2 rifletta il rilassamento e l’assuefazione alla camera in questo punto temporale avanzato del saggio con conseguente sottile abbassamento del tasso metabolico. Potrebbe anche riflettere la sfida molto reale nella misurazione accurata V˙O2 (rispetto agli altri parametri cardiorespiratori) per questi piccoli cuccioli di topo e/o riflettere un modesto effetto del CNO stesso (indipendente dall’espressione Di [Gomezet al., 2017; Manvich et al., 2018]) sul tasso metabolico del cucciolo P8.
La perturbazione acuta dei neuroni di Pet1 perturba la normale risposta dell’apnea nei neonati
Non solo le proprietà cardiorespiratorie di base sono state influenzate nei neonati P8 a seguito di un’interruzione acuta dell’attività del Pet1-neurone, ma anche e più sorprendentemente la capacità di auto-riuscitare da ripetute apnee indotte da asfissia. La mortalità è stata aumentata in modo significativo e l’auto-rianimazione è stata prolungata lungo tutta la catena del dosaggio delle sfide apnee. Così, la risposta neonatale di recupero omeostatico sembra richiedere attivamente la funzione Pet1-neurone per la robustezza di supporto vitale, con la morte in ~ 32% dei cuccioli di Pet1-Di-CNO rispetto al ~7% dei cuccioli di controllo-Di-CNO. Precedenti studi sulla perturbazione cronica dello sviluppo(Barrett et al., 2016; Cummings et al., 2011a), pur determinando un simile aumento della mortalità al P8, non sono stati in grado di risolvere temporalmente se l’attività del Pet1-neurone fosse richiesta durante l’embriogenesi per la più ampia istituzione del circuito di auto-rianimazione o se fosse effettivamente richiesta al P8 come partecipante fondamentale nella risposta omeostatica. I risultati attuali indicano la partecipazione attiva al P8, rivelando un componente attivo nel circuito omeostatico neonatale e informando i possibili interventi per mitigare il rischio di fallimento dell’auto-rianimazione.
Un’ulteriore scoperta sorprendente nei cuccioli di Pet1-Di-CNO è stata che i deficit nella sola risposta di recupero respiratorio, senza disfunzioni altrettanto precoci e gravi nel recupero cardiaco, erano sufficienti ad aumentare la mortalità dopo un’apnea(Figure 4 e 5). Questo disaccoppiamento della risposta di recupero della frequenza cardiaca e della risposta di recupero respiratorio suggerisce la segregazione nel circuito sottostante e la sua modulazione da parte dei neuroni Pet1 a P8, basandosi sulla segregazione dei fenotipi tra perturbazione cronica e acuta Pet1-neuronedescritta sopra. L’interruzione di questo legame tra le risposte respiratorie e cardiache contribuisce probabilmente all’aumento della mortalità. In particolare, l’innalzamento continuo dell’HR nell’impostazione non supportiva dell’ipossia non risolta è stato dimostrato in altri modelli per aumentare la mortalità(Scremin et al., 1980); condizioni simili possono verificarsi nei cuccioli di Pet1-Di-CNO quando il recupero produttivo e la ventilazione sono in ritardo e fuori sincronia con il recupero dell’HR.
Le caratteristiche di risposta iniziale sono correlate con la futura mortalità dovuta all’apnea
Mentre l’insuccesso o il prolungamento dell’auto-rianimazione ha caratterizzato in ultima analisi la maggior parte dei cuccioli Pet1-Di-CNO, nel combattimento iniziale asfissia-apnea quasi tutti recuperati, il che ci ha permesso di chiederci se ci fossero caratteristiche di quella prima risposta di recupero che erano specifiche per i cuccioli che alla fine sono morti durante una delle successive sfide di apnea. In effetti, abbiamo trovato differenze discrete e misurabili nella risposta ansimante alla prima sfida di apnea, rispetto ai controlli: un primo sussulto più piccolo, una latenza prolungata al primo sussulto, intervalli inter-gasp più lunghi. Un’interpretazione è che una risposta iniziale non ottimale al primo gasp, con le associate condizioni estese di scarsa ossigenazione nonostante il recupero finale dell’apnea, può mettere in moto una qualche carenza cellulare che poi predispone alla mortalità durante una prossima apnea. Inoltre, i nostri risultati indicano che questi gaspi compromessi non sono in grado di innescare lo stesso tipo di recupero della frequenza cardiaca durante il tentativo iniziale di recupero dell’apnea, anche se la tempistica complessiva per il recupero del 63% delle risorse umane non è compromessa. Suggeriamo che la risposta iniziale subottimale del gasp può essere indicativa di un fallimento intrinseco della risposta respiratoria più ampia, non solo della risposta del gasp, con questo fallimento più ampio il risultato di perturbazione acuta Pet1-neuroni, che in ultima analisi aumenta il rischio di mortalità in caso di esposizione a stress da apnea asfissiante. Data l’alta frequenza di apnee tra i neonati umani(Daily et al., 1969; Kelly et al., 1985; Southall et al., 1980), la misurazione del recupero dell’apnea (dimensione del respiro, tempistica, HR tra i gasp, e la respirazione e l’accoppiamento della frequenza cardiaca) potrebbe essere un potenziale indicatore di disfunzione del rafe neurone e la necessità di un monitoraggio mirato del neonato durante l’età di picco per il rischio di SIDS di 2-4 mesi.
Oltre ad identificare le caratteristiche iniziali di risposta al gasp che contraddistinguono i cuccioli morti per esposizione ad apnee multiple, abbiamo anche identificato lo stato omeostatico di modesta iperventilazione – V˙E/V˙O2 all’estremità superiore della distribuzione – come un aumento del rischio di morte nei cuccioli sfidati con i fattori di stress combinati di disfunzione acuta Pet1-neurone e apnee ripetute. Quando all’estremità superiore della distribuzione di V˙E, i fattori normalmente forti di ansimazione, frequenza cardiaca e recupero della frequenza respiratoria – cioè l’aumento della PCO2 e la diminuzione della PO2– sono neutralizzati perché questi cuccioli al livello di base sono sempre in uno stato di modesto eccesso di respirazione e quindi relativamente ipocapnici e iperossici, tanto che sarebbero necessarie condizioni apneiche più gravi per innescare la risposta respiratoria. Questo potrebbe quindi contribuire all’insufficiente risposta al gasp, che nonostante il cucciolo abbia iniziato con una V˙E/V˙O2 elevata, potrebbe portare ad un’ipossiemia più grave a causa delle HR e del disaccoppiamento della frequenza respiratoria nell’impostazione della disfunzione del Pet1-neurone, con conseguente diminuzione della capacità di resistere a future apnee (Figura 7). In controllo, i cuccioli di tipo selvaggio, la ridondanza nella risposta respiratoria può consentire risposte omeostatiche sufficientemente robuste nonostante l’iperventilazione così modesta da resistere ad apnee ripetute; tuttavia, se contemporaneamente alla disfunzione del Pet1-neurone, può non essere più possibile montare la necessaria risposta vitale(Figura 7C). Tale vulnerabilità può essere esacerbata durante il sonno attivo contro il sonno tranquillo, come recentemente suggerito da studi in Tph2-/- cuccioli di ratto(Magnusson e Cummings, 2018; Young et al., 2017). Inoltre, vale la pena di notare che i neuroni midollari Pet1 proiettano verso centri del tronco encefalico rilevanti per il controllo cardiorespiratorio, come il complesso pre-Bötzinger con il suo ruolo nel ritmo respiratorio e nell’elaborazione chemio-sensoriale, il nucleo ambiguo che ospita i neuroni cardiovagali, e il nucleo del tratto solitario, un importante sito di integrazione del chemoreflex (periferico e centrale) (Brustet al., 2014; Feldman et al., 2003; Hennessy et al., 2017; Hodges e Richerson, 2010; Wang e Richerson, 1999).
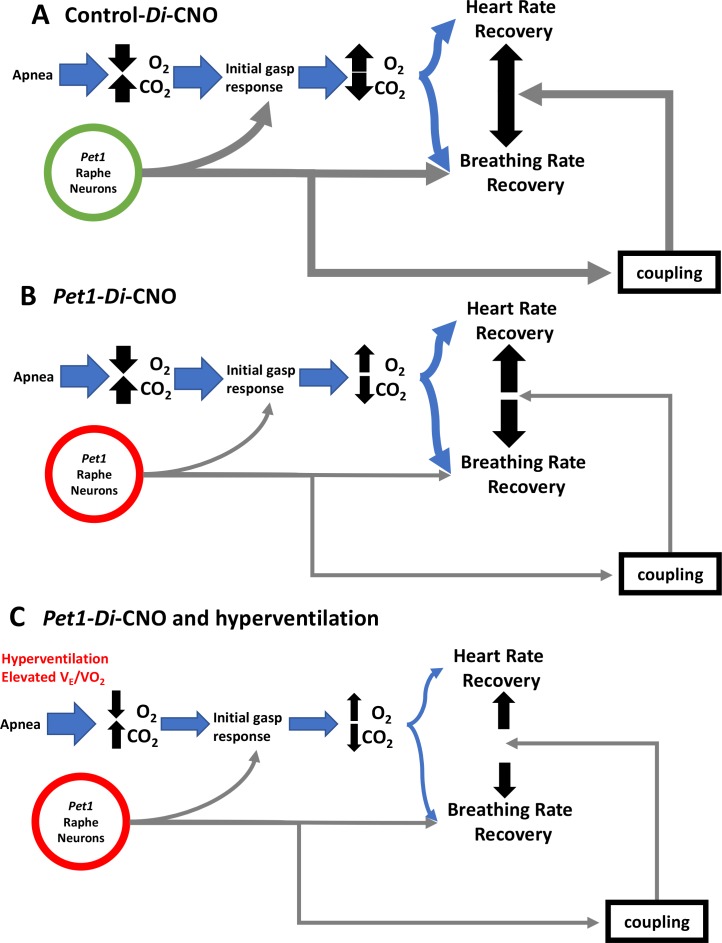
Figura 7.Figura 7. Proposta di coinvolgimento di Pet1-neuroni nella risposta post-neonatale di auto-rianimazione alle apnee.(A) Nei cuccioli di controllo (non combinati RC-FDi allele harboring, non-Di expressors esposti a CNO), un apnea (con bradicardia associata) porterebbe a sangue / tessuto ossigeno tensione (PO2) riduzione della tensione di ossigeno (PO2) e la tensione di anidride carbonica(PCO2) elevazione, che a sua volta stimolerebbe l’attività dei neuroni del rafe Pet1 insieme ad altre aree del tronco encefalico per innescare il boccheggiamento, con conseguente innalzamento omeostatico del PO2e riduzione del PCO2, consentendo il recupero della frequenza cardiaca e respiratoria, che si verifica in modo lineare, ripristinando in ultima analisi i livelli di PO2e PCO2che supportano la vita.(B) Nei cuccioli Pet1-Di-CNOin cui i neuroni Pet1 sono fortemente perturbati, la risposta iniziale al respiro è disordinata e diminuita, così come il recupero della frequenza respiratoria, che diventa disaccoppiato dalla più normale traiettoria di recupero della frequenza cardiaca. Collettivamente questo porta a livelli di PO2e PCO2 prolungati e potenzialmente pericolosi per la vita.(C) Peggiora ancora quando le condizioni spontanee di iperventilazione (V˙E/V˙O2) si accoppiano con la perturbazione neuronale Pet1. Il doppio insulto si traduce in una diminuzione della spinta collettiva attraverso Pet1 e altri tipi di neuroni, con conseguente maggiore compromissione del respiro e un più grave disaccoppiamento delle risposte di recupero della respirazione e della frequenza cardiaca, aumentando significativamente la probabilità di rischio di morte.

Figura 7.Figura 7. Coinvolgimento proposto di Pet1-neuroni nella risposta post-neonatale di auto-rianimazione alle apnee.(A) Nei cuccioli di controllo (non combinati RC-FDi allele harboring allele, non-Di expressors esposti a CNO), un apnea (con bradicardia associata) porterebbe a sangue / tessuto tensione di ossigeno (PO2) riduzione della tensione di ossigeno (PO2) e la tensione di anidride carbonica(PCO2) elevazione, che a sua volta stimolerebbe l’attività dei neuroni del rafe Pet1 insieme ad altre aree del tronco encefalico per innescare il boccheggiamento, con conseguente innalzamento omeostatico del PO2e riduzione del PCO2, consentendo il recupero della frequenza cardiaca e respiratoria, che si verifica in modo lineare, ripristinando in ultima analisi i livelli di PO2e PCO2che supportano la vita.(B) Nei cuccioli Pet1-Di-CNOin cui i neuroni Pet1 sono fortemente perturbati, la risposta iniziale al respiro è disordinata e diminuita, così come il recupero della frequenza respiratoria, che diventa disaccoppiato dalla più normale traiettoria di recupero della frequenza cardiaca. Collettivamente questo porta a livelli di PO2e PCO2 prolungati e potenzialmente pericolosi per la vita.(C) Peggiora ancora quando le condizioni spontanee di iperventilazione (V˙E/V˙O2) si accoppiano con la perturbazione neuronale Pet1. Il doppio insulto si traduce in una diminuzione della spinta collettiva attraverso Pet1 e altri tipi di neuroni, con conseguente maggiore compromissione del respiro e un più grave disaccoppiamento delle risposte di recupero della respirazione e della frequenza cardiaca, aumentando significativamente la probabilità di rischio di morte.
Conclusioni
In sintesi, abbiamo scoperto che i neuroni di Pet1 giocano un ruolo attivo nei cuccioli di topo P8 nel mantenere il tono cardiorespiratorio e nel supportare risposte di auto-rianimazione robuste e vitali alle apnee indotte dall’asfissia. Quando i neuroni di Pet1 sono stati gravemente compromessi, V˙E è diminuito, l’HR ha rallentato e il fallimento dell’auto-rianimazione è aumentato. L’insufficienza respiratoria più che il recupero cardiaco è stata compromessa, causando una disorganizzazione del normale rapporto lineare tra respirazione ƒ e FC. Inoltre, anomalie iniziali anormalità ansimanti distingueva i cuccioli Pet1-neuroni-compromessi che sono andati a morire durante le apnee successive, così come modesta iperventilazione basale. Collettivamente, questi risultati gettano nuova luce sui sistemi di controllo cardiorespiratorio e, più specificamente, supportano un potenziale ruolo patogenetico per il ritrovamento post-mortem di anomalie neuronali del tronco encefalico 5-HT associate alla SIDS. Inoltre, suggeriscono che le caratteristiche del gasp potrebbero potenzialmente aiutare a definire un profilo fisiologico associato ad una maggiore probabilità di rischio per la SIDS.
Materiali e metodi
| Tipo di reagente (specie) o risorsa | Designazione | Fonte o riferimento | Identificatori | Ulteriori informazioni |
|---|---|---|---|---|
| Reagente genetico(M. musculus) | Pet1-Flpe | PMID: 18344997 | Dr. Susan Dymecki (Dipartimento di Genetica, Harvard Medical School) | |
| Reagente genetico(M. musculus) | RC-FDi Gt(ROSA)26Sortm(CAG-FSF-CHRM4*(Di))Dym | PMID: 21798952 | derivato di MGI:5790683 Gt(ROSA)26Sortm9(CAG-mCherry,-CHRM4*)Dym | Dr. Susan Dymecki (Dipartimento di Genetica, Harvard Medical School) |
| Anticorpo | Coniglio policlonale anti-Tph2 | Novus Biologico | Cat. #: NB100-74555 RRID:AB_1049988 | IHC (1:1000) |
| Anticorpo | Ratto monoclonale anti-HA | Chromotek | Cat. # 7C9 RRID: AB_2631399 | IHC (1:200) |
| Anticorpo | Capra policlonale anti-5-HT | Abcam | Cat. # ab66047 RRID:AB_1142794 | IHC (1:1000) |
| Anticorpo | Ciuchino anti-coniglio IgG-Alexa Fluor 488 | ThermoFisher Scientific | Cat. # A-21206 RRID:AB_2535792 | IHC (1:500) |
| Anticorpo | Donkey anti-ratto IgG-Alexa Fluor 594 | ThermoFisher Scientific | Cat. # A-21209 RRID:AB_2535795 | IHC (1:500) |
| Anticorpo | Ciuchino anti capra igG-Alexa Fluor 647 | ThermoFisher Scientific | Cat. # A-21447 RRID:AB_2535864 | IHC (1:500) |
| Reagente DNA ricombinante | Primer per la flangiatura in avanti | 5′-GCATCTGGGAGATCACACTGAG-3′. | Genotipizzazione PCR | |
| Reagente DNA ricombinante | Primer invertitore a flangiatura | 5′-CCCATTCCATCCATGCGGGGTATT-3”. | Genotipizzazione PCR | |
| Reagente DNA ricombinante | FDi forward primer | 5′-CGAATTCGGAAACATAACTTTTCG-3”. | Genotipizzazione PCR | |
| Reagente DNA ricombinante | Primer invertito FDi | 5′-GGCAATGAATGAAGTTTTTCCACCCCO-3”. | Genotipizzazione PCR | |
| Composto chimico, farmaco | clozapina N-ossido (CNO) | Sigma | Cat. # C0832 | soluzione madre fresca 1 mg/ml in soluzione salina |
| Composto chimico, farmaco | DAPI (4′, 6-diamidino-2-fenilindolo) | ThermoFisher Scientific | Cat. # D1306 | colorazione del contatore nucleare, concentrazione finale a 5 µg/mL |
Approvazione etica
Tutti i protocolli sperimentali sono stati approvati presso la Harvard Medical School (HMS) e la Geisel School of Medicine di Dartmouth dai rispettivi Comitati istituzionali per la cura e l’uso degli animali (IS00000231-3 e 2035, rispettivamente) e dal Comitato HMS per la sicurezza microbiologica (15-225), e sono conformi alle linee guida per la cura degli animali dei National Institutes of Health.
Animali sperimentali
Per la perturbazione acuta e chemiogenetica dei neuroni Pet1 in vivo, i cuccioli di topo a doppio transgenico del genotipo Pet1-Flpe, RC-FDi (indicato genotipicamente come Pet1-Di) sono stati generati attraverso l’incrocio Gt(ROSA)26Sortm(CAG-FSF-CHRM4*)Dym (indicato in breve come RC-FDi[Ray et al., 2011]) femmine omozigoti a maschi emizygoti Pet1-Flpe(Jensen et al., 2008). Qui espressione Flpe media FRT ricombinazione FRT dell’allele RC-FDi con conseguente espressione della inibitoria, sintetica G proteine-accoppiato recettore Di esclusivamente nei neuroni con corrente o una storia lineare di Pet1 espressione, consentendo così acuta, CNO-triggered Di inibizione dei neuroni serotoninergici su iniezione CNO i.p.. Ci riferiamo a questi topi transgenici doppi trattati con CNO come topi Pet1-Di-CNO. I controlli dei littermatti erano del singolo genotipo transgenico RC-FDi e quindi privi di espressione Di ma di un background genetico comparabile (prevalentemente C57BL/6J, minore 129) che serviva quindi come controlli (CNO-trattati controlli CNO-trattati indicati come controllo-CNO). I topi sono stati ottenuti da nove cucciolate indipendenti, producendo 22 cuccioli doppi transgenici Pet1-Flpe, RC-FDi (11 maschi, 11 femmine) e 15 cuccioli singoli transgenici RC-FDi (5 maschi, 10 femmine). I topi sono stati alloggiati in un ambiente a temperatura controllata su un ciclo luce-buio di 12:12 ore in un ambiente esterno con accesso ad libitum al cibo per roditori standard e all’acqua. Esperimenti precedenti con genotipi simili e misure fisiologiche hanno dimostrato che una dimensione del gruppo di n ≥ 15 avrebbe fornito una potenza statistica sufficiente per rilevare le differenze tra i gruppi sperimentali e di controllo (Barrett etal., 2016; Brust et al. , 2014).
Genotipizzazione
I genotipi sono stati determinati come descritto in precedenza(Brust et al., 2014). In breve, gli isolati di DNA dalle biopsie della punta della coda dei cuccioli P3-5 sono stati sottoposti ad amplificazione PCR utilizzando Taq DNA polimerasi (New England BioLabs Inc.) e le seguenti sequenze di primer (Invitrogen, Carlsbad, CA) diagnostiche per Flpe (800 bp amplicon) o hM4Di (268 bp amplicon): 5′-GCATCTGGGGGAGATCACTGAG-3′ (primer di Flpeforward ); 5′-CCCATTCCATGGGGGGGTATCG-3′ (primer di Flpe reverse primer); 5′-CGAATTCGGGGAAACATAACTTCG-3′ (FDiforward primer); 5′-GGGCAATGAAGACTTTCCACCG-3′ (FDi reverse primer). L’amplificazione PCR consisteva in una denaturazione iniziale di 5 minuti a 94 ˚C, seguita da 35 cicli, ciascuno composto da 1 minuto a 94 ˚C, 1,5 minuti a 60 ˚C, e 1 minuto a 72 ˚C, seguiti da un’estensione finale di 10 minuti a 72 ˚C.
Immunoistochimica
Per la preparazione del doppio transgenico Pet1-Flpe, tessuto RC-FDi, giorno postnatale otto topi sono stati brevemente anestetizzati con ghiaccio e immediatamente perfusi per via intracardiaca con tampone fosfato salino (PBS) seguito dal 4% di paraformaldeide (PFA) in PBS. I cervelli sono stati estratti, immersi per 2 ore in PFA al 4% a 4°C, crioprotetti in saccarosio 30% / PBS per 48 ore, e successivamente incorporati nel composto OCT (Tissue-Tek). Le sezioni coronali sono state crio sezionate a 20 µm e montate su vetrini di vetro, sono state poi risciacquate tre volte con PBS per 10 minuti e permeabilizzate con 0,5% di Triton X-100 in PBS per 1 ora, e bloccate in 5% di siero d’asino normale (NDS, Jackson ImmunoResearch), 1% BSA, 0,5% di Triton X-100 in PBS per 1 ora a temperatura ambiente (RT). Le sezioni sono state risciacquate tre volte con tampone anticorpale (5% NDS, 0,5% Triton X-100 in PBS) per 10 minuti ciascuna, seguite da incubazione per 72 ore a 4°C con gli anticorpi primari nello stesso tampone. Anticorpi primari: coniglio policlonale anti-Tph2 (1:1000; NB100-74555; Novus Biological), ratto monoclonale anti-HA (1:200; 7C9; Chromotek), capra policlonale anti-5-HT (1:1000, ab66047; Abcam). Le sezioni sono state poi lavate con tampone anticorpale tre volte per 10 minuti e incubate con anticorpi secondari per 2 ore a RT. Anticorpi secondari: asino anti-coniglio IgG-Alexa Fluor 488 (1:500, ThermoFisher Scientific.), asino anti-ratto IgG-Alexa Fluor 594 (1:500, ThermoFisher Scientific), asino anti-capra IgG-Alexa Fluor 647 (1:500, ThermoFisher Scientific). Il DAPI (4′, 6-diamidino-2-fenilindolo) è stato utilizzato per la colorazione di contrasto nucleare.
Acquisizione ed elaborazione di immagini
Le immagini sono state raccolte su un microscopio confocale a scansione a punto invertito Zeiss LSM 780 con un obiettivo a immersione multipla Zeiss LD LCI Plan-Apochromat 25x/0.8 N.A. per immagini panoramiche e un obiettivo a immersione ad olio Zeiss Plan Apochromat 63x/1.4 N.A. per immagini a maggiore ingrandimento. Le impostazioni laser sono state regolate per ogni campione, ma sono state mantenute costanti per tutta la raccolta delle immagini all’interno delle stesse aree tra le sezioni Pet1-Di e Control-Di. Le immagini sono state importate ed elaborate con ImageJ (distribuzione Fiji) per la regolazione della luminosità e del contrasto, che sono state mantenute costanti anche tra le sezioni Pet1-Di e Control-Di.
Impostazione sperimentale
Le misurazioni fisiologiche sono state ottenute come descritto in precedenza(Barrett et al., 2016; Cummings et al., 2011a). In breve, la ventilazione è stata misurata utilizzando un sistema pletismografico a testa fuoriuscita, costituito da una camera del corpo e da una camera della testa. La camera del corpo (volume = ~ 60 ml; diametro = 3 cm, lunghezza = 8,5 cm) è stata realizzata con un cilindro di vetro rivestito d’acqua con porte di ingresso e di uscita che sono state collegate a un bagno d’acqua, consentendo la circolazione continua di acqua intorno alla camera per mantenere la temperatura corporea del cucciolo. La temperatura ambiente (TA) della camera del corpo e quindi la temperatura corporea (TB) del cucciolo di topo erano controllate regolando la temperatura dell’acqua che circolava intorno alla camera di vetro. Sia laTA che laTB sono state continuamente monitorate con una sonda a termistore e una termocoppia fine, rispettivamente (Omega Engineering Inc, Stamford, CT). La camera di testa (volume =~3 ml) è stata realizzata dal fondo di un tubo di plastica da 50 ml per siringhe (Terumo Medical, Somerset, NJ) con un pezzo di guanto di vinile che copre la più grande delle due aperture. Una guarnizione di gomma (Terumo Medical, Somerset, NJ) è stata utilizzata per tenere il pezzo di guanto di vinile in posizione e per fissare la camera della testa nell’estremità anteriore della camera del corpo. Un piccolo foro è stato praticato al centro del guanto di vinile, dove è stato inserito il muso del cucciolo di topo e il foro è stato sigillato con materiale da impronta in polietere Impregum F (3M, St. Paul, MN). La camera della testa aveva una porta di uscita collegata a valle ad una pompa (S-3A/I, AEI Technologies, Pittsburgh, PA) che tirava aria attraverso la camera della testa ad una velocità di 140 ml/min. Questa elevata portata è stata scelta per evitare l’accumulo diCO2 nella camera di testa e per garantire una rapida erogazione del gas sperimentale all’animale. L’aria in uscita dalla camera della testa è stata fatta passare attraverso un tubo di essiccazione Nafion (PerkinElmer, Waltham, MA) prima di essere campionata da analizzatori di ossigeno (O2) (S-3A/I, AEI Technologies, Pittsburgh, PA) al fine di monitorare il consumo di ossigeno (). Un pneumotacografo collegato all’estremità aperta della camera di testa è stato collegato ad un trasduttore di pressione differenziale (Validyne Engineering Corp, Northridge, CA) per misurare l’attività respiratoria. I gas sperimentali sono stati consegnati alla camera di testa attraverso l’estremità aperta di un tubo per siringhe da 50 ml che è stato collegato alla bombola del gas e poi collocato sopra il pneumotacografo. Il pneumotacografo è stato calibrato estraendo e iniettando 0,02 ml di aria nella camera della testa e il segnale di pressione associato all’iniezione di questo volume è stato integrato per determinare il volume. La frequenza cardiaca (HR) è stata monitorata con un dispositivo telemetrico (CTA-F40, DSI, Inc., St. Paul, MN) che consisteva di 2 elettrocateteri ECG che sono stati posizionati sulla superficie del torace del cucciolo e tenuti in posizione con un gilet fatto da un bendaggio flessibile coesivo (Andover, Salisbury, MA).
Analisi dei dati
Mortalità
La mortalità è stata calcolata valutando il numero totale di topi morti in qualsiasi momento durante il saggio.
Respirazione di base e frequenza cardiaca
L’applicazione LabChart (AD Instruments Inc, Colorado Springs, CO) è stata utilizzata per eseguire l’analisi dei dati su file di dati randomizzati e non identificati. I topi sono stati registrati in modo continuo durante tutto il saggio. Dopo che i topi sono stati collocati nella camera, è stato permesso loro di acclimatarsi per 20 minuti. Durante l’iniziale 20 min topi sono stati esposti all’aria della stanza, con la camera tenuta a 35-36 ± 0,05 ° C (Figura 1G). Entro gli ultimi tre minuti, 30 s di dati stabili è stata presa, la stabilità è stata valutata dalla mancanza di artefatto di movimento nelle tracce di respirazione e frequenza cardiaca, per ottenere la linea di base prima di tacere (vedi Figura 1 G finestra aperta a). Dopo il periodo di acclimatazione, i topi sono stati rimossi dalla camera per breve tempo e iniettati per via intraperitoneale con CNO disciolto in soluzione salina (1 mg / ml) ad una concentrazione efficace di 10 mg / kg e poi rapidamente restituito alla camera per altri 10 min. Simile alla misurazione di base innata presa prima della somministrazione di CNO, questa misurazione è stata effettuata ottenendo un segmento stabile 30 s di dati entro un periodo di 3 minuti immediatamente prima della prima sfida asfissiante (vedi Figura 1H riempito finestra b’ ). La frequenza respiratoria di base(f; respiri – min-1), volume di marea (VT ; ml– g-1), ventilazione minuta(V˙E; ml – min-1 – g-1), il consumo di ossigeno (V˙O2; ml – min-1– g-1), gli equivalenti ventilatori per l’ossigeno (V˙E/V˙O2) e la frequenza cardiaca (HR) sono stati valutati. V˙E è stato calcolato come il prodotto della frequenza respiratoria f e del volume corrente VT. La f è stata ottenuta direttamente dai tracciati respiratori, mentre l’integrazione delle variazioni di pressione associate all’attività respiratoria è stata utilizzata per calcolare la VT. V˙O2 è stato calcolato come il prodotto della portata del gas e la differenza tra l’O2 inspirato e miscelato scaduto O2 normalizzato al peso corporeo ([Flusso (ml – min-1)* (FIO2– FEO2)]–peso corporeo (g)-1). L’HR è stato calcolato valutando il tempo tra ogni onda r sui tracciati ECG.
Variabilità della frequenza cardiaca di base e della frequenza respiratoria
Utilizzando il modulo LabChart HeartChart Heart Rate Variability (Variabilità della frequenza cardiaca), sono stati analizzati i segmenti di 30 s precedentemente definiti di ECG e di tracce respiratorie prima e durante l’esposizione al CNO. Il rilevamento iniziale dei picchi ha utilizzato l’algoritmo incorporato insieme alla verifica dello sperimentatore, utilizzando la selezione manuale di tutte le onde r sul tracciato dell’ECG e la massima deflessione della tensione sul tracciato di respirazione. Utilizzando questo modulo, è stato anche determinato il coefficiente di variazione per la respirazione f e HR. Inoltre, questo software è stato utilizzato per identificare la deviazione standard (SD), gli assi maggiore e minore del grafico Poincare, e il quadrato medio della radice della deviazione successiva (RMSSD) per gli intervalli di interbattito e interbreath.
Frequenza cardiaca e recupero della frequenza respiratoria durante l’auto-rianimazione.
L’apnea è stata indotta dall’introduzione di una miscela di gas asfissiante (97% di azoto e 3% di anidride carbonica) nella bombola da 50 ml come descritto in precedenza(Barrett et al., 2016; Cummings et al., 2011a; Erickson e Sposato , 2009). Un primo esame del tempo impiegato da entrambi i genotipi per sviluppare un’apnea una volta introdotte condizioni asfittiche non ha dimostrato alcuna differenza (23,4 ± 4,1 [deviazione standard] (s) per Pet1-Di-CNO e 23,4 ± 4,9 [deviazione standard] (s) controllo-CNO rispettivamente). Dopo l’esposizione asfissiante, abbiamo misurato il recupero della frequenza cardiaca, e il recupero della frequenza respiratoria. Il tempo per recuperare la frequenza cardiaca o la frequenza respiratoria al 63% della linea di base (τ HR e τ f, rispettivamente) è stato determinato essere il tempo tra la fine dell’asfissia e il tempo impiegato da un animale per recuperare e sostenere per almeno 3 s la loro frequenza cardiaca o la frequenza respiratoria al 63% della loro frequenza cardiaca o la frequenza respiratoria di base immediatamente prima di quel combattimento asfissiante (vedi Figura 4A). Il τ per ogni combattimento asfissiante è stato ottenuto utilizzando la nuova linea di base misurata immediatamente prima di ogni combattimento asfissiante (vedi Figura 4A [ aprire la finestra a’-d’ per a-b, rispettivamente]). Degli animali morti, alcuni (3 di 7 cuccioli Pet1-FDi-CNO e 1 di 1 cucciolo di controllo-CNO) hanno comunque recuperato la frequenza cardiaca a più del 63% della linea di base pre-bout per un breve periodo prima della morte, quindi i dati di quell’attacco apneico fatale (chiamato fatal bout) sono stati inclusi nelle nostre analisi (vedi Figura 4D e E simboli pieni di grigio). Gli altri 4 cuccioli Pet1-FDi-CNO che hanno ceduto ad un attacco apneico non hanno mai recuperato il 63% dei livelli di respirazione e frequenza cardiaca prima dell’attacco apneico fatale, quindi solo i dati del recupero prima dell’attacco fatale sono stati inclusi nelle rappresentazioni grafiche(Figura 4B-E simboli pieni di nero). Un cucciolo di Pet1-Di-CNO, che non è morto, non è riuscito comunque, nel corso del test, a recuperare la frequenza respiratoria al 63% della sua linea di base finale / 4th-bout, così abbiamo assegnato come tempo di recupero l’intera durata del test di 331 s, anche se una sottostima. Un malfunzionamento del piombo ECG ha impedito la misurazione delTHR da un singolo animale Pet1-Di-CNO per l’asfissia circa 1 e 2, ma che è stato corretto per i casi 3 e 4. Per l’analisi di correlazione e di regressione lineare, sono stati necessariamente inclusi solo i dati dei recuperi per asfissia con recupero sia della frequenza cardiaca che della frequenza respiratoria.
Gasp caratteristiche osservate durante il combattimento asfissiante iniziale
Il primo gasp è stato definito come la prima forte inalazione dopo l’insorgenza dell’apnea e durante la quale l’O2 aumentava determinato dal valore del sensore O2, ~5 s, assicurando che la camera O2 potesse supportare l’auto-rianimazione. La dimensione del gasp è stata determinata come l’integrale del primo gasp con una variazione di tensione maggiore di 0,002 V, distinguendola empiricamente dalle variazioni più piccole del trasduttore di pressione che riflettono invece gli artefatti del movimento del corpo. Il tempo fra i gasp è stato calcolato come il tempo fra queste deviazioni di tensione “a guglia” (vedi Figura 6A ). L’HR durante gli intervalli di gasp è stato calcolato come frequenza cardiaca media tra le deviazioni del campanile.
Analisi statistica
I dati sono presentati come media ±SD. Gli effetti del genere e del genotipo sul peso corporeo (BW), V˙E, V˙O2, V˙E/V˙O2and Parametri HR alla linea di base prima dell’iniezione di CNO (Figura 1G,finestra apertaa) sono stati valutati da un t-test a due code Student t-test a confronto. Per valutare gli effetti del CNO sui gruppi sperimentali e di controllo, sono stati eseguiti dei t-test Student a due code accoppiati sulle caratteristiche omeostatiche di base (HR, V˙E, V˙O2, V˙E/V˙O2, e caratteristiche di variabilità della frequenza cardiaca e della frequenza respiratoria) di ciascun gruppo prima e durante l’esposizione al CNO (Figura 1G,finestra aperta a e 1 H bar b ‘, rispettivamente). Per testare l’ipotesi di un aumento della mortalità nei cuccioli Pet1-FDi-CNO, abbiamo applicato un test di Fisher Exact a una coda con la correzione di Lancaster a metà percorso (Biddlee Morris, 2011) a causa della precedente ipotesi che la perturbazione dei neuroni del raphe Pet1 avrebbe aumentato la mortalità (Barrettet al., 2016). Il rapporto di probabilità per la morte del cucciolo come risultato di apnea asfissiante di fronte al Pet1-Di-CNOcontro il controllo-Di-CNOè stato calcolato come segue: (A/C)/(B/D), dove A =cuccioli Pet1 Di-CNO morti, B = cuccioli Pet1 Di-CNOsopravvissuti, C = cuccioli Control Di morti e D = cuccioli Control Di sopravvissuti. La versione tre di OpenEpi è stata utilizzata per eseguire il test Fisher Exact a una coda(Sullivan et al., 2009). Per analizzare i recuperi della respirazione e della frequenza cardiaca attraverso gli attacchi di asfissia, abbiamo usato un’analisi bidirezionale della varianza (ANOVA) con gli attacchi di asfissia e il genotipo come variabili, con il test di Tukey per la correzione di confronto multiplo post hoc e i t-test non accoppiati. Un modello di regressione lineare è stato eseguito per valutare la relazione tra BR e recupero HR. Inoltre, un test Runs è stato utilizzato per valutare se questi dati avevano una relazione lineare non rara. Per confrontare le risposte al primo colpo, è stato applicato un test ANOVA a senso unico. Per valutare la relazione tra la durata dell’intervallo gasp e la sopravvivenza del genotipo tra gli intervalli gasp, abbiamo applicato un test ANOVA bidirezionale ripetuto con intervallo gasp e genotipo/sorvivenza come variabili; le analisi post hoc hanno impiegato il test di Tukey per confronti multipli per determinare l’effetto dell’asfissia sui diversi gruppi. Abbiamo utilizzato la stessa analisi per valutare la relazione tra HR durante l’intervallo gasp e la sopravvivenza del genotipo. Per testare gli effetti indipendenti delle caratteristiche omeostatiche sulla mortalità, un modello di regressione logistica è stato adattato alla mortalità (sì/no) come risultato e alle caratteristiche omeostatiche come predittori, controllando per il genotipo. La varianza della misura V˙E/V˙O2 è stata analizzata usando un test F. Tutti i grafici e tutte le altre analisi statistiche sono state eseguite utilizzando GraphPad Prism versione 7.0 c per Mac OS X, GraphPad Software, La Jolla California USA, www.graphpad.com.
References
- American Academy of Pediatrics Task Force on Sudden Infant Death Syndrome. The changing concept of sudden infant death syndrome: diagnostic coding shifts, controversies regarding the sleeping environment, and new variables to consider in reducing risk. Pediatrics. 2005; 116:1245-1255. DOI | PubMed
- Armbruster BN, Li X, Pausch MH, Herlitze S, Roth BL. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. PNAS. 2007; 104:5163-5168. DOI | PubMed
- Barrett KT, Dosumu-Johnson RT, Daubenspeck JA, Brust RD, Kreouzis V, Kim JC, Li A, Dymecki SM, Nattie EE. Partial raphe dysfunction in neurotransmission is sufficient to increase mortality after anoxic exposures in mice at a critical period in postnatal development. Journal of Neuroscience. 2016; 36:3943-3953. DOI | PubMed
- Biddle DA, Morris SB. Using Lancaster’s mid-P correction to the Fisher’s exact test for adverse impact analyses. Journal of Applied Psychology. 2011; 96:956-965. DOI | PubMed
- Brust RD, Corcoran AE, Richerson GB, Nattie E, Dymecki SM. Functional and developmental identification of a molecular subtype of brain serotonergic neuron specialized to regulate breathing dynamics. Cell Reports. 2014; 9:2152-2165. DOI | PubMed
- Chen J, Magnusson J, Karsenty G, Cummings KJ. Time- and age-dependent effects of serotonin on gasping and autoresuscitation in neonatal mice. Journal of Applied Physiology. 2013; 114:1668-1676. DOI | PubMed
- Cummings KJ, Commons KG, Hewitt JC, Daubenspeck JA, Li A, Kinney HC, Nattie EE. Failed heart rate recovery at a critical age in 5-HT-deficient mice exposed to episodic anoxia: implications for SIDS. Journal of Applied Physiology. 2011a; 111:825-833. DOI | PubMed
- Cummings KJ, Hewitt JC, Li A, Daubenspeck JA, Nattie EE. Postnatal loss of brainstem serotonin neurones compromises the ability of neonatal rats to survive episodic severe hypoxia. The Journal of Physiology. 2011b; 589:5247-5256. DOI | PubMed
- Cummings KJ, Commons KG, Trachtenberg FL, Li A, Kinney HC, Nattie EE. Caffeine improves the ability of serotonin-deficient (Pet-1-/-) mice to survive episodic asphyxia. Pediatric Research. 2013; 73:38-45. DOI | PubMed
- Daily WJ, Klaus M, Meyer HB. Apnea in premature infants: monitoring, incidence, heart rate changes, and an effect of environmental temperature. Pediatrics. 1969; 43:510-518. PubMed
- Duncan JR, Paterson DS, Hoffman JM, Mokler DJ, Borenstein NS, Belliveau RA, Krous HF, Haas EA, Stanley C, Nattie EE, Trachtenberg FL, Kinney HC. Brainstem serotonergic deficiency in sudden infant death syndrome. JAMA. 2010; 303:430-437. DOI | PubMed
- Erickson JT, Shafer G, Rossetti MD, Wilson CG, Deneris ES. Arrest of 5HT neuron differentiation delays respiratory maturation and impairs neonatal homeostatic responses to environmental challenges. Respiratory Physiology & Neurobiology. 2007; 159:85-101. DOI | PubMed
- Erickson JT, Sposato BC. Autoresuscitation responses to hypoxia-induced apnea are delayed in newborn 5-HT-deficient Pet-1 homozygous mice. Journal of Applied Physiology. 2009; 106:1785-1792. DOI | PubMed
- Feldman JL, Mitchell GS, Nattie EE. Breathing: rhythmicity, plasticity, chemosensitivity. Annual Review of Neuroscience. 2003; 26:239-266. DOI | PubMed
- Fewell JE. Protective responses of the newborn to hypoxia. Respiratory Physiology & Neurobiology. 2005; 149:243-255. DOI | PubMed
- Fewell JE, Ng VK, Zhang C. Prior exposure to hypoxic-induced apnea impairs protective responses of newborn rats in an exposure-dependent fashion: influence of normoxic recovery time. Journal of Applied Physiology. 2005; 99:1607-1612. DOI | PubMed
- Fyodorov D, Nelson T, Deneris E. Pet-1, a novel ETS domain factor that can activate neuronal nAchR gene transcription. Journal of Neurobiology. 1998; 34:151-163. DOI | PubMed
- Gershan WM, Jacobi MS, Thach BT. Mechanisms underlying induced autoresuscitation failure in BALB/c and SWR mice. Journal of Applied Physiology. 1992; 72:677-685. DOI | PubMed
- Gomez JL, Bonaventura J, Lesniak W, Mathews WB, Sysa-Shah P, Rodriguez LA, Ellis RJ, Richie CT, Harvey BK, Dannals RF, Pomper MG, Bonci A, Michaelides M. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 2017; 357:503-507. DOI | PubMed
- Guntheroth WG, Kawabori I. Hypoxic apnea and gasping. Journal of Clinical Investigation. 1975; 56:1371-1377. DOI | PubMed
- Hennessy ML, Corcoran AE, Brust RD, Chang Y, Nattie EE, Dymecki SM. Activity of Tachykinin1-Expressing Pet1 Raphe Neurons Modulates the Respiratory Chemoreflex. The Journal of Neuroscience. 2017; 37:1807-1819. DOI | PubMed
- Hodges MR, Richerson GB. The role of medullary serotonin (5-HT) neurons in respiratory control: contributions to eupneic ventilation, CO2 chemoreception, and thermoregulation. Journal of Applied Physiology. 2010; 108:1425-1432. DOI | PubMed
- Jacobi MS, Gershan WM, Thach BT. Mechanism of failure of recovery from hypoxic apnea by gasping in 17- to 23-day-old mice. Journal of Applied Physiology. 1991; 71:1098-1105. DOI | PubMed
- Jensen P, Farago AF, Awatramani RB, Scott MM, Deneris ES, Dymecki SM. Redefining the serotonergic system by genetic lineage. Nature Neuroscience. 2008; 11:417-419. DOI | PubMed
- Kelly DH, Stellwagen LM, Kaitz E, Shannon DC. Apnea and periodic breathing in normal full-term infants during the first twelve months. Pediatric Pulmonology. 1985; 1:215-219. DOI | PubMed
- Kinney HC, Thach BT. The sudden infant death syndrome. New England Journal of Medicine. 2009; 361:795-805. DOI | PubMed
- Magnusson JL, Cummings KJ. Central serotonin and the control of arterial blood pressure and heart rate in infant rats: influence of sleep state and sex. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2018; 314:R313-R321. DOI | PubMed
- Manvich DF, Webster KA, Foster SL, Farrell MS, Ritchie JC, Porter JH, Weinshenker D. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 2018; 8DOI | PubMed
- Meny RG, Carroll JL, Carbone MT, Kelly DH. Cardiorespiratory recordings from infants dying suddenly and unexpectedly at home. Pediatrics. 1994; 93:44-49. PubMed
- Okaty BW, Freret ME, Rood BD, Brust RD, Hennessy ML, deBairos D, Kim JC, Cook MN, Dymecki SM. Multi-Scale molecular deconstruction of the serotonin neuron system. Neuron. 2015; 88:774-791. DOI | PubMed
- Paterson DS, Trachtenberg FL, Thompson EG, Belliveau RA, Beggs AH, Darnall R, Chadwick AE, Krous HF, Kinney HC. Multiple serotonergic brainstem abnormalities in sudden infant death syndrome. JAMA. 2006; 296:2124-2132. DOI | PubMed
- Pelosi B, Migliarini S, Pacini G, Pratelli M, Pasqualetti M. Generation of Pet1210-Cre transgenic mouse line reveals non-serotonergic expression domains of Pet1 both in CNS and periphery. PLoS One. 2014; 9DOI | PubMed
- Peña F, Ramirez JM. Endogenous activation of serotonin-2A receptors is required for respiratory rhythm generation in vitro. The Journal of Neuroscience. 2002; 22:11055-11064. DOI | PubMed
- Poets CF, Meny RG, Chobanian MR, Bonofiglo RE. Gasping and other cardiorespiratory patterns during sudden infant deaths. Pediatric Research. 1999; 45:350-354. DOI | PubMed
- Ptak K, Yamanishi T, Aungst J, Milescu LS, Zhang R, Richerson GB, Smith JC. Raphé neurons stimulate respiratory circuit activity by multiple mechanisms via endogenously released serotonin and substance P. Journal of Neuroscience. 2009; 29:3720-3737. DOI | PubMed
- Ray RS, Corcoran AE, Brust RD, Kim JC, Richerson GB, Nattie E, Dymecki SM. Impaired respiratory and body temperature control upon acute serotonergic neuron inhibition. Science. 2011; 333:637-642. DOI | PubMed
- Saiki C, Ikeda M, Nishikawa T, Tanimoto T, Yoshida S, Matsumoto S. The process of cardiorespiratory autoresuscitation in intact newborn rats. Canadian Journal of Physiology and Pharmacology. 2001; 79:1036-1043. DOI | PubMed
- Scremin AM, Scremin OU, Brechner T. Survival under hypoxia. Age dependence and effect of cholinergic drugs. Stroke. 1980; 11:548-552. DOI | PubMed
- Sos KE, Mayer MI, Cserép C, Takács FS, Szőnyi A, Freund TF, Nyiri G. Cellular architecture and transmitter phenotypes of neurons of the mouse median raphe region. Brain Structure and Function. 2017; 222:287-299. DOI | PubMed
- Southall DP, Richards J, Brown DJ, Johnston PG, de Swiet M, Shinebourne EA. 24-hour tape recordings of ECG and respiration in the newborn infant with findings related to sudden death and unexplained brain damage in infancy. Archives of Disease in Childhood. 1980; 55:7-16. DOI | PubMed
- Sridhar R, Thach BT, Kelly DH, Henslee JA. Characterization of successful and failed autoresuscitation in human infants, including those dying of SIDS. Pediatric Pulmonology. 2003; 36:113-122. DOI | PubMed
- Stachniak TJ, Ghosh A, Sternson SM. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus→midbrain pathway for feeding behavior. Neuron. 2014; 82:797-808. DOI | PubMed
- Sullivan KM, Dean A, Soe MM. OpenEpi: a web-based epidemiologic and statistical calculator for public health. Public Health Reports. 2009; 124:471-474. DOI | PubMed
- Teissier A, Chemiakine A, Inbar B, Bagchi S, Ray RS, Palmiter RD, Dymecki SM, Moore H, Ansorge MS. Activity of raphé serotonergic neurons controls emotional behaviors. Cell Reports. 2015; 13:1965-1976. DOI | PubMed
- Wang W, Richerson GB. Development of chemosensitivity of rat medullary raphe neurons. Neuroscience. 1999; 90:1001-1011. DOI | PubMed
- Yang HT, Cummings KJ. Brain stem serotonin protects blood pressure in neonatal rats exposed to episodic anoxia. Journal of Applied Physiology. 2013; 115:1733-1741. DOI | PubMed
- Young JO, Geurts A, Hodges MR, Cummings KJ. Active sleep unmasks apnea and delayed arousal in infant rat pups lacking central serotonin. Journal of Applied Physiology. 2017; 123:825-834. DOI | PubMed
Fonte
Dosumu-Johnson RT, Cocoran AE, Chang Y, Nattie E, Dymecki SM, et al. () Acute perturbation of . eLife 7e37857. https://doi.org/10.7554/eLife.37857





