Abstract
Background
A causa dell’invecchiamento della popolazione, il numero di persone affette da demenza è in aumento. Nel 2015, l’Organizzazione Mondiale della Sanità (OMS) ha stimato il numero di persone affette da demenza a 35,6 milioni. Si prevede che questo numero raddoppierà entro il 2030 e addirittura triplicherà entro il 2050[1].
Per consentire ai caregiver di migliorare la qualità della vita delle persone affette da demenza, hanno bisogno di sapere cosa è importante per loro, quali sono le loro preoccupazioni specifiche e come e dove vogliono ricevere assistenza. Tuttavia, le persone affette da demenza perdono gradualmente la capacità di prendere decisioni informate[2]. Pertanto può essere necessario tenere queste discussioni nelle fasi iniziali della demenza, quando la persona è ancora in grado di prendere decisioni ed esprimere i propri valori e le proprie preferenze[3].
Fornire un’assistenza di alta qualità alle persone affette da demenza richiede una pianificazione anticipata dell’assistenza (ACP)[4]. ACP è un processo continuo e dinamico di riflessione precoce e di dialogo tra una persona affetta da demenza, le persone a lei vicine e i professionisti sanitari competenti, che riguarda le preferenze e i valori della persona quando si tratta di cure e assistenza future, comprese le cure di fine vita [5]. Se lo desiderano, il contenuto di queste conversazioni può essere registrato sotto forma di testamento preventivo, e può essere nominato un delegante o può essere concessa una procura permanente in previsione di un futuro deterioramento[6, 7].
Nonostante il diffuso riconoscimento dell’importanza degli ACP per le persone affette da demenza[1- 3, 8- 10], la realtà è diversa, e solo una minoranza di persone affette da demenza ha la possibilità di impegnarsi negli ACP [11]. Per esempio, gli studi mostrano che una minoranza di persone decedute residenti in case di cura con demenza aveva una direttiva anticipata[12-14] e che i medici di medicina generale (medici di base) avevano comunicato di rado sulle future opzioni di assistenza alla fine della vita. Ad esempio, solo il 22% delle persone decedute residenti in case di cura in Belgio ha avuto una conversazione ACP[13]. Anche tra un campione rappresentativo di decessi non cruenti in Belgio e nei Paesi Bassi, solo il 34% dei pazienti si era impegnato in ACP con il proprio medico di famiglia[15]. Le persone affette da demenza sono spesso un gruppo svantaggiato quando si tratta di essere invitate a conversazioni ACP al momento opportuno e il declino cognitivo è spesso visto come una barriera per avviare ACP[16- 26].
Anche se diverse organizzazioni e professionisti hanno chiesto una guida su quando e come eseguire ACP in questa specifica popolazione[1- 3], mancano linee guida che siano state sviluppate in modo sistematico utilizzando le migliori prove disponibili. Nel tentativo di migliorare la prevalenza, la qualità e la coerenza dell’ACP nelle persone affette da demenza, abbiamo cercato di sviluppare raccomandazioni cliniche per l’applicazione e la conduzione pratica dell’ACP, per fornire supporto al personale sanitario (medici, compresi medici di base, infermieri, operatori sanitari e assistenti alleati) che lavorano con persone affette da demenza in ambienti comunitari, residenziali e ospedalieri.
Metodi
Per questo studio non è stato necessario alcun consenso informato. La procedura sviluppata dal Centro belga per la medicina basata sulle prove (CEBAM) (in stretta collaborazione con il Servizio pubblico belga per la salute, la sicurezza della catena alimentare e l’ambiente e con le due organizzazioni professionali del GP belga Domus Medica e Société Scientifique de Médecin General o SSMG) è stata utilizzata come metodologia per sviluppare una linea guida. La procedura comporta: 1) una ricerca bibliografica per identificare ciò che è già noto sugli ACP nelle persone affette da demenza, 2) lo sviluppo di raccomandazioni basate sulle prove esistenti e sull’opinione degli esperti del gruppo di autori, e 3) un processo di validazione per fornire un feedback sulla chiarezza, l’accettabilità e l’importanza e per discutere i possibili ostacoli all’attuazione delle raccomandazioni.
1) Ricerca della letteratura
Quadro di ricerca: selezione di domande di ricerca e temi clinici su ACP e pratica clinica
Un gruppo multidisciplinare di autori è stato riunito per sviluppare le raccomandazioni: un coordinatore della ricerca, un geriatra, due medici di base, un esperto in cura delle demenze, un’infermiera, due psicologi e il direttore della Federazione delle Fiandre per le cure palliative. Collettivamente, hanno una vasta esperienza nelle cure palliative, primarie e nella cura della demenza in diversi contesti nelle Fiandre (Belgio). Sulla base della loro esperienza e degli ostacoli che hanno incontrato nella pratica, questo gruppo di autori ha formulato domande di ricerca clinica relative all’ACP nelle persone affette da demenza. Gli ostacoli sono definiti come quelle aree del processo ACP che fanno sì che gli ACP non vengano avviati al momento opportuno o non vengano affatto eseguiti. La chiarezza, l’applicabilità e la completezza di ogni domanda di ricerca clinica è stata valutata in interviste semi-strutturate da SM e DN con 28 medici di base, di cui 14 svolgono anche il ruolo di coordinamento dei medici consulenti o CAP in una casa di cura e 14 sono responsabili dell’assistenza residenziale, tutti provenienti da diverse case di cura delle Fiandre e tutti hanno familiarità con il concetto e la pratica di ACP. Attraverso la discussione e il consenso all’interno del team di autori, questi sono stati classificati in sei temi clinici principali per guidare la ricerca in letteratura (vedi Tabella 1).Tabella 1I sei temi clinici e gli esempi di domande di ricerca utilizzati per la ricerca di proveTema 1Capacità mentaleE.g.:Come si può definire la capacità mentale nel contesto dell’assistenza sanitaria per le persone affette da demenza? Come si può valutare la capacità mentale? Tema 2Pianificazione dell’assistenza alle persone affette da demenzaE.g.:Quali sono i punti specifici di interesse nel coinvolgimento delle persone affette da demenza nella pianificazione dell’assistenza preventiva? Per le fasi iniziali: Come ci comportiamo con le persone che non conoscono la malattia? E se le persone sono restie a parlare di cure future? Per le fasi lievi della demenza in cui la comunicazione verbale è ancora possibile? Per le persone affette da demenza in cui la comunicazione verbale sull’ACP è troppo difficile o non è possibile Cosa succede se i desideri della persona mentalmente competente (l'”io di allora”) non corrispondono ai reali desideri della persona ora priva di capacità mentale (l'”io di oggi”) o al “migliore interesse” della persona?Tema 3Famiglia e ambiente delle persone affette da demenzaE.g.:Qual è il ruolo della famiglia e del circolo sociale immediato nella pianificazione preventiva delle cure durante le diverse fasi della demenza?Come possono gli operatori sanitari sostenere le famiglie e le persone nell’ambiente circostante nell’assumere questi ruoli? Tema 4Specifiche per la pianificazione anticipata delle cure nelle persone con demenza precoceE.g.:Ci sono punti di interesse specifici riguardanti le persone con demenza precoce e la pianificazione anticipata delle cure? Tema 5Documentazione e registrazione di ACPE.g.:Quali aspetti di ACP devono essere registrati? Tema 6OrganizzazioneE.g.:Qual è il ruolo nel processo ACP dei diversi professionisti? Quali sono i prerequisiti ottimali per l’ACP in diversi contesti?
Ricerca di prove
Abbiamo intrapreso un approccio graduale per cercare nella letteratura scientifica le prove sull’ACP nelle persone affette da demenza legate ai sei temi clinici selezionati. Le pubblicazioni sono state incluse se (i) sono state pubblicate in olandese, francese, inglese o tedesco, (ii) il loro tema principale era ACP nelle persone con demenza, o, se una linea guida, ACP è stata inclusa negli obiettivi, o era una delle raccomandazioni di risultato. Le pubblicazioni sono state escluse se il tema ACP nelle persone affette da demenza non era al centro dell’articolo. Le meta-analisi e le revisioni sistematiche sono state escluse se sono state pubblicate prima del 2004, per evitare di includere pubblicazioni che si avvicinano troppo strettamente agli ACP. Gli autori ritengono che la maggior parte delle pubblicazioni abbia iniziato a definire l’ACP solo a partire dal 2004 come un processo più completo che non si limita alle direttive anticipate[27].
La ricerca è consistita in tre fasi per identificare 1) linee guida internazionali, 2) revisioni sistematiche e meta-analisi e 3) studi primari (studi randomizzati controllati e ricerca osservazionale). I termini di ricerca e un diagramma di flusso PRISMA sono forniti nella Fig. 1.La procedura di valutazione della qualità è descritta di seguito. Abbiamo cercato le linee guida esistenti riguardanti ACP e demenza nelle banche dati di linee guida G-I-N (Guidelines International Network), NHS (National Health Service), NGC (National Guideline Clearinghouse), e una banca dati del NZGGG (New Zealand Guideline Group), utilizzando due motori di ricerca EBM (TRIP e SUMSEARCH).Le revisioni sistematiche e le meta-analisi sono state ricercate da due autori (SM e DN) utilizzando cinque importanti database bibliografici (Cochrane Database of Systematic Reviews, Medline, Embase, CINAHL e PsycINFO).due autori indipendenti hanno effettuato una ricerca mirata della letteratura in Medline e Embase per studi primari (studi randomizzati controllati o studi osservazionali) per rispondere a domande cliniche alle quali non è stato possibile rispondere attraverso linee guida, revisioni sistematiche e/o meta-analisi. Inoltre, utilizzando il metodo della palla di neve e basandosi sul parere di esperti, sono stati aggiunti altri articoli che potrebbero essere stati tralasciati se ritenuti rilevanti dagli autori.Fig. 1PRISMA diagramma di flusso dello screening dello studio, dell’ammissibilità, della selezione e del processo di inclusione ACP pianificazione anticipata delle cure; G-I-N Guidelines International Network; NHS National Health Service; NGC National Guideline Clearinghouse; NZGG New Zealand Guidelines Group; TRIP Trip medical database; MeSH Medical Subject Headings; AGREE Appraisal of Guidelines for Research and Evaluation.
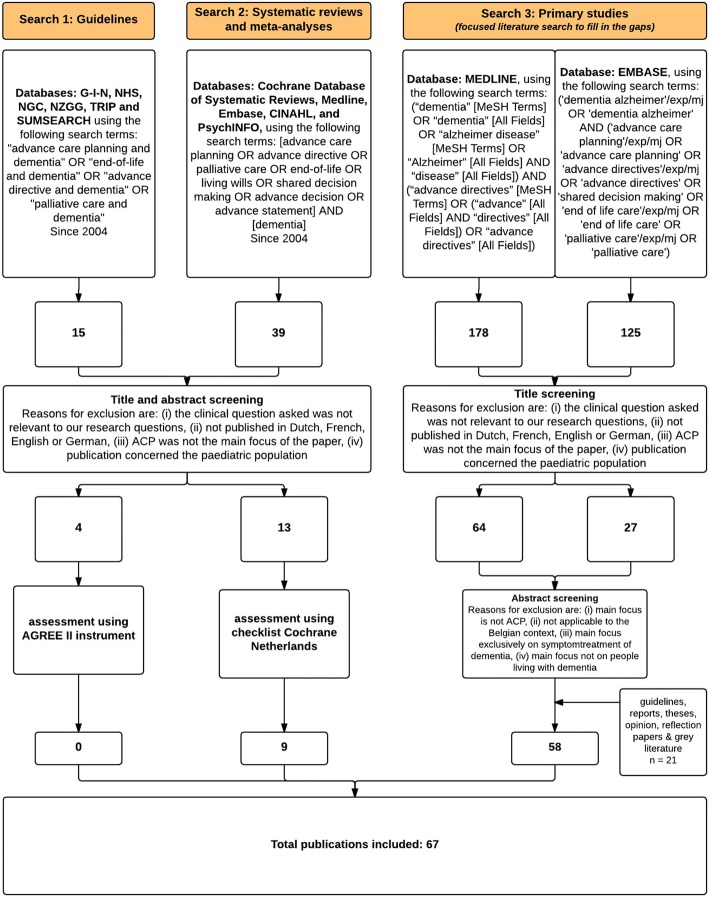
Fig. 1.Fig. 1. Diagramma di flusso PRISMA del processo di screening dello studio, ammissibilità, selezione e inclusione ACP pianificazione anticipata delle cure; G-I-N Guidelines International Network; NHS National Health Service; NGC National Guideline Clearinghouse; NZGG New Zealand Guidelines Group; TRIP Trip medical database; MeSH Medical Subject Headings; AGREE Appraisal of Guidelines for Research and Evaluation
Valutazione della qualità
La qualità delle linee guida e delle revisioni sistematiche e/o delle meta-analisi è stata verificata in modo indipendente da coppie di autori rispetto allo strumento di valutazione delle linee guida di ricerca e valutazione (AGREE II)[28] per le linee guida e una lista di controllo per valutare la qualità metodologica delle revisioni sistematiche[29], come raccomandato da CEBAM e Cochrane Netherlands[30- 35]. Lo strumento AGREE II è uno strumento internazionale a 23 voci per valutare la qualità e la rendicontazione delle linee guida pratiche, organizzato in sei settori. Tutte le voci sono valutate su una scala di 7 punti (1 “fortemente in disaccordo” – 7 “fortemente d’accordo”). La checklist utilizzata per la valutazione delle revisioni sistematiche è stata sviluppata da Cochrane Netherlands(http://netherlands.cochrane.org; disponibile solo in olandese). È stata abbreviata dagli autori. Ora consiste di 12 domande “sì – no – non può rispondere/non può rispondere/non può dare troppe poche informazioni nel documento”, organizzate in tre categorie: validità, importanza e applicabilità. Le domande per la valutazione includono: 1) La richiesta di ricerca è stata formulata in modo adeguato? 2) La ricerca è stata eseguita in modo adeguato? 3) La procedura di selezione degli articoli è stata effettuata in modo adeguato? 4) La valutazione della qualità è stata effettuata in modo adeguato? 5) La descrizione di come è stata organizzata l’estrazione dei dati è adeguata? 6) Sono state riportate le caratteristiche più importanti della ricerca inclusa? 7) La meta-analisi è stata effettuata in modo adeguato? 8) Esiste un pooling statistico? 9) La ricerca è valida? 10) I risultati sono descritti in modo adeguato? 11) I risultati sono applicabili nella regione? 12) Sono applicabili nella pratica quotidiana? (traduzione da parte degli autori). Il punteggio di qualità è il numero di volte che è stato applicato “sì” alle domande (1 “bassa qualità” – 12 “alta qualità”). Come specificato dalla procedura CEBAM, avremmo seguito il processo scientifico della procedura ADAPTE al momento della valutazione dell’ACCORDO, per adattare le linee guida utili al contesto locale attraverso un processo che si può trovare altrove[31- 35]. Tuttavia, nessuna delle linee guida soddisfaceva questi criteri e, a causa del numero limitato di revisioni sistematiche su ACP e demenza, gli autori hanno deciso di includere anche altri studi primari (studi controllati randomizzati e ricerche osservazionali), opinion piece e letteratura grigia. Una panoramica di tutte le pubblicazioni incluse è fornita nella Tabella 2.Tabella 2Panoramica e caratteristiche delle pubblicazioni incluse(n = 67) Revisioni sistematiche e meta-analisi (n =67).9)Primo autore (anno di pubblicazione)Tipo di studioNumero di pubblicazioni incluse (n)Punteggio di qualità compreso tra 1 e 12* (numero di voci a cui non è stato possibile rispondere a causa delle scarse informazioni contenute nel documento)1Dening (2011)Review178 (4)|Robinson (2012)Revisione sistematica47 (5)|3Seeber (2012)Review436 (5)4Van der Steen (2010)Revisione sistematica454 (8)|5Sampson (2010)Revisione (editoriale)2 (2)|6Goodman (2010)Revisione integrativa688 (3)|7De Boer (2010)Revisione della letteraturaInformazioninon disponibili3 (7)8Raymond (2014)Sintesi critica86 (3)■9Van der Steen (2014)Revisione sistematica337 (4)Altro (n = 58)Primo autore (anno di pubblicazione)MetodiSetting (campione, n)Ricercaquantitativae sperimentale1Detering (2010)Sperimentazione controllata randomizzataRaccolta di pazienti ospedalizzati di 80 o più anni(n= 309)2Vandervoort (2012)Indagine retrospettiva trasversaleRaccolta retrospettiva trasversaleRaccolta di pazienti deceduti con demenza in 345 case di cura (n= 764)|3De Gendt (2010)Sondaggio retrospettivo trasversaleAmministratori di case di cura (n = 345)|4Benkendorf (1997)Studio prospettico di coortePazienti > o = 19 anni con arresto per presunta causa cardiaca, con collocazione a casa o in una casa di cura (n = 2348)5De Gendt (2013)Indagine retrospettiva trasversale trasversaleRivenditori di case di cura deceduti (n=1240)■6Sampson (2011)Studio esplorativo randomizzato controllatoGli assistenti familiari di pazienti affetti da demenza grave (n =33; IG: n= 22; CG: n = 11 )|7Brasile(2015)Indagine trasversale Medici generici (n = 133)|8Grisso (1997)Quasi-sperimental trialAcutely sick inpatients with a diagnosis of schizophrenia or schizoaffective disorder (IG: n= 40)■9Givens (2009)Studio prospettico di coorteRivenditori in case di cura con demenza avanzata e loro delegati sanitari (n = 223)■10Vandervoort (2013)Indagine retrospettiva trasversaleRivenditori deceduti con demenza in 69 case di cura (n =198)■11Baile (2002)QuestionariOncologi(n= 167)12Szafara (2012)Studio prospettico di coorteResidenti (n = 1044 USA, n = 513 Paesi Bassi )13van der Steen (2012)Studio prospettico di coorteResidenti con demenza avanzata (n = 94)Ricerca qualitativa14Garand (2011)Interviste semi-strutturatePersone (n= 127) con diagnosi di MCI o AD precoce (n = 72) o AD da moderato a grave (n = 55)■15de Boer (2012)Interviste semi-strutturateIndividui con diagnosi di AD precoce (n = 24)16Poppe (2013)Interviste approfonditePazienti con problemi di memoria o lieve demenza (n = 2) e otto assistenti (n = 8) e membri del personale di una clinica della memoria e di un team di salute mentale della comunità (n = 11) 17Chan( 2011)Interviste semi-strutturateRivenditori in case di cura (n = 42)18Piers (2013)Interviste semi-strutturatePazienti anziani con prognosi limitata(n= 38)|19Ashton (2014)IntervisteGli assistenti familiari all’interno di un’unità specializzata in demenza (n = 12)|20Levi (2010)Focus groupsGli individui anziani (n = 23)|21Kim Suh (2011)IntervistePersone con AD (n=188)|22Shanley (2009)IntervisteGestori di strutture residenziali per anziani (n =41)|23Dening(2012)Studio di gruppo nominalePersone con demenza (n = 6), badanti (n = 5) e diadi di persone con demenza e badanti (n = 6)6) frequentare i servizi di valutazione della memoria 24Dening (2012) Studio qualitativo di interi sistemi basato su interviste e focus groupNine carer di persone con demenza (n = 9) e focus group (n = 6) con professionisti sanitari con professioni miste (n = 6).26) e interviste individuali con professionisti sanitari con professioni miste(n= 15)■25Hirschman (2006)Interviste semi-strutturateFamiliari di pazienti con demenza avanzata (n = 30)■26Hirschman (2008)Interviste semi-strutturateFamiliari di pazienti con demenza avanzata (n =30)■26Hirschman (2008)■Familiari di pazienti con demenza avanzata (n =30)30)■27Dickinson (2013)Interviste semi-strutturatePersone con demenza lieve-moderata (n =-17) e assistenti familiari (n = 29)■28Hoe (2007)Interviste semi-strutturateDiadi destinatarie e assistenti (n =191)29Steeman (2007)Studio intervistePersone anziane con probabile demenza lieve e i loro familiari(n= 20)■30Zimmerman (2015)Studio intervisteMembri di famiglie di deceduti di 118 case di cura e ambienti residenziali (n = 264)■31McMahan (2013)Focus group semi-strutturatiGruppi di focus group con partecipanti di un Veterans Affairs e di un ospedale della contea e della comunità (n==13)■32Steeman (2013)Studio di intervista longitudinalePersone anziane con demenza in fase iniziale (n==17)Ricerca con metodi misti33Silvester (2012)Indagine (1) e revisione della documentazione esistente relativa ai paesi ACP (2)(1) personale delle strutture di cura per anziani (n= 45); (2) strutture di cura per anziani (n=12)■34Froggatt (2009) Indagine (1) e interviste semi-strutturate (2)(1) responsabili di case di riposo (n =213); (2) responsabili di case di riposo (n =15)35de Boer (2011)Indagine (1) e interviste semi-strutturate (2)(1) medici anziani (n=434); (2) medici (n==)11) e parenti (n==8)■36Van der steen (2014)Esperti di studi quinquennali di Delphi provenienti da 23 paesi (n=64)Linee guida, rapporti,tesi37Van Mechelen (2014)GuidelineNA 38Clayton (2007)GuidelineNA 39WHO (2012)ReportNA 40Harle (2008)ReportNA 41Titler (2008)GuidelineNA42Vellinga (2006)TesiNA43Church (2007)GuidelineNA44Conroy (2009)GuidelineNA45American Medical Association (1999)GuidelineNAOpinionand reflection papers46Harvey (2006)NANA 47Lemmens (2012)NANA 48Gillick (2012)NANA 49Scott (2012)NANA 50Berghmans (2001)NANA 51Burlà (2014)NANA52Kim Suh (2006)NANA 53Gillick (2004)NANA 54Juthani-Mehta (2015)NANA 55Mold (1991)NANA 56Smith (2013)ipotetico case report (n=2)2Greyliterature■57Vander steen (2011)Volantino (olandese) NA■58Keirse(2009)Volantino (olandese)NANA Nonapplicabile, GP General Practitioner, IG Intervention Group, CG Control Group, AD Alzheimer’s Disease*Utilizzando la checklist sviluppata da Cochrane Netherlands (http:// Paesi Bassi.cochrane.org; disponibile solo in olandese). È stata leggermente adattata dagli autori. Consta di 12 domande “sì – no – non può rispondere/non può rispondere/non può dare troppe poche informazioni nel documento”, organizzate in tre domini (validità, importanza e applicabilità): 1) La richiesta di ricerca è stata formulata in modo adeguato? 2) La ricerca è stata eseguita in modo adeguato? 3) La procedura di selezione degli articoli è stata eseguita in modo adeguato? 4) La valutazione della qualità è stata effettuata in modo adeguato? 5) La descrizione di come è stata organizzata l’estrazione dei dati è adeguata? 6) Sono state riportate le caratteristiche più importanti della ricerca inclusa? 7) La meta-analisi è stata effettuata in modo adeguato? 8) C’è stato un pooling statistico? 9) La ricerca è valida? 10) I risultati sono stati descritti adeguatamente? 11) I risultati sono applicabili nella regione? 12) Sono applicabili nella pratica quotidiana? (traduzione da parte degli autori). Il punteggio di qualità è il numero di volte che è stato applicato “sì” alle domande (1 “bassa qualità” – 12 “alta qualità”)
2) Sviluppo delle raccomandazioni
L’estrazione dei dati ha seguito un processo strutturato in cui le domande di ricerca sono state divise per tema e date a una coppia di autori per ognuno dei sei temi clinici. Ogni coppia ha esaminato una selezione della letteratura inclusa e ha estratto i dati (“messaggi chiave”) applicabili alla loro domanda di ricerca clinica. I dati estratti sono stati memorizzati e strutturati in una matrice di Microsoft Excel™. Questi dati sono stati poi utilizzati per informare lo sviluppo di una prima bozza di possibili raccomandazioni redatte da due autori (GA e LVdB). Due autori (GA e JS) hanno inoltre valutato la forza di ciascuna raccomandazione attraverso una valutazione critica delle prove, in base ai criteri del gruppo di lavoro Grading of Recommendations Assessment, Development and Evaluation (GRADE)[30- 35]. La qualità della letteratura inclusa e di ogni raccomandazione si trova nella Tabella 2 e nella Tabella 3.Tabella 3Raccomandazioni-raccomandazionisulla qualità della raccomandazione, secondo il GRADEbDomain 1Iniziazione degli ACP il più presto possibile e integrare gli ACP nella cura quotidiana delle persone affette da demenza [10, 37, 106 ] [11, 38- 43] Potrebbero esserci momenti chiave specifici:- il periodo intorno alla diagnosi di demenza[39, 44] – quando si discute il piano di assistenza generale – quando si verificano cambiamenti nello stato di salute, nel luogo di residenza o nella situazione finanziaria[45]1C 2Be allerta per gli stimoli e le opportunità di iniziare ACP e sfruttare qualsiasi opportunità di parlare di ACP [46, 47 ]1C3 L’operatore sanitario dovrebbe iniziare le conversazioni ACP se la persona che vive con demenza e/o le persone a lei vicine non lo fanno da sole [37, 44-47][38, 45-48]1C 4Considerare la persona come un individuo e considerare la sua situazione specifica quando si iniziano le conversazioni ACP [43, 49]1CDomain 2Evalutazione della capacità mentale 5Considerare sempre la capacità mentale massima [50, 51]1C 6Considerare la capacità mentale come una condizione fluttuante piuttosto che statica [52], e stare attenti ai segni di perdita della capacità1C 7Giudicare il compito della capacità mentale – in particolare i.e. per una certa decisione in un determinato momento[11, 50, 51]1C#8Stare sempre in contatto con la persona e garantire la sua massima partecipazione [1]1C#9Valutare la capacità mentale attraverso una valutazione clinica formale:- in caso di dubbio o disaccordo tra gli operatori sanitari e/o la famiglia – quando le decisioni possono avere conseguenze di vasta portata – preferibilmente da parte di un team multidisciplinare o interdisciplinare con esperienza in demenzaNA*Dominio 3Eseguire conversazioni ACP10Regolare lo stile e il contenuto della conversazione al livello e al ritmo della persona [59]1C11Esplorare chi sono le persone significative nella loro vita e chi può essere coinvolto nelle conversazioni ACP, ed esplorare chi può diventare il loro rappresentante legale[47, 52, 61]1C12Portare la conversazione ma non forzarla a diventare troppo formulaica o graduale [59]1C13Esplorare la consapevolezza della persona sulla malattia e le sue aspettative, idee e possibili idee sbagliate riguardo alla traiettoria della malattia [5]1C14Dove qualcuno manca di consapevolezza della malattia o è riluttante a parlare di ACP, non insistere[106, 63]1C 14Non insistere [106, 63]1C 15Le conversazioni ACP possono essere tenute al meglio in diverse occasioni e per un periodo di tempo più lungo [38, 106 , 45] e riguardano diversi argomenti diversi, come i valori più ampi della persona, la sua esperienza del presente e le sue paure sul futuro e la fine della vita, i suoi obiettivi di cura futuri, le specifiche decisioni anticipate sulla fine della vita, le direttive anticipate1C&emsp.16C  16Provare a comprendere l’intera persona che vive con la demenza; esplorare la storia della sua vita, i valori importanti, le norme, le credenze e le preferenze[17, 26]1C  17Esplorare le esperienze attuali della persona; chiedere qual è la percezione della persona che vive con la demenza della sua qualità di vita? Quali sono le sue paure e le sue preoccupazioni?[25, 106, 52, 65]1C#18Esplorare le paure e le preoccupazioni della persona per il futuro e per la fine della vita [106]1C#19Se possibile e auspicabile, guidare la persona nel formulare i suoi obiettivi di cura [49, 66]1C#.20Se possibile e auspicabile, guidare le persone con la formulazione di desideri specifici riguardanti specifiche decisioni di fine vita[45]1C 20Esplorare se la persona vorrebbe avere un testamento scritto anticipato o se ne ha fatto uno in passato [45]1Dominio 4Il ruolo e l’importanza di coloro che le sono vicini22 Coinvolgere il più presto possibile la famiglia o altre persone significative nel processo ACP e informarle sul ruolo di un decisore surrogato[11, 26, 41]1C23Valutare la loro consapevolezza della malattia e informarle sulla traiettoria prevista della malattia e sulle possibili decisioni di fine vita [17, 25, 43, 82, 83 ]1C24Porre attenzione alle loro percezioni durante il processo ACP[11, 26, 52, 65, 85]1BDomain 5ACP quando è difficile o non è più possibile comunicare verbalmente con la persona affetta da demenza e garantire la loro massima partecipazione [1]: rispondere alle loro emozioni, curare la comunicazione non verbale e osservare il loro comportamento per conoscere meglio la loro attuale qualità di vita, le loro paure e i loro desideri1C’26C Coinvolgere attivamente la famiglia e le persone a loro vicine nel processo ACP e nell’espressione degli obiettivi di cura e dei desideri relativi alle decisioni di fine vita [11, 26, 82 ]1Dominio 6Documentazione dei desideri e delle preferenze, compreso il trasferimento di informazioni27Scrivi nei dossier medico/cura della persona affetta da demenza gli esiti del processo ACP, i loro valori, le loro preferenze e i loro obiettivi di cura e, se del caso, la direttiva anticipata e il rappresentante legale[26, 87, 88]1B28Rivalutare regolarmente nell’ambito del processo ACP; le decisioni possono essere riviste in qualsiasi momento [17, 26, 47 ]1C 29Comunicare gli esiti del processo ACP all’interno del team di assistenza, i.e. valori, preferenze e obiettivi di cura e, se del caso, direttive anticipate o rappresentanti legali, soprattutto in caso di trasferimento in un altro ambiente di cura.NA*Dominio 7Dominio 30C ponderare attentamente i desideri (espressi e/o scritti in precedenza) rispetto all’interesse attuale della persona affetta da demenza, in consultazione con le persone a lei vicine e con gli operatori sanitari coinvolti [83, 89, 90 ]1Dominio 8Presupposti per l’attuazione ottimale degli ACP31 Fornire sufficienti opportunità di formazione per gli operatori sanitari per imparare a condurre le conversazioni ACP. Un sostegno adeguato è essenziale per rendere gli operatori sanitari fiduciosi di impegnarsi in ACP[11, 17, 26, 94, 114]1C 32 Integrare ACP nella missione e nella politica dell’organizzazione e incorporarla nella cultura organizzativa [62, 91, 95- 97] [61, 96-98][62, 96-98] [62, 96-9698]1CNA Non applicabile, ACP Advance care planningingRecommendations senza referenze sono state aggiunte solo dagli esperti e dagli utenti finali durante la procedura di consensob I punteggi di valutazione vanno da 1A a 2B, 1A rappresenta una forte raccomandazione, basata su un alto livello di prove e 2C rappresenta una raccomandazione debole e un livello di prove da basso a molto basso. Un punteggio di classificazione di 1C rappresenta una “raccomandazione forte ma con un livello di evidenza da basso a molto basso”, il che significa che questa raccomandazione può essere applicata ai pazienti e alle cure, ma può comunque cambiare una volta che l’evidenza di qualità superiore è disponibile. Un punteggio di 1B rappresenta una “forte raccomandazione e un livello di evidenza moderato”, il che significa che questa raccomandazione ha un supporto sufficiente per essere applicata nella pratica. Maggiori informazioni sui punteggi GRADE possono essere trovate sul sito web del gruppo di lavoro GRADE
Quando non c’erano abbastanza prove su una domanda di ricerca clinica, il gruppo di autori ha formulato un parere di esperti. Ogni fase del processo decisionale è stata discussa e approvata all’interno del gruppo degli autori. Le raccomandazioni sono state infine riorganizzate in otto settori.
3) Processo di convalida
Poiché mancavano prove di alta qualità per molte delle domande della ricerca clinica, abbiamo condotto un’ulteriore convalida delle raccomandazioni. I risultati di questo ciclo di validazione sono stati discussi all’interno del gruppo di autori e le raccomandazioni sono state riviste se necessario e applicabile. Per valutare la chiarezza, l’accettabilità e l’importanza di ogni raccomandazione formulata, è stato creato un sondaggio online. Questo sondaggio è stato poi inviato via e-mail o inviato con la newsletter del Flemish Expertise Centre on Dementia Care e del Flemish Council for the Elderly ai potenziali utenti finali (professionisti sanitari che lavorano con persone affette da demenza) in tutti i contesti (assistenza primaria, assistenza domiciliare, assistenza residenziale e ospedali) delle Fiandre. Agli intervistati è stato chiesto di attribuire a ciascuna raccomandazione un punteggio su una scala da 1 a 7 per (i) chiarezza, (ii) accettabilità e (iii) importanza. Come risultato di questa indagine di validazione gli autori hanno fornito maggiori informazioni per alcuni dei termini utilizzati nella raccomandazione. Per esempio: gli “obiettivi di cura” sono stati definiti più chiaramente fornendo diversi esempi come “prolungare la vita, preservare la funzione o il controllo, il comfort ottimale, migliorare la qualità della vita, una “buona morte” o il sostegno da parte di coloro che gli sono vicini”.Per valutare i possibili ostacoli all’attuazione di ogni raccomandazione, abbiamo organizzato due incontri di gruppi di revisione tra pari di medici di base e geriatri l’8 marzo e il 28 aprile 2016 per fornire un feedback. Quasi il 97% di tutti i medici in Belgio sono affiliati a gruppi di peer review come questi e sono obbligati a partecipare a due riunioni su quattro all’anno per l’accreditamento[36].Infine, abbiamo fornito a diversi esperti (oltre agli autori) la prima bozza delle raccomandazioni (informata da 1 e 2) affinché formulino commenti per migliorarle. Gli esperti sono professionisti della sanità specificamente selezionati dagli autori da diverse discipline, tutti con una vasta conoscenza della pratica quotidiana della cura della demenza e dell’ACP.
Risultati
Selezione di domande di ricerca e temi clinici
Le domande di ricerca e i temi clinici che dovevano essere affrontati secondo il gruppo multidisciplinare degli autori sono riportati nella Tabella 1.
Ricerca di prove e convalida di esperti e utenti
La Figura 1 riassume il flusso di pubblicazioni selezionate attraverso la revisione di tutta la letteratura. Un totale di 67 pubblicazioni ha costituito la base di prova e di validazione sulla quale sono state sviluppate le raccomandazioni (Tabella 2). In totale, 51 utenti finali, 10 esperti, 12 medici di base e 12 geriatri hanno confermato l’importanza, la rilevanza e la chiarezza delle raccomandazioni e hanno contribuito a definirle ulteriormente. Le caratteristiche dei partecipanti al processo di validazione sono descritte nella Tabella 4.Tabella 4Ritratto professionale dei partecipanti coinvolti durante il processo di validazioneRitratto professionale dei partecipanti all’indagine (utenti finali)51 Infermiera17 Persona di riferimento per la demenza8 Operatore sociale5 Operatore sociale5 Terapista occupazionale4 Medico3Altri professionisti sanitari in vari contesti14Esperti10 Psichiatra geriatrico1 Psichiatra1 Neurologo1 Assistente sociale2 Infermiere2 Medico generico1 Terapista occupazionale1 Psicologo2Gruppi di revisione2 Medici di famiglia12 Geriatra12
Raccomandazioni
Abbiamo formulato 32 raccomandazioni relative a otto settori: 1) l’avvio di ACP, 2) la valutazione delle capacità mentali, 3) lo svolgimento di conversazioni ACP, 4) il ruolo e l’importanza delle persone vicine alla persona affetta da demenza, 5) ACP quando è difficile o non è più possibile comunicare verbalmente, 6) documentazione dei desideri e delle preferenze, compreso il trasferimento di informazioni, 7) decisione di fine vita e 8) condizioni preliminari per un’attuazione ottimale. Le principali raccomandazioni all’interno di ciascuno degli otto settori principali sono indicate in grassetto e descritte di seguito. Le raccomandazioni sono presentate nella Tabella 3, con i relativi punteggi che ne indicano la forza e i riferimenti di supporto.
Avvio di ACP
Iniziare l’ACP il più presto possibile e integrare l’ACP nella cura quotidiana delle persone affette da demenza, idealmente prima della diagnosi o di un eventuale declino cognitivo[9, 25, 37-42]. Preferibilmente, l’ACP dovrebbe essere eseguito in diverse occasioni. Queste conversazioni possono variare da brevi a lunghe discussioni a seconda di come la persona affetta da demenza si sente e di quanto tempo rimane. Possono essere pianificate o svolgersi spontaneamente quando se ne presenta l’occasione[23, 37-41,43]. Ci sono diversi fattori chiave per le conversazioni ACP identificati in letteratura: l’ammissione in una casa di cura, l’inizio di cure palliative, il deterioramento della condizione o su richiesta. In particolare per la demenza, i momenti chiave possono essere il periodo intorno alla diagnosi[38, 44], mentre si discute il piano generale di assistenza generale e/o quando si verificano cambiamenti nello stato di salute, nel luogo di residenza o nella situazione finanziaria[45]. State attenti ai fattori scatenanti e alle opportunità di iniziare ACP e sfruttate qualsiasi opportunità di parlare di ACP[46, 47]. Date le capacità cognitive fluttuanti delle persone affette da demenza, è importante sfruttare le opportunità spontanee.
Poiché la ricerca ha dimostrato che le conversazioni ACP non sono spesso avviate dalla persona che vive con la demenza, gli operatori sanitari dovrebbero avviarle a meno che la persona e/o le persone a lei vicine non lo facciano[37, 45- 47]. Sebbene i medici di base svolgano un ruolo importante, tutti gli operatori sanitari possono essere coinvolti nella discussione degli elementi ACP[46, 47] in base alle proprie competenze[37, 45- 47]. È importante avere un rapporto di fiducia con la persona e con le persone a lei vicine, avere una certa conoscenza della traiettoria della malattia[37, 48] e comunicare con il medico di base.
Ogni singolo paziente e situazione è diversa. Quindi, quando si iniziano le conversazioni ACP, bisogna considerare la persona come un individuo e considerare la sua situazione specifica[43, 49].
Valutazione della capacità mentale
Quando si esegue ACP con persone affette da demenza, si dovrebbe considerare la loro capacità mentale. Tuttavia, una diagnosi di demenza non dovrebbe essere automaticamente equiparata alla perdita della capacità mentale. Gli operatori sanitari dovrebbero considerare i seguenti principi:
Assumere sempre la piena capacità mentale[50, 51] e considerarla come una condizione fluttuante, non statica, situata su un continuum[52]. State attenti ai segnali di perdita della capacità mentale. Giudicare il compito della capacità mentale – in particolare come la capacità di prendere una certa decisione in un determinato momento[9, 50, 51]. Restare sempre in contatto con la persona in questione per assicurare la massima partecipazione [1]. Una valutazione clinica formale (compresi gli esami clinici sostanziali e neuropsicologici[53]) è necessaria solo in caso di dubbio o disaccordo tra gli operatori sanitari e/o le persone vicine alla persona, o quando le decisioni possono avere conseguenze di vasta portata, e dovrebbe quindi essere preferibilmente eseguita da un team multidisciplinare con competenze in materia di demenza. Per poter tenere conversazioni ACP con persone affette da demenza, di solito è sufficiente un giudizio clinico generale sulla capacità mentale come parte della conversazione. Strumenti disponibili per dare un giudizio clinico generale sulla capacità mentale sono il MacArthur Competence Assessment Tool[54], il metodo Vignette[55] o la guida al diagramma di flusso di Church et al.[56].
Conversazioni ACP
Nelle persone affette da demenza, l’attività cognitiva e il pensiero astratto – abilità necessarie per pensare al futuro – possono diventare difficili, anche in casi lievi [42]. Inoltre, è probabile che le persone con demenza vivano nel presente e pensare al futuro può causare paura o ansia. Questo non preclude l’ACP, ma rende le conversazioni ACP più difficili[21, 57, 58]. Per facilitare le conversazioni ACP con le persone affette da demenza, si applicano le seguenti raccomandazioni:
Quando ci si impegna in una conversazione con una persona affetta da demenza lieve/moderata, adattare lo stile e il contenuto della comunicazione al proprio livello e al proprio ritmo[59], tenendo conto dei principi della cura incentrata sulla persona[60].
Scoprire chi sono le persone significative nella loro vita, le persone che possono essere coinvolte nelle conversazioni ACP e che possono diventare i loro decisori surrogati (se non ancora nominati), spiegando che si tratta di persone che possono essere legalmente nominate per agire per conto di un paziente quando non è più in grado di farlo[47, 52, 61].
Guidare la conversazione, ma non renderla troppo graduale, nonostante il fatto che l’ACP sia spesso descritto in questo modo[59]. A causa della mancanza di consapevolezza della malattia, della diminuzione della capacità decisionale e della capacità immaginativa e della diminuzione della capacità di elaborare nuove informazioni, spesso non sarà possibile seguire una struttura prescritta[25, 43, 62]. Il materiale di supporto, se necessario e disponibile, può essere utile (per esempio applicazioni, libri, ecc.).
Esplorare la consapevolezza della malattia della persona e le sue aspettative, idee e possibili idee sbagliate sulla traiettoria della malattia [5]. È importante fornire una visione equilibrata di ciò che la convivenza con la demenza può comportare.
Se qualcuno non ha la consapevolezza della malattia o è riluttante a parlare di ACP, non insistere[42, 63]. È importante che le persone decidano le proprie preferenze in materia di informazione. Tuttavia, anche se manca la consapevolezza della malattia, rimane importante esplorare i valori e le preoccupazioni generali di qualcuno come parte del processo ACP [9,64].
Leconversazioni ACP si svolgono meglio in diverse occasioni e per un certo periodo di tempo[37, 42, 45]. Possono riguardare diversi argomenti diversi: i valori più generali della persona, la sua esperienza del presente e le sue paure sul futuro e la fine della vita, i suoi obiettivi di cura futuri, le sue specifiche decisioni anticipate sulla fine della vita e le direttive anticipate.
Imparare a conoscere chi è la persona che vive con la demenza “nel suo insieme”: esplorare la storia della sua vita e i valori, le norme, le idee e le preferenze più importanti per capire chi è la persona, quali sono stati gli eventi significativi della sua vita e cosa dà un senso alla sua vita [15, 25,37, 45].
Esplorare le esperienze attuali delle persone in termini di qualità della vita, paure e preoccupazioni. ACP non riguarda solo l’esplorazione del futuro, ma include un’attenzione al passato e al presente[4, 22, 63, 65]. Esplorare le paure e le preoccupazioni della persona per il futuro e per la fine della vita [42,63].
Se possibile e auspicabile, guidare la persona nel formulare i suoi obiettivi di cura[8, 49, 66, 67], cioè prolungare la vita, preservare la funzione o il controllo, il comfort ottimale, migliorare la qualità della vita, una ‘buona morte’ o il sostegno da parte di chi le è vicino [67, 68]. Siate consapevoli che tali obiettivi di cura possono cambiare lungo tutta la traiettoria della malattia[58, 69, 70].
Se possibile e auspicabile, guidate la persona nella formulazione di desideri specifici riguardanti specifiche decisioni di fine vita[45]. La maggior parte delle persone affette da demenza non muore all’improvviso. Spesso sono rilevanti le decisioni mediche riguardanti la somministrazione di antibiotici, il ricovero in ospedale in caso di problemi di salute urgenti, la rianimazione e i fluidi artificiali[2, 71, 72]. Fornire le informazioni necessarie sulle diverse possibili decisioni di fine vita nella demenza (ad esempio, decisioni di non trattamento) e prevenire le idee sbagliate riguardo all’uso di rianimazione[73-76], alimenti e liquidi artificiali [77] e antibiotici vicino alla fine della vita [78-80].
Esplorare se la persona desidera completare una direttiva anticipata o se lo ha fatto in passato[45]. È importante stabilire che documentare i desideri in modo formale può essere rilevante per le persone affette da demenza, specialmente per coloro che non hanno parenti stretti o che apprezzano di avere il controllo. Tuttavia, i professionisti dovrebbero essere consapevoli del fatto che in alcune situazioni, le direttive anticipate potrebbero non essere abbastanza specifiche da informare pienamente il processo decisionale. I desideri documentati contribuiranno a guidare il processo decisionale di fine vita per i medici, gli altri operatori sanitari e le persone vicine alla persona, e saranno di grande aiuto se saranno il risultato di un processo di comunicazione continuo e approfondito.
Queste raccomandazioni si applicano principalmente alle persone affette da demenza lieve o moderata, con le quali è ancora possibile una comunicazione verbale. La parte 5 si concentra maggiormente sulle persone affette da demenza che trovano difficile o impossibile comunicare verbalmente.
Il ruolo e l’importanza delle persone vicine alla persona affetta da demenza
A causa della graduale perdita di capacità mentale nelle persone affette da demenza – più che in altre malattie – spesso dipendono da altre persone[81]. La famiglia o altre persone significative dovrebbero preferibilmente essere coinvolte il più presto possibile nel processo ACP ed essere informate sul ruolo di un decisore surrogato[9, 25, 40]. Nell’ambito del processo ACP, sarà importante determinare chi può essere coinvolto nelle conversazioni ACP, ma può essere difficile stabilire quando coinvolgerli e quante persone coinvolgere. Se viene nominato un rappresentante legale, questi dovrebbe essere coinvolto nelle conversazioni ACP[82]. Se non c’è un rappresentante legale, sarà utile considerare chi sarà il primo punto di contatto per i professionisti, e come le informazioni vengono trasferite tra gli altri membri della famiglia. Ogni famiglia è unica, quindi il coinvolgimento della famiglia e delle persone vicine alla persona affetta da demenza deve essere valutato caso per caso, insieme alla persona affetta da demenza stessa.
Valutare la consapevolezza della malattia delle persone vicine alla persona e informarle sulla traiettoria della malattia prevista e sulle possibili decisioni di fine vita[15, 23, 43, 83, 84]. Si dovrebbero anche esplorare le preferenze informative delle persone vicine alla persona affetta da demenza. Assicuratevi che le informazioni sulla traiettoria della malattia siano corrette e assicuratevi che siano equilibrate e qualificate. In molti casi la persona affetta da demenza non vive la sua malattia come qualcosa di “negativo” come fa la famiglia [82, 85].
Prestare attenzione ai bisogni di coloro che sono vicini alla persona durante il processo ACP[9, 25, 63, 65, 86]. Un sostegno, un’educazione e un’informazione sufficienti sono importanti, così come affrontare le preoccupazioni, le esperienze, le aspettative e le paure della famiglia. La famiglia può essere impreparata o sentirsi in colpa[87]. Prestare attenzione al processo emotivo dei membri della famiglia e considerare che le dinamiche familiari possono cambiare nel tempo. Non è sempre facile armonizzare i punti di vista di chi è vicino alla persona affetta da demenza.
ACP quando è difficile o non è più possibile comunicare verbalmente
In caso di demenza moderata o grave, dove la comunicazione verbale è difficile o non più possibile, è difficile formulare obiettivi di cura o preferenze di cura specifiche. Mantenere un legame con la persona affetta da demenza e garantire la massima partecipazione[1, 42]. Rispondere alle loro emozioni, curare la comunicazione non verbale e osservare il comportamento per capire meglio la loro attuale qualità di vita, le loro paure e i loro desideri[63]. Le emozioni delle persone possono dare una direzione al processo decisionale [42]. Successivamente, coinvolgere attivamente la famiglia o altre persone vicine nel processo ACP e nell’espressione degli obiettivi di cura e dei desideri relativi alle decisioni di fine vita[9, 25, 83] per comprendere la storia della vita della persona affetta da demenza e per interpretare alcuni aspetti del suo comportamento o delle sue emozioni.
Documentazione dei desideri e delle preferenze, compreso il trasferimento di informazioni
Dopo ogni discussione ACP pianificata o non pianificata, gli operatori sanitari dovrebbero scrivere il risultato nelle cartelle cliniche/cura del paziente, ad esempio i valori, i desideri o gli obiettivi di cura della persona e, se del caso, i dettagli di una direttiva anticipata o di un rappresentante legale [25,88, 89]. Se la persona lo desidera, sostenerla nella formulazione di desideri specifici e decisioni anticipate relative alla fine della sua vita, verificare se in passato ha fatto un testamento scritto formale o se ne vuole fare uno ora[45] e fornire informazioni sui vantaggi e gli svantaggi delle direttive anticipate[2, 71]. Si raccomanda di valutare regolarmente la documentazione ACP nell’ambito del processo ACP, ad esempio in previsione di un “turno di risposta” [15, 25,40, 47, 70]. Le decisioni possono essere riviste in qualsiasi momento.
I risultati del processo ACP devono essere comunicati all’interno dell’équipe di assistenza, cioè i valori, le preferenze e gli obiettivi di assistenza e le eventuali direttive anticipate o i rappresentanti legali, in particolare in caso di trasferimento in un altro ambiente di assistenza. Ciò può essere fatto verbalmente o per iscritto. Assicuratevi che le informazioni pertinenti siano disponibili ad altri fornitori di assistenza nelle sezioni condivise della cartella clinica o che siano facilmente accessibili quando necessario, specialmente in caso di trasferimento in un altro ambiente di assistenza. La condivisione delle informazioni dovrebbe sempre tenere conto del segreto professionale[66].
Processo decisionale di fine vita
Nonostante tutte le buone intenzioni, l’ACP non può anticipare tutti i possibili scenari. La traiettoria della malattia non è sempre prevedibile e l’onere emotivo che grava su chi è vicino alla persona affetta da demenza può spesso portare a una certa confusione e alla mancanza di chiarezza nel fornire assistenza. Quando è necessario prendere decisioni di fine vita, è importante soppesare attentamente i desideri espressi e/o scritti in precedenza rispetto all’interesse attuale della persona affetta da demenza, in consultazione con la cerchia ristretta della persona e con gli operatori sanitari coinvolti [84,90, 91]. Il processo decisionale di fine vita comporta decisioni condivise e il maggior consenso possibile tra gli operatori sanitari e le persone vicine alla persona[84, 90, 91]. Materiali come il Framework for Weighing Previously Expressed Preferences v. Best Interest possono supportare i professionisti e la famiglia nel prendere queste decisioni, ponendo domande come: “la situazione clinica è un’emergenza che non concede tempo per deliberare?”, “in considerazione dei valori e degli obiettivi della persona, quanto è probabile che i benefici dell’intervento siano superiori agli oneri?”in che misura il testamento biologico si adatta alla situazione attuale?”, “quanto margine di manovra ha lasciato al paziente il surrogato nel prevalere sul testamento biologico?” o “in che misura il surrogato rappresenta l’interesse del paziente?
Precondizioni per l’attuazione ottimale di ACP
L’attuazione ottimale dell’ACP richiede una migliore comprensione pubblica delle questioni relative alle cure di fine vita[92] e pazienti più informati o istruiti sull’ACP[92]. Inoltre, è importante fornire sufficienti opportunità di formazione agli operatori sanitari per imparare a condurre le conversazioni ACP. Un adeguato sostegno nella pratica è essenziale per rendere gli operatori sanitari fiduciosi di potersi impegnare nell’ ACP[9, 20, 25, 93, 94]. La formazione dovrebbe comprendere almeno i principi di base dell’ACP, il quadro giuridico, deontologico ed etico, l’importanza e l’efficacia dell’ACP, una discussione sugli ostacoli che i professionisti stessi si frappongono all’ACP, tecniche generali di comunicazione e capacità di ascolto attivo, documentazione delle direttive anticipate, comunicazione con altri professionisti e come prendere decisioni in determinati momenti [9,20, 25, 93, 94]. Sono importanti anche le sessioni interattive con giochi di ruolo, sessioni di ritorno regolari e un’attenzione specifica per gli atteggiamenti nei confronti della morte e del morire[5, 25, 62, 95, 96]. Questi programmi di formazione dovrebbero essere organizzati per i medici di base, gli infermieri e gli assistenti sociali, poiché le competenze che forniscono spesso fungono da importante facilitatore tra medico e paziente[92, 97].
Integrare l’ACP nella missione e nella politica dell’organizzazione e incorporare l’ACP nella cultura organizzativa[62, 97-99]. ACP dovrebbe essere parte della pratica quotidiana e questo richiede una cultura di sostegno all’interno della comunità o della struttura e un atteggiamento aperto alle conversazioni sulle cure di fine vita e sulla demenza tra gli operatori sanitari. All’interno della struttura dovrebbe esserci una chiara dichiarazione d’intenti e una politica formale riguardante gli ACP e come integrarli nelle cure di routine[1, 62, 92, 97-99].
Discussione
Ci sono poche linee guida disponibili per gli operatori sanitari che riguardano gli ACP nelle persone affette da demenza, specialmente quelle con demenza ad esordio precoce. E queste linee guida spesso non sono sviluppate utilizzando una ricerca di alta qualità, soprattutto perché tale ricerca è carente. Le difficoltà di attuazione degli ACP in questa popolazione e la valutazione dei “principi attivi” necessari per modificare con successo i risultati non sono pienamente affrontate nella ricerca e le ricerche di valutazione di alta qualità, come gli studi di progettazione randomizzata, sono ancora rare [6, 8]. Mantenendo un approccio sistematico, potremmo definire una serie unica di raccomandazioni per fornire ACP alle persone affette da demenza e a quelle vicine. Così facendo, abbiamo integrato le competenze disponibili nella cura della demenza in una vasta gamma di contesti nelle Fiandre con le prove esistenti sull’ACP, come riportato nella letteratura scientifica.
Rispetto agli ACP in altre malattie in cui la mancanza di capacità mentale è un problema meno pronunciato, l’esecuzione di ACP nella demenza comporta diversi punti di attenzione significativi e specifici. Il più importante riguarda il coinvolgimento delle persone vicine alla persona affetta da demenza. I familiari, i parenti, i parenti stretti e altre persone significative sono un importante punto di contatto nella comunicazione e nel processo decisionale nelle cure di fine vita per le persone affette da demenza, poiché la loro capacità mentale diminuisce gradualmente e la comunicazione verbale diventa più difficile o addirittura impossibile[1]. Il coinvolgimento di queste persone fin dalle fasi iniziali della condizione è della massima importanza nel fornire un’assistenza di fine vita che corrisponda ai desideri e alle preferenze della persona affetta da demenza.
Un secondo elemento molto specifico degli ACP nelle persone affette da demenza è la traiettoria della diminuzione della capacità mentale[81]. La questione clinica della valutazione della capacità mentale come parte del processo ACP è stata fortemente dibattuta dal gruppo degli autori e all’interno del gruppo di esperti e si è dimostrata essere qualcosa di difficile da fare nella pratica. A causa di queste discussioni, abbiamo concluso che la capacità mentale dovrebbe essere considerata come un continuum che fluttua nel tempo e che è specifico del compito. Inoltre, raccomandiamo che le valutazioni formali, approfondite e multidisciplinari delle capacità non siano sempre effettuate prima o durante le conversazioni ACP. Tuttavia, è importante che gli operatori sanitari tengano le conversazioni ACP in punti diversi per un certo periodo di tempo, facendo uso di osservazioni spontanee su questioni relative agli ACP da parte dei pazienti o di coloro che gli sono vicini, oltre ad avere conversazioni pianificate. Tali conversazioni non sempre seguiranno un formato predefinito o strutturato e varieranno per contenuto, lunghezza e profondità a seconda dello stato fisico, cognitivo e psicologico della persona. In alcuni casi, ad esempio quando è necessario prendere decisioni di alto livello, sarà necessaria una valutazione multidisciplinare formale e un rinvio. Tuttavia, sono necessarie ulteriori ricerche per corroborare questa raccomandazione.
Gli ACP sono una parte importante dell’assistenza, soprattutto nelle persone anziane e in quelle affette da demenza. Le persone anziane stesse indicano che trovano l’ACP prezioso[17, 63] e c’è un’importante letteratura che suggerisce che ha un impatto positivo sui risultati, che va dalla soddisfazione della famiglia per l’assistenza alla concordanza tra le cure di fine vita e i desideri dei pazienti, specialmente per le persone anziane e quelle che vivono in case di cura[100, 101]. Vi sono ulteriori prove, anche se di qualità variabile, che dimostrano che ACP ha il potenziale di ridurre i ricoveri ospedalieri inappropriati e i costi sanitari nelle case di cura dove la spesa per l’assistenza di fine vita è già alta[39, 102]. Un’ulteriore ricerca di alta qualità, tuttavia, rafforzerebbe le argomentazioni a favore dell’inserimento di ACP nell’assistenza di routine per la demenza e fornirebbe informazioni su come possa essere effettuata in modo efficace e sostenibile[103]. Più specificamente, abbiamo trovato una ricerca insufficiente a sostenere le raccomandazioni su questioni quali una definizione uniforme della mancanza di capacità mentale, le controindicazioni per avviare ACP e cosa fare se una persona che vive con la demenza non vuole coinvolgere le persone che le sono vicine.
Per quanto ne sappiamo, questa è la prima linea guida pratica sviluppata per migliorare le prestazioni degli operatori sanitari nel fornire ACP alle persone affette da demenza in tutti i contesti. Finora, le linee guida esistenti dei gruppi di sviluppo delle linee guida (GDG), come il National Institute for Health and Clinical Excellence (Istituto nazionale per la salute e l’eccellenza clinica), hanno messo in evidenza solo alcune raccomandazioni riguardanti la pianificazione anticipata delle cure, e si limitano a “discutere l’uso delle direttive anticipate e identificare i surrogati” e “discutere in anticipo la rianimazione cardiopolmonare e informare i pazienti sugli scarsi risultati nella demenza avanzata” [26, 104]. Tuttavia, l’evidenza mostra che l’ACP può essere più efficace nel soddisfare le preferenze di un paziente quando comporta più di semplici documenti scritti e di una conversazione [39, 101] . Le iniziative locali hanno cercato di fornire una guida in ACP specificamente per le persone affette da demenza, ma mancano la standardizzazione e la coerenza[105]. Consultando sia esperti che utenti finali con diversi background professionali, siamo stati in grado di includere un ampio supporto multidisciplinare a livello regionale per queste raccomandazioni. Inoltre, anziché limitarsi a richiedere agli esperti di concordare o non concordare con le affermazioni predefinite, essi sono stati attivamente coinvolti nello specificare le affermazioni in modo da ottenere un maggiore consenso. Riteniamo che questa sia una caratteristica importante del nostro lavoro.
Tuttavia, i lettori devono essere consapevoli dei diversi limiti di questo studio. Il primo limite è il numero piuttosto ridotto di esperti(n=10) e di utenti finali (n=51) che hanno risposto all’indagine, e il numero limitato di gruppi di peer-review (n=2). Inoltre, la fonte principale da cui derivano le raccomandazioni sono le revisioni sistematiche di bassa qualità, gli studi in cui la qualità delle prove non è stata valutata formalmente, e le opinioni di professionisti o esperti. Desideriamo anche chiarire che i professionisti devono essere consapevoli delle politiche e della legislazione che regolano la giurisdizione in cui lavorano e che devono attenersi alle politiche e alla legislazione esistenti quando applicano le raccomandazioni. Inoltre, i professionisti del settore sanitario devono naturalmente applicare queste raccomandazioni sul posto di lavoro per servire da guida generale, ma seguirle in base al proprio giudizio e ad ogni singolo caso. Le raccomandazioni non servono né come programma d’azione né come linea guida rigorosa, ma forniscono un elenco di punti di attenzione per gli operatori sanitari coinvolti nella cura della demenza. Raccomandiamo loro di essere addestrati anche a svolgere l’attività ACP, perché la semplice fornitura e diffusione di una linea guida come questa non sarà sufficiente a migliorare la loro pratica[106]. I risultati di questo studio possono servire come strumento per educare gli operatori sanitari.
La linea guida finale richiede ulteriori test nella pratica clinica. Tuttavia, il feedback iniziale da parte di professionisti sanitari esperti e di altri esperti ha indicato che può essere utile in termini di avvio, organizzazione e attuazione di ACP e quando si tengono discussioni sulle cure di fine vita. Tali linee guida hanno dimostrato di svolgere un ruolo importante nel rendere possibile una buona assistenza fino alla fine della vita che viene fornita secondo elevati standard etici e di qualità[1].
Conclusione
Sono disponibili poche prove di alta qualità su ACP in cura per la demenza. Combinando le prove disponibili con le opinioni degli esperti e degli utenti, abbiamo definito una serie unica di raccomandazioni per gli ACP nelle persone affette da demenza. Queste raccomandazioni saranno utilizzate per lo sviluppo di una linea guida fiamminga per gli ACP nelle persone affette da demenza e possono servire come un prezioso strumento per educare i professionisti della sanità su come eseguire l’ACP in tutti i contesti.
References
- . ISBN: 9789241564458Publisher Full Text
- Givens JL, Kiely DK, Carey K, Mitchell SL. Healthcare proxies of nursing home residents with advanced dementia: decisions they confront and their satisfaction with decision-making: Healthcare Proxy Decision-Making Satisfaction. J Am Geriatric Soc. 2009; 57:1149-1155. DOI
- Sampson EL, Burns A, Richards M. Improving end-of-life care for people with dementia. Br J Psychiatry. 2011; 199:357-359. DOI | PubMed
- Exley C, Bamford C, Hughes J, Robinson L. Advance care planning: an opportunity for person-centered care for people living with dementia. Dementia. 2009; 8:419-424. DOI
- Van Mechelen W. Federatie Palliatieve Zorg Vlaanderen vzw. 2014.
- .Publisher Full Text
- Royal College of Physicians of London. Royal College of Physicians of London. 2009.
- Dixon J, Karagiannidou M, Knapp M. The effectiveness of advance care planning in improving end-of-life outcomes for people with dementia and their Carers: a systematic review and critical discussion. J Pain Symptom Manag. 2018; 55:132-150.e1. DOI
- Dening KH, Jones L, Sampson EL. Advance care planning for people with dementia: a review. Int Psychogeriatr. 2011; 23:1535-1551. DOI | PubMed
- Vandervoort A, Houttekier D, Vander Stichele R, van der Steen JT, Van den Block L. Quality of dying in nursing home residents dying with dementia: does advanced care planning matter? A Nationwide postmortem study. Montazeri a. PLoS One. 2014; 9:e91130. DOI | PubMed
- Vandervoort A, Houttekier D, Van den Block L, van der Steen JT, Stichele RV, Deliens L. Advance care planning and physician orders in nursing home residents with dementia: a Nationwide retrospective study among professional caregivers and relatives. J Pain Symptom Manag. 2014; 47:245-256. DOI
- De Gendt C, Bilsen J, Mortier F, Vander Stichele R, Medical DL. End-of-life decision-making and terminal sedation among very old patients. Gerontology. 2009:99–105.
- Meeussen K, Van den Block L, Echteld M, Bossuyt N, Bilsen J, Van Casteren V. Advance care planning in Belgium and the Netherlands: a Nationwide retrospective study via sentinel networks of general practitioners. J Pain Symptom Manag. 2011; 42:565-577. DOI
- Wickson-Griffiths A, Kaasalainen S, Ploeg J, McAiney C. A review of advance care planning programs in long-term care homes: are they dementia friendly?. Nurs Res Pract. 2014; 2014:1-11. DOI
- Ashton SE, Roe B, Jack B, McClelland B. End of life care: The experiences of advance care planning amongst family caregivers of people with advanced dementia – A qualitative study. Dementia [Internet]. 2014 [cited 2015 Apr 10]; Available from: http://dem.sagepub.com/cgi/doi/10.1177/1471301214548521
- Stewart F, Goddard C, Schiff R, Hall S. Advanced care planning in care homes for older people: a qualitative study of the views of care staff and families. Age Ageing. 2011; 40:330-335. DOI | PubMed
- Sharp T, Moran E, Kuhn I, Barclay S. Do the elderly have a voice? Advance care planning discussions with frail and older individuals: a systematic literature review and narrative synthesis. Br J Gen Pract. 2013; 63:657-668. DOI
- Lovell A, Yates P. Advance care planning in palliative care: a systematic literature review of the contextual factors influencing its uptake 2008-2012. Palliat Med. 2014; 28:1026-1035. DOI | PubMed
- Black BS, Fogarty LA, Phillips H, Finucane T, Loreck DJ, Baker A. Surrogate decision makers’ understanding of dementia patients’ prior wishes for end-of-life care. J Aging Health. 2009; 21:627-650. DOI | PubMed
- Ke L-S, Huang X, O’Connor M, Lee S. Nurses’ views regarding implementing advance care planning for older people: a systematic review and synthesis of qualitative studies. J Clin Nurs. 2015;24(15-16):2057–73. 10.1111/jocn.12853.
- Dickinson C, Bamford C, Exley C, Emmett C, Hughes J, Robinson L. Planning for tomorrow whilst living for today: the views of people with dementia and their families on advance care planning. Int Psychogeriatr. 2013; 25:2011-2021. DOI | PubMed
- Lorenz KA, Lynn J, Dy SM, Shugarman LR, Wilkinson A, Mularski RA. Evidence for improving palliative care at the end of life: a systematic review. Ann Intern Med. 2008; 148:147-159. DOI | PubMed
- Dening KH, Jones L, Sampson EL. Preferences for end-of-life care: a nominal group study of people with dementia and their family carers. Palliat Med. 2013;27(5):409–17. 10.1177/0269216312464094.
- Dempsey D. Advance care planning for people with dementia: benefits and challenges. Int J Palliat Nurs. 2013; 19:227-234. DOI | PubMed
- van der Steen JT. Dying with dementia: what we know after more than a decade of research. J Alzheimers Dis. 2010; 22:37-55. DOI | PubMed
- Ngo J, Holroyd-Leduc JM. Systematic review of recent dementia practice guidelines. Age Ageing. 2015; 44:25-33. DOI | PubMed
- Briggs L. Shifting the focus of advance care planning: using an in-depth interview to build and strengthen relationships. J Palliat Med. 2004; 7:341-349. DOI | PubMed
- Maymone MB de C, Gan SD, Bigby M. Evaluating the strength of clinical recommendations in the medical literature: GRADE, SORT, and AGREE. J Invest Dermatol. 2014; 134:e25. DOI
- Shea BJ, Hamel C, Wells GA, Bouter LM, Kristjansson E, Grimshaw J. AMSTAR is a reliable and valid measurement tool to assess the methodological quality of systematic reviews. J Clin Epidemiol. 2009; 62:1013-1020. DOI | PubMed
- .Publisher Full Text
- The ADAPTE Collaboration. The ADAPTE process: Resource Toolkit for Guideline Adaptation. Version 2.0. [Internet]. 2009.
- Fervers B, Burgers JS, Voellinger R, Brouwers M, Browman GP, Graham ID. Guideline adaptation: an approach to enhance efficiency in guideline development and improve utilisation. BMJ Qual Saf. 2011; 20:228-236. DOI | PubMed
- Attia A. Adaptation of international evidence based clinical practice guidelines: the ADAPTE process. Middle East Fertil Soc J. 2013; 18:123-126. DOI
- Van Royen P. GRADE. Een systeem om niveau van bewijskracht en graad van aanbeveling aan te geven. Huisarts Nu. 2008; 37:505-509.
- Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, Guyatt GH, Harbour RT, Haugh MC, Henry D, Hill S, Jaeschke R, Leng G, Liberati A, Magrini N, Mason J, Middleton P, Mrukowicz J, O’Connell D, Oxman AD, Phillips B, Schünemann HJ, Edejer T, Varonen H, Vist GE, Williams JW Jr, Zaza S. GRADE Working Group. Grading quality of evidence and strength of recommendations. BMJ. 2004;328(7454):1490.
- Reyniers T, Houttekier D, Cohen J, Pasman HR, Deliens L. What justifies a hospital admission at the end of life? A focus group study on perspectives of family physicians and nurses. Palliat Med. 2014; 28:941-948. DOI | PubMed
- Burlá C, Rego G, Nunes R. Alzheimer, dementia and the living will: a proposal. Med Health Care Philos. 2014; 17:389-395. DOI | PubMed
- Garand L, Dew MA, Lingler JH, DeKosky ST. Incidence and predictors of advance care planning among persons with cognitive impairment. Am J Geriatr Psychiatry Off J Am Assoc Geriatr Psychiatry.. 2011; 19:712-720. DOI
- Robinson L, Dickinson C, Rousseau N, Beyer F, Clark A, Hughes J. A systematic review of the effectiveness of advance care planning interventions for people with cognitive impairment and dementia. Age Ageing. 2012; 41:263-269. DOI | PubMed
- Sampson EL. Palliative care for people with dementia. Br Med Bull. 2010; 96:159-174. DOI | PubMed
- Vandervoort A, Van den Block L, van der Steen JT, Vander Stichele R, Bilsen J, Deliens L. Advance directives and physicians’ orders in nursing home residents with dementia in Flanders, Belgium: prevalence and associated outcomes. Int Psychogeriatr. 2012; 7:1133-1143. DOI
- de Boer ME, Dröes R-M, Jonker C, Eefsting JA, Hertogh CMPM. Thoughts on the future: the perspectives of elderly people with early-stage Alzheimer’s disease and the implications for advance care planning. AJOB Prim Res. 2012; 3:14-22. DOI
- van der Steen JT, Van Soest-Poortvliet MC, Hallie-Heierman M, Onwuteaka-Philipsen BD, Deliens L, de Boer ME. Factors associated with initiation of advance care planning in dementia: a systematic review. J Alzheimers Dis. 2014; 40:743-757. DOI | PubMed
- Poppe M, Burleigh S, Banerjee S. Qualitative evaluation of advanced care planning in early dementia (ACP-ED). Forloni G, editor. PLoS One. 2013; 8:e60412. DOI | PubMed
- Hirschman KB, Kapo JM, Karlawish JHT. Identifying the factors that facilitate or hinder advance planning by persons with dementia. Alzheimer Dis Assoc Disord. 2008; 22:293-298. DOI | PubMed
- Brazil K, Carter G, Galway K, Watson M, van der Steen JT. General practitioners’ perceptions on advance care planning for patients living with dementia. BMC Palliat Care [Internet]. 2015 [cited 2015 May 4];14. Available from:Publisher Full Text
- Scott IA, Mitchell GK, Reymond E J, Daly MP. Difficult but necessary conversations — the case for advance care planning. Med J Aust. 2013; 199:662-666. DOI | PubMed
- Seeber AA, Hijdra A, Vermeulen M, Willems DL. Discussions about treatment restrictions in chronic neurologic diseases: a structured review. Neurology. 2012; 78:590-597. DOI | PubMed
- Bélanger E, Rodríguez C, Groleau D. Shared decision-making in palliative care: a systematic mixed studies review using narrative synthesis. Palliat Med. 2011; 25:242-261. DOI | PubMed
- Kim SYH, Appelbaum PS. The capacity to appoint a proxy and the possibility of concurrent proxy directives. Behav Sci Law. 2006; 24:469-478. DOI | PubMed
- Capacity BRL. consent. Curr Opin Psychiatry. 2001; 14:491-499. DOI
- Robinson L, Tang E, Taylor J-P. Dementia: Timely diagnosis and early intervention. BMJ. 2015;350:h3029–9.
- Welie SPK, Dute J, Nys H, van Wijmen FCB. Patient incompetence and substitute decision-making: an analysis of the role of the health care professional in Dutch law. Health Policy Amst Neth 2005;73:21–40.
- Grisso T, Appelbaum P, Hill-Fotouhi C. The MacCAT-T: a clinicial tool to assess patients’ capacities to make treatment decisions. Psychiatr Serv. 1997; 48:1415. DOI | PubMed
- Vellinga A. To know or not to be: development of an instrument to assess decision-making capacity of cognitively impaired elderly patients. [S.l.]: s.n.]; 2006.
- Church M, Watts S. Assessment of mental capacity: a flow chart guide. Psychiatr Bull. 2007; 31:304-307. DOI
- Dening KH, Greenish W, Jones L, Mandal U, Sampson EL. Barriers to providing end-of-life care for people with dementia: a whole-system qualitative study. BMJ Support Palliat Care. 2012; 2:103-107. DOI | PubMed
- de Boer ME, Dröes R-M, Jonker C, Eefsting JA, Hertogh CMPM. Advance directives for euthanasia in dementia: how do they affect resident care in Dutch nursing homes? Experiences of physicians and relatives. J Am Geriatr Soc. 2011; 59:989-996. DOI | PubMed
- Chan HY, Pang SM. Readiness of Chinese frail old age home residents towards end-of-life care decision making: readiness towards end-of-life decision making. J Clin Nurs. 2011; 20:1454-1461. DOI | PubMed
- The American Geriatrics Society Expert Panel on Person-Centered Care. Person-centered care: a definition and essential elements. J Am Geriatr Soc. 2016; 64:15-18. DOI | PubMed
- Séchaud L, Goulet C, Morin D, Mazzocato C. Advance care planning for institutionalised older people: an integrative review of the literature. Int J Older People Nursing. 2014; 9:159-168. DOI
- Raymond M, Warner A, Davies N, Nicholas N, Manthorpe J, Iliffe S. Palliative and end of life care for people with dementia: lessons for clinical commissioners. Prim Health Care Res Dev. 2014; 15:406-417. DOI | PubMed
- Piers RD, van Eechoud IJ, Van Camp S, Grypdonck M, Deveugele M, Verbeke NC. Advance care planning in terminally ill and frail older persons. Patient Educ Couns. 2013; 90:323-329. DOI | PubMed
- Hirschman KB, Kapo JM, Karlawish JHT. Why doesn’t a family member of a person with advanced dementia use a substituted judgment when making a decision for that person?. Am J Geriatr Psychiatry Off J Am Assoc Geriatr Psychiatry. 2006; 14:659-667. DOI
- Levi BH, Dellasega C, Whitehead M, Green MJ. What influences individuals to engage in advance care planning?. Am J Hosp Palliat Med. 2010; 27:306-312. DOI
- Clayton JM, Hancock KM, Butow PN, Tattersall MH, Currow DC, Adler J. Clinical practice guidelines for communicating prognosis and end-of-life issues with adults in the advanced stages of a life-limiting illness, and their caregivers. Med J Aust. 2007; 187:478.
- van der Steen JT, Radbruch L, Hertogh CM, de Boer ME, Hughes JC, Larkin P. White paper defining optimal palliative care in older people with dementia: a Delphi study and recommendations from the European Association for Palliative Care. Palliat Med. 2014; 28:197-209. DOI | PubMed
- Mold JW, Blake GH, Becker LA. Goal-oriented medical care. Fam Med. 1991; 23:46-51. PubMed
- American Medical Association. Education for Physicians on End-of-life Care (EPEC) Project. Plenary 3 Elem Models End–Life Care [Internet]. 1999. Available from:Publisher Full Text
- Steeman E, Tournoy J, Grypdonck M, Godderis J, De Casterlé BD. Managing identity in early-stage dementia: maintaining a sense of being valued. Ageing Soc. 2013; 33:216-242. DOI
- McMahan RD, Knight SJ, Fried TR, Sudore RL. Advance care planning beyond advance directives: perspectives from patients and surrogates. J Pain Symptom Manag. 2013; 46:355-365. DOI
- Vandervoort A, Van den Block L, van der Steen JT, Volicer L, Stichele RV, Houttekier D. Nursing home residents dying with dementia in Flanders, Belgium: a Nationwide postmortem study on clinical characteristics and quality of dying. J Am Med Dir Assoc. 2013; 14:485-492. DOI | PubMed
- Benkendorf R, Swor RA, Jackson R, Rivera-Rivera EJ, Demrick A. Outcomes of cardiac arrest in the nursing home: destiny or futility? [see comment]. Prehospital Emerg Care Off J Natl Assoc EMS Physicians Natl Assoc State EMS Dir. 1997; 1:68-72. DOI
- van Gijn MS, Frijns D, van de Glind EMM, C van Munster B, Hamaker ME. The chance of survival and the functional outcome after in-hospital cardiopulmonary resuscitation in older people: a systematic review. Age Ageing 2014;43:456–463.
- Ebell MH, Afonso AM. Pre-arrest predictors of failure to survive after in-hospital cardiopulmonary resuscitation: a meta-analysis. Fam Pract. 2011; 28:505-515. DOI | PubMed
- .Publisher Full Text
- Van der Steen, Jenny, de Graas, T. Zorg rond het levenseinde voor mensen met de ziekte van Alzheimer of een andere vorm van dementie. Een handreiking voor familie en naasten. (Leaflet). VU Medisch Centrum – EMGO Instituut voor onderzoek naar gezondheid en zorg.; 2011.
- Szafara KL, Kruse RL, Mehr DR, Ribbe MW, van der Steen JT. Mortality following nursing home-acquired lower respiratory infection: LRI severity, antibiotic treatment, and water intake. J Am Med Dir Assoc. 2012; 13:376-383. DOI | PubMed
- van der Steen JT, Lane P, Kowall NW, Knol DL, Volicer L. Antibiotics and mortality in patients with lower respiratory infection and advanced dementia. J Am Med Dir Assoc. 2012; 13:156-161. DOI | PubMed
- Juthani-Mehta M, Malani PN, Mitchell SL. Antimicrobials at the end of life: an opportunity to improve palliative care and infection management. JAMA. 2015; 314:2017-2018. DOI | PubMed
- Mitchell SL, Teno JM, Kiely DK, Shaffer ML, Jones RN, Prigerson HG. The clinical course of advanced dementia. N Engl J Med. 2009; 361:1529-1538. DOI | PubMed
- Hoe J, Katona C, Orrell M, Livingston G. Quality of life in dementia: care recipient and caregiver perceptions of quality of life in dementia: the LASER-AD study. Int J Geriatr Psychiatry. 2007; 22:1031-1036. DOI | PubMed
- Sampson EL, Jones L, Thuné-Boyle ICV, Kukkastenvehmas R, King M, Leurent B. Palliative assessment and advance care planning in severe dementia: an exploratory randomized controlled trial of a complex intervention. Palliat Med. 2011; 25:197-209. DOI | PubMed
- Gillick MR. Doing the right thing: a geriatrician’s perspective on medical care for the person with advanced dementia. J law med ethics J am Soc law. Med Ethics. 2012; 40:51-56.
- Steeman E, Godderis J, Grypdonck M, De Bal N, Dierckx de Casterlé B. Living with dementia from the perspective of older people: is it a positive story?. Aging Ment Health. 2007; 11:119-130. DOI | PubMed
- Detering KM, Hancock AD, Reade MC, Silvester W. The impact of advance care planning on end of life care in elderly patients: randomised controlled trial. BMJ. 2010;340:c1345–5.
- Smith AK, Lo B, Sudore R. When previously expressed wishes conflict with best interests. JAMA Intern Med. 2013; 173:1241-1245. DOI | PubMed
- Shanley C, Whitmore E, Khoo A, Cartwright C, Walker A, Cumming RG. Understanding how advance care planning is approached in the residential aged care setting: a continuum model of practice as an explanatory device. Australas J Ageing. 2009; 28:211-215. DOI | PubMed
- Bernacki RE, Block SD. Communication about serious illness care goals: a review and synthesis of best practices. JAMA Intern Med. 2014; 174:1994. DOI | PubMed
- Harvey M. Advance Directives and the severely demented. J Med Philos. 2006; 31:47-64. DOI | PubMed
- Lemmens C. End-of-life decisions and demented patients. What to do if the patient’s current and past wishes are in conflict with each other?. Eur J Health Law. 2012; 19:177-186. DOI | PubMed
- Conroy S, Fade P, Fraser A, Schiff R, Guideline Development Group. Advance care planning: concise evidence-based guidelines. Clin Med Lond Engl. 2009; 9:76-79. DOI
- De Gendt C, Bilsen J, Stichele RV, Deliens L. Nursing home policies regarding advance care planning in Flanders, Belgium. Eur J Pub Health. 2010; 20:189-194. DOI | PubMed
- Zimmerman S, Cohen L, van der Steen JT, Reed D, van Soest-Poortvliet MC, Hanson LC. Measuring end-of-life care and outcomes in residential care/assisted living and nursing homes. J Pain Symptom Manag. 2015; 49:666-679. DOI
- Baile WF, Lenzi R, Parker PA, Buckman R, Cohen L. Oncologists’ attitudes toward and practices in giving bad news: an exploratory study. J Clin Oncol Off J Am Soc Clin Oncol. 2002; 20:2189-2196. DOI
- Keirse M, Vlaanderen OFPZ. Het levenseinde teruggeven aan de mensen. Vroegtijdige Plan Van Zorg Fed Palliat Zorgen Wemmel Downloadbare Broch Op Www Palliatief Be [Internet]. 2009 [cited 2016 Jul 13]; Available from:Publisher Full Text
- Froggatt K, Vaughan S, Bernard C, Wild D. Advance care planning in care homes for older people: an English perspective. Palliat Med. 2009; 23:332-338. DOI | PubMed
- Beck ER, McIlfatrick S, Hasson F, Leavey G. Health care professionals’ perspectives of advance care planning for people with dementia living in long-term care settings: A narrative review of the literature. Dementia. 2017;16(4):486–12. 10.1177/1471301215604997. Epub 2015 Sep 16.
- Silvester W, Fullam RS, Parslow RA, Lewis VJ, Sjanta R, Jackson L. Quality of advance care planning policy and practice in residential aged care facilities in Australia. BMJ Support Palliat Care. 2012; bmjspcare:2012.
- Martin RS, Hayes B, Gregorevic K, Lim WK. The effects of advance care planning interventions on nursing home residents: A systematic review. J Am Med Dir Assoc. 2016;17(4):284–93. 10.1016/j.jamda.2015.12.017.
- Houben CHM, Spruit MA, Groenen MTJ, Wouters EFM, Janssen DJA. Efficacy of advance care planning: a systematic review and meta-analysis. J Am Med Dir Assoc. 2014; 15:477-489. DOI | PubMed
- Dixon J, Matosevic T, Knapp M. Economic evidence for advance care planning: Systematic review of evidence. Palliat Med. 2015;29(10):869–84. 10.1177/0269216315586659.
- Penders YW, Gilissen J, Moreels S, Deliens L, Van den Block L. Palliative care service use by older people: Time trends from a mortality follow-back study between 2005 and 2014. Palliat Med. 2018;32(2):466–75. 10.1177/0269216317720833.
- National Collaborating Centre for Mental Health. UK. Dementia: A NICE-SCIE Guideline on Supporting People With Dementia and Their Carers in Health and Social Care [Internet] Leicester (UK): British Psychological Society; 2007 [cited 2016 Jul 14] Available from.Publisher Full Text
- Rondia K, Raeymaekers P. Vroeger nadenken …over later: reflecties over de toepassing van vroegtijdige zorgplanning in België (met bijzondere aandacht voor dementie). Brussel: Koning Boudewijnstichting; 2011.
- Titler MG. The Evidence for Evidence-Based Practice Implementation. In: Hughes RG, editor. Patient Saf Qual Evid-Based Handb Nurses [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2008 [cited 22 Aug 2016]. Available from:Publisher Full Text
Fonte
Piers R, Albers G, Gilissen J, De Lepeleire J, Steyaert J, et al. (2018) Advance care planning in dementia: recommendations for healthcare professionals. BMC Palliative Care 1788. https://doi.org/10.1186/s12904-018-0332-2





