Abstract
Introduzione
I ritmi stagionali modulano diversi aspetti del comportamento umano e della fisiologia, tra cui le funzioni cerebrali come l’umore nel disturbo affettivo stagionale[1], l’insorgenza di sintomi nella schizofrenia[2], e le risposte cerebrali funzionali MRI (fMRI) alle attività cognitive[3]. Diversi studi suggeriscono che la stagione può modulare la cognizione negli adulti più giovani[4,5], anche se questo non è un dato universale[3,6,7], e mancano i dati degli adulti più anziani.
La dimostrazione della modulazione stagionale della cognizione e dei suoi substrati neurali negli adulti più anziani avrebbe importanti implicazioni cliniche e traslazionali. Suggerirebbe che la malattia di Alzheimer (AD) potrebbe essere una malattia stagionale, e che le risorse per la cura della demenza dovrebbero essere mirate alle stagioni di picco del bisogno, sia per identificare quelle nelle prime fasi della malattia, sia per sostenere i pazienti quando sono più vulnerabili. La modulazione stagionale può spiegare l’osservazione che alcuni individui con un lieve deficit cognitivo (MCI) ritornano successivamente alla normale cognizione e può essere un’importante fonte di errori di classificazione diagnostica sia negli studi clinici che nella pratica clinica. Soprattutto, può far luce sui meccanismi della plasticità cognitiva che potrebbero essere sfruttati per migliorare la cognizione nei pazienti con AD.
Abbiamo recentemente dimostrato i ritmi stagionali nell’espressione genica neocorticale umana in adulti anziani con e senza AD[8], Nel presente studio di 3.353 adulti anziani con e senza AD negli Stati Uniti, Francia e Canada, abbiamo testato le ipotesi che la stagione ha una significativa associazione con la cognizione, le probabilità di essere diagnosticato con MCI o demenza, il liquido cerebrospinale (CSF) biomarcatori AD, e l’espressione di moduli associati alla cognizione di geni co-espressi nel cervello umano.
Metodi
Progettazione dello studio e partecipanti
Abbiamo analizzato i dati trasversali in più punti temporali dei partecipanti a 3 studi prospettici di coorte osservazionali basati sulla comunità di persone anziane (il progetto Rush Memory and Aging Project [MAP], Religious Orders Study [ROS], e Minority Aging Research Study [MARS]) e 2 serie di casi prospettici basati sulla clinica osservazionale (lo studio del Centre de Neurologie Cognitive [CNC], a Lariboisiè).re Hospital, Università di Parigi Diderot, e Assistance Publique-Hôpitaux de Paris, e lo Studio sulla demenza di Sunnybrook [SDS]).
Salvo diversa indicazione, tutte le analisi sono state pianificate ed eseguite nel marzo 2018. Queste analisi non sono state pianificate prima della raccolta dei dati. Le analisi sono state effettuate a seguito di un’analisi dei ritmi stagionali di espressione genica e di modificazione epigenetica nelle coorti ROS e MAP, che è stata riportata altrove, e sono state parzialmente guidate da questi risultati precedenti[8]. Inoltre, avevamo precedentemente analizzato i dati cognitivi in relazione al sonno[9]. Le analisi sono state altrimenti concepite prima di vedere i dati delle coorti MARS, SDS e CNC. L’analisi che incorpora lo stato endocrino della tiroide (vedi sotto) è stata eseguita in revisione nel giugno del 2018 su richiesta di un revisore. Abbiamo correlato le misure di cognizione e le diagnosi cliniche di demenza fino alla data della valutazione cognitiva, i biomarcatori del liquor di AD fino alla data della puntura lombare, e post-mortem neocorticale RNA sequenziamento (RNA-Seq) i dati relativi alla data del decesso rispetto all’anno solare.
Le caratteristiche dei partecipanti allo studio sono riportate nella Tabella 1. Gli studi ROS, MAP e MARS sono studi prospettici di coorte osservazionali dei fattori di rischio per le comuni malattie croniche dell’invecchiamento. Essi condividono protocolli quasi identici. Il ROS è uno studio longitudinale sull’invecchiamento in fratelli, suore e sacerdoti cattolici di tutti gli Stati Uniti[10]. Il MAP è uno studio comunitario sull’invecchiamento nell’area metropolitana di Chicago che iscrive partecipanti con diversi background e status socioeconomico, provenienti da comunità di pensionati che si occupano di assistenza continuativa in tutto il nord-ovest dell’Illinois, così come da case individuali nell’area metropolitana di Chicago[10]. Sia la coorte ROS che quella MAP sono composte principalmente da individui di autodichiarazione di origine europea (93%). Il MARS è uno studio basato sulla comunità di adulti anziani di autodichiarazione di discendenza africana nell’area metropolitana di Chicago[11]. I partecipanti a tutti e 3 gli studi sono esenti da demenza nota al momento dell’iscrizione allo studio. Tutti i partecipanti alle coorti ROS e MAP e un sottoinsieme di partecipanti alla coorte MARS accettano la donazione del cervello in caso di morte. Per le nostre analisi primarie, abbiamo incluso tutti i partecipanti al ROS, MAP e MARS con test cognitivi completi (vedi sotto) e senza deterioramento cognitivo al momento della loro prima valutazione cognitiva. Dei 4.004 partecipanti ROS, MAP e MARS iscritti tra gennaio 1994 e maggio 2017, 3.924 hanno completato l’intera batteria cognitiva alla loro valutazione di base, di cui 2.761 senza deficit cognitivo. I dati cognitivi, demografici e clinici di questi 2.761 partecipanti sono stati inclusi nelle nostre analisi primarie. Inoltre, autopsie strutturate sono state eseguite su 1.410 deceduti, e RNA-Seq dati dalla corteccia prefrontale dorsolaterale (DLPFC) sono stati ottenuti da 507 di questi.
| Caratteristica | ROS/MAP di base | MARS baseline | ROS/MAPPA/MARS | SDS | CNC | |||
|---|---|---|---|---|---|---|---|---|
| Linea di base | Ultimo disponibile | Deceduto | Deceduto con RNA-Seq | |||||
| n | 2,234 | 527 | 2,761 | 2,761 | 1,410 | 507 | 271 | 321 |
| Età alla valutazione (anni) | 77.4 (71.2, 82.3) | 71.5 (68.6, 76.0) | 76.0 (70.2, 81.4) | 83.5 (77.5, 88.9) | 88.0 (83.4, 92.3) | 87.7 (83.5, 91.8) | 72.1 (63.9, 78.9) | 68.6 (62.8, 75.0) |
| Età alla morte (anni) | NA | NA | NA | NA | 89.2 (84.6, 93.4) | 88.8 (84.5, 92.7) | NA | NA |
| Sesso femminile | 1,663 (74.4%) | 418 (79.3%) | 2,081 (75.4%) | 2,081 (75.4%) | 939 (66.6%) | 314 (61.9%) | 132 (48.7%) | 182 (56.7%) |
| Discendenza europea | 2,103 (94.1%) | 0 (0.0%) | 2,103 (76.2%) | 2,103 (76.2%) | 1,349 (95.7%) | 502 (99.0%) | NA | NA |
| Anni di istruzione | 16 (14, 19) | 14 (12, 16) | 16 (13, 18) | 16 (13, 18) | 16 (13, 18) | 16 (14, 18) | 13 (12, 16) | NA |
| MMSE | 29 (28, 30) | 29 (27, 29) | 29 (28, 30) | 28 (26, 29) | 25 (17, 28) | 26 (19, 28) | 23 (20, 26) | 24 (20, 27) |
| MCI | 0 (0%) | 0 (0%) | 0 (0%) | 457 (16.6%) | 366 (26.0%) | 145 (28.6%) | 0 (0%) | 56 (17.4%) |
| Demenza clinica | 0 (0%) | 0 (0%) | 0 (0%) | 356 (12.9%) | 532 (37.7%) | 186 (36.7%) | 271 (100%) | 176 (54.8%) |
| ANNUNCIO PATOLOGICO | NA | NA | NA | NA | 901 (63.9%) | 295 (58.2%) | NA | NA |
La SDS (ClinicalTrials.gov NCT01800214) è uno studio di coorte osservazionale di casi raccolti consecutivamente (1992-2014) da una clinica di cura terziaria a Toronto, Canada [12]. Per questo studio, abbiamo incluso partecipanti classificati clinicamente come affetti da AD alla loro valutazione di base (vedi criteri qui sotto), e nei quali erano disponibili i punteggi della Dementia Rating Scale (DRS). Su 1.143 partecipanti arruolati tra il 1992 e il 2014, 285 avevano una diagnosi clinica primaria di AD, di cui 271 avevano punteggi DRS al momento della valutazione di base. I dati clinici, demografici e psicometrici di questi 271 partecipanti sono stati inclusi in questo studio. La coorte CNC è composta da pazienti che hanno frequentato una clinica clinica della memoria clinica e di ricerca specializzata nella cura di pazienti con disturbi cognitivi, la clinica della memoria presso l’Ospedale di Lariboisière, tra il 2 luglio 2008 e il 15 giugno 2017, che si erano sottoposti alla raccolta di CSF con la misurazione dell’amiloide e della tau, il cui intero work-up clinico è stato eseguito presso l’Ospedale di Lariboisière, e per i quali era disponibile una diagnosi clinica finale. Su 2.298 pazienti valutati tra luglio 2008 e giugno 2017, la stragrande maggioranza aveva fatto completare una parte del loro work-up clinico presso un istituto esterno ed era stata esclusa da queste analisi. Dei restanti 424 partecipanti con una diagnosi clinica definitiva, 321 hanno anche avuto una puntura lombare con quantificazione di Aβ 40, Aβ 42, tau e fosfo-tau. In questo studio sono stati inclusi i dati psicometrici, clinici, demografici e del liquido cerebrospinale di questi 321 partecipanti.
Dichiarazione di approvazione etica
Il ROS, il MAP e il MARS sono stati approvati dall’Institutional Review Board del Rush University Medical Center, il SDS è stato approvato dal Research Ethics Board del Sunnybrook Research Institute, e lo studio CNC è stato approvato dal Comitato Etico Istituzionale dell’Università di Parigi Diderot. Tutti gli studi sono stati condotti in conformità con l’ultima versione della Dichiarazione di Helsinki e tutti i partecipanti hanno fornito il consenso informato scritto. Inoltre, tutti i partecipanti al ROS e al MAP, e alcuni partecipanti al MARS, hanno firmato un Atto di donazione anatomica per la donazione di organi.
Valutazione della cognizione e diagnosi di demenza
I partecipanti alle coorti ROS, MAP e MARS sono stati sottoposti a valutazioni cognitive annuali uniformi e strutturate, consistenti in una batteria di 19 test cognitivi che si estendono su 5 domini (memoria episodica [memoria logica Ia, memoria logica IIa, richiamo immediato della storia, richiamo ritardato della storia, memoria della lista delle parole, richiamo della lista delle parole, riconoscimento della lista delle parole], memoria semantica [test di denominazione di Boston, fluidità della categoria, test nazionale di lettura per adulti], memoria di lavoro [intervallo tra le cifre in avanti, intervallo tra le cifre all’indietro, ordine delle cifre], velocità percettiva [test delle modalità dei simboli, confronto dei numeri, lettura delle parole Stroop, denominazione dei colori Stroop] e capacità visuospaziale [giudizio sull’orientamento delle linee, matrici progressive standard]). Come descritto in precedenza[13], è stata creata una misura composita per ogni dominio convertendo ogni test all’interno di ogni dominio in uno z-score e facendo la media degli z-score. Le 5 misure composite del dominio sono state poi mediate per creare un punteggio cognitivo globale composito in scala tale che 0 rappresenta il punteggio medio di tutti i partecipanti alla linea di base, i punteggi positivi indicano una migliore performance, e 1 unità rappresenta circa 1 deviazione standard della performance. I partecipanti sono stati classificati come aventi una diagnosi clinica di demenza dal National Institute of Neurological and Communicative Disorders and Stroke-Alzheimer’s Disease and Related Disorders Association criteri [14]. Le persone con deficit cognitivo mediante test neuropsicologici, ma senza una diagnosi clinica di demenza, sono state classificate come affette da MCI. I partecipanti senza demenza o MCI sono stati classificati come non affetti da deficit cognitivo. La data della valutazione cognitiva è stata registrata al momento della valutazione cognitiva.
I pazienti della coorte SDS sono stati sottoposti a una batteria completa di 17 test come descritto in precedenza[15]. Di questi, sono stati inclusi in queste analisi i dati del DRS[16], il Test di apprendimento verbale della California [17], l’ampiezza delle cifre in avanti e indietro[18], il Test di Sostituzione dei Simboli Digitali [19], il Test di ordinamento delle carte del Wisconsin [20], la fluidità semantica per gli animali[21,22] e il Test di Orientamento della Linea di Benton [23]. Le diagnosi di AD sono state effettuate per consenso di 2 medici indipendenti secondo i criteri di consenso clinico prevalenti[24]. La data della valutazione cognitiva è stata registrata al momento della valutazione cognitiva.
I pazienti della coorte CNC sono stati sottoposti a valutazioni cliniche, neurologiche, neuropsicologiche e neuropsicologiche di routine e all’imaging cerebrale come clinicamente indicato. Sulla base di tutti i dati disponibili, compresi i biomarcatori del liquor, e in conformità con i criteri dell’Associazione dell’Istituto Nazionale sull’Invecchiamento (NIA)-Alzheimer [24], i pazienti sono stati classificati in 2 gruppi: AD e non AD. I casi complessi sono stati discussi e le diagnosi sono state fatte da un team multidisciplinare di neurologi, geriatri e neuropsicologi. I partecipanti non-Ad hanno incluso partecipanti con disturbi cognitivi diversi da AD, tra cui demenza frontotemporale, malattia di Lewy, malattia di Parkinson, malattia di Creutzfeldt-Jakob e demenza non degenerativa (tra cui demenza vascolare, demenza alcol-correlata, idrocefalo a pressione normale, malattia infettiva e disturbi psichiatrici tra gli altri).
Valutazione delle covariate cliniche
Nelle coorti ROS, MAP e MARS, abbiamo calcolato l’età al momento della valutazione cognitiva a partire dalla data di nascita e dalla data di valutazione autodenunciata. Abbiamo calcolato l’età alla morte a partire dalla data di nascita e dalla data di morte. Abbiamo registrato il sesso e la razza dichiarata al momento dell’intervista di base. I sintomi depressivi sono stati valutati alla data della valutazione cognitiva con una versione a 10 voci della scala del Center for Epidemiologic Studies-Depression (CES-D) [25]. L’ora del test cognitivo è stata registrata al momento del test. I tempi sono stati raggruppati in ore e considerati come una variabile categorica. Per la durata del sonno, ai partecipanti al MAP e al ROS è stato chiesto, alla data della valutazione cognitiva, di riportare quante ore hanno dormito di solito durante la notte nel corso del mese precedente. Per quanto riguarda l’attività fisica, ai partecipanti alla MAP e al ROS è stato chiesto, alla data della valutazione cognitiva, di indicare il numero di ore settimanali trascorse in 5 categorie di attività: passeggiate, giardinaggio o lavoro in cortile, ginnastica fisica o esercizio fisico generale, bicicletta e nuoto o esercizi in acqua[26]. In un sottoinsieme di partecipanti a ROS, MAP e MARS, i livelli di ormone sierostimolante della tiroide (TSH) sono stati valutati mediante immunodosaggio da Quest Diagnostics (Madison, NJ, USA).
Nella coorte SDS, l’età, il sesso e gli anni di istruzione sono stati estratti dalle cartelle cliniche.
Nella coorte CNC, l’età e il sesso sono stati estratti dalle cartelle cliniche.
Valutazione del CSF
Nella coorte CNC, le punture lombari sono state eseguite su pazienti a digiuno entro 1 mese dalla diagnosi clinica, di solito tra le 09:00 e le 12:00. Entro 4 ore dal prelievo, i campioni sono stati centrifugati a 1.000 g per 10 minuti a 4 °C, aliquotati in provette di polipropilene da 0,5 ml e conservati a -80 °C. Successivamente, CSF Aβ 40, Aβ 42, tau totale e fosfo-tau sono stati misurati utilizzando un test di immunosorbimento enzimatico a sandwich disponibile in commercio (INNOTEST, Fujirebio Europe, Gent, Belgio) secondo le istruzioni del produttore. La data della puntura lombare è stata registrata al momento della puntura lombare.
Valutazione neuropatologica
La valutazione neuropatologica è stata eseguita in deceduti delle coorti ROS, MAP e MARS. AD patologia è stata quantificata come descritto in precedenza[27,28]. Grovigli neurofibrillari, placche diffuse, e le placche neuritiche sono stati visualizzati da Bielschowsky colorazione d’argento in sezioni dal frontale, temporale, parietale, e cortecce entorinee e l’ippocampo. Per una diagnosi patologica categorica di AD, i casi sono stati classificati come nessun AD, AD a bassa probabilità, AD a bassa probabilità, AD a media probabilità o AD ad alta probabilità sulla base dei criteri NIA-Reagan[29]; un partecipante è stato considerato avere una diagnosi patologica di AD se la sua classificazione NIA-Reagan era “probabilità intermedia” o “alta probabilità”.”Per generare una misura composita continua del carico della patologia di AD, i grovigli neurofibrillari, le placche diffuse e le placche neuritiche sono stati contati nelle regioni sopra citate, i conteggi grezzi sono stati divisi per la deviazione standard dello stesso indice per quella regione nell’intera coorte, e i punteggi scalari sono stati mediati come descritto in precedenza [28]. Oltre a quanto sopra, l’area percentuale occupata dall’amiloide beta è stata quantificata come descritto in precedenza[30]. In breve, dopo la fissazione immersione in paraformaldeide, blocchi di tessuto da 8 regioni cerebrali (corteccia mid-frontale, corteccia premotoria, corteccia temporale inferiore, giro angolare, corteccia calcarica, corteccia cingolata anteriore, corteccia entorinale, e ippocampo CA1/subiculum) sono stati incorporati in paraffina, sezionato, e incubato con anticorpi contro l’amiloide beta (topo monoclonale anti-clone beta amiloide 10D5; Elan Pharmaceuticals, San Francisco, CA, USA) seguito da sviluppo con diaminobenzidina e nichel. L’area percentuale media occupata dal materiale amiloide beta-immunopositivo è stata quantificata in ciascuna delle 8 regioni cerebrali di ogni individuo utilizzando un approccio sistematico di campionamento casuale e un protocollo di analisi delle immagini computazionale multistadio come descritto in precedenza [30]. Questi valori sono stati mediati tra le regioni per generare una misura sintetica del carico amiloide per ogni individuo.
Per quantificare la patologia del corpo di Lewy, 6-μ m m paraffina incorporato sezioni dal cingolo, entorinale, midfrontal, midfrontal, temporale medio, e inferiore cortecce parietali e la substantia nigra sono stati immunostained con anticorpi alla sinucleina alfa (pSyn-64, 1:20.000; Wako Chemicals USA; Richmond, VA, USA). La distribuzione dei corpi di Lewy è stata classificata su una scala semi-quantitativa (0 = nessuno, 1 = predominante nel tronco encefalico o limbico, 2 = neocorticale) secondo una versione modificata dei criteri pubblicati[31].
Gli infarti cerebrali macroscopici sono stati identificati mediante l’ispezione visiva di lastre coronali di 1 cm e confermati dalla revisione istologica come descritto in precedenza[32]. Infarti microscopici sono stati quantificati in un minimo di 9 regioni (6 corticali e 3 sottocorticali) come precedentemente descritto[33].
Valutazione dell’espressione della trascrizione DLPFC
RNA-Seq è stato eseguito su blocchi di DLPFC da un sottoinsieme di partecipanti ROS e MAP come descritto in precedenza[8]. L’RNA è stato estratto da blocchi di DLPFC e quantificato da Nanodrop (Thermo Fisher Scientific, Waltham, MA, US). Un Bioanalizzatore Agilent è stato utilizzato per valutare la qualità. Campioni da cui sono stati ottenuti meno di 5-μg di RNA e campioni con un punteggio di integrità dell’RNA (RIN) pari o inferiore a 5 sono stati esclusi da ulteriori analisi. Il metodo dUTP strand-specific dUTP[34] con selezione poly-A[35] è stato utilizzato dal Broad Institute Genomics Platform per preparare la libreria RNA-Seq. La selezione poly-A è stata seguita dalla prima stringa specifica di sintesi cDNA, con dUTP utilizzato per la seconda stringa specifica di sintesi cDNA, seguita dalla frammentazione e dalla legatura dell’adattatore Illumina per la costruzione della biblioteca. Una macchina Illumina HiSeq è stata utilizzata per eseguire il sequenziamento con letture paired-end a 101 bp, ottenendo una copertura di 150M di letture per i primi 12 campioni, che sono serviti come riferimento di copertura profonda. I rimanenti campioni sono stati sequenziati con una copertura di 50M di letture. Successivamente, all’inizio e alla fine, le basi di bassa qualità e le sequenze di adattatori sono state tagliate dalle letture, e le letture di RNA ribosomiale sono state rimosse. Il pacchetto software Bowtie 1[36] è stato utilizzato per allineare le letture rifilate al genoma di riferimento. Infine, il pacchetto software RSEM è stato usato per stimare, in unità di frammenti per kilobase per milione di frammenti mappati (FPKM), i livelli di espressione per 55.889 singoli geni GENCODE v14, che sono stati poi quantile-normalizzati, correggendo l’effetto batch con Combat[37]. Questi dati sono disponibili attraverso il portale di conoscenza Synapse AMP-AD (Synapse ID syn3388564; 10.7303/syn3388564).
Abbiamo utilizzato un metodo di clustering di consenso chiamato SpeakEasy[38,39] per definire in modo robusto i sistemi molecolari coespressivi basati sulla matrice di correlazione gene-gene. In breve, questo metodo raggruppa i dati centinaia di volte in condizioni leggermente diverse e seleziona il clustering più rappresentativo. SpeakEasy è relativamente insensibile alla selezione dei parametri, è in grado di utilizzare correlazioni negative nel processo di clustering, riduce al minimo i nodi non classificati del “modulo grigio” e mostra buone prestazioni sui benchmark di clustering sintetico, compresi i benchmark Lancichinetti-Fortunato-Radicchi [38]. Applicando questo approccio ai nostri dati RNA-Seq abbiamo generato 257 moduli, di cui 47 di dimensioni comprese tra 20 e 556 geni. In totale, il 98% di tutti i geni sono stati assegnati ad uno di questi 47 moduli. Questo approccio ha prodotto risultati molto simili agli algoritmi WGCNA standard[40] quando applicato ai nostri dati[39].
Per ogni gene in ogni modulo, abbiamo calcolato il livello di espressione normalizzato sottraendo il livello di espressione medio per quel gene in tutti gli individui e dividendo per la deviazione standard. Poi, abbiamo riassunto il livello di espressione di ogni modulo in ogni individuo calcolando la media dei livelli di espressione normalizzati di tutti i geni di quel modulo.
In questa analisi sono stati inclusi i dati di 507 campioni che soddisfano i criteri di controllo della qualità come sopra e con i dati clinici completi(Tabella 1).
Analisi statistica
Qui viene fornita una sintesi delle analisi statistiche. Per una descrizione completa si veda S1 Methods.
Per tutte le analisi sono state utilizzate solo osservazioni con dati completi per ogni analisi.
I principali risultati di interesse sono stati le prestazioni cognitive considerate come variabile continua, la diagnosi clinica combinata di MCI o demenza considerata come variabile categorica, i livelli dei biomarcatori del liquor AD (tra cui Aβ 42, Aβ 40, tau e fosfo-tau) considerati come variabili continue, e l’espressione DLPFC dei geni GENCODE v14, considerati come variabili continue. Il principale predittore di interesse era la data relativa all’anno solare (della valutazione cognitiva per gli esiti cognitivi, della puntura lombare per i marcatori del liquor, e della morte per l’RNA-Seq post mortem) considerata come variabile continua angolare. I potenziali fattori di confusione includevano l’età (al momento della valutazione cognitiva, della puntura lombare o della morte) considerata come variabile continua, il sesso considerato come variabile dicotomica, gli anni di istruzione considerati come variabile continua, il numero di sintomi depressivi considerati come variabile continua, le ore di sonno considerate come variabile continua, le ore di attività fisica considerate come variabile continua, il livello di TSH sierico come variabile continua, e l’ora della valutazione o della morte considerata come variabile categorica in contenitori di 1 ora. I potenziali modificatori dell’effetto includono l’età (continua), il sesso (dicotomico) e la razza (categorica).
Nelle coorti ROS, MAP e MARS, abbiamo caratterizzato i modelli stagionali nella cognizione considerando la cognizione come una funzione lineare del coseno della data di valutazione, aggiustata per l’età alla valutazione, il sesso e il livello di istruzione(S1 Fig). Abbiamo determinato il significato della ritmicità confrontando questo modello con uno senza il termine coseno utilizzando un F-test. Abbiamo estratto l’ampiezza, e la tempistica dell’acrofase (picco) e del nadir (trogolo) della curva del coseno(S1 Fig). Abbiamo calcolato le ampiezze standardizzate dividendo l’ampiezza per la deviazione standard della funzione cognitiva attraverso la coorte alla linea di base. Inoltre, abbiamo contestualizzato l’ampiezza di questa ampiezza confrontandola con l’ampiezza della stima dell’effetto per l’età dall’equazione 1 nei metodi S1.
Utilizzando questo approccio, nelle nostre analisi primarie, abbiamo valutato la ritmicità stagionale nella valutazione della funzione cognitiva globale composita alla linea di base nelle coorti ROS e MAP, controllando per età, sesso e livello di istruzione, e includendo solo i partecipanti senza MCI o demenza. Abbiamo poi fatto lo stesso per la coorte MARS. Poi, abbiamo analizzato insieme le coorti ROS, MAP e MARS, controllando per l’effetto della coorte di studio come effetto fisso. Anche se in alcuni partecipanti al ROS, MAP e MARS sono disponibili più cicli annuali di dati cognitivi, il disegno di questi studi è tale che i partecipanti sono valutati all’incirca alla stessa data attraverso i cicli (intervallo interquartile da -13 a +11 giorni). A causa dell’elevata correlazione intra-partecipante delle date di valutazione, l’aggiunta dei dati di più cicli per partecipante non migliorerebbe sostanzialmente le nostre stime degli effetti stagionali né consentirebbe una stima efficace degli effetti stagionali intra-partecipanti. Pertanto, nell’interesse della parsimonia analitica, non abbiamo incluso cicli multipli di dati nelle nostre analisi primarie.
La cognizione può essere influenzata da una serie di potenziali fattori di confusione che possono anche mostrare variazioni stagionali, tra cui il tempo dei test cognitivi, la depressione, le ore di sonno e l’attività fisica. Per tenerne conto, abbiamo considerato modelli corretti per il tempo del test cognitivo (considerato come variabile categorica per ora e disponibile nelle coorti ROS, MAP e MARS), il numero di sintomi depressivi (considerato come variabile continua e disponibile nelle coorti ROS, MAP e MARS), le ore di sonno (considerato come variabile continua e disponibile solo nelle coorti ROS e MAP), e le ore passate impegnate in attività fisiche (considerato come variabile continua e disponibile solo nelle coorti ROS e MAP). Inoltre, nel giugno 2018, abbiamo considerato un modello aggiuntivo adeguato al livello sierico del TSH. La valutazione del TSH è stata aggiunta ai protocolli di valutazione ROS e MAP solo dopo il 2002, e quindi i dati sui livelli sierici di TSH non erano disponibili per quasi il 50% dei partecipanti ROS e MAP alla loro valutazione di base. Al contrario, i dati sui livelli sierici di TSH erano disponibili per il 97% dei partecipanti al MARS alla loro valutazione di base. Pertanto, l’analisi del TSH è stata limitata alla coorte MARS.
Successivamente abbiamo esaminato se i ritmi stagionali nella cognizione possono variare a seconda del dominio cognitivo specifico. Per fare ciò, nelle coorti combinate ROS, MAP e MARS, abbiamo ripetuto le nostre analisi primarie, considerando separatamente i punteggi riassuntivi nei domini specifici della memoria di lavoro, della velocità percettiva, della capacità visuospaziale, della memoria semantica e della memoria episodica.
La variazione stagionale della cognizione può plausibilmente portare a variazioni stagionali nella diagnosi di MCI o demenza. Per valutare questo, abbiamo seguito i partecipanti al ROS, MAP e MARS dalle nostre analisi primarie di cui sopra, e abbiamo considerato la loro diagnosi clinica all’ultima valutazione cognitiva disponibile. Nel giugno del 2018 abbiamo ripetuto le nostre analisi primarie, considerando l’ultima disponibile al posto della valutazione cognitiva di base. Poi, abbiamo considerato le probabilità di essere classificati come affetti da MCI o demenza in funzione del coseno della data di valutazione, adattate per età, sesso, educazione e coorte di origine. Per quantificare il contributo della ritmicità stagionale alle probabilità di essere classificati come affetti da MCI o demenza, abbiamo confrontato questo modello con un’equazione ridotta senza il termine coseno utilizzando un test di likelihood ratio.
Abbiamo anche considerato la stagione come variabile categoriale, definendo l’inverno/primavera come gennaio-giugno e l’estate/autunno come luglio-dicembre, e abbiamo considerato l’effetto della stagione categoriale sulle probabilità di essere diagnosticati con MCI/demenza, confrontando questo modello con un’equazione ridotta senza il termine stagionale con un test di likelihood ratio. Nel giugno del 2018, abbiamo anche considerato modelli corretti per il tempo del test cognitivo, il numero di sintomi depressivi, le ore di sonno, le ore di attività fisica e il livello sierico del TSH.
Successivamente, abbiamo esaminato se la patologia AD è associata alla ritmicità differenziale stagionale della cognizione. Per fare ciò, abbiamo ripetuto le nostre analisi primarie di cui sopra utilizzando le ultime valutazioni cognitive conosciute dei partecipanti deceduti ROS, MAP, e MARS con e senza patologia AD, definita come una classificazione NIA-Reagan di intermedio o alto, alla morte. Abbiamo considerato un modello incrementato, che consente effetti indipendenti della patologia AD sul livello e sulla ritmicità della cognizione.
Successivamente, abbiamo ripetuto le nostre analisi primarie nella coorte SDS con il punteggio totale di DRS come risultato primario, e poi con i sottoscore DRS, così come i punteggi sul test digit span, Digit Symbol Substitution Test, California Verbal Learning Test, test di apprendimento verbale, test di fluidità semantica (denominazione degli animali), Wisconsin Card Sorting Test, e Benton Line Orientation Test come risultati secondari, tutti considerati come variabili continue.
Processi fisiopatologici alla base di AD, tra cui l’amiloide e il metabolismo tau, sono importanti fattori che contribuiscono alla cognizione compromessa negli adulti più anziani. Per esaminare l’evidenza della ritmicità stagionale nella biologia dell’amiloide e della tau, abbiamo esaminato il CSF Aβ 40, Aβ 42, tau e fosfo-tau nella coorte CNC in funzione della data della puntura lombare, regolata per l’età e il sesso, utilizzando un approccio identico a quello utilizzato per la cognizione di cui sopra, considerando prima tutti i partecipanti insieme, regolata per la diagnosi (AD contro non-AD), e poi permettendo differenze di livello e la ritmicità tra i partecipanti con e senza AD.
Successivamente, ci siamo proposti di identificare i sistemi molecolari co-espressivi che possono essere correlati ai ritmi stagionali della cognizione. Abbiamo considerato un insieme di geni co-espressi (modulo) potenzialmente correlati ai ritmi stagionali nella cognizione se soddisfa tutti i seguenti requisiti: (1) l’espressione era ritmica stagionale, (2) l’espressione era in fase o antifase al ritmo della cognizione, e (3) l’espressione era associata a prestazioni cognitive vicine alla morte. Per valutare la ritmicità stagionale, abbiamo considerato il livello medio di espressione di ogni modulo genico in funzione della data e dell’ora del decesso, adattato all’età al momento della morte, al sesso, al livello di istruzione e alle covariate metodologiche come il lotto, l’intervallo post mortem e la qualità dell’RNA (punteggio RIN), e tenendo conto di confronti multipli per permutazione, come descritto in precedenza[8]. Un modulo è stato considerato stagionalmente ritmico se il suo valore p, corretto per i confronti multipli, era <0,05. Per valutare l’associazione con la cognizione vicino alla morte, abbiamo considerato la cognizione globale composita vicino alla morte come una funzione lineare dell’espressione media del modulo, regolata per l’età, il sesso, l’educazione e le covariate metodologiche, inclusi l’intervallo post mortem, il lotto e la qualità dell’RNA (punteggio RIN), mentre abbiamo considerato i confronti multipli per la generazione di 10.000 set di dati nulli creati dalle etichette del modulo permuting. Un modulo è stato considerato associato alla cognizione se il suo valore p, corretto per i confronti multipli, era <0,05. Nel giugno del 2018, abbiamo utilizzato lo stesso approccio per mettere in relazione l’espressione del modulo con il carico della patologia amiloide in autopsia. Nel giugno del 2018, abbiamo anche caratterizzato i ritmi cognitivi in prossimità della morte ripetendo le nostre analisi primarie sul sottoinsieme dei partecipanti ROS e MAP con i dati RNA-Seq disponibili, utilizzando l’ultima valutazione cognitiva disponibile in prossimità della morte, e considerando la funzione cognitiva globale composita, così come i 5 domini cognitivi.
Per i moduli di co-espressione che soddisfano i criteri di cui sopra, abbiamo controllato per i potenziali confonditori tra cui la depressione e le neuropatologie che potenzialmente influenzano la cognizione, compreso il peso della patologia AD considerata come una misura continua, la presenza o assenza di corpi corticali Lewy corticali considerati come variabile dicotomica, e il numero di infarti corticali macroscopici e microscopici considerati come misure continue, ripetendo l’analisi di cui sopra in modelli adeguati per queste covariate. Abbiamo anche esaminato l’associazione della patologia AD con il livello e la ritmicità dell’espressione del modulo considerando modelli aumentati simili all’analisi che abbiamo eseguito con cognizione nelle equazioni 10, 11, e 12 nei metodi S1.
Abbiamo poi esaminato le associazioni tra l’espressione del modulo e altri fenotipi cognitivi correlati alla cognizione, compresi i singoli domini cognitivi, i punteggi Mini-Mental State Examination, e le misure della patologia AD calcolando le correlazioni Spearman tra l’espressione media del modulo alla morte e i fenotipi cognitivi all’ultima misurazione in prossimità della morte o fenotipi neuropatologici alla morte, regolando per i confronti multipli con la correzione Bonferroni.
Infine, abbiamo esaminato i siti di legame del fattore di trascrizione associati ai 4 moduli di co-espressione putativamente associati ai ritmi stagionali della cognizione. Per fare ciò, abbiamo usato siti di legame annotati a livello genomico per 161 fattori di trascrizione del progetto ENCODE[41- 43]. Abbiamo considerato una trascrizione come localmente associata a un fattore di trascrizione se il suo sito di inizio trascrizione si sovrapponeva a uno dei siti di legame del fattore di trascrizione annotato da ENCODE o si trovava entro 2.000 bp da esso. Per ciascuno dei 4 moduli di co-espressione, abbiamo quindi utilizzato modelli di regressione logistica per esaminare l’associazione indipendente della presenza locale di siti di rilegatura per ciascuno dei 161 fattori di trascrizione ENCODE con la probabilità che una trascrizione sia membro di un dato modulo di co-espressione. Abbiamo corretto per confronti multipli usando la correzione Bonferroni per 161 fattori di trascrizione (α = 0,05/161 = 0,0003).
Risultati
Partecipanti allo studio
Le caratteristiche dei partecipanti allo studio sono riportate nella Tabella 1.
Associazione tra stagione e cognizione negli adulti anziani senza deficit cognitivo
Per prima cosa abbiamo esaminato l’associazione tra la stagione e la cognizione di base nei partecipanti al ROS e al MAP senza deficit cognitivo(Tabella 1; n = 2.234). Il ROS e MAP sono studi di coorte longitudinali di invecchiamento in cui i partecipanti sono esenti da demenza al momento dell’iscrizione allo studio e accettano di donare il cervello alla morte. La media (SD) del punteggio cognitivo globale composito di base tra i partecipanti senza danno cognitivo nella coorte combinata ROS e MAP era di 0,26 (0,44) unità. In un modello non regolato, la stagione ha avuto una significativa associazione con la funzione cognitiva globale composito, con la più alta cognizione globale composito media vista poco prima dell’equinozio di caduta(p = 0,004). Rispetto ai partecipanti valutati al trogolo invernale / primavera, il punteggio cognitivo globale composito dei partecipanti valutati al picco estivo / autunnale è stato di 0,20 deviazioni standard (una misura della grandezza della variazione stagionale rispetto alla variabilità complessiva) superiore (95% CI 0,09 a 0,32, p = 0,004). In un modello adattato per età, sesso e istruzione, l’effetto della stagione sulla cognizione globale composita era simile, con un picco prima dell’equinozio d’autunno(Fig 1A). Rispetto ai partecipanti valutati in inverno e in primavera, il punteggio cognitivo globale composito dei partecipanti valutati in estate e in autunno è stato di 0,13 SD superiore (95% CI 0,04 a 0,24, p = 0,039)-equivalente a quello dei partecipanti 4,4 anni più giovani (95% CI 1,8 a 8,6, p = 0,018). Nella coorte afroamericana MARS(Tabella 1; n = 527), il punteggio cognitivo globale composito medio (deviazione standard) è stato di 0,19 (0,47). Nella coorte MARS, in un modello aggiustato per età, sesso e istruzione, l’entità dell’effetto stagionale era simile a quella delle coorti ROS e MAP, con 0,21 SD di cognizione globale composito (95% CI 0,06 a 0,47, p = 0,109) che separa i partecipanti valutati al nadir invernale/primavera e all’acrofase estiva/invernale, equivalente a una differenza di età di 4,3 anni (95% CI 1,29 a 9,26, p = 0,064). Il valore p nella coorte MARS è stato in qualche modo attenuato, anche se questo può riflettere il minor numero di partecipanti MARS(n = 527) rispetto ai partecipanti ROS/MAP(n = 2.234) in queste analisi. La messa in comune dei dati di tutte e 3 le coorti(Tabella 1) ha migliorato l’effetto(Fig 1C; ampiezza = 0,14 SD [95% CI da 0,07 a 0,23], p = 0,007, con una differenza tra il picco e la depressione equivalente ad una differenza di età di 4,8 anni [95% CI da 2,1 a 8,5], p = 0,009). L’associazione tra stagione e cognizione non varia in base all’età, al sesso, alla razza o alla coorte di origine(p > 0, 05 per i termini di interazione). Inoltre, l’inclusione di termini per il tempo del test cognitivo, la depressione, il sonno, l’attività fisica o il livello sierico del TSH non ha sostanzialmente modificato le stime di questi effetti stagionali rispetto ai modelli senza questi termini(Tabella S1). La tempistica dei ritmi delle prestazioni cognitive è stata simile in tutti i sottodomini cognitivi(S2 Fig), con un picco di prestazioni vicino all’equinozio d’autunno. Tuttavia, l’effetto stagionale è stato più forte per la memoria di lavoro e la velocità percettiva e più debole per gli altri domini.
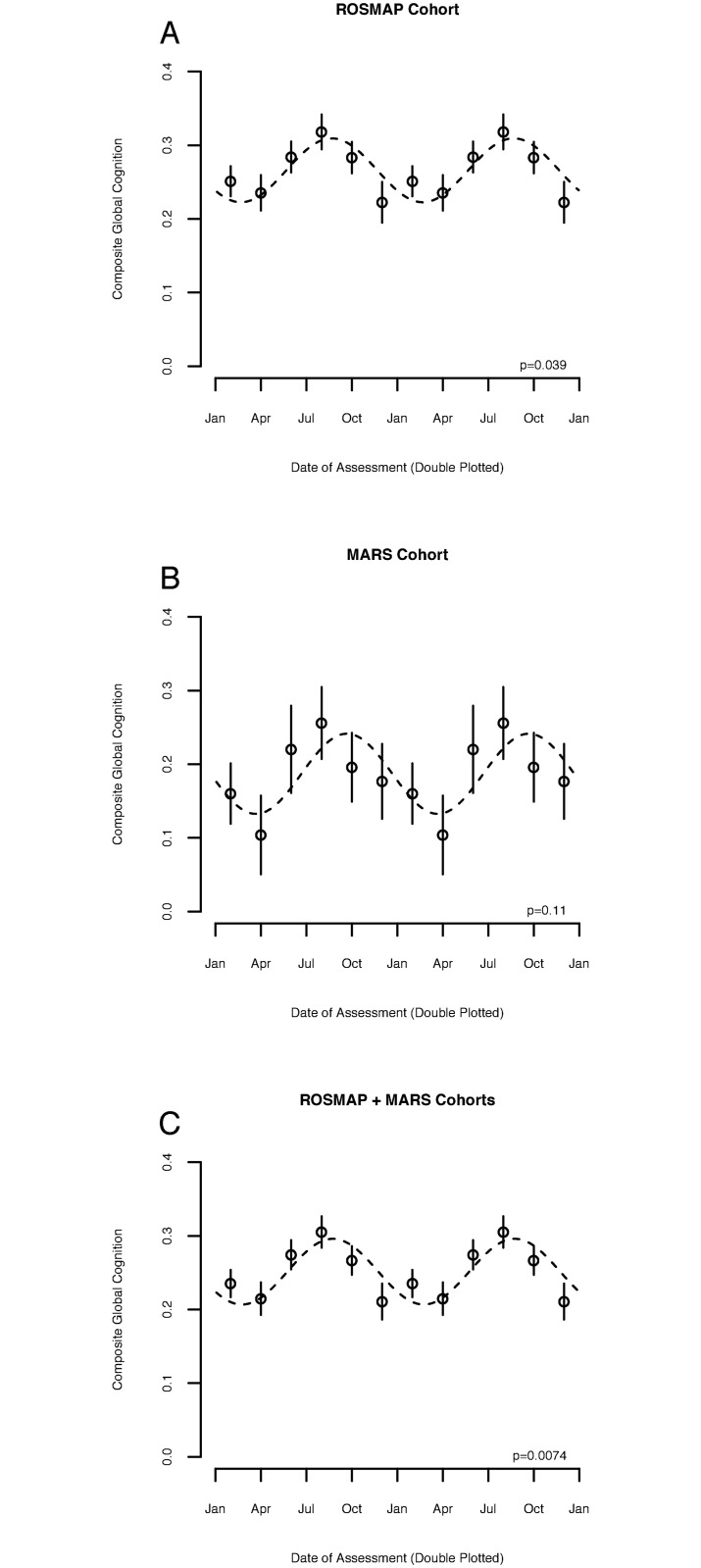
Fig 1.Associazione tra stagione e funzione cognitiva negli adulti senza deficit cognitivo.Prestazioni cognitive globali composte in funzione della data di valutazione, tracciate due volte. I cerchi indicano i mezzi dei bidoni di 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano la curva del coseno dell’adattamento. p-Valore indica la significatività del contributo della ritmicità stagionale alla varianza globale, calcolata come descritto nel testo. (A) Misurazioni di base per le coorti Religious Orders Study (ROS) e Rush Memory and Aging Project (MAP) combinate(n = 2.234). (B) Misurazioni di base per la coorte di Minority Aging Research Study (MARS) (n = 527). (C) Misure di base per le coorti combinate ROS, MAP e MARS considerate insieme(n = 2.761).

Fig. 1.Fig. 1. Associazione tra stagione e funzione cognitiva negli adulti senza deficit cognitivo.Prestazioni cognitive globali composte in funzione della data di valutazione, tracciate due volte. I cerchi indicano i mezzi dei bidoni a 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano la curva del coseno dell’adattamento. p-Valore indica la significatività del contributo della ritmicità stagionale alla varianza globale, calcolata come descritto nel testo. (A) Misurazioni di base per le coorti Religious Orders Study (ROS) e Rush Memory and Aging Project (MAP) combinate(n = 2.234). (B) Misurazioni di base per la coorte di Minority Aging Research Study (MARS) (n = 527). (C) Misure di base per le coorti combinate ROS, MAP e MARS considerate insieme(n = 2.761).
Associazione tra stagione e diagnosi clinica
Abbiamo ipotizzato che l’associazione della stagione con la cognizione si rifletterebbe nei tassi di diagnosi cognitive. Per testare questo, abbiamo analizzato l’ultima valutazione disponibile per i partecipanti ROS, MAP e MARS(Tabella 1; una mediana [IQR] di 6 [3-11] anni dall’iscrizione allo studio). In un modello adattato per età, sesso e istruzione, vi è persistita una significativa ritmicità stagionale delle prestazioni cognitive globali composte all’ultima ondata di dati disponibili (ampiezza = 0,13 SD [95% CI 0,05 a 0,24], p = 0,022). I risultati sono stati simili quando abbiamo limitato queste analisi ai partecipanti deceduti in cui erano disponibili i dati RNA-Seq(S3 Fig). Abbiamo poi utilizzato modelli di regressione logistica adattati per età, sesso, educazione e coorte di origine per modellare l’associazione tra la data di valutazione e le probabilità di soddisfare i criteri per MCI o demenza. Dei 2.761 partecipanti, 813 (29,5%) hanno soddisfatto i criteri diagnostici per MCI o AD. Nei modelli non corretti, l’effetto della stagione sulla diagnosi è stato significativo (devianza = -10,3, p = 0, 006). Un partecipante valutato in inverno o in primavera (gennaio-giugno) ha avuto una probabilità di soddisfare i criteri per l’MCI o la demenza superiore di circa il 24% rispetto a uno valutato in estate o in autunno (luglio-dicembre; rapporto di probabilità 1,24 [95% CI 1,05-1,47], p = 0,008). Nei modelli corretti per età, sesso e istruzione, gli effetti sono stati simili(Fig 2A; devianza = -10,2, p = 0,006). In questi modelli corretti, un partecipante valutato in inverno o in primavera (gennaio-giugno) aveva una probabilità maggiore di soddisfare i criteri per l’MCI o la demenza rispetto a uno valutato in estate o in autunno (luglio-dicembre; odds ratio 1,31 [95% CI 1,10-1,57], p = 0,003). Questo effetto è rimasto altrettanto significativo nei modelli corretti per il tempo di prova, il numero di sintomi depressivi, le ore di sonno dichiarate, le ore di attività fisica dichiarate o il livello sierico di TSH(tabella S2).
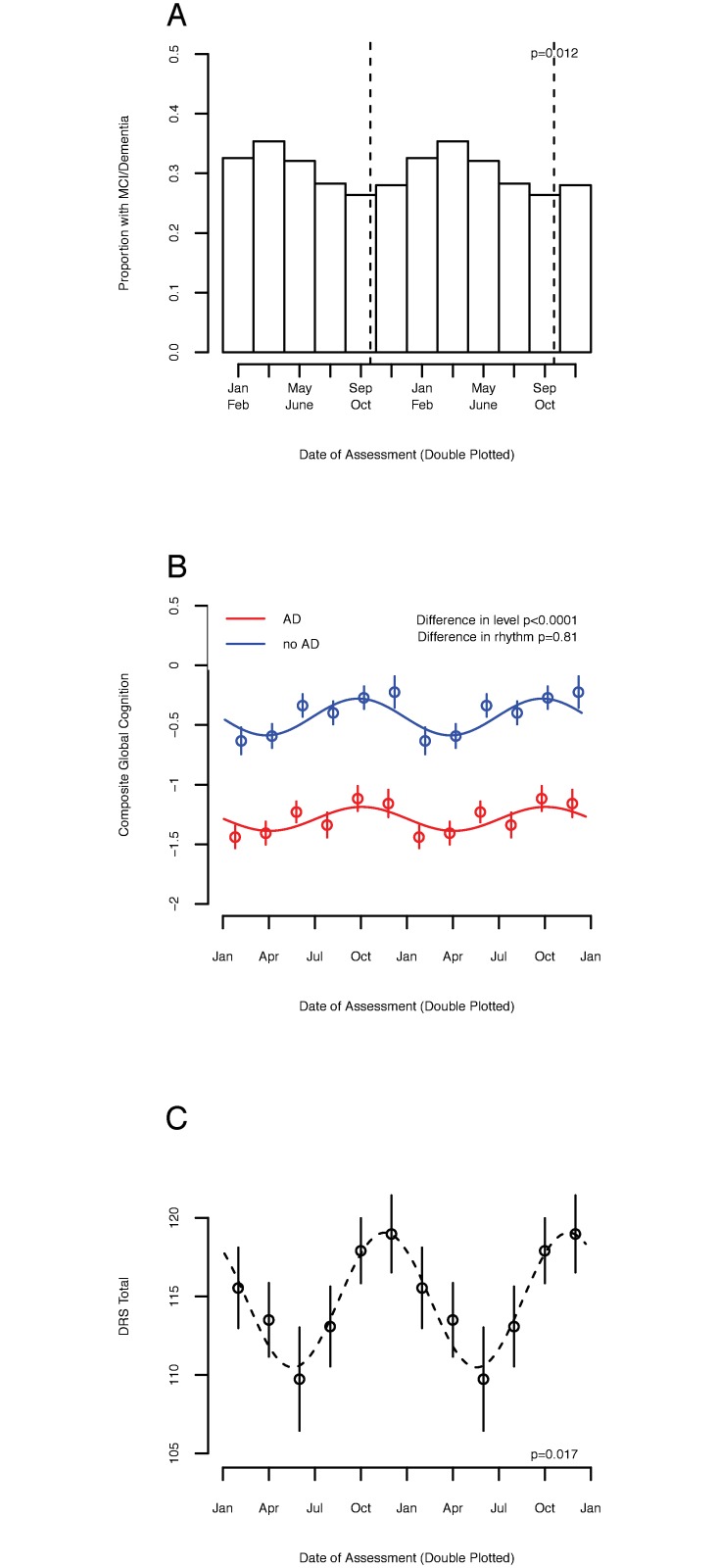
Fig. 2.Associazione tra la stagione e la diagnosi clinica e la funzione cognitiva negli adulti con malattia di Alzheimer (AD).(A) Percentuale dei partecipanti classificati come affetti da deficit cognitivo lieve (MCI) o demenza, in bidoni a 2 mesi a doppia trama, considerando l’ultima valutazione disponibile nelle coorti degli Ordini religiosi (ROS), Rush Memory and Aging Project (MAP), e Minority Aging Research Study (MARS) insieme(n = 2.761). La linea tratteggiata indica la tempistica dell’acrofase della cognizione globale composita. p-Valore indica l’importanza del contributo della ritmicità stagionale al log-odds di essere classificati come affetti da MCI o demenza. (B) Prestazioni cognitive globali composte in funzione della data di valutazione, tracciate due volte, stratificate dalla presenza/assenza di una diagnosi patologica di AD, in deceduti delle coorti ROS, MAP e MARS(n = 1.410). I cerchi indicano i mezzi dei bidoni a 2 mesi. Le barre indicano errori standard della media. Le linee indicano le curve del coseno in forma. Rosso = senza una diagnosi patologica di AD. Blu = con diagnosi patologica di AD. p-Valori indicano il significato della differenza di livello o di ritmicità tra i partecipanti con e senza diagnosi patologica di AD, come calcolato nel testo. (C) Punteggio della Total Dementia Rating Scale (DRS) in funzione della data di valutazione, a doppia trama, per la valutazione di base dei partecipanti alla coorte SDS (n = 271). I cerchi indicano i mezzi dei bidoni a 2 mesi. Le barre indicano gli errori standard della media. La linea tratteggiata indica la curva del coseno di fit. p-Valore indica il significato del contributo della ritmicità stagionale alla varianza complessiva, calcolata come descritto nel testo.

Fig. 2.Associazione tra la stagione e la diagnosi clinica e la funzione cognitiva negli adulti con malattia di Alzheimer (AD).(A) Percentuale dei partecipanti classificati come affetti da deficit cognitivo lieve (MCI) o demenza, in bidoni a 2 mesi a doppia trama, considerando l’ultima valutazione disponibile nelle coorti degli Ordini religiosi (ROS), Rush Memory and Aging Project (MAP), e Minority Aging Research Study (MARS) insieme(n = 2.761). La linea tratteggiata indica la tempistica dell’acrofase della cognizione globale composita. p-Valore indica l’importanza del contributo della ritmicità stagionale al log-odds di essere classificati come affetti da MCI o demenza. (B) Prestazioni cognitive globali composte in funzione della data di valutazione, tracciate due volte, stratificate dalla presenza/assenza di una diagnosi patologica di AD, in deceduti delle coorti ROS, MAP e MARS(n = 1.410). I cerchi indicano i mezzi dei bidoni a 2 mesi. Le barre indicano errori standard della media. Le linee indicano le curve del coseno in forma. Rosso = senza una diagnosi patologica di AD. Blu = con diagnosi patologica di AD. p-Valori indicano il significato della differenza di livello o di ritmicità tra i partecipanti con e senza diagnosi patologica di AD, come calcolato nel testo. (C) Punteggio della Total Dementia Rating Scale (DRS) in funzione della data di valutazione, a doppia trama, per la valutazione di base dei partecipanti alla coorte SDS (n = 271). I cerchi indicano i mezzi dei bidoni a 2 mesi. Le barre indicano gli errori standard della media. La linea tratteggiata indica la curva del coseno di fit. p-Valore indica il significato del contributo della ritmicità stagionale alla varianza complessiva, calcolata come descritto nel testo.
Associazione tra stagione e cognizione negli adulti con AD
L’AD influisce sulla ritmicità circadiana e può plausibilmente influenzare la ritmicità stagionale. Per esaminare l’associazione tra AD patologicamente confermato e ritmi cognitivi stagionali, abbiamo analizzato l’ultima valutazione disponibile in ROS, MAP, e MARS decedenti(Tabella 1; n = 1.410). Il tempo mediano (IQR) tra l’ultima valutazione cognitiva e la morte è stato di 282 giorni (152-434). Considerando tutti i partecipanti, è rimasta una significativa associazione tra la stagione e la cognizione globale composita(Fig 2B; ampiezza = 0,23 SD [95% CI 0,11 a 0,38], p = 0,026). I partecipanti con AD patologico avevano una cognizione globale composita media inferiore rispetto a quelli senza (stima = -0,65 SD, SE = 0,05, p < 0,0001); tuttavia, la ritmicità stagionale della cognizione non differisce significativamente tra questi gruppi (p = 0,81), suggerendo una stagionalità conservata della cognizione in AD patologico.
Per valutare la generalizzabilità, abbiamo replicato le nostre analisi nei dati di base della coorte canadese SDS, uno studio osservazionale di casi provenienti da una clinica di memoria di cura terziaria a Toronto, Canada. Il punteggio medio (SD) di Mattis DRS dei partecipanti con AD è stato di 115 (17). In un modello adattato all’età, al sesso e agli anni di istruzione, l’associazione tra la stagione e il punteggio totale di DRS era significativa (ampiezza 0,50 SD [95% CI 0,07 a 0,66], p = 0,017; Fig 2C). I punteggi DRS più alti previsti dal modello sono stati visti in autunno (16 novembre), con una differenza media di 8 punti tra i partecipanti valutati al nadir primaverile (18 maggio) e il picco autunnale. Ci sono stati forti effetti sui sottodomini DRS di attenzione, velocità e iniziazione, ed effetti più deboli su altri domini(Figg. S4 e S5 ).
Ritmi stagionali dei biomarcatori del CSF AD
L’amiloide e la patologia tau contribuiscono al deterioramento cognitivo negli adulti più anziani[44], e i livelli di amiloide del liquor sono diurnalmente ritmici[45]. Per testare un’associazione tra la stagione e la biologia dell’amiloide e della tau, abbiamo analizzato i livelli di amiloide del liquor e di tau nei pazienti con(n = 176) e senza(n = 145) AD clinico della coorte CNC, uno studio di coorte osservazionale di pazienti di un centro di memoria di cure terziarie a Parigi, Francia(Tabella 1; n = 321). I livelli medi (SD) di CSF Aβ 42, Aβ 40, tau e phospho-tau erano rispettivamente 754 (280), 11.835 (4.856), 469 (318) e 71 (40) pg/ml. Considerando tutti i partecipanti insieme, in un modello adattato per età e sesso, il livello di CSF Aβ 42 era fortemente ritmico, con un picco alla fine di giugno (ampiezza 0,30 SD [95% CI 0,10 a 0,64], p = 0,003; Fig 3A). Nei modelli regolati per età e sesso, la stagione non è stata associata in modo significativo con Aβ 40 (p =0, 06; Fig 3C). Tau e fosfo-tau non erano ritmici(p = 0,515 per tau; p = 0,67 per fosfo-tau; Fig 3E e 3G). I pazienti con AD avevano il CSF Aβ 42 inferiore e Aβ 40, tau e fosfo-tau superiore, come previsto (Fig 3B,3D, 3F e 3H). Inoltre, la ritmicità di Aβ 42 è stata attenuata nei partecipanti con AD (Fig3B).
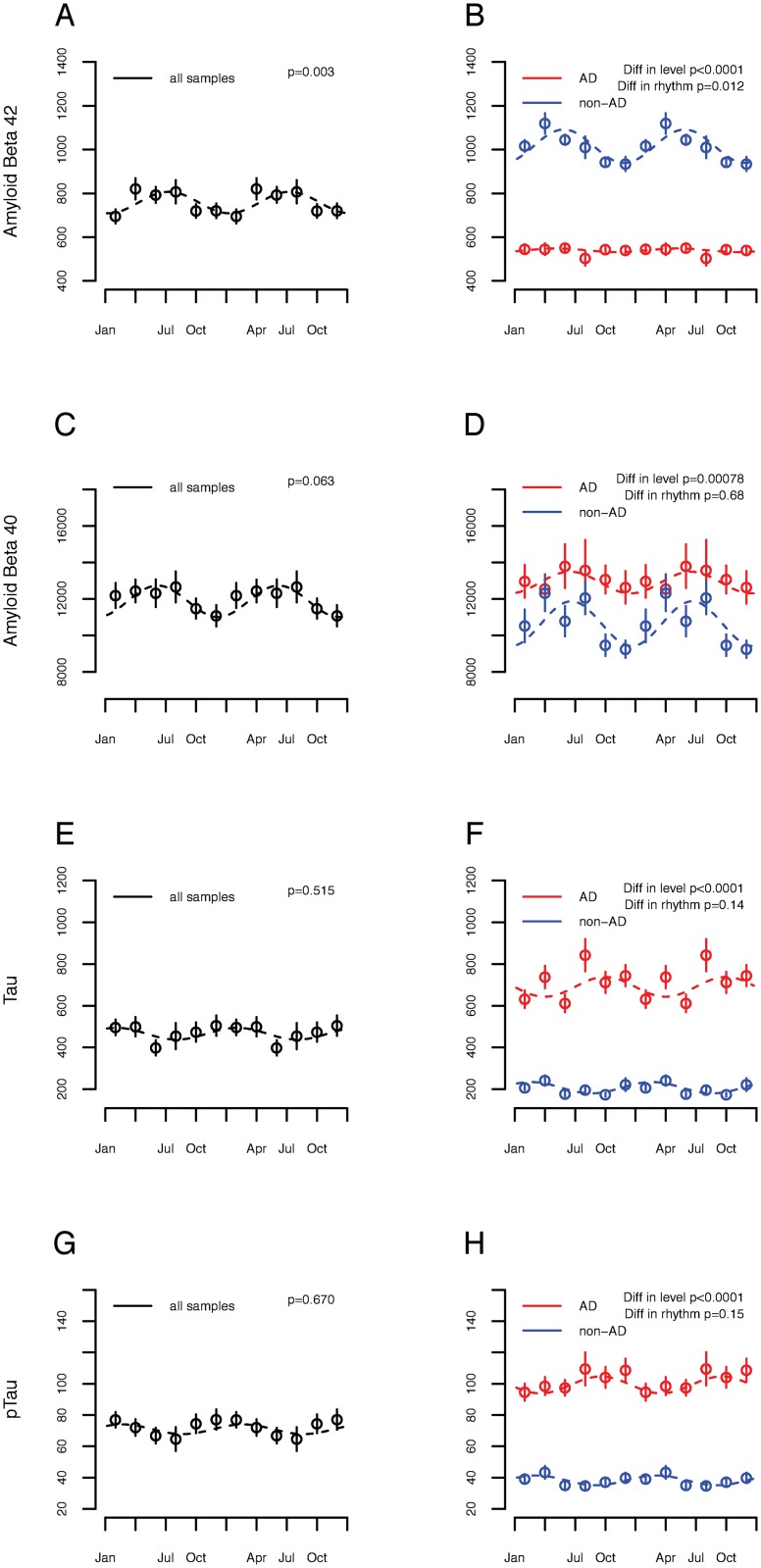
Fig 3.Associazione tra la stagione e la malattia di Alzheimer (AD) biomarcatori del liquido cerebrospinale.Concentrazioni di biomarcatori del liquido cerebrospinale AD nel fluido cerebrospinale dei partecipanti del Centre de Neurologie Cognitive (CNC) in funzione della data della puntura lombare (n = 321). I cerchi indicano i mezzi dei bidoni di 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano le curve dei coseni in forma. (A, C, E e G) Tutti i partecipanti al CNC considerati insieme. (B, D, F, e H) Stratificati dalla diagnosi clinica di AD (rosso) contro il deterioramento cognitivo non AD (blu). p-Valori indicano il significato della differenza di livello o di ritmicità tra i partecipanti con e senza diagnosi clinica di AD, come calcolato nel testo. (A e B) Aβ 42. (C e D) Aβ 40. (E e F) Tau. (G e H) Tau fosforilato.

Fig. 3.Fig. 3. Associazione tra la stagione e la malattia di Alzheimer (AD) biomarcatori del liquido cerebrospinale.Concentrazioni di biomarcatori AD nel fluido cerebrospinale del Centre de Neurologie Cognitive (CNC) partecipanti in funzione della data della puntura lombare (n = 321). I cerchi indicano i mezzi dei bidoni di 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano le curve dei coseni in forma. (A, C, E e G) Tutti i partecipanti al CNC considerati insieme. (B, D, F, e H) Stratificati dalla diagnosi clinica di AD (rosso) contro il deterioramento cognitivo non AD (blu). p-Valori indicano il significato della differenza di livello o di ritmicità tra i partecipanti con e senza diagnosi clinica di AD, come calcolato nel testo. (A e B) Aβ 42. (C e D) Aβ 40. (E e F) Tau. (G e H) Tau fosforilato.
Associazione tra la stagione e l’espressione genica neocorticale
I ritmi stagionali dell’espressione genica sono correlati con la funzione dei tessuti in altri sistemi di organi come il sistema immunitario[46]. Per identificare i geni che collegano la stagione alla cognizione, abbiamo usato l’RNA-Seq per quantificare l’espressione genica nei campioni postmortem DLPFC di 507 partecipanti ROS e MAP, come precedentemente riportato[8]. Il DLPFC è un nodo chiave per la memoria di lavoro, il dominio cognitivo più fortemente influenzato dalla stagione nei nostri dati. Abbiamo analizzato gruppi di geni co-espressi chiamati “moduli”, che vengono rilevati come cluster di geni correlati. Questi moduli sono guidati da meccanismi cellulari o di regolazione che controllano una vasta gamma di funzioni[47] e sono marcatori più robusti delle funzioni biologiche rispetto ai singoli geni. Abbiamo considerato un modulo come potenzialmente in grado di collegare la stagione alla cognizione se la sua espressione era (1) essa stessa stagionalmente ritmica, (2) in fase o antifase con la cognizione, e (3) associata alla cognizione vicina alla morte. Dei 47 moduli esaminati, in modelli adattati per età, sesso, educazione, ora del decesso, intervallo post mortem, e variabili metodologiche come lotto, intervallo post mortem e qualità dell’RNA (punteggio RIN), 4 moduli (etichettati arbitrariamente m6: n = 328 geni, ampiezza = 0,44 SD [95% CI 0.21 a 0,65], p = 0,0021; m13: n = 353 geni, ampiezza = 0,46 SD [95% CI 0,27 a 0,76], p = 0,0009; m109: n = 390 geni, ampiezza = 0.43 SD [95% CI 0,24 a 0,67], p = 0,0021; e m122: n = 370 geni, ampiezza 0,46 SD [95% CI 0,20 a 0,71], p = 0,0012) soddisfano tutti e 3 i criteri(Tabella S3).
I geni di questi moduli sono nella tabella S4. Due moduli, m13 e m122, hanno mostrato l’espressione del picco al momento della cognizione del picco(Fig 4A-4D e 4I-4L). Una maggiore espressione di questi moduli è stata associata ad una migliore cognizione in prossimità della morte e ad un minore carico di patologia amiloide all’autopsia. Gli altri 2 moduli, m6 e m109, hanno mostrato un picco di espressione al momento della cognizione più povera(Fig 4E-4H e 4M-4P). Una maggiore espressione di questi moduli è stata associata ad un peggioramento della cognizione in prossimità della morte e ad un maggiore carico di patologia amiloide all’autopsia. Questi moduli sono rimasti associati con la stagione e la cognizione nei modelli adattati per la depressione e altre neuropatologie(Tabella S5). Essi sono stati anche associati ad altri fenotipi cognitivi e neuropatologici(Fig 5). Ritmicità modulo era simile in quelli con e senza patologia AD(p > 0, 05 per tutti i 4 moduli).
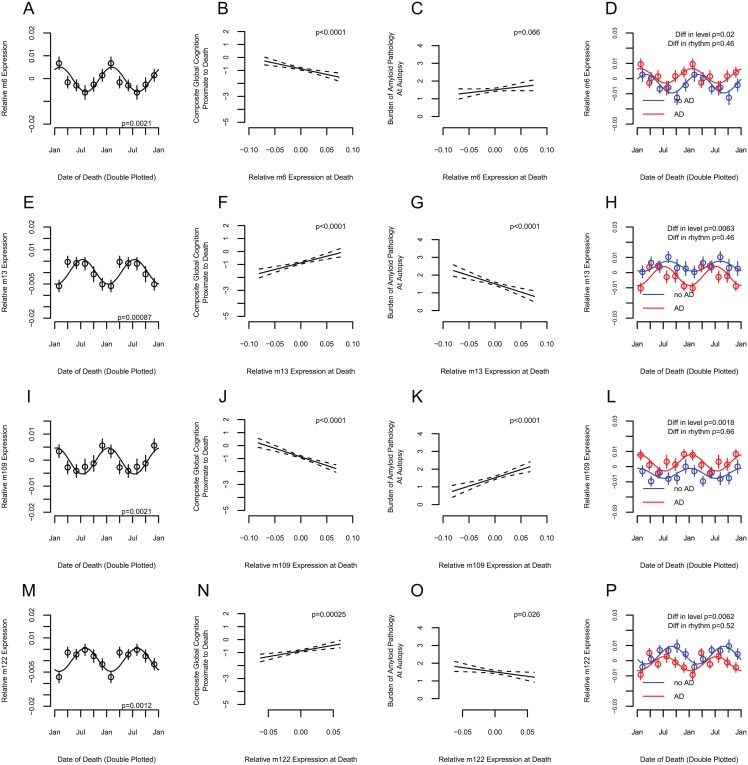
Fig 4.Associazione tra la stagione e l’espressione dei sistemi molecolari co-espressivi associati alla cognizione.Sistemi molecolari coespressi (moduli), composti da insiemi di geni presunti associati alla ritmicità stagionale della cognizione, come operativamente definito nel testo(n = 507). (A, D, E, E, H, I, I, L, M e P) Espressione media del modulo in funzione della data di morte, a doppia trama. I cerchi indicano i mezzi dei bidoni di 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano le curve del coseno in forma. (A, E, I e M) Tutti i partecipanti considerati insieme; p-Valore indica il significato del contributo della ritmicità stagionale alla varianza complessiva, calcolato come descritto nel testo. (D, H, L e P) Stratificati dalla presenza (rosso) o assenza (blu) di diagnosi patologica della malattia di Alzheimer (AD). p-Valori indicano la significatività della differenza di livello o della ritmicità tra i partecipanti con e senza diagnosi patologica di AD, come calcolato nel testo. (B, C, F, G, G, J, K, N, e O) Associazione tra la cognizione globale composita all’ultima misurazione prima della morte (B, F, J, e N) o il carico della patologia amiloide alla morte (C, G, K, e O) e l’espressione del modulo alla morte. La linea continua indica la risposta prevista dal modello per il modello non regolato. Le linee tratteggiate indicano intervalli di confidenza del 95% sulla previsione. p-Valore è regolato per le covariate come indicato nel testo.

Fig. 5.Fig. 5. Associazione di moduli genici con altri fenotipi cognitivi e neuropatologici.I colori indicano i punti z; gli asterischi indicano il significato dopo la correzione di Bonferroni per i confronti multipli(n = 507). AD, malattia di Alzheimer; Mod, modulo.
Infine, abbiamo usato siti di legame annotati a livello genomico per 161 fattori di trascrizione del progetto ENCODE[41] per identificare i siti associati a ciascun modulo. Dopo la correzione per i confronti multipli per permutazione, 15, 13, 6 e 9 fattori di trascrizione, i siti di legame dei fattori di trascrizione sono stati associati ai moduli m6, m13, m109 e m122, rispettivamente(Tabella S6). Di questi, 5 (BCL11A, EGR1, MEF2C, e THAP1 associati a m109, e CTCF associati a m13) sono stati a loro volta precedentemente identificati come ritmici stagionali[8].

Fig 4.Fig. 4. Associazione tra la stagione e l’espressione dei sistemi molecolari co-espressivi associati alla cognizione.Sistemi molecolari coespressi (moduli), composti da insiemi di geni putatilmente associati alla ritmicità stagionale della cognizione, come operativamente definito nel testo(n = 507). (A, D, E, E, H, I, I, L, M e P) Espressione media del modulo in funzione della data di morte, a doppia trama. I cerchi indicano i mezzi dei bidoni di 2 mesi. Le barre indicano gli errori standard della media. Le linee tratteggiate indicano le curve del coseno in forma. (A, E, I e M) Tutti i partecipanti considerati insieme; p-Valore indica il significato del contributo della ritmicità stagionale alla varianza complessiva, calcolato come descritto nel testo. (D, H, L e P) Stratificati dalla presenza (rosso) o assenza (blu) di diagnosi patologica della malattia di Alzheimer (AD). p-Valori indicano la significatività della differenza di livello o della ritmicità tra i partecipanti con e senza diagnosi patologica di AD, come calcolato nel testo. (B, C, F, G, G, J, K, N, e O) Associazione tra la cognizione globale composita all’ultima misurazione prima della morte (B, F, J, e N) o il carico della patologia amiloide alla morte (C, G, K, e O) e l’espressione del modulo alla morte. La linea continua indica la risposta prevista dal modello per il modello non regolato. Le linee tratteggiate indicano intervalli di confidenza del 95% sulla previsione. p-Valore è regolato per le covariate come indicato nel testo.

Fig. 5.Fig. 5. Associazione di moduli genici con altri fenotipi cognitivi e neuropatologici.I colori indicano i punti z; gli asterischi indicano il significato dopo la correzione di Bonferroni per i confronti multipli(n = 507). AD, malattia di Alzheimer; Mod, modulo.
Discussione
In questo studio di 3.353 adulti anziani in più paesi, coorti e razze, c’è stata un’associazione significativa e riproducibile tra stagione e cognizione, con un picco di cognizione vicino all’equinozio d’autunno e un effetto stagionale equivalente a una differenza di età di circa 4 anni. Questa associazione era indipendente dall’umore, dal sonno, dall’attività fisica e dallo stato della tiroide; era clinicamente significativa, come si riflette in una probabilità quasi del 30% in più di soddisfare i criteri per la MCI o la demenza in inverno e in primavera rispetto all’estate e all’autunno; e persisteva nei casi con AD patologicamente confermato. Inoltre, la stagione è stata anche associata con i livelli di Aβ del liquor e l’espressione cerebrale dei moduli genici associati alla cognizione che sono stati associati con i siti di legame del fattore di trascrizione identificabili. Ulteriori risorse di cura della demenza possono essere necessarie in inverno e in primavera, quando la cognizione è probabile che sia peggiore. Inoltre, questi risultati suggeriscono una sostanziale plasticità stagionale della cognizione, la biologia amiloide, e programmi trascrizionali correlati alla cognizione, anche in presenza di AD patologico. Fattori stagionali possono quindi essere importanti modificatori dell’associazione della cognizione con la patologia AD, un effetto potenzialmente mediato da BCL11A, EGR1, THAP1, CTCF, MEF2C, e altri fattori trascrizionali chiave, alcuni dei quali sono essi stessi stagionalmente ritmici. Ulteriori lavori per capire i meccanismi alla base di questa plasticità può portare a nuovi interventi ambientali, comportamentali o farmacologici per migliorare la cognizione in AD migliorando il normale picco estivo e autunnale della cognizione, e/o estendendolo in altre stagioni.
Diversi studi precedenti non hanno trovato alcuna associazione della stagione con la cognizione[3,6,7], mentre altri hanno mostrato un’associazione tra la stagione e alcuni domini ma non altri[4,48], o solo in individui con psicopatologia[5]. Al contrario, abbiamo dimostrato una robusta associazione della stagione con la cognizione negli adulti più anziani con e senza AD in coorti multiple. Diversi fattori possono spiegare questa divergenza rispetto agli studi precedenti. In primo luogo, diversi studi precedenti hanno esaminato la cognizione solo in prossimità dei solstizi[4,6] o la cognizione correlata alla durata del giorno[7]. Se, come suggeriscono i nostri dati, i picchi cognitivi vicino all’equinozio d’autunno, questi approcci non riuscirebbero a scoprire una stagionalità significativa. In secondo luogo, diversi studi non hanno esaminato la memoria di lavoro[6,7], che nei nostri dati era il dominio cognitivo più influenzato dalla stagione. In terzo luogo, è possibile che negli adulti più giovani, che sono stati oggetto della maggior parte degli studi precedenti, l’abbondanza di riserva cognitiva abbia minimizzato l’associazione tra stagione e cognizione, mentre questo fenomeno diventa più importante man mano che la riserva cognitiva diminuisce con l’invecchiamento cognitivo. Uno studio che non ha trovato alcuna associazione tra stagione e cognizione nei giovani adulti ha comunque trovato un’associazione tra la stagione e le risposte della fMRI corticale durante un compito di memoria di lavoro[3], con picchi di risposta che si verificano vicino all’equinozio d’autunno, più o meno in coincidenza con il picco nella memoria di lavoro osservato nel nostro studio. Questo supporta l’ipotesi di un’associazione subclinica tra stagione e cognizione nei giovani adulti, vista sulla fMRI ma non sui test cognitivi.
La persistenza di un robusto picco estivo/inverno nella cognizione suggerisce che anche in AD patologicamente confermato, rimane una sostanziale plasticità cognitiva. L’identificazione di fattori o mediatori di questo effetto può consentire di sfruttare questa plasticità per migliorare la cognizione durante tutto l’anno. Ci sono diverse ipotesi riguardanti i potenziali mediatori e i fattori scatenanti. In primo luogo, il picco cognitivo estivo e autunnale può essere determinato da fattori ambientali come la luce e la temperatura. Se è vero, allora interventi come la fototerapia o la modifica della temperatura possono essere efficaci nel sostenere questo picco durante tutto l’anno. In secondo luogo, fattori comportamentali come l’attività[49], il sonno[50] e la dieta[51] mostrano la stagionalità e possono guidare il picco cognitivo estivo e autunnale. In questo studio, l’associazione tra stagione e cognizione è indipendente dal sonno e dall’attività fisica, anche se gli studi che incorporano marcatori oggettivi di questi e altri comportamenti possono rivelare un ruolo più importante per i fattori comportamentali. In terzo luogo, i ritmi stagionali in stato psicologico (ad esempio, la depressione) possono guidare l’associazione tra stagione e cognizione. In questo studio, la stagionalità della cognizione era indipendente dalla depressione; tuttavia, altri fattori psicologici, come l’effetto negativo, che è stato associato a MCI e demenza[52], possono essere importanti. Mentre i dati sull’effetto positivo e negativo sono stati raccolti su alcuni dei nostri partecipanti, essi erano disponibili su un numero troppo ridotto di partecipanti per testare la loro associazione con i ritmi cognitivi stagionali in questo studio. In quarto luogo, i ritmi stagionali in stato fisiologico possono potenzialmente guidare l’associazione tra stagione e cognizione. Nel nostro studio, l’aggiustamento per i livelli sierici di TSH non ha attenuato sostanzialmente le stime dell’associazione tra stagione e cognizione. Tuttavia, ulteriori fattori metabolici che possono potenzialmente collegare la stagione alla cognizione sono la vitamina D[53], gli ormoni sessuali come il testosterone[54] e la melatonina[55]. Purtroppo, i dati sui livelli sierici di vitamina D, testosterone e melatonina non erano disponibili nel nostro studio. Infine, un orologio endogeno stagionale può guidare i ritmi della cognizione. A sostegno di ciò, ci sono alcune prove di un tale orologio in altre specie[56], e i ritmi stagionali nelle risposte fMRI alle attività cognitive persistono anche con il controllo dei fattori comportamentali e ambientali[3]. Studi che combinano misure seriali di cognizione, ambiente, comportamento e fisiologia negli stessi individui in più punti temporali nel corso dell’anno aiuteranno a distinguere queste possibilità.
Nella coorte CNC, il livello di CSF Aβ 42 era più alto in estate, leggermente precedente il momento di picco cognitivo e il rischio più basso per MCI/demenza nelle coorti ROS, MAP e MARS. Questo picco non era correlato al tempo di orologio della puntura lombare, poiché tutte le punture lombari sono state eseguite ogni giorno in una stretta finestra di 2 o 3 ore. La differenza di fase tra i ritmi del CSF Aβ nella coorte CNC e i ritmi cognitivi e molecolari nelle altre coorti può essere in parte correlata a differenze di latitudine (CNC 49° N rispetto a sud di 44° N per le altre coorti). La sovrapposizione tra i tempi dei maggiori livelli di CSF Aβ 42 e le più basse probabilità di MCI/demenza è in linea con la letteratura esistente che mostra che alti livelli di CSF Aβ 42 sono associati a una migliore cognizione anche in adulti più anziani senza una diagnosi clinica di AD [57]. Altri studi hanno identificato i ritmi diurni dell’amiloide del liquor[45], ma, a nostra conoscenza, non sono stati descritti i ritmi stagionali. Questi ritmi possono riflettere la variazione stagionale nella sintesi di Aβ 42 o nelle transizioni tra compartimenti (parenchima, interstizio, liquido cerebrospinale e circolazione sistemica) o forme (monomeriche, oligomeriche e insolubili) dell’amiloide. Le concentrazioni monomeriche del liquor monomerico Aβ 42 sono inversamente correlate all’oligomerico interstiziale del cervello [58] e al fibrillare [59]Aβ in alcuni contesti. Pertanto, i bassi livelli invernali di CSF monomerico Aβ 42 possono riflettere alti livelli di specie di Aβ interstiziali oligomeriche cerebrali, che possono avere un impatto negativo sulla cognizione [60]. Gli studi che esaminano l’associazione tra la stagione e le specie Aβ oligomeriche possono fare luce su questo aspetto.
Indipendentemente dai fattori finali del picco cognitivo estivo/invernale, gli sforzi per comprendere i suoi substrati neurobiologici possono identificare percorsi molecolari la cui plasticità è conservata in AD patologico e che possono quindi essere obiettivi promettenti per migliorare le funzioni cognitive in AD. In questo studio, il picco cognitivo estivo/inverno ha messo in parallelo le nadri stagionali di 2 moduli genici di co-espressione della corteccia prefrontale (m6 e m109) associati negativamente alla cognizione, e le acrofasi stagionali di 2 moduli genici (m13 e m122) associati positivamente alla cognizione. Queste relazioni di fase significano che gli effetti stagionali di questi moduli possono essere sinergici; il picco di cognizione in estate e in autunno può essere guidato da una sinergia di una maggiore espressione dei moduli associati positivamente alla cognizione e associati negativamente alla Aβ (m13 e m122) e di una minore espressione dei moduli associati negativamente alla cognizione e associati positivamente alla Aβ (m6 e m109), mentre in inverno e in primavera si verifica il contrario. L’ontologia genica e le analisi di arricchimento di tipo cellulare per questi moduli sono state precedentemente pubblicate[39]. Anche se 3 dei 4 moduli (m6, m13 e m122) non sono fortemente arricchiti per specifici percorsi di ontologia genica o tipi di cellule, m109 è relativamente arricchito per i percorsi coinvolti nella modificazione della cromatina e nel controllo del ciclo cellulare, ed è associato al declino cognitivo e alla patologia amiloide[39]. Negli esperimenti in linee cellulari umane, il knock-down di geni selezionati m109, tra cui INPPL1 e PLXNB1, si traduce in una riduzione dei livelli di amiloide extracellulare, potenzialmente collegando i ritmi stagionali di m109 ai ritmi stagionali dell’amiloide extracellulare del cervello[39]. Così, uno scenario possibile è che in estate e all’inizio dell’autunno, l’espressione neocorticale di m109 e dei geni associati come INPPL1 e PLXNB1 è al suo minimo, portando a livelli relativamente più bassi di specie oligomeriche cerebrali interstiziali Aβ (riflesso dai livelli relativamente alti di Aβ monomerica del liquor monomerico), che porta ad un miglioramento della cognizione, mentre in inverno e all’inizio della primavera è vero il contrario (S6 Fig). Un ulteriore lavoro è necessario per esaminare l’impatto cognitivo dell’aumento o della diminuzione dell’espressione di questi moduli nei sistemi modello, e per capire i meccanismi, come i fattori di trascrizione identificati in questo studio, che spiegano la loro ritmicità. Ciò può consentire di aumentare terapeuticamente l’espressione di m13 e m122, o di diminuire terapeuticamente l’espressione di m109 e m6 per migliorare la cognizione durante tutto l’anno in individui con AD.
Alcuni limiti devono essere osservati. In primo luogo, ogni partecipante o campione ha contribuito solo 1 punto di dati per ciclo annuale. Sarebbe preferibile ricavare stime della ritmicità a livello individuale da test o campionamenti ripetuti dallo stesso individuo durante tutto l’anno. Tuttavia, per limitare l’onere dei partecipanti, abbiamo limitato le valutazioni a una volta all’anno e il campionamento del CSF a una volta per partecipante. Inoltre, non sarebbe eticamente ammissibile campionare ripetutamente il tessuto neocorticale di partecipanti viventi. In secondo luogo, ci siamo basati sull’auto-rapporto per misurare i fattori ambientali e comportamentali che hanno portato ad ogni valutazione, e abbiamo avuto dati quantitativi limitati, rendendo difficile distinguere l’influenza di questi fattori. In particolare, poiché tutte le coorti di studio erano basate in latitudini relativamente settentrionali (a nord di 41° N), è possibile che gli estremi del tempo, in particolare il freddo, possano aver fatto sì che i partecipanti con maggiori gradi di disabilità neurologiche (ad esempio, quelli con maggiori danni cognitivi) abbiano meno probabilità di poter partecipare alle visite di studio in inverno. Tuttavia, questo avrebbe influenzato lo studio verso la ricerca di una minore probabilità di soddisfare i criteri diagnostici per l’MCI o la demenza nei mesi più freddi, che è l’opposto dell’effetto che si è visto. In terzo luogo, avevamo informazioni limitate sulla causa di morte nei deceduti, che possono influenzare l’espressione genica al momento del decesso e che possono essere stagionali. Quarto, sebbene questo sia stato uno dei più grandi studi finora condotti per esaminare i ritmi stagionali dell’espressione genica del cervello umano, mancava tuttavia il potere statistico di trarre conclusioni definitive a livello di singolo gene, da qui la nostra analisi di insiemi di geni definiti da modelli di co-espressione. In quinto luogo, questo studio consisteva principalmente di individui di origine europea o africana che vivevano in regioni temperate dell’emisfero settentrionale, limitando la generalizzabilità ad altre razze o località geografiche. Sarebbe di particolare interesse studiare le popolazioni nelle regioni temperate dell’emisfero meridionale, dove ci si potrebbe aspettare che gli effetti stagionali siano in antifase rispetto a quelli dell’emisfero settentrionale, e studiare le popolazioni nelle regioni equatoriali, dove ci si potrebbe aspettare che gli effetti stagionali siano relativamente attenuati rispetto alle regioni temperate. Infine, tutte le valutazioni cognitive e del QCS sono state eseguite durante una finestra relativamente limitata nell’arco delle 24 ore diurne. Se da un lato questo ha limitato il potenziale di confondere il momento della valutazione, dall’altro ha anche limitato la capacità di ottenere stime robuste degli effetti circadiani, che richiederebbero un campionamento intorno alle 24 ore.
Questo studio ha avuto anche diversi punti di forza. Nonostante le limitazioni demografiche e geografiche di cui sopra, abbiamo replicato le nostre analisi primarie in coorti di 3 diversi paesi e 2 diversi gruppi razziali, migliorando la generalizzabilità. In secondo luogo, la convergenza temporale dei dati cognitivi e molecolari ha migliorato la plausibilità biologica e ci ha permesso di tracciare dei collegamenti tra i ritmi molecolari e comportamentali. In terzo luogo, le valutazioni cognitive, le punture lombari e le date di morte sono state distribuite durante tutto l’anno, piuttosto che limitate a tempi di campionamento discreti, massimizzando la capacità di rilevare la ritmicità indipendentemente dalla fase. In quarto luogo, abbiamo avuto una conferma istopatologica nei deceduti, fornendo un alto grado di certezza diagnostica.
Nel complesso, riportiamo stime attendibili di un’importante fonte di variazione delle prestazioni cognitive e dei suoi correlati biologici tra un insieme diversificato di individui anziani. La stagione dovrebbe essere considerata come un importante cofondatore quando si analizzano i dati di studi terapeutici e studi osservazionali in AD. In particolare, gli studi che mirano a stimare i tassi di declino cognitivo con misurazioni ripetute dello stesso partecipante dovrebbero valutare lo stesso individuo alla stessa data in diversi cicli di studio (come avviene nelle coorti ROS, MAP e MARS) o dovrebbero considerare la stagione come una covariata. Nella pratica clinica, gli effetti stagionali possono essere un’importante fonte di errori di classificazione diagnostica e possono spiegare l’osservazione che alcuni individui con MCI ritornano alla normale cognizione nei test successivi. I nostri risultati dovrebbero anche informare la progettazione di algoritmi clinici che sfruttano il nadir cognitivo invernale/primaverile per aumentare la sensibilità nell’identificazione dei partecipanti nei primi stadi della malattia. Infine, le dimensioni dell’effetto viste in questo studio suggeriscono che il targeting dei driver ambientali o comportamentali della plasticità cognitiva stagionale, o i fattori chiave di trascrizione e i geni identificati in questo studio come potenzialmente mediatori di questi effetti, possono permetterci di migliorare sostanzialmente la cognizione negli adulti con e senza patologia AD.
Informazioni di supporto
References
- Rosenthal NE, Sack DA, Gillin JC, Lewy AJ, Goodwin FK, Davenport Y. Seasonal affective disorder. A description of the syndrome and preliminary findings with light therapy. Arch Gen Psychiatry. 1984; 41(1):72-80. PubMed
- Owens N, McGorry PD. Seasonality of symptom onset in first-episode schizophrenia. Psychol Med. 2003; 33(1):163-7. PubMed
- Meyer C, Muto V, Jaspar M, Kusse C, Lambot E, Chellappa SL. Seasonality in human cognitive brain responses. Proc Natl Acad Sci U S A. 2016; 113(11):3066-71. DOI | PubMed
- Brennen T, Martinussen M, Hansen BO, Hjemdal O. Arctic cognition: a study of cognitive performance in summer and winter at 69 degrees N. Appl Cogn Psychol. 1999; 13(6):561-80. DOI | PubMed
- Rajajarvi E, Antila M, Kieseppa T, Lonnqvist J, Tuulio-Henriksson A, Partonen T. The effect of seasons and seasonal variation on neuropsychological test performance in patients with bipolar I disorder and their first-degree relatives. J Affect Disord. 2010; 127(1–3):58-65. DOI | PubMed
- Afsar B, Kirkpantur A. Are there any seasonal changes of cognitive impairment, depression, sleep disorders and quality of life in hemodialysis patients?. Gen Hosp Psychiatry. 2013; 35(1):28-32. DOI | PubMed
- Lacny C, Kirk A, Morgan DG, Karunanayake C. Does day length affect cognitive performance in memory clinic patients?. Can J Neurol Sci. 2011; 38(3):461-4. PubMed
- Lim AS, Klein HU, Yu L, Chibnik LB, Ali S, Xu J. Diurnal and seasonal molecular rhythms in human neocortex and their relation to Alzheimer’s disease. Nat Commun. 2017; 8:14931. DOI | PubMed
- Lim AS, Kowgier M, Yu L, Buchman AS, Bennett DA. Sleep fragmentation and the risk of incident Alzheimer’s disease and cognitive decline in older persons. Sleep. 2013; 36(7):1027-32. DOI | PubMed
- Bennett DA, Buchman AS, Boyle PA, Barnes LL, Wilson RS, Schneider JA. Religious Orders Study and Rush Memory and Aging Project. J Alzheimers Dis. 2018; 64(s1):S161-89. DOI | PubMed
- Barnes LL, Shah RC, Aggarwal NT, Bennett DA, Schneider JA. The Minority Aging Research Study: ongoing efforts to obtain brain donation in African Americans without dementia. Curr Alzheimer Res. 2012; 9(6):734-45. PubMed
- Ramirez J, McNeely AA, Scott CJM, Masellis M, Black SE, Alzheimer’s disease neuroimaging I. white matter hyperintensity burden in elderly cohort studies: the Sunnybrook Dementia Study, Alzheimer’s Disease Neuroimaging Initiative, and Three-City Study. Alzheimers Dement. 2016; 12(2):203-10. DOI | PubMed
- Wilson RS, Beck TL, Bienias JL, Bennett DA. Terminal cognitive decline: accelerated loss of cognition in the last years of life. Psychosom Med. 2007; 69(2):131-7. DOI | PubMed
- McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology. 1984; 34(7):939-44. PubMed
- Misch MR, Mitchell S, Francis PL, Sherborn K, Meradje K, McNeely AA. Differentiating between visual hallucination-free dementia with Lewy bodies and corticobasal syndrome on the basis of neuropsychology and perfusion single-photon emission computed tomography. Alzheimers Res Ther. 2014; 6(9):71. DOI | PubMed
- Mattis S, Bellak L, Carasu TB. Geriatirc psychiatry: a handbook for psychiatrists and primary care physicians. Grune & Stratton: New York; 1976.
- Delis DC, Kramer JH, Kaplan EF, Ober BA. The California Verbal Learning Test. Psychological Corporation: San Antonio; 1987.
- Wechsler D. Wechsler Memory Scale—revised manual. Psychological Corporation: San Antonio; 1987.
- Kaplan EF, Fein D, Morris R, Delis D. The WAIS-R as a neuropsychological instrument. Psychological Corporation: San Antonio; 1991.
- Heaton RK. Wisconsin Card Sorting Test manual. Psychological Assessment Resources: Odessa (FL); 1981.
- Lezack MD. Neuropsychological assessment. Oxford University Press: New York; 1983.
- Gladsjo JA, Schuman CC, Evans JD, Peavy GM, Miller SW, Heaton RK. Norms for letter and category fluency: demographic corrections for age, education, and ethnicity. Assessment. 1999; 6(2):147-78. DOI | PubMed
- Benton AL, Hamser K, Varney NR, Spreen O. contributions to neuropsychological assessment. Oxford University Press: New York; 1983.
- McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR, Kawas CH. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement. 2011; 7(3):263-9. DOI | PubMed
- Bennett DA, Schneider JA, Buchman AS, Barnes LL, Boyle PA, Wilson RS. Overview and findings from the rush Memory and Aging Project. Curr Alzheimer Res. 2012; 9(6):646-63. PubMed
- Wilson RS, Mendes De Leon CF, Barnes LL, Schneider JA, Bienias JL, Evans DA. Participation in cognitively stimulating activities and risk of incident Alzheimer disease. JAMA. 2002; 287(6):742-8. PubMed
- Bennett DA, Schneider JA, Arvanitakis Z, Kelly JF, Aggarwal NT, Shah RC. Neuropathology of older persons without cognitive impairment from two community-based studies. Neurology. 2006; 66(12):1837-44. DOI | PubMed
- Bennett DA, Wilson RS, Schneider JA, Evans DA, Aggarwal NT, Arnold SE. Apolipoprotein E epsilon4 allele, AD pathology, and the clinical expression of Alzheimer’s disease. Neurology. 2003; 60(2):246-52. PubMed
- National Institute on Aging, Reagan Institute Working Group of Diagnostic Criteria for the Neuropathological Assessment of Alzheimer’s Disease. Consensus recommendations for the postmortem diagnosis of Alzheimer’s disease. Neurobiol Aging. 1997; 18(4 Suppl):S1-2. PubMed
- Bennett DA, Schneider JA, Tang Y, Arnold SE, Wilson RS. The effect of social networks on the relation between Alzheimer’s disease pathology and level of cognitive function in old people: a longitudinal cohort study. Lancet Neurol. 2006; 5(5):406-12. DOI | PubMed
- McKeith IG, Galasko D, Kosaka K, Perry EK, Dickson DW, Hansen LA. Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the consortium on DLB international workshop. Neurology. 1996; 47(5):1113-24. PubMed
- Schneider JA, Wilson RS, Bienias JL, Evans DA, Bennett DA. Cerebral infarctions and the likelihood of dementia from Alzheimer disease pathology. Neurology. 2004; 62(7):1148-55. PubMed
- Arvanitakis Z, Leurgans SE, Barnes LL, Bennett DA, Schneider JA. Microinfarct pathology, dementia, and cognitive systems. Stroke. 2011; 42(3):722-7. DOI | PubMed
- Levin JZ, Yassour M, Adiconis X, Nusbaum C, Thompson DA, Friedman N. Comprehensive comparative analysis of strand-specific RNA sequencing methods. Nat Methods. 2010; 7(9):709-15. DOI | PubMed
- Adiconis X, Borges-Rivera D, Satija R, DeLuca DS, Busby MA, Berlin AM. Comparative analysis of RNA sequencing methods for degraded or low-input samples. Nat Methods. 2013; 10(7):623-9. DOI | PubMed
- Langmead B, Trapnell C, Pop M, Salzberg SL. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biol. 2009; 10(3):R25. DOI | PubMed
- Johnson WE, Li C, Rabinovic A. Adjusting batch effects in microarray expression data using empirical Bayes methods. Biostatistics. 2007; 8(1):118-27. DOI | PubMed
- Gaiteri C, Chen M, Szymanski B, Kuzmin K, Xie J, Lee C. Identifying robust communities and multi-community nodes by combining top-down and bottom-up approaches to clustering. Sci Rep. 2015; 5:16361. DOI | PubMed
- Mostafavi S, Gaiteri C, Sullivan SE, White CC, Tasaki S, Xu J. A molecular network of the aging human brain provides insights into the pathology and cognitive decline of Alzheimer’s disease. Nat Neurosci. 2018; 21(6):811-9. DOI | PubMed
- Langfelder P, Horvath S. WGCNA: an R package for weighted correlation network analysis. BMC Bioinformatics. 2008; 9:559. DOI | PubMed
- Wang J, Zhuang J, Iyer S, Lin XY, Greven MC, Kim BH. Factorbook.org: a Wiki-based database for transcription factor-binding data generated by the ENCODE consortium. Nucleic Acids Res. 2013; 41(Database issue):D171-6. DOI | PubMed
- Wang J, Zhuang J, Iyer S, Lin X, Whitfield TW, Greven MC. Sequence features and chromatin structure around the genomic regions bound by 119 human transcription factors. Genome Res. 2012; 22(9):1798-812. DOI | PubMed
- Gerstein MB, Kundaje A, Hariharan M, Landt SG, Yan KK, Cheng C. Architecture of the human regulatory network derived from ENCODE data. Nature. 2012; 489(7414):91-100. DOI | PubMed
- Bennett DA, Schneider JA, Wilson RS, Bienias JL, Berry-Kravis E, Arnold SE. Amyloid mediates the association of apolipoprotein E e4 allele to cognitive function in older people. J Neurol Neurosurg Psychiatry. 2005; 76(9):1194-9. DOI | PubMed
- Huang Y, Potter R, Sigurdson W, Santacruz A, Shih S, Ju YE. Effects of age and amyloid deposition on Abeta dynamics in the human central nervous system. Arch Neurol. 2012; 69(1):51-8. DOI | PubMed
- Dopico XC, Evangelou M, Ferreira RC, Guo H, Pekalski ML, Smyth DJ. Widespread seasonal gene expression reveals annual differences in human immunity and physiology. Nat Commun. 2015; 6:7000. DOI | PubMed
- Gaiteri C, Ding Y, French B, Tseng GC, Sibille E. Beyond modules and hubs: the potential of gene coexpression networks for investigating molecular mechanisms of complex brain disorders. Genes Brain Behav. 2014; 13(1):13-24. DOI | PubMed
- Merikanto I, Lahti T, Castaneda AE, Tuulio-Henriksson A, Aalto-Setala T, Suvisaari J. Influence of seasonal variation in mood and behavior on cognitive test performance among young adults. Nord J Psychiatry. 2012; 66(5):303-10. DOI | PubMed
- Kimura T, Kobayashi H, Nakayama E, Kakihana W. Seasonality in physical activity and walking of healthy older adults. J Physiol Anthropol. 2015; 34:33. DOI | PubMed
- Yetish G, Kaplan H, Gurven M, Wood B, Pontzer H, Manger PR. Natural sleep and its seasonal variations in three pre-industrial societies. Curr Biol. 2015; 25(21):2862-8. DOI | PubMed
- Shahar DR, Froom P, Harari G, Yerushalmi N, Lubin F, Kristal-Boneh E. Changes in dietary intake account for seasonal changes in cardiovascular disease risk factors. Eur J Clin Nutr. 1999; 53(5):395-400. PubMed
- Dos Santos SB, Rocha GP, Fernandez LL, de Padua AC, Reppold CT. Association of lower spiritual well-being, social support, self-esteem, subjective well-being, optimism and hope scores with mild cognitive impairment and mild dementia. Front Psychol. 2018; 9:371. DOI | PubMed
- Hintzpeter B, Mensink GB, Thierfelder W, Muller MJ, Scheidt-Nave C. Vitamin D status and health correlates among German adults. Eur J Clin Nutr. 2008; 62(9):1079-89. DOI | PubMed
- Svartberg J, Jorde R, Sundsfjord J, Bonaa KH, Barrett-Connor E. Seasonal variation of testosterone and waist to hip ratio in men: the Tromso study. J Clin Endocrinol Metab. 2003; 88(7):3099-104. DOI | PubMed
- Morera AL, Abreu P. Seasonality of psychopathology and circannual melatonin rhythm. J Pineal Res. 2006; 41(3):279-83. DOI | PubMed
- Kondo N, Sekijima T, Kondo J, Takamatsu N, Tohya K, Ohtsu T. Circannual control of hibernation by HP complex in the brain. Cell. 2006; 125(1):161-72. DOI | PubMed
- Stomrud E, Hansson O, Zetterberg H, Blennow K, Minthon L, Londos E. Correlation of longitudinal cerebrospinal fluid biomarkers with cognitive decline in healthy older adults. Arch Neurol. 2010; 67(2):217-23. DOI | PubMed
- Savage MJ, Kalinina J, Wolfe A, Tugusheva K, Korn R, Cash-Mason T. A sensitive abeta oligomer assay discriminates Alzheimer’s and aged control cerebrospinal fluid. J Neurosci. 2014; 34(8):2884-97. DOI | PubMed
- Hansson O, Seibyl J, Stomrud E, Zetterberg H, Trojanowski JQ, Bittner T. CSF biomarkers of Alzheimer’s disease concord with amyloid-beta PET and predict clinical progression: a study of fully automated immunoassays in BioFINDER and ADNI cohorts. Alzheimers Dement. 2018. DOI | PubMed
- Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I. Amyloid-beta protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory. Nat Med. 2008; 14(8):837-42. DOI | PubMed
Fonte
Lim ASP, Gaiteri C, Yu L, Sohail S, Swardfager W, et al. (2018) Seasonal plasticity of cognition and related biological measures in adults with and without Alzheimer disease: Analysis of multiple cohorts. PLoS Medicine 15(9): e1002647. https://doi.org/10.1371/journal.pmed.1002647





