Introduzione
I cannabinoidi sono il gruppo di droghe illecite più comunemente usate, e si stima che l’uso e la dipendenza da cannabis siano aumentati negli ultimi 2 decenni.1 Nonostante la percezione comune che la cannabis sia relativamente innocua, ci sono prove sostanziali a sostegno di un’associazione tra il consumo di cannabis e diverse sequele mediche, neurocognitive, funzionali e psicosociali.2 I rischi noti dell’uso di cannabinoidi a breve termine includono la compromissione della memoria a breve termine e della coordinazione motoria, l’alterazione del giudizio, la paranoia e le psicosi.3 Analogamente, gli effetti a lungo termine dell’uso di cannabinoidi includono dipendenza, alterazione dello sviluppo cerebrale, scarsi risultati educativi, deterioramento cognitivo, diminuzione della qualità della vita, aumento del rischio di malattie croniche delle vie respiratorie e psicotiche, lesioni, collisioni con veicoli a motore e suicidio.3,4
In parallelo con altre sindromi da astinenza da sostanze, una sindrome da astinenza da cannabis (CWS) – originariamente proposta da Budney e colleghi5,6,7,8 -ha ricevuto un riconoscimento negli ultimi anni. I sintomi della sindrome da astinenza da cannabis si manifestano in modo affidabile in seguito a uno specifico decorso temporale con la cessazione dell’uso di cannabis, sono transitori, possono essere migliorati con una nuova somministrazione di cannabis e sono clinicamente significativi. La sindrome da astinenza da cannabis è stata riconosciuta dal Manuale Diagnostico e Statistico dei Disturbi Mentali, Quinta Edizione,9 e richiede la presenza di almeno 3 dei seguenti sintomi che si sviluppano entro 7 giorni dalla riduzione del consumo di cannabis: (1) irritabilità, rabbia o aggressività; (2) nervosismo o ansia; (3) disturbi del sonno; (4) disturbi dell’appetito o del peso; (5) irrequietezza; (6) umore depresso; (7) sintomi somatici, come mal di testa, sudorazione, nausea, vomito o dolore addominale.
Diversi studi che utilizzano approcci diversi hanno caratterizzato la CWS, e le stime di prevalenza che ne sono risultate vanno dall’11,1% al 94,2%.8,10,11,12 Quindi, sebbene ci sia preoccupazione per i rischi associati all’uso dei cannabinoidi e alla CWS, a nostra conoscenza, non esiste attualmente una sintesi quantitativa completa dell’entità del rischio e di quanto elevato possa essere tale rischio rispetto alla popolazione generale tra le persone con un uso regolare o problematico di cannabinoidi.
Lo scopo principale di questa revisione sistematica e meta-analisi è stato quello di stimare la prevalenza di CWS e di identificare i contributori all’eterogeneità dei risultati riportati. Abbiamo cercato di produrre stime della prevalenza di CWS in base all’età e al sesso, ove possibile.
Metodi
Utilizzando un protocollo a priori,13 abbiamo condotto la nostra revisione sistematica in conformità con la linea guidaPRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses).14 La Queen’s University ha rinunciato a richiedere l’approvazione del comitato di revisione istituzionale perché questa revisione sistematica non costituisce una ricerca su soggetti umani. La strategia di ricerca è stata sviluppata in consultazione con un bibliotecario di ricerca. Otto database elettronici (MEDLINE, Embase, PsycInfo, Web of Science, Allied and Complementary Medicine, Cumulative Index to Nursing and Allied Health Literature, ProQuest e Psychiatry Online) sono stati ricercati dall’inizio al 19 giugno 2019, senza alcuna restrizione sull’anno di studio. Sono stati usati i titoli dei soggetti medici e le parole chiave relative al ritiro della cannabis, all’uso di cannabis e alla prevalenza di fattori epidemiologici (eTabella 1 nel supplemento). Le liste di riferimento di tutti gli articoli full-text inclusi sono state ricercate per identificare eventuali studi mancati nella ricerca iniziale, e la funzione di articoli simili di PubMed è stata usata per trovare articoli accademici aggiuntivi che citano articoli idonei. Non sono stati presi in considerazione i riferimenti che consistevano solo in abstracts. I riferimenti sono stati compilati e gestiti utilizzando Zotero (Università George Mason).15 Le citazioni sono state poi importate nello strumento di screening basato sul web Covidence (Cochrane Collaboration),16 dove sono state rimosse le citazioni doppie.
I titoli e gli abstract sono stati controllati da un revisore (A.B.), e tutto il materiale contrassegnato come escluso è stato controllato da una seconda persona (R.T.) per garantire l’accuratezza dello screening di primo passaggio. In questa fase, i criteri erano volutamente ampi per consentire l’inclusione di qualsiasi studio pertinente. Per essere inclusi, gli studi dovevano essere pubblicati in inglese e riportare la ricerca originale usando qualsiasi disegno osservazionale (ad esempio, trasversale o di coorte) che riportasse la CWS in individui con uso regolare o dipendente di cannabis o di cannabinoidi sintetici. La definizione esatta dell’uso regolare di cannabinoidi variava da coorte a coorte, e riassumiamo i criteri e le caratteristiche degli studi nella Tabella 1.17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60 Sono stati esclusi i rapporti sui casi e le serie. Gli articoli a testo integrale sono stati vagliati da 2 revisori indipendenti (A.B. e C.S.), con discrepanze risolte per consenso o tramite consultazione con un terzo revisore (R.T., E.R.H., o D.P.S.) quando non è stato raggiunto il consenso. Gli articoli sono stati inclusi se (1) sono stati pubblicati in inglese, (2) hanno riportato individui con uso regolare o dipendente di cannabinoidi come gruppo di studio primario, (3) hanno riportato sintomi di CWS o CWS utilizzando uno strumento convalidato, e (4) hanno riportato la prevalenza di CWS in individui con uso regolare o dipendente di cannabinoidi. Per gli studi che hanno utilizzato lo stesso campione di dati, sono stati inclusi quelli che fornivano le informazioni più dettagliate, e gli altri sono stati tenuti come riferimento.
| Fonte: | Impostazione dello studio | Criteri | No. | CUD, % | Maschio, %, %, %, %, %, %, %, %, %, %, %, %. | Età, y | CWS, %, %. | |
|---|---|---|---|---|---|---|---|---|
| CUD | CWS | |||||||
| Cottler et al,17 1995, Stati Uniti | Popolazione | DSM-III-R | CIDI-SAM | 102 | 8 | 57 | 37.0 | 15.7 |
| Wiesbeck et al,18 1996, Stati Uniti | Popolazione | DSM-IV | SSAGA | 1735 | 50.4 | 63 | 32.3 | 15.6 |
| Budney et al,19 1998, Stati Uniti | Ambulatorio | DSM-III-R | Operativo | 62 | 100 | 87 | 31.2 | 75.8 |
| Crowley et al,20 1998, Stati Uniti | Ambulatorio | DSM-III-R | CIDI-SAM, DISCO | 229 | 78.6 | 72 | 15.8 | 66.8 |
| Swift et al,21 1998, Australia | Popolazione | DSM-III-R | Operativo | 243 | 57 | 58 | 36.0 | 20.2 |
| Budney et al,6 1999, Stati Uniti | Ambulatorio | DSM-III-R | MWC | 54 | 54 | 85 | 33.8 | 57.4 |
| Schuckit et al,22 1999, Stati Uniti | Ambulatorio | DSM-III-R | Operativo | 596 | 30 | 66.1 | 32.0 | 39.9 |
| Kouri e Papa et al,23 2000, Stati Uniti | Ambulatorio | DSM-IV | Diario autodichiarato | 30 | 100 | 87 | 42.5 | 60.0 |
| Swift et al,24 2000, Australia | Ambulatorio | DSM-III-R | Operativo | 162 | 92 | 53.7 | 30.0 | 32.1 |
| Swift et al,25 2001, Australia | Popolazione | DSM-IV | CIDI, DSM-IV, SCID | 722 | 20.8 | NA | NA | 29.5 |
| Stephens et al,26 2002, Stati Uniti | Ambulatorio | DSM-IV | SCID, TLFB, ASI | 450 | 100 | 68.4 | 36.1 | 77.6 |
| Budney et al,7 2003, Stati Uniti | Ambulatorio | DSM-IV | MWC, MCQ | 18 | 100 | 61 | 30.9 | 77.8 |
| Vandrey et al,27 2005, Stati Uniti | Ambulatorio | DSM-IV | MWC, YSR, WDS | 72 | 56.9 | 90 | 16.2 | 58.3 |
| Copersino et al,28 2006, Stati Uniti | Ambulatorio | DSM-IV | MJQQ | 104 | 54 | 78 | 35.0 | 44.2 |
| Levin et al,29 2006, Stati Uniti | Ambulatorio | DSM-IV | CMR, URICA, RDU | 42 | 100 | 74 | 34.3 | 69.0 |
| Nocon et al,30 2006, Germania | Popolazione | DSM-IV | CIDI-SAM, MWC | 732 | 3.5 | NA | 19.0 | 16.1 |
| Lukasiewicz et al,31 2007, Francia | Popolazione | DSM-IV | Operativo | 278 | 26.7 | 90.1 | 39.0 | 7.6 |
| Agrawal et al,32 2008, Stati Uniti | Popolazione | DSM-IV | AUDADIS | 1603 | 12.2 | 62 | 30.8 | 8.0 |
| Chung et al,33 2008, Stati Uniti | Ambulatorio | DSM-IV | MWC, SCID | 214 | 60.7 | 67 | 16.8 | 36.9 |
| Cornelius et al,34 2008, Stati Uniti | Ambulatorio | DSM-IV | MWC | 170 | 100 | 54 | 20.3 | 43.5 |
| Hasin et al,35 2008, Stati Uniti | Popolazione | DSM-IV | SCID | 2613 | 57.2 | 67 | 58.5 | 34.4 |
| Jungerman et al,36 2008, Brasile | Ambulatorio | DSM-III-R | CIDI, TFLB, MWC | 160 | 100 | 80 | 32.3 | 51.3 |
| Milin et al,37 2008, Canada | Ricoverato | DSM-IV | CWS, SCID | 21 | 100 | 67 | 17.0 | 100.0 |
| Vandrey et al,38 2008, Stati Uniti | Ricoverato | DSM-IV | WSC | 12 | 100 | 50 | 28.2 | 100.0 |
| Mennes et al,39 2009, Stati Unitia | Ambulatorio | DSM-IV | CIDI-SAM | 416 | 48 | 49 | 22.0 | 50.0 |
| Mennes et al,39 2009, Stati Unitia | Ambulatorio | DSM-IV | CIDI-SAM | 278 | 63 | 49 | 22.0 | 68.0 |
| Ehlers et al,40 2010, Stati Uniti | Popolazione | DSM-IV | SSAGA | 818 | 13.9 | 38 | 48.4 | 16.5 |
| Levin et al,41 2010, Stati Uniti | Ambulatorio | DSM-IV | MJQQ | 469 | 91 | 58 | 31.2 | 42.4 |
| Preuss et al,42 2010, Germania | Ricoverato | DSM-IV | MWC | 118 | 100 | 85 | 19.6 | 72.0 |
| Vorspan et al,43 2010, Stati Unitia | Ambulatorio | DSM-IV | MJQQ | 43 | 79.1 | 69.8 | 37.0 | 65.1 |
| Vorspan et al,43 2010, Stati Unitia | Ambulatorio | DSM-IV | MJQQ | 56 | 100 | 71.4 | 27.0 | 64.3 |
| Dervaux et al,44 2011, Francia | Ricoverato | DSM-IV | DIGS | 92 | 100 | 75 | 28.7 | 84.8 |
| Gorelick et al,45 2012, Stati Uniti | Ambulatorio | DSM-IV | MJQQ, diario di auto-relazione | 384 | 92.4 | 58.3 | 29.2 | 40.9 |
| Boggs et al,46 2013, Stati Uniti d’America | Ambulatorio | DSM-IV | MJQQ | 120 | 81.7 | 77 | 41.5 | 50.0 |
| Smith et al,47 2013, Stati Uniti d’Americaa | Popolazione | DSM-IV | AUDADIS | 1712 | NA | 68 | 34.3 | 18.8 |
| Smith et al,47 2013, Stati Uniti d’Americaa | Popolazione | DSM-IV | AUDADIS | 1187 | NA | 68 | 34.3 | 9.8 |
| Verweij et al,48 2013, Australia | Popolazione | DSM-IV | SSAGA, CWS, MCQ | 2276 | 23.6 | 39 | 31.9 | 11.9 |
| Bonnet et al,49 2014, Germania | Ricoverato | DSM-IV | MWC | 39 | 100 | 80 | 28.6 | 92.3 |
| Greene et al,50 2014, Stati Uniti d’America | Ambulatorio | DSM-IV | CDDR | 90 | 84.4 | 82 | 16.6 | 40.0 |
| Lee et al,51 2014, Stati Uniti d’America | Ricoverato | DSM-IV | CWS, MCQ, SCL-90R | 30 | 79.3 | 100 | 28.5 | 73.3 |
| Delforterie et al,52 2015, Stati Unitia | Popolazione | DSM-IV | AUDADIS, CIDI | 1568 | 11.7 | 50 | 24.8 | 29.2 |
| Delforterie et al,52 2015, Paesi Bassia | Popolazione | DSM-IV | AUDADIS, CIDI | 359 | 16.4 | 65 | 23.9 | 12.5 |
| Herrmann et al,53 2015, Stati Uniti | Ambulatorio | DSM-5 | MWC, WDS | 136 | 77.9 | 73 | 33.3 | 50.7 |
| Macfarlane e Christie,54 2015, Nuova Zelanda | Ricoverato | DSM-IV | MWC | 47 | 100 | 63 | 31.0 | 87.2 |
| Soenksen et al,55 2015, Stati Uniti | Ambulatorio | DSM-IV | MWC | 93 | 76.9 | 100 | 16.4 | 66.7 |
| Davis et al,56 2016, Stati Uniti | Ambulatorio | DSM-IV | CWS | 110 | 53.4 | 93 | 19.2 | 48.2 |
| Sherman et al,57 2017, Stati Uniti | Ambulatorio | DSM-5 | TFLB, MWC, MCQ | 302 | 100 | 72 | 30.3 | 50.3 |
| Chauchard et al,58 2018, Stati Uniti | Ambulatorio | DSM-IV | MJQQ | 23 | 100 | 82.6 | 27.4 | 30.4 |
| Livne et al,59 2019, Stati Uniti | Popolazione | DSM-5 | DSM-5 | 1527 | 24.6 | 66 | NA | 12.1 |
| Perron et al,60 2019, Stati Uniti | Ambulatorio | DSM-5 | MWC | 801 | 1.8 | 53.6 | 45.1 | 52.3 |
Il modulo di estrazione dei dati è stato sviluppato in Microsoft Excel 2016 (Microsoft Corp) sulla base di revisioni condotte in precedenza12,61,62 e le raccomandazioni delineate nella dichiarazione STROBE (eTabella 2 nel supplemento).63 I dati sono stati estratti in modo indipendente da 1 membro del team di ricerca (A.B.) e controllati da un secondo (C.S.). Oltre ai dati specifici dello studio sono state estratte informazioni bibliografiche.
Sono stati estratti i seguenti dati: informazioni sullo studio (autore, rivista e anno di pubblicazione), caratteristiche dello studio (impostazione dello studio, paese di studio e durata del follow-up), caratteristiche dei partecipanti (età, comorbilità, uso della sostanza e razza/etnicità), informazioni sulle condizioni (fonti di dati, definizione delle condizioni e numero totale di partecipanti), prevalenza della CWS o informazioni necessarie per calcolare una stima.
I dati sulla prevalenza delle informazioni CWS sono stati estratti e, ove possibile, raggruppati per essere coerenti con i precedenti strumenti di valutazione CWS sviluppati da gruppi di esperti di cannabinoidi (eTable 3 nel Supplemento).64,65 Se i dati riportati nelle pubblicazioni erano incompleti, sono state ricercate informazioni e documenti supplementari per individuare i dati mancanti. Se non è stato possibile reperire informazioni supplementari o non sono stati forniti i dati necessari, gli autori dello studio primario sono stati contattati via e-mail per ottenere ulteriori informazioni.
La qualità degli studi è stata valutata utilizzando la scala di Newcastle-Ottawa per gli studi osservazionali.66 Questa scala utilizza un sistema a stella per valutare gli studi non randomizzati relativi a 3 domini di qualità (selezione, comparabilità ed esito) utilizzando 8 criteri: rappresentatività della coorte esposta, selezione della coorte non esposta, accertamento dell’esposizione, dimostrazione che l’esito di interesse non era presente all’inizio dello studio, comparabilità delle coorti sulla base del disegno o dell’analisi, valutazione dell’esito, durata sufficiente del follow-up perché gli esiti si verifichino e adeguatezza del follow-up della coorte. I punteggi delle singole stelle per ogni criterio sono stati calcolati per fornire un punteggio complessivo di qualità, dove maggiore è il punteggio di qualità, maggiore è la qualità metodologica dello studio (punteggio massimo: 8 punti). Gli studi che hanno ottenuto un punteggio totale pari o superiore a 6 punti sono stati considerati di qualità più elevata, quelli che hanno ottenuto un punteggio totale inferiore a 2 punti sono stati considerati di qualità più bassa, mentre quelli tra 2 e 5 punti sono stati valutati come qualità equa. Le informazioni sullo studio necessarie per la valutazione della qualità sono state estratte nel modello Excel da un revisore (A.B.) e controllate due volte da un secondo revisore (C.S.). Le discrepanze sono state risolte consultando un terzo revisore (R.T., E.R.H. o D.P.S.).
Analisi statistica
Le statistiche descrittive sono state calcolate utilizzando proporzioni e mezzi e confrontate con i test t o con i test χ 2, se del caso. Per tutti i test sono stati considerati statisticamente significativi i valori P su 2 lati <,05. Le impostazioni dello studio comprendevano studi non clinici, studi basati sulla popolazione, studi clinici ambulatoriali, o impostazioni cliniche di pazienti ricoverati. Le scale di valutazione dell’informatore erano quelle completate da un membro della famiglia o da un altro informatore che conosceva il partecipante. Se gli studi hanno utilizzato più punti di taglio per calcolare la CWS, è stata selezionata la soglia più bassa per definire la CWS.
Per la meta-analisi è stato utilizzato un modello a effetti casuali a causa della presunta eterogeneità tra gli studi. Il pacchetto metaforico in R, versione 1.1.463 (R Studio) è stato utilizzato per produrre le stime messe in comune, le trame forestali e la meta regressione.67 La meta-analisi delle proporzioni utilizza la distribuzione binomiale per modellare la variabilità all’interno dello studio o consentendo la trasformazione a doppio arco di Freeman-Tukey per stabilizzare le varianze.68 L’eterogeneità è stata quantificata utilizzando la statistica I2, e la sua significatività è stata determinata sulla base del valore P del test Q di Cochran Q che accompagna il test.69 Un valore I2dello 0% indica l’assenza di eterogeneità osservata, e valori crescenti rappresentano una maggiore eterogeneità; valori del 25%, 50% e 75% indicano rispettivamente livelli di eterogeneità bassi, moderati e alti.69
Sono state pianificate analisi di sottogruppo per accedere alle associazioni di origine della popolazione dello studio (basate sulla popolazione o sulla clinica), al metodo di diagnosi della CWS (valutato dall’informatore, autodenunciato o somministrato dal medico), alla posizione geografica, all’intensità dell’uso di cannabis, al sesso, alla comorbilità psichiatrica e all’età con la prevalenza della CWS nei pazienti con uso regolare o dipendente di cannabinoidi. Tuttavia, laddove gli studi non hanno riportato stime a livello di sottogruppo all’interno di studi primari, abbiamo applicato la meta-regolazione degli effetti casuali per valutare l’associazione tra la variabile e la prevalenza della CWS.70
Il bias di pubblicazione è stato valutato qualitativamente, usando la simmetria del diagramma ad imbuto come surrogato per il basso rischio di bias di pubblicazione, così come quantitativamente, usando i metodi Egger e trim-and-fill.71,72,73 Le analisi supplementari sono descritte nella eFigure 1 nel Supplemento.
Risultati
Abbiamo vagliato un totale di 3848 citazioni uniche, di cui 86 sono state vagliate per intero, e 47 sono state incluse nella revisione(Figura 1), riportando 50 coorti uniche. In totale, 23-518 partecipanti sono stati rappresentati in tutte le coorti (età media [SD], 29,9 [9,0] anni; 16 839 bianchi [72%]; e 14 387 uomini [69%]). Venticinque coorti (50%) erano di individui in cerca di trattamento. La maggior parte delle coorti proveniva dal Nord America (38 [76%]), dall’Australia (7 [14%]), o dall’Europa (6 [12%])(Tabella 1). I partecipanti alle fonti incluse sono stati ottenuti da campioni prevalentemente clinici (ricoverati: 7 [14%] e ambulatoriali: 28 [56%]) o da campioni basati sulla popolazione (15 [30%]). Le coorti individuali variavano notevolmente in termini di dimensioni (12-2613). I dati demografici delle coorti erano incompleti; per esempio, meno della metà delle coorti riportava l’assunzione di cannabis di base. Diciotto coorti hanno riportato la percentuale di persone che hanno sperimentato la CWS a vita, e le rimanenti 32 hanno riportato la prevalenza della CWS attuale (anno passato).

Figura 1.Diagramma di flusso PRISMA della selezione dello studioProcesso di ricerca e selezione applicato durante la revisione sistematica.
La sindrome da astinenza da cannabis è stata identificata da una varietà di strumenti amministrati dal medico (inclusa la scala di astinenza da cannabis74), scale di valutazione autodichiarate (compresa la lista di controllo dei sintomi da ritiro della marijuana6), e interviste cliniche semistrutturate (che coinvolgono il Time-Line-Follow-Back75 e l’Intervista Clinica Strutturata per il DSM76). Tra gli studi, gli strumenti specifici utilizzati sono stati il Disturbo da uso di alcol e disabilità associate,32,47,52 il record abituale di consumo di alcol e droghe,50 il Composite International Diagnostic Interview-Substance Abuse Module,17,20,25,30,36,39 la Scala di Prelievo della Cannabis,37,51,54,56 il questionario sulla marijuana,28,41,43,45,46,58 la lista di controllo dei sintomi da ritiro della marijuana,6,7,27,33,34,42,49,53,55,60 la Valutazione semi-strutturata per la Genetica dell’Alcolismo,18,40,48 l’Intervista Clinica Strutturata per il DSM,19,21,22,23,24,26,31,35,59 e il Time-Line-Follow-Back.57
Il disturbo da uso di cannabis (CUD) o il suo equivalente (cioè la dipendenza da cannabis con o senza abuso di cannabis) è stato analizzato come definito dagli autori dello studio utilizzando diversi set di criteri, tra cui il Manuale Diagnostico e Statistico dei Disturbi Mentali, Quinta Edizione77 o Classificazione statistica internazionale delle malattie e dei problemi sanitari correlati, 11a revisione,78 con o senza l’uso di guide per le interviste, come la Mini-International Neuropsychiatric Interview79 o l’Intervista Clinica Strutturata per il DSM.76 La percentuale complessiva dei partecipanti con CUD è stata del 34,7% (n=8275). Negli studi sulla popolazione, le stime andavano dall’8% al 34%. Nei campioni ambulatoriali, le stime andavano dal 30% al 74%. Nei campioni in regime di ricovero, le stime andavano dal 72% al 98%.
La meta-analisi ha identificato che la prevalenza complessiva di CWS nei pazienti con uso regolare o dipendente di cannabinoidi era del 47% (95% CI, 27%-37%). C’era una significativa eterogeneità osservata in questa stima(I299,2%, P<<.001; 50 studi; n=23-518), con proporzioni di 0,16 (95% IC, 0,13-0,20) per la popolazione, 0,54 (95% IC, 0,49-0,59) per il ricoverato, e 0,87 (95% IC, 0,77-0,93) per il ricoverato (Figura 2). La gamma di CWS tra gli studi variava dall’8% al 100%.
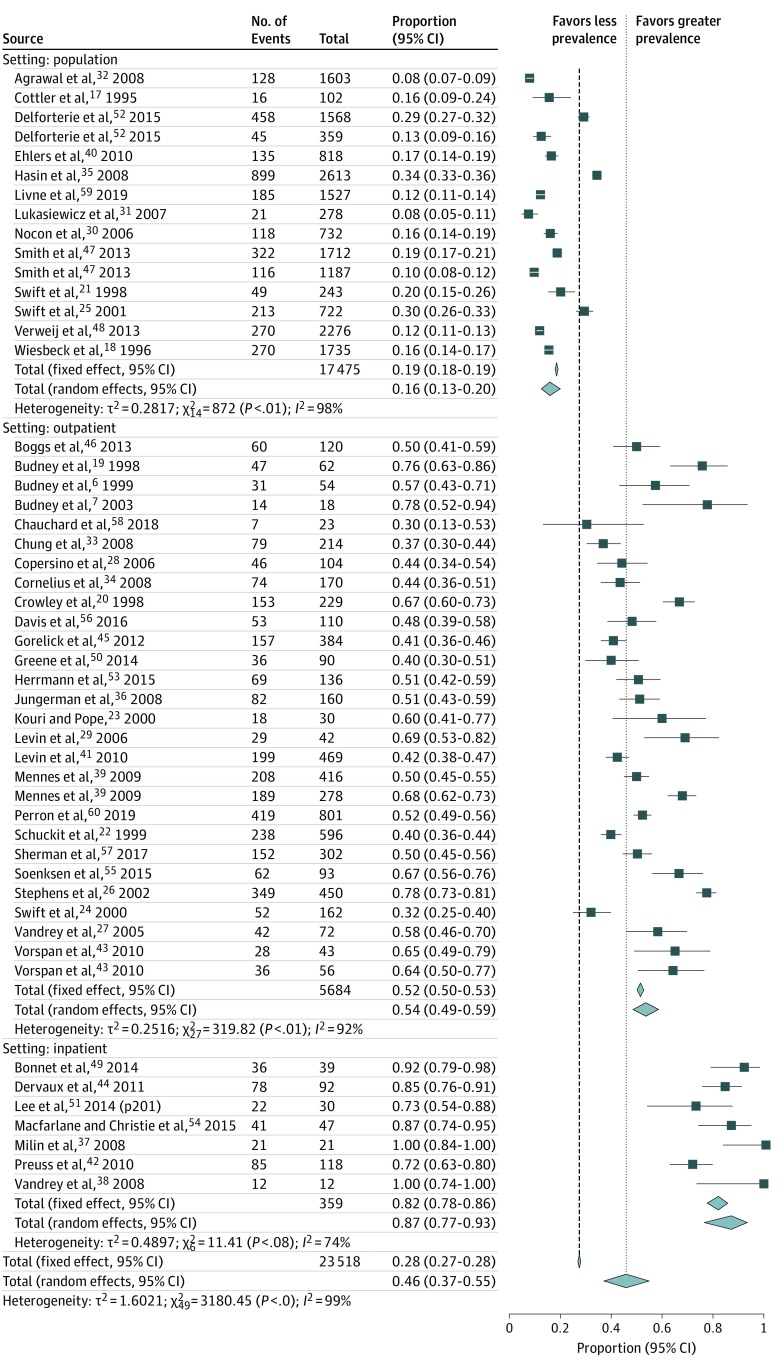
Figura 2.Prevalenza del ritiro di cannabis nelle persone con disturbo da uso di cannabis Prevalenza dei sintomi di astinenza da cannabis in 3 contesti clinici: campioni a livello di popolazione, campioni clinici ambulatoriali e campioni clinici in ricovero. Gli studi di Smith et al (2013), Mennes et al (2009) e Vorspan et al (2010) hanno incluso 2 o più sottostudi.
Se stratificata per impostazione dello studio, la prevalenza di CWS nei campioni basati sulla popolazione era del 17% (95% di IC, 13%-21%; n = 15 studi; n = 17-475 partecipanti), 54% nei campioni ambulatoriali (95% di IC, 48%-59%); n=28 studi; n=5684 partecipanti), e 87% in campioni ospedalizzati (95% IC, 79%-94%; n=7 studi; n=357 partecipanti). La differenza tra questi gruppi era statisticamente significativamente diversa (χ 2=0,172, P<<1001) (Tabella 2). Esisteva un’eterogeneità significativa all’interno delle stime per i campioni basati sulla popolazione(I2= 98%), per i campioni ambulatoriali (I2= 92%) e per i campioni basati sui ricoveri ospedalieri (I2= 74%). L’analisi del sottogruppo basata sul sesso non ha trovato differenze nella prevalenza di CWS tra gli uomini (27%) rispetto alle donne (26%) (χ 2=0,172, P==,99). Allo stesso modo, non c’è stata alcuna associazione tra la prevalenza di CWS e l’età, la razza/etnia, il metodo di accertamento della CWS, il metodo di diagnosi CUD, l’uso di alcool comorboso, il disturbo psichiatrico comorboso, o la regione geografica. Inoltre, le stime della CWS erano significativamente più alte tra gli studi che misuravano la vita piuttosto che l’attuale prevalenza della CWS (χ 2 = 0,314, P = 0,001) , tra gli studi di coorte piuttosto che le indagini trasversali (χ 2 = 0.194, P<<.001), e tra gli studi che coinvolgono partecipanti in cerca di trattamento rispetto a quelli che non lo sono (χ 2= 446,32,P<.001).
| Analisi dei sottogruppi | Prevalenza (95% CI), %. | Studi, no. | z Valore | I2, % | ValoreP | Confronto tra gruppi | |
|---|---|---|---|---|---|---|---|
| χ 2 | ValoreP | ||||||
| Fonte del campionea | |||||||
| Basato sulla popolazione | 17 (13-22) | 15 | 7.866 | 98 | <.001 | 0.172 | <.001 |
| Clinica | |||||||
| Ambulatorio | 54 (48-59) | 28 | 20.267 | 94 | <.001 | ||
| Ricoverato | 87 (79-94) | 7 | 22.346 | 94 | <.001 | ||
| Studio di progettazionea | |||||||
| Sezione trasversale | 19 (15.-24) | 17 | 8.733 | 99 | <.001 | 0.194 | <.001 |
| Coorte | 62 (56-68) | 33 | 19.816 | 96 | <.001 | ||
| Metodo di diagnosi CWS | |||||||
| Valutazione per i medici | 52 (41-62) | 20 | 9.725 | 99. | <.001 | 0.518 | .49 |
| Autoreferenziale | 45 (37-53) | 23 | 11.086 | 99. | <.001 | ||
| Valutazione da parte dell’Informatore | 40 (21-59) | 7 | 4.071 | 99 | <.001 | ||
| Metodo di diagnosi CUD | |||||||
| DSM-IV | 49 (43-56) | 37 | 14.993 | 99 | <.001 | 0.493 | .44 |
| DSM-III-R | 45 (31-58) | 8 | 6.382 | 97 | <.001 | ||
| DSM-5 | 34 (15-54) | 5 | 3.470 | 99 | <.001 | ||
| Cronologia di CWSa | |||||||
| Anno scorso | 31 (27-36) | 32 | 13.590 | 99 | <.001 | 0.314 | <.001 |
| Lifetime | 76 (70-82) | 18 | 26.659 | 86 | <.001 | ||
| Sesso | |||||||
| Maschio | 27 (21-34) | 15 | 9.952 | 93 | <.001 | 0.172 | .99 |
| Femmina | 26 (19-33) | 15 | 9.200 | 96 | <.001 | ||
| Regione geografica | |||||||
| Nord America | 48 (42-55) | 38 | 14.637 | 99 | <.001 | 0.484 | .77 |
| Europa | 47 (25-70) | 6 | 4.121 | 99 | <.001 | ||
| Sud America | 51 (44-59) | 1 | NA | NA | NA | ||
| Australasia | 36 (20-52) | 5 | 5.385 | 99 | <.001 | ||
Abbiamo usato la meta-regressione per esplorare le variabili potenziali che possono aver rappresentato l’elevata eterogeneità osservata per la prevalenza di CWS(Tabella 3; eFigure 1 nel Supplemento). Diverse caratteristiche metodologiche degli studi e delle caratteristiche dei partecipanti sono state associate in modo significativo alla prevalenza di CWS nella meta-regressione. La prevalenza della CWS era più alta con una maggiore proporzione di partecipanti che riportavano un uso giornaliero di cannabis (β=0.004, P<<.001), avevano un disturbo da uso di cannabis (β=0.005, P=0,002, P=0,02), aveva un uso di tabacco comorboso (β=0,002, P=0,02), e aveva un uso di droghe comorbose (β=0,003, P=0,05).
| Meta-regressione | β | Intercettare | Studi, no. | ValoreP |
|---|---|---|---|---|
| Disturbo, %. | ||||
| Consumo di alcolici | −0.000 | 0.463 | 17 | .97 |
| Psichiatrico | 0.000 | 0.469 | 16 | .93 |
| Uso di droghe | 0.003 | 0.443 | 11 | .05 |
| Uso del tabacco | 0.002 | 0.396 | 26 | .02 |
| Uso di cannabis | 0.005 | 0.128 | 48 | <.001 |
| Età media, y | −0.007 | 0.679 | 48 | .10 |
| Consumo giornaliero di cannabis, %. | 0.004 | 0.151 | 48 | <.001 |
| Razza bianca, %. | 0.001 | 0.433 | 42 | .46 |
Abbiamo esplorato l’associazione di ogni studio con le stime messe in comune attraverso l’analisi di sensibilità e la meta-analisi, permettendo l’eliminazione di ogni studio dalla valutazione. Questa analisi non ha cambiato sostanzialmente la prevalenza di CWS.
Il potenziale di distorsione della pubblicazione è stato valutato attraverso grafici ad imbuto e applicando test di correlazione di rango, test Egger e il metodo trim and fill (eFigure 2 nel supplemento). I risultati non hanno suggerito alcuna prova a sostegno dell’esistenza di un significativo bias all’interno di questa revisione.
Dei 50 studi, la maggior parte (36 [72%]) ha avuto una valutazione complessiva di qualità equa, mentre 2 studi (4%) sono stati valutati come buoni e 12 studi (24%) sono stati valutati come poveri (eTabella 3 nel Supplemento). I criteri di qualità più frequentemente soddisfatti sono stati l’accertamento dell’esposizione, riportato da 36 studi (72%), e la comparabilità delle coorti sulla base del progetto o dell’analisi, riportata da 26 studi (52%). Un certo numero di elementi sono stati completati in modo incoerente, tra cui la dimostrazione che il risultato di interesse non era presente all’inizio dello studio, che è stato riportato da 3 studi (6%), e l’adeguatezza del follow-up delle coorti, con tassi di logoramento e follow-up completo riportato da 7 studi (14%).

Figura 1.Diagramma di flusso PRISMA della selezione dello studioProcesso di ricerca e selezione applicato durante la revisione sistematica.

Figura 2.Prevalenza del ritiro di cannabis nelle persone con disturbo da uso di cannabis Prevalenza dei sintomi di astinenza da cannabis in 3 contesti clinici: campioni a livello di popolazione, campioni clinici ambulatoriali e campioni clinici in ricovero. Gli studi di Smith et al (2013), Mennes et al (2009) e Vorspan et al (2010) hanno incluso 2 o più sottostudi.
Discussione
La nostra revisione sistematica e meta-analisi ha identificato 50 studi che hanno esaminato la prevalenza di CWS. Nel complesso, è stato stimato che quasi la metà (47%) di tutte le persone con uso regolare o dipendente di cannabinoidi sperimenterà l’astinenza da cannabis. Tra gli altri fattori associati alla CWS vi sono l’impostazione dello studio, i disturbi concomitanti da tabacco, cannabis e uso di droghe e l’intensità dell’uso di cannabis. Non abbiamo trovato che la CWS sia associata a sesso, età, razza/etnicità o comorbilità psichiatrica. La qualità della letteratura è stata giudicata equa per la maggior parte degli studi considerati.
Molti professionisti e membri del pubblico in generale potrebbero non essere a conoscenza dell’astinenza da cannabis, portando potenzialmente a confusione sui benefici della cannabis per il trattamento o l’automedicazione dei sintomi dell’ansia o dei disturbi depressivi.80 Per esempio, quando ai clienti di marijuana medica è stato chiesto di fornire un reale sollievo dai sintomi, meno della metà di loro ha riferito di tale sollievo,81 mentre altri82 ha riferito il ritorno di sintomi di ansia alla cessazione dell’uso, suggerendo che i sintomi potrebbero essere dovuti all’astinenza da cannabis.83 Poiché molti criteri della CWS sono i sintomi della depressione o dell’ansia, i consumatori regolari possono cercare la cannabis per ottenere un sollievo dai sintomi a breve termine, ignari del fatto che questo uso potrebbe perpetuare un problema di astinenza a lungo termine.77
I clinici dovrebbero essere consapevoli della CWS in quanto è associata a sintomi clinicamente significativi, che possono scatenare la ripresa dell’uso di cannabis e servire da rinforzo negativo per una ricaduta durante un tentativo di astinenza.28,41 L’importanza clinica della CWS è dimostrata dal fatto che può essere compromettente,84 che la cannabis o altre sostanze vengono usate per alleviarne l’effetto, per la sua associazione con la difficoltà di smettere di usarla,28,41,85 e dalla sua associazione prognostica negativa.33,34,50,84 L’importanza clinica della CWS è supportata anche dall’evidenza epidemiologica, poiché gli studi che coinvolgono la modellazione variabile latente hanno dimostrato che l’aggiunta del ritiro ad altri criteri CUD migliora l’adattamento del modello.86 Tratti di personalità, comorbilità psichiatrica, età all’esordio, livello di consumo di cannabis, gravità della dipendenza da cannabis e consumo contemporaneo di droghe e alcol sono stati proposti come altri fattori di rischio che possono giocare un ruolo nell’aumentare il rischio di ricaduta della cannabis dopo un tentativo di abbandono.74
Quando è stato pubblicato il Manuale Diagnostico dei Disturbi Mentali, quarta edizione, poco si sapeva della CWS, ma nei vent’anni successivi, notevoli sforzi di ricerca hanno fatto progredire la nostra comprensione della CWS.87,88,89 I modelli animali sono stati utili per chiarire i potenziali meccanismi e le cause della CWS, con i roditori che mostrano sia tolleranza che dipendenza dopo la somministrazione cronica di cannabinoidi.90 La tolleranza alla cannabis è nota per essere mediata dal downregulation del recettore dei cannabinoidi di tipo 1,91 che si verifica più rapidamente nelle regioni corticali che nelle regioni subcorticali92,93 ed è reversibile in astinenza.91 Gli inibitori degli enzimi metabolizzanti degli endocannabinoidi riducono le risposte della CWS tra i topi dipendenti dalla cannabis.94 La sindrome da astinenza da cannabis e la CUD sono moderatamente ereditabili,48 che implicano sia fattori genetici che ambientali nella loro comparsa.
Nel nostro studio, la CWS è stata riscontrata più frequentemente tra i pazienti affetti da tabacco comorboso e uso di droghe. Sebbene il nostro studio non abbia identificato un’associazione tra la comorbilità psichiatrica o l’uso di alcol e la prevalenza della CWS, la prevalenza della comorbilità CUD è nota per essere sostanzialmente più alta tra gli individui con un’ansia primaria,44,95,96 umore,34,97 mangiare,61 o disturbo psicotico46,98,99 rispetto alla popolazione in generale. Questi risultati sono coerenti con la letteratura sulla comorbilità, che fornisce un ulteriore supporto all’idea che la natura delle associazioni tra l’uso di sostanze e i disturbi psichiatrici è solitamente avversa.100 Inoltre, questa associazione può essere esacerbata da potenziali effetti di infiammazione indotti dalla cannabis con l’insorgenza di altre condizioni psichiatriche.101 La comprensione di questi rischi può aiutare i medici a fornire cure basate sull’evidenza e una consulenza appropriata ai loro pazienti, in particolare per quanto riguarda la gestione dei cannabinoidi.101
La constatazione che la prevalenza della CWS era sostanzialmente più alta nelle popolazioni cliniche – in particolare nei campioni dei pazienti ricoverati – è coerente con la nozione di un’associazione bidirezionale tra l’uso di cannabis e i disturbi della salute mentale.102,103,104,105 Questo risultato è compatibile con le precedenti recensioni, che hanno costantemente riportato che un terzo dei consumatori regolari di cannabis nella popolazione generale5,32,35 e dal 50 al 95% dei consumatori pesanti in studi di trattamento o di ricerca28,33,34,41 segnalare i sintomi della CWS. Questo risultato può indicare che le persone con CWS sono più propense a presentare ai medici per chiedere aiuto rispetto a quelle senza CWS, nonostante il fatto che la CWS possa essere diagnosticata e non trattata.10 Se ci sia un’interazione o un’associazione cumulativa tra la prevalenza della CWS e i tassi di presentazione per le cure cliniche è speculativo a questo punto e richiede ulteriori studi. Con questo in mente, se la CWS riflette fattori patologici CUD sottostanti, può essere un’indicazione del carico di dipendenza sottostante e aumentare la probabilità che le persone siano in cura clinica invece di avere CUD nella comunità senza supporto clinico.10 L’associazione tra CWS e CUD può anche essere correlata alle teorie centrali dell’iniziazione della sostanza, per cui i cannabinoidi possono essere usati per automedicare i sintomi psichiatrici.106 o può precipitare o aggravare le condizioni di salute mentale esistenti.107
Diversi studi hanno cercato di determinare i migliori strumenti per la diagnosi della CWS,74,108 ma c’è stata generalmente una scarsa correlazione tra le scale di valutazione. Nonostante l’eterogeneità all’interno del campione, le stime della prevalenza di CWS erano simili indipendentemente dal metodo di accertamento nel nostro studio. La stratificazione dei metodi di accertamento CWS non ha conciliato l’eterogeneità delle stime di prevalenza; tuttavia, ciò non significa che tutti gli strumenti CWS siano uguali. Finché non ci saranno linee guida metodologiche e consenso sui migliori strumenti di screening per la CWS, a nostra conoscenza, questi sono i dati più completi disponibili. Il trattamento della CUD è particolarmente impegnativo perché non sono attualmente disponibili farmaci efficaci, anche con terapie sostitutive dei cannabinoidi, come il nabilone, i nabiximoli o il dronabinol.12,109
Punti di forza e limitazioni
Ci sono diversi punti di forza di questo studio. In primo luogo, a nostra conoscenza, questa è la più grande revisione sistematica dell’astinenza da cannabis tra le persone con CUD, e la prima meta-analisi. In secondo luogo, la qualità della maggior parte degli studi valutati è stata equa. Tuttavia, questo studio ha dei limiti che dovrebbero essere considerati nella valutazione delle prove presentate da questa revisione. Il limite maggiore è la vasta gamma di strumenti utilizzati per definire CUD e CWS, che ha contribuito alla grande eterogeneità degli studi. Mentre l’ampio spettro di studi inclusi ha probabilmente contribuito all’eterogeneità, l’inclusione di sole scale di valutazione convalidate può aver mitigato in qualche modo l’eterogeneità. Sebbene le proporzioni del sesso siano state riportate in campioni globali, le stime della prevalenza specifica per sesso sono state riportate solo da un sottoinsieme di studi (n = 15). Trattandosi di una meta-analisi a livello di studio, un limite dei metodi è che non sono state esplorate le caratteristiche a livello individuale. C’era anche una rappresentazione limitata di studi provenienti da tutte le regioni geografiche, con solo 1 studio dal Sud America e nessuno dall’Africa; questa limitazione ha ostacolato la nostra capacità di stimare la prevalenza di CWS in tutti i continenti. Tuttavia, la nostra analisi dei sottogruppi ha indicato che non c’era una differenza significativa nella prevalenza di CWS tra le regioni valutate, il che suggerisce che le regioni geografiche potrebbero non avere un ruolo sostanziale nella stima della prevalenza di CWS. C’erano anche informazioni limitate sulla CWS in specifici sottogruppi di pazienti. Ci sono altre questioni che potrebbero influenzare la CWS, che non potrebbero essere affrontate in questa meta-analisi, tra cui i prodotti in evoluzione che vengono utilizzati, che possono influenzare la tolleranza, la dipendenza e la CWS. Tuttavia, queste informazioni non sono ancora disponibili nella maggior parte degli studi clinici. Mancavano anche le analisi a livello individuale, che possono essere considerate come un’altra limitazione di questo studio. Inoltre, pochi studi hanno riportato le quantità di uso concomitante di sostanze o i livelli di cannabinoidi nei fluidi corporei (ad esempio, urine e sangue), precludendo un’analisi più focalizzata sull’associazione tra queste misure e la prevalenza della CWS.
Conclusioni
La sindrome da astinenza da cannabis sembra essere comune tra le persone con uso regolare o dipendente di cannabinoidi, con una prevalenza complessiva del 47% in questa meta-analisi. La sindrome da astinenza da cannabis era più comune negli uomini, nei partecipanti a campioni clinici, negli individui con uso di droghe comorbide o di tabacco, e in quelli con un livello più alto di uso di cannabis. I clinici dovrebbero essere consapevoli dell’alta prevalenza della CWS e dovrebbero prendere in considerazione lo screening per la CWS, in particolare tra coloro che sono a maggior rischio, al fine di consigliare i pazienti e sostenere gli individui che stanno riducendo il loro uso di cannabis.
References
- The global burden of disease attributable to alcohol and drug use in 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Psychiatry. 2018; 5(12)DOI | PubMed
- Effects of chronic, heavy cannabis use on executive functions. J Addict Med. 2011; 5(1):9-15. DOI | PubMed
- Adverse health effects of marijuana use. N Engl J Med. 2014; 370(23):2219-2227. DOI | PubMed
- Cannabis use and suicide attempts among 86,254 adolescents aged 12-15 years from 21 low- and middle-income countries. Eur Psychiatry. 2019; 56:8-13. DOI | PubMed
- The cannabis withdrawal syndrome. Curr Opin Psychiatry. 2006; 19(3):233-238. DOI | PubMed
- Marijuana withdrawal among adults seeking treatment for marijuana dependence. Addiction. 1999; 94(9):1311-1322. DOI | PubMed
- The time course and significance of cannabis withdrawal. J Abnorm Psychol. 2003; 112(3):393-402. DOI | PubMed
- Review of the validity and significance of cannabis withdrawal syndrome. Am J Psychiatry. 2004; 161(11):1967-1977. DOI | PubMed
- Diagnostic and Statistical Manual of Mental Disorders. American Psychiatric Association Publishing; 2013.
- US epidemiology of cannabis use and associated problems. Neuropsychopharmacology. 2018; 43(1):195-212. DOI | PubMed
- Cannabis epidemiology: a selective review. Curr Pharm Des. 2017; 22(42):6340-6352. DOI | PubMed
- Treatment of cannabis dependence with synthetic cannabinoids: a systematic review. Can J Addict. 2016; 7(4):8-13.
- 2019. Publisher Full Text
- The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009; 6(7)DOI | PubMed
- 2018. Publisher Full Text
- Publisher Full Text
- The DSM-IV field trial for substance use disorders: major results. Drug Alcohol Depend. 1995; 38(1):59-69. DOI | PubMed
- An evaluation of the history of a marijuana withdrawal syndrome in a large population. Addiction. 1996; 91(10):1469-1478. DOI | PubMed
- Adults seeking treatment for marijuana dependence: a comparison with cocaine-dependent treatment seekers. Exp Clin Psychopharmacol. 1998; 6(4):419-426. DOI | PubMed
- Cannabis dependence, withdrawal, and reinforcing effects among adolescents with conduct symptoms and substance use disorders. Drug Alcohol Depend. 1998; 50(1):27-37. DOI | PubMed
- Patterns and correlates of cannabis dependence among long-term users in an Australian rural area. Addiction. 1998; 93(8):1149-1160. DOI | PubMed
- Clinical implications for four drugs of the DSM-IV distinction between substance dependence with and without a physiological component. Am J Psychiatry. 1999; 156(1):41-49. DOI | PubMed
- Abstinence symptoms during withdrawal from chronic marijuana use. Exp Clin Psychopharmacol. 2000; 8(4):483-492. DOI | PubMed
- One year follow-up of cannabis dependence among long-term users in Sydney, Australia. Drug Alcohol Depend. 2000; 59(3):309-318. DOI | PubMed
- Characteristics of DSM-IV and ICD-10 cannabis dependence among Australian adults: results from the National Survey of Mental Health and Wellbeing. Drug Alcohol Depend. 2001; 63(2):147-153. DOI | PubMed
- The Marijuana Treatment Project: rationale, design and participant characteristics. Addiction. 2002; 97(s1):109-124. DOI | PubMed
- Cannabis withdrawal in adolescent treatment seekers. Drug Alcohol Depend. 2005; 78(2):205-210. DOI | PubMed
- Cannabis withdrawal among non–treatment-seeking adult cannabis users. Am J Addict. 2006; 15(1):8-14. DOI | PubMed
- Severity of dependence and motivation for treatment: comparison of marijuana- and cocaine-dependent treatment seekers. J Addict Dis. 2006; 25(1):33-41. DOI | PubMed
- Dependence symptoms in young cannabis users? a prospective epidemiological study. J Psychiatr Res. 2006; 40(5):394-403. DOI | PubMed
- Prevalence and factors associated with alcohol and drug-related disorders in prison: a French national study. Subst Abuse Treat Prev Policy. 2007; 2:1. DOI | PubMed
- Is there evidence for symptoms of cannabis withdrawal in the national epidemiologic survey of alcohol and related conditions?. Am J Addict. 2008; 17(3):199-208. DOI | PubMed
- Cannabis withdrawal predicts severity of cannabis involvement at 1-year follow-up among treated adolescents. Addiction. 2008; 103(5):787-799. DOI | PubMed
- Cannabis withdrawal is common among treatment-seeking adolescents with cannabis dependence and major depression, and is associated with rapid relapse to dependence. Addict Behav. 2008; 33(11):1500-1505. DOI | PubMed
- Cannabis withdrawal in the United States: results from NESARC. J Clin Psychiatry. 2008; 69(9):1354-1363. DOI | PubMed
- Characteristics of cannabis users seeking treatment in São Paulo, Brazil. Rev Panam Salud Publica. 2008; 23(6):384-393. DOI | PubMed
- Prospective assessment of cannabis withdrawal in adolescents with cannabis dependence: a pilot study. J Am Acad Child Adolesc Psychiatry. 2008; 47(2):174-179. DOI | PubMed
- A within-subject comparison of withdrawal symptoms during abstinence from cannabis, tobacco, and both substances. Drug Alcohol Depend. 2008; 92(1-3):48-54. DOI | PubMed
- The reliability of self-reported cannabis abuse, dependence and withdrawal symptoms: multisite study of differences between general population and treatment groups. Addict Behav. 2009; 34(2):223-226. DOI | PubMed
- Cannabis dependence in the San Francisco Family Study: age of onset of use, DSM-IV symptoms, withdrawal, and heritability. Addict Behav. 2010; 35(2):102-110. DOI | PubMed
- Cannabis withdrawal symptoms in non–treatment-seeking adult cannabis smokers. Drug Alcohol Depend. 2010; 111(1-2):120-127. DOI | PubMed
- Cannabis withdrawal severity and short-term course among cannabis-dependent adolescent and young adult inpatients. Drug Alcohol Depend. 2010; 106(2-3):133-141. DOI | PubMed
- Self-reported sleep disturbances during cannabis withdrawal in cannabis-dependent outpatients with and without opioid dependence. Sleep Med. 2010; 11(5):499-500. DOI | PubMed
- Anxiety and depressive symptoms or disorders in patients with cannabis dependence without major psychiatric disorders. Eur Neuropsychopharmacol. 2011; 21(suppl 3):S578-S579. DOI
- Diagnostic criteria for cannabis withdrawal syndrome. Drug Alcohol Depend. 2012; 123(1-3):141-147. DOI | PubMed
- Cannabis withdrawal in chronic cannabis users with schizophrenia. J Psychiatr Res. 2013; 47(2):240-245. DOI | PubMed
- Marijuana withdrawal and aggression among a representative sample of US marijuana users. Drug Alcohol Depend. 2013; 132(1-2):63-68. DOI | PubMed
- A genetic perspective on the proposed inclusion of cannabis withdrawal in DSM-5. Psychol Med. 2013; 43(8):1713-1722. DOI | PubMed
- Abstinence phenomena of chronic cannabis-addicts prospectively monitored during controlled inpatient detoxification: cannabis withdrawal syndrome and its correlation with delta-9-tetrahydrocannabinol and -metabolites in serum. Drug Alcohol Depend. 2014; 143:189-197. DOI | PubMed
- The prevalence of cannabis withdrawal and its influence on adolescents’ treatment response and outcomes: a 12-month prospective investigation. J Addict Med. 2014; 8(5):359-367. DOI | PubMed
- Cannabis withdrawal in chronic, frequent cannabis smokers during sustained abstinence within a closed residential environment. Am J Addict. 2014; 23(3):234-242. DOI | PubMed
- Functioning of cannabis abuse and dependence criteria across two different countries: the United States and the Netherlands. Subst Use Misuse. 2015; 50(2):242-250. DOI | PubMed
- Sex differences in cannabis withdrawal symptoms among treatment-seeking cannabis users. Exp Clin Psychopharmacol. 2015; 23(6):415-421. DOI | PubMed
- Synthetic cannabinoid withdrawal: a new demand on detoxification services. Drug Alcohol Rev. 2015; 34(2):147-153. DOI | PubMed
- Cannabis withdrawal among detained adolescents: exploring the impact of nicotine and race. J Child Adolesc Subst Abuse. 2015; 24(2):119-124. DOI | PubMed
- Cannabis withdrawal, posttreatment abstinence, and days to first cannabis use among emerging adults in substance use treatment: a prospective study. J Drug Issues. 2016; 46(1):64-83. DOI | PubMed
- Gender differences among treatment-seeking adults with cannabis use disorder: clinical profiles of women and men enrolled in the Achieving Cannabis Cessation–Evaluating N-Acetylcysteine Treatment (ACCENT) study. Am J Addict. 2017; 26(2):136-144. DOI | PubMed
- Cannabis withdrawal in adults with attention-deficit/hyperactivity disorder. Prim Care Companion CNS Disord. 2018; 20(1)DOI | PubMed
- DSM-5 cannabis withdrawal syndrome: demographic and clinical correlates in US adults. Drug Alcohol Depend. 2019; 195:170-177. DOI | PubMed
- Mental health functioning and severity of cannabis withdrawal among medical cannabis users with chronic pain. Drug Alcohol Depend. 2019; 194:401-409. DOI | PubMed
- Prevalence of substance use disorder comorbidity among individuals with eating disorders: a systematic review and meta-analysis. Psychiatry Res. 2019; 273:58-66. DOI | PubMed
- ECT beyond unipolar major depression: systematic review and meta-analysis of electroconvulsive therapy in bipolar depression. Acta Psychiatr Scand. 2019; 139(3):214-226. DOI | PubMed
- Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. BMJ. 2007; 335(7624):806-808. DOI | PubMed
- The global epidemiology and contribution of cannabis use and dependence to the global burden of disease: results from the GBD 2010 study. PLoS One. 2013; 8(10)DOI | PubMed
- The persistence of the association between adolescent cannabis use and common mental disorders into young adulthood. Addiction. 2013; 108(1):124-133. DOI | PubMed
- Publisher Full Text
- Conducting meta-analyses in R with the metafor package. J Stat Softw. 2010; 36:1-48. DOI | PubMed
- The inverse of the Freeman–Tukey double arcsine transformation. Am Stat. 1978; 32(4):138. DOI
- Quantifying heterogeneity in a meta-analysis. Stat Med. 2002; 21(11):1539-1558. DOI | PubMed
- Measuring the statistical validity of summary meta-analysis and meta-regression results for use in clinical practice. Stat Med. 2017; 36(21):3283-3301. DOI | PubMed
- Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997; 315(7109):629-634. DOI | PubMed
- Trim and fill: a simple funnel-plot-based method of testing and adjusting for publication bias in meta-analysis. Biometrics. 2000; 56(2):455-463. DOI | PubMed
- Operating characteristics of a rank correlation test for publication bias. Biometrics. 1994; 50(4):1088-1101. DOI | PubMed
- The Cannabis Withdrawal Scale development: patterns and predictors of cannabis withdrawal and distress. Drug Alcohol Depend. 2011; 119(1-2):123-129. DOI | PubMed
- Measuring Alcohol Consumption: Psychosocial and Biochemical Methods. Humana Press; 1992. DOI
- The Encyclopedia of Clinical Psychology. American Cancer Society; 2015. DOI
- DSM-V: Diagnostic and Statistical Manual of Mental Disorders. American Psychiatric Association; 2013. DOI
- Publisher Full Text
- The Mini-International Neuropsychiatric Interview (M.I.N.I.): the development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. J Clin Psychiatry. 1998; 59(suppl 20):22-33. PubMed
- Cannabis withdrawal—a new diagnostic category in DSM-5. Isr J Psychiatry Relat Sci. 2014; 51(4):270-275. PubMed
- Self-reported cannabis use characteristics, patterns and helpfulness among medical cannabis users. Am J Drug Alcohol Abuse. 2014; 40(1):23-30. DOI | PubMed
- Survey of Australians using cannabis for medical purposes. Harm Reduct J. 2005; 2(1):18. DOI | PubMed
- Medical cannabis and mental health: a guided systematic review. Clin Psychol Rev. 2017; 51:15-29. DOI | PubMed
- Quantifying the clinical significance of cannabis withdrawal. PLoS One. 2012; 7(9)DOI | PubMed
- Comparison of cannabis and tobacco withdrawal: severity and contribution to relapse. J Subst Abuse Treat. 2008; 35(4):362-368. DOI | PubMed
- A latent class analysis of illicit drug abuse/dependence: results from the National Epidemiological Survey on Alcohol and Related Conditions. Addiction. 2007; 102(1):94-104. DOI | PubMed
- Marijuana dependence and its treatment. Addict Sci Clin Pract. 2007; 4(1):4-16. DOI | PubMed
- Marijuana withdrawal in humans: effects of oral THC or divalproex. Neuropsychopharmacology. 2004; 29(1):158-170. DOI | PubMed
- Marijuana withdrawal syndrome in the animal model. J Clin Pharmacol. 2002; 42(S1):20S-27S. DOI | PubMed
- Cannabinoid tolerance and dependence: a review of studies in laboratory animals. Pharmacol Biochem Behav. 2005; 81(2):300-318. DOI | PubMed
- Reversible and regionally selective downregulation of brain cannabinoid CB1 receptors in chronic daily cannabis smokers. Mol Psychiatry. 2012; 17(6):642-649. DOI | PubMed
- Regulation of cannabinoid CB1 receptors in the central nervous system by chronic cannabinoids. Crit Rev Neurobiol. 2003; 15(2):91-119. DOI | PubMed
- Prolonged recovery rate of CB1 receptor adaptation after cessation of long-term cannabinoid administration. Mol Pharmacol. 2006; 70(3):986-996. DOI | PubMed
- Inhibitors of endocannabinoid-metabolizing enzymes reduce precipitated withdrawal responses in THC-dependent mice. AAPS J. 2009; 11(2):342-352. DOI | PubMed
- The role of anxiety sensitivity in the relation between anxious arousal and cannabis and alcohol use problems among low-income inner city racial/ethnic minorities. J Anxiety Disord. 2017; 48:87-94. DOI | PubMed
- Cannabis and anxiety: a critical review of the evidence. Hum Psychopharmacol. 2009; 24(7):515-523. DOI | PubMed
- Abuse or dependence on cannabis and other psychiatric disorders: Madrid study on dual pathology prevalence. Actas Esp Psiquiatr. 2013; 41(2):122-129. PubMed
- Relief of cannabis withdrawal symptoms and cannabis quitting strategies in people with schizophrenia. Psychiatry Res. 2013; 209(3):273-278. DOI | PubMed
- Psychoactive substance use by adults with schizophrenia before and during cannabis withdrawal. Prim Care Companion CNS Disord. 2016; 18(5)DOI | PubMed
- Cannabis and development of dual diagnoses: a literature review. Am J Drug Alcohol Abuse. 2017; 43(4):442-455. DOI | PubMed
- Why not pot? a review of the brain-based risks of cannabis. Innov Clin Neurosci. 2016; 13(3-4):13-22. PubMed
- Bipolar disorder and co-occurring cannabis use disorders: characteristics, co-morbidities and clinical correlates. Psychiatry Res. 2013; 209(3):459-465. DOI | PubMed
- Cannabis and psychosis: triangulating the evidence. Lancet Psychiatry. 2019; 6(5):364-365. DOI | PubMed
- The bidirectional relationships between alcohol, cannabis, co-occurring alcohol and cannabis use disorders with major depressive disorder: results from a national sample. J Affect Disord. 2013; 148(2-3):188-195. DOI | PubMed
- Bidirectional associations between cannabis use and depressive symptoms from adolescence through early adulthood among at-risk young men. J Stud Alcohol Drugs. 2016; 77(2):287-297. DOI | PubMed
- The self-medication hypothesis of substance use disorders: a reconsideration and recent applications. Harv Rev Psychiatry. 1997; 4(5):231-244. DOI | PubMed
- Does cannabis cause, exacerbate or ameliorate psychiatric disorders? an oversimplified debate discussed. Neuropsychopharmacology. 2016; 41(2):393-401. DOI | PubMed
- Psychometric evaluation of a lifetime version of the marijuana problems scale. Addict Behav Rep. 2018; 8:21-24. DOI | PubMed
- Pharmacotherapies for cannabis dependence. Cochrane Database Syst Rev. 2014; 12DOI | PubMed
- The fifth edition of the Addiction Severity Index. J Subst Abuse Treat. 1992; 9(3):199-213. DOI | PubMed
Fonte
Bahji A, Stephenson C, Tyo R, Hawken ER, Seitz DP, et al. (2020) Prevalence of Cannabis Withdrawal Symptoms Among People With Regular or Dependent Use of Cannabinoids. JAMA Network Open 3(4): e202370. https://doi.org/10.1001/jamanetworkopen.2020.2370





