Abstract
Background
Il glioblastoma è il tumore cerebrale maligno primario più aggressivo negli adulti[1]. Lo standard di cura (SOC) consiste nella resezione chirurgica seguita da 6 settimane di radioterapia giornaliera con temozolomide concomitante, poi temozolomide mensile [2]. La sopravvivenza globale mediana (mOS) sotto questo SOC è di soli 15-17 mesi [2, 3],ed è≤5% dei pazienti sono vivi a 5 anni [3]. La terapia loco-regionale con campi elettrici alternati ha recentemente mostrato un aumento della PFS mediana (mPFS) a 6,7 mesi e mOS a 20,9 mesi dalla randomizzazione, rispettivamente [4]. Tuttavia, non c’è stato alcun progresso materiale nella sopravvivenza con le terapie sistemiche dall’aggiunta della temozolomide 12 anni fa, nonostante le indagini con molti agenti diversi [2, 5- 10].
L’immunoterapia è una strategia interessante per la potenziale capacità delle cellule immunitarie di trasportare e distruggere le cellule tumorali infiltrate. Le cellule dendritiche (DC) sono centrali nel sistema immunitario come regolatori chiave della tolleranza immunitaria e dell’immunità[11]. Per più di un decennio, il nostro gruppo e altri hanno testato strategie di vaccinazione attiva, come le DC pulsate con lisati tumorali o peptidi sintetici per indurre l’immunità antitumorale nei pazienti affetti da glioblastoma[12, 13]. Abbiamo precedentemente dimostrato l’efficacia della vaccinazione con DC in modelli preclinici[14-16], e gli studi clinici in fase iniziale hanno mostrato una promessa sostanziale [17-19].
In questo rapporto, descriviamo i dati provvisori in cieco della popolazione complessiva di pazienti ITT arruolati in uno studio clinico randomizzato di Fase 3, in doppio cieco, controllato con placebo, di un vaccino autologo a cellule dendritiche lisato-pulsate (DCVax®-L) per il glioblastoma appena diagnosticato. Ad oggi, non abbiamo ancora raggiunto un numero sufficiente di eventi (cioè di decessi) in questo studio per giustificare lo smascheramento. Tuttavia, poiché la stragrande maggioranza (86,4%) della popolazione ITT ha ricevuto il trattamento sperimentale DC ad un certo punto durante lo studio a causa del disegno dello studio incrociato, l’analisi dei dati provvisori può fornire una visione anticipata dell’impatto del DCVax-L sulla sopravvivenza globale. Un’analisi finale dei dati ottenuti in questo studio a seguito di unblinding si verificherà una volta che si saranno verificati sufficienti eventi di progressione della malattia o di morte per chiarire completamente i dati di sopravvivenza del paziente nella coda della curva di sopravvivenza.
Metodi
Studiare i pazienti
I pazienti potevano partecipare a questo studio se avevano un’età compresa tra i 18 e i 70 anni e avevano una nuova diagnosi di glioblastoma, come stabilito dalla revisione patologica centrale. Altri criteri di idoneità includevano il Karnofsky Performance Score (KPS) di ≥ 70 [20], un’adeguata funzionalità del midollo osseo, del fegato e dei reni, un’aspettativa di vita di ≥ 8 settimane, nessun’altra malignità precedente negli ultimi 5 anni, nessuna infezione virale attiva e materiale tumorale resecato sufficiente per produrre il vaccino autologo. I pazienti sono stati esclusi se hanno già avuto un’apparente progressione/recidiva precoce della malattia o una pseudo progressione alla visita di base, in modo simile ai criteri di inclusione/esclusione di altri recenti studi sul glioblastoma[4, 21].
Progettazione dello studio e trattamenti
Abbiamo condotto questo studio in oltre 80 siti in 4 paesi: Stati Uniti, Canada, Germania e Regno Unito. Il reclutamento dei pazienti è stato avviato nel 2007 ed è stato sospeso dal 2009 al 2011 per motivi economici. Il punto medio di arruolamento è stato raggiunto nel maggio del 2014, e il paziente finale è stato arruolato nel novembre del 2015. Il protocollo è stato approvato dai comitati etici indipendenti e dai comitati di revisione istituzionale richiesti. È stato ottenuto il consenso scritto da tutti i pazienti che hanno partecipato allo studio.
Tutti i pazienti sono stati sottoposti a resezione chirurgica e a 6 settimane di chemioradioterapia per SOC, prima dell’arruolamento e della randomizzazione nello studio.
La randomizzazione è stata eseguita a livello centrale ed è stata stratificata per sito clinico e per lo stato di metilazione del promotore del gene MGMT (O6-metilguanina-DNA metiltransferasi), che è stato determinato da un laboratorio centrale. I pazienti sono stati randomizzati 2:1 a SOC più vaccino DC autologo (DCVax-L; n = 232) o SOC più placebo (n = 99). I PBMC sono stati utilizzati come controllo placebo in quanto queste cellule sono visivamente indistinguibili dalla DC e sono considerate immunologicamente inattive. I pazienti in entrambe le braccia hanno continuato a ricevere mensilmente il temozolomide adiuvante (150-200 mg/m2/giorno×5 giorni ogni 28 giorni), intervallato dal vaccino DC o da trattamenti placebo somministrati nei giorni 0, 10 e 20, poi nei mesi 2, 4 e 8, e successivamente a intervalli di 6 mesi a partire dal mese 12. Ogni trattamento con DCVax-L comportava una dose di 2,5 milioni di DC autologhi lisato-pulsati per tumore autologo somministrato per via intradermica nel braccio superiore, alternando i bracci tra le visite di iniezione.
A tutti i pazienti è stato consentito di ricevere DCVax-L a seguito di progressione / recidiva tumorale, così come altri trattamenti approvati per pratica locale. Tutte le parti (ricercatori, pazienti e sponsor) sono rimasti ciechi su quale trattamento ogni paziente aveva ricevuto prima del crossover. Tutti i pazienti che hanno scelto questa opzione sono stati sottoposti al trattamento attivo secondo un programma di riavvio con vaccinazioni ai giorni 0, 10 e 20, e poi ai mesi 2, 4 e 8, e in seguito ogni 6 mesi a partire dal mese 12, con il giorno 0 che è il giorno della prima vaccinazione dopo la progressione. Ad oggi, il DCVax-L è stato spedito per 286 pazienti (86,4%) nello studio.
Sia il trattamento dello studio (DCVax-L) che il placebo (PBMC) sono stati preparati da Cognate BioServices, Inc. per tutti i pazienti negli Stati Uniti e in Canada, e da Cognate e dal Fraunhofer Institute for Cell Therapy insieme per i pazienti in Europa, durante il periodo di chemioradioterapia prima della visita di base. La produzione di DCVax-L ha comportato la trasformazione del tessuto tumorale resecato in un lisato, e quindi la raccolta, la purificazione, la differenziazione, l’attivazione e il caricamento dei DC autologhi. In generale, sono stati necessari circa 2 g di tessuto tumorale per produrre le dieci dosi complete per il trattamento di 36 mesi e il programma di follow-up. Il vaccino è stato aliquotare in dosi individuali e crioconservato a 150 °C [22]. Le dosi sono state conservate a livello centrale e spedite singolarmente ai siti di sperimentazione clinica.
Valutazioni
Le valutazioni di base comprendevano l’esame fisico, l’esame neurologico, i segni vitali, la KPS, la risonanza magnetica del cervello con e senza contrasto, l’ematologia (emocromo con differenziale, piastrine), e la chimica del siero (calcio, magnesio, SGOT, SGPT, fosfatasi alcalina, LDH, bilirubina totale, BUN, creatinina, elettroliti, glucosio). Il sangue è stato raccolto per i marcatori sierici delle malattie autoimmuni (anti-DNA) e per il monitoraggio immunitario, alla visita di base e alle visite di trattamento durante tutto lo studio. Le scansioni cerebrali MRI sono state eseguite ogni 2 mesi, per SOC, dopo la visita di base MRI fino alla progressione radiologica del tumore. Tutte le scansioni MRI sono state valutate centralmente da 2 radiologi indipendenti in cieco, con la decisione di un terzo radiologo, se necessario.
Gli eventi avversi sono stati registrati prospetticamente secondo i Common Terminology Criteria del National Cancer Institute (versione 3.0 NCI CTC), fino a 2 mesi dopo l’ultimo trattamento di studio. I pazienti sono seguiti per la S.O. fino alla morte.
Analisi statistiche
L’endpoint primario dello studio è PFS, mentre l’endpoint secondario è OS. PFS non è stato ancora valutato per questa pubblicazione e sarà oggetto di analisi successive per consentire una valutazione centrale e multifattoriale da parte di un gruppo di esperti, utilizzando i criteri attualmente emergenti come appropriati per la terapia immunitaria in questa popolazione di pazienti in cui la progressione può essere complessa da determinare e la pseudo-progressione è un noto fenomeno confondente. L’analisi dei dati provvisori in cieco sulla OS della popolazione ITT (utilizzando la versione SAS 9.4) è stata eseguita 34 mesi dopo la metà dell’arruolamento dei pazienti, e 16 mesi dopo l’arruolamento e la randomizzazione dell’ultimo paziente.
Le statistiche descrittive generali includono il numero di valori osservati, la media, la deviazione standard, la mediana e i valori dell’intervallo per le misure continue. Per le variabili categoriali, vengono riportati il numero e la percentuale di soggetti con un livello specifico della variabile. Per le analisi di sopravvivenza, sono state generate le curve Kaplan-Meier (KM), che forniscono stime dei tempi mediani di sopravvivenza, insieme agli intervalli di confidenza su due lati (95% di IC) e alle stime di sopravvivenza in specifici punti temporali.
Risultati
Studiare i pazienti
Da luglio 2007 a novembre 2015, 331 pazienti sono stati reclutati nello studio, che comprendeva la popolazione intent-to-treat (ITT). Un diagramma di flusso che illustra il flusso dei pazienti attraverso il processo di screening e di arruolamento è fornito nella Fig. 1.Il tempo mediano tra l’intervento chirurgico e la randomizzazione è stato di 3,1 mesi.Fig. 1 Reclutamento, inclusione e randomizzazione dei pazienti nello studio. (1) I pazienti vengono sottoposti a screening prima dell’intervento chirurgico, quindi la determinazione del glioblastoma (GBM) viene effettuata a partire dalla diagnosi patologica dopo l’intervento chirurgico. (2) Insufficiente lisato tumorale generato per raggiungere la soglia. (3) Malattia progressiva o pseudo-progressione (che sono indistinguibili a questo punto) basata sulla revisione centrale della risonanza magnetica a livello di base post-chemoradiazione. (4) Pazienti che hanno acconsentito alla donazione del tumore ma hanno poi rifiutato la partecipazione alla sperimentazione prima della leucaferesi. (5) Include deviazioni dal protocollo standard di chemioradiazione, storia di malignità pregressa, funzione renale o del midollo osseo inadeguata, ecc. (6) Comprende il fallimento del prodotto farmaceutico o l’insufficienza del farmaco o del placebo prodotto per soddisfare i criteri di rilascio. (7) Comprende il deterioramento clinico, lo stato di prestazione di Karnofsky in declino o la morte del paziente. (8) Comprende solo la biopsia, l’intervento chirurgico annullato o il tessuto tumorale non trattato dopo l’intervento chirurgico.
La popolazione ITT (n=331) (Tabella 1) è similead altri recenti studi sul glioblastoma [4, 21, 24],con il 61% di maschi(n=202) e il 39% di femmine (n=129), con 75.2% dei pazienti di età superiore ai 50 anni (range 19-73 anni), e KPS mediano di 90. Il 63,1% dei pazienti (n=209) ha avuto una resezione totale lorda e il 36,9% (n=122) no. Il promotore del gene MGMT è stato metilato nel 39,6% dei pazienti (n=131) e non metilato nel 48,9% (n=162), con informazioni non disponibili per l’11,5% (n=38; i dati mancanti si riferiscono ai primi pazienti arruolati un decennio fa). La conta linfocitaria assoluta (ALC) era di 800 cellule/mm3 nel 48,6% dei pazienti (n=161) ed era di< 800 cellule/mm3 nel 51,4% dei pazienti (n=170), caratteristica che è stata associata ad una prognosi sfavorevole dopo la radioterapia [23]. Sono stati esclusi i pazienti con evidenza radiografica della progressione della malattia al basale, in quanto sono stati esclusi anche in altri recenti studi per glioblastomi di nuova diagnosi[4, 21, 24].Tabella 1Caratteristiche demografiche e cliniche del basaleVariablen=331 (100%) Età (anno) Media (SD)55.33 (10,01) Mediana (range)56 (19, 73)Sesso, n (%) Femmina129 (39,0) Maschio202 (61,0)Razza, n (%) Indiana d’America o nativa dell’Alaska1 (0,3) Asiatica2 (0,6) Nera o afroamericana7 (2).1) Ispanico o latino16 (4,8) Bianco294 (88,8) Non disponibilea11 (3,3)KPS alla linea di base, n (%) <9097 (29,3) ≥90234 (70,7) Classificazione MGMT, n (%) Metilato131 (39,6) Non metilato162 (48).9) Non disponibile38 (11,5)Gruppo di linfociti, n (%) Alto161 (48,6) Basso170 (51,4)Stato chirurgico, n (%) Resezione parziale122 (36,9) Resezione completa209 (63,1)aRace in alcuni casinonviene raccolta a causa della politica istituzionale
Poiché altri trattamenti sono stati autorizzati in seguito alla progressione della malattia, abbiamo valutato il loro utilizzo in questo studio. Mentre nello studio, tre pazienti (1%) hanno avuto un’altra resezione, 103 pazienti (31%) hanno ricevuto bevacizumab, 53 pazienti (16%) hanno ricevuto CCNU e 6 pazienti (1,8%) sono stati trattati con campi di trattamento tumorale. In diversi studi riportati, né il bevacizumab né la CCNU hanno dimostrato di estendere la sopravvivenza[9, 25].
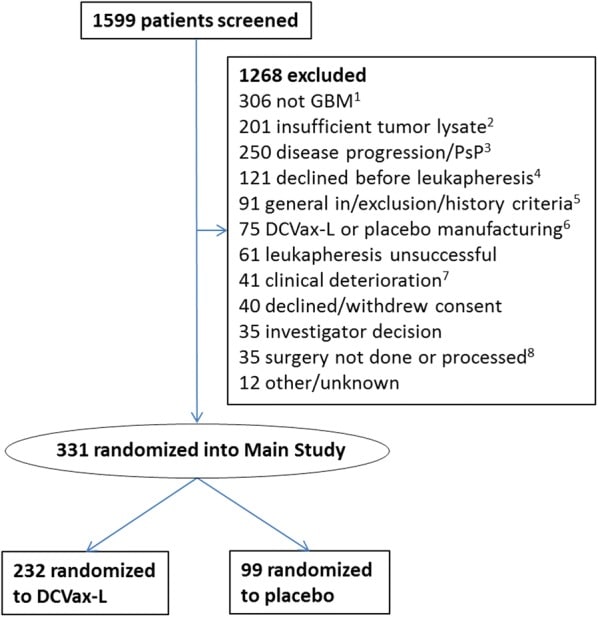
Fig. 1.Reclutamento, inclusione e randomizzazione dei pazienti nello studio. (1) I pazienti vengono sottoposti a screening prima dell’intervento chirurgico, quindi la determinazione del glioblastoma (GBM) viene effettuata a partire dalla diagnosi patologica dopo l’intervento chirurgico. (2) Insufficiente lisato tumorale generato per raggiungere la soglia. (3) Malattia progressiva o pseudo-progressione (che sono indistinguibili a questo punto) basata sulla revisione centrale della risonanza magnetica a livello di base post-chemoradiazione. (4) Pazienti che hanno acconsentito alla donazione del tumore ma hanno poi rifiutato la partecipazione alla sperimentazione prima della leucaferesi. (5) Include deviazioni dal protocollo standard di chemioradiazione, storia di malignità pregressa, funzione renale o del midollo osseo inadeguata, ecc. (6) Comprende il fallimento del prodotto farmaceutico o l’insufficienza del farmaco o del placebo prodotto per soddisfare i criteri di rilascio. (7) Comprende il deterioramento clinico, lo stato di prestazione di Karnofsky in declino o la morte del paziente. (8) Comprende solo la biopsia, l’intervento chirurgico annullato o il tessuto tumorale non trattato dopo l’intervento chirurgico.
Risultati del trattamento
Popolazione ITT
Al momento di questa analisi, 108 dei 331 pazienti (32,6%) erano ancora vivi. Il mOS della popolazione complessiva di ITT (n=331) era di 23,1 mesi dal momento dell’intervento (95% CI 21,2-25,4), con tassi di sopravvivenza a 2 e 3 anni rispettivamente di 46,2 e 25,4% (vedi Fig. 2a e Tabella 2). L’analisi della sopravvivenza dei pazienti rispetto all’anno di arruolamento non ha rivelato una tendenza nel tempo, né differenze significative tra gli anni.Fig. 2Curve di sopravvivenza complessive per i pazienti della popolazione interessata al trattamento. Analisi della sopravvivenza globale del tempo dalla data dell’intervento fino al decesso o all’ultimo follow-up secondo il metodo di Kaplan-Meier per tutti i pazienti della popolazione “intent-to-treat” (ITT) (a), e la popolazione ITT stratificata dallo stato di metilazione del promotore del gene MGMT (b). I pazienti censurati sono annotati da una piccola lineTabella verticale 2Studio endpoint secondo i sottogruppi genetico molecolare e prognostico clinicoPopolazione-S.O. mediana dalla chirurgia (mesi)aSovravvivenza a 1 annobSovravvivenza a 2 annisbSovravvivenza a 3 annisbSovravvivenza a 3 anni33123.1(21,2, 25,4)89,3%(85,4, 92,2)46,2%(40,4, 51,8)25,4%(19,9, 31,3)MGMT metilato13134,7(27,0, 40,7)94.5%(88,8, 97,3)66,7%(57,5, 74,4)46,4%(35,8, 56,3)MGMT non metilato16219,8(17,9, 21,7)86,4%(80,0, 90,8)32,1%(24,5, 9,9)11,0%(5,7, 18,2)Resezione totale lorda20925,4(21,8, 28,2)91,8%(87,1, 94.8)51,2%(43,9, 58,1)29,9%(22,6, 37,5)Resezione parziale12221,1(19,1, 23,1)85,0%(77,2, 90,2)37,7%(28,6, 46,7)18,0%(10,5, 27,1)KPS a baseline ≥ 9023423,7(21,8, 26,7)94,0%(90,0, 96,4)49.2%(42,3, 55,8)26,6%(19,9, 33,8)KPS al baseline <909719,8(16,6, 23,9)77,8%(68,0, 84,9)38,8%(28,5, 49,0)22,1%(13,4, 32,2)ALC> 80016123,6(21,7, 28,2)89,9%(84,0, 93.7)49,5%(41,1, 57,4)28,7%(20,6, 37,3)ALC≤80017021,6(19,9, 25,2)88,7%(82,8, 92,6)43,3%(35,4, 50,9)22,2%(15,0, 30,3)Età< 50 anni8226,2(21,1, 31,5)92,5%(84.2, 96,6)51,7%(39,9, 62,3)28,0%(16,4, 40,8)Età≥ 50 anni24922,4(20,4, 24,1)88,2%(83,5, 91,7)44,4%(37,7, 50,8)24,6%(18,5, 31.2)aMedianasopravvivenza globale (OS) in mesi di popolazione intent-to-treat (ITT), seguita da un intervallo di confidenza del 95% tra parentesibTasso annuo di percentuale di sopravvivenza nella popolazione ITT, seguito da un intervallo di confidenza del 95% tra parentesi
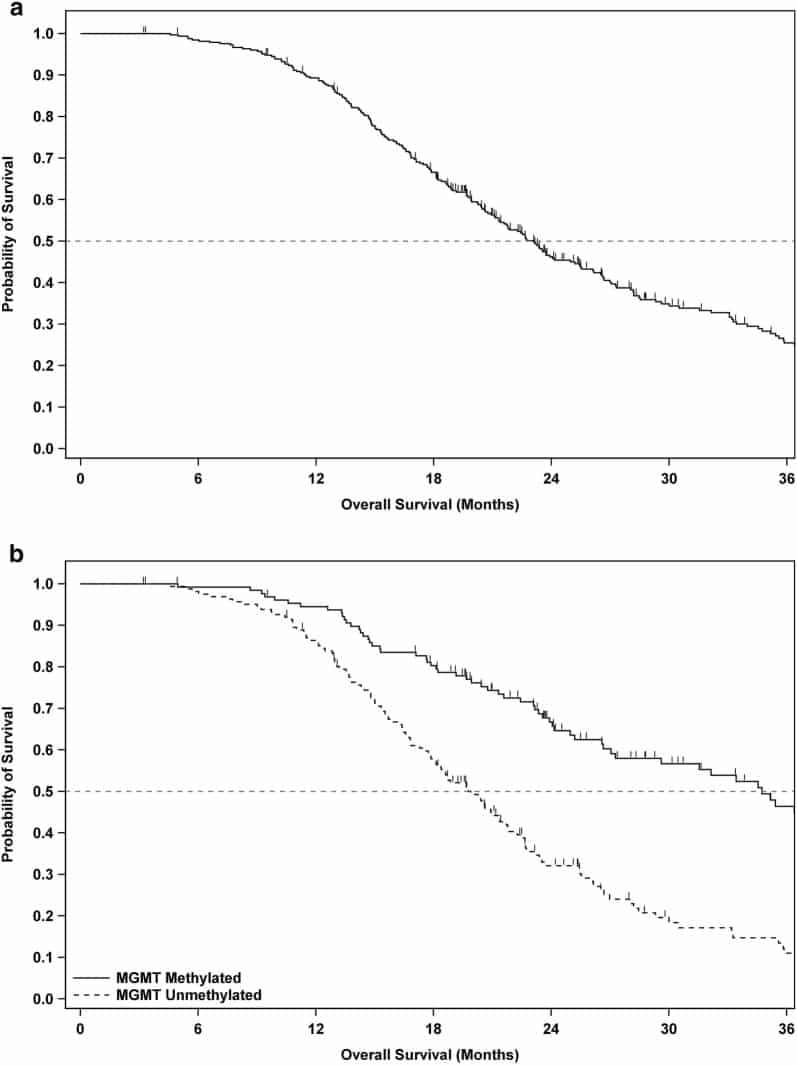
Fig. 2.Curve di sopravvivenza globale per i pazienti della popolazione interessata al trattamento. Analisi della sopravvivenza globale del tempo dalla data dell’intervento fino al decesso o all’ultimo follow-up secondo il metodo di Kaplan-Meier per tutti i pazienti della popolazione “intent-to-treat” (ITT) (a), e la popolazione ITT stratificata dallo stato di metilazione del promotore del gene MGMT (b). I pazienti censurati sono annotati da una piccola linea verticale
Coda lunga tra la popolazione ITT
Con le terapie immunitarie, un punto chiave è la coda della curva di sopravvivenza[26]. Tra i pazienti ITT con una data di intervento chirurgico ≥ 30 mesi prima della raccolta dati (n = 223), il 30% (n = 67) ha vissuto ≥ 30 mesi, e la loro stima del mOS derivato dal KM è di 46,5 mesi. Tra i pazienti ITT con una data di intervento chirurgico ≥ 36 mesi prima della raccolta dati (n = 182), il 24,2% (n = 44) ha vissuto ≥ 36 mesi e la loro stima di mOS derivato dal KM è di 88,2 mesi.
Stato di MGMT ed estensione della resezione
Nei pazienti con MGMT metilato (n=131), il mOS era a 34,7 mesi dall’intervento (95% CI 27,0-40,7), con tassi di sopravvivenza a 2 e 3 anni rispettivamente del 66,7% e del 46,4%. Nei pazienti con MGMT non metilato (n==162), mOS era a 19,8 mesi dall’intervento (95% CI 17,9-21,7), con tassi di sopravvivenza a 2 e 3 anni del 32,1% e dell’11,0%, rispettivamente (Fig. 2b e Tabella 2).
Per i pazienti con resezione chirurgica totale lorda (n=209), mOS era a 25,4 mesi dall’intervento (95% CI 21,8-28,2), con tassi di sopravvivenza a 2 e 3 anni del 51,2% e del 29,9%, rispettivamente. Per i pazienti con resezione chirurgica solo parziale (n=122), mOS a 21,1 mesi dall’intervento (95% CI 19,1-23,1), con tassi di sopravvivenza a 2 e 3 anni del 37,7% e del 18,0%, rispettivamente (Tabella 2).
Nei pazienti con metilazione MGMT e resezione totale lorda (n=83), il mOS è stato di 36,5 mesi (95% CI 31,5-46,5)-1,8 mesi più lungo del mOS dei pazienti con metilazione MGMT e resezione solo parziale (n=48). Nei pazienti con MGMT non metilato, non c’era un vantaggio di sopravvivenza statisticamente significativo con una resezione totale lorda rispetto ad una resezione solo parziale.
Fattori sconosciuti: sottogruppo con sopravvivenza estesa
Circa il 30% della popolazione ITT (n=100) ha mostrato una sopravvivenza particolarmente estesa, con una stima di mOS derivata dal KM di 40,5 mesi. Questo non è pienamente spiegato da fattori prognostici noti, in quanto solo alcuni di questi pazienti avevano fattori prognostici positivi: solo il 29% aveva meno di 50 anni, il 65,9% aveva MGMT metilato, il 71% aveva una resezione completa e solo l’8% di questi pazienti aveva tutti e tre i fattori prognostici positivi. Questi pazienti saranno oggetto di ulteriori analisi e ricerche approfondite.
Sicurezza e tossicità
I dati sulla sicurezza e sulla tossicità sono stati valutati in cieco per tutti i 331 pazienti ITT. Dopo la chemioradioterapia SOC e prima di qualsiasi trattamento con DCVax-L, la linfopenia era l’evento avverso più comune, che si verificava in circa 170 pazienti (51%)[23].
Il trattamento DCVax-L è stato ben tollerato, con solo 7 pazienti ITT (2,1%) che hanno subito eventi avversi gravi (NCI CTC Gradi 3-4) ritenuti correlati o eventualmente correlati al trattamento DCVax-L. Questi includevano edema cerebrale in 3 pazienti (0,9%), convulsioni in 2 pazienti (0,6%), nausea in 1 paziente (0,3%) e infezione della ghiandola linfatica in 1 paziente (0,3%).
Il tasso di eventi avversi totali con SOC più DCVax-L era paragonabile al solo SOC (Tabella 3). Gli eventi avversi non gravi che sono stati considerati possibilmente correlati al trattamento includevano reazioni nel sito di iniezione, stanchezza, febbre a basso grado e brividi notturni.Tabella 3 Gradi 3-4 di trattamento degli eventi avversi allergici (TEAE)System organ classaNumber (%) di pazienti con TEAE (n=331)Pazienti che hanno segnalato almeno un TEAE grave (correlato o meno al trattamento con vaccino DC)137 (41.1%)Disturbi del sistema nervoso93 (28,1%)Infezione23 (6,9%)Disturbi generali e reazioni del sito di iniezione22 (6,6%)Disturbi respiratori, toracici e mediastinici17 (5.).1%)Disturbi psichiatrici16 (4,8%)Disturbi gastrointestinali16 (4,8%)Lesioni, avvelenamenti e complicazioni procedurali12 (3,6%)Disturbi vascolari6 (1,8%)Disturbi muscoloscheletrici e del tessuto connettivo5 (1,5%)Neoplasie benigne, maligne e non specificate5 (1,5%)Disturbi ematologici5 (1.)5%)Disturbi del metabolismo e della nutrizione3 (0,9%)Disturbi epatobiliari2 (0,6%)Disturbi renali e urinari2 (0,6%)Disturbi cardiaci1 (0,3%)Disturbi dell’orecchio e del labirinto1 (0,3%)Disturbi del sistema immunitariosc1 (0,3%)Disturbi del sistema riproduttivo e del seno1 (0,3%)aCodiceper MedDRA 16.0. I pazienti possono aver avuto più di un evento avverso, quindi le sottocategorie non totalbComprende le infezioni da ferite chirurgiche, meningite, infezioni del tratto urinario e altrescInclude l’ipersensibilità ai farmaci
Discussione
Sebbene l’arruolamento sia stato completato nel 2015, questo studio, che comprende sia i trattamenti che il follow-up, è ancora in corso e rimarrà in cieco fino a quando non si saranno verificati sufficienti eventi di progressione della malattia e/o morte per chiarire meglio la coda della curva di sopravvivenza. Ad oggi, a causa del progetto del crossover, quasi il 90% della popolazione ITT ha ricevuto DCVax-L in un certo punto dello studio, a causa del progetto del crossover.
Il DCVax-L viene somministrato tramite iniezione intra-dermica nel braccio, sei volte nell’anno uno e due volte all’anno dopo. In questo modo impone solo un onere minimo al paziente.
Nella popolazione complessiva di ITT in questo studio, il mOS di 23,1 mesi dalla chirurgia si confronta favorevolmente con il mOS di 15-17 mesi dalla chirurgia tipicamente ottenuto con il SOC negli studi e nella pratica clinica passati, così come con i dati di sopravvivenza con il trattamento SOC nei bracci di controllo di altri studi in popolazioni di pazienti simili. Ad esempio, Weller et al. hanno riportato un mOS di 17,4 mesi dalla randomizzazione nella popolazione ITT [21], e Stupp et al. hanno riportato un mOS di 16,0 mesi dalla randomizzazione nella popolazione ITT [24].
Nei pazienti con un promotore del gene MGMT metilato, il mOS di 34,7 mesi dall’intervento chirurgico si confronta favorevolmente anche con il SOC in studi precedenti e con il mOS riportato per i trattamenti SOC del braccio di controllo in altri recenti studi sul glioblastoma in popolazioni di pazienti simili. Ad esempio, Stupp et al. hanno riportato per il loro gruppo di controllo un mOS di 21,2 mesi dalla randomizzazione in una popolazione di pazienti simile [24]. L’aumento della sopravvivenza nei pazienti con MGMT-metilato nello studio DCVax-L aumenta la possibilità di un effetto cooperativo della combinazione della chemioterapia con temozolomide e della terapia immunitaria attiva DCVax-L[17].
Lo stato di mutazione del gene IDH1 non è stato ancora indagato per questo studio, in quanto questo fattore non è stato incluso nei progetti dello studio una decina di anni fa, quando questo studio è iniziato. Sarà raccolto e analizzato in seguito, ma è improbabile che possa spiegare i risultati complessivi della sopravvivenza, poiché la mutazione associata alla sopravvivenza prolungata si verifica in meno del 10% dei pazienti con glioblastoma di nuova diagnosi[27].
Gli effetti benefici delle immunoterapie sono spesso osservati in punti successivi, nella coda della curva di sopravvivenza[26]. Sebbene questo studio di Fase 3 richieda un’ulteriore maturazione, dai dati provvisori in cieco comincia ad emergere un quadro che è coerente con una coda di sopravvivenza estesa. Ad esempio, tra i pazienti (n=182) che alla data di questa analisi sono stati sottoposti ad un intervento chirurgico da più di 36 mesi, il 24,2% (n=44) è rimasto in vita per più di 36 mesi e ha un tempo di sopravvivenza mediano stimato di 88,2 mesi. Quindi, sembra che i pazienti che sopravvivono oltre certi punti di tempo soglia possano continuare a sopravvivere per tempi insolitamente lunghi, in modo simile ai risultati dei nostri precedenti studi di Fase I/II di questo vaccino a base di DC[17- 19]. Un’ulteriore maturazione dei dati dello studio è necessaria per rivelare in modo più completo l’estensione della coda lunga della curva di sopravvivenza.
Il DCVax-L ha mostrato un profilo di sicurezza benigno in questo studio di Fase 3, come ha sempre fatto nei precedenti studi di fase iniziale[17, 19], e in un ampio gruppo di pazienti trattati con un uso compassionevole[28]. Il fatto che solo 7 dei 331 pazienti ITT (2,1%) hanno avuto eventi avversi di grado 3 o 4 che erano almeno possibilmente correlati al trattamento rende questo vaccino DC un trattamento particolarmente ben tollerato.
Con un tale profilo di sicurezza, questo vaccino DC può essere somministrato in un’ampia gamma di contesti clinici e può essere potenzialmente combinato con una vasta gamma di altri agenti terapeutici, inclusi gli inibitori dei checkpoint immunitari e le terapie mirate, senza che ciò comporti un’eccessiva tossicità per i pazienti, come è stato visto con alcune altre combinazioni di trattamento[29, 30]. Sono necessari ulteriori studi per esplorare tali combinazioni.
Conclusioni
L’aggiunta del vaccino a cellule dendritiche autologhe DCVax-L al SOC è fattibile e sicura. Collettivamente, i dati sulla sopravvivenza provvisoria in cieco suggeriscono che i pazienti di questo studio di Fase 3 vivono più a lungo del previsto. Questi risultati giustificano un ulteriore follow-up e analisi.
References
- Ostrom QT, Gittleman H, Xu J, Kromer C, Wolinsky Y, Kruchko C, Barnholtz-Sloan JS. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2009–2013. Neuro-oncology. 2016; 18(suppl_5):v1-v75. DOI | PubMed
- Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005; 352(10):987-996. DOI | PubMed
- Stupp R, Hegi ME, Mason WP, van den Bent MJ, Taphoorn MJ, Janzer RC, Ludwin SK, Allgeier A, Fisher B, Belanger K. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009; 10(5):459-466. DOI | PubMed
- Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, Taylor LP, Lieberman F, Silvani A, Fink KL. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma: a randomized clinical trial. JAMA. 2015; 314(23):2535-2543. DOI | PubMed
- Wick W, Puduvalli VK, Chamberlain MC, van den Bent MJ, Carpentier AF, Cher LM, Mason W, Weller M, Hong S, Musib L. Phase III study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol. 2010; 28(7):1168-1174. DOI | PubMed
- Batchelor TT, Mulholland P, Neyns B, Nabors LB, Campone M, Wick A, Mason W, Mikkelsen T, Phuphanich S, Ashby LS. Phase III randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma. J Clin Oncol. 2013; 31(26):3212-3218. DOI | PubMed
- Stupp R, Hegi ME, Gorlia T, Erridge SC, Perry J, Hong YK, Aldape KD, Lhermitte B, Pietsch T, Grujicic D. Cilengitide combined with standard treatment for patients with newly diagnosed glioblastoma with methylated MGMT promoter (CENTRIC EORTC 26071-22072 study): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2014; 15(10):1100-1108. DOI | PubMed
- Gilbert MR, Dignam JJ, Armstrong TS, Wefel JS, Blumenthal DT, Vogelbaum MA, Colman H, Chakravarti A, Pugh S, Won M. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014; 370(8):699-708. DOI | PubMed
- Chinot OL, Wick W, Mason W, Henriksson R, Saran F, Nishikawa R, Carpentier AF, Hoang-Xuan K, Kavan P, Cernea D. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014; 370(8):709-722. DOI | PubMed
- Westphal M, Heese O, Steinbach JP, Schnell O, Schackert G, Mehdorn M, Schulz D, Simon M, Schlegel U, Senft C. A randomised, open label phase III trial with nimotuzumab, an anti-epidermal growth factor receptor monoclonal antibody in the treatment of newly diagnosed adult glioblastoma. Eur J Cancer. 2015; 51(4):522-532. DOI | PubMed
- Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells. Nat Rev Cancer. 2012; 12(4):265-277. DOI | PubMed
- Hickey MJ, Malone CC, Erickson KL, Jadus MR, Prins RM, Liau LM, Kruse CA. Cellular and vaccine therapeutic approaches for gliomas. J Transl Med. 2010; 8:100. DOI | PubMed
- Prins RM, Liau LM. Cellular immunity and immunotherapy of brain tumors. Front Biosci. 2004; 9:3124-3136. DOI | PubMed
- Liau LM, Black KL, Prins RM, Sykes SN, DiPatre PL, Cloughesy TF, Becker DP, Bronstein JM. Treatment of intracranial gliomas with bone marrow-derived dendritic cells pulsed with tumor antigens. J Neurosurg. 1999; 90(6):1115-1124. DOI | PubMed
- Prins RM, Craft N, Bruhn KW, Khan-Farooqi H, Koya RC, Stripecke R, Miller JF, Liau LM. The TLR-7 agonist, imiquimod, enhances dendritic cell survival and promotes tumor antigen-specific T cell priming: relation to central nervous system antitumor immunity. J Immunol. 2006; 176(1):157-164. DOI | PubMed
- Prins RM, Odesa SK, Liau LM. Immunotherapeutic targeting of shared melanoma-associated antigens in a murine glioma model. Cancer Res. 2003; 63(23):8487-8491. PubMed
- Liau LM, Prins RM, Kiertscher SM, Odesa SK, Kremen TJ, Giovannone AJ, Lin JW, Chute DJ, Mischel PS, Cloughesy TF. Dendritic cell vaccination in glioblastoma patients induces systemic and intracranial T-cell responses modulated by the local central nervous system tumor microenvironment. Clin Cancer Res. 2005; 11(15):5515-5525. DOI | PubMed
- Prins RM, Cloughesy TF, Liau LM. Cytomegalovirus immunity after vaccination with autologous glioblastoma lysate. N Engl J Med. 2008; 359(5):539-541. DOI | PubMed
- Prins RM, Soto H, Konkankit V, Odesa SK, Eskin A, Yong WH, Nelson SF, Liau LM. Gene expression profile correlates with T-cell infiltration and relative survival in glioblastoma patients vaccinated with dendritic cell immunotherapy. Clin Cancer Res. 2011; 17(6):1603-1615. DOI | PubMed
- Curran WJ, Scott CB, Horton J, Nelson JS, Weinstein AS, Fischbach AJ, Chang CH, Rotman M, Asbell SO, Krisch RE. Recursive partitioning analysis of prognostic factors in three Radiation Therapy Oncology Group malignant glioma trials. J Natl Cancer Inst. 1993; 85(9):704-710. DOI | PubMed
- Weller M, Butowski N, Tran DD, Recht LD, Lim M, Hirte H, Ashby L, Mechtler L, Goldlust SA, Iwamoto F. Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV): a randomised, double-blind, international phase 3 trial. Lancet Oncol. 2017; 18:1378-1385. DOI
- Hong S, Li H, Qian J, Yang J, Lu Y, Yi Q. Optimizing dendritic cell vaccine for immunotherapy in multiple myeloma: tumour lysates are more potent tumour antigens than idiotype protein to promote anti-tumour immunity. Clin Exp Immunol. 2012; 170(2):167-177. DOI | PubMed
- Grossman SA, Ellsworth S, Campian J, Wild AT, Herman JM, Laheru D, Brock M, Balmanoukian A, Ye X. Survival in patients with severe lymphopenia following treatment with radiation and chemotherapy for newly diagnosed solid tumors. J Natl Compr Canc Netw. 2015; 13(10):1225-1231. DOI | PubMed
- Stupp R, Taillibert S, Kanner A, Read W, Steinberg DM, Lhermitte B, Toms S, Idbaih A, Ahluwalia MS, Fink K. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. JAMA. 2017; 318(23):2306-2316. DOI | PubMed
- Friedman HS, Prados MD, Wen PY, Mikkelsen T, Schiff D, Abrey LE, Yung WK, Paleologos N, Nicholas MK, Jensen R. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009; 27(28):4733-4740. DOI | PubMed
- Harris SJ, Brown J, Lopez J, Yap TA. Immuno-oncology combinations: raising the tail of the survival curve. Cancer Biol Med. 2016; 13(2):171-193. DOI | PubMed
- Parsons DW, Jones S, Zhang X, Lin JC, Leary RJ, Angenendt P, Mankoo P, Carter H, Siu IM, Gallia GL. An integrated genomic analysis of human glioblastoma multiforme. Science. 2008; 321(5897):1807-1812. DOI | PubMed
- Bosch ML, Prins RM. Prolonged survival for patients with recurrent glioblastoma multiforme who are treated with tumour lysate-pulsed autologous dendritic cells. Eur J Cancer. 2015; 51(Supplement 1):S6-S7.
- Larkin J, Chmielowski B, Lao CD, Hodi FS, Sharfman W, Weber J, Suijkerbuijk KPM, Azevedo S, Li H, Reshef D. Neurologic serious adverse events associated with nivolumab plus ipilimumab or nivolumab alone in advanced melanoma, including a case series of encephalitis. Oncologist. 2017; 22(6):709-718. DOI | PubMed
- Maxwell R, Jackson CM, Lim M. Clinical trials investigating immune checkpoint blockade in glioblastoma. Curr Treat Options Oncol. 2017; 18(8):51. DOI | PubMed
Fonte
Liau LM, Ashkan K, Tran DD, Campian JL, Trusheim JE, et al. (2018) First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma. Journal of Translational Medicine 16142. https://doi.org/10.1186/s12967-018-1507-6





