Introduzione
Le varianti farmacogenetiche contribuiscono alle differenze individuali osservate nella risposta ai farmaci e al rischio di reazioni avverse ai farmaci.1,2 Circa il 10% dei 1200 farmaci approvati dalla US Food and Drug Administration contiene informazioni farmacogenetiche sull’etichetta del farmaco.3 La conoscenza clinica delle varianti farmacogenetiche ha il potenziale di influenzare la cura di un paziente per tutta la vita in quanto sono ereditarie e quindi non cambiano. Recenti studi su larga scala di genotipizzazione e sequenziamento hanno rilevato che oltre il 95% dei pazienti è portatore di almeno una variante farmacogenetica che influenzerebbe gli esiti correlati ai farmaci e che sarebbe considerata utilizzabile.4,5,6 Nel complesso, la farmacogenetica ha il potenziale di fornire un processo più sicuro ed efficace per la prescrizione di farmaci, migliorando in ultima analisi i risultati sanitari e riducendo i costi dell’assistenza sanitaria.7 Tuttavia, la traduzione di queste conoscenze in cure cliniche è stata lenta.8
Due iniziative di collaborazione stanno guidando gli sforzi nella cura e nella diffusione delle informazioni sulla farmacogenetica: il National Institutes of Health-funded Pharmacogenomic Knowledgebase1 e il Clinical Pharmacogenetics Implementation Consortium (CPIC).9 Per accelerare la traduzione dei risultati dei test in decisioni attuabili per la prescrizione, la CPIC pubblica linee guida per farmaci specifici, basate su evidenze scientifiche e sottoposte a revisione tra pari. Ci sono più di 30 interazioni gene-farmaci classificati dalla CPIC come livello A, che indicano un alto livello di evidenza da studi ben progettati e ben condotti, compresi i farmaci comunemente prescritti simvastatina,10 clopidogrel,11 e codeina.12 Una lacuna nella comprensione della farmacogenetica è che le linee guida CPIC non forniscono indicazioni su quando ordinare i test farmacogenetici.
Un ostacolo all’implementazione della farmacogenetica nella pratica è l’incertezza su quali test farmacogenetici abbiano la maggiore utilità clinica per una popolazione di pazienti. Una valutazione approfondita della prevalenza delle varianti farmacogenetiche e dei modelli di prescrizione dei farmaci affetti da varianti farmacogenetiche nella popolazione target può aiutare a identificare i test di maggiore utilità e guidare gli sforzi di implementazione per aumentare l’adozione in ambito clinico. La Veterans Health Administration (VHA) è il più grande sistema sanitario integrato degli Stati Uniti, che comprende 9,1 milioni di veterani arruolati nel 2016 e una cartella clinica elettronica integrata a livello nazionale (EHR),13 con la possibilità di collegare i risultati dei test di laboratorio alla prescrizione, alla dispensazione e alla somministrazione dei farmaci. Lo scopo di questo studio è quello di valutare il potenziale impatto dell’adozione di test farmacogenetici per i farmaci di livello A all’interno del VHA. Abbiamo stimato la prevalenza di varianti farmacogenetiche attivabili tra i veterani, quantificato il numero di veterani unici a cui sono stati prescritti farmaci di livello A e proiettato il potenziale impatto clinico che la conoscenza delle varianti farmacogenetiche attivabili potrebbe avere sulle decisioni di prescrizione per i veterani.
Metodi
Questo studio è stato approvato dal Dipartimento degli Affari dei Veterani degli Stati Uniti (VA), Bedford, Massachusetts, e dal comitato di revisione istituzionale e di ricerca e sviluppo dell’Università dello Utah e ha ricevuto l’autorizzazione del Health Insurance Portability and Accountability Act. È stata concessa una deroga al consenso perché la ricerca non comportava più del minimo rischio per i partecipanti, veniva eseguita utilizzando i dati raccolti durante le cure cliniche di routine e non poteva essere praticamente eseguita senza la deroga al consenso. Lo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE) per gli studi trasversali.
Caratteristiche demografiche
Le caratteristiche demografiche dei veterani che hanno ricevuto assistenza nel VHA dal 1° ottobre 2011 al 30 settembre 2017 sono state estratte dalle tabelle di Observational Medical Outcomes Partnership del VA Corporate Data Warehouse all’interno dell’Infrastruttura Informatica e Informatica VA.14 Sono stati identificati utenti unici di VHA sulla base di qualsiasi record per le cure ospedaliere e ambulatoriali di VHA, gli esami di laboratorio e le prescrizioni (eTable 1 nel supplemento). Abbiamo identificato gli utenti di farmacie VHA con almeno 1 record di farmaci durante lo studio utilizzando la tabella Observational Medical Outcomes Partnership Drug Exposure table, una serie di dati curata e nazionale per tutti i farmaci distribuiti attraverso le farmacie VHA in ambulatorio e in regime di ricovero. I pazienti sono stati inclusi nelle analisi basate sull’esistenza di almeno 1 record per un farmaco di livello A durante lo studio. I pazienti sono stati qualificati come nuovi destinatari di farmaci solo per l’anno della prima prescrizione di un farmaco di livello A nel periodo. Per i pazienti con una prima prescrizione nel 2012, abbiamo esaminato i loro record di prescrizione dell’anno precedente; i pazienti con una prescrizione per quel farmaco nel 2011 sono stati poi esclusi dai nuovi destinatari del farmaco di livello A nel 2012.
Analisi statistica
Le analisi dei dati sono iniziate il 26 aprile 2018 e si sono concluse il 6 febbraio 2019. Le analisi sono state condotte sulla base delle seguenti ipotesi: (1) la prescrizione di un farmaco guidato dal genotipo non è ampiamente eseguita all’interno del PSA; (2) le varianti farmacogenetiche sono in equilibrio Hardy-Weinberg all’interno della popolazione di PSA; e (3) lo stato di portatore farmacogenetico non influisce sulla necessità iniziale del farmaco.15 Abbiamo raccolto le frequenze alleliche delle varianti farmacogenetiche con un’interazione gene-farmaco di livello A per popolazioni ancestrali specifiche del Progetto 1000 Genomi.16,17,18 Le varianti dello stesso gene sono state trattate come reciprocamente esclusive (eTable 2 nel supplemento), e la frequenza dell’allele wild-type è stata calcolata come 1 meno la somma delle frequenze della variante attivabile all’interno di quella popolazione. Il numero di genotipi azionabili (cioè il numero di omozigoti, omozigoti ed eterozigoti, o portatori delle varianti, a seconda dei casi) è stato calcolato per ogni popolazione (eTabella 3 nel supplemento).
Per il gene G6PD sul cromosoma X, la frequenza dei genotipi attivabili è stata stimata separatamente per sesso (eTabella 3 nel supplemento). Per i geni ad alto polimorfismo, cioè CYP2C9, CYP2C19 e CYP2D6, abbiamo raccolto la distribuzione dei fenotipi funzionali classificati come azionabili dalla CPIC (eTabella 4 nel supplemento), che comprendeva variazioni nel numero di copie CYP2D6.12,19,20
Per approssimare la diversità della popolazione dei VHA (15% di ascendenza africana), abbiamo ponderato la frequenza della variante specifica conosciuta del Progetto 1000 Genomi con la diversità razziale nella popolazione dei VHA (eTabella 1 nel Supplemento). Modelli di popolazione alternativi sono stati testati in analisi di sensibilità e hanno prodotto stime simili per la prevalenza della variante farmacogenetica (eMethods, eTable 5, eTable 6, eFigure nel supplemento). Infine, la percentuale di veterani che avrebbero portato almeno 1 variante attivabile è stata stimata come 1 meno la probabilità di avere un genotipo wild-type per tutti i geni analizzati (eMethods e eTable 7 nel supplemento).
Abbiamo calcolato la percentuale complessiva di veterani che hanno prescritto un farmaco di livello A tra gli utenti unici di farmacie VHA e tra i nuovi destinatari di farmaci di livello A. Per i primi 10 farmaci di livello A recentemente prescritti a destinatari unici, abbiamo stimato la proporzione di destinatari di farmaci con varianti farmacogenetiche attivabili come prodotto della frequenza riportata di fenotipi attivabili in base al numero di nuovi destinatari di quel farmaco. Abbiamo anche riportato il numero previsto di pazienti che ricevono clopidogrel entro 30 giorni dopo un intervento coronarico percutaneo per il quale le raccomandazioni cliniche sono più forti (eMethods e eTable 8 nel supplemento).
Abbiamo stimato il numero assoluto di pazienti recentemente esposti a farmaci e a rischio di non efficacia dei farmaci o di effetti tossici sulla base delle frequenze dei fenotipi proiettati. Abbiamo limitato le nostre analisi ai farmaci con un forte livello di CPIC A basato sul fenotipo, raccomandando al paziente di farsi prescrivere una terapia alternativa o una terapia dose-adeguata (eTable 9 e eTable 10 nel supplemento).
Risultati
Ci sono stati 7.769.359 veterani che hanno utilizzato i servizi della farmacia VHA dal 1° ottobre 2011 al 30 settembre 2017. L’età media (SD) all’inizio dello studio era di 58,1 (17,8) anni; 7/021/504 veterani (90,4%) erano uomini. La coorte comprendeva 5-153-274 veterani bianchi (66,3%), 195-906 veterani afroamericani (15,4%) e 450 692 veterani ispanici (5,8%) (eTabella 1 nel supplemento). La tabella 1 mostra la prevalenza prevista di genotipi attivabili tra gli utenti di farmacie VHA per ciascun gene. Le frequenze alleliche individuali per ogni razza/gruppo etnico e i calcoli per le varianti attivabili sono forniti nella eTabella 2 e nella eTabella 3 del supplemento. La variante più diffusa è quella del gene IFNL3(IL28B) (rs12979860; Tabella 2), che influenza la risposta del paziente al peginterferone del farmaco antiepatiteC.21 Dopo aver tabulato le frequenze delle varianti attivabili, abbiamo stimato che il 99% dei veterani che ricevono cure di PEV avrebbe almeno 1 variante farmacogenetica (eTabella 7 nel supplemento). Le nostre stime basate sulle frequenze alleliche specifiche della popolazione sono coerenti con gli studi precedenti direttamente genotipizzazione4 o il sequenziamento di grandi popolazioni di biobanche,5 dimostrando che le varianti farmacogenetiche si trovano in più del 90% della popolazione.
| Gene | Allele | Effetto | Popolazione con genotipi attivabili, n. (%)a | Farmaci interessati |
|---|---|---|---|---|
| CYP2C9 | *2,*3,*5,*6,*8,*11 | Funzione diminuita | 2 633 813 (33.9) | Warfarin, fenitoina |
| VKORC119 | 1639G>A | Aumento della sensibilità al warfarin | 4 529 536 (58.3) | Warfarin |
| CYP2C19 | *2, *3, *4, *8 | Funzione diminuita | 2 035 572 (26.2) | Clopidogrel, citalopram, escitalopram, amitriptilina |
| *17 | Funzione aumentata | 3 348 594 (43.1) | Voriconazolo | |
| CYP2D612 | *3, *4, *5, *6, *9, *10, *17, *29, *41 | Funzione diminuita o nessuna funzione | 318 544 (4.1) | Codeina, tramadolo, fluvoxamina, paroxetina, nortriptilina, ondansetron |
| Duplicazione genica | Funzione aumentata | 264 158 (3.4) | Tamoxifen | |
| CYP3A543 | *1 | Aumento del dosaggio raccomandato | 1 926 801 (24.8) | Tacrolimus |
| SLCO1B1 | *5 | Aumento del rischio di miopatia | 1 988 956 (25.6) | Simvastatina |
| UGT1A1 | *80 | Funzione diminuita | 870 168 (11.2) | Atazanavir, irinotecan |
| TPMT | *2, *3 | Nessuna funzione | 450 623 (5.8) | Azatioprina, mercaptopurina, tioguanina |
| DPYD | *2A, D949V | Nessuna funzione o funzione ridotta | 69 924 (0.9) | Capecitabina, fluorouracile |
| G6PD44 | 202A/376G | Carenza | 380 699 (4.9) | Rasburicase |
| IFNL321 | rs12979860 | Risposta sfavorevole | 6 433 029 (82.8) | Interferone pegilato |
| HLA-A45 | *31:01 | Reazione di ipersensibilità | 372 929 (4.8) | Carbamazepina, oxcarbazepina |
| HLA-B45 | *57:01 | Reazione di ipersensibilità | 435 084 (5.6) | Abacavir, fenitoina |
| *58:01 | Gravi reazioni avverse cutanee | 295 236 (3.8) | Allopurinolo, carbamazepina, oxcarbazepina | |
| *15:02 | Sindrome di Stevens-Johnson o necrolisi epidermica tossica | 5515 (0.1) |
| Droga | Classe di droga | N. (%) (N=7-769-359) | |
|---|---|---|---|
| Tutti i destinatari della droga | Nuovi destinatari della droga | ||
| ≥1 Livello A farmaco | Qualsiasi | 4 259 153 (54.8) | 2 943 872 (37.9) |
| Simvastatina | Statin | 1 925 052 (24.8) | 533 928 (6.9) |
| Tramadol | Opioide | 1 308 595 (16.8) | 923 671 (11.9) |
| Ondansetron | Oncologia | 702 244 (9.0) | 604 226 (7.8) |
| Codeine | Opioide | 680 527 (8.8) | 528 159 (6.8) |
| Citalopram | Antidepressivo | 569 668 (7.3) | 266 952 (3.4) |
| Clopidogrel | Antiplatelet | 560 001 (7.2) | 338 295 (4.4) |
| Allopurinolo | Gotta | 408 862 (5.3) | 215 055 (2.8) |
| Warfarin | Anticoagulante | 385 821 (5.0) | 205 177 (2.6) |
| Amitriptyline | Antidepressivo | 257 092 (3.3) | 174 693 (2.2) |
| Paroxetina | Antidepressivo | 214 166 (2.8) | 138 183 (1.8) |
| Fluorouracil | Oncologia | 192 482 (2.5) | 160 356 (2.1) |
| Escitalopram | Antidepressivo | 176 907 (2.3) | 170 690 (2.2) |
| Nortriptyline | Antidepressivo | 123 001 (1.6) | 88 551 (1.1) |
| Carbamazepina | Anticonvulsivo | 58 304 (0.8) | 32 868 (0.4) |
| Fenitoina | Anticonvulsivo | 43 348 (0.6) | 15 556 (0.2) |
| Tacrolimus | Immunosoppressore | 39 168 (0.5) | 26 487 (0.3) |
| Ribavirin | Antivirale | 35 744 (0.5) | 31 606 (0.4) |
| Oxcarbazepina | Anticonvulsivo | 18 763 (0.2) | 15 213 (0.2) |
| Azatioprina | Immunosoppressore | 15 769 (0.2) | 9283 (0.1) |
| Capecitabina | Oncologia | 11 994 (0.2) | 9677 (0.1) |
| Peginterferone alfa-2a | Antivirale | 10 348 (0.1) | 6437 (0.08) |
| Abacavir | Antivirale | 9716 (0.1) | 6263 (0.08) |
| Atazanavir | Antivirale | 6495 (0.08) | 1709 (0.02) |
| Voriconazolo | Antimicotico | 4603 (0.06) | 3785 (0.05) |
| Tamoxifen | Oncologia | 4374 (0.06) | 3159 (0.04) |
| Fluvoxamina | Antidepressivo | 3842 (0.05) | 2460 (0.03) |
| Mercaptopurina | Immunosoppressore | 3566 (0.05) | 1996 (0.03) |
| Rasburicase | Oncologia | 1637 (0.02) | 1444 (0.02) |
| Peginterferone alfa-2b | Antivirale | NRa | NRa |
| Irinotecan | Oncologia | NRa | NRa |
| Tioguanina | Immunosoppressore | NRa | NRa |
Le varianti farmacogenetiche sono considerate utilizzabili solo se i portatori sono esposti ai farmaci associati. Nel nostro studio, 7 769 359 veterani che hanno ricevuto cure nel VHA avevano almeno 1 record di farmaci, e di questi utilizzatori di farmaci VHA, 4 259 153 (54,8%) avevano almeno 1 record per un farmaco di livello A (Tabella 2). Il farmaco di livello A più comune prescritto nel sistema VHA era la simvastatina, prescritta a 1-925 veterani (24,8%), e l’esposizione a più farmaci di livello A era frequente (Figura 1A).Durante lo studio, 2-943-872 veterani (37,9%) hanno ricevuto una nuova prescrizione per un farmaco di livello A, il più frequente è stato il tramadolo, prescritto a 923-671 veterani (11,9%). Inoltre, una parte sostanziale dei nuovi destinatari di un farmaco di livello A ha ricevuto nuove prescrizioni per più farmaci di livello A nello stesso anno: 726 502 (24,7%) hanno ricevuto nuove prescrizioni per 2 farmaci di livello A e 356 685 (12,1%) hanno ricevuto 3 o più farmaci di livello A (Figura 1B).Le combinazioni di farmaci più frequenti comprendevano oppioidi, agenti oncologici, simvastatina, antidepressivi e clopidogrel(Figura 1C).
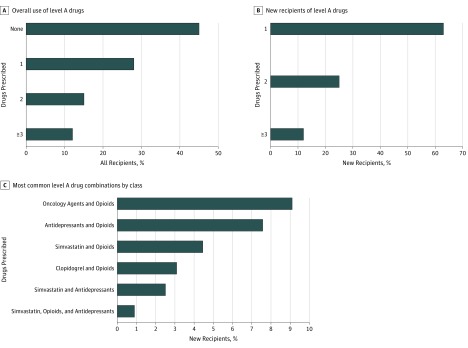
Figura 1.Uso di farmaci di livello A e combinazioni tra gli utenti delle farmacie dell’amministrazione sanitaria veterinaria dal 1° ottobre 2011 al 30 settembre 2017A, Percentuale di utenti di farmacie della Veterans Health Administration che hanno prescritto 1 o più farmaci di livello A. B, Percentuale dei consumatori di farmaci della Veterans Health Administration che hanno ricevuto una nuova prescrizione di 1 o più farmaci di livello A. C, Percentuale dei nuovi destinatari di farmaci che ricevono le più comuni combinazioni di farmaci di livello A per classi di farmaci.
Abbiamo stimato la percentuale di individui potenzialmente a rischio di esiti avversi secondari ad un’interazione gene-farmaco, determinando la prevalenza di genotipi utilizzabili nei pazienti esposti a 1 dei 10 farmaci di livello A più importanti(Figura 2) (eTabella 8 nel Supplemento). Ad esempio, tra i 923-671 veterani che hanno appena ricevuto tramadolo per analgesia, 82-092 (8,9%) sono proiettati ad avere una risposta inadeguata alla terapia. Tra i 533-928 pazienti cui è stata recentemente prescritta la simvastatina, si stima che 136-599 (25,6%) siano portatori della variante rs4149056 in SLCO1B1, che li metterebbe a rischio di miopatia indotta dalla simvastatina, e a 32010 riceventi di simvastatina con genotipi attivabili previsti è stata prescritta una dose iniziale di 80 mg, che li metterebbe a più alto rischio (eTabella 8 nel supplemento).
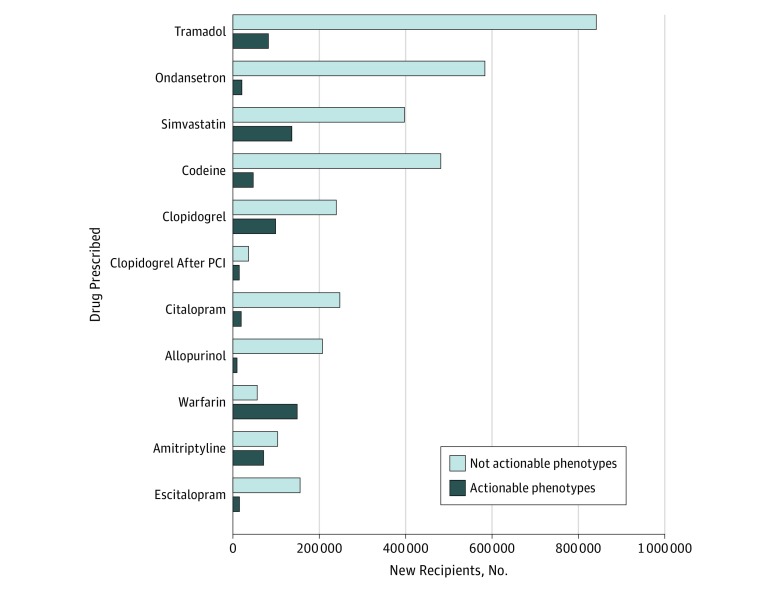
Figura 2.Figura 2. Numero di nuovi destinatari previsti di nuovi farmaci con fenotipi attivabili e non attivabili per i primi 10 farmaci di livello AProiezioni basate sul numero di utenti di farmacie della Veterans Health Administration che riceveranno una nuova prescrizione per ogni farmaco dal 1° ottobre 2011 al 30 settembre 2017. I numeri sono presentati per tutti i pazienti che ricevono il clopidogrel e per i pazienti che ricevono il clopidogrel dopo un intervento coronarico percutaneo (PCI) a causa del maggiore impatto clinico della variante farmacogenetica per questa indicazione.
Per valutare l’effetto clinico di un particolare genotipo sulla risposta al farmaco, è importante considerare sia la traduzione dal genotipo ai fenotipi farmacogenetici sia le caratteristiche farmacologiche del farmaco. La Figura 3 descrive il numero di veterani esposti ai farmaci nella nostra lista dei primi 10 farmaci di livello A e ad alto rischio di fallimento terapeutico o di effetti tossici. Per farmaci come la codeina, il citocromo P450 2D6, codificato dal CYP2D6, converte la codeina in morfina, un metabolita con un’attività maggiore rispetto al farmaco genitore. Tra i 528-159 veterani che hanno prescritto farmaci contenenti codeina, 18486 (3,5%) sono stati previsti come metabolizzatori ultrarapidi CYP2D6 e ad alto rischio di effetti tossici, e 28-521 (5,4%) sono stati stimati come metabolizzatori poveri di CYP2D6 e potrebbero non ricevere benefici terapeutici. Tra i 215 veterani a cui è stato prescritto l’allopurinolo, si stima che 8172 (3,8%) siano portatori dell’allele HLA-B*58:01, che aumenta il rischio di gravi reazioni avverse cutanee, tra cui la sindrome di Stevens-Johnson e la necrolisi epidermica tossica. Inoltre, si stima che 116-151 veterani (66,6%) di origine europea siano portatori di varianti genetiche che potrebbero aiutare a guidare il dosaggio del warfarin, aumentando il potenziale di efficacia del farmaco e diminuendo il rischio di effetti tossici (eTabella 10 nel supplemento ); anche i veterani di origine africana sono suscettibili di avere varianti che potrebbero guidare il dosaggio, sebbene diverse varianti possano influenzare la risposta del warfarin in questa popolazione.22,23 Pertanto, i test farmacogenetici possono essere utilizzati clinicamente per prevedere un’ampia gamma di effetti terapeutici.
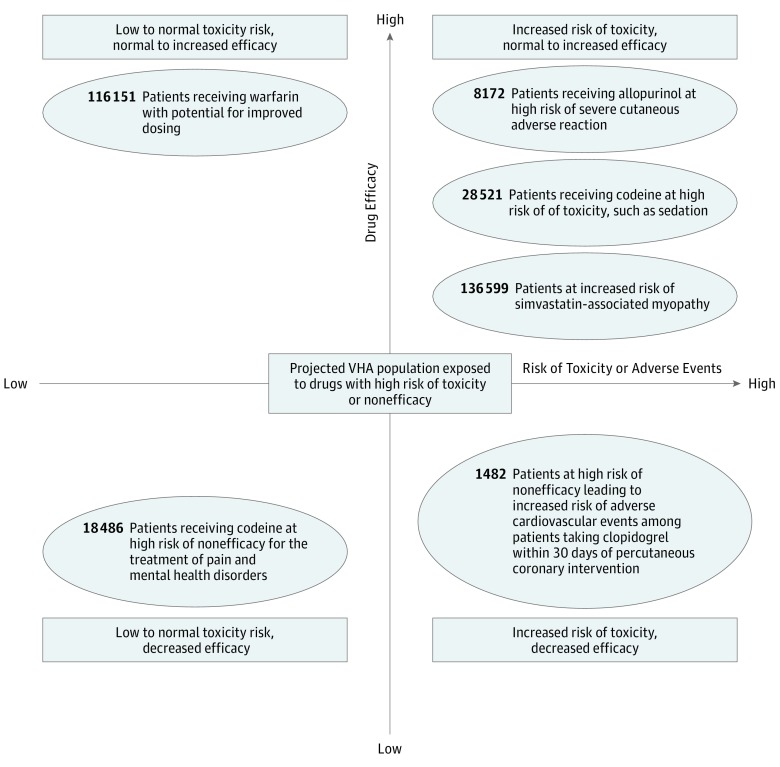
Figura 3.Figura 3. Popolazione prevista della Veterans Health Administration (VHA) Esposta a un farmaco ad alto rischio di effetti tossici o di inefficacia dal 1° ottobre 2011 al 30 settembre 2017Sono inclusi i farmaci con un forte livello A, che raccomandano di evitare o di regolare la dose in base ai risultati dei test farmacogenetici disponibili. L’asse delle ascisse descrive il rischio crescente di effetti tossici o reazioni avverse ai farmaci in risposta all’esposizione ai farmaci per pazienti con fenotipi selezionati. L’asse y descrive lo spettro dell’efficacia prevista del farmaco per i pazienti con fenotipi selezionati – quelli con determinati fenotipi sono a più alto rischio di non risposta al farmaco. Il numero di pazienti che si prevede saranno portatori della variante genetica o del fenotipo specifico si basa sul numero di nuovi destinatari del farmaco dal 1° ottobre 2011 al 30 settembre 2017.

Figura 1.Uso di farmaci di livello A e combinazioni tra gli utenti della Farmacia dell’Amministrazione Sanitaria Veterinaria dal 1° ottobre 2011 al 30 settembre 2017A, Percentuale di utenti di farmacie della Veterans Health Administration che hanno prescritto 1 o più farmaci di livello A. B, Percentuale dei consumatori di farmaci della Veterans Health Administration che hanno ricevuto una nuova prescrizione di 1 o più farmaci di livello A. C, Percentuale dei nuovi destinatari di farmaci che ricevono le più comuni combinazioni di farmaci di livello A per classi di farmaci.

Figura 2.Figura 2. Numero previsto di nuovi destinatari di nuovi farmaci con fenotipi attivabili e non attivabili per i primi 10 farmaci di livello AProiezioni basate sul numero di utenti di farmacie della Veterans Health Administration che riceveranno una nuova prescrizione per ogni farmaco dal 1° ottobre 2011 al 30 settembre 2017. I numeri sono presentati per tutti i pazienti che ricevono il clopidogrel e per i pazienti che ricevono il clopidogrel dopo un intervento coronarico percutaneo (PCI) a causa del maggiore impatto clinico della variante farmacogenetica per questa indicazione.

Figura 3.Figura 3. Popolazione prevista della Veterans Health Administration (VHA) esposta a un farmaco ad alto rischio di effetti tossici o di inefficacia dal 1° ottobre 2011 al 30 settembre 2017Sono inclusi i farmaci con un forte livello A, che raccomandano di evitare o di regolare la dose in base ai risultati dei test farmacogenetici disponibili. L’asse delle ascisse descrive il rischio crescente di effetti tossici o reazioni avverse ai farmaci in risposta all’esposizione ai farmaci per pazienti con fenotipi selezionati. L’asse y descrive lo spettro dell’efficacia prevista del farmaco per i pazienti con fenotipi selezionati – quelli con determinati fenotipi sono a più alto rischio di non risposta al farmaco. Il numero di pazienti che si prevede saranno portatori della variante genetica o del fenotipo specifico si basa sul numero di nuovi destinatari del farmaco dal 1° ottobre 2011 al 30 settembre 2017.
Discussione
A nostra conoscenza, questo è il primo studio che fornisce una stima affidabile del numero di veterani che potrebbero trarre beneficio dall’implementazione di test farmacogenetici nelle cure cliniche. Quasi tutti i veterani sono portatori di almeno 1 variante genetica che potrebbe influenzare le decisioni di farmacoterapia se venisse loro prescritto un farmaco di livello A. Inoltre, più di un terzo dei 7,8 milioni di veterani che hanno ricevuto farmaci dalla farmacia del VHA dal 1° ottobre 2011 al 30 settembre 2017, hanno ricevuto una nuova prescrizione di almeno 1 farmaco di livello A. Questi farmaci comprendono classi di farmaci comunemente prescritti in contesti di cure primarie, come le statine, gli analgesici oppiacei e gli antidepressivi. Tra i nuovi destinatari dei farmaci di livello A, al 38% è stato prescritto più di 1 farmaco di livello A, il che suggerisce che un test iniziale per un gruppo di varianti farmacogenetiche rilevanti può informare le decisioni di farmacoterapia durante l’intero ciclo di cura nel PCA. Questo studio fornisce informazioni che possono aiutare la leadership dei PMA a sviluppare una strategia e un quadro di riferimento per l’implementazione clinica completa delle linee guida CPIC.
I nostri risultati sono in gran parte coerenti con 2 studi precedenti che hanno quantificato l’associazione delle informazioni farmacogenetiche con i risultati nei grandi sistemi sanitari.24,25 Uno studio del 2012 di Schildcrout et al.24 ha mostrato che tra 52-942 partecipanti che hanno ricevuto almeno 1 dei 56 farmaci con associazioni farmacogenetiche elencati sulle etichette dei farmaci dalla Food and Drug Administration, al 65% è stato prescritto almeno 1 farmaco per un periodo di 5 anni e al 12% ne sono stati prescritti 4 o più. Sulla base della probabilità di 6 eventi avversi gravi selezionati, circa 400 eventi erano potenzialmente prevenibili con test farmacogenetici preventivi, e i farmaci associati al rischio maggiore comprendevano clopidogrel, abacavir, azatioprina, simvastatina, tamoxifene e warfarin. L’esposizione ai farmaci nello studio di Schildcrout et al.24 era più alto rispetto al nostro studio perché hanno usato un elenco più ampio di farmaci, mentre ci siamo concentrati sui 30 farmaci con il più alto livello di evidenza (CPIC livello A). A causa di questa differenza, le nostre stime potrebbero sottovalutare la prescrizione di farmaci con livelli di evidenza più bassi o di nuove prove emergenti associate a varianti farmacogenetiche. Uno studio del 2016 di Samwald et al.25 che ha esaminato circa 73 milioni di cartelle cliniche di pazienti arruolati in assicurazioni private, Medicare Supplemental, o Medicaid durante un periodo di 4 anni ha rilevato che metà della popolazione aveva ricevuto almeno 1 farmaco affetto da varianti farmacogenetiche, mentre un terzo aveva ricevuto 2 o più farmaci. Queste stime sono coerenti con il nostro studio sulla popolazione di VHA. Questi risultati suggeriscono che l’esposizione a più farmaci affetti da varianti farmacogenetiche è comune nella popolazione e che i test per un panel di varianti farmacogenetiche possono aiutare a prevenire gravi eventi avversi.
Esistono 2 modelli principali che potrebbero essere utilizzati per testare i pazienti per le varianti farmacogenetiche. In primo luogo, i pazienti potrebbero essere testati in modo reattivo, quando il clinico considera di ordinare un farmaco con farmacogenetica attivabile. Se da un lato questo sistema consente ai medici di scegliere test farmacogenetici con livelli di evidenza più elevati e su misura per il paziente, dall’altro presenta anche diverse limitazioni. I medici devono essere pronti e in grado di ordinare i test, e i risultati dei test devono essere restituiti in modo tempestivo per evitare ritardi nella prescrizione.26
Un’alternativa a questo modello è il test preventivo. Diversi centri hanno lanciato programmi di test farmacogenetici preventivi che si rivolgono a pazienti che potrebbero ricevere farmaci influenzati da varianti farmacogenetiche.27,28,29,30,31 Il vantaggio di questo approccio è che la genotipizzazione viene eseguita prima che il farmaco sia necessario, e i risultati sono memorizzati nella EHR e disponibili al momento della prescrizione. L’Università di Vanderbilt ha incorporato i risultati farmacogenetici preventivi nel sistema EHR per 5 coppie gene-farmaci: CYP2C19 con clopidogrel, CYP2C9 o VKORC1 con warfarin, SLCO1B1 con simvastatina, TPMT con tiopurine e CYP3A5 con tacrolimus.4 Le varianti clinicamente attivabili innescano un sistema di supporto alle decisioni cliniche nell’EHR per guidare la selezione e il dosaggio dei farmaci. Analogamente, la Mayo Clinic offre test farmacogenetici preventivi( genotipizzazioneCYP2D6 e sequenziamento mirato di 84 geni farmacogenetici) ai partecipanti alla biobanca con un’alta probabilità di iniziare un trattamento con statina entro 3 anni.29 In questo sistema, il supporto alle decisioni cliniche in tempo reale integrato nella EHR segnala le interazioni gene-farmaci specifici e fornisce raccomandazioni farmacoterapiche. Questo sistema tiene conto della complessità delle informazioni, poiché diverse varianti geniche possono influenzare gli stessi farmaci (ad esempio, CYP2C9 o VKORC1 con warfarin) o una singola variante può influenzare la risposta a diversi farmaci (ad esempio, CYP2C19 con clopidogrel o escitalopram). Una sfida è la capacità degli strumenti di supporto alle decisioni cliniche di rimanere aggiornati con la base di conoscenza emergente man mano che diventano disponibili più prove e linee guida e i modelli di prescrizione cambiano.32
Il VHA è stato in prima linea nell’adozione di innovazioni della medicina di precisione nella cura clinica dei veterani. Ad esempio, il sequenziamento di prossima generazione è offerto ai veterani con diagnosi di cancro,33 e il test farmacogenetico dell’allele HLA-B*57:01 prima di prescrivere l’abacavir è già uno standard di cura. Il nostro studio suggerisce che un’ulteriore espansione dei test farmacogenetici potrebbe beneficiare molti veterani e dovrebbe essere presa in considerazione per la prossima implementazione della medicina genomica nel VHA. Poiché il VHA è in fase di implementazione di una nuova EHR, la tempistica dell’implementazione farmacogenetica clinica potrebbe essere ideale. La creazione di una solida pipeline informatica che colleghi i risultati dei test farmacogenetici dal laboratorio alla farmacia per segnalare le interazioni gene-farmaci faciliterebbe la selezione e la dose appropriata dei farmaci somministrati dai farmacisti. La piena integrazione dei risultati dei test farmacogenetici di laboratorio e dei dati della farmacia potrebbe ridurre notevolmente gli eventi avversi gravi causati dalle interazioni gene-farmaci. Esiste già una partnership tra medicina di laboratorio e farmacia per il trattamento dell’epatite C per guidare l’uso di nuovi farmaci antivirali ad azione diretta informati dalla genetica virale. Nel 2014 i laboratori VHA hanno iniziato ad eseguire test di resistenza e, in collaborazione con il dipartimento di farmacia, più di 50.000 veterani sono stati testati e trattati con successo per l’epatite C in un periodo di 2 anni.34 Dal punto di vista della tecnologia dei laboratori clinici, non sarebbe difficile espandere le capacità dalla genetica virale alla farmacogenetica.
Il VHA è anche leader internazionale nella ricerca sulla medicina genomica con il Million Veteran Program.35 Più di 700.000 veterani sono stati sottoposti a valutazione genomica su un array di genotipizzazione personalizzato,35 che contiene diverse delle stesse varianti farmacogenetiche clinicamente attivabili descritte nel nostro studio. Si prevede che le informazioni farmacogenetiche di questa coorte rappresentativa, combinate con i dati di EHR e di farmacia, colmino una lacuna nell’evidenza dell’impatto farmacogenetico in diverse popolazioni. Tuttavia, affinché questi dati possano essere utilizzati per l’assistenza clinica, dovrebbero essere convalidati e restituiti ai pazienti e ai medici, poiché sono stati raccolti come ricerca. Inoltre, l’array di genotipi utilizzato nel Million Veteran Program non cattura tutte le varianti farmacogenetiche rilevanti, come le variazioni del numero di copie del CYP2D6. Pertanto, altre opzioni tecnologiche potrebbero essere più adatte ad offrire una piattaforma personalizzata per i test farmacogenetici ai veterani nel momento in cui viene prescritto un farmaco di livello A.
Limitazioni
Vanno segnalate diverse limitazioni all’analisi. La prevalenza delle varianti farmacogenetiche è stata proiettata utilizzando i dati del Progetto 1000 Genomi piuttosto che direttamente saggiata. C’è una carenza di informazioni farmacogenetiche nelle popolazioni minoritarie e sono necessari ulteriori studi nelle popolazioni afroamericane e nelle popolazioni ispaniche non bianche.36,37,38 La nostra analisi si è limitata alla valutazione delle varianti comuni nei gruppi di antenati europei e africani, anche se le nostre analisi di sensibilità hanno mostrato proiezioni simili quando si utilizzano popolazioni diverse (eTable 6 nel supplemento). La contabilizzazione dei veterani di etnia ispanica utilizzando le frequenze delle varianti farmacogenetiche riportate per le popolazioni delle Americhe non ha influito in modo significativo sulle nostre stime di popolazione (eTabella 6 nel Supplemento); tuttavia, è probabile che sia una scarsa proxy per approssimare la prevalenza nella diversa popolazione ispanica statunitense, in cui si osservano ampie variazioni nella commistione delle ascendenze indigene americane, europee, africane e asiatiche per regione di origine.39,40,41,42 Data la nostra attenzione alla stima basata sulla popolazione, potremmo non aver colto l’impatto di varianti rare. Le analisi future e gli sforzi di implementazione clinica dovranno tenere conto delle mutevoli caratteristiche demografiche dei PTA nel tempo e la genotipizzazione clinica dovrà tenere conto delle varianti specifiche degli antenati che influenzano la risposta ai farmaci. Non abbiamo esaminato i risultati associati alla prescrizione di farmaci di livello A nei veterani con varianti ad alto rischio; studi futuri che utilizzeranno i dati del Million Veteran Program saranno pronti ad affrontare questa limitazione. I dati sui farmaci sono stati limitati alla farmacia del PSA e non catturano le prescrizioni ricevute in contesti di assistenza comunitaria, né abbiamo raccolto dati sull’uso di farmaci a distanza. Inoltre, il panorama dell’esposizione ai farmaci sta cambiando rapidamente e questa analisi riflette la prescrizione di farmaci di livello A utilizzati prevalentemente presso la VHA per lo studio. Anche se non abbiamo riportato tendenze nel tempo, sappiamo che l’uso di warfarin è diminuito all’interno del VHA, poiché l’uso di anticoagulanti orali ad azione diretta è aumentato; tuttavia, è improbabile che la prescrizione di warfarin venga completamente sostituita. I nostri risultati sono cambiati solo leggermente quando abbiamo escluso il warfarin dall’analisi, con una diminuzione dell’1,6% del numero di pazienti che hanno ricevuto un farmaco di livello A, una diminuzione del 2,3% del numero di nuovi pazienti che hanno ricevuto un farmaco di livello A e la percentuale prevista di pazienti con almeno una variante attivabile passa dal 99,4% al 97,6%. Con l’aumento della popolarità dei nuovi farmaci, saranno necessarie revisioni per adeguarsi al cambiamento della prevalenza delle interazioni gene-farmaci e l’aggiunta di nuovi test farmacogenetici. Crediamo che l’effetto sarà maggiore in futuro, man mano che impareremo di più sulle interazioni gene-farmaci aggiuntive. Speriamo e ci aspettiamo di saperne di più soprattutto sulle interazioni gene-farmaci rilevanti per le popolazioni di minoranza.38 Tra gli attuali lavori CPIC in corso, un’espansione delle linee guida sugli oppioidi e il rilascio di linee guida sulle interazioni del CYP2C19 con gli inibitori della pompa protonica e del CYP2C9 con il celecoxib avranno probabilmente un effetto sulla popolazione dei veterani. Considerate le conoscenze in via di sviluppo sulle varianti farmacogenetiche, le nostre stime sono probabilmente prudenti e altri veterani potrebbero beneficiare in futuro di test farmacogenetici oltre a quelli inclusi in questo studio.
Conclusioni
Abbiamo stimato che le varianti farmacogenetiche clinicamente importanti sono altamente prevalenti nella popolazione di PTA. Quasi tutti i veterani sarebbero portatori di una variante farmacogenetica attivabile, e più della metà della popolazione è stata esposta a un farmaco che potrebbe essere influenzato da queste varianti entro il periodo di 6 anni. Questi risultati suggeriscono che i test farmacogenetici preventivi hanno il potenziale di influenzare le decisioni di farmacoterapia per la maggior parte dei veterani; tuttavia, è necessario quantificare la misura in cui questa strategia ridurrà il rischio di eventi avversi e minimizzerà gli insuccessi terapeutici nella popolazione dei veterani. Questi risultati non suggeriscono che la farmacogenetica debba sostituire le attuali strategie di monitoraggio della risposta ai farmaci (ad esempio, il rapporto internazionale normalizzato per il warfarin) o di adattamento delle terapie (ad esempio, la funzione renale o epatica), ma piuttosto che l’integrazione dei risultati farmacogenetici all’interno dell’EHR offre un’ulteriore promettente strada per migliorare i risultati e la sicurezza dei farmaci influenzati da queste varianti.
References
- Pharmacogenomics knowledge for personalized medicine. Clin Pharmacol Ther. 2012; 92(4)DOI | PubMed
- Pharmacogenomics in the clinic. Nature. 2015; 526(7573):343-350. DOI | PubMed
- Table of pharmacogenomic biomarkers in drug labeling.Publisher Full Text
- Clinically actionable genotypes among 10,000 patients with preemptive pharmacogenomic testing. Clin Pharmacol Ther. 2014; 95(4):423-431. DOI | PubMed
- Genetic variation among 82 pharmacogenes: the PGRNseq data from the eMERGE network. Clin Pharmacol Ther. 2016; 100(2):160-169. DOI | PubMed
- Preemptive pharmacogenomic testing for precision medicine: a comprehensive analysis of five actionable pharmacogenomic genes using next-generation DNA sequencing and a customized CYP2D6 genotyping cascade. J Mol Diagn. 2016; 18(3):438-445. DOI | PubMed
- Cost-effectiveness of pharmacogenetic-guided treatment: are we there yet?. Pharmacogenomics J. 2017; 17(5):395-402. DOI | PubMed
- The Pharmacogenomics Research Network Translational Pharmacogenetics Program: overcoming challenges of real-world implementation. Clin Pharmacol Ther. 2013; 94(2):207-210. DOI | PubMed
- CPIC: Clinical Pharmacogenetics Implementation Consortium of the Pharmacogenomics Research Network. Clin Pharmacol Ther. 2011; 89(3):464-467. DOI | PubMed
- The clinical pharmacogenomics implementation consortium: CPIC guideline for SLCO1B1 and simvastatin-induced myopathy. Clin Pharmacol Ther. 2012; 92(1):112-117. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy: 2013 update. Clin Pharmacol Ther. 2013; 94(3):317-323. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium guidelines for cytochrome P450 2D6 genotype and codeine therapy: 2014 update. Clin Pharmacol Ther. 2014; 95(4):376-382. DOI | PubMed
- VA benefits and health care utilization.Publisher Full Text
- San Francisco, CA.
- Mapping the incidentalome: estimating incidental findings generated through clinical pharmacogenomics testing. Genet Med. 2013; 15(5):325-331. DOI | PubMed
- A map of human genome variation from population-scale sequencing. Nature. 2010; 467(7319):1061-1073. DOI | PubMed
- A global reference for human genetic variation. Nature. 2015; 526(7571):68-74. DOI | PubMed
- Ensembl 2018. Nucleic Acids Res. 2018; 46(D1):D754-D761. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for pharmacogenetics-guided warfarin dosing: 2017 update. Clin Pharmacol Ther. 2017; 102(3):397-404. DOI | PubMed
- CYP2D6 copy number distribution in the US population. Pharmacogenet Genomics. 2016; 26(2):96-99. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for IFNL3 (IL28B) genotype and PEG interferon-α-based regimens. Clin Pharmacol Ther. 2014; 95(2):141-146. DOI | PubMed
- A randomized trial of genotype-guided dosing of warfarin. N Engl J Med. 2013; 369(24):2294-2303. DOI | PubMed
- Effect of genotype-guided warfarin dosing on clinical events and anticoagulation control among patients undergoing hip or knee arthroplasty: the GIFT randomized clinical trial. JAMA. 2017; 318(12):1115-1124. DOI | PubMed
- Optimizing drug outcomes through pharmacogenetics: a case for preemptive genotyping. Clin Pharmacol Ther. 2012; 92(2):235-242. DOI | PubMed
- Incidence of exposure of patients in the United States to multiple drugs for which pharmacogenomic guidelines are available. PLoS One. 2016; 11(10):e0164972. DOI | PubMed
- Preemptive panel-based pharmacogenetic testing: the time is now. Pharm Res. 2017; 34(8):1551-1555. DOI | PubMed
- Preemptive clinical pharmacogenetics implementation: current programs in five US medical centers. Annu Rev Pharmacol Toxicol. 2015; 55:89-106. DOI | PubMed
- Operational implementation of prospective genotyping for personalized medicine: the design of the Vanderbilt PREDICT project. Clin Pharmacol Ther. 2012; 92(1):87-95. DOI | PubMed
- Preemptive genotyping for personalized medicine: design of the right drug, right dose, right time-using genomic data to individualize treatment protocol. Mayo Clin Proc. 2014; 89(1):25-33. DOI | PubMed
- The CLIPMERGE PGx Program: clinical implementation of personalized medicine through electronic health records and genomics-pharmacogenomics. Clin Pharmacol Ther. 2013; 94(2):214-217. DOI | PubMed
- Prerequisites to implementing a pharmacogenomics program in a large health-care system. Clin Pharmacol Ther. 2014; 96(3):307-309. DOI | PubMed
- Electronic medical record-integrated pharmacogenomics and related clinical decision support concepts. Clin Pharmacol Ther. 2017; 102(2):254-264. DOI | PubMed
- VA Precision Oncology Program to be expanded nationally.Publisher Full Text
- VA expands hepatitis C drug treatment.Publisher Full Text
- Million Veteran Program: a mega-biobank to study genetic influences on health and disease. J Clin Epidemiol. 2016; 70:214-223. DOI | PubMed
- The future of warfarin pharmacogenetics in under-represented minority groups. Future Cardiol. 2012; 8(4):563-576. DOI | PubMed
- Cardiovascular pharmacogenomics: does it matter if you’re black or white?. Annu Rev Pharmacol Toxicol. 2019; 59:577-603. DOI | PubMed
- The ACCOuNT Consortium: a model for the discovery, translation, and implementation of precision medicine in African Americans. Clin Transl Sci.PubMed
- Estimating ancestral proportions in a multi-ethnic US sample: implications for studies of admixed populations. Hum Genomics. 2012; 6:2. DOI | PubMed
- The genetic ancestry of African Americans, Latinos, and European Americans across the United States. Am J Hum Genet. 2015; 96(1):37-53. DOI | PubMed
- Characterizing race/ethnicity and genetic ancestry for 100,000 subjects in the Genetic Epidemiology Research on Adult Health and Aging (GERA) cohort. Genetics. 2015; 200(4):1285-1295. DOI | PubMed
- The genetic diversity of the Americas. Annu Rev Genomics Hum Genet. 2017; 18:277-296. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium (CPIC) Guidelines for CYP3A5 genotype and tacrolimus dosing. Clin Pharmacol Ther. 2015; 98(1):19-24. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for rasburicase therapy in the context of G6PD deficiency genotype. Clin Pharmacol Ther. 2014; 96(2):169-174. DOI | PubMed
- Clinical Pharmacogenetics Implementation Consortium Guideline for HLA genotype and use of carbamazepine and oxcarbazepine: 2017 update. Clin Pharmacol Ther. 2018; 103(4):574-581. DOI | PubMed
Fonte
Chanfreau-Coffinier C, Hull LE, Lynch JA, DuVall SL, Damrauer SM, et al. (2019) Projected Prevalence of Actionable Pharmacogenetic Variants and Level A Drugs Prescribed Among US Veterans Health Administration Pharmacy Users. JAMA Network Open 2(6): e195345. https://doi.org/10.1001/jamanetworkopen.2019.5345





