Una delle più importanti storie di successo evolutivo nelle piante è lo sviluppo di semi racchiusi nel tessuto materno, come le pareti di frutta e i manti di semi.1 Questi strati protettivi esterni possono mostrare una notevole durezza e resistenza, che ha attirato una notevole attenzione in relazione alla loro microstruttura, in particolare con l’obiettivo di sviluppare materiali biomimetici.2, 3, 4 In questo studio, riveliamo la micro e nanostruttura 3D del guscio di noce nel corso del suo sviluppo, dallo stato morbido a quello duro. Oltre alle indagini al microscopio elettronico e alla luce, le visualizzazioni 3D del tessuto e delle singole cellule chimicamente isolate sono state la chiave per identificare la nuova morfologia cellulare e il suo confezionamento ad incastro.
Sulla microscala, il guscio della noce(Juglans regia) è caratterizzato da un tessuto denso, in cui le singole cellule e la loro forma sono difficili da identificare – anche a maggiore ingrandimento (Figura1a). Solo nella parte interna del guscio (in basso nell’immagine) la struttura tissutale è più sciolta e sono visibili le cellule a parete sottile: piccole tondeggianti insieme a quelle molto grandi e lobi irregolari (Figura 1a). Prima della maturità (raccolto in luglio, giugno e maggio), il guscio di noce in via di sviluppo è circondato da una buccia verde (Figura 1b) e possiede una struttura tissutale sciolta in tutto il guscio. Nel mese di luglio, la struttura del tessuto polilobato è chiaramente visibile e con una circolarità di 0,43 simile a quella di ottobre. Nel mese di giugno, le cellule più piccole con meno lobi (circolarità = 0,49) dominano e le cellule nelle noci più giovani e più piccole (campionate a maggio) non avevano ancora sviluppato lobi (Figura 1b). La forma poligonale delle cellule all’inizio dello sviluppo del guscio di noce assomiglia di più alla forma delle cellule in un mantello di semi di pino maturo(Pinus koraiensis) (Figura 1c). Tuttavia, le cellule hanno pareti spesse come tipico per le cellule sclerenchimatiche e si trovano in tutto il mantello del seme come l’unico tipo di cellula (Figura 1c). Altri gusci di noce, come Macadamia, mostrano oltre alle cellule isodiametriche dello sclerenchima anche cellule fibrose.2, 3, 4, 5 Ciò che tutte le cellule sclereidi hanno in comune è una struttura a più strati della parete cellulare,4, 5 che apparentemente deriva da una disposizione elicoidale delle microfibrille di cellulosa.6

Figura 1.Struttura del tessuto del guscio di noce e del mantello dei semi di pino. a) La noce matura, raccolta in ottobre, mostra un guscio marrone e completamente sviluppato. La microsezione colorata di blu di toluidina rivela uno strato esterno denso e uno strato interno con cellule a parete sottile, che mostra la forma delle cellule polilobate. b) Le fasi di sviluppo di una noce con forte aumento del frutto da maggio a luglio. La forma polilobata in giugno e luglio con alta circolarità deriva da una forma cellulare regolare e la disposizione delle cellule in maggio. c) In confronto, la struttura del tessuto denso da un manto di semi di pino maturo con cellule nonlobate.
Al fine di indagare la forma delle cellule in modo più dettagliato, le singole cellule sono state isolate dal composito tissutale mediante rimozione della lignina (macerazione) e riprese al microscopio a scansione laser confocale (CLSM; Figura2a, Film S1, Informazioni di supporto) e microscopia elettronica (Figura S1, Informazioni di supporto). Due cellule polilobate sono visualizzate in profondità diverse: diverse fette della pila z mostrano chiaramente che si tratta di cellule singole con lobi (Figura 2a, 3-4); mentre, altre fette attraverso i lobi potrebbero dare una falsa impressione di essere cellule singole (Figura 2a 1-2 ,5-6). Sulla base della pila z, è stato ricostruito un modello delle due cellule polilobate, che mostra, oltre ai lobi, che molti pori perforano la parete cellulare (Figura 2a). Questi pori svolgono un ruolo essenziale per lo scambio di composti chimici durante la crescita e lo sviluppo. Più sottile è la parete cellulare (fase iniziale, parte interna), più grandi sono i pori (Figura 2a, cella superiore destra rispetto alla cella più spessa parete nell’angolo sinistro).
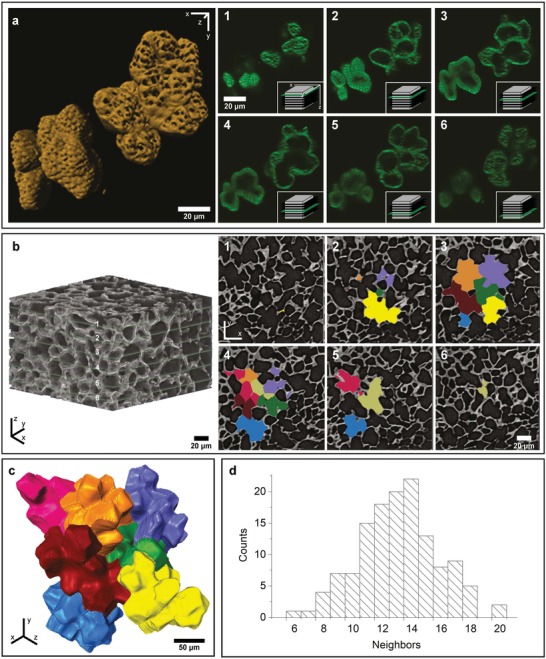
Figura 2.Figura 2. Visualizzazione 3D delle cellule di noce da CLSM e nano-CT. a) Sei fette esemplari della scansione CLSM (100 fette, vedi anche il filmato S1 nelle informazioni di supporto) di due singole cellule, colorate con Calcofluor White. Le due celle mostrano una differenza nello spessore della parete cellulare (meglio vedere in 2 e 3). Le icone in basso a destra mostrano la posizione della fetta nella pila. Ricostruzione 3D della stessa scansione CLSM, che rivela la forma lobata delle singole cellule e l’elevato numero di pori, che sono più grandi nella parete sottile (cella in alto a destra) rispetto alla cella a parete più spessa (in basso a sinistra). b) Orientamento e disposizione del pezzo di guscio, che consiste di 170 fette in direzione z; sei fette sono contrassegnate in verde e mostrate sulla destra (1-6). Le aree colorate indicano le singole cellule utilizzate per la segmentazione e la ricostruzione digitale. c) Ricostruzione 3D delle cellule segmentate, mostrando l’interblocco tra le cellule vicine (vedi anche il filmato S2 nelle Informazioni di supporto). d) La distribuzione delle cellule vicine dopo l’analisi delle aree di contatto tra le singole cellule dopo la ricostruzione 3D.
La disposizione 3D di queste cellule polilobate è confermata dalla nanotomografia a raggi X del guscio. Le cellule segmentate (Figura 2b) assomigliano alle cellule epidermiche a forma di puzzle 2D di foglie di Arabidopsis thaliana e cotiledoni.7, 8, 9 Tuttavia, quando le cellule segmentate sono ricostruite, il puzzle si rivela per la prima volta in 3D (Figura 2c). Ognuna delle cellule polilobate è in media intrecciata con 14 cellule vicine (Figura 2de Movie S2, Supporting Information).
Sulla base del numero di vicini più vicini (Figura 2d) e delle cellule osservate nelle prime fasi di sviluppo (Figura 1b), suggeriamo che le cellule hanno inizialmente iniziato a formare una disposizione simile ad una configurazione tetrakaidecaedro, utilizzata anche per descrivere e modellare i solidi cellulari.10 I processi che sono alla base della formazione delle cellule di puzzle nelle foglie di Arabidopsis e nei cotiledoni sono stati un argomento di ricerca caldo negli ultimi 2 decenni, ad esempio7, 8, 9. Il beneficio funzionale della forma complessa del guscio è rimasto elusivo. Tuttavia, è stato recentemente proposto che queste forme intricate forniscano una strategia efficace per ridurre lo stress meccanico nella parete cellulare dell’epidermide.8 È stato dimostrato che la forma della cellula influenza la direzione e l’entità delle sollecitazioni meccaniche esercitate sulla parete cellulare, e che la forza motrice della complessa forma a puzzle ha origine dalla restrizione della crescita nelle rientranze piuttosto che dalla promozione della crescita nelle sporgenze.8 Per comprendere lo sviluppo della complessa struttura a forma di puzzle 3D nei gusci di noce a partire dai primi principi, saranno necessari studi sulle traiettorie dei microtubuli e sull’orientamento della cellulosa nelle prime fasi dello sviluppo, nonché la modellazione della crescita. Se lo stress meccanico e il vincolo sono i due principali fattori trainanti, le traiettorie di fabbricazione biomimetiche potrebbero essere derivate utilizzando componenti di materiale gonfiabile.
Per quantificare come la presenza di lobi influisce sulle prestazioni meccaniche, sono stati scelti per il confronto i manti di semi di pino. Questa selezione si basa su uno “screening sclerenchima”, che ha mostrato che il mantello di semi di pino è anche composto da cellule di sclerenchima a pareti spesse solo, tuttavia, senza lobi (Figura 1c). Per una descrizione matematica delle differenze, il rapporto tra volume e superficie è stato calcolato in base ai dati della tomografia a raggi X per le cellule di noce dei campioni di luglio e ottobre e confrontato con le cellule di pino (Figura1c).3a). La forma cellulare polilobata del guscio della noce implica una superficie superiore del 30-40% rispetto alla forma cellulare poligonale del mantello dei semi di pino. Questi ultimi si avvicinano alla linea di tendenza del tetrakaidecaedro (Figura 3a), che può essere vista come la forma di base per l’imballaggio dei tessuti con 14 facce. I test micromeccanici del guscio di noce hanno portato a una maggiore dispersione dei dati rispetto al mantello di semi di pino (Figura 3b). Ciò si spiega con il fatto che nel campione di noce testato erano presenti diverse proporzioni del tessuto interno meno denso, mentre lo strato di semi di pino era uniforme in termini di densità (Figura 1, Figura 3c,d). I test meccanici dei gusci di noce hanno dato un modulo di Young mediano di 5,2 GPa e un carico di rottura mediano di 51,1 MPa. I rivestimenti di semi di pino mostrano una rigidità comparabile (mediana: 4,4 GPa); tuttavia, hanno dimostrato una resistenza a trazione finale significativamente più bassa (38,5 MPa) (Figura 3b). La superficie di frattura dello strato di semi di pino rivela superfici cellulari più intatte a causa della rottura dell’interfaccia tra le cellule (Figura 3c). Al contrario, i gusci di noce spesso mostrano fratture attraverso i lobi a causa dell’incastro (Figura 3d). Allo stesso modo, nella parte interna del guscio di noce con le cellule a parete sottile, si osservano più fratture che tagliano l’intera cellula, aprendo così la vista sulla grande forma delle cellule polilobate. (Figura 3d, immagine a destra). La maggiore superficie e l’incastro spiegano la maggiore resistenza a trazione finale, mentre il modulo di Young è simile a causa dello stesso “materiale” (struttura e composizione della parete cellulare).
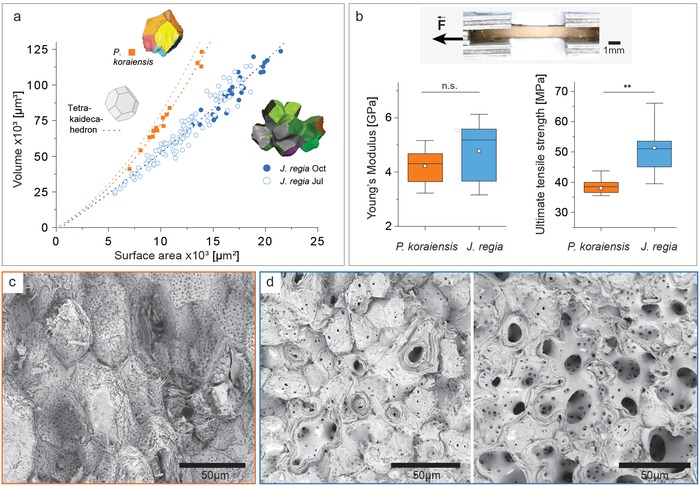
Figura 3.Figura 3. Confronto tra la forma delle cellule e la meccanica dei gusci di noce e dei manti di semi di pino. a) Rapporto tra volume e superficie per le singole cellule di noce dei campioni di luglio e ottobre, rispetto alle cellule di pino e al tetrakaidecaedro, che è la forma di base per l’imballaggio dei tessuti con 14 facce. b) Campione di prova di trazione esemplare e dati meccanici (modulo di Young e resistenza alla trazione finale) per il guscio di noce (campionato in ottobre, n = 10) e strato di semi di pino (n = 8). c) Immagine al SEM della superficie di frattura dopo il test di trazione di pino e d) noce (esempio per la parte esterna densa sulla parte sinistra e la parte interna sul lato destro).
La disposizione interdigitale delle cellule di noce (Figura 2c, Film S2, Informazioni di supporto) è un affascinante esempio di disposizione geometrica intelligente nei materiali biologici, che può essere classificata come tassellazione. Questo motivo strutturale comporta la disposizione periodica di elementi morbidi e duri in serie, che è stata riportata a tutte le scale; dalle disposizioni molecolari alle unità macroscopiche per una vasta gamma di materiali biologici.11, 12 Per le piante, una tassellazione suturale ondulata è stata recentemente riportata nel mantello del seme del miglio comune(Panicum miliaceum) come strategia per amplificare la forza, la durezza e l’auxeticità.13 Nella progettazione dei materiali, l’idea della tassellazione è realizzata in materiali ad incastro per ottenere un’elevata resistenza alla propagazione delle cricche, una grande capacità di assorbimento di energia e una notevole tolleranza ai guasti locali.14, 15 Questi materiali si basano su blocchi di costruzione esattamente della stessa geometria e si basano su un bordo esterno come vincolo. La nostra struttura puzzle 3D riportata è interbloccata individualmente; molti diversi lobi strutturati sono inseriti nei loro vicini negativi e funzioneranno senza alcun vincolo di confine.
I gusci di noce sono un abbondante sottoprodotto dell’industria alimentare,16 che di solito vengono bruciati, anche se stanno emergendo sempre più applicazioni di valorizzazione del potenziale.17 Considerando i promettenti approcci per nuovi materiali strutturali e funzionali ad alte prestazioni basati sul legno naturale,18,19, 20, 21 i gusci di noce potrebbero essere interessanti anche per la densificazione, così come l’impregnazione e lo stampaggio in strutture con altri biopolimeri per una bioeconomia più sostenibile.
Sezione sperimentale
Campionamento: Le noci(Juglans regia, cultivar “Geisenheim”) sono state raccolte da luglio a ottobre 2017 e da Mai a ottobre 2018 da un albero di 48 anni nel “BOKU horticulture Jedlersdorf” di Vienna, Austria. Per ogni campionamento, dieci noci sono state raccolte a caso e immediatamente conservate in sacchetti di plastica a -20 °C fino a ulteriori indagini. I dadi e le loro sezioni trasversali sono stati fotografati con una Canon EOS M10 con obiettivo macro (35 mm, f/2,8). I pinoli(Pinus koraiensis) sono stati coltivati nel nord-est della Cina vicino alle montagne del Changbai e raccolti nel 2018.
Colorazione istologica: La Toluidina Blu O (Sigma-Aldrich) e l’Euparal (ROTH) sono state utilizzate per colorare sezioni sottili di 8 µm, provenienti da blocchi di noce congelata campionati in Mai, giugno e luglio, e tagliate con un Cryostat Leica CM 3050 S (Leica) a -10 °C. I campioni di noce e pinolo di ottobre sono stati tagliati con un microtomo rotante Leica RM 2255 (Leica) dopo essere stati immersi in acqua distillata per 48 ore a temperatura ambiente. Le sezioni sono state immediatamente macchiate con la soluzione di Toluidine Blue O(c = 0,2 mg mL-1) e incubate a temperatura ambiente per 30 minuti, e poi lavate con acqua distillata fino a quando la soluzione di lavaggio è limpida. Le sezioni macchiate sono state incorporate in Euparal e fotografate con un microscopio Labophot-2 (NIKON).
Circolarità: Dalle diverse sezioni di noce, il perimetro e l’area delle cellule più grandi(n = 30) sono stati misurati digitalmente (ImageJ, NIH) e la circolarità è stata calcolata con la formula 4 π (area/perimetro2). Più alto è il rapporto, più la forma si avvicina ad un cerchio perfetto caratterizzato da una circolarità pari a 1.
Delignificazione (Macerazione): Blocchi di gusci di noce (avg. 5 mm × 5 mm × 2 mm) raccolti in luglio e ottobre sono stati macerati per immersione in una soluzione contenente H2O2 (30%,ROTH), acqua distillata e acido acetico (>99.8%, Sigma-Aldrich; V:V:V:V = 1:4:5), conservato in un tubo Eppendorf da 1,5 mL 72 h in forno (60 °C), risciacquato tre volte con acqua distillata, seguito da una vigorosa scossa per separare le singole cellule.
Microscopia a scansione laser confocale (CLSM): Per visualizzare le singole cellule macerate, due gocce di Calcoflour White (1 g L-1, Sigma-Aldrich) sono state messe su un vetrino di vetro, sopra le singole cellule macerate. Una LEICA SP5 è stata equipaggiata con un obiettivo di 60 × /0.9 acqua, e un laser a diodi (λ exc = 405nm). La cellulosa colorata è stata rilevata a 425-475 nm. Le immagini sono state ottenute con un passo di 0,4 µm, coprendo l’intero volume delle celle (50-100 piani) tramite il software Leica (LAS AF 3.1). Il software Imaris (8.4.0, Bitplane) è stato utilizzato per la ricostruzione 3D delle cellule.
Microscopia elettronica a scansione (SEM): Per l’imaging del tessuto del guscio e delle singole cellule, i campioni essiccati in forno (24 ore a 60 °C) sono stati montati su stub in alluminio con nastri biadesivi in carbonio appiccicoso e oro sputterizzato con uno sputter coater (LEICA EM SCD005) prima della visualizzazione al microscopio elettronico a scansione (FEI Apreo). I parametri di scansione sono stati impostati su una tensione del fascio di 1,0 kV e una corrente di 6,3 pA. A seconda dell’ingrandimento è stata scelta una distanza di lavoro compresa tra 3,3 e 7,8 mm.
Tomografia microcalcolata (CT) e visualizzazione 3D: Per l’imaging, i nutshell (ottobre, avg. 1 mm × 1 mm × 3 mm) sono stati scansionati in una tomografia a raggi X microcomputati (RXsolutions EasyTom 160). I parametri di scansione del tubo nanofocus (target diamantato e filamento di tungsteno/LaB6) sono stati impostati su una tensione del tubo di 60 kV e 200 µA di corrente (tempo di esposizione 0,5 s e media del frame 3). Il tempo di esposizione del rivelatore a schermo piatto era di 0,5 s, la media dei frame era di 3, e la dimensione del voxel era di 0,8 µm. Ogni scansione consisteva di 1268 radiografie, che sono state ricostruite nel software XAct 2 (RXsolutions) e poi visualizzate nel software Amira (FEI, versione 6.1). Le pile in direzione z sono state prima filtrate con mezzi non locali, seguite da un filtro mediano, e poi il lume della cellula e la parete della cellula sono stati selezionati con il toolbox di segmentazione. La parete della cella è stata aggiunta ad ogni cella ed è stato generato un grafico di superficie per rendere i volumi in 3D. L’area della superficie della cella e il volume, così come il numero di aree di contatto delle celle vicine, sono stati poi calcolati dal grafico della superficie delle singole celle.
Test di trazione: I gusci di noce maturi raccolti nell’ottobre 2018 e i pinoli(Pinus koraiensis) sono stati pretagliati con una sega a mano e rifilati su campioni di barre rettangolari (larghezza ≈ 1-2 mm, solo i gusci di noce sono stati rifilati ad uno spessore uniforme di ≈0,90-1,15 mm a causa della loro ondulazione) con un Cryostat (CM 3050 S, Leica) a -10 °C. Per ogni specie, sono stati selezionati da otto a dieci campioni da testare ed entrambe le estremità sono state incollate (Loctite 454, Henkel) su strisce di supporto (compensato per aeromodelli a tre strati di betulla, spessore 1 mm, tagliato a una lunghezza di 60 mm e una larghezza di 18 mm) con una distanza di 4 mm. Due strisce di supporto aggiuntive sono state incollate (Ponal Express Holzleim, Henkel) sopra la prima striscia (struttura a sandwich mostrata in Figura 3b) per fornire un supporto aggiuntivo. Immediatamente dopo l’applicazione delle colle, la struttura a sandwich è stata compressa per 15 minuti mettendovi sopra un peso di ≈2 kg. Le prove meccaniche sono iniziate 24 ore dopo per garantire l’indurimento della colla. Il carico di trazione è stato eseguito con una macchina di prova da 2,5 kN (zwickiLine Z2.5, Zwick-Roell), dotata di una cella di carico da 1 kN e di un estensimetro video (videoXtens, Zwick-Roell) per misurare le variazioni di lunghezza del provino durante le prove (precarico 1 N, velocità di prova 0,004 mms-1). La distanza iniziale del morsetto è stata impostata a 45 mm. Le dimensioni di ogni provino sono state determinate con un calibro elettronico per calcolare l’area della sezione trasversale. Per il calcolo del modulo di Young è stato usato il campo di deformazione 0,02-0,12%. Le analisi statistiche sono state eseguite in OriginPro applicando il test di Mann-Whitney (livelli di significatività: 0,05*; 0,01**).
Conflitto di interesse
Gli autori non dichiarano alcun conflitto di interessi.
Informazioni di supporto
References
- New Phytol.. 2010; 186:817. PubMed
- Bioinspiration Biomimetics. 2016; 11:045002. PubMed
- Sci. Rep.. 2018; 8:9668. PubMed
- PLoS One. 2014; 9:8.
- J. Mater. Chem.. 2011; 21:8389.
- Protoplasma. 1992; 166:21.
- Development. 2017; 144:4386. PubMed
- eLife. 2018; 7PubMed
- PLoS One. 2012; 7PubMed
- J. Biomech.. 2005; 38:377. PubMed
- Chem. Soc. Rev.. 2016; 45:252. PubMed
- J. Mech. Behav. Biomed. Mater.. 2017; 73:102. PubMed
- Adv. Mater.. 2018; 30:36.
- Sci. Rep.. 2017; 7:11844. PubMed
- Mater. Sci. Eng., C. 2011; 31:1189.
- J. Sci. Food Agric.. 2010; 90:12.
- RSC Adv.. 2018; 8:22376.
- Nature. 2018; 554:224. PubMed
- ACS Appl. Mater. Interfaces. 2018; 10:5030. PubMed
- Adv. Mater.. 2018; 30:1704285.
- Adv. Sci.. 2019; 6:1802190.
Fonte
Antreich SJ, Xiao N, Huss JC, Horbelt N, Eder M, et al. (2019) The Puzzle of the Walnut Shell: A Novel Cell Type with Interlocked Packing. Advanced Science 6(16): 1900644. https://doi.org/10.1002/advs.201900644





