Abstract
Dichiarazione di importanza
L’assistenza materna è un importante fattore ambientale che influenza lo sviluppo del cervello, e i deficit in questa assistenza possono portare a comportamenti disadattivi nella prole. Mentre l’interazione materna è cruciale, poco si sa sui meccanismi sottostanti con cui modula l’attività cerebrale del neonato e del cucciolo. In questo studio, utilizzando registrazioni elettrofisiologiche senza fili, dimostriamo che il contatto della madre regola l’attività delle principali regioni prefrontaliere dei cuccioli di ratto di 10-12 anni. Per quanto riguarda i meccanismi, abbiamo scoperto che il sistema serotoninergico contribuisce a questa modulazione, in particolare attraverso i recettori 5-HT2 (5-HT2Rs). Questi risultati suggeriscono che le cure materne influenzano l’attività neurale serotoninergica durante la prima infanzia e forniscono informazioni chiave su come le cure materne influenzano lo sviluppo adattivo/maladattabile dei circuiti cerebrali implicati nella patologia dell’adulto.
Introduzione
Il periodo postnatale è una fase critica durante la quale il cervello subisce importanti cambiamenti: nuovi cablaggi, organizzazione e intensa plasticità. Questa plasticità sinaptica ha la duplice funzione di organizzare il comportamento immediato del bambino e di programmare il cervello per i futuri comportamenti adattativi. Così, qualsiasi fattore ambientale che può influenzare il cervello in via di sviluppo durante questo periodo può avere ripercussioni di lunga durata(Chaudhury et al., 2016). In questa prima fase della vita, uno dei principali input ambientali è la cura materna. La presenza materna, la qualità delle cure materne, e la rimozione di tali cure durante la separazione prolungata durante la prima fase della vita è stata dimostrata, sia negli esseri umani che nei roditori, per regolare la paura(Routh et al., 1978; Barr et al., 2009), per mediare i cambiamenti di umore durante tutta la vita(Vetulani, 2013), per modulare la risposta allo stress(Hellstrom et al., 2012; Rincón-Cortés et al., 2015), e per influenzare il consumo di droghe (Delavari et al.,2016). Le interazioni materne durante la prima infanzia sono quindi fondamentali per la salute mentale degli individui per tutta la vita (Nelsonet al., 2011; Cameron et al., 2017; Sale , 2018). Recentemente, l’attività corticale del cucciolo è stato trovato per essere influenzato dalle interazioni materne. Utilizzando le registrazioni del potenziale di campo locale (LFP) nel comportamento dei cuccioli di ratto (P12-P19), la presenza materna è stata trovata per essere correlata ad un aumento dell’attività neurale a bassa frequenza, e la norepinefrina è stata trovata per mediare le risposte neurali del cucciolo all’espulsione del latte materno (Sarro etal., 2014). Mentre la noradrenalina può mediare le risposte neurali del cucciolo all’espulsione del latte, i meccanismi esatti con cui la presenza/assenza materna regola l’attività del cervello in via di sviluppo non sono ancora compresi. Considerando che la trascuratezza materna è la forma più diffusa di abuso infantile, con importanti conseguenze sociali(U.S. Department of Health and Human Services 2010), è fondamentale sezionare e comprendere questi meccanismi.
La serotonina (5-HT) è un neuromodulatore chiave noto per regolare l’espressione dei comportamenti materni(Angoa-Pérez et al., 2014). Nello sviluppo di roditori, i livelli di serotonina picco durante la fase perinatale(Hohmann et al., 1988). È importante notare che la modifica della segnalazione serotoninergica durante i primi anni di vita porta a cambiamenti nella morfologia dei neuroni corticali piramidali, nonché a deficit emotivi in età adulta(Ansorge et al., 2004, 2008; Rebello et al., 2014). Questi deficit sembrano essere mediati attraverso i recettori 5-HT2 (5-HT2Rs; Sarkar et al., 2014). Una delle più alte densità di terminali serotoninergici nella neocorteccia si trova nella corteccia prefrontale (PFC), dove i recettori serotoninergici multipli, in particolare 5-HT1A e 5-HT2R, sono abbondanti(Celada et al., 2013). È importante notare che nel PFC in via di sviluppo, c’è un drammatico cambiamento nella funzione e nell’espressione dei recettori 5-HT(Beique et al., 2004). Beique et al. (2004) mostrano che in fette di ratti P6-P19, il 5-HT provoca la depolarizzazione dei neuroni piramidali che si sposta verso l’iperpolarizzazione a partire dalla terza settimana postnatale. Un cambiamento nell’espressione dei recettori si verifica con una diminuzione della depolarizzazione mediata da 5-HT7R e la comparsa di 5-HT1AR-mediata iperpolarizzazione. Allo stesso tempo, i cambiamenti nell’efficacia, piuttosto che i cambiamenti nell’espressione dei recettori, sono associati ad un declino nella depolarizzazione 5-HT2AR-mediata(Beique et al., 2004). Il PFC è una struttura critica che subisce varie funzioni cognitive(Bechara et al., 1998; Miller e Cohen, 2001; Schoenbaum et al., 2002), tra cui la flessibilità comportamentale e la memoria di lavoro(Tottenham et al., 2011; Parnaudeau et al., 2013; Funahashi, 2017). Il PFC ha un periodo di sviluppo prolungato, che estende alti livelli di plasticità nell’adolescenza, che gli permette di adattarsi ai cambiamenti ambientali, ma lo rende anche più suscettibile agli insulti ambientali che possono portare a uno sviluppo disadattivo e conseguenti deficit comportamentali(Kolb et al., 2012). La serotonina è quindi un buon candidato a partecipare alla regolamentazione dello sviluppo dell’attività cerebrale, in particolare dell’attività dei PFC, associata alle cure materne.
Utilizzando la registrazione wireless LFP, abbiamo registrato l’attività del PFC dei cuccioli [in particolare nella regione della corteccia cingolata anteriore (ACC)] nella loro gabbia domestica con i cuccioli e la diga. Abbiamo scoperto che la presenza e l’assenza della diga dal nido modulava l’attività PFC dei cuccioli di ratto. In primo luogo, abbiamo trovato che la potenza LFP è stata aumentata in bande a bassa frequenza durante i periodi in cui la diga era in contatto con il cucciolo. In secondo luogo, abbiamo trovato che il blocco 5-HT2R bloccava l’aumento delle oscillazioni a bassa frequenza associate al contatto materno. In terzo luogo, abbiamo osservato che l’aumento della segnalazione serotoninergica, utilizzando un inibitore selettivo di ricaptazione della serotonina (SSRI), era sufficiente ad aumentare la potenza LFP nelle bande a bassa frequenza rispetto ai controlli e che questo aumento era mediato attraverso 5-HT2R. I nostri risultati rivelano il contributo del sistema serotoninergico nella regolazione dell’attività corticale dei cuccioli in risposta alle interazioni materne.
Materiali e metodi
Animali
I ratti Long Evans (diga e cuccioli) sono stati utilizzati per questi esperimenti (Fattorie Taconiche). Ventiquattro cuccioli di ratto maschi (P9-P12) da 12 cucciolate sono stati utilizzati per gli esperimenti LFP, 12 cuccioli maschi (P11-P16) da sei cucciolate sono stati utilizzati per l’esperimento di attacco del capezzolo, e 24 cuccioli (P7-P12) da sei cucciolate sono stati utilizzati per l’esperimento di vocalizzazioni ad ultrasuoni (USVs). I cuccioli sono stati allevati nella nostra colonia e sono stati mantenuti su un ciclo di 12/12 h luce / buio con accesso al cibo e acqua ad libitum. Per gli esperimenti LFP, i cuccioli sono stati abbattuti a quattro o sei cuccioli e abituati alla gabbia e alla stanza sperimentale per 3 d prima dell’intervento chirurgico per garantire una diga calma durante le registrazioni. Gli interventi chirurgici sono stati eseguiti su cuccioli di ratto P9-P11 e le registrazioni sono state effettuate il giorno dopo l’intervento (P10-P12). Questo intervallo di età è stato scelto perché la regolazione materna dell’attività cerebrale dei cuccioli è massima prima della P16 (Sarroet al., 2014), e la P9 è stato il primo momento in cui questo intervento può essere eseguito in modo affidabile da noi.
Gli esperimenti sono stati condotti alla cieca per la condizione di trattamento dei cuccioli. Tutte le procedure sugli animali sono state eseguite in conformità con i regolamenti del comitato locale per la cura degli animali e con le linee guida dell’NIH.
Chirurgia per la registrazione della LFP
Sotto anestesia isoflurano (5% per l’induzione e 1,5-3% per la manutenzione), un elettrodo in acciaio inossidabile (A-M Systems) è stato impiantato nella regione ACC del PFC (AP: +2,0 mm, ML: -0,5 mm, DV: -2 mm; Fig. 1A,B) e cementato al cranio. L’elettrodo era precedentemente collegato ad un dispositivo di telemetria (ETA-F10, DSI). Il dispositivo telemetrico è stato posizionato sottocutaneo sotto la pelle dorsale. L’incisione è stata chiusa con sutura chirurgica (Stoelting) e l’area dell’incisione è stata pulita con acqua sterile per rimuovere quanti più odori estranei possibile. Dopo l’intervento, i cuccioli sono stati tenuti al caldo fino al completo recupero dall’anestesia(∼ 2min). I cuccioli sono stati poi delicatamente coperti con della biancheria da letto usata e riposti nel nido. Gli interventi chirurgici sono stati eseguiti in due cuccioli maschi per cucciolata.
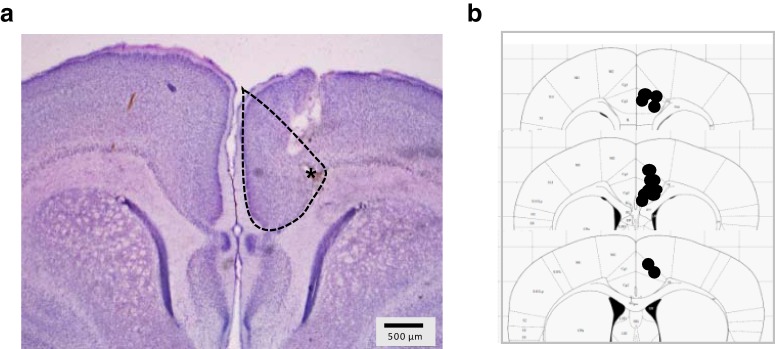
Figura 1.
Posizionamento degli elettrodi. A, Colorazione illustrativa di un cervello di cucciolo che mostra i segni di tracce di elettrodi. B, Gli elettrodi sono stati collocati nell’area ACC del PFC.

Figura 1.
Posizionamento degli elettrodi. A, Colorazione illustrativa di un cervello di cucciolo che mostra le tracce degli elettrodi. BGli elettrodi sono stati posizionati nell’area ACC del PFC.
Farmaci
Per testare il contributo del sistema serotoninergico sull’attività neurale dei cuccioli associata alla presenza materna, sono state eseguite modifiche farmacologiche utilizzando farmaci iniettati per via intraperitoneale.
Per bloccare la segnalazione serotoninergica, abbiamo preso di mira 5-HT2R utilizzando l’antagonista 5-HT2A/2CR chetanserina (2,5 mg/kg; Tocris, catalogo #0908; Sarkar et al., 2014). La chetanserina è un forte antagonista 5-HT2AR e 5-HT2CR con un debole blocco α-adrenergico associato e attività antistaminica (Awouters,1985). Per migliorare la segnalazione serotoninergica, abbiamo usato la fluoxetina SSRI (10 mg / kg; Sigma, catalogo # 1279804; Ansorge et al., 2004). Questi farmaci e veicolo (0,9% salina) sono stati iniettati ad un volume di 0,02 ml per 10 g. Fluoxetina non si scioglie facilmente in soluzione salina così fluoxetina è stato diluito prima in acqua sterile e poi è stato aggiunto NaCl. Il peso medio dei cuccioli era di 25,46 ± 4,7 g. Per garantire che lo sperimentatore era cieco al trattamento degli animali, le soluzioni sono state preparate da un diverso sperimentatore e colore codificato. Il codice colore è stato rivelato solo dopo l’analisi istologica e dei dati.
Progettazione sperimentale (registrazioni LFP)
Ventiquattro ore dopo l’intervento, l’attività neurale dei cuccioli è stata registrata durante le diverse fasi degli esperimenti comportamentali. I segnali LFP sono stati acquisiti, digitalizzati e memorizzati utilizzando il software Spike 2 (CED). Ventiquattro cuccioli maschi sono stati impiantati e registrati per questi esperimenti (due sono stati esclusi a causa di frequenti artefatti del segnale). Due cuccioli sono stati registrati al giorno, uno al mattino e uno al pomeriggio. Il trattamento farmacologico somministrato al mattino o al pomeriggio è stato controbilanciato. L’approccio di registrazione wireless LFP scelto permette di registrare durante le interazioni materne indisturbate nella gabbia domestica. L’attività neurale dei cuccioli di P10-P12 è stata registrata in due configurazioni abitative: nella gabbia domestica con la diga e i cuccioli presenti, e in isolamento in un becher di plastica caldo da 500 ml. La gabbia domestica (47 × 25 cm) era ricoperta da uno strato di pino da barba e comprendeva una conigliera in plastica sotto la quale si trovava generalmente il nido. Durante i periodi di gabbia domestica, la presenza (in nido) e l’assenza (fuori dal nido) della diga dal nido sono state osservate direttamente e l’orario è stato stampato sul file di registrazione LFP. Il comportamento “In nido” è stato registrato come il momento in cui la diga stava toccando il nido. “Fuori dal nido” è stato registrato quando la diga non era in contatto fisico con il nido. Durante questo periodo, i cuccioli motoricamente immaturi rimanevano per lo più rannicchiati nel nido, mentre le dighe, impegnate a mangiare/bere, si aggiravano nella gabbia e si riposavano o sopra la conigliera o altrove nella gabbia. Le transizioni materne nel nido e fuori dal nido non sono state analizzate per garantire registrazioni ininterrotte e coerenti relative alla presenza o assenza della madre.
Tre esperimenti sono stati eseguiti su ogni cucciolo in una sequenza seriale:
Esperimento 1
Le registrazioni LFP sono state ottenute durante un’ora nella gabbia di casa durante la quale la presenza o l’assenza della diga nel nido è stata cronometrata. Dopo questo periodo, i cuccioli sono stati messi in isolamento in un becher contenente la lettiera della gabbia domestica per 15 minuti(Fig. 2A). Questo periodo di isolamento è stato utilizzato come base per l’analisi dei dati. All’interno della registrazione dell’homecage ∼1-h, i segnali LFP sono stati analizzati solo nei cuccioli in cui abbiamo ottenuto periodi ininterrotti di presenza o assenza della diga nel nido di almeno 5 min.
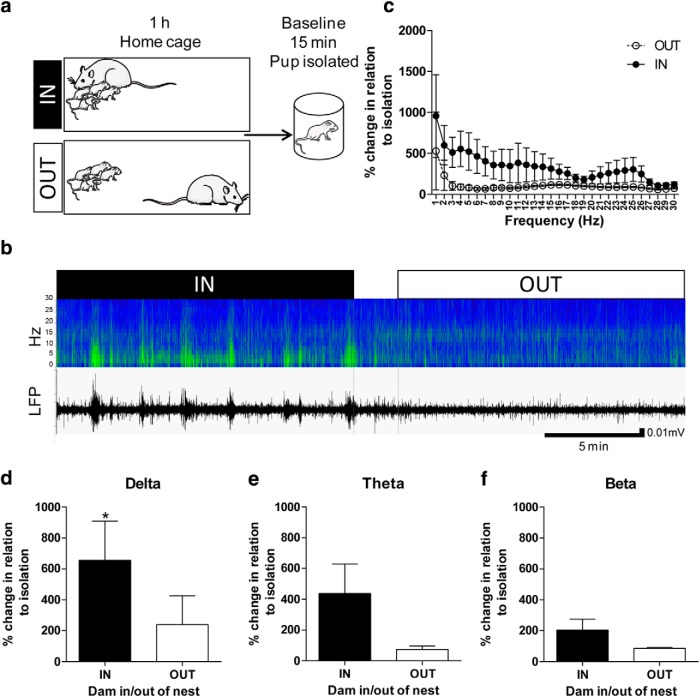
Figura 2.La presenza materna aumenta il potere di oscillazione a bassa frequenza nel cervello dei cuccioli. A, Progettazione sperimentale. I cuccioli di ratto sono stati impiantati nel PFC con un dispositivo di registrazione LFP senza fili. Il giorno successivo, i LFP sono stati registrati durante l’attività della gabbia domestica (diga nell’area del nido: IN; diga nella gabbia ma fuori dall’area del nido: OUT) e l’isolamento. I dati IN e OUT sono stati normalizzati rispetto a quando il cucciolo era in isolamento (posizione materna/isolamento × 100). BEsempio di sonogramma (in alto) e LFP (in basso) registrati in un cucciolo all’interno della stessa seduta. IN rappresenta il periodo in cui la diga era nel nido e OUT rappresenta il periodo in cui la diga era fuori dal nido. CLa presenza materna nel nido tendeva ad aumentare la potenza della LFP nella maggior parte delle frequenze registrate (0-30 Hz). D, δ la potenza è stata significativamente aumentata quando la diga era presente nel nido. E, C’è stata una tendenza all’aumento della potenza LFP nella gamma θ durante la presenza materna. F, La potenza di oscillazione β non era significativamente influenzata dalla presenza materna. N = 13; *p < 0,05. Immagini di ratto e giovane ratto, Servier Medical Art di Servier è concesso in licenza sotto una licenza Creative Commons Attribution 3.0 Unported License (Figg. 2-4 e abstract visivo).

Figura 2.La presenza materna aumenta il potere di oscillazione a bassa frequenza nel cervello dei cuccioli. A, Progettazione sperimentale. I cuccioli di ratto sono stati impiantati nel PFC con un dispositivo di registrazione LFP senza fili. Il giorno successivo, i LFP sono stati registrati durante l’attività della gabbia domestica (diga nell’area del nido: IN; diga nella gabbia ma fuori dall’area del nido: OUT) e l’isolamento. I dati IN e OUT sono stati normalizzati rispetto a quando il cucciolo era in isolamento (posizione materna/isolamento × 100). BEsempio di sonogramma (in alto) e LFP (in basso) registrati in un cucciolo all’interno della stessa seduta. IN rappresenta il periodo in cui la diga era nel nido e OUT rappresenta il periodo in cui la diga era fuori dal nido. CLa presenza materna nel nido tendeva ad aumentare la potenza della LFP nella maggior parte delle frequenze registrate (0-30 Hz). D, δ la potenza è stata significativamente aumentata quando la diga era presente nel nido. E, C’è stata una tendenza all’aumento della potenza LFP nella gamma θ durante la presenza materna. F, La potenza di oscillazione β non era significativamente influenzata dalla presenza materna. N = 13; *p < 0,05. Immagini di ratto e giovane ratto, Servier Medical Art di Servier è concesso in licenza sotto una licenza Creative Commons Attribution 3.0 Unported License (Figg. 2-4 e abstract visivo).
Esperimento 2
Dopo l’esperimento 1, i cuccioli sono stati rimossi dalla lettiera, pesati, iniettati con ketanserina o veicolo e immediatamente rimessi nel nido. Questa procedura ha richiesto <1 min. L’ordine di trattamento dei cuccioli è stato alternato tra le cucciolate, così la metà del tempo il primo cucciolo registrato ha ricevuto la soluzione salina e l’altra metà, la chetanserina.
Quindici minuti dopo l’iniezione, la registrazione LFP è stata avviata e la presenza/assenza della diga nel nido è stata registrata e l’ora è stata impressa sul file di registrazione(Fig. 3A). All’interno del ∼ 1h di registrazione, i segnali LFP sono stati analizzati solo nei cuccioli in cui abbiamo ottenuto un periodo ininterrotto di presenza o assenza della diga nel nido di almeno 5 min.
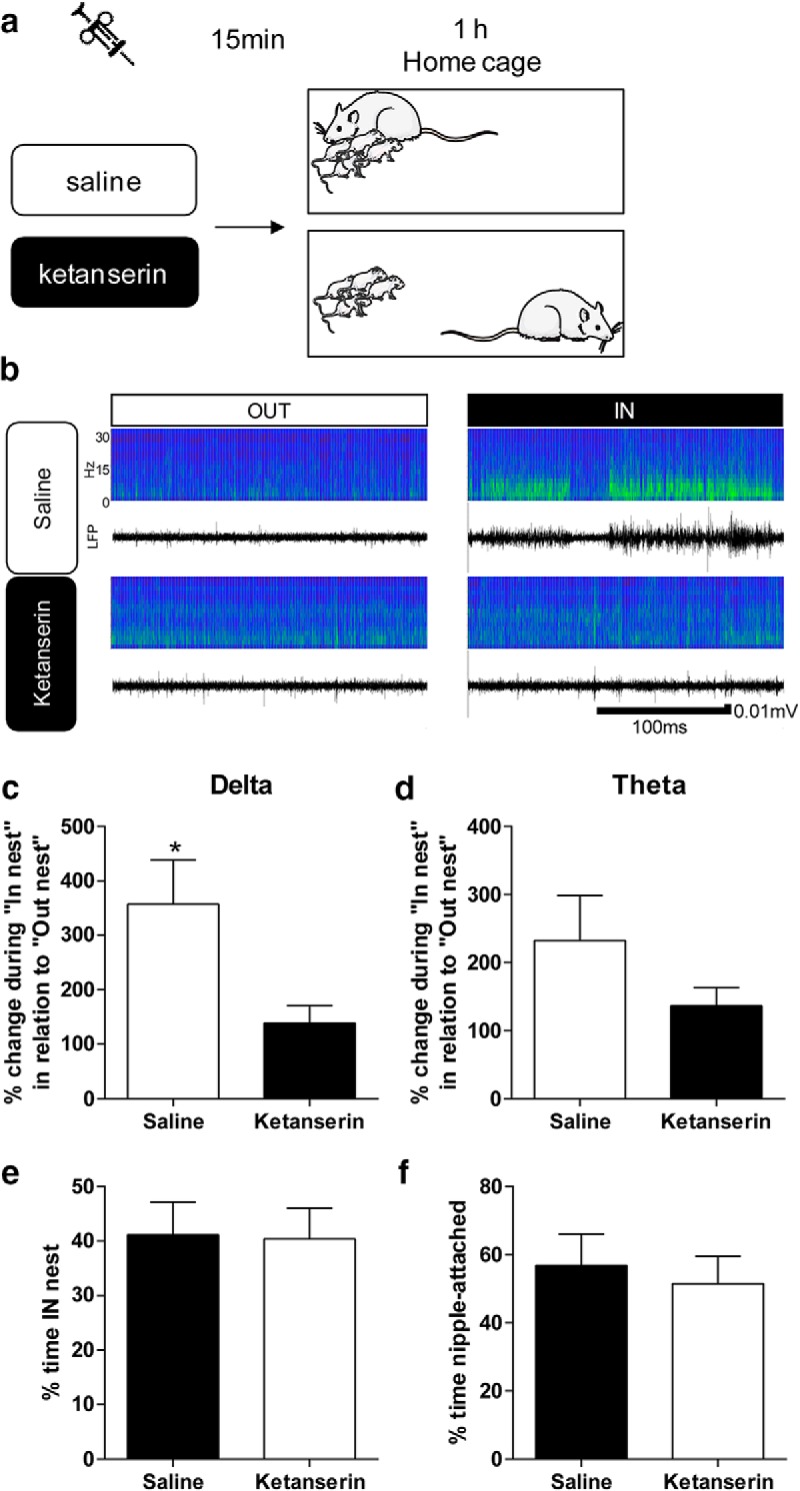
Figura 3.Ketanserin blocca la regolazione materna dell’attività cerebrale dei cuccioli. A, Progettazione sperimentale. B, Esempio di sonogrammi e LFP registrati all’interno della stessa sessione durante il periodo In e Out of the nest per un cucciolo iniettato con soluzione fisiologica (in alto) e un altro cucciolo iniettato con ketanserina (in basso). CLa ketanserina ha bloccato l’effetto della presenza materna (rapporto “In nido”/”Out of nest”*100) sull’attività dei PFC dei cuccioli nella banda di frequenza δ rispetto all’iniezione di soluzione fisiologica. DNon c’è stata alcuna differenza significativa tra gli animali trattati con soluzione fisiologica e quelli trattati con ketanserina nella banda θ. N = 6 chetanserina; N = 7 salina. E, Non ci sono state differenze nella percentuale di tempo trascorso nel nido con la madre nelle registrazioni salina e ketanserina. FIn un gruppo separato di animali è stato quantificato il tempo trascorso nel capezzolo. Non ci sono state differenze tra gli animali iniettati di soluzione salina e ketanserina(N = 6 per gruppo). * p < 0.05.

Figura 3.Ketanserin blocca la regolazione materna di attività cerebrale dei cuccioli. A, Progettazione sperimentale. B, Esempio di sonogrammi e LFP registrati all’interno della stessa sessione durante il periodo In e Out of the nest per un cucciolo iniettato con soluzione fisiologica (in alto) e un altro cucciolo iniettato con ketanserina (in basso). CLa ketanserina ha bloccato l’effetto della presenza materna (rapporto “In nido”/”Out of nest”*100) sull’attività dei PFC dei cuccioli nella banda di frequenza δ rispetto all’iniezione di soluzione fisiologica. DNon c’è stata alcuna differenza significativa tra gli animali trattati con soluzione fisiologica e quelli trattati con ketanserina nella banda θ. N = 6 chetanserina; N = 7 salina. E, Non ci sono state differenze nella percentuale di tempo trascorso nel nido con la madre nelle registrazioni salina e ketanserina. FIn un gruppo separato di animali è stato quantificato il tempo trascorso nel capezzolo. Non ci sono state differenze tra gli animali iniettati di soluzione salina e ketanserina(N = 6 per gruppo). * p < 0.05.
Esperimento 3
Dopo l’iniezione di chetanserina o salina e successivo ∼ 1h di periodo di gabbia domestica dell’esperimento 2, i cuccioli sono stati suddivisi per ricevere una seconda somministrazione di fluoxetina o veicolo, in un ordine pseudo-casuale, per produrre quattro gruppi di trattamento: salina-salina, salina-fluoxetina, ketanserina-salina, e ketanserin-fluoxetina. Subito dopo la seconda iniezione, i cuccioli sono stati messi in isolamento e dopo un periodo di attesa di 15 minuti, le LFP sono state registrate per 30 minuti(Fig. 4A).
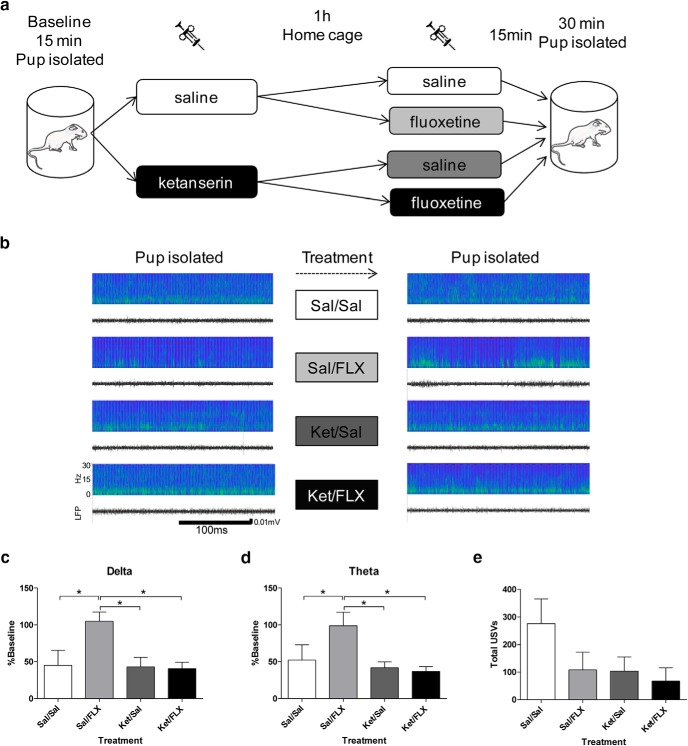
Figura 4.La somministrazione di fluoxetina aumenta la potenza della LFP nelle bande a bassa frequenza durante l’isolamento rispetto ai controlli. A, Progettazione sperimentale. Un cucciolo impiantato è stato messo in isolamento per 15 minuti mentre la LFP di base è stata registrata. Il cucciolo è stato iniettato con chetanserina o soluzione salina per la prima iniezione e restituito alla gabbia di casa. Un’ora dopo, al cucciolo è stata iniettata fluoxetina o soluzione salina. Il cucciolo è stato poi messo in isolamento e 15 minuti dopo, le LFP sono state registrate per 30 minuti. BEsempio di sonogrammi e LFP registrati nella stessa seduta durante il primo (a sinistra) e il secondo (a destra, dopo i trattamenti) periodi di isolamento in cuccioli iniettati (dall’alto verso il basso) con Sal/Sal, Sal/FLX, Ket/Sal, e Ket/FLX. C-DLa somministrazione di fluoxetina ha aumentato la potenza della LFP in bande δ e θ durante l’isolamento. Questo effetto è stato bloccato dall’antagonista 5-HT2R ketanserina N = 4 in ogni gruppo. E, USVs in cuccioli isolati(N = 6 per gruppo). Sal = salina, Ket = chetanserina, FLX = fluoxetina. * p < 0.05.

Figura 4.La somministrazione di fluoxetina aumenta la potenza della LFP nelle bande a bassa frequenza durante l’isolamento rispetto ai controlli. A, Progettazione sperimentale. Un cucciolo impiantato è stato messo in isolamento per 15 minuti mentre la LFP di base è stata registrata. Il cucciolo è stato iniettato con chetanserina o soluzione salina per la prima iniezione e restituito alla gabbia di casa. Un’ora dopo, al cucciolo è stata iniettata fluoxetina o soluzione salina. Il cucciolo è stato poi messo in isolamento e 15 minuti dopo, le LFP sono state registrate per 30 minuti. BEsempio di sonogrammi e LFP registrati nella stessa seduta durante il primo (a sinistra) e il secondo (a destra, dopo i trattamenti) periodi di isolamento in cuccioli iniettati (dall’alto verso il basso) con Sal/Sal, Sal/FLX, Ket/Sal, e Ket/FLX. C-DLa somministrazione di fluoxetina ha aumentato la potenza della LFP in bande δ e θ durante l’isolamento. Questo effetto è stato bloccato dall’antagonista 5-HT2R ketanserina N = 4 in ogni gruppo. E, USVs in cuccioli isolati(N = 6 per gruppo). Sal = salina, Ket = chetanserina, FLX = fluoxetina. * p < 0.05.
Progettazione sperimentale (attacco per capezzoli)
Per verificare se la chetanserina influisce sul comportamento dei cuccioli nel nido abbiamo valutato il comportamento dell’allattamento. Due cuccioli maschi (P11-P16) per cucciolata, da sei cucciolate, sono stati selezionati a caso e uno è stato iniettato con soluzione fisiologica e uno con chetanserina. I cuccioli sono stati riportati nella gabbia di casa con la sola presenza della madre. In questa configurazione, tutti gli altri cuccioli e la gabbia di plastica sono stati rimossi due ore prima del test per facilitare l’osservazione dell’allattamento. Trenta minuti dopo l’iniezione, la durata di ogni cucciolo è stata registrata da un osservatore.
Progettazione sperimentale (USVs)
Quattro cuccioli maschi (P7-P12) per cucciolata sono stati selezionati a caso e iniettati con soluzione fisiologica o chetanserina e sono tornati nella loro gabbia di casa per 1 h. Sono stati poi iniettati con soluzione fisiologica o fluoxetina e riposti nella loro gabbia di casa per produrre quattro gruppi di trattamento: salina-salina, salino-fluoxetina, chetanserina-salina e chetanserina-fluoxetina. Sei cucciolate sono state testate in questo esperimento. Trenta minuti dopo, i cuccioli sono stati rimossi dalla cucciolata e messi in isolamento in un becher, posizionato sotto un microfono ULTRAMIC200K (Dodotronic), all’interno di una scatola a prova di suono. Gli USV sono stati registrati per 30 minuti e analizzati con il software SeaWave (CIPRA e AEST). Il numero di vocalizzazioni in frequenze comprese tra 30 e 65 Hz(Simola, 2015) è stato quantificato.
Analisi LFP
I segnali LFP sono stati analizzati offline utilizzando Spike 2 durante le diverse epoche comportamentali. Le analisi di potenza in trasformata veloce di Fourier (FFT) sono state eseguite su periodi di diversi minuti (definiti dai marcatori per ogni periodo comportamentale) utilizzando una finestra di Hanning con intervalli di frequenza di 0,9766-Hz. Per correggere la variabilità interanimale, la potenza LFP è stata espressa come rapporto relativo al primo periodo in cui il cucciolo è stato isolato nel becher (esperimenti 1 e 3, posizione materna/isolamento*100 e trattamento/isolamento*100, rispettivamente) o relativo al periodo fuori dal nido (esperimento 2, in nido / fuori dal nido*100). Abbiamo poi calcolato la potenza media nelle diverse bande di frequenza: δ (0-3,9 Hz), θ (3,9-7,8 Hz), e β (15,6-31,3 Hz).
Analisi statistica
L’analisi statistica è stata effettuata utilizzando il software GraphPad Prism con α di 0,05. Per testare le differenze tra gruppi di frequenze, abbiamo usato misure ripetute a due vie (RM) ANOVA. Per confrontare la potenza LFP normalizzata tra in nido e fuori condizioni di nido all’interno di animali nell’esperimento 1, abbiamo eseguito test t accoppiato. Per testare le differenze tra i gruppi di trattamento composti da animali indipendenti nell’esperimento 2, abbiamo usato prove t non accoppiate. Per testare le differenze tra i gruppi di trattamento nell’esperimento 3, abbiamo usato ANOVA a senso unico seguito da LSD post hoc test. I dati sono riportati come media ± SEM.
Posizione anatomica del posizionamento degli elettrodi
Al termine degli esperimenti, i cuccioli sono stati sovradosati con uretano (1,25 g/kg), il cervello è stato rimosso, fissato e crioprotetto in una soluzione di saccarosio al 4% PFA + 30%. Le sezioni coronali del cervello (40-50 μm di spessore) sono state tagliate su un microtomo (Leica). Le sezioni sono state montate su vetrini, colorate con violetto di cresile, e i posizionamenti degli elettrodi sono stati esaminati al microscopio ottico. Il posizionamento degli elettrodi ha riguardato prevalentemente la parte ACC del PFC(Schweimer e Hauber, 2005; Fig. 1A,B). Le tracce di alcuni elettrodi sono passate attraverso la corteccia motoria, con alcune punte di elettrodi che si trovano vicino alla corteccia motoria. Sei cuccioli in cui le tracce degli elettrodi hanno mostrato danni al corpo calloso sono stati rimossi dalle analisi.
Risultati
La presenza/assenza materna dal nido influenza l’attività dei PFC nei cuccioli
Ai cuccioli di ratto maschi (P10 ± 1 d) è stato impiantato un elettrodo mirato alla regione ACC del PFC e collegato ad un dispositivo di telemetria.
Il giorno dopo l’intervento, le LFP corticali sono state registrate nella gabbia di casa dei cuccioli per 1 h. Dopo questa registrazione, l’attività di base è stata ottenuta registrando i cuccioli in isolamento per 15 min (Fig.2A). Le oscillazioni delle bande a bassa frequenza delle LFP (bande δ, θ, e β) sono state normalizzate al basale e analizzate in quanto sembrano essere critiche nella connettività funzionale a lungo raggio nei primi anni di vita (Del Rio-Bermudezet al., 2017).
Abbiamo osservato una tendenza generale per l’aumento della potenza LFP attraverso le frequenze quando la diga era nel nido rispetto a fuori dal nido (0-30 Hz; posizione della diga: F(1,24) = 3, 261, p = 0,08, bidirezionale RM ANOVA; Fig. 2B,C). Quando i dati sono stati analizzati da specifiche bande di frequenza oscillatorie (cioè, δ: 0-3,9 Hz; θ: 3,9-7,8 Hz; e β: 15,6-30 Hz), abbiamo osservato un significativo aumento di potenza in δ (t(12) = 2,580, p = 0,02, test t accoppiato; Fig. 2D) durante la presenza materna rispetto alla condizione fuori dal nido, così come un andamento in θ (t(12) = 1, 934, p = 0 , 08, test t accoppiato; Fig. 2E) e nessuna differenza significativa in β (t(12)= 1,639, p = 0,13, test t accoppiato; Fig. 2F Tabella 1). I risultati attuali e un precedente rapporto(Sarro et al., 2014) evidenziano la rilevanza delle oscillazioni di frequenza più basse in età precoce in risposta alla presenza materna.
| Figura | Test statistici utilizzati | Effetti principali | Post hoc (test LSD) |
|---|---|---|---|
|
Figura 2C Frequenze incrociate |
RM ANOVA a due vie | Posizione: F(1,24) = 3,261; p = 0,0835Frequenza: F(29.696) = 2,400; p < 0,0001Posizione × frequenza: F(29.696) = 0,6265; p = 0,9383 | |
| Figura 2D, δ | Test t accoppiato | t(12) = 2,580, p = 0,02 | |
| Figura 2E, θ | Test t accoppiato | t(12) = 1,934, p = 0,08 | |
| Figura 2F, β | Test t accoppiato | t(12) = 1,639, p = 0,13 | |
| Figura 3C, δ | Test t non accoppiato | t(11) = 2,353, p = 0,04 | |
| Figura 3D, θ | Test t non accoppiato | t(11) = 1,264, p = 0,23 | |
| Figura 3E, % tempo in nido | Test t non accoppiato | t(11) = 0,09022, p = 0,9297 | |
| Figura 3F% tempo capezzolo attaccato al capezzolo | Test t non accoppiato | t(10) = 0,4373, p = 0,6712 | |
| Figura 4C, δ | ANOVA a senso unico | F(3,12) = 4,704, p = 0,0215 | SAL-FLX vs SAL-SAL: p = 0,012SAL-FLX vs KET-FLX: p = 0,008SAL-FLX vs KET-SAL: p = 0,010SAL-SAL vs KET-FLX: p = 0,829SAL-SAL vs KET-SAL: p = 0,920KET-FLX vs KET-SAL: p = 0,908 |
| Figura 4E, USVs | ANOVA a senso unico | F(3,20) = 2,039, p = 0,1407 |
L’effetto della presenza materna sull’attività dei PFC dei cuccioli è mediato da 5-HT2R
Abbiamo poi testato se il sistema serotoninergico contribuisce alla modulazione dell’attività del PFC nel cucciolo in risposta alla presenza materna. Abbiamo usato la chetanserina per inibire il 5-HT2R. In ogni sessione di registrazione, un cucciolo è stato selezionato a caso e iniettato (per via intraperitoneale) con un veicolo (0,9% di soluzione fisiologica) o con chetanserina (2,5 mg/kg). Quindici minuti dopo l’iniezione, LFP è stato registrato per 1 h mentre contemporaneamente si registrava se la diga era dentro o fuori dal nido(Fig. 3A). I dati sono stati espressi come rapporto di potenza della LFP in entrata e in uscita dal nido*100. Come mostrato in Figura 4C,D e descritto di seguito, non vi è stato alcun effetto della ketanserina sull’attività della LFP durante la linea di base (isolamento).
Quando abbiamo analizzato i dati all’interno delle bande di frequenza oscillatorie di interesse, abbiamo osservato una significativa riduzione dell’effetto della presenza materna negli animali iniettati di chetanserina nella δ (t(11)= 2, 353, p = 0 , 04, test t non accoppiato; Fig. 3B,C) ma non in banda θ (t(11)= 1, 264, p = 0 , 23, prova t non accoppiata; Fig. 3B-D). Abbiamo verificato che questa differenza non era legata a cambiamenti nel comportamento delle dighe. Per valutare questo, abbiamo misurato la percentuale di tempo che la diga ha trascorso nel nido, così come il numero di volte che la diga è entrata nel nido e non abbiamo trovato alcuna differenza tra i due gruppi(t(11) = 0,09022, p = 0,9297, test t non accoppiato; Fig. 3E). Inoltre, in un gruppo separato di animali, abbiamo testato se il comportamento infermieristico è stato influenzato nei cuccioli iniettati di ketanserina. Non abbiamo trovato alcuna differenza nel tempo di attacco del capezzolo tra la soluzione salina e gli animali iniettati di ketanserina(t(10) = 0,4373, p = 0,6712, test t non accoppiato; Fig. 3F).
Abbiamo così dimostrato che il blocco 5-HT2R inibisce l’effetto della presenza materna sulla frequenza oscillatoria LFP più bassa.
Migliorare la trasmissione serotoninergica nei cuccioli isolati è sufficiente per aumentare la potenza LFP in bande a bassa frequenza rispetto ai controlli
In quest’ultimo esperimento, abbiamo testato se un aumento artificiale di 5-HT è sufficiente per aumentare la potenza di oscillazione a bassa frequenza nei cuccioli isolati rispetto ai controlli. Per fare ciò, i cuccioli sono stati iniettati con la SSRI-fluoxetina (10 mg / kg). Per testare la specificità dell’azione della fluoxetina sulla trasmissione serotoninergica, la chetanserina è stata usata per inibire il 5-HT2R (2,5 mg/kg). Nella prima parte di questo esperimento, ogni singolo cucciolo è stato collocato e registrato per 15 minuti in isolamento in un becher di plastica da 500 ml, poi sono stati selezionati a caso per ricevere veicolo o chetanserina, iniettato, e riposto nella gabbia di casa. Un’ora dopo, ogni cucciolo è stato selezionato in modo pseudo casuale per ricevere fluoxetina o veicolo. Dopo un tempo di attesa di 15 minuti, l’attività del PFC dei cuccioli è stata registrata per 30 minuti mentre erano isolati (Fig.4A). Questo disegno ha portato a quattro gruppi di trattamento: salina-salina; fluoxetina salina; chetanserina-salina; e una chetanserina-fluoxetina(Fig. 4A).
Quando ogni banda di frequenza di interesse (bande δ e θ) è stata analizzata, abbiamo osservato un aumento del gruppo salino-fluoxetina nel δ (F(3,12) = 4,704, p = 0,0215, a senso unico ANOVA; LSD post hoc test; Fig. 4B,C Tabella 1) e bande θ rispetto agli altri gruppi di trattamento (F(3,12) = 3,668, p = 0 , 0439, ANOVA unidirezionale; LSD post hoc test; Fig. 4B-D; Tabella 1). Questi dati suggeriscono che l’aumento della segnalazione serotoninergica, quando i cuccioli sono isolati dalla diga, è sufficiente per aumentare la potenza a bassa frequenza dell’LFP rispetto ai controlli. Inoltre, questo effetto è stato completamente abolito dal blocco 5-HT2R, sostenendo ulteriormente che gli effetti della neurotrasmissione serotoninergica sulle LFP corticali nel nostro modello sono mediati attraverso 5-HT2R. È importante notare che l’antagonismo 5-HT2R da solo non ha modificato le LFP durante le condizioni di base (cioè, salina / salina vs chetanserina / salina non differivano in modo significativo; Tabella 1). Abbiamo così dimostrato in cuccioli isolati, che l’attività del PFC nella banda a bassa frequenza può essere aumentata artificialmente aumentando 5-HT rispetto ai controlli, un aumento osservato anche quando la diga era nel nido.
Quando sono separati dalla madre e dai figli, i cuccioli di ratto emettono USV in frequenze comprese tra 30 e 65 kHz, un intervallo generalmente indicato come chiamata di soccorso(Simola, 2015). Queste chiamate sono state ridotte da diversi farmaci antidepressivi, tra cui la fluoxetina(Simola, 2015). Coerentemente con la letteratura, anche se non statisticamente significativa, abbiamo trovato una tendenza alla riduzione del numero di USV nel gruppo trattato con fluoxetina. Inoltre, la ketanserina non sembra bloccare la riduzione degli USV nei cuccioli trattati con fluoxetina e da sola tende a ridurre il numero di USV(F(3,20) = 2,039, p = 0,1407, ANOVA unidirezionale).
Discussione
L’attività neuronale durante lo sviluppo modella l’anatomia neuronale, la connettività e la funzione. E’ stato fatto un ampio lavoro, specialmente nel sistema visivo, per stabilire come l’esperienza ambientale e le oscillazioni neurali durante i periodi critici dello sviluppo influenzino lo sviluppo e la funzione neuronale(Katz e Shatz, 1996). Durante la prima infanzia, il comportamento materno è una fonte importante di input ambientale per il cucciolo. I modelli di abuso/negazione materna hanno implicato una scarsa cura materna come fattore critico nello sviluppo di deficit cognitivi ed emotivi nella prole in età avanzata, che è stato supportato dalla letteratura umana sullo sviluppo e collegato causalmente all’interno della letteratura animale a partire dagli anni ’50 utilizzando una miriade di paradigmi, tra cui la separazione materna, la leccata alta/bassa dei cuccioli e la riduzione delle risorse materne per la costruzione del nido(Hofer, 1994; Liu et al., 1997; Krugers et al., 2017; Walker et al., 2017). Tuttavia, una ricerca minima si è concentrata su come la presenza materna influisce sulla risposta immediata del cervello del neonato. Utilizzando un sistema di registrazione wireless LFP che ha permesso una valutazione indisturbata, diretta e simultanea dell’effetto della presenza materna sull’attività cerebrale dei cuccioli, i nostri risultati indicano il contatto materno con i cuccioli nel nido come uno dei principali regolatori dell’attività neuronale.
Questo studio stabilisce un contributo di 5-HT nella regolazione delle oscillazioni corticali dei cuccioli. In particolare, abbiamo dimostrato che il contatto materno è correlato ad un aumento delle oscillazioni a bassa frequenza nella regione ACC del PFC, e questo aumento è mediato da 5-HT2R. Inoltre, abbiamo trovato che l’aumento della trasmissione serotoninergica utilizzando un SSRI è sufficiente per aumentare la potenza LFP nelle bande a bassa frequenza in un modello simile a quello ottenuto quando la diga è in contatto con il cucciolo. È importante notare che questo regolamento è stato anche abolito bloccando il 5-HT2R. Insieme, questi risultati stabiliscono che il sistema serotoninergico fa parte della rete coinvolta nella modulazione dell’attività cerebrale dei cuccioli in risposta alla presenza materna.
Influenza della presenza/assenza materna nel nido sull’attività cerebrale dei cuccioli: importanza delle oscillazioni a bassa frequenza e del PFC
La presenza/assenza materna può avere un impatto critico sugli animali in via di sviluppo. Tra le altre cose, modula il rilascio degli ormoni dello stress, modifica gli USV e fornisce input olfatto-tattili ai cuccioli(Kuhn e Schanberg ,1998; Ise e Ohta, 2009; Hanganu-Opatz, 2010).
Relativamente all’attività neuronale, abbiamo scoperto che la presenza materna nel nido aumenta la potenza LFP nelle bande a bassa frequenza del PFC(Fig. 2). Questo aumento della potenza corticale della LFP può essere correlato a vari fattori durante il periodo di nidificazione. Anche se non abbiamo monitorato l’attività specifica della diga nel nido, possiamo ipotizzare, sulla base del lavoro precedente, che questo aumento sia correlato a (1) l’attaccamento del capezzolo, che ha dimostrato di indurre un aumento della banda a bassa frequenza nella corteccia somatosensoriale(Sarro et al., 2014); (2) alla stimolazione tattile derivante dalla madre/littermate, che ha dimostrato di guidare l’attività della corteccia somatosensoriale(Yang et al., 2009; Akhmetshina et al., 2016a); (3) alla stimolazione olfattiva materna(Moriceau e Sullivan, 2005, 2006) e molto probabilmente ad una combinazione di questi ed altri fattori.
I nostri risultati confermano l’importanza delle oscillazioni della banda a bassa frequenza della LFP nei cuccioli giovani. L’attività oscillatoria lenta è ritenuta importante nel coordinamento tra le regioni cerebrali a lunga distanza e si propone anche di essere fondamentale per lo sviluppo(Khazipov e Luhmann, 2006; Uhlhaas et al., 2010). In particolare, negli esseri umani prematuri, utilizzando l’elettroencefalografia, è stata osservata l’attività ritmica e la banda oscillatoria δ è stata descritta come la principale banda di frequenza oscillatoria, sulla quale si possono sovrapporre ritmi più veloci, cioè i pennelli δ, (per la revisione, vedi Khazipov e Luhmann, 2006). È interessante notare che i pennelli δ sono stati proposti come biomarcatori per rilevare i deficit neurocognitivi nei neonati umani (Whiteheadet al., 2017). Nei roditori, pochi studi hanno registrato l’attività neuronale nei cuccioli in vivo, ma nei cuccioli di ratto P1-P8, Khazipov et al. (2004) hanno dimostrato l’emergere di fusi nella corteccia somatosensoriale legati all’integrazione sensoriale-motoria pensato per essere analogo ai pennelli δ negli esseri umani. Inoltre, Adelsberger et al. (2005) hanno anche rivelato, in vivo, un’intrinseca attività ritmica neocorticale di calcio neocorticale lenta attività ritmica nei cuccioli di topo a riposo. L’effetto della presenza materna che abbiamo osservato sul potere di oscillazione lenta della LFP potrebbe quindi avere effetti critici sul cervello in via di sviluppo.
L’effetto sul PFC è di grande interesse in quanto si tratta di una struttura coinvolta in una vasta gamma di funzioni come il controllo esecutivo o la memoria di lavoro(Miller e Cohen, 2001). Come evidenziato da Kolb et al. (2012), il PFC ha un lungo periodo di sviluppo e l’esperienza della prima infanzia, come l’assistenza materna, può influenzare criticamente questo sviluppo portando a conseguenze a lungo termine in età adulta. Infatti, è stato dimostrato che la separazione materna porta alla modificazione dell’arborizzazione dendritica nei neuroni piramidali del PFC(Monroy et al., 2010; González-Mariscal e Melo, 2017). Inoltre, Chugani et al. (2001) hanno mostrato che gli orfani istituzionalizzati mostrano un metabolismo glucidico ridotto nelle aree prefrontaliere associate a deficit neurocognitivi. Criticamente, è stato anche dimostrato che la separazione materna precoce modifica la rete prefrontale-hippocampale nei ratti registrati a P21-P22, soprattutto nei maschi (Reinckee Hanganu-Opatz, 2017). In particolare, gli autori mostrano una diminuzione della potenza della banda oscillatoria LFP θ-β nella parte prelimbica del PFC così come una diminuzione dei picchi di neuroni prefrontalieri che bloccano la fase di oscillazione θ registrata nell’ippocampo. Questo studio evidenzia il fatto che una vasta rete di strutture può essere influenzata dalle interazioni materne.
Ruolo della serotonina nella modulazione dell’attività neurale dei cuccioli da parte delle cure materne
I giovani animali altricial si basano sulla regolazione materna della loro funzione fisiologica e omeostasi attraverso stimoli sensoriali ricevuti durante la cura materna, compresi gli stimoli somatosensoriali e chemiosensoriali(Hofer, 1994). L’influenza della stimolazione sensoriale sul comportamento immediato del lattante e sulla funzione neurocomportamentale del neonato è stata documentata da decenni di ricerca. Questo lavoro ha evidenziato un ruolo importante per i livelli di glucocorticoidi(Levine, 1967; Meaney et al., 1988). Studi successivi hanno dimostrato che il maneggiamento/licking/grooming regolano la trascrizione dei recettori dei glucocorticoidi attraverso il sistema serotoninergico(Mitchell et al., 1990, 1992; Laplante et al., 2002; Hellstrom et al., 2012). È interessante notare che nei ratti, la separazione materna diminuisce il rapporto 5-HIAA/5-HT nel PFC(Xue et al., 2013; González-Mariscal e Melo, 2017). Rispetto ai diversi sottotipi di recettori 5HT, è stato dimostrato che gli animali sottoposti a separazione materna mostrano una deregolamentazione della funzione 5-HT2R(Benekareddy et al., 2010). Insieme a queste linee di evidenza, mostrando un contributo della segnalazione serotoninergica all’effetto della presenza materna sull’attività cerebrale dei cuccioli, abbiamo trovato, in vivo nei cuccioli che si comportano bene, che la segnalazione serotoninergica di blocco tramite 5-HT2R ha abolito l’aumento di potenza nelle bande a bassa frequenza osservate quando la diga era nel nido (Fig.3). Questo effetto non è stato dovuto ad un generale abbassamento della potenza della LFP a causa dell’antagonista 5-HT2R chetanserina, in quanto non abbiamo osservato un cambiamento nell’attività corticale tra animali iniettati con soluzione fisiologica e chetanserina(Fig. 4C,D). L’effetto della ketanserina che abbiamo osservato potrebbe essere indiretto e legato ad un cambiamento del comportamento della diga nei confronti del cucciolo iniettato (cioè, toelettatura, allattamento) noto per modulare in modo differenziato l’attività LFP del cucciolo (Sarro etal., 2014). Non abbiamo registrato i comportamenti specifici della diga nel nido, tuttavia non abbiamo trovato differenze nella frequenza e nella durata del tempo che la diga ha trascorso nel nido, né il tempo che i cuccioli hanno trascorso attaccati al capezzolo (eseguito in un diverso gruppo di animali), tra i gruppi di ketanserin e quelli iniettati con soluzione fisiologica.
In futuro, sarebbe interessante misurare in tempo reale il rilascio di 5-HT durante l’interazione materna utilizzando la microdialisi o la voltammetria ciclica. Purtroppo, queste tecniche, allo stato attuale della tecnica, non possono essere eseguite senza fili, pregiudicando così le analisi durante l’interazione attiva tra madre e madre.
Infine, abbiamo scoperto che il miglioramento della segnalazione 5-HT utilizzando un SSRI induce un aumento della potenza oscillatoria a bassa banda di frequenza LFP in cuccioli isolati rispetto ai controlli. Questo effetto può essere correlato ad esempio con i cambiamenti nel comportamento del cucciolo (ad esempio, USVs), o / e l’attività in altre aree cerebrali, per esempio, il citalopram SSRI è stato dimostrato di ridurre le attività spontanee, così come gli evocati sensoriali, nella corteccia barile di P2-P5 cuccioli di ratto (Akhmetshinaet al., 2016b). Tuttavia, dai nostri dati, non sembra che la modulazione dell’attività corticale possa essere attribuita solo a cambiamenti negli USV. Infatti, e coerentemente con gli studi precedenti, abbiamo riscontrato una tendenza alla riduzione del numero di USV nei cuccioli iniettati di fluoxetina(Simola, 2015). Tuttavia, abbiamo scoperto che la chetanserina non sembra bloccare la riduzione degli USV nei cuccioli trattati con fluoxetina e inoltre, come descritto in precedenza, la chetanserina da sola sembra ridurre gli USV(Schreiber et al., 1998). Questi dati suggeriscono quindi una dissociazione tra USVs e LFP nelle nostre condizioni di trattamento.
La stretta regolazione dei livelli di 5-HT durante lo sviluppo è di estrema importanza, con livelli sia bassi che alti di segnalazione serotoninergica che sembrano essere dannosi. Infatti, sembra che ci sia un periodo critico e un range ottimale del livello di 5-HT e che qualsiasi deviazione da questo range possa alterare il normale sviluppo del cervello(Yu et al., 2014; Suri et al., 2015; Gingrich et al., 2017). Ad esempio, la somministrazione della fluoxetina SSRI ai cuccioli di roditori ha dimostrato di portare a deficit comportamentali in età adulta(Ansorge et al., 2004; Sarkar et al., 2014; Rebello et al., 2014). È interessante notare che questi deficit comportamentali sono evitati con la somministrazione concomitante di fluoxetina e chetanserina(Sarkar et al., 2014). Inoltre, il trattamento con l’antagonista 5-HT2R, la chetanserina, ha impedito l’emergere di comportamenti ansiosi e cambiamenti nell’espressione 5-HT2R associati alla separazione materna(Benekareddy et al., 2011).
Conclusione
In questo rapporto, riveliamo che la presenza materna modula l’attività corticale dei cuccioli attraverso il sistema serotoninergico, sottolineando l’importanza della cura materna nell’attività di questo sistema strettamente regolato. 5-HT è uno dei neuromodulatori coinvolti nella regolazione dell’attività cerebrale della prole da parte delle cure materne, altri neuromodulatori e regioni cerebrali sono probabilmente coinvolti congiuntamente o in parallelo come la noradrenalina nella corteccia somatosensoriale (Sarroet al., 2014) o l’acetilcolina nella rete prefrontale-hippocampale (Janieschet al., 2011). Ulteriori studi ci aiuteranno a sezionare l’intera estensione di questa modulazione.
References
- Cortical calcium waves in resting newborn mice. Nat Neurosci. 2005; 8:988-990. DOI | PubMed
- The nature of the sensory input to the neonatal rat barrel cortex. J Neurosci. 2016a; 36:9922-9932. DOI | PubMed
- The serotonin reuptake inhibitor citalopram suppresses activity in the neonatal rat barrel cortex in vivo. Brain Res Bull. 2016b; 124:48-54. DOI | PubMed
- Brain serotonin determines maternal behavior and offspring survival. Genes Brain Behav. 2014; 13:579-591. DOI | PubMed
- Early-life blockade of the 5-HT transporter alters emotional behavior in adult mice. Science. 2004; 306:879-881. DOI | PubMed
- Inhibition of serotonin but not norepinephrine transport during development produces delayed, persistent perturbations of emotional behaviors in mice. J Neurosci. 2008; 28:199-207. DOI | PubMed
- The pharmacology of ketanserin, the first selective serotonin S2‐antagonist. Drug Dev Res. 1985; 6:263-300. DOI
- Transitions in infant learning are modulated by dopamine in the amygdala. Nat Neurosci. 2009; 12:1367-1369. DOI | PubMed
- Dissociation of working memory from decision making within the human prefrontal cortex. J Neurosci. 1998; 18:428-437. DOI | PubMed
- Serotonergic regulation of membrane potential in developing rat prefrontal cortex: coordinated expression of 5-hydroxytryptamine (5-HT)1A, 5-HT2A, and 5-HT7 receptors. J Neurosci. 2004; 24:4807-4817. DOI | PubMed
- Enhanced function of prefrontal serotonin 5-HT(2) receptors in a rat model of psychiatric vulnerability. J Neurosci. 2010; 30:12138-12150. DOI | PubMed
- Postnatal serotonin type 2 receptor blockade prevents the emergence of anxiety behavior, dysregulated stress-induced immediate early gene responses, and specific transcriptional changes that arise following early life stress. Biol Psychiatry. 2011; 70:1024-1032. DOI | PubMed
- Social origins of developmental risk for mental and physical illness. J Neurosci. 2017; 37:10783-10791. DOI | PubMed
- Serotonin modulation of cortical neurons and networks. Front Integr Neurosci. 2013; 7:25. DOI | PubMed
- Activity-dependent synaptic plasticity modulates the critical phase of brain development. Brain Dev. 2016; 38:355-363. DOI | PubMed
- Local brain functional activity following early deprivation: a study of postinstitutionalized Romanian orphans. Neuroimage. 2001; 14:1290-1301. DOI | PubMed
- Theta oscillations during active sleep synchronize the developing rubro-hippocampal sensorimotor network. Curr Biol. 2017; 27:1413-1424.e4. DOI | PubMed
- Maternal separation and the risk of drug abuse in later life. Addict Health. 2016; 8:107-114. PubMed
- Working memory in the prefrontal cortex. Brain Sci. 2017; 7:49. DOI
- New insights into how serotonin selective reuptake inhibitors shape the developing brain. Birth Defects Res. 2017; 109:924-932. DOI | PubMed
- Bidirectional effects of mother-young contact on the maternal and neonatal brains. Adv Exp Med Biol. 2017; 1015:97-116. DOI | PubMed
- Between molecules and experience: role of early patterns of coordinated activity for the development of cortical maps and sensory abilities. Brain Res Rev. 2010; 64:160-176. DOI | PubMed
- Maternal licking regulates hippocampal glucocorticoid receptor transcription through a thyroid hormone–serotonin–NGFI-A signalling cascade. Philos Trans R Soc Lond B Biol Sci. 2012; 367:2495-2510. DOI | PubMed
- Early relationships as regulators of infant physiology and behavior. Acta Paediatr Suppl.. 1994; 397:9-18. PubMed
- Transient postnatal elevation of serotonin levels in mouse neocortex. Brain Res. 1988; 471:163-166. PubMed
- Power spectrum analysis of ultrasonic vocalization elicited by maternal separation in rat pups. Brain Res. 2009; 1283:58-64. DOI | PubMed
- Cholinergic control in developing prefrontal-hippocampal networks. J Neurosci. 2011; 31:17955-17970. DOI | PubMed
- Synaptic activity and the construction of cortical circuits. Science. 1996; 274:1133-1138. PubMed
- Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends Neurosci. 2006; 29:414-418. DOI | PubMed
- Early motor activity drives spindle bursts in the developing somatosensory cortex. Nature. 2004; 432:758-761. DOI | PubMed
- Experience and the developing prefrontal cortex. Proc Natl Acad Sci USA. 2012; 109:17186-17193. DOI | PubMed
- Early life adversity: lasting consequences for emotional learning. Neurobiol Stress. 2017; 6:14-21. DOI | PubMed
- Responses to maternal separation: mechanisms and mediators. Int J Dev Neurosci. 1998; 16:261-270. PubMed
- Serotonin regulates hippocampal glucocorticoid receptor expression via a 5-HT7 receptor. Brain Res Dev Brain Res. 2002; 139:199-203. DOI | PubMed
- Maternal and environmental influences on the adrenocortical response to stress in weanling rats. Science. 1967; 156:258-260. PubMed
- Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress. Science. 1997; 277:1659-1662. PubMed
- Effect of neonatal handling on age-related impairments associated with the hippocampus. Science. 1988; 239:766-768. PubMed
- An integrative theory of prefrontal cortex function. Annu Rev Neurosci. 2001; 24:167-202. DOI | PubMed
- Serotonin regulates type II corticosteroid receptor binding in hippocampal cell cultures. J Neurosci. 1990; 10:1745-1752. DOI | PubMed
- Serotonergic regulation of type II corticosteroid receptor binding in hippocampal cell cultures: evidence for the importance of serotonin-induced changes in cAMP levels. Neuroscience. 1992; 48:631-639. PubMed
- Maternal separation disrupts dendritic morphology of neurons in prefrontal cortex, hippocampus, and nucleus accumbens in male rat offspring. J Chem Neuroanat. 2010; 40:93-101. DOI | PubMed
- Neurobiology of infant attachment. Dev Psychobiol. 2005; 47:230-242. DOI | PubMed
- Maternal presence serves as a switch between learning fear and attraction in infancy. Nat Neurosci. 2006; 9:1004-1006. DOI | PubMed
- The neurobiological toll of early human deprivation. Monogr Soc Res Child Dev. 2011; 76:127-146. DOI | PubMed
- Inhibition of mediodorsal thalamus disrupts thalamofrontal connectivity and cognition. Neuron. 2013; 77:1151-1162. DOI | PubMed
- Postnatal day 2 to 11 constitutes a 5-HT-sensitive period impacting adult mPFC function. J Neurosci. 2014; 34:12379-12393. DOI | PubMed
- Early-life stress impairs recognition memory and perturbs the functional maturation of prefrontal-hippocampal-perirhinal networks. Sci Rep. 2017; 7:42042. DOI | PubMed
- Enduring good memories of infant trauma: rescue of adult neurobehavioral deficits via amygdala serotonin and corticosterone interaction. Proc Natl Acad Sci USA. 2015; 112:881-886. DOI | PubMed
- Development of activity level in children revisited: effects of mother presence. Dev Psychol. 1978; 14:571. DOI
- A systematic look at environmental modulation and its impact in brain development. Trends Neurosci. 2018; 41:4-17. DOI | PubMed
- Postnatal fluoxetine-evoked anxiety is prevented by concomitant 5-HT2A/C receptor blockade and mimicked by postnatal 5-HT2A/C receptor stimulation. Biol Psychiatry. 2014; 76:858-868. DOI | PubMed
- Maternal regulation of infant brain state. Curr Biol. 2014; 24:1664-1669. DOI | PubMed
- Teaching old rats new tricks: age-related impairments in olfactory reversal learning. Neurobiol Aging. 2002; 23:555-564. PubMed
- The role of 5-HT receptor subtypes in the anxiolytic effects of selective serotonin reuptake inhibitors in the rat ultrasonic vocalization test. Psychopharmacology. 1998; 135:383-391. PubMed
- Involvement of the rat anterior cingulate cortex in control of instrumental responses guided by reward expectancy. Learn Mem. 2005; 12:334-342. DOI | PubMed
- Rat ultrasonic vocalizations and behavioral neuropharmacology: from the screening of drugs to the study of disease. Curr Neuropharmacol. 2015; 13:164-179. DOI | PubMed
- Monoamine-sensitive developmental periods impacting adult emotional and cognitive behaviors. Neuropsychopharmacology. 2015; 40:88-112. DOI | PubMed
- Behavioral assessment of emotion discrimination, emotion regulation, and cognitive control in childhood, adolescence, and adulthood. Front Psychol. 2011; 2:39. DOI | PubMed
- Neural synchrony and the development of cortical networks. Trends Cogn Sci. 2010; 14:72-80. DOI | PubMed
- U.S. Department of Health and Human Services. Child maltreatment 2009. US Government Printing Office: Washington, DC; 2010.
- Early maternal separation: a rodent model of depression and a prevailing human condition. Pharmacol Rep. 2013; 65:1451-1461. DOI | PubMed
- Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: critical considerations of methodology, outcomes and translational potential. Stress. 2017; 20:421-448. DOI | PubMed
- Characteristics and clinical significance of delta brushes in the EEG of premature infants. Clin Neurophysiol Pract. 2017; 2:12-18. DOI | PubMed
- Maternal separation induces alterations of serotonergic system in different aged rats. Brain Res Bull. 2013; 95:15-20. DOI | PubMed
- Three patterns of oscillatory activity differentially synchronize developing neocortical networks in vivo. J Neurosci. 2009; 29:9011-9025. DOI | PubMed
- Dopamine and serotonin signaling during two sensitive developmental periods differentially impact adult aggressive and affective behaviors in mice. Mol Psychiatry. 2014; 19:688-698. DOI | PubMed
Fonte
Courtiol E, Wilson DA, Shah R, Sullivan RM, Teixeira CM, et al. (2018) Maternal Regulation of Pups’ Cortical Activity: Role of Serotonergic Signaling. eNeuro 5(4): ENEURO.0093-18.2018. https://doi.org/10.1523/ENEURO.0093-18.2018





