Abstract
Dichiarazione di rilevanza
Qui mostriamo come le informazioni di una sequenza di eventi siano prioritarie nel buffer di manutenzione della memoria di lavoro negli esseri umani. I partecipanti hanno mantenuto tre stimoli visivi consecutivi, e abbiamo decodificato il contenuto del mantenimento della memoria di lavoro utilizzando la classificazione multivariata del modello e la magnetoencefalografia. Abbiamo osservato che gli eventi meno frequentati durante la codifica hanno dominato il contenuto della memoria di lavoro immediatamente dopo la conservazione off-line. In sostanza, il cervello amplifica in modo selettivo e intelligente l’elemento di memoria meno codificato per massimizzare la fedeltà del richiamo, invece di provare ugualmente l’intera sequenza. Le nostre scoperte spostano il ruolo funzionale della memoria di lavoro da una facoltà che “lavora con la memoria” ad una che “lavora per la memoria”, selezionando attivamente quali elementi codificati devono essere migliorati per essere ricordati.
Introduzione
La memoria di lavoro è concettualizzata come un meccanismo per mantenere e manipolare attivamente le informazioni(Baddeley, 1992). È considerata costituita da più strati, tra cui la memoria a lungo termine e un buffer di manutenzione, che è anche noto come il centro dell’attenzione durante la manutenzione(Oberauer, 2002; Baddeley , 2010) che interagisce con la memoria a lungo termine. Il mantenimento della memoria di lavoro è associato a una riattivazione delle informazioni nei primati non umani(Miller et al., 1993; Lee et al., 2005; Woloszyn e Sheinberg, 2009) e negli esseri umani(Lepsien e Nobre, 2007; Harrison e Tong, 2009; Fuentemilla et al., 2010). Qui abbiamo indagato il contenuto rappresentazionale del mantenimento di una sequenza di stimoli multipli nella memoria di lavoro. Per decodificare il contenuto rappresentazionale, abbiamo usato l’analisi multivariata dei pattern delle registrazioni della magnetoencefalografia (MEG)(Jafarpour et al., 2013; Cichy et al., 2014).
Abbiamo affrontato due ipotesi. La prima ipotesi è che gli stimoli siano mantenuti in una struttura circolare e ripetitiva. Questa ipotesi è stata motivata dal modello di codifica temporale del mantenimento della memoria di lavoro, che propone che il meccanismo di replay conservi l’ordine temporale in cui gli stimoli sono stati incontrati(Lisman, 2010; Jensen et al., 2014). Così, la sequenza di 1-2-3 prove circolari come 1-2-3-1-2-2-3-3-1-2-3-etc. Tale dinamica è stata riportata nel lobo temporale mediale dei roditori(Jensen e Lisman, 1996) e nella corteccia prefrontale dei primati non umani(Siegel et al., 2009). Il supporto per il modello di codifica temporale viene anche da un recente studio MEG umano(Heusser et al., 2016). In tale studio, adattando il modello di codifica temporale al cervello intero, la fonte di dati MEG ha fornito prove localizzate per il modello nell’ippocampo umano(Heusser et al., 2016). Tuttavia, l’attività trial-by-trial della corteccia prefrontale di un primate non umano supporta un modello di codifica dinamica della memoria di lavoro, piuttosto che il modello di codifica temporale(Lundqvist et al., 2016). Il modello di codifica dinamica suggerisce che gli oggetti sono mantenuti in uno “stato di attività silenziosa” e che la riproduzione è guidata dall’attenzione (Stokes,2015; Myers et al., 2017). L’attenzione alla codifica potrebbe quindi dare priorità al contenuto della memoria di lavoro in modo tale che il mantenimento della memoria di lavoro sia dominato da uno stimolo selezionato piuttosto che dalla sequenza completa da memorizzare. Ad esempio, sarebbe più efficace dal punto di vista delle risorse dare priorità agli stimoli meno privilegiati della codifica da riprodurre nella memoria di lavoro(Zokaei et al., 2014; Stokes, 2015; Rose et al., 2016).
Qui abbiamo usato i dati MEG dell’intero cervello per decodificare il contenuto della memoria di lavoro. Il nostro esperimento era una versione modificata del compito di Sternberg, dove si doveva mantenere una sequenza di tre stimoli visivi. Gli oggetti di tre distinte categorie visive [facce (Fs), oggetti fabbricati e oggetti naturali] sono stati presentati successivamente (il set di stimoli conteneva campioni degli stessi oggetti da prospettive diverse; Fig. 1B) seguita da un periodo di ritardo di 5000 ms. Dopo il ritardo, una sonda ha interrogato l’identità dello stimolo (test di dettaglio) e una seconda sonda ha interrogato la sequenza dei tre elementi (test di primo, secondo o terzo ordine; Fig. 1).
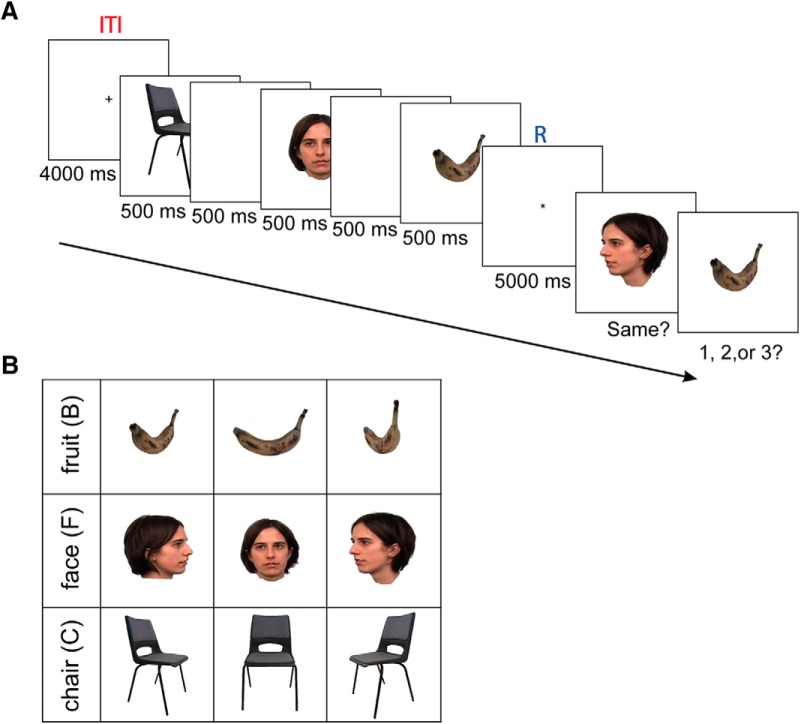
Figura 1.Paradigma sperimentale della memoria di lavoro. ASono stati presentati tre stimoli in sequenza, ciascuno per 500 ms ciascuno e con un intervallo di 500 ms tra di loro. C’è stato un periodo di ritenzione di 5000 ms tra la presentazione del terzo stimolo e i test della sonda di memoria. I test della sonda di memoria hanno comportato un giudizio “uguale” o “diverso” e una decisione di ordine temporale. Un intervallo intertriale di 4000 ms ha preceduto la prova successiva. Il periodo R è mostrato in blu, e l’ITI è mostrato in rosso. BGli stimoli sono stati utilizzati in questo esperimento come segue un B, un F e un C da tre punti di vista, 60° a sinistra, davanti, 60° a destra.
I classificatori di modelli sono stati formati su rappresentazioni categoriche di stimoli visivi in brevi intervalli di tempo (20 ms) durante la codifica(Carlson et al., 2013; Jafarpour et al., 2014). I classificatori hanno etichettato il segnale in corso durante i periodi di ritenzione (R) e di intervallo intertriale (ITI) per il controllo. Secondo l’output dei classificatori [faccia, banana (B), sedia (C), o “nessuno” (N) per nessun replay], è stata costruita una matrice a catena di Markov di transizioni tra stimoli riprodotti e nessuno (Fig. 2). Con tre stimoli, abbiamo potuto testare la direzione di replay (cioè 1-2-3 vs 3-2-1). Una matrice a catena di Markov delle transizioni quantificava la riproduzione direzionale delle sequenze. La probabilità di transizione dallo stato 1-2, 2-3, e 3-1 sarebbe più alta della probabilità di transizione dallo stato 1-3, 3-2, e 2-1 se ci fosse un replay in avanti e il modello inverso sarebbe osservato per il replay all’indietro.
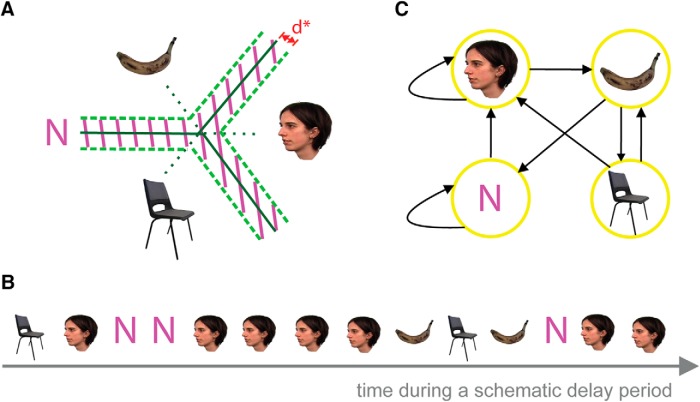
Figura 2.Schema dell’analisi del modello multivariato utilizzando SVM. ALo stato di attività neurale durante i periodi di ritardo (periodo R o ITI) è stato decodificato ad ogni bin di tempo, utilizzando tre classificatori a coppie. Una soglia conservatrice di d*(rappresentata in rosso) è stata usata per rifiutare le rappresentazioni che erano vicine al confine e classificarle come N (l’area ombreggiata). BUn esempio schematico di stati decodificati durante un periodo di ritardo. CIl modello a catena di Markov a tempo discreto della transizione di stato estratto dalla sequenza schematica in B.
Un algoritmo di supporto macchina vettoriale è stato utilizzato per la decodifica delle informazioni categoriali (a coppie) a -20 a 500 ms dall’inizio degli stimoli visivi durante la codifica. Si noti che la rappresentazione categoriale e la rappresentazione specifica dell’elemento si sovrappongono nel nostro caso, perché in questo studio abbiamo usato solo un campione di una categoria(Fig. 1B). Abbiamo addestrato i classificatori sull’ampiezza dei segnali MEG a banda larga di un singolo evento e li abbiamo testati con un metodo di validazione incrociata durante la codifica. Abbiamo applicato i classificatori con le migliori prestazioni alla decodifica durante l’intervallo di manutenzione. Per determinare il grado di attenzione durante la codifica, abbiamo analizzato i primi campi correlati all’evento (ERF) ad ogni stimolo.
L’ipotesi del replay mnemonico sequenziale predice l’informazione della sequenza di decodifica o almeno un’uguale probabilità di decodifica per tutti e tre gli stimoli codificati durante la manutenzione. Al contrario, un conto di attenuazione delle priorità predice che il grado di riproduzione degli stimoli durante il periodo di manutenzione dipenderà dalle dimensioni dei primi ERF in fase di codifica.

Figura 1.Paradigma sperimentale della memoria di lavoro. ASono stati presentati tre stimoli in sequenza, ciascuno per 500 ms e con uno scarto di 500 ms tra di loro. C’è stato un periodo di ritenzione di 5000 ms tra la presentazione del terzo stimolo e i test della sonda di memoria. I test della sonda di memoria hanno comportato un giudizio “uguale” o “diverso” e una decisione di ordine temporale. Un intervallo intertriale di 4000 ms ha preceduto la prova successiva. Il periodo R è mostrato in blu, e l’ITI è mostrato in rosso. BGli stimoli sono stati utilizzati in questo esperimento come segue un B, un F e un C da tre punti di vista, 60° a sinistra, davanti, 60° a destra.

Figura 2.Schema dell’analisi del modello multivariato utilizzando SVM. ALo stato di attività neurale durante i periodi di ritardo (periodo R o ITI) è stato decodificato ad ogni bin di tempo, utilizzando tre classificatori a coppie. Una soglia conservatrice di d*(rappresentata in rosso) è stata usata per rifiutare le rappresentazioni che erano vicine al confine e classificarle come N (l’area ombreggiata). BUn esempio schematico di stati decodificati durante un periodo di ritardo. CIl modello a catena di Markov a tempo discreto della transizione di stato estratto dalla sequenza schematica in B.
Materiali e metodi
Partecipanti
A questo esperimento hanno partecipato sedici adulti destrorsi, sani, con visione normale o correlata alla normalità [8 femmine; età media, 24 anni (SD = 2)]. I dati MEG di due partecipanti non sono stati inclusi nell’analisi, in quanto i loro segnali MEG erano troppo rumorosi e sono stati respinti come artefatti (per i dettagli, vedi sotto). Tutti i partecipanti hanno dato il loro consenso informato per iscritto e sono stati compensati finanziariamente per la loro partecipazione. Il Comitato etico di ricerca dell’Università di Londra per la ricerca a base umana ha approvato lo studio.
Progettazione sperimentale
Abbiamo usato una combinazione di un delay-match-to-sample e di compiti Sternberg. L’esperimento consisteva di sei prove, e ogni prova consisteva di 27 prove. I partecipanti hanno avuto una pausa facoltativa di 5 minuti tra una prova e l’altra. Ogni prova conteneva una presentazione sequenziale di tre stimoli, un periodo di ritenzione e due prove con sonda. Una prova è iniziata con un periodo di fissazione (intervallo intertriale) per 4000 ms. Poi una sequenza casuale di tre stimoli è apparsa in sequenza per 500 ms, con un intervallo di 500 ms tra gli stimoli. Un periodo di ritenzione di 5000 ms ha seguito la presentazione del terzo elemento. Infine, è stato presentato uno stimolo sonda per testare la memoria dell’item (delay-match-to-sample), dove i soggetti erano tenuti a selezionare “stesso” se lo stimolo esatto (categoria e prospettiva) era mostrato nella sequenza e “diverso” altrimenti (la prospettiva era diversa). Casualmente, nella metà delle prove, la risposta corretta era “stesso”. Per la seguente domanda, i soggetti dovevano rispondere “1, 2 o 3” a seconda della posizione della sonda nella sequenza (Fig. 1A).
Gli stimoli erano immagini provenienti da tre categorie visive per le quali una precedente ricerca di decodifica multivariata indicava le seguenti rappresentazioni corticali spaziali distinte(Kriegeskorte et al., 2008): un volto, un frutto e un manufatto(Fig. 1B). Le immagini erano da tre diverse prospettive (frontale, 60° a sinistra e 60° a destra) mostrate in verticale su sfondo bianco, estendendo ∼6° di un angolo visivo orizzontale e verticale (le immagini dei volti sono state scaricate da Faces stimulus images Tarrlab, Center for the Neural Basis of Cognition and Department of Psychology, Carnegie Mellon University, Pittsburgh, PA; http://www.tarrlab.org/). I soggetti hanno familiarizzato con gli stimoli al di fuori dello scanner MEG, e hanno anche eseguito l’esperimento con feedback al di fuori dello scanner per assicurarsi di aver capito l’esperimento in modo corretto. Durante l’esperimento non è stato dato alcun feedback all’interno dello scanner MEG. In sei esecuzioni, ciascuna con 27 prove (in totale, ci sono state 162 prove), abbiamo testato tutte le possibili combinazioni sequenziali di tre stimoli. Tutte le possibili combinazioni di tre stimoli sono 162 sequenze: sei combinazioni di sequenze di tre stimoli categorici e tre prospettive di ogni categoria di stimolo (= 6 × 3 × 3 × 3 × 3). Abbiamo presentato le prove in modo casuale, e ogni prova è stata vista una sola volta.
Registrazioni MEG e preelaborazione dei dati
I dati MEG sono stati registrati con un sistema di gradiometro a testa intera CTF Omega a 274 canali (VSM MedTech) con una frequenza di campionamento di 600 Hz con un filtro passa-banda in linea da 0,1 a 200 Hz. La posizione della testa all’interno del sistema è stata monitorata tramite bobine localizzatrici della testa attaccate alla nasione e 1 cm anteriormente ai punti preauricolari destro e sinistro. I partecipanti seduti in posizione eretta, e gli stimoli sono stati retroproiettati su uno schermo di 1 m davanti a loro.
I dati MEG sono stati preprocessati utilizzando il pacchetto SPM12b (Wellcome Trust Center for Neuroimaging, Londra, www.fil.ion.ucl.ac.uk/spm) e analizzati con il software MATLAB R2009b (MathWorks). Abbiamo filtrato il rumore principale (50 Hz) da un segnale continuo utilizzando un filtro Butterworth del quinto ordine. Abbiamo ritagliato i dati MEG durante la codifica in epoche da -100 a 500 ms dall’inizio degli stimoli. Abbiamo scartato qualsiasi epoca con magnitudini di campo >1.5e-11 tesla in qualsiasi canale, perché conteneva artefatti. Due soggetti avevano troppi esperimenti con tali artefatti e sono stati rimossi da ulteriori analisi.
Decodificare la categoria degli stimoli visivi durante la codifica
Una macchina di supporto vettoriale (SVM) con un kernel lineare(Vapnik, 2000), implementata nel software di statistica MATLAB, è stata utilizzata per classificare il segnale generato dall’inizio degli stimoli visivi. Ventisei classificatori sono stati adottati a -20 a 500 ms dall’inizio dello stimolo durante la codifica. La frequenza di campionamento del segnale era di 600 Hz. Il segnale è stato finestrato in intervalli di tempo di 20 ms (13 punti di tempo in ogni intervallo di tempo), centrato a -10, 10, 30, 50, 50, 70, 70, 90, 110, 130, 130, 150, 170, 190, 190, 210, 230, 250, 250, 270, 290, 310, 310, 330, 350, 350, 370, 390, 410, 430, 450, 450, 470 e 490 ms. L’ingresso di prova singolo ai classificatori SVM era l’ampiezza a banda larga in ogni punto temporale e ogni canale (13 × 274 = 3562 caratteristiche) per ogni stimolo. Le caratteristiche sono state normalizzate prima dell’addestramento, e la scala è stata utilizzata per normalizzare le caratteristiche nei dati di prova. Abbiamo usato un test a due code t con una soglia di 0,05 per la riduzione delle caratteristiche.
Abbiamo addestrato tre classificatori a coppie per decodificare la categoria dello stimolo in ogni bin di tempo durante la codifica, indipendentemente dall’ordine di presentazione o dalla prospettiva: faccia contro banana (F contro B), faccia contro sedia (F contro C), e banana contro sedia (B contro C). Abbiamo identificato i cestini del tempo con una classificazione affidabile degli stimoli di categoria e abbiamo addestrato i classificatori sul 90% dei campioni selezionati a caso da ogni categoria e li abbiamo testati sul 10% dei campioni lasciati fuori da ogni categoria (cioè 10 volte la convalida incrociata). Abbiamo selezionato un numero uguale di prove da ogni categoria per l’addestramento e i test.
Abbiamo esaminato le prestazioni di classificazione a livello di gruppo. Per testare l’accuratezza di ogni classificatore rispetto al caso (cioè il 50%), abbiamo usato un test di un campione t con una correzione per confronti multipli [familywise error (FWE)] usando la teoria dei campi casuali (RFT) implementata in SPM(Kilner et al., 2005; Litvak et al., 2011). Come è standard nel neuroimaging, abbiamo fatto inferenze utilizzando una soglia a livello di cluster. La procedura RFT regola le statistiche del valore p che sono funzioni del numero di punti temporali (ripetizione della classificazione). Tale aggiustamento è simile a una correzione Bonferroni. Tuttavia, una correzione Bonferroni è adatta per set di dati che sono indipendenti ad ogni ripetizione (o punto di dati). Qui i dati provenienti da punti temporali adiacenti non sono indipendenti, e la RFT è più adatta per la correzione di confronto multiplo(Kilner et al., 2005; Jafarpour et al., 2014).
Decodifica della categoria degli stimoli visivi durante i periodi di ritardo
I più accurati classificatori di codifica sono stati usati per decodificare il replay durante la manutenzione (il periodo di ritardo tra la codifica e il test) e durante gli ITI(Fig. 2). Per il periodo di ritardo, abbiamo limitato l’analisi ai 1000-4000 ms dopo l’offset dell’ultimo stimolo nella sequenza (sono stati testati 150 bins di tempo) per escludere l’attività evento-correlata suscitata dall’offset dell’ultimo stimolo. Abbiamo selezionato i 3000 ms prima dell’inizio del primo stimolo nella sequenza (di nuovo compresi i 150 time bins) per testare gli ITI.
Le uscite dei tre classificatori a coppie erano etichette di classe (F, B, o C), e la distanza tra l’attività sconosciuta e i confini della decisione di classificazione. Abbiamo determinato le etichette decodificate in base a queste uscite in due fasi. In primo luogo, abbiamo selezionato l’etichetta di classe (tra le tre uscite del classificatore) che aveva la maggiore distanza dai confini di decisione. In secondo luogo, abbiamo usato una soglia per identificare le attività sconosciute che erano troppo vicine ai confini di classificazione. Abbiamo respinto queste classi decodificate e le abbiamo etichettate come N.
Una soglia è stata utilizzata per rifiutare una percentuale di output di classificazione durante il periodo di conservazione. Ad esempio, se la performance del classificatore era affidabile per l’80% del tempo, abbiamo rifiutato il 20% delle etichette dei contenitori di tempo decodificati durante il periodo di conservazione. Abbiamo applicato la stessa soglia conservativa sull’output decodificato durante gli ITI. Seguendo questi passaggi, dai classificatori sono risultate quattro possibili etichette: F, B, C, o N (per le classificazioni rifiutate; Fig. 2).
Sono stati studiati due parametri per quantificare le differenze nella decodifica durante il periodo R e l’ITI a livello di prova per prova. Il primo parametro è stato il numero di bidoni di tempo consecutivi decodificati come lo stesso elemento (cioè un’epoca di decodifica). Abbiamo confrontato la lunghezza dell’epoca decodificata tra il periodo R e l’ITI. Confidavamo che gli elementi decodificati fossero riprodotti solo quando la memoria beneficiava della decodifica (vedi l’analisi sull’effetto della manutenzione attiva sulle risposte comportamentali).
Il secondo parametro era la dinamica di replay estratta dalla catena di Markov. Abbiamo trattato i risultati dei classificatori come uno stato e abbiamo contato il numero di visite agli stati e le transizioni tra di essi durante il periodo R e l’ITI. Abbiamo poi estratto le probabilità di transizioni per ogni soggetto e le abbiamo confrontate tra i periodi di ritenzione e gli intervalli interprocessuali a livello di gruppo utilizzando un test di somma dei gradi Wilcoxon su due lati.
La direzionalità del replay è stata testata utilizzando un test di somma dei gradi Wilcoxon su due lati. Abbiamo effettuato i seguenti confronti: Probabilità di replay in avanti con la probabilità di replay all’indietro. Ipotizzando una probabilità indipendente di replay di ogni stimolo, il replay in avanti era il multiplo della probabilità di transizioni dal primo stimolo al secondo stimolo, dal secondo stimolo al terzo stimolo e dal terzo stimolo al primo stimolo. La riproduzione all’indietro era il multiplo di probabilità di transizioni dal terzo stimolo al secondo stimolo, dal secondo stimolo al primo stimolo, e dal primo stimolo al terzo stimolo.probabilità di transizioni dal primo stimolo al secondo stimolo con probabilità di transizioni dal primo al terzo stimolo.Probabilità di transizioni dal secondo stimolo al primo stimolo con probabilità di transizioni dal secondo al terzo stimolo.probabilità di transizioni dal terzo stimolo al primo stimolo con probabilità di transizioni dal terzo stimolo al secondo stimolo.
Effetto del mantenimento attivo sulle risposte comportamentali
Abbiamo applicato un modello lineare ad effetti misti per valutare l’effetto della lunghezza di un’epoca prevalentemente riprodotta sulla performance comportamentale e sul tempo di risposta dei soggetti. In ogni studio e per ogni sonda (sia nei test di dettaglio che in quelli di ordine), abbiamo preso il numero di intervalli di tempo consecutivi che la sonda è stata riprodotta come variabile fissa e il numero del soggetto come variabile casuale. L’effetto della replay sul comportamento è stato visualizzato raggruppando le sonde a seconda che siano state riprodotte o meno durante il periodo di ritenzione e, se riprodotte, se l’epoca di replay sia stata lunga (>1100 ms; vedi Fig. 4) o breve. Abbiamo raggruppato di conseguenza il tasso di risposta e il tempo di risposta. Abbiamo studiato le prestazioni comportamentali normalizzate e l’effetto del mantenimento attivo sul comportamento a livello di gruppo utilizzando ANOVA e i test di coppia t per i test post hoc, implementati in IBM SPSS Statistics versione 23.
Campo evento-correlato che prevede il replay predominante
Abbiamo indagato se gli ERF durante la presentazione dello stimolo prevedevano la manutenzione. Durante la manutenzione, uno stimolo è stato prevalentemente riprodotto. Abbiamo raggruppato una risposta evento-correlata secondo il suo replay durante il periodo di ritenzione: se lo stimolo è stato mantenuto prevalentemente durante l’intervallo di ritenzione (PM) o meno (non-PM). Abbiamo studiato il campo evento-correlato utilizzando SPM12b, e segnali ERF sono stati corretti di base sulla base dell’ampiezza media in tutta l’epoca e passa basso filtrato a 20 Hz.
Gli effetti significativi sono stati poi sorgente localizzati separatamente (un effetto iniziale ha raggiunto il picco di 125 ms, e un effetto successivo ha raggiunto il picco di 278 ms). Abbiamo tagliato il segnale ad un’epoca di 50-200 ms per localizzare il primo effetto (115-135 ms), e abbiamo tagliato il segnale ad un’epoca di 200-350 ms per localizzare il secondo effetto (270-300 ms). Gli ERF sono stati localizzati usando 8192 vertici sulla superficie corticale nello spazio MNI, un singolo guscio come modello in avanti, e precedenti sparse multivariate(Friston et al., 2008). L’attività individuale localizzata alla fonte è stata poi esaminata in un’analisi statistica a livello di gruppo(Henson et al., 2007).
Risultati
Prestazioni dei classificatori di modello
Abbiamo calcolato le precisioni di tre classificatori a coppie facendo la media delle precisioni di classificazione rispetto alle pieghe di convalida e alle categorie accoppiate. I risultati hanno indicato che tutti i classificatori sono stati eseguiti ad un livello migliore del casuale (50%) da ∼100 a 500 ms dopo l’inizio degli stimoli (da -10 a 490 ms testato bins di tempo). La performance della classificazione F contro C è stata superiore al caso da 90 ms dopo l’insorgenza degli stimoli, con la performance più alta dell’80% a 170 ms (t(13) = 14,76, p < 0,001, FWE corretto). Anche la performance per il classificatore B contro C è stata significativa da 90 ms, con la migliore performance del 75% a 190 ms(t(13) = 14,61, FWE corretto p < 0,001). La classificazione F contro B è stata significativa da 110 ms, con la prestazione dell’80% a 170 ms (t(13) = 12,35, p < 0,001, FWE corretto; Fig . 3).
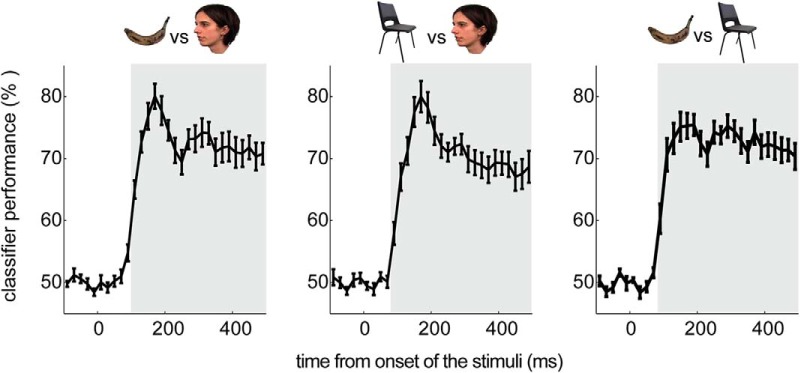
Figura 3.Figura 3. Classificazione multivariata delle categorie di stimolo: prestazioni di validazione incrociata, questi grafici mostrano le prestazioni medie di classificazione di 3 classificatori a coppie in tutto il gruppo: sinistra, F vs B; centrale, F vs C; e destra, B vs C. L’asse x è il tempo dallo stimolo (0 ms), e l’asse y è la prestazione di classificazione in percentuale. Le barre di errore mostrano il SEM. L’area grigia indica la classificazione significativa dopo la correzione per i confronti multipli.

Figura 3.Figura 3. Classificazione multivariata delle categorie di stimolo: prestazioni di validazione incrociata, questi grafici mostrano la prestazione media di classificazione di 3 classificatori a coppie in tutto il gruppo: sinistra, F vs B; centrale, F vs C; e destra, B vs C. L’asse x è il tempo dallo stimolo (0 ms), e l’asse y è la prestazione di classificazione in percentuale. Le barre di errore mostrano il SEM. L’area grigia indica la classificazione significativa dopo la correzione per i confronti multipli.
La riproduzione di una categoria di stimolo domina durante la ritenzione
I classificatori da 170 ms hanno avuto le prestazioni più elevate durante la codifica (la precisione media convalidata incrociata, su tutti e tre i classificatori a coppie, è stata del 78%). Così, abbiamo selezionato i classificatori da 170 ms per la decodifica entro due finestre temporali in cui può avvenire la manutenzione: l’intervallo R stesso e l’ITI per il controllo. Ogni periodo conteneva 151 intervalli di tempo. Nel complesso, abbiamo decodificato ∼330.000 time bins.
Le distribuzioni delle etichette delle categorie assegnate ad ogni cestino sono state diverse durante il periodo R e ITI(Fig. 4). Durante il periodo R, i cestini di tempo adiacenti decodificati erano più frequentemente della stessa categoria(Fig. 4).Aun esempio da un soggetto rappresentativo). Ci riferiamo a questi contenitori temporali adiacenti con le stesse categorie decodificate come “epoca” di replay: quantifica la durata della permanenza nello stesso stato. Le lunghezze di tutte le epoche (multiple per un periodo di ritardo) sono state poi calcolate, e l’istogramma delle lunghezze delle epoche durante il periodo R e ITI è stato confrontato nei quattro contenitori di lunghezza: 20-140, 160-400, 420-1100, e 1200-3000 ms (si noti che un contenitore di tempo unitario era di 20 ms). Abbiamo osservato epoche di replay più brevi durante l’ITI rispetto al periodo R (20-140 ms: p < 0,001), e epoche di replay più lunghe durante il periodo R rispetto all’ITI (420-1100 ms, p = 0,007; 1200-3000 ms, p < 0,001; Fig. 4B).
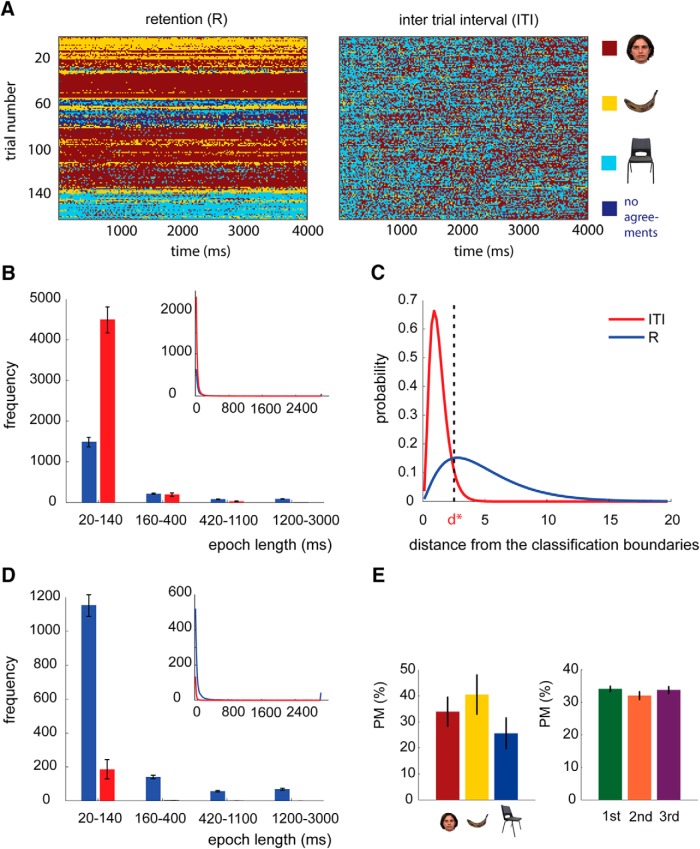
Figura 4.Decodifica delle categorie mantenute nel periodo di ritardo. AIl grafico mostra un esempio rappresentativo (da un soggetto) del periodo R decodificato e dell’ITI prima della trebbiatura. L’asse delle x è il periodo di tempo decodificato e l’asse delle y è il numero di prova. BL’istogramma della lunghezza delle epoche di replay durante il periodo R (in blu) e durante l’ITI (in rosso) prima della soglia: l’asse x mostra la lunghezza dell’epoca. Il grafico in alto è la lunghezza media delle epoche da 20 a 3000 ms, e il grafico in basso è il grafico a barre per i bidoni di lunghezze epocali (20-140, 160-400, 420-1100 e 1200-3000 ms). Le barre di errore mostrano il SEM. L’asse delle x è la lunghezza dell’epoca di replay degli stimoli. CLa distribuzione di probabilità della distanza dai confini di classificazione durante il periodo R (blu) e ITI (rosso). d* mostra la soglia per rifiutare il 22% degli output di classificazione durante il mantenimento. Questa soglia ha respinto il 94% degli output di classificazione durante l’ITI. DGli stessi istogrammi di B ma dopo aver applicato la soglia. EI grafici a barre mostrano la percentuale di prove in cui gli stimoli della categoria selezionata (grafico a sinistra) o l’ordine nella sequenza (grafico a destra) sono stati prevalentemente mantenuti. Non c’è stato alcun effetto significativo della categoria o dell’ordine degli stimoli.
L’analisi è stata ripetuta dopo aver introdotto la categoria nulla (N) per nessun replay. Abbiamo introdotto una soglia per il rifiuto delle uscite del classificatore che erano vicine ai confini della decisione di classificazione. Abbiamo etichettato come nulli gli output del classificatore respinti. Per misurare la soglia, abbiamo prima estratto la distribuzione di probabilità della distanza dai confini di classificazione(d) ottenuta dai periodi R e ITI(Fig. 4C). Il classificatore applicato è stato accurato per il 78% del tempo. Abbiamo poi selezionato una soglia conservativa(d*= 2,49) per rifiutare il 22% delle uscite dei classificatori che decodificavano i pattern più vicini ai confini di classificazione durante il periodo di ritenzione (erano il 22% più ambigui). La stessa soglia ha respinto il 94% dei pattern decodificati durante il periodo ITI. Abbiamo etichettato questi contenitori di tempo rifiutati come N per nullo.
Dopo aver applicato la soglia, il numero complessivo di replay di 170 ms rappresentazioni (F, B e C) è stato più alto durante il periodo R (5422, SD = 1061) che nell’ITI (92, SD = 149; p < 0,001), e il numero di N (bidoni respinti) è stato più alto durante l’ITI (12.657, SD = 2961) che durante il periodo R (3058, SD = 1669; p < 0,001). Inoltre, le epoche decodificate erano più lunghe durante il periodo R che durante l’ITI (in tutti e quattro i contenitori di lunghezza, p < 0,001; Fig . 4D), il che significa che gli stimoli riprodotti persistevano più a lungo durante il periodo R. Questi risultati hanno indicato che durante il periodo di ritenzione uno stimolo era PM. Non vi è stata alcuna interazione significativa tra la categoria di stimolo e l’ordine e gli stimoli predominanti(F(4,52) = 0,603, p = 0,662) e nessun effetto principale di ordine(F(2,26) = 0,747, p = 0,484) o categoria di stimolo(F(2,26) = 0,701, p = 0,505; Fig. 4E). A livello di gruppo, la lunghezza delle epoche di replay per la categoria prevalentemente mantenuta è stata inferiore a 160 ms nel 25% (SD = 11,2) delle prove, tra 160 e 400 ms nel 18,7% (SD = 4,5) delle prove, tra 420 e 1100 ms nel 15,1% (SD = 3,8) delle prove, e superiore a 1100 ms nel 41,3% (SD = 14) delle prove.

Figura 4.La decodifica delle categorie mantenute nel periodo di ritardo. AIl grafico mostra un esempio rappresentativo (da un soggetto) del periodo R decodificato e dell’ITI prima della trebbiatura. L’asse delle x è il periodo di tempo decodificato e l’asse delle y è il numero di prova. BL’istogramma della lunghezza delle epoche di replay durante il periodo R (in blu) e durante l’ITI (in rosso) prima della soglia: l’asse x mostra la lunghezza dell’epoca. Il grafico in alto è la lunghezza media delle epoche da 20 a 3000 ms, e il grafico in basso è il grafico a barre per i bidoni di lunghezze epocali (20-140, 160-400, 420-1100 e 1200-3000 ms). Le barre di errore mostrano il SEM. L’asse delle x è la lunghezza dell’epoca di replay degli stimoli. CLa distribuzione di probabilità della distanza dai confini di classificazione durante il periodo R (blu) e ITI (rosso). d* mostra la soglia per rifiutare il 22% degli output di classificazione durante il mantenimento. Questa soglia ha respinto il 94% degli output di classificazione durante l’ITI. DGli stessi istogrammi di B ma dopo aver applicato la soglia. EI grafici a barre mostrano la percentuale di prove in cui gli stimoli della categoria selezionata (grafico a sinistra) o l’ordine nella sequenza (grafico a destra) sono stati prevalentemente mantenuti. Non c’è stato alcun effetto significativo della categoria o dell’ordine degli stimoli.
Nessuna prova per il replay in ordine sequenziale
La differenza tra il modello di replay durante il periodo R e l’ITI era anche rilevabile dalla probabilità di replay di ogni stimolo al tempo bin t + 1 data la replay di uno stimolo al tempo bin t (cioè, matrice di transizione a catena di Markov a un passo e a tempo discreto tra gli stati replayed). Se al tempo t uno stimolo viene riprodotto, molto probabilmente al tempo t + 1 lo stesso stimolo verrà riprodotto (la probabilità media di transizione era del 56,32%). Le probabilità di transizioni verso lo stesso stato e da N a ciascuno degli stati di stimolo erano più alte durante il periodo R che durante l’ITI, e le probabilità di transizioni da qualsiasi stato a N erano più basse durante il periodo R che durante l’ITI. Non c’era differenza tra le transizioni in avanti e indietro(Fig. 5).
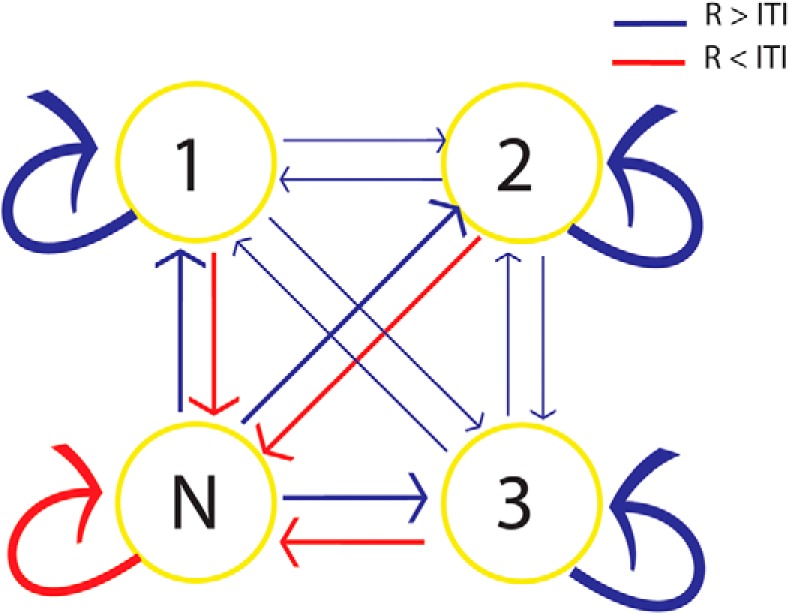
Figura 5.La differenza nella matrice della probabilità media delle transizioni di stato è riflessa dallo spessore delle frecce. Le probabilità di tutte le transizioni erano diverse tra i periodi R e gli ITI. Le frecce rosse mostrano le transizioni che si sono verificate più spesso durante l’ITI che il periodo R, e le frecce blu mostrano la situazione opposta. Non c’era differenza tra le probabilità di transizioni in avanti (1-2-3) e indietro (3-2-1).

Figura 5.La differenza nella media delle probabilità della matrice di transizione di stato è riflessa dallo spessore delle frecce. Le probabilità di tutte le transizioni erano diverse tra i periodi R e ITI. Le frecce rosse mostrano le transizioni che si sono verificate più spesso durante l’ITI che il periodo R, e le frecce blu mostrano la situazione opposta. Non c’era differenza tra le probabilità di transizioni in avanti (1-2-3) e indietro (3-2-1).
Richiamo migliorato della memoria per gli stimoli riprodotti in modo predominante
Abbiamo poi esaminato la performance comportamentale per gli stimoli riprodotti adattando un modello lineare ad effetti misti, cioè la lunghezza della (più lunga) ripetizione consecutiva delle sonde in ogni studio come variabile fissa e l’identità del soggetto come variabile casuale. I risultati hanno mostrato effetti significativi della lunghezza di replay sulla performance per il test di dettaglio (stima del parametro, 0,0001; t(2232) = 2,578, p = 0,01) e sul tempo di risposta per il test di dettaglio (stima del parametro, -0,63175; t(2232) = -2,115, p = 0,0345). Il risultato non è stato significativo per l’esecuzione del test dell’ordine (stima del parametro, <0,0001; t(2232) = 0,47757, p = 0,633) o il tempo di risposta del test dell’ordine (stima del parametro, 0,39498; t(2232) = 1,1955, p = 0,232).
Abbiamo considerato quanto è stata lunga l’epoca di replay più lunga della sonda durante l’intervallo di ritenzione precedente. Abbiamo raggruppato le sonde nei seguenti tre gruppi: quelle senza replay [test di dettaglio, 72,1 sonde (SD = 9,9); test d’ordine, 73,6 sonde (SD = 12,4)]; un’epoca di replay breve [<1100 ms; Fig . 4, prime tre barre); test di dettaglio, 64,1 sonde (SD = 16,8); test dell’ordine, 64,4 sonde (SD = 16,1)]; e un’epoca di replay lunga [>1100 ms; Fig . 4, ultima barra; test di dettaglio, 23,8 sonde (SD = 9,7); test dell’ordine, 21,9 sonde (SD = 8,9)]. Abbiamo anche testato le risposte comportamentali in base a quanto tempo la sonda ha riprodotto durante la ritenzione. L’effetto della lunghezza dell’epoca di replay ha previsto la precisione nel test di dettaglio (il primo test che i soggetti hanno eseguito dopo il periodo di ritenzione; F(2,26) = 4, 98, p = 0,015). Il test post hoc ha mostrato che la percentuale di successo era più alta per le sonde con epoche di replay lunghe rispetto a quelle con epoche di replay brevi(t(13) = 2,78, p = 0,016) o a quelle non riprodotte(t(13) = 2,85, p = 0,014; Fig. 6). Non abbiamo trovato alcun effetto di replay sul tempo di risposta del test di dettaglio(F(2,26) = 1,89, p = 0,17), ordinare il tempo di risposta del test(F(2,26) = 0,20, p = 0,82), o ordinare la precisione del test(F(2,26) = 0,12, p = 0,89).
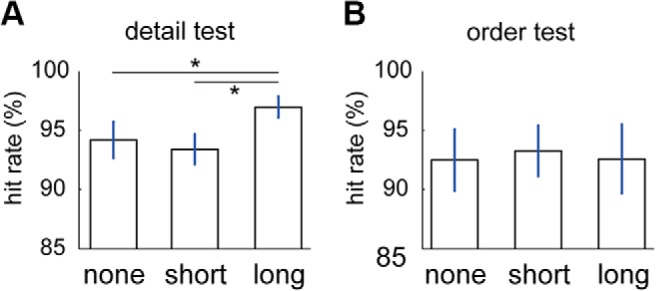
Figura 6.Effetto della riproduzione di 170 ms di rappresentazione sulla performance di WM. A, B, Il test di dettaglio (A) e per la prova d’ordine (B) mostrano il tasso di successo (%) rispetto al fatto che gli stimoli non sono stati riprodotti (nessuno), sono stati riprodotti per una breve durata (meno di 1100 ms), o sono stati riprodotti per una lunga durata (più di 1100 ms). Le barre di errore mostrano il SEM. *p < 0.05.

Figura 6.Effetto della riproduzione della rappresentazione di 170 ms sulle prestazioni di WM. A, B, Il test di dettaglio (A) e per la prova d’ordine (B) mostrano il tasso di successo (%) rispetto al fatto che gli stimoli non sono stati riprodotti (nessuno), sono stati riprodotti per una breve durata (meno di 1100 ms), o sono stati riprodotti per una lunga durata (più di 1100 ms). Le barre di errore mostrano il SEM. *p < 0.05.
L’attività dell’evento durante la codifica prevede il replay della voce
Le ERF durante la codifica sono state esaminate in funzione di quale voce era PM durante il periodo di ritenzione. Le ERF sono state preprocessate esattamente nello stesso modo del segnale per l’analisi della classificazione del modello e sono state filtrate a 20 Hz. I risultati hanno rivelato che gli stimoli PM e non-PM durante la codifica evocano ERF significativamente diversi a destra canali temporali (picco a 125 ms; F(2,26) = 44,14, p < 0,001, FWE corretto) e canali temporali di sinistra (picco a 115 ms; F(2 ,26) = 39,25, p < 0,001, FWE corretto; e picchi successivi a 453 ms; F(2,26 )= 23,06, p = 0 , 008; Fig. 7A,B), così come ai canali frontali medi (con un picco di 287 ms; F(2,26) = 32, 49, p = 0,002, FWE corretto; Fig. 7C,D). La componente ERF iniziale (con un picco di 125 ms) è stata localizzata all’origine nella corteccia temporale occipitale e mediale sia nell’emisfero destro che in quello sinistro(Fig. 7E). La differenza era significativa nell’occipitale sinistro(F(1,13) = 36, 51, p = 0, 027, FWE corretto; Fig. 7E). La componente successiva ERF, che ha raggiunto il picco di 287 ms, è stato fonte localizzata a tre regioni cerebrali, una a sinistra corteccia temporale inferiore(F(1,13) = 21,85, p = 0,033, FWE corretto; Fig. 7F) e due sulla corteccia temporale inferiore destra(F(1,13) = 20, 44, p = 0,036, FWE corretto; e F(1,13) = 19, 03, p = 0, 42, FWE corretto; Fig. 7F).
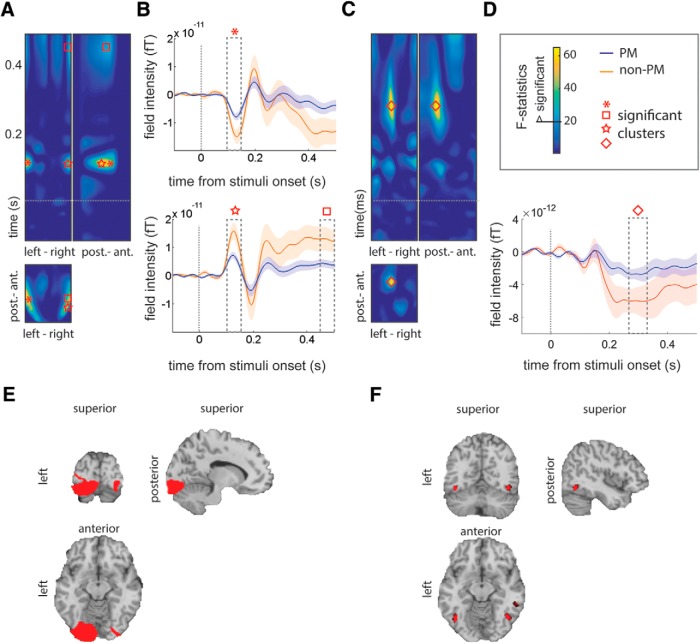
Figura 7.Gli ERF durante la codifica distinguono tra stimoli PM nella memoria di lavoro e stimoli non PM. ALe trame grafiano le statistiche F in canale per topografia temporale, concentrandosi sui cluster significativi a 125 ms dall’inizio degli stimoli. Il grafico in basso mostra la topografia canale per canale dell’effetto(l’asse x è da sinistra a destra, e l’asse y è da posteriore ad anteriore). I grafici in alto sono canale per canale. L’asse delle x sul grafico a sinistra mostra i canali da sinistra a destra, e l’asse delle x sul grafico a destra mostra i canali da anteriore a posteriore. I picchi sono evidenziati con forme in A a D. BIl grafico in alto è per l’effetto che ha raggiunto il picco di 125 ms(p < 0,001) in un canale laterale sinistro, e il grafico in basso è per l’effetto ERF a 453 ms (p = 0,008) in un canale laterale destro. Le trame mostrano gli effetti ERF nel picco di cluster significativi, che sono evidenziati da forme (A e B). Le caselle tratteggiate mostrano i tempi degli effetti. CI grafici grafici rappresentano le statistiche F nel canale per tempo (lo stesso che in A), concentrandosi sull’effetto significativo che ha raggiunto il picco di 287 ms(p = 0,002). L’effetto è evidenziato da una forma a diamante in C e D. DLa trama mostra l’effetto ERF a 287 ms dall’inizio degli stimoli nei canali frontali mediani. E, L’effetto ERF a 125 ms (A e B) era fonte localizzata nella corteccia occipitale bilaterale. FL’effetto FER a 287 ms (C e D) è stato localizzato nelle aree temporali inferiori posteriori. A a DLa linea tratteggiata mostra l’inizio degli stimoli alla codifica.

Figura 7.Gli ERF durante la codifica distinguono tra stimoli PM nella memoria di lavoro e stimoli non PM. ALe trame grafiano le statistiche F nella topografia dei canali in base al tempo, concentrandosi sui cluster significativi a 125 ms dall’inizio degli stimoli. Il grafico in basso mostra la topografia canale per canale dell’effetto(l’asse x è da sinistra a destra, e l’asse y è da posteriore ad anteriore). I grafici in alto sono canale per canale. L’asse delle x sul grafico a sinistra mostra i canali da sinistra a destra, e l’asse delle x sul grafico a destra mostra i canali da anteriore a posteriore. I picchi sono evidenziati con forme in A a D. BIl grafico in alto è per l’effetto che ha raggiunto il picco di 125 ms(p < 0,001) in un canale laterale sinistro, e il grafico in basso è per l’effetto ERF a 453 ms (p = 0,008) in un canale laterale destro. Le trame mostrano gli effetti ERF nel picco di cluster significativi, che sono evidenziati da forme (A e B). Le caselle tratteggiate mostrano i tempi degli effetti. CI grafici grafici rappresentano le statistiche F nel canale per tempo (lo stesso che in A), concentrandosi sull’effetto significativo che ha raggiunto il picco di 287 ms(p = 0,002). L’effetto è evidenziato da una forma a diamante in C e D. DLa trama mostra l’effetto ERF a 287 ms dall’inizio degli stimoli nei canali frontali mediani. E, L’effetto ERF a 125 ms (A e B) era fonte localizzata nella corteccia occipitale bilaterale. FL’effetto FER a 287 ms (C e D) è stato localizzato nelle aree temporali inferiori posteriori. A a DLa linea tratteggiata mostra l’inizio degli stimoli alla codifica.
Discussione
Utilizzando il MEG, abbiamo decodificato il contenuto della memoria di lavoro mentre gli individui mantenevano la sequenza e i dettagli visivi di tre stimoli distinti. I nostri risultati hanno rivelato che uno dei tre stimoli dominava il contenuto della memoria di lavoro. L’elemento mantenuto in modo predominante ha beneficiato delle prestazioni della memoria, come l’effetto comportamentale del mantenimento di un elemento al centro dell’attenzione(Lepsien e Nobre ,2007; Lepsien et al., 2011; Gazzaley e Nobre, 2012; Tan et al., 2014). L’elemento selezionato per il replay preferenziale non è stato previsto dall’identità o dalla posizione della sequenza(Fig. 4E). Invece, lo stimolo prevalentemente mantenuto è stato selezionato in base alla quantità più bassa di attenzione relativa all’ampiezza ERF durante la codifica(Fig. 7).
Il nostro criterio rigoroso per l’esistenza di un replay sequenziale era la probabilità di transizioni sequenziali in una matrice di transizione a catena di Markov a tempo discreto (un passo) (Fig. 5). Di conseguenza, non abbiamo trovato la riproduzione direzionale; vale a dire, eventuali differenze tra la riproduzione in avanti (1, 2, e poi 3) o indietro (3, 2, e poi 1; Fig. 5). Oltre a questo rigido criterio, abbiamo testato una previsione diretta del modello di codifica temporale. Il modello di codifica temporale prevede che tutti e tre i memoranda saranno decodificati con uguale probabilità durante la manutenzione. Anche questo criterio non è stato soddisfatto(Fig. 6). Questi risultati nulli devono essere interpretati con cautela perché la risoluzione spazio-temporale della nostra metodologia potrebbe non essere sensibile alla riproduzione sequenziale e la registrazione intracranica diretta potrebbe essere richiesta per fornire ulteriori prove a favore o contro questi modelli. Inoltre, la riproduzione sequenziale può essere reclutata con un carico di memoria di lavoro più elevato rispetto a quello utilizzato nello studio attuale(Heusser et al., 2016).
Abbiamo osservato che uno stimolo ha dominato durante la ritenzione(Fig. 4). L’identità di questo stimolo variava da prova a prova. Come notato, la categoria o l’ordine di sequenza non determinava quale stimolo avrebbe riprodotto(Fig. 4E). Invece, è stata l’ampiezza dei FER a 125 ms dall’inizio dello stimolo durante la codifica a prevedere quale stimolo sarebbe stato riprodotto(Fig. 7). L’effetto iniziale era fonte localizzata a sinistra della corteccia extrastriata(Fig. 7), e questo modello spazio-temporale corrisponde strettamente all’effetto ben noto dell’attenzione ad uno stimolo visivo durante la codifica(Heinze et al., 1990; Luck et al., 1990; Okazaki et al., 2008; Rutman et al., 2010). L’attenzione ad uno stimolo visivo provoca un aumento della componente evento-correlata nelle cortecce occipitali(Hopf et al., 2000). In particolare, l’attenzione agli stimoli visivi aumenta l’ampiezza dell’EEG e dell’ampiezza MEG dell’evento su ∼100 ms dopo l’inizio dello stimolo visivo rispetto agli stimoli meno frequentati (Hillyarde Anllo-Vento, 1998; Downing, 2000). Così, gli stimoli che hanno dominato la riproduzione durante l’intervallo di ritenzione sono stati quelli che avevano ricevuto l’assegnazione di attenzione meno precoce durante la codifica. Questo effetto di riduzione dell’attenzione precoce sull’evento codificato più debole è stato seguito da una ridotta ampiezza di risposta evento-correlata a 287 ms che fonte localizzata alle regioni temporali inferiori posteriori. Ciò indica che la diminuzione dell’attenzione visiva precoce è stata seguita da rappresentazioni più deboli nelle aree visive a valle.
Le nostre scoperte sono compatibili con le ricerche di lunga data su come l’attenzione possa influenzare il contenuto della memoria di lavoro. Più elementi nella memoria di lavoro non sono tutti nello stesso stato rappresentativo durante il mantenimento dell’attenzione(Zokaei et al., 2014; Myers et al., 2017). Piuttosto, la stimolazione cerebrale o le istruzioni sperimentali per mantenere uno stimolo richiesto (cioè, la procedura di retro-cue) manipola il contenuto della ritenzione(Lewis-Peacock e Postle, 2012; Zokaei et al., 2014; Rose et al., 2016). Nel nostro esperimento non abbiamo usato retro-cuzione o simulazione cerebrale, ma tutti e tre gli elementi visivi erano rilevanti per il compito. Questa procedura ci ha permesso di scoprire una priorità non strutturata del contenuto della memoria di lavoro che dipendeva dal grado di attenzione iniziale.
La nostra osservazione che un elemento può dominare il periodo di manutenzione è compatibile con i recenti dati neurofisiologici della corteccia prefrontale (PFC) di primati non umani. Questi effetti della riproduzione sul comportamento suggeriscono che solo l’oggetto al centro dell’attenzione è riprodotto attivamente nella memoria di lavoro, mentre la rappresentazione di altri stimoli è in uno stato “attivo-silenzioso” (Sandberget al., 2003; Stokes, 2015). Lo stato attivo-silenzioso è proposto come una forma di ritenzione del livello sinaptico in cui l’attività di una singola unità scende a livelli di base dopo un’esplosione iniziale(Mongillo et al., 2008; Stokes, 2015; Lundqvist et al., 2016).
Una domanda intrigante sollevata dai nostri dati è come gli stimoli debolmente codificati siano prioritari per la manutenzione. Poiché la prioritizzazione era indipendente dalla posizione della sequenza, essa avrebbe potuto avvenire solo dopo che tutti e tre gli stimoli erano stati incontrati. Uno scenario parsimonioso è che la prioritizzazione della manutenzione avviene all’inizio del periodo di ritardo (forse nel PFC; Lundqvist et al., 2016) e comporta il recupero di informazioni. Una possibilità è che lo stimolo prioritario richieda un maggiore sforzo di ricerca o di recupero durante il ritardo. Tale processo avrebbe potuto essere supportato da meccanismi prefrontalieri che consentissero il monitoraggio(Barbey et al., 2013; Szczepanski e Knight, 2014) e il controllo inibitorio(Knight et al., 1999 ; Barceló et al., 2000; Aron et al., 2004) riducendo le interferenze (LaRocque et al.,2014; Zokaei et al., 2014 ) da stimoli fortemente codificati. Questo potenziale meccanismo compenserebbe le limitazioni di capacità della memoria di lavoro(Luck e Vogel, 1997; Awh et al., 2006; Bays e Husain, 2008; Bays et al., 2009) e sarebbe più efficace in termini di risorse, dando priorità agli stimoli meno privilegiati nella codifica nel buffer di manutenzione. In sostanza, i soggetti hanno migliorato la riproduzione di stimoli poco frequentati per migliorare le prestazioni successive. Resta aperta la questione se gli stimoli più frequenti (i primi ERF di maggiore ampiezza) siano stati codificati e recuperati dalla memoria a lungo termine o se si trovino in uno stato di silenzio attivo(Stokes, 2015; Lundqvist et al., 2016). Un’altra opzione è che gli elementi sono stati riprodotti in sequenza, ma quando il segnale per l’elemento poco frequentato è stato amplificato, questo ha mascherato la decodifica di altri elementi.
In sintesi, abbiamo decodificato la riproduzione dinamica del contenuto della memoria di lavoro visiva ad alta risoluzione temporale utilizzando il MEG. I risultati hanno rivelato che la rappresentazione delle informazioni visive categoriali degli stimoli meno frequentati durante la codifica è stata riprodotta preferibilmente durante la ritenzione. Questi risultati rivelano che il mantenimento della memoria di lavoro dà priorità in modo intelligente agli stimoli più deboli e codificati rilevanti per il compito, migliorando la fedeltà del richiamo della memoria.
References
- Inhibition and the right inferior frontal cortex. Trends Cogn Sci. 2004; 8:170-177. DOI | PubMed
- Interactions between attention and working memory. Neuroscience. 2006; 139:201-208. DOI | PubMed
- Working memory. Science. 1992; 255:556-559. DOI | PubMed
- Working memory. Curr Biol. 2010; 20:R136-R140. DOI | PubMed
- Dorsolateral prefrontal contributions to human working memory. Cortex. 2013; 49:1195-1205. DOI | PubMed
- Prefrontal modulation of visual processing in humans. Nat Neurosci. 2000; 3:399-403. DOI | PubMed
- Dynamic shifts of limited working memory resources in human vision. Science. 2008; 321:851-854. DOI | PubMed
- The precision of visual working memory is set by allocation of a shared resource. J Vis. 2009; 9(10):1-11. DOI
- Representational dynamics of object vision: the first 1000 ms. J Vis. 2013; 13(10):1-19. DOI
- Resolving human object recognition in space and time. Nat Neurosci. 2014; 17:455-462. DOI | PubMed
- Interactions between visual working memory and selective attention. Psychol Sci. 2000; 11:467-473. DOI | PubMed
- Multiple sparse priors for the M/EEG inverse problem. Neuroimage. 2008; 39:1104-1120. DOI | PubMed
- Theta-coupled periodic replay in working memory. Curr Biol. 2010; 20:606-612. DOI | PubMed
- Top-down modulation: bridging selective attention and working memory. Trends Cogn Sci. 2012; 16:129-135. DOI | PubMed
- Decoding reveals the contents of visual working memory in early visual areas. Nature. 2009; 458:632-635. DOI | PubMed
- Visual event-related potentials index focused attention within bilateral stimulus arrays. I. Evidence for early selection. Electroencephalogr Clin Neurophysiol. 1990; 75:511-527. DOI | PubMed
- Population-level inferences for distributed MEG source localization under multiple constraints: application to face-evoked fields. Neuroimage. 2007; 38:422-438. DOI | PubMed
- Episodic sequence memory is supported by a theta-gamma phase code. Nat Neurosci. 2016; 19:1374-1380. DOI | PubMed
- Event-related brain potentials in the study of visual selective attention. Proc Natl Acad Sci U S A. 1998; 95:781-787. DOI | PubMed
- Neural sources of focused attention in visual search. Cereb Cortex. 2000; 10:1233-1241. DOI | PubMed
- Population level inference for multivariate MEG analysis. PLoS One. 2013; 8:e71305. DOI | PubMed
- Replay of very early encoding representations during recollection. J Neurosci. 2014; 34:242-248. DOI | PubMed
- Hippocampal CA3 region predicts memory sequences: accounting for the phase precession of place cells. Learn Mem. 1996; 3:279-287. DOI | PubMed
- Temporal coding organized by coupled alpha and gamma oscillations prioritize visual processing. Trends Neurosci. 2014; 37:357-369. PubMed
- Applications of random field theory to electrophysiology. Neurosci Lett. 2005; 374:174-178. DOI | PubMed
- Prefrontal cortex regulates inhibition and excitation in distributed neural networks. Acta Psychol. 1999; 101:159-178. DOI
- Matching categorical object representations in inferior temporal cortex of man and monkey. Neuron. 2008; 60:1126-1141. DOI | PubMed
- Multiple neural states of representation in short-term memory? It’s a matter of attention. Front Hum Neurosci. 2014; 8:5. DOI | PubMed
- Phase locking of single neuron activity to theta oscillations during working memory in monkey extrastriate visual cortex. Neuron. 2005; 45:147-156. DOI | PubMed
- Attentional modulation of object representations in working memory. Cereb Cortex. 2007; 17:2072-2083. DOI | PubMed
- Modulation of working-memory maintenance by directed attention. Neuropsychologia. 2011; 49:1569-1577. DOI | PubMed
- Decoding the internal focus of attention. Neuropsychologia. 2012; 50:470-478. DOI | PubMed
- Working memory: the importance of theta and gamma oscillations. Curr Biol. 2010; 20:R490-R492. DOI | PubMed
- EEG and MEG data analysis in SPM8. Comput Intell Neurosci. 2011; 2011:852961. DOI | PubMed
- The capacity of visual working memory for features and conjunctions. Nature. 1997; 390:279-281. PubMed
- Visual event-related potentials index focused attention within bilateral stimulus arrays. II. Functional dissociation of P1 and N1 components. Electroencephalogr Clin Neurophysiol. 1990; 75:528-542. DOI | PubMed
- Gamma and beta bursts underlie working memory. Neuron. 2016; 90:152-164. DOI | PubMed
- Activity of neurons in anterior inferior temporal cortex during a short-term memory task. J Neurosci. 1993; 13:1460-1478. PubMed
- Synaptic theory of working memory. Science. 2008; 319:1543-1546. DOI | PubMed
- Prioritizing information during working memory: beyond sustained internal attention. Trends Cogn Sci. 2017; 21:449-461. PubMed
- Access to information in working memory: Exploring the focus of attention. J Exp Psychol Learn Mem Cogn. 2002; 28:411-421. DOI | PubMed
- The timing of face selectivity and attentional modulation in visual processing. Neuroscience. 2008; 152:1130-1144. DOI | PubMed
- Reactivation of latent working memories with transcranial magnetic stimulation. Science. 2016; 354:1136-1139. DOI | PubMed
- Early top–down control of visual processing predicts working memory performance. J Cogn Neurosci. 2010; 22:1224-1234. DOI | PubMed
- A working memory model based on fast Hebbian learning. Network. 2003; 14:789-802. DOI | PubMed
- Phase-dependent neuronal coding of objects in short-term memory. Proc Natl Acad Sci U S A. 2009; 106:21341-21346. DOI | PubMed
- “Activity-silent” working memory in prefrontal cortex: a dynamic coding framework. Trends Cogn Sci. 2015; 19:394-405. DOI | PubMed
- Insights into human behavior from lesions to the prefrontal cortex. Neuron. 2014; 83:1002-1018. DOI | PubMed
- The temporal dynamics of visual working memory guidance of selective attention. Front Behav Neurosci. 2014; 8:345. DOI | PubMed
- The nature of statistical learning theory. Springer: New York; 2000.
- Neural dynamics in inferior temporal cortex during a visual working memory task. J Neurosci. 2009; 29:5494-5507. DOI | PubMed
- Causal evidence for a privileged working memory state in early visual cortex. J Neurosci. 2014; 34:158-162. DOI | PubMed
Fonte
Jafarpour A, Penny W, Barnes G, Knight RT, Duzel E, et al. (2017) Working Memory Replay Prioritizes Weakly Attended Events. eNeuro 4(4): ENEURO.0171-17.2017. https://doi.org/10.1523/ENEURO.0171-17.2017





