Abstract
Introduzione
L’assenza di somatosensazione diminuisce profondamente la capacità di una persona di muoversi e interagire all’interno del proprio ambiente (Colee Cole, 1995; Sainburg et al., 1993). Anche con la visione e l’udito intatti, che possono fornire informazioni sensoriali sulla posizione del corpo, il movimento e l’interazione, i comportamenti di base come camminare o raggiungere e afferrare richiedono un carico cognitivo sostanzialmente maggiore senza feedback somatosensoriale. La gravità di questi deficit sottolinea quanto le somatosensazioni cutanee e propriocettive siano profondamente integrate nel controllo neurale del movimento e motiva il problema del ripristino della sensazione quando manca. Tuttavia, la complessità del circuito somatosensoriale, e la difficoltà di scrivere informazioni in questo circuito con sufficiente integrità, hanno posto sfide significative. I recenti progressi della tecnologia dell’interfaccia cervello-macchina (BMI) hanno portato a rinnovare gli sforzi in questo settore, nell’ipotesi che fornire un controllo motorio-sensoriale a circuito chiuso e percorsi di feedback possa portare ad un aumento vitale delle prestazioni(Bensmaia e Miller, 2014). La microstimolazione intracorticale (ICMS) è una tecnica promettente per implementare un percorso di ritorno in cui gli stimoli elettrici sono scritti direttamente nella corteccia somatosensoriale attraverso array di elettrodi impiantati. I primati non umani (NHP) hanno incorporato con successo le informazioni ICMS per eseguire compiti di discriminazione, di rilevazione(Romo et al., 1998; Romo et al., 2000; Tabot et al., 2013; Dadarlat et al., 2015) e come feedback sensoriale per il controllo del cervello in compiti di IMC (O’Doherty et al., 2011; Klaes et al., 2014), e recenti studi sull’uomo hanno fornito informazioni sulla sensazione e la percezione delle sensazioni prodotte attraverso ICMS(Flesher et al., 2016). Tuttavia, le qualità attribuite dai soggetti umani a queste sensazioni (ad esempio, “formicolio” o “ronzio”) sono state per lo più di natura artificiale (Johnson et al.,2013; Flesher et al., 2016), e non è ancora chiaro quale gamma di sensazioni possa essere suscitata attraverso l’ICMS. Qui presentiamo i nuovi risultati di due esperimenti: uno che ha testato ogni elettrodo su una gamma di ampiezze con frequenza fissa, e uno che ha testato un sottoinsieme di elettrodi su una gamma di ampiezze e frequenze. Abbiamo trovato l’elicitazione affidabile di sensazioni naturali cutanee e propriocettive che abbracciano una gamma di ampiezze di stimolo e frequenze, ottenute dalla stimolazione in S1 di un singolo soggetto umano (partecipante FG, Figura 1; vedi Materiali e metodi) con una lesione del midollo spinale di livello C5. Mostriamo inoltre che l’ampiezza della corrente, non la frequenza, dello stimolo elettrico differenzia la modalità (cioè, cutanea o propriocettiva) del percetto suscitato in alcuni siti di stimolazione.
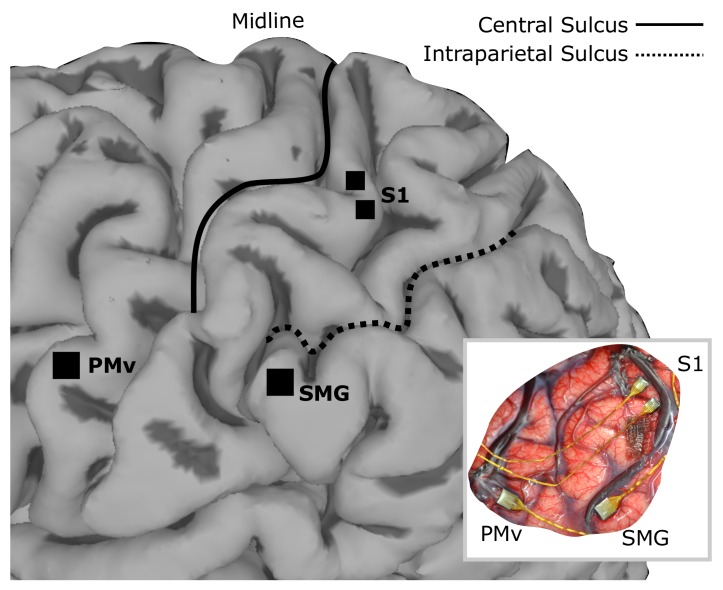
Figura 1.Figura 1. Posizioni dell’impianto a matrice su immagine MRI resa dell’emisfero sinistro di FG.96-canale array di microelettrodi sono stati impiantati nella corteccia premotoria ventrale (PMv) e giro sopramarginale (SMG), e due array di 48 canali stimolanti sono stati impiantati nella corteccia somatosensoriale primaria (S1). L’inserto mostra le posizioni degli array in situ.

Figura 1.Figura 1. Posizioni di impianto array su immagini di risonanza magnetica resa dell’emisfero sinistro di FG.96-canali array di microelettrodi sono stati impiantati nella corteccia premotoria ventrale (PMv) e giro sopramarginale (SMG), e due array di 48 canali stimolanti sono stati impiantati nella corteccia somatosensoriale primaria (S1). L’inserto mostra le posizioni degli array in situ.
Risultati e discussione
Nell’Esperimento 1, nell’arco di otto settimane, sono stati testati stimoli elettrici in una gamma di ampiezze di corrente tra 20-100 µA, con frequenza di impulso mantenuta costante a 150 Hz (vedere Materiali e metodi). La stimolazione attraverso 46/96 elettrodi (48%) ha richiesto almeno una risposta, e ci sono stati in totale 381 sensazioni segnalate su 1229 prove senza cattura (vedi Materiali e metodi). C’era una debole correlazione tra il numero di elettrodi che ha suscitato una sensazione e l’ampiezza della corrente (r = 0,34, p = 0,42, correlazione lineare Pearson). Inoltre, non abbiamo trovato alcuna correlazione tra l’impedenza degli elettrodi e la probabilità di percezioni suscitato (p = 0,80, Pearson coefficiente di correlazione lineare), mettendo in comune tutte le risposte degli elettrodi per tutti i giorni. Inoltre, non c’era alcuna differenza significativa nelle impedenze aggregate di entrambi gli elettrodi che hanno prodotto o non hanno prodotto percezioni (p = 0,707, Kolmogorov-Smirnov test a due campioni). Non sono stati segnalati falsi positivi in nessuna prova di cattura, e non abbiamo trovato alcun effetto della storia di prova nella proporzione delle sensazioni segnalate durante la stimolazione (vedi Materiali e metodi). La stimolazione non ha scatenato alcuna sensazione dolorosa e non si sono verificati eventi avversi durante nessuna delle sessioni.
I campi recettivi lungo la parte superiore del braccio, l’avambraccio e la mano corrispondevano all’organizzazione somatotopica grossolana nei siti di stimolazione corrispondenti. La Figura 2 mostra il campo ricettivo e la modalità di sensazione più frequentemente segnalati per ogni elettrodo in tutte le prove. Dei 46 elettrodi con risposta, 32 percezioni evocate nel braccio superiore, 18 nell’avambraccio e due nella mano (superficie palmare delle cifre e un tampone per le dita). In accordo con i rapporti precedenti, la stimolazione potrebbe produrre percezioni con campi ricettivi di dimensioni variabili in diversi elettrodi(Flesher et al., 2016). Per la maggior parte degli elettrodi (24/46), i campi ricettivi sono stati riportati nella stessa regione del corpo (cioè braccio o avambraccio) o nello stesso piano (cioè anteriore o posteriore) attraverso tutte le ampiezze testate. La somatotopia grossolana era presente tra l’array mediale e laterale(Figura 2B); l’array mediale aveva più probabilità di avere campi ricettivi affidabili nel braccio superiore anteriore (46% dei campi ricettivi dell’array mediale), mentre la stimolazione sull’array laterale induceva più frequentemente la sensazione sull’avambraccio posteriore (51% dei campi ricettivi dell’array laterale). Tuttavia, non c’era una chiara organizzazione somatotopica all’interno di ciascun array come precedentemente riportato(Kim et al., 2015a; Kaas, 1983; Flesher et al., 2016). La somatotopia grossolana trovata attraverso gli array ma non all’interno degli array, potrebbe essere dovuta alla piccola area della corteccia campionata dagli impianti, e al fatto che gli impianti coprivano prevalentemente la parte superiore del braccio e l’avambraccio, aree con una mappa somatotopica meno consolidata(Kaas et al., 1979; Kaas, 1983). Un’altra spiegazione plausibile è che la topografia della corteccia somatosensoriale è stata rimappata dopo la lesione(Kaas et al., 1983; Florence et al., 1998; Moore et al., 2000).
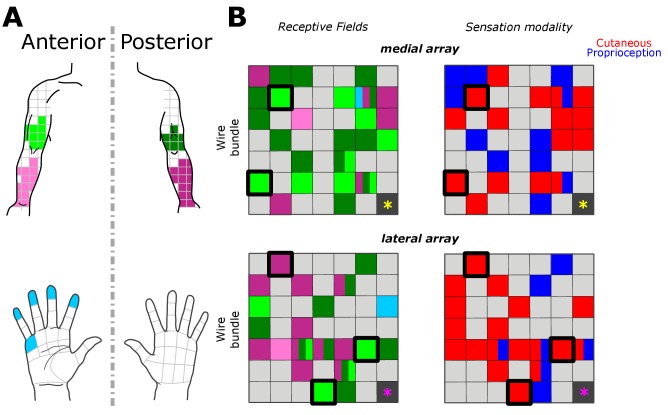
Figura 2.Campi ricettivi e modalità di sensazione in tutti gli esperimenti di mappatura dell’ampiezza.(A) Posizione del campo ricettivo sui piani anteriori (tonalità più chiare) e posteriori (tonalità più scure) del braccio superiore destro (verde), dell’avambraccio (rosa) e della mano (ciano). La griglia è la stessa a cui il soggetto ha fatto riferimento durante l’esperimento.(B) Schema dei due array di elettrodi impiantati su S1(Figura 1). Pannelli laterali sinistro visualizzare i campi segnalati ricettivi in ogni posizione degli elettrodi, e pannelli laterali destro visualizzare la modalità di sensazione (cutaneo – rosso, propriocettivo – blu). I riquadri grigio chiaro mostrano gli elettrodi senza alcuna sensazione riportata, mentre i riquadri grigio scuro rappresentano i canali di riferimento che non vengono utilizzati nella registrazione. I cinque elettrodi con uno spesso contorno nero rappresentano il sottoinsieme testato nel compito aggiuntivo di mappatura a livello di parametri. Gli asterischi giallo e magenta segnano l’angolo inferiore-posteriore degli impianti, rispettivamente per l’array mediale e laterale.
FG ha riportato una ricchezza di sensazioni qualitative indotte dall’ICMS (Tabella1). A differenza delle sensazioni parestesiche sperimentate dopo la lesione, queste risposte naturalistiche sono state ampiamente caratterizzate come cutanee (ad es. spremitura) o propriocettive (ad es. movimento verso destra), e come soggettivamente simili alle sensazioni sperimentate prima della lesione. A sua discrezione, il soggetto utilizzava descrittori a parole singole per caratterizzare le sensazioni percepite nel modo più accurato possibile. I descrittori mono-parola hanno il vantaggio di poter essere confrontati tra grandi serie di dati o soggetti. Tuttavia, poiché i progressi sperimentali continuano a spingere le capacità dell’ICMS, le risposte potrebbero diventare più complesse e gli studi futuri potrebbero trarre vantaggio da descrittori più strutturati, che tengono conto della complessità di queste esperienze sensoriali(Darie et al., 2017).
| Descrizione | % Totale Sensazioni (381 totali) | Ampiezza μA (modo) | Ampiezza μA (25°, 75° percentile) | Intensità (modo) | Intensità (25°, 75° percentile) |
|---|---|---|---|---|---|
| Spremere | 24.9 | 40 | 40, 87.5 | 7 | 4, 7 |
| Toccare | 17.3 | 70 | 40, 80 | 1 | 1, 4 |
| Movimento a destra | 9.7 | 90 | 55, 90 | 1 | 1, 3 |
| Vibrazioni | 8.1 | 40 | 40, 90 | 2 | 2, 3 |
| Soffiaggio | 6.6 | 60 | 30, 80 | 1 | 1, 2 |
| Movimento in avanti | 5.8 | 70 | 40, 80 | 1 | 1, 4 |
| Pizzica | 5.5 | 40 | 40, 90 | 3 | 3, 6 |
| Stampa | 5.0 | 40 | 40, 70 | 7 | 4, 7 |
| Movimento verso l’alto | 3.9 | 70 | 70, 85 | 1 | 1.25, 4 |
| La pelle d’oca | 3.1 | 100 | 60, 90 | 5 | 2, 5 |
Abbiamo trovato che 18 elettrodi avevano risposte solo cutanee in tutte le ampiezze di corrente testate, mentre sei elettrodi avevano risposte solo propriocettive; il resto degli elettrodi (22/46) aveva risposte miste, dove la modalità percepita (cutanea o propriocettiva) variava al variare dei parametri di stimolo. Di questi elettrodi a risposta mista, il 45% evocava sensazioni per lo più cutanee, il 32% evocava sensazioni per lo più propriocettive, e il 23% aveva un numero uguale di sensazioni cutanee e propriocettive(Figura 2B). Questo modello di sensazioni evocate cutanee e propriocettive completa i recenti rapporti di neuroni multimodali (cioè cutanei e propriocettivi) in tutto S1(Yau et al., 2016; Kim et al., 2015b). Mentre gli esperimenti precedenti su singole unità hanno definito mappe da singoli neuroni a campi ricettivi unimodali specifici(Kaas et al., 1979; Kaas, 1983; Friedman et al., 2004; Romo et al., 2000), i risultati di cui sopra suggeriscono che più di una variabile può essere rappresentata quando si mappano con ICMS. Questo risultato può essere il prodotto di diversi meccanismi attraverso i quali i campi ricettivi sono osservati attraverso la registrazione rispetto alla stimolazione, e potrebbe essere un argomento importante per il lavoro futuro. Abbiamo trovato una differenza significativa tra le ampiezze che hanno suscitato risposte cutanee o propriocettive, con la distribuzione delle risposte propriocettive inclinate verso ampiezze più elevate(Figura 3A), quando si mettono in comune tutti gli elettrodi e le ampiezze che hanno prodotto una sensazione (p = 0.039, Kruskal-Wallis nonparametrico ANOVA, χ 2 (1.378)=4,41, risposte propriocettive N = 79, risposte cutanee N = 302). Per valutare l’erogazione di corrente costante su tutti gli elettrodi, abbiamo misurato l’impedenza degli elettrodi all’inizio di ogni sessione e non abbiamo trovato alcuna differenza significativa quando abbiamo confrontato le risposte propriocettive o cutanee (p=0.237, χ 2(1.378)=1,39) e, inoltre, non abbiamo trovato alcuna differenza significativa tra l’impedenza degli elettrodi solo propriocettivi e cutanei (p=0,922, χ 2(1.155)=0,01) o a risposta mista (p=0,372, χ 2(1.221)=0,8). Per tenere conto di potenziali distorsioni da una distribuzione non uniforme delle risposte su ampiezze, abbiamo confrontato la proporzione di risposte propriocettive e cutanee in un ricampionamento bootstrapped (N = 10000), in cui ogni ripetizione ha disegnato 15 risposte ad ogni ampiezza da tutti i dati raccolti nel corso dei giorni (Figura 3B). Abbiamo osservato una chiara relazione tra il numero di risposte propriocettive e cutanee e le ampiezze di stimolazione, misurate attraverso pendenze positive complessive nel polinomio di 1° ordine ad ogni iterazione per le risposte propriocettive, e pendenze negative per le risposte cutanee(Figura 3C).
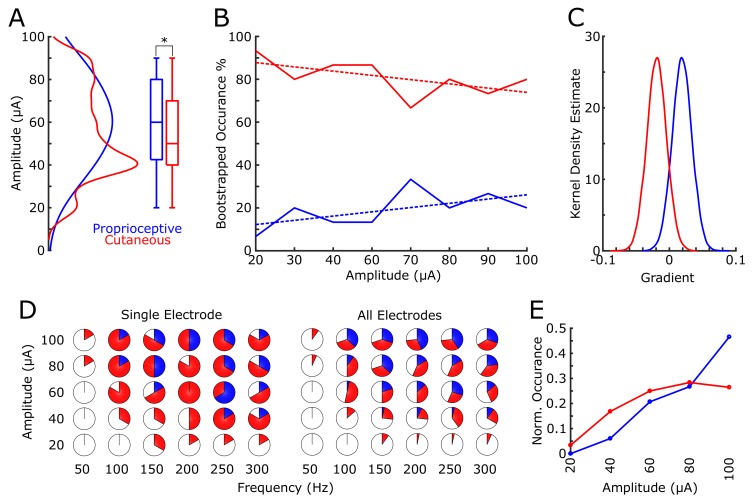
Figura 3.Risposte propriocettive e cutanee.(A) Stima della densità del kernel e box plot che mostra la differenza nella distribuzione delle ampiezze associate ad ogni rapporto di risposte propriocettive (blu) o cutanee (rosso).(B) La percentuale mediana delle risposte nel campione bootstrapped (linea solida) per le risposte propriocettive e cutanee ad ogni ampiezza testata. La linea tratteggiata mostra l’adattamento polinomiale di 1° ordine.(C) Stime della densità del kernel della distribuzione delle pendenze da 1 ° ordine polinomiale si adatta in ogni iterazione bootstrap.(D) I grafici a torta mostrano la percentuale delle stimolazioni totali delle risposte per il sottoinsieme degli elettrodi testati su un intervallo sia di ampiezze di corrente che di frequenze di impulso. Il pannello di sinistra mostra un singolo elettrodo di esempio (sei prove per combinazione di ampiezza e frequenza) e il pannello di destra mostra i dati raggruppati su tutti e cinque gli elettrodi (30 stimolazioni totali per combinazione). Viene mostrata la percentuale di nessuna risposta (bianco), propriocettiva (blu) o cutanea (rosso).(E) Un istogramma normalizzato di risposte propriocettive (blu) e cutanee (rosso) a ciascuna delle ampiezze testate nell’esperimento 2.
Esperimento 2 testato un sottoinsieme di 5 elettrodi con risposte robuste attraverso tutte le ampiezze testate nell’esperimento 1(Figura 2B, Figura 3D). In un modo pseudorandomly-interterfoglia, abbiamo stimolato ogni elettrodo con cinque ampiezze (range da 20 a 100 μA) a sei diverse frequenze (range da 50 a 300 Hz) nel corso di tre giorni consecutivi (vedi Materiali e metodi). Abbiamo riprodotto l’effetto dell’ampiezza sulla modalità di sensazione, sia propriocettiva o cutanea, quando si mette in comune tutte le risposte (p = 2 × 10-5, χ 2 (1323) = 18,17, Figura 3E). Analogamente al compito principale di mappatura, non abbiamo trovato alcun effetto significativo sulla modalità a causa dell’impedenza dell’elettrodo (p=0.305, χ 2(1323)=0.8). Inoltre, non vi è stata alcuna rilevanza nel testare l’effetto della frequenza nel suscitare risposte propriocettive o cutanee (p = 0,22, χ 2 (1323)= 1, 48).
Questo effetto specifico dell’ampiezza sulla modalità di sensazione è forse sorprendente, dato l’effetto più comunemente osservato della frequenza e della modulazione dell’ampiezza dell’impulso sulla sensazione nella periferia(Graczyk et al., 2016). Anche se ci sono prove di input tattili e propriocettivi che co-modulano l’attività di cottura S1(Kim et al., 2015b), non siamo a conoscenza di alcun effetto riportato di trebbiatura di ampiezza o frequenza per diverse modalità sensoriali nel sistema nervoso centrale. Le sensazioni propriocettive si pensa comunemente derivino dall’attività nelle aree 2 o 3a, mentre le sensazioni cutanee corrispondono più probabilmente all’attività nelle aree 3b e 1. Dalle caratteristiche topografiche, stimiamo che i nostri impianti si trovino nell’area 1; tuttavia, con l’evidenza della variabilità interindividuale nell’organizzazione microstrutturale all’interno di S1(Geyer et al., 1999), e il potenziale di riorganizzazione funzionale dopo l’infortunio(Kaas et al., 1983; Florence et al., 1998), è possibile che le ampiezze di corrente più elevate possano aumentare il range effettivo di stimolazione per includere le aree sensoriali 3a o 2. Inoltre, dati i campi ricettivi attivati durante la stimolazione, i due impianti si trovano ben all’interno delle regioni del braccio e dell’avambraccio di S1, che potrebbero ricevere un rapporto maggiore di segnali propriocettivi e cutanei rispetto alle regioni della mano(McKenna et al., 1982), rendendo più probabile l’attivazione di queste diverse modalità con ICMS.
FG ha anche fornito misure soggettive dell’intensità e della durata della sensazione. L’intensità della sensazione è stata classificata da 1 a 10 (da più debole a più forte). Nell’esperimento 1, abbiamo trovato una forte correlazione positiva tra intensità e ampiezza (r = 0,2, p = 2,1 × 10-5, Pearson coefficiente di correlazione lineare), con un’intensità di 2.4 ± 1,9 u.a. (media ±s.d.) per 20 μA e 4,0 ± 2,1 u.a. per 100 μA, con una pendenza di 0,02 (polinomio di 1° ordine, raccordo dei minimi quadrati). Poiché le misure soggettive dell’intensità sono molto probabilmente sensibili alla variabilità giornaliera, nell’analisi post-hoc abbiamo anche normalizzato i valori dell’intensità all’interno di ogni sessione (vedi Materiali e metodi). Abbiamo misurato una correlazione negativa tra l’ampiezza della corrente e la deviazione standard dell’intensità (r = -0,6, p=0,12). La durata del percept è stata registrata per ogni risposta come breve (la sensazione dura solo brevemente all’inizio della stimolazione), media (la sensazione persiste per tutta la stimolazione ma non per tutta la durata della stimolazione) o lunga (la sensazione dura per tutta la durata della stimolazione). La maggior parte delle risposte è stata breve (N = 225), seguita da media (N = 122) con pochissime risposte lunghe (N = 12). La durata dello stimolo non è stata registrata per 22 risposte su 381 risposte. Per l’Esperimento 2 questa tendenza è stata replicata (N = 268, 55 e 1. Breve, media e lunga, rispettivamente). Non vi era alcuna relazione tra la durata della sensazione e sia l’ampiezza della stimolazione (p = 0,1, χ 2 (1323) = 4,53) o la frequenza di stimolazione (p = 0,2, χ 2 (1323) = 2,83).
A nostra conoscenza, questo è il primo rapporto in umano di replicabile, puramente naturalistico sensazioni propriocettive e cutanee indotte attraverso ICMS. La stimolazione su una vasta gamma di ampiezze e frequenze ha generato sensazioni qualitativamente diverse, anche se la modalità percept era fortemente legata a variazioni di ampiezza. L’abbinamento di queste sensazioni naturali con l’IMC crea un’opportunità unica per esplorare quanto efficacemente possano essere incorporate in un sistema IMC a circuito chiuso. Ad esempio, la capacità di evocare sensazioni propriocettive potrebbe consentire al soggetto di interpretare le informazioni relative alla posizione o al movimento, come precedentemente riportato negli studi sui primati(Tomlinson e Miller ,2016; Dadarlat et al., 2015), mentre l’evocazione di sensazioni cutanee potrebbe migliorare la nostra capacità di fornire un feedback somatosensoriale più ricco per la manipolazione degli oggetti. Insieme questi segnali somatosensoriali hanno il potenziale per migliorare le prestazioni e l’incarnazione quando si utilizza un dispositivo esterno controllato dall’IMC.

Figura 2.Campi ricettivi e modalità di sensazione in tutti gli esperimenti di mappatura dell’ampiezza.(A) Posizione del campo ricettivo sui piani anteriori (tonalità più chiare) e posteriori (tonalità più scure) del braccio superiore destro (verde), avambraccio (rosa) e mano (ciano). La griglia è la stessa a cui il soggetto ha fatto riferimento durante l’esperimento.(B) Schema dei due array di elettrodi impiantati su S1(Figura 1). Pannelli laterali sinistro visualizzare i campi segnalati ricettivi in ogni posizione degli elettrodi, e pannelli laterali destro visualizzare la modalità di sensazione (cutaneo – rosso, propriocettivo – blu). I riquadri grigio chiaro mostrano gli elettrodi senza alcuna sensazione segnalata, mentre i riquadri grigio scuro rappresentano i canali di riferimento che non vengono utilizzati nella registrazione. I cinque elettrodi con uno spesso contorno nero rappresentano il sottoinsieme testato nel compito aggiuntivo di mappatura a livello di parametri. Gli asterischi giallo e magenta segnano l’angolo inferiore-posteriore degli impianti, rispettivamente per l’array mediale e laterale.

Figura 3.Risposte propriocettive e cutanee.(A) Stima della densità del kernel e box plot che mostra la differenza nella distribuzione delle ampiezze associate ad ogni rapporto di risposte propriocettive (blu) o cutanee (rosso).(B) La percentuale mediana delle risposte nel campione bootstrapped (linea solida) per le risposte propriocettive e cutanee ad ogni ampiezza testata. La linea tratteggiata mostra l’adattamento polinomiale di 1° ordine.(C) Stime della densità del kernel della distribuzione delle pendenze da 1 ° ordine polinomiale si adatta in ogni iterazione bootstrap.(D) I grafici a torta mostrano la percentuale delle stimolazioni totali delle risposte per il sottoinsieme degli elettrodi testati su un intervallo sia di ampiezze di corrente che di frequenze di impulso. Il pannello di sinistra mostra un singolo elettrodo di esempio (sei prove per combinazione di ampiezza e frequenza) e il pannello di destra mostra i dati raggruppati su tutti e cinque gli elettrodi (30 stimolazioni totali per combinazione). Viene mostrata la percentuale di nessuna risposta (bianco), propriocettiva (blu) o cutanea (rosso).(E) Un istogramma normalizzato di risposte propriocettive (blu) e cutanee (rosso) a ciascuna delle ampiezze testate nell’esperimento 2.
Materiali e metodi
Oggetto
Abbiamo reclutato e acconsentito a un partecipante maschio di 32 anni (FG) con lesione midollare completa di livello C5, 1,5 anni dopo la lesione, a partecipare a uno studio clinico di un sistema BMI con registrazione e stimolazione intracorticale. Il soggetto ha una sensazione residua nella sezione radiale anteriore del braccio, e qualche sensazione residua nella sezione radiale posteriore del braccio e dell’avambraccio, che si presenta come parestesie. Tutte le procedure sono state approvate dall’Institutional Review Boards (IRB) della University of Southern California (USC) e dal Rancho Los Amigos National Rehabilitation Hospital (RLA). La procedura di impianto è stata eseguita presso il Keck Hospital dell’USC e le sessioni di studio si sono svolte presso l’RLA.
Pianificazione chirurgica e impianto
La pianificazione chirurgica ha seguito i protocolli descritti in(Aflalo et al., 2015), con un compito aggiuntivo per identificare la posizione di un impianto all’interno della corteccia somatosensoriale. In questo compito, uno spunto visivo ha spinto lo sperimentatore, che si trovava in piedi accanto alla risonanza magnetica, a raggiungere la macchina per la risonanza magnetica con un palo di legno e premere ripetutamente in uno dei tre punti dell’arto superiore destro del soggetto dove aveva precedentemente riportato la sensazione parestesica residua; bicipite, avambraccio e poiar eminenza. Il soggetto è stato istruito ad occuparsi di ogni sensazione residua che ha avvertito in ogni punto e a riportare il numero di volte in cui lo sperimentatore lo ha toccato sulla sede del cued(Kastner et al., 1998; Staines et al., 2002). Dopo l’imaging funzionale, sono stati identificati tre luoghi di destinazione per il posizionamento degli elettrodi; giro sopramarginale (SMG), corteccia premotoria ventrale (PMv) e corteccia somatosensoriale primaria (S1). Un 96-canale, con punta di platino Neuroport microelettrodo di registrazione array (Blackrock Microsystems, Salt Lake City, UT) è stato impiantato in ciascuno di SMG e PMv. Due 7 × 7 SIROF (pellicola di ossido di iridio sputtered) con punta di microelettrodo (con 48 canali fisicamente collegati ciascuno) sono stati impiantati in S1. Gli elettrodi con punta SIROF hanno un’impedenza inferiore rispetto agli elettrodi con punta in platino, e quindi sono più adatti alla stimolazione.
Parametri di stimolazione e registrazione
Tutti gli stimoli consistevano in impulsi bifasici, bilanciati in carica, catodici leader, con larghezza di 200 µs per fase, intervallo interfase di 53 µs e durata dello stimolo di un secondo erogato ad un singolo elettrodo solo sulla matrice S1. La carica massima erogata per fase era di 20 nC. Abbiamo selezionato questi parametri, e abbiamo impostato i limiti di carica elettrica secondo gli intervalli di sicurezza mostrati negli studi ICMS con gli NHP(Kim et al., 2015a). La stimolazione è stata fornita con un dispositivo Blackrock CereStim, e i parametri di stimolazione sono stati impostati e forniti utilizzando l’API CereStim attraverso il software MATLAB (The Mathworks Inc, Natick, MA) (codice MATLAB nel file di codice sorgente 1).
Attività
Esperimento 1: Dopo una valutazione iniziale della vitalità dell’impianto, abbiamo valutato gli effetti dei parametri di stimolazione attraverso un compito di rilevamento del percept. Per questo compito di mappatura primaria, ciascuno dei 96 elettrodi di stimolazione è stato valutato a otto ampiezze: 20, 30, 40, 40, 60, 70, 70, 80, 90 e 100 μA, a 150 Hz. Il soggetto era seduto su una sedia a rotelle a circa 1,5 metri da uno schermo televisivo. Il soggetto è stato istruito a guardare un punto di fissaggio al centro dello schermo per tutta la durata dell’esperimento. In ogni prova, dopo un intervallo interprocessuale di tre secondi, il soggetto è stato presentato con un grande cerchio viola sullo schermo che indicava l’erogazione di uno stimolo elettrico. Poi, dopo un ritardo di un secondo, un segnale acustico segnalava al soggetto se provava una qualche sensazione. Quando una sensazione veniva percepita, il soggetto riportava la sua posizione su una mappa del corpo e della mano, con vista anteriore e posteriore, facendo riferimento ad una sottile griglia sovrapposta(Figura 1). Il soggetto ha anche riportato caratteristiche qualitative, tra cui l’intensità dello stimolo percepito, la durata percepita della stimolazione e una descrizione della sensazione(Tabella 1). Sensazioni più vicine in natura agli stimoli tattili sono state classificate come cutanee, e quelle che innescano una sensazione di movimento o di cambiamento di posizione sono state classificate come propriocettive. Per completare la mappatura dell’ampiezza, abbiamo eseguito dei blocchi di prova in cui abbiamo selezionato casualmente un sottoinsieme di elettrodi. Ogni blocco conteneva tre repliche di stimolazione per parametro, per elettrodo. Un ulteriore set di prove, pari al 10% del totale delle prove in un blocco, è stato aggiunto come prove di ‘cattura’, dove gli stimoli visivi sullo schermo e la stecca di risposta uditiva sono rimasti identici, ma la stimolazione non si è verificata. Gli studi di cattura sono stati randomizzati tra gli studi normali. In ogni blocco, gli studi sono stati ordinati in modo tale che la stimolazione non si è verificata agli stessi elettrodi o ad elettrodi adiacenti contemporaneamente.
Esperimento 2: Per il secondo compito di mappatura, sono stati selezionati cinque elettrodi per un’ulteriore valutazione a diverse ampiezze e frequenze. Tutte le fasi del compito e gli altri parametri di stimolazione erano gli stessi del precedente compito di mappatura. Il sottoinsieme di elettrodi selezionati per questo compito sono stati quelli che hanno mostrato le risposte più affidabili nel primo compito di mappatura. Abbiamo variato l’ampiezza della corrente (20, 40, 60, 60, 80, 100 μA) e la frequenza dell’impulso (50, 100, 150, 150, 200, 250, 300 Hz), e abbiamo testato ogni combinazione ampiezza-frequenza sei volte per elettrodo. L’intero set di dati è stato ottenuto per tre giorni consecutivi. In ogni giorno, ciascuno dei cinque elettrodi ha ricevuto due repliche di tutte le possibili combinazioni di ampiezza e frequenza. L’ordine di stimolazione degli elettrodi è stato determinato pseudorandomly.
Statistiche e metodi di analisi
Per tutta l’analisi abbiamo utilizzato il test statistico non parametrico ANOVA di Kruskal-Wallis. Abbiamo calcolato le correlazioni tra le risposte utilizzando il coefficiente di correlazione lineare di Pearson.
Per esaminare se la storia delle risposte ha avuto un effetto significativo sulla proporzione delle sensazioni riportate (de Lafuentee Romo, 2005), abbiamo esaminato le differenze tra la distribuzione delle sensazioni riportate durante la stimolazione per tre condizioni: tutte le prove, prove dopo una sensazione riportata (hit)e prove dopo una sensazione non riportata (miss). Abbiamo stimato queste distribuzioni per ogni ampiezza in una data sessione sperimentale su tutti gli elettrodi testati e abbiamo usato l’ANOVA non parametrico Kruskal-Wallis con la correzione dei confronti multipli Dunn-Sidak per verificare la significatività ad ogni ampiezza. Inoltre, abbiamo generato una distribuzione shuffle di probabilità con N = 10.000 permutazioni per i colpi dopo un colpo o una mancanza per ogni ampiezza. Non abbiamo trovato alcuna differenza significativa tra le distribuzioni shuffle e i dati empirici, con la proporzione effettiva all’interno del 5°-95° percentile della distribuzione shuffle. Per il ricampionamento bootstrapped delle risposte propriocettive e cutanee nell’Esperimento 1, abbiamo prelevato 15 campioni ad ogni iterazione dalle risposte totali ad ogni ampiezza (range 21-93 risposte su tutte le ampiezze). Dove i dati di intensità normalizzati sono riportati, abbiamo ridimensionato l’intensità grezza (range 1-10) ad una scala normalizzata (range 0-1) per ogni giorno sottraendo il minimo e poi dividendo per il massimo.
I dati grezzi per tutte le analisi presentate in questo manoscritto possono essere trovati come dati sorgente scaricabili ‘Risposte alla stimolazione a singolo elettrodo’. Dettagli specifici possono essere trovati anche nel primo foglio del file di dati grezzi.
References
- Aflalo T, Kellis S, Klaes C, Lee B, Shi Y, Pejsa K, Shanfield K, Hayes-Jackson S, Aisen M, Heck C, Liu C, Andersen RA. Neurophysiology. Decoding motor imagery from the posterior parietal cortex of a tetraplegic human. Science. 2015; 348:906-910. DOI | PubMed
- Bensmaia SJ, Miller LE. Restoring sensorimotor function through intracortical interfaces: progress and looming challenges. Nature Reviews Neuroscience. 2014; 15:313-325. DOI | PubMed
- Cole J, Cole JO. Pride and a Daily Marathon. MIT Press; 1995.
- Dadarlat MC, O’Doherty JE, Sabes PN. A learning-based approach to artificial sensory feedback leads to optimal integration. Nature Neuroscience. 2015; 18:138-144. DOI | PubMed
- Darie R, Powell M, Borton D. Delivering the sense of touch to the human brain. Neuron. 2017; 93:728-730. DOI | PubMed
- de Lafuente V, Romo R. Neuronal correlates of subjective sensory experience. Nature Neuroscience. 2005; 8:1698-1703. DOI | PubMed
- Flesher SN, Collinger JL, Foldes ST, Weiss JM, Downey JE, Tyler-Kabara EC, Bensmaia SJ, Schwartz AB, Boninger ML, Gaunt RA. Intracortical microstimulation of human somatosensory cortex. Science Translational Medicine. 2016; 8DOI | PubMed
- Florence SL, Taub HB, Kaas JH. Large-scale sprouting of cortical connections after peripheral injury in adult macaque monkeys. Science. 1998; 282:1117-1121. DOI | PubMed
- Friedman RM, Chen LM, Roe AW. Modality maps within primate somatosensory cortex. PNAS. 2004; 101:12724-12729. DOI | PubMed
- Geyer S, Schleicher A, Zilles K. Areas 3a, 3b, and 1 of human primary somatosensory cortex. NeuroImage. 1999; 10:63-83. DOI | PubMed
- Graczyk EL, Schiefer MA, Saal HP, Delhaye BP, Bensmaia SJ, Tyler DJ. The neural basis of perceived intensity in natural and artificial touch. Science Translational Medicine. 2016; 8DOI | PubMed
- Johnson LA, Wander JD, Sarma D, Su DK, Fetz EE, Ojemann JG. Direct electrical stimulation of the somatosensory cortex in humans using electrocorticography electrodes: a qualitative and quantitative report. Journal of Neural Engineering. 2013; 10DOI | PubMed
- Kaas JH, Merzenich MM, Killackey HP. The reorganization of somatosensory cortex following peripheral nerve damage in adult and developing mammals. Annual Review of Neuroscience. 1983; 6:325-356. DOI | PubMed
- Kaas JH, Nelson RJ, Sur M, Lin CS, Merzenich MM. Multiple representations of the body within the primary somatosensory cortex of primates. Science. 1979; 204:521-523. DOI | PubMed
- Kaas JH. What, if anything, is SI? Organization of first somatosensory area of cortex. Physiological Reviews. 1983; 63:206-231. DOI | PubMed
- Kastner S, De Weerd P, Desimone R, Ungerleider LG. Mechanisms of directed attention in the human extrastriate cortex as revealed by functional MRI. Science. 1998; 282:108-111. DOI | PubMed
- Kim S, Callier T, Tabot GA, Gaunt RA, Tenore FV, Bensmaia SJ. Behavioral assessment of sensitivity to intracortical microstimulation of primate somatosensory cortex. PNAS. 2015a; 112:15202-15207. DOI | PubMed
- Kim SS, Gomez-Ramirez M, Thakur PH, Hsiao SS. Multimodal interactions between proprioceptive and cutaneous signals in primary somatosensory cortex. Neuron. 2015b; 86:555-566. DOI | PubMed
- Klaes C, Shi Y, Kellis S, Minxha J, Revechkis B, Andersen RA. A cognitive neuroprosthetic that uses cortical stimulation for somatosensory feedback. Journal of Neural Engineering. 2014; 11DOI | PubMed
- McKenna TM, Whitsel BL, Dreyer DA. Anterior parietal cortical topographic organization in macaque monkey: a reevaluation. Journal of Neurophysiology. 1982; 48:289-317. DOI | PubMed
- Moore CI, Stern CE, Dunbar C, Kostyk SK, Gehi A, Corkin S. Referred phantom sensations and cortical reorganization after spinal cord injury in humans. PNAS. 2000; 97:14703-14708. DOI | PubMed
- O’Doherty JE, Lebedev MA, Ifft PJ, Zhuang KZ, Shokur S, Bleuler H, Nicolelis MA. Active tactile exploration using a brain-machine-brain interface. Nature. 2011; 479:228-231. DOI | PubMed
- Romo R, Hernández A, Zainos A, Brody CD, Lemus L. Sensing without touching. Neuron. 2000; 26:273-278. DOI | PubMed
- Romo R, Hernández A, Zainos A, Salinas E. Somatosensory discrimination based on cortical microstimulation. Nature. 1998; 392:387-390. DOI | PubMed
- Sainburg RL, Poizner H, Ghez C. Loss of proprioception produces deficits in interjoint coordination. Journal of Neurophysiology. 1993; 70:2136-2147. DOI | PubMed
- Staines WR, Graham SJ, Black SE, McIlroy WE. Task-relevant modulation of contralateral and ipsilateral primary somatosensory cortex and the role of a prefrontal-cortical sensory gating system. NeuroImage. 2002; 15:190-199. DOI | PubMed
- Tabot GA, Dammann JF, Berg JA, Tenore FV, Boback JL, Vogelstein RJ, Bensmaia SJ. Restoring the sense of touch with a prosthetic hand through a brain interface. PNAS. 2013; 110:18279-18284. DOI | PubMed
- Tomlinson T, Miller LE. Toward a proprioceptive neural interface that mimics natural cortical activity. Advances in Experimental Medicine and Biology. 2016; 957:367-388. DOI | PubMed
- Yau JM, Kim SS, Thakur PH, Bensmaia SJ. Feeling form: the neural basis of haptic shape perception. Journal of Neurophysiology. 2016; 115:631-642. DOI | PubMed
Fonte
Armenta Salas M, Bashford L, Kellis S, Jafari M, Jo H, et al. () Proprioceptive and cutaneous sensations in humans elicited by intracortical microstimulation. eLife 7e32904. https://doi.org/10.7554/eLife.32904





