Introduzione
Per molti pazienti affetti da cancro, la chirurgia complessa rappresenta sia la loro migliore possibilità di guarigione sia il loro maggiore potenziale di danno associato al trattamento, in quanto le complicanze maggiori rimangono comuni.1,2,3,4,5 Studi precedenti hanno identificato ampie variazioni nella sicurezza di complesse procedure chirurgiche per il cancro negli ospedali, con complicazioni letali che si verificano fino a 4 volte più spesso in ospedali a basso volume o con prestazioni insufficienti.4,6,7,8 Purtroppo, quasi la metà delle complesse procedure chirurgiche per il cancro si svolgono in questi ambienti ospedalieri ad alto rischio.7,9 Di conseguenza, sono stati fatti diversi tentativi da parte di pagatori e medici per indirizzare i pazienti verso gli ospedali più sicuri per la chirurgia oncologica complessa, con esiti variabili.10,11,12 In definitiva, la scelta individuale per l’assistenza ospedaliera può offrire il massimo potenziale per allineare i pazienti con gli ambienti più sicuri per la chirurgia oncologica complessa, ma richiederebbe che i pazienti siano adeguatamente informati delle loro opzioni più sicure.
La reputazione dell’ospedale è un fattore importante che i pazienti considerano quando scelgono gli ospedali per le cure complesse.13,14 Il nome di ogni ospedale evoca una reputazione per la sicurezza e la qualità che diventa il “marchio” dell’ospedale. reputazioni particolarmente favorevoli, comprese quelle supportate da importanti classifiche nazionali (ad esempio, U.S. News e World Report), possono generare un riconoscimento positivo del marchio e influenzare la scelta del paziente.14,15,16 Negli ultimi anni, i principali ospedali oncologici hanno sempre più spesso condiviso il loro marchio con ospedali più piccoli attraverso affiliazioni. Tuttavia, questa condivisione del marchio può confondere la scelta del paziente, poiché i pazienti potrebbero non essere più in grado di distinguere la reputazione dei singoli ospedali per la sicurezza all’interno delle reti oncologiche.17,18,19
A questo proposito, un recente sondaggio rappresentativo a livello nazionale ha rilevato che quasi la metà degli intervistati ha percepito la sicurezza degli interventi chirurgici complessi presso gli ospedali affiliati più piccoli come identica a quella degli ospedali più grandi specializzati nella cura del cancro (di cui condividono il marchio).19,20 Inoltre, il 31% degli intervistati ritiene che, una volta che un ospedale locale si è affiliato a un ospedale oncologico di alto livello, non sia più necessario recarsi negli ospedali di alto livello per sottoporsi a interventi chirurgici complessi.20
Nonostante la percezione pubblica, non ci sono attualmente prove a sostegno (o a confutazione) delle ipotesi di equivalenza delle cure all’interno delle reti oncologiche. Pertanto, nel tentativo di migliorare il processo decisionale informato, abbiamo valutato la mortalità chirurgica dei beneficiari di Medicare negli ospedali che partecipano a reti con i migliori ospedali oncologici.
Metodi
Fonte dei dati primari
I Centers for Medicare & Medicaid Services 100% Medicare Provider and Analysis Review File e Master Beneficiary Summary File sono stati analizzati dal 1° gennaio 2012 al 31 dicembre 2016 (i dati del 2012 sono stati utilizzati esclusivamente per stabilire le comorbidità preoperatorie). Lo studio è stato approvato dal Yale Human Investigations Committee, con la rinuncia al consenso del paziente perché i dati sono stati deidentificati. Questo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE).
Lo studio ha incluso pazienti di età superiore ai 65 anni con una diagnosi di tumore primario del colon, polmone, pancreas, stomaco o esofago e che sono stati sottoposti a chirurgia oncologica complessa non urgente (lobectomia polmonare, colectomia, gastrectomia, pancreaticoduodenectomia [procedura di Whipple], o esofagectomia) tra il 1 gennaio 2013 e il 1 ottobre 2016 (tabella 1 nel supplemento).
Selezione dell’ospedale
Ospedali di alto livello specializzati nella cura del cancro
Un obiettivo chiave di questo studio è stato quello di valutare una coorte di ospedali di primo piano riconosciuti dal grande pubblico per l’eccellenza nella cura del cancro, i cui marchi ospedalieri hanno il maggiore potenziale di influenzare la scelta dei pazienti per la cura. Lo studio si è concentrato sugli ospedali classificati tra i primi 50 migliori ospedali per il cancro da U.S. News and World Report almeno una volta tra il 2013 e il 2016 (n=59). Le classifiche degli ospedali di U.S. News and World Report sono state scelte perché la reputazione è una componente importante del loro metodo di classificazione,21 queste classifiche sono le più pubblicizzate dagli ospedali più grandi,14,15 e queste classifiche sono note per influenzare la scelta del paziente per la cura.14,15 Diversi altri rapporti pubblicamente disponibili di “migliori ospedali oncologici” sono derivati dalle classifiche di U.S. News e World Report (ad esempio, Medscape, CNN, Livestrong, e Men’s Health), evidenziando ulteriormente l’influenza della nostra coorte al top della classifica.
Affiliati di ospedali specializzati nella cura del cancro
Sono stati compiuti due passi per stabilire l’affiliazione con un ospedale oncologico di alto livello in modo da poter influenzare la scelta del paziente (eFig. 1 nel supplemento). In primo luogo, il database dell’American Hospital Association Annual Survey Database è stato interrogato dal 2012 al 2015 per identificare gli ospedali che hanno partecipato a una rete con un ospedale oncologico di alto livello. Questo passo ha identificato 637 affiliati candidati. In secondo luogo, è stato stabilito che il nome del top-ranked cancer hospital era pubblicamente associato all’ospedale affiliato (brand sharing), in contrapposizione a relazioni più ristrette che non erano promosse strategicamente (cioè, solo finanziariamente). Ogni candidato affiliato è stato valutato per la prova online (pubblicità e sito web) della condivisione del marchio. Un totale di 388 ospedali affiliati è stato identificato come brand sharing con un ospedale oncologico di alto livello, di cui 343 hanno eseguito un intervento chirurgico oncologico complesso durante il periodo di studio (eAppendice nel Supplemento).
Risultati
La mortalità a novanta giorni è stata selezionata come risultato primario in quanto è considerata la misura più accurata della mortalità associata all’intervento chirurgico.6,22,23,24 Il Master Beneficiary Summary File è stato utilizzato per derivare la mortalità totale che si verifica entro 90 giorni dall’intervento chirurgico dell’indice. Tuttavia, poiché la mortalità a 30 giorni può comprendere elementi distinti dell’assistenza ospedaliera (ad esempio, il mancato salvataggio da complicazioni), le analisi sono state ripetute utilizzando la mortalità a 30 giorni. I risultati di queste analisi di sensibilità sono stati coerenti con i risultati primari (eTable 2 nel supplemento).
Analisi statistica
Sono stati utilizzati due approcci complementari per determinare la misura in cui la sicurezza delle cure chirurgiche complesse variava a seconda dello stato all’interno delle reti. L’approccio primario ha messo a confronto tutti i pazienti che hanno subito un intervento chirurgico in un ospedale affiliato con tutti i pazienti che hanno subito un intervento chirurgico in un ospedale di alto livello, il che ha permesso di valutare un’associazione di affiliazione globale. Il secondo approccio è stato progettato per confrontare le associazioni all’interno di ogni rete ospedaliera e ha permesso di valutare se la sicurezza di un ospedale affiliato rispetto a quella di un ospedale di alto livello variava da una rete all’altra.
Per la prima analisi, sono stati stimati complessivamente modelli di regressione logistica multivariabile gerarchica e, per ogni procedura, è stata valutata l’associazione tra l’intervento chirurgico in un ospedale affiliato e quello in un ospedale oncologico di alto livello e la mortalità chirurgica a 90 giorni. I modelli comprendevano un indicatore dicotomico che indicava se i pazienti erano stati sottoposti a un intervento chirurgico in un ospedale affiliato o in un ospedale oncologico di alto livello e includevano un effetto casuale specifico dell’ospedale per tenere conto del raggruppamento dei pazienti all’interno degli ospedali. I modelli sono stati corretti per le caratteristiche dei pazienti, tra cui l’età, il sesso, la razza/etnia, l’anno dell’intervento, le comorbidità di Elixhauser,25,26 procedura e tipo di ammissione. Il modello complessivo rappresentava inoltre il tipo di procedura; i modelli specifici della procedura per la colectomia e la gastrectomia includevano ulteriori aggiustamenti per la resezione parziale o totale. Il periodo di studio ha incluso una transizione dalla Classificazione Internazionale delle Malattie, Nona Revisione alla Classificazione Statistica Internazionale delle Malattie e dei Problemi di Salute Correlati, Decima Revisione, che è stata incorporata in tutti gli algoritmi di codifica delle diagnosi e delle procedure, anche per le comorbidità di Elixhauser.27
Per la seconda analisi, ogni ospedale oncologico di primo livello è stato confrontato con il suo insieme collettivo di affiliati utilizzando indici di mortalità standardizzati (SMR). I rapporti di mortalità standardizzati sono stati calcolati come rapporto tra i tassi di mortalità osservati e quelli previsti a 90 giorni. I tassi di mortalità previsti sono stati generati da modelli di regressione logistica multivariabile specifici della procedura, corretti per le variabili dei pazienti sopra elencate, utilizzando tutti i beneficiari ammissibili (cioè non limitati agli ospedali oncologici di primo livello e alle loro affiliate; n=109-635) per evitare l’endogeneità. È stato imposto un volume minimo di 10 procedure chirurgiche per calcolare l’SMR (da parte degli affiliati collettivi o dell’ospedale di primo livello) per ridurre la variazione introdotta da ospedali con volumi particolarmente bassi.28 Agli SMR trasformati in log sono stati applicati test di coppia ponderati in base al volume della procedura per distinguere gli ospedali di primo livello e le affiliate collettive dalla media nazionale. Poiché la mortalità prevista è stata ricavata utilizzando tutti i beneficiari ammissibili, un SMR inferiore a 1 ha indicato prestazioni ospedaliere più sicure rispetto alla media nazionale. All’interno di ogni rete, l’SMR degli ospedali al top della classifica è stato confrontato con i loro affiliati collettivi utilizzando test t corretti per confronti multipli utilizzando la correzione Bonferroni stepdown, così come la valutazione di IC al 95% sovrapposti. Gli IC al 95% intorno agli SMR erano basati su 1000 campioni bootstrapped.
Contributo degli attributi ospedalieri alla sicurezza differenziale
Ai modelli di regressione logistica sono state aggiunte individualmente più caratteristiche a livello ospedaliero per valutare il contributo relativo di ciascun attributo ospedaliero sul rischio differenziale di mortalità a 90 giorni tra ospedali di alto livello e affiliati.
Analisi della sensibilità
Sono state effettuate diverse analisi alternative a supporto dei modelli primari:
- La colectomia era più comune di altre procedure, in particolare tra gli ospedali affiliati. Le 2 analisi principali sono state ripetute escludendo i pazienti sottoposti a colectomia (eTable 3 e eFigure 2 nel supplemento).
- Due reti sono state particolarmente ampie, combinando il 23,6% di tutti gli ospedali affiliati idonei (n=81) e il 16% dei pazienti. Sono stati stimati modelli di regressione logistica gerarchica corretti escludendo queste due grandi reti (eTable 4 nel supplemento).
- Come approccio alternativo all’aggiustamento del rischio, abbiamo effettuato l’aggiustamento dell’affidabilità stimando gli indici di mortalità standardizzati per il rischio, che rappresentano un’altra metrica delle prestazioni ospedaliere utilizzata dai Centri per l’Assistenza Medica e i Servizi Medicaid per il reporting di qualità (eFigure 3 nel Supplemento ).29,30 Il rapporto di mortalità a rischio standardizzato agisce come uno stimatore di restringimento che generalmente sovrastima le prestazioni degli ospedali a basso volume.31 Abbiamo inoltre applicato un adeguamento dell’affidabilità per confrontare ogni ospedale oncologico di alto livello con ogni affiliato della rete (eFigure 4 nel supplemento).
- Per valutare l’associazione tra rango ospedaliero e sicurezza, abbiamo stimato gli SMR per quintili dei primi 50 ospedali classificati (eFigure 5 nel Supplemento).
I risultati di tutte le analisi di sensibilità sono stati coerenti con i risultati primari.
Il confronto delle variabili categoriali tra i gruppi è stato effettuato utilizzando i test χ 2 e le variabili parametriche continue con i test t. Tutti i valori di P sono stati ottenuti da test su due lati e i risultati sono stati ritenuti statisticamente significativi a P<0,05. Tutte le analisi sono state eseguite utilizzando SAS, versione 9.4 (SAS Institute Inc.).
Risultati
Un totale di 59 ospedali hanno raggiunto il primo posto nella classifica degli ospedali oncologici durante il periodo di studio e sono stati affiliati con altri 343 ospedali(Tabella 1).32 Il numero mediano di affiliati per ogni ospedale al top della classifica era di 4 (intervallo interquartile, 1-8), e 6 ospedali al top della classifica non avevano affiliati. In generale, gli ospedali affiliati erano più piccoli (numero mediano di letti, 210 [intervallo interquartile, 148-347] contro 711 [intervallo interquartile, 540-893]) e meno propensi ad essere ospedali didattici (38 [11,1%] contro 56 [94,9%]).
| Caratteristica | Ospedali, n. (%) | P Valore | |
|---|---|---|---|
| Affiliato (n = 343) | Top-Ranked (n=59) | ||
| Letti, mediana (IQR), No. | 210 (148-347) | 711 (540-893) | <.001 |
| Commissione oncologica accreditata | |||
| Sì | 230 (67.1) | 58 (98.3) | <.001 |
| No | 113 (32.9) | 1 (1.7) | |
| Ospedale universitario | |||
| Sì | 38 (11.1) | 56 (94.9) | <.001 |
| No | 305 (88.9) | 3 (5.1) | |
| Durata dell’affiliazione nel periodo di studio, mediana (IQR), y | |||
| ≤1.0 | 7 (2.0) | NA | NA |
| 1.1-2.0 | 64 (18.7) | NA | |
| 2.1-3.0 | 46 (13.4) | NA | |
| >3.0 | 226 (65.9) | NA | |
| Volume annuale di tutte le procedure, mediana (IQR), n.a | 10 (5-21) | 74 (56-112) | <.001 |
| Volume della procedura, mediana (IQR), n.b | |||
| Lobectomia | 8 (3-18) | 77 (53-107) | <.001 |
| Colectomia | 15 (7-30) | 78 (59-120) | <.001 |
| Gastrectomia | 2 (1-4) | 21 (15-30) | <.001 |
| Esofagectomia | 3 (1-5) | 25 (12-34) | <.001 |
| Pancreaticoduodenectomia | 3 (2-8) | 43 (26-62) | <.001 |
| Percentuale di colectomie eseguite con tecnica minimamente invasiva, mediana (IQR) | 0.26 (0.13-0.41) | 0.34 (0.29-0.47) | <.001 |
| Met ≥1 Leapfrog Group standard per la resezione polmonare, esofagea o pancreatica32 | 9 (2.6) | 42 (71.2) | <.001 |
Un totale di 17-300 su 29-228 pazienti (59,2%; 8612 donne e 8688 uomini; età media [SD], 74,7 [6,2] anni) sono stati sottoposti a chirurgia oncologica complessa presso ospedali di alto livello e 11-928 (40,8%; 6287 donne e 5641 uomini; età media [SD], 76,2 [6,9] anni) sono stati sottoposti a chirurgia oncologica complessa presso le affiliate (Tabella 2). Gli ospedali affiliati hanno eseguito 318 di 1777 esofagectomie (17,9%) e 522 di 2103 gastrectomie (24,8%). La popolazione di pazienti curati dagli affiliati era più anziana della popolazione che si è sottoposta a interventi chirurgici negli ospedali di alto livello (età media [SD], 76,2 [6,9] contro 74,7 [6,2] anni) ma per il resto clinicamente simile. La mortalità osservata a 90 giorni è stata significativamente più alta (1,4-2,0 volte più alta; P<<1001) tra i pazienti trattati dagli ospedali affiliati rispetto a quelli trattati dagli ospedali di primo livello per ogni procedura (Figura 1).
| Caratteristica | Pazienti, n. (%) | P Valore | |
|---|---|---|---|
| Ospedale affiliato (n=11 928) | Ospedale Top-Ranked (n=17 300) | ||
| Età, y | |||
| 66-69 | 1687 (14.1) | 3071 (17.8) | <.001 |
| 70-74 | 3119 (26.1) | 5259 (30.4) | |
| 75-79 | 3433 (28.8) | 5254 (30.4) | |
| ≥80 | 3689 (30.9) | 3716 (21.5) | |
| Sesso | |||
| Maschio | 5641 (47.3) | 8688 (50.2) | <.001 |
| Femmina | 6287 (52.7) | 8612 (49.8) | |
| Gara/etnicità | |||
| Bianco | 10 631 (89.1) | 15 031 (86.9) | <.001 |
| Nero | 765 (6.4) | 984 (5.7) | |
| Altro o sconosciuto | 532 (4.5) | 1285 (7.4) | |
| Anno di intervento | |||
| 2013 | 1856 (15.6) | 3450 (19.9) | <.001 |
| 2014 | 2408 (20.2) | 3854 (22.3) | |
| 2015 | 3521 (29.5) | 4644 (26.8) | |
| 2016 | 4143 (34.7) | 5352 (30.9) | |
| Tipo di ammissione | |||
| Elettivo | 10 955 (91.8) | 16 079 (92.9) | <.001 |
| Urgente | 973 (8.2) | 1221 (7.1) | |
| Punteggio di comorbilità di Elixhauser | |||
| 0 | 2007 (16.8) | 3053 (17.6) | .01 |
| 1-2 | 4618 (38.7) | 6853 (39.6) | |
| ≥3 | 5303 (44.5) | 7394 (42.7) | |
| Procedura | |||
| Lobectomia | 2899 (24.3) | 5551 (32.1) | <.001 |
| Colectomia | 7526 (63.1) | 5749 (33.2) | <.001 |
| Gastrectomia | 522 (4.4) | 1581 (9.1) | <.001 |
| Esofagectomia | 318 (2.7) | 1459 (8.4) | <.001 |
| Pancreaticoduodenectomia | 663 (5.6) | 2960 (17.1) | <.001 |
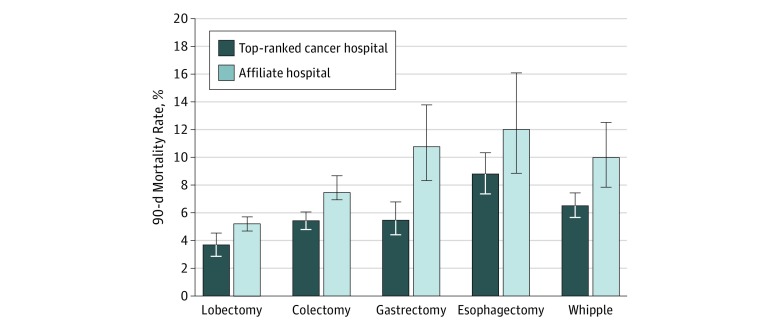
Figura 1.Figure 1. Tassi di mortalità chirurgica osservati per 90 giorni per procedura presso i migliori ospedali e gli ospedali affiliatiLe barre di errore indicano il 95% di CI binomiali. La differenza di mortalità osservata tra i migliori ospedali e gli affiliati ha raggiunto un significato(P=.05) per ogni procedura ad eccezione dell’esofagectomia (P=.08).

Figura 1.Figura 1. Tassi di mortalità chirurgica osservati per 90 giorni per procedura presso gli ospedali di alto livello e gli ospedali affiliatiLe barre di errore indicano il 95% di CI binomiali. La differenza di mortalità osservata tra i migliori ospedali e gli affiliati ha raggiunto un significato(P=.05) per ogni procedura ad eccezione dell’esofagectomia (P=.08).
Sicurezza della chirurgia negli ospedali di alto livello contro gli ospedali affiliati
La mortalità a 90 giorni corretta per il rischio dopo un intervento chirurgico oncologico complesso è stata significativamente più alta negli ospedali affiliati rispetto agli ospedali al top della classifica per tutte e 5 le procedure combinate (odds ratio, 1,40; 95% CI, 1,23-1,59; P<<1001) (Tabella 3). Il rischio più elevato di mortalità sperimentato dai pazienti negli ospedali affiliati variava in grandezza se stratificato per procedura, a partire da un odds ratio di 1,32 per la colectomia (95% di IC, 1,12-1,56; P  P==.001) ad un odds ratio di 2,04 per la gastrectomia (95% CI 1,41-2,95; P==.001); tutte le analisi specifiche della procedura erano significative ad eccezione dell’esofagectomia (odds ratio, 1,48; 0,98-2,22; P==.06).
| Procedura chirurgica | Rapporto tra quote di rischio e quote adeguate al rischio (95% CI)a | P Valore |
|---|---|---|
| Tutte le procedure | 1.40 (1.23-1.59) | <.001 |
| Lobectomia | 1.34 (1.03-1.74) | .03 |
| Colectomia | 1.32 (1.12-1.56) | .001 |
| Gastrectomia | 2.04 (1.41-2.95) | <.001 |
| Esofagectomia | 1.48 (0.98-2.22) | .06 |
| Pancreaticoduodenectomia | 1.59 (1.12-2.24) | .009 |
Rischio di mortalità all’interno di ogni rete
È stato calcolato un SMR per 49 degli ospedali più importanti e dei loro affiliati collettivi (10 reti non avevano un volume sufficiente per stimare in modo affidabile l’SMR)(Figura 2). Rispetto alla media nazionale, 39 dei 49 ospedali al primo posto (79,6%) e 17 delle 49 reti collettive affiliate (34,7%) hanno ottenuto risultati migliori del previsto (stima SMR, significativamente <1). L’SMR degli ospedali al top della classifica era inferiore a quello dei loro affiliati collettivi all’interno di 41 delle 49 reti studiate (83,7%; IC binomiale 95%, 73,1%-93,3%), di cui 37 (75,5%) che hanno raggiunto la significatività statistica e 28 (57,1%) con il 95% di IC che non si sono sovrapposti.
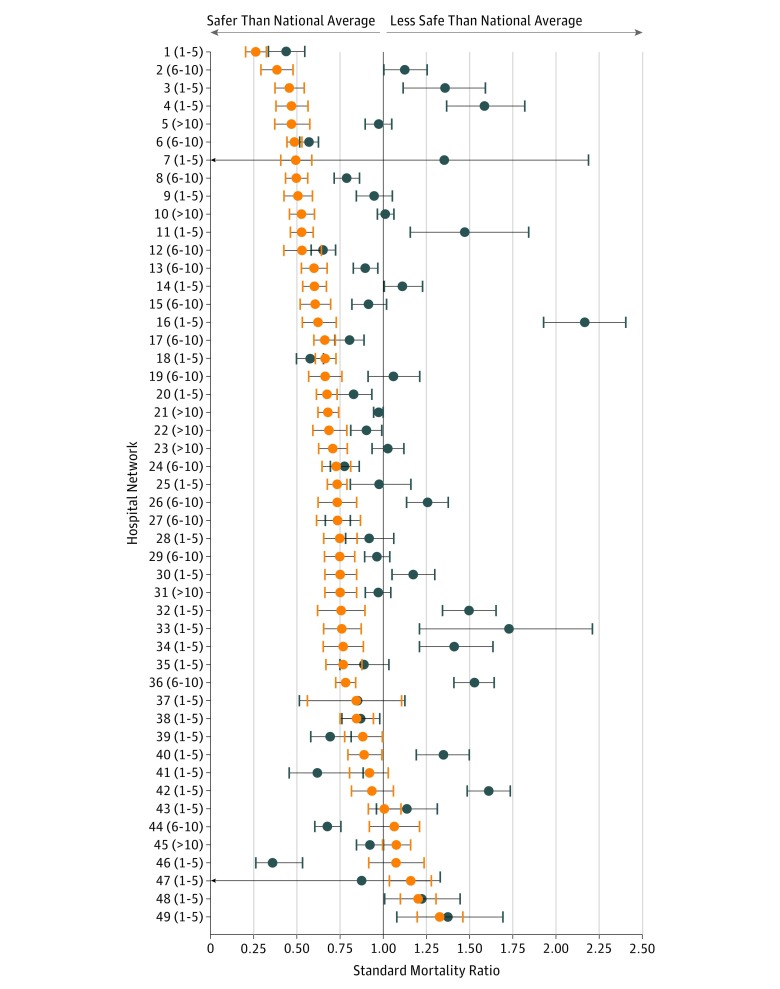
Figura 2.Figura 2. Confronto del rapporto di mortalità standardizzato presso gli ospedali di alto livello e le loro affiliate collettiveIl rapporto di mortalità standardizzato (asse delle x) di ogni ospedale al top della classifica è mostrato (arancione) insieme ai suoi affiliati collettivi (blu) con il 95% di IC (barre di errore). Le reti ospedaliere ordinate in base all’indice di mortalità standardizzato ospedaliero più basso (rete = 1) rispetto all’indice di mortalità standardizzato ospedaliero più alto (rete = 49), con il numero di ospedali affiliati all’interno di ciascuna rete tra parentesi. Per il numero di ospedali affiliati all’interno di ogni rete, sono stati utilizzati intervalli invece di valori esatti per preservare la riservatezza della rete di ospedali oncologici. Il rapporto di mortalità medio standardizzato nazionale di 1 è basato su un modello che include tutti gli ospedali che hanno eseguito interventi chirurgici oncologici durante il periodo di studio per evitare l’endogeneità.
Quando è stata confrontata la sicurezza di ogni ospedale al top della classifica rispetto a ciascuna delle sue affiliate, gli ospedali al top della classifica hanno superato l’84,5% delle loro affiliate (290 su 343). Tuttavia, il basso volume delle procedure negli ospedali affiliati distorce le stime verso la media nazionale; pertanto, le stime puntuali devono essere interpretate con cautela (eFigure 4 nel supplemento).

Figura 2.Figura 2. Confronto del rapporto di mortalità standardizzato presso gli ospedali di alto livello e i loro affiliati collettiviIl rapporto di mortalità standardizzato (asse delle x) di ogni ospedale al top della classifica è mostrato (arancione) insieme ai suoi affiliati collettivi (blu) con il 95% di IC (barre di errore). Le reti ospedaliere ordinate in base all’indice di mortalità standardizzato ospedaliero più basso (rete = 1) rispetto all’indice di mortalità standardizzato ospedaliero più alto (rete = 49), con il numero di ospedali affiliati all’interno di ciascuna rete tra parentesi. Per il numero di ospedali affiliati all’interno di ogni rete, sono stati utilizzati intervalli invece di valori esatti per preservare la riservatezza della rete di ospedali oncologici. Il rapporto di mortalità medio standardizzato nazionale di 1 è basato su un modello che include tutti gli ospedali che hanno eseguito interventi chirurgici oncologici durante il periodo di studio per evitare l’endogeneità.
Contributo degli attributi ospedalieri alla sicurezza differenziale
Nel tentativo di spiegare il differenziale di rischio di mortalità a 90 giorni osservato tra i migliori ospedali oncologici e le affiliate, al modello di regressione gerarchica adattato sono stati aggiunti individualmente diversi attributi ospedalieri. Sebbene nessun singolo attributo ospedaliero abbia eliminato il differenziale, l’aggiunta di un volume ospedaliero annuale per le complesse procedure chirurgiche e lo stato di insegnamento dell’ospedale ha attenuato l’entità e il significato del differenziale (eTable 5 nel supplemento).
Discussione
Questo studio su un’ampia coorte di pazienti anziani che si sottopongono a chirurgia oncologica presso i migliori ospedali oncologici e le loro affiliate di rete rivela che, indipendentemente dalle covariate, il rischio di morire dopo un intervento chirurgico oncologico complesso è notevolmente più alto quando l’intervento chirurgico viene eseguito presso gli ospedali affiliati rispetto agli ospedali oncologici di primo livello con cui condividono un marchio. Questo non è del tutto sorprendente, in quanto gli ospedali affiliati sono generalmente più piccoli, hanno meno probabilità di essere ospedali didattici, ed eseguono procedure chirurgiche complesse con minore frequenza (volume inferiore) rispetto agli ospedali di alto livello.7,8,33,34 A questo punto, l’inclusione delle caratteristiche ospedaliere nei modelli corretti ha attenuato (ma non ha eliminato) le differenze nella mortalità a 90 giorni.
Le implicazioni di questi risultati sono importanti perché studi precedenti suggeriscono che lo status di affiliazione può influenzare la scelta dell’ospedale e convincere i pazienti ad assumere l’equivalenza.19,20 In una recente indagine rappresentativa a livello nazionale sulla popolazione statunitense, l’affiliazione a un ospedale oncologico di alto livello è stata associata a una maggiore preferenza per le cure oncologiche complesse presso l’ospedale affiliato.19 In uno studio separato, circa la metà degli intervistati non è riuscita a identificare alcuna differenza nella sicurezza o nella qualità dell’assistenza tra i migliori ospedali e i loro affiliati.20 Quasi un terzo degli intervistati che erano disposti a viaggiare un’ora in più per sottoporsi a un intervento chirurgico oncologico complesso in un ospedale oncologico di alto livello ha cambiato la sua preferenza a favore di un ospedale locale più piccolo se questo condivideva un’affiliazione con un ospedale oncologico di alto livello. Di conseguenza, c’è motivo di temere che una parte del pubblico statunitense possa interpretare erroneamente la condivisione del marchio come indicazione di un’assistenza equivalente.
L’attività clinica all’interno di queste reti ha rappresentato una parte significativa (e crescente) della complessa operazione chirurgica eseguita durante il periodo di studio, sottolineando il potenziale effetto dei risultati. Entro il 2016, i 59 ospedali oncologici più importanti e le loro 343 affiliate hanno eseguito il 31% delle complesse procedure chirurgiche oncologiche selezionate all’interno della popolazione Medicare (eFigure 6 nel supplemento).
Ci sono metriche pubblicamente disponibili, oltre alle classifiche di U.S. News e World Report, che potrebbero supportare il processo decisionale dei pazienti. Il volume chirurgico annuale è un esempio (anche se i lavori precedenti suggeriscono che il volume è una misura imperfetta di sicurezza).6 Tuttavia, lo studio attuale è stato progettato per rispecchiare la prospettiva dei pazienti, la cui conoscenza di specifici attributi ospedalieri (oltre allo status di classifica basato sulla reputazione) è probabilmente limitata. In una certa misura, l’influenza delle classifiche ospedaliere è perpetuata dagli ospedali stessi. Ad esempio, la classifica degli ospedali è elencata sul sito web di 40 degli attuali 50 principali ospedali oncologici (80%), mentre un elevato volume chirurgico è menzionato solo in 5 dei 50 siti web (10%). Lo studio attuale non è stato concepito per spiegare perché gli ospedali affiliati sono meno sicuri. Il nostro obiettivo era quello di valutare il differenziale, perché una parte del pubblico suppone che gli ospedali di alto livello e gli ospedali affiliati siano gli stessi. Detto questo, l’analisi degli attributi ospedalieri, compreso il volume chirurgico annuale e lo stato di insegnamento dell’ospedale, indica che questi attributi possono contribuire in parte al rischio di mortalità differenziale, che rispecchia gli studi precedenti nella chirurgia oncologica complessa.4,7,33,35
La sicurezza perioperatoria raggiunta dagli ospedali al top della classifica sostiene il loro riconoscimento come ospedali oncologici leader, dato che il 79,6% degli ospedali al top della classifica ha ottenuto risultati significativamente migliori della media nazionale. Anche il 34,7% delle reti affiliate ha ottenuto risultati migliori della media nazionale. Nei 2 casi in cui gli affiliati hanno offerto un’assistenza più sicura rispetto agli ospedali di primo livello, gli ospedali di primo livello sono risultati meno performanti (SMR >1). Pertanto, mentre la chirurgia negli ospedali al top della classifica era complessivamente più sicura, alcuni affiliati possono anche offrire ambienti relativamente sicuri per interventi chirurgici complessi.
I risultati di questo studio suggeriscono un’opportunità per ridurre la mortalità attraverso l’ottimizzazione all’interno delle reti. Il concetto più semplice (anche se impegnativo da implementare) sarebbe quello di indirizzare la più pericolosa delle complesse procedure chirurgiche verso gli ospedali più sicuri all’interno di ogni rete.36 Sebbene gli ospedali affiliati abbiano eseguito il 40,8% di tutte le procedure chirurgiche complesse nell’attuale coorte di studi, hanno eseguito solo il 17,9% delle esofagectomie e il 24,8% delle gastrectomie, che hanno avuto il maggior differenziale di mortalità chirurgica tra gli affiliati e gli ospedali di alto livello. Si potrebbe anche immaginare di utilizzare la connettività all’interno delle reti per diffondere le migliori pratiche, le nuove tecniche chirurgiche o anche i membri delle équipe chirurgiche per migliorare la sicurezza negli ospedali affiliati più piccoli. In definitiva, i principali ospedali oncologici devono assumersi la responsabilità di sfruttare i rapporti con gli ospedali affiliati per garantire che la sicurezza e la qualità dell’assistenza siano ottimizzate in tutti gli ospedali che adottano il loro marchio di fiducia.
Limitazioni
L’attuale studio presenta importanti limiti oltre a quelli tipicamente attribuiti all’analisi osservazionale delle richieste di risarcimento amministrativo. Ci siamo concentrati sui marchi più riconoscibili nel settore della cura del cancro (ovvero, i migliori ospedali oncologici) e sui loro affiliati. Sebbene siamo rimasti sorpresi dalla loro quota di mercato (quasi un terzo dei beneficiari di Medicare ha ricevuto un complesso intervento chirurgico oncologico all’interno di queste reti), riconosciamo che le nostre osservazioni potrebbero non generalizzare a tutti gli scenari in cui gli ospedali condividono il loro marchio.
Lo studio si è concentrato sui pazienti di età superiore ai 65 anni; anche se le procedure chirurgiche più complesse si verificano in pazienti di età superiore ai 65 anni, e questa coorte di età probabilmente includerebbe molti dei pazienti a più alto rischio di complicanze perioperatorie,6 è possibile che i risultati possano differire tra le coorti di pazienti più giovani. Diverse caratteristiche cliniche e sociodemografiche, come lo stadio tumorale, non erano disponibili e non sono state incluse nei modelli corretti per il rischio. Tuttavia, diversi studi suggeriscono che la distribuzione del case mix è simile tra gli ospedali che eseguono la stessa procedura, sia in contesti ad alto che a basso volume.4,37,38 Sebbene i modelli specifici della procedura siano stati adattati per le resezioni parziali e totali per la gastrectomia e la colectomia, non siamo stati in grado di includere dettagli più granulari di procedure specifiche (cioè, emicolectomia destra) perché la dimensione del campione all’interno di ciascun gruppo di procedure sarebbe troppo piccola.
Ci siamo concentrati sugli ospedali che condividono marchi riconosciuti. In realtà, le reti possono contenere una vasta gamma di relazioni ospedaliere (cioè, affiliazione limitata, sistema sanitario integrato o proprietà) che potrebbero influire sulla loro sicurezza relativa.39 Tuttavia, abbiamo cercato di rappresentare la prospettiva del tipico consumatore di assistenza sanitaria, la cui risposta alla condivisione del marchio molto probabilmente avviene senza una comprensione dettagliata della natura del rapporto ospedaliero. Abbiamo valutato 3 attributi dei principali affiliati della rete di assistenza sanitaria (dimensioni della rete, durata dell’affiliazione e distanza dall’ospedale di primo livello) (eTable 6 nel supplemento), ma alla fine non abbiamo identificato alcun modello coerente associato al rischio di mortalità a 90 giorni.
Conclusioni
I pazienti che si sottopongono a un intervento chirurgico oncologico complesso presso ospedali oncologici di alto livello sono associati a un rischio di mortalità notevolmente inferiore entro 90 giorni rispetto a quelli che si sottopongono a un intervento chirurgico presso i loro ospedali affiliati. Queste informazioni possono influenzare la preferenza dell’ospedale per un sottoinsieme di pazienti, in quanto i lavori precedenti suggeriscono che gran parte del pubblico in generale equivale alla condivisione del marchio con un’assistenza equivalente all’interno di reti di alto livello.19,20,40 Un’ulteriore indagine sulle prestazioni delle reti oncologiche di fiducia potrebbe migliorare il processo decisionale informato per la cura di tumori complessi.
References
- Rates and patterns of death after surgery in the United States, 1996 and 2006. Surgery. 2012; 151(2)DOI | PubMed
- In-hospital death following inpatient surgical procedures in the United States, 1996-2006. World J Surg. 2011; 35(9):1950-1956. DOI | PubMed
- Trends in hospital and surgeon volume and operative mortality for cancer surgery. Ann Surg Oncol. 2006; 13(6):851-858. DOI | PubMed
- Impact of hospital volume on operative mortality for major cancer surgery. JAMA. 1998; 280(20):1747-1751. DOI | PubMed
- Exploring the burden of inpatient readmissions after major cancer surgery. J Clin Oncol. 2015; 33(5):455-464. DOI | PubMed
- Quality versus quantity: the potential impact of public reporting of hospital safety for complex cancer surgery. Ann Surg.DOI | PubMed
- Hospital volume and surgical mortality in the United States. N Engl J Med. 2002; 346(15):1128-1137. DOI | PubMed
- Hospital volume and operative mortality in cancer surgery: a national study. Arch Surg. 2003; 138(7):721-725. DOI | PubMed
- Regional availability of high-volume hospitals for major surgery. Health Aff (Millwood). 2004; 23(suppl 2):45-53. PubMed
- Spontaneous regionalization of esophageal cancer surgery: an analysis of the National Cancer Database. J Thorac Dis. 2018; 10(3):1721-1731. DOI | PubMed
- Potential benefits of the new Leapfrog standards: effect of process and outcomes measures. Surgery. 2004; 135(6):569-575. DOI | PubMed
- Trends in centralization of cancer surgery. Ann Surg Oncol. 2010; 17(11):2824-2831. DOI | PubMed
- Choosing a cancer surgeon: analyzing factors in patient decision making using a best-worst scaling methodology. Ann Surg Oncol. 2014; 21(12):3732-3738. DOI | PubMed
- Hospital affiliations, co-branding, and consumer impact. Health Mark Q. 2014; 31(1):65-77. DOI | PubMed
- Reacting to rankings: evidence from “America’s Best Hospitals.”. J Health Econ. 2009; 28(6):1154-1165. DOI | PubMed
- US News and World Report cancer hospital rankings: do they reflect measures of research productivity?. PLoS One. 2014; 9(9):e107803. DOI | PubMed
- Hospitals, market share, and consolidation. JAMA. 2013; 310(18):1964-1970. DOI | PubMed
- TrendWatch Chartbook 2016: Trends Affecting Hospitals and Health Systems. American Hospital Association: Washington, DC; 2016.
- US public perceptions about cancer care provided by smaller hospitals associated with large hospitals recognized for specializing in cancer care. JAMA Oncol. 2018; 4(7):1008-1009. DOI | PubMed
- Why travel for complex cancer surgery? Americans react to ‘brand-sharing’ between specialty cancer hospitals and their affiliates. Ann Surg Oncol. 2019; 26(3):732-738. DOI | PubMed
- Reputation and the best hospital rankings: what does it really mean?. Am J Med Qual. 2017; 32(6):632-637. DOI | PubMed
- Doubling of 30-day mortality by 90 days after esophagectomy: a critical measure of outcomes for quality improvement. Ann Surg. 2016; 263(2):286-291. DOI | PubMed
- The appropriateness of 30-day mortality as a quality metric in colorectal cancer surgery. Am J Surg. 2018; 215(1):66-70. DOI | PubMed
- Beyond 30-day mortality: aligning surgical quality with outcomes that patients value. JAMA Surg. 2014; 149(7):631-632. DOI | PubMed
- Comorbidity measures for use with administrative data. Med Care. 1998; 36(1):8-27. DOI | PubMed
- Comparison of the Elixhauser and Charlson/Deyo methods of comorbidity measurement in administrative data. Med Care. 2004; 42(4):355-360. DOI | PubMed
- Publisher Full Text
- Hospital volume and 30-day mortality for three common medical conditions. N Engl J Med. 2010; 362(12):1110-1118. DOI | PubMed
- An administrative claims model suitable for profiling hospital performance based on 30-day mortality rates among patients with heart failure. Circulation. 2006; 113(13):1693-1701. DOI | PubMed
- Reliability adjustment for reporting hospital outcomes with surgery. Ann Surg. 2012; 255(4):703-707. DOI | PubMed
- The Hospital Compare mortality model and the volume-outcome relationship. Health Serv Res. 2010; 45(5, pt 1):1148-1167. DOI | PubMed
- Publisher Full Text
- Hospital volume and operative mortality in the modern era. Ann Surg. 2014; 260(2):244-251. DOI | PubMed
- Surgeon volume and operative mortality in the United States. N Engl J Med. 2003; 349(22):2117-2127. DOI | PubMed
- Trends in hospital volume and operative mortality for high-risk surgery. N Engl J Med. 2011; 364(22):2128-2137. DOI | PubMed
- Pledging to eliminate low-volume surgery. N Engl J Med. 2015; 373(15):1388-1390. DOI | PubMed
- Hospital volume and late survival after cancer surgery. Ann Surg. 2007; 245(5):777-783. DOI | PubMed
- Understanding and reducing variation in surgical mortality. Annu Rev Med. 2009; 60:405-415. DOI | PubMed
- Association of hospital network participation with surgical outcomes and Medicare expenditures. Ann Surg.DOI | PubMed
- Motivators, barriers, and facilitators to traveling to the safest hospitals in the United States for complex cancer surgery. JAMA Netw Open. 2018; 1(7):e184595. DOI | PubMed
Fonte
Hoag JR, Resio BJ, Monsalve AF, Chiu AS, Brown LB, et al. (2019) Differential Safety Between Top-Ranked Cancer Hospitals and Their Affiliates for Complex Cancer Surgery. JAMA Network Open 2(4): e191912. https://doi.org/10.1001/jamanetworkopen.2019.1912





