Introduzione
Il trapianto di polmoni è un prolungamento della vita per i pazienti con malattia polmonare allo stadio terminale, ma l’elevata mortalità limita la sopravvivenza mediana post-trapianto a meno di 6 anni. I pazienti ricevono regimi immunosoppressivi a vita per prevenire l’eventuale perdita di funzionalità polmonare a causa di una disfunzione cronica dell’allotrapianto polmonare dovuta al rigetto cronico, che di solito si manifesta con la sindrome di bronchiolite obliterans o con la sindrome dell’allotrapianto restrittivo.1,2 Sfortunatamente, i regimi immunosoppressivi non sono completamente efficaci nel prevenire il rigetto cronico, e molti pazienti muoiono per le conseguenze legate all’immunosoppressione, comprese le infezioni e le malattie maligne. Nessun farmaco immunosoppressivo ha attualmente l’approvazione della US Food and Drug Administration per i pazienti che hanno ricevuto un trapianto di polmone, quindi tutti i farmaci sono usati off-label.
I regimi immunosoppressivi standard a lungo termine combinano un inibitore della calcineurina (tacrolimus o ciclosporina) con un antimetabolite (micofenolato mofetil, micofenolato di sodio o azatioprina), che serve come inibitore del ciclo cellulare. Un regime alternativo sostituisce l’antimetabolite con un bersaglio mammifero di inibitore della rapamicina (più comunemente sirolimus) come inibitore del ciclo cellulare. Questa sostituzione avviene di solito da 3 a 12 mesi dopo il trapianto perché il bersaglio mammifero di inibitori della rapamicina può compromettere la guarigione della ferita se somministrato immediatamente dopo il trapianto di polmone, portando alla deiscenza bronchiale anastomotica, che è spesso fatale.3
I potenziali benefici di sirolimus includono molteplici meccanismi per prevenire il rigetto cronico4,5,6,7 e antitumorale8,9,10,11 e anti-invecchiamento10,12 effetti. Sirolimus è stata una terapia di salvataggio efficace nel trapianto di polmoni dopo il rigetto cronico7 o cancro della pelle13 si è verificato con altri immunosoppressori. L’estensione limitata degli studi precedenti6,14,15,16 sull’uso del sirolimus profilattico nel trapianto di polmoni ha portato a risultati inconcludenti, anche se i risultati sono stati favorevoli nella maggior parte degli studi. Uno studio randomizzato aperto a 3 anni6 confrontando il sirolimus (terapia iniziata 3 mesi dopo il trapianto) con l’azatioprina, in cui più della metà dei pazienti in una popolazione con l’intenzione di trattare ha interrotto la terapia assegnata, non ha trovato differenze significative oltre alla minore incidenza di infezione da citomegalovirus con sirolimus. Uno studio di coorte a lungo termine su un unico centro14 trovato che sirolimus (terapia iniziata 1 anno dopo il trapianto) era significativamente superiore al micofenolato mofetil in sopravvivenza (67% vs 37% vivo a 9 anni), con minore rigetto cronico e incidenza di infezione. Un altro studio monocentrico15 trovato che i pazienti che ricevono sirolimus entro 6 mesi dopo il trapianto avevano una migliore funzione polmonare a 3 anni. Infine, un recente studio a un solo centro16 ha riportato una sopravvivenza favorevole a breve e a lungo termine e un’incidenza molto bassa di rigetto cronico quando sirolimus è stato iniziato 1 mese dopo il trapianto in pazienti con anastomosi bronchiali completamente guarite. Poiché nessuno studio su larga scala, a nostra conoscenza, ha esaminato la sopravvivenza a lungo termine associata all’uso profilattico di sirolimus nel trapianto di polmoni, l’obiettivo primario di questo studio è stato quello di confrontare la sopravvivenza a lungo termine tra i pazienti che hanno ricevuto sirolimus e il micofenolato mofetile, il più popolare inibitore del ciclo cellulare, utilizzando i dati nazionali statunitensi sul trapianto di polmoni.
Metodi
Studio Design e Popolazione
Questo studio di coorte retrospettivo ha incluso i destinatari statunitensi di trapianti di polmoni dal 1° gennaio 2003 al 31 agosto 2016 nella serie di dati dell’United Network for Organ Sharing (UNOS). Il comitato di revisione istituzionale dell’Università del Maryland, Baltimora, ha stabilito che questo studio non costituisce una ricerca su soggetti umani, non richiede la revisione istituzionale ed è esente dalla necessità di un consenso informato. Abbiamo seguito le linee guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE) per gli studi di coorte. Tutti i pazienti dello studio hanno ricevuto l’inibitore della calcineurina tacrolimus (Prograf) in modo profilattico e non hanno ricevuto alcuna terapia di induzione di anticorpi o terapia di induzione di anticorpi con 1 dei seguenti: basiliximab, daclizumab, alemtuzumab, o globulina antitimocita. Gli inibitori del ciclo cellulare studiati comprendevano sirolimus (Rapamune), micofenolato mofetil (Cellcept), micofenolato di sodio (Myfortic), azatioprina (Imuran), e la combinazione di sirolimus e micofenolato mofetil. Sono stati esclusi i pazienti che non hanno ricevuto uno di questi farmaci per l’immunosoppressione profilattica o che hanno ricevuto un farmaco o una combinazione non menzionati (oltre ai corticosteroidi).
I pazienti sono stati classificati in base all’inibitore del ciclo cellulare che hanno ricevuto in modo profilattico, che generalmente si trova nel loro primo record di immunosoppressione nel set di dati, subito dopo il trapianto. Tuttavia, poiché l’inizio di sirolimus è solitamente ritardato da 3 a 12 mesi dopo il trapianto, la maggior parte dei pazienti trattati con sirolimus deve essere identificata da un record di immunosoppressione di follow-up nel set di dati (occasionalmente disponibile a 3 o 6 mesi, ma di solito disponibile solo a 1 anno dal trapianto o alla morte per i pazienti deceduti entro il primo anno). Poiché l’uso di sirolimus nel primo anno è a volte per il salvataggio piuttosto che per l’uso profilattico, comunemente dopo l’insorgenza di rigetto cronico o di malattia maligna7,13,17 (che sono entrambi riportati annualmente nel set di dati UNOS), i pazienti che soffrono di rigetto cronico o di malattia maligna nel primo anno avrebbero maggiori probabilità di ricevere sirolimus. Per evitare questa potenziale fonte di confusione, le analisi primarie si sono basate su pazienti esenti da rigetto cronico e malattia maligna (e vivi) a 1 anno dal trapianto in tutti i gruppi di trattamento. Per tutte le analisi, i pazienti sono stati mantenuti nelle classificazioni dei gruppi di trattamento profilattico, indipendentemente da eventuali cambiamenti di trattamento.
Analisi statistica
Tutte le analisi sono state effettuate utilizzando SAS, versione 9.4 (SAS Institute Inc) o R, versione 3.4.3 (R Project for Statistical Computing) dal 1° gennaio al 13 settembre 2018. Un P<<.05 a due facce è stato considerato statisticamente significativo. Tra i pazienti trattati con sirolimus (gruppo sirolimus) e micofenolato mofetil (gruppo MMF, cioè, il gruppo più grande), le variabili continue sono stati confrontati utilizzando test di somma rango Wilcoxon, che ospita distribuzioni non normali, e le variabili categoriali sono stati confrontati utilizzando test χ 2. Le variabili comprendevano l’età, il sesso, la razza, l’indice di massa corporea, il livello di istruzione, l’anamnesi del fumo (>10 anni a pacchetto), il diabete, la scarsa funzionalità renale (livello di creatinina ≥1.3 mg/dL [da convertire in micromole per litro, moltiplicare per 88.4]), tipo di malattia polmonare, condizione medica, trapianto precedente, corrispondenza HLA donatore-ricevente, stato citomegalovirus donatore-ricevente, rapporto capacità polmonare totale prevista da donatore a ricevente, età del donatore, sesso del donatore, fumo del donatore (>20 anni di vita), tipo di trapianto, somministrazione di corticosteroidi ad alte dosi al trapianto, punteggio di allocazione polmonare (LAS), era del trapianto (dal 2003 al 2005 pre-LAS, dal 2005 post-LAS al 2010, o dal 2011 al 2016), e farmaco a induzione.
Per il confronto della sopravvivenza tra i gruppi, abbiamo esplorato approcci multipli per evitare la distorsione del tempo immortale derivante dall’inizio ritardato della terapia con sirolimus. L’approccio primario prevedeva la regressione proporzionale dei pericoli di Cox (che generava rapporti di pericolo aggiustati [aHRs] e 95% di CIs) e le analisi di sopravvivenza di Kaplan-Meier a partire da un tempo di riferimento18,19 di 12 mesi dopo il trapianto in modo che tutti i pazienti inclusi nell’analisi fossero vivi al momento del trapianto. È stato inoltre esaminato un periodo di riferimento di 3 mesi per confermare la somiglianza dei risultati. Questi 2 tempi di riferimento corrispondono all’inizio della terapia con sirolimus che si verifica ipoteticamente il più presto possibile (3 mesi dopo il trapianto) o il più tardi possibile entro il primo anno (12 mesi dopo il trapianto) perché non sono disponibili i tempi esatti di inizio della terapia con sirolimus. Nel contesto di un tempo di inizio della terapia con sirolimus di 3 mesi, la possibilità di un utilizzo di sirolimus di soccorso è meno probabile, per cui tutti i pazienti che hanno ricevuto sirolimus entro il primo anno sono stati contati come utenti profilattici. Tuttavia, nel contesto di un tempo di inizio della terapia con sirolimus di 12 mesi, se un paziente avesse avuto un rigetto cronico o una malattia maligna registrata entro il primo anno, questo risultato si sarebbe verificato prima dell’inizio della terapia con sirolimus ed è probabile che sia il motivo dell’inizio; pertanto, i pazienti che hanno avuto un rigetto cronico o una malattia maligna nel primo anno sono stati esclusi da tutti i gruppi di trattamento per garantire gruppi comparabili ed evitare confusioni per indicazione. Il secondo approccio analitico ha utilizzato una covariata dipendente dal tempo per sirolimus in un modello di regressione dei pericoli proporzionali Cox, con 12 o 3 mesi considerati come il tempo di inizio della terapia con sirolimus. Il terzo approccio utilizzava l’imputazione multipla per identificare, tra i pazienti che morivano entro 12 mesi dopo il trapianto, quelli che probabilmente avevano programmato di ricevere il sirolimus (ma che morivano prima di poterlo ricevere). Sulla base delle caratteristiche demografiche, cliniche o di trapianto associate ai pazienti del gruppo sirolimus, i pazienti che morivano entro il primo anno e che avevano caratteristiche simili sono stati identificati attraverso l’imputazione multipla e aggiunti al gruppo sirolimus, e le analisi di sopravvivenza sono state eseguite a partire dal momento del trapianto.
Nelle analisi di regressione, tutte le variabili sopra menzionate, eccetto il LAS, sono state corrette, perché il LAS si basa in gran parte su diverse di queste variabili e alcuni pazienti nel nostro studio sono stati sottoposti a trapianto prima dell’introduzione del LAS. I modelli di regressione includevano un effetto casuale che rappresentava il centro del trapianto per affrontare la confusione per centro. L’imputazione multipla è stata utilizzata per consentire alle analisi di regressione di includere i pazienti con dati covariarianti mancanti. Venti set di dati imputati sono stati generati utilizzando il metodo di specificazione completamente condizionale,20 e i coefficienti di regressione medi sono stati calcolati a partire dai risultati basati su questi 20 set di dati imputati.
Abbiamo esaminato le frequenze dei decessi dovuti a ciascuna causa comune (rigetto / polmonare, infezione, malattia maligna, insufficienza di altri organi, o altro / sconosciuto) nei gruppi sirolimus e MMF in base alle funzioni di incidenza cumulativa. Per i 3 eventi più comuni che causano la mortalità (rigetto cronico, infezione e malattia maligna), i rischi semicompetenti Analisi di regressione dei pericoli proporzionali Cox hanno confrontato i rischi di evento e i rischi di morte post-mortem tra i farmaci. Il quadro dei rischi semicompetitivi, inteso ad affrontare la possibile censura informativa di eventi non mortali per morte dovuta ad altre cause, è spiegato altrove da Alvares et al.21 e Haneuse e Lee,22 autori del pacchetto SemiCompRisks R. Un manuale di riferimento è disponibile all’indirizzo https://cran.r-project.org, e questi metodi sono stati precedentemente applicati da Jazić et al.23
Infine, per valutare se i confronti di sopravvivenza tra sirolimus e antimetaboliti differiscono a seconda della terapia di induzione utilizzata (se esiste), abbiamo esaminato la sopravvivenza associata ad ogni possibile combinazione di induzione (alemtuzumab, globulina antitimocita, basiliximab, daclizumab, o nessuna induzione) e di mantenimento (tacrolimus più sirolimus, micofenolato mofetil, o azatioprina). Questa analisi ci ha permesso di determinare quale combinazione di induzione e manutenzione è stata associata alla maggiore sopravvivenza.
Risultati
Confronto delle caratteristiche di pazienti, donatori e trapianti tra gruppi
La popolazione dello studio per l’analisi principale era composta da 9019 riceventi di trapianti di polmoni con un’età media di 57 anni (intervallo interquartile [IQR], 46-63 anni), di cui 5194 uomini (57,6%) e 3825 donne (42,4%). La tabella 1 confronta le caratteristiche principali tra i gruppi sirolimus e MMF. La maggior parte delle caratteristiche erano simili tra i gruppi; le eventuali differenze sono state corrette per le analisi di regressione.
| Caratteristica | Gruppo di studioa | P Valoreb | |
|---|---|---|---|
| Sirolimus (n = 219) | Mofetil micofenolato (n = 5782) | ||
| Età, mediana (IQR), y | 58 (48-63) | 58 (46-64) | .53 |
| Sesso | |||
| Maschio | 128 (58.4) | 3326 (57.5) | .79 |
| Femmina | 91 (41.6) | 2456 (42.5) | |
| Razza/etnicità | |||
| Nero | 27 (12.3) | 456 (7.9) | .05 |
| Bianco | 178 (81.3) | 4788 (82.8) | |
| Ispanico | 9 (4.1) | 407 (7.0) | |
| Altro | 5 (2.3) | 131 (2.3) | |
| Categoria IMC | |||
| Sottopeso | 38 (17.4) | 1115 (19.5) | .34 |
| Normale | 62 (28.4) | 1764 (30.9) | |
| Sovrappeso | 76 (34.9) | 1982 (34.7) | |
| Obeso | 42 (19.3) | 859 (15.0) | |
| Malattia polmonare (primaria) | |||
| Fibrosi cistica | 31 (14.2) | 881 (15.2) | .70 |
| Fibrosi polmonare | 84 (38.4) | 2251 (38.9) | |
| COPD | 63 (28.8) | 1535 (26.5) | |
| α1-Carenza di antitritripsina | 3 (1.4) | 175 (3.0) | |
| Ipertensione polmonare | 6 (2.7) | 181 (3.1) | |
| Sarcoidosi | 9 (4.1) | 163 (2.8) | |
| Altro | 23 (10.5) | 596 (10.3) | |
| Trapianto preliminare | |||
| Sì | 17 (7.8) | 233 (4.0) | .007 |
| No | 202 (92.2) | 5549 (96.0) | |
| LAS | |||
| Mediana (IQR) | 41 (35-48) | 40 (35-50) | .97 |
| Mancante o NA (era pre-LAS) | 70 (32.0) | 581 (10.0) | |
| Tipo di trapianto | |||
| Singola | 89 (40.6) | 2056 (35.6) | .12 |
| Doppio | 130 (59.4) | 3726 (64.4) | |
| Terapia ad induzione | |||
| Alemtuzumab | 15 (6.8) | 504 (8.7) | <.001 |
| Equino ATG | 4 (1.8) | 323 (5.6) | |
| Coniglio ATG | 2 (0.9) | 266 (4.6) | |
| Basiliximab | 71 (32.4) | 1890 (32.7) | |
| Daclizumab | 60 (27.4) | 467 (8.1) | |
| Nessuna induzione | 67 (30.6) | 2332 (40.3) | |
| Corrispondenza HLA | |||
| 0-3 Partite | 171 (96.6) | 4927 (96.1) | .75 |
| 4-6 Partite | 6 (3.4) | 198 (3.9) | |
| Età del donatore, mediana (IQR), y | 30 (20-44) | 31 (21-45) | .48 |
| Fumo da donatore (>20 anni pacchetto) | |||
| Sì | 37 (16.9) | 637 (11.1) | .008 |
| No | 182 (83.1) | 5082 (88.9) | |
Confronto di sopravvivenza tra gruppi Sirolimus e MMF
Nell’analisi del tempo di riferimento di 12 mesi, l’aHR per il gruppo sirolimus contro il gruppo MMF è stato di 0,71 (95% CI, 0,56-0,89; P==.003). La sopravvivenza mediana è stata di 8,9 anni (IQR, 4,4-12,7 anni) contro 7,1 anni (IQR, 3,6-12,1 anni) dopo il trapianto per i gruppi sirolimus vs MMF, rispettivamente. Nell’analisi del tempo di riferimento di 3 mesi, l’aHR era 0.70 (95% CI, 0.58-0.85; P<<.001) e la sopravvivenza mediana era di 7.9 anni (IQR, 3.5-12.7 anni) vs 6.2 (IQR, 2.7-11.5 anni) per i gruppi sirolimus vs MMF. La Figura 1 mostra le corrispondenti curve di sopravvivenza Kaplan-Meier. Tutti gli altri approcci analitici hanno anche indicato una migliore sopravvivenza per il sirolimus rispetto ai gruppi MMF, come mostrato nella eTabella 1 e nella eFigure 1 nel supplemento. Inoltre, sirolimus è stato associato con la sopravvivenza più favorevole tra tutte le alternative valutate (sirolimus più micofenolato mofetile, micofenolato di sodio, e azatioprina) sulla base di tutti gli approcci. Nessun’altra terapia ha avuto una sopravvivenza significativamente diversa rispetto al micofenolato mofetile (aHR per sirolimus più micofenolato mofetil più tacrolimus, 1,14 [95% CI, 0,79-1,65]; aHR per micofenolato di sodio più tacrolimus, 0,95 [95% CI, 0,77-1,17]).
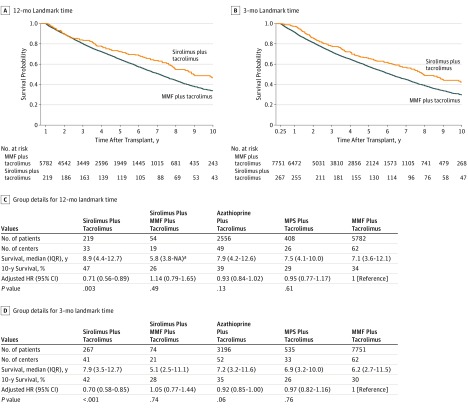
Figura 1.Figura 1. Sopravvivenza per Sirolimus vs Micofenolato Mofetil (MMF) e altre terapie standardHR indica il rapporto di pericolo; IQR, intervallo interquartile; MPS, micofenolato di sodio; e NA, non applicabile.aNon c‘è un valore superiore per questo intervallo perché il follow-up è terminato prima del 75° percentile del tempo di sopravvivenza.

Figura 1.Figura 1. Sopravvivenza per Sirolimus vs Micofenolato Mofetil (MMF) e altre terapie standardHR indica il rapporto di pericolo; IQR, intervallo interquartile; MPS, micofenolato di sodio; e NA, non applicabile.aNon c‘è un valore superiore per questo intervallo perché il follow-up è terminato prima del 75° percentile del tempo di sopravvivenza.
Confronto tra le Incidenze e la Mortalità dovuta alle Maggiori Cause di Morte tra Gruppi
Per il gruppo sirolimus e il gruppo MMF, la Figura 2 mostra le frequenze dei decessi per ogni causa principale a partire da 12 mesi dopo il trapianto. Nelle analisi di regressione multivariabile a rischi semicompetitivi, il gruppo sirolimus ha avuto una minore incidenza di rigetto cronico rispetto al gruppo MMF (aHR, 0,75; 95% CI, 0,61-0,92; P = 005) e un minore rischio di morte dopo il rigetto cronico (aHR, 0,52; 95% CI, 0,31-0,81; P = 009). L’incidenza dell’infezione è stata simile (aHR,■0,91; 95% CI, 0,55-1,36; P==,68), ma il rischio di morte dopo l’infezione è stato più basso nel gruppo sirolimus (aHR,■0,33; 95% CI, 0,21-0,53; P==,001). Non siamo stati in grado di rilevare una differenza significativa nell’incidenza della malattia maligna (aHR,0,71; 95% CI, 0,47-1,03; P==.09) o nel rischio di mortalità dopo la malattia maligna (aHR,0,70; 95% CI, 0,37-1,23; P==.26) nel gruppo sirolimus.
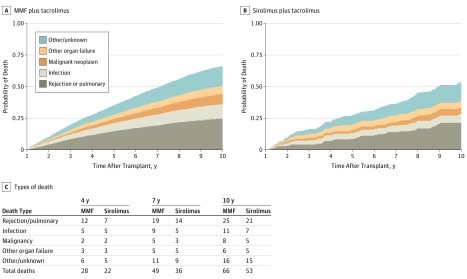
Figura 2.Figura 2. Probabilità di morte per cause principali (Sirolimus vs Micofenolato Mofetil [MMF])

Figura 2.Probabilità di morte per cause maggiori (Sirolimus vs Micofenolato Mofetil [MMF])
Valutazione dei fattori che influenzano la sopravvivenza dei pazienti trattati con Sirolimus
Nel gruppo dei sirolimus, 124 pazienti (66,7%) hanno continuato la terapia con sirolimus 1 anno dopo (al follow-up di 2 anni). Tra i pazienti vivi a 2 anni, la sopravvivenza è stata significativamente migliore per quelli che hanno continuato la terapia con sirolimus a 2 anni rispetto a quelli che hanno interrotto la terapia (sopravvivenza mediana, 10,5 anni [IQR, 6,6 anni da non raggiungere] vs 7,8 anni [IQR, 5,1-12,7 anni]; P==.01) come mostrato nella Figura 2 del Supplemento (per il gruppo sirolimus, il follow-up si è concluso prima del raggiungimento del 75° percentile di sopravvivenza). Una tendenza simile, ma una differenza di sopravvivenza minore, è stata osservata per coloro che hanno continuato contro la terapia del micofenolato mofetil interrotta al secondo anno nel gruppo MMF (sopravvivenza mediana, 8,1 anni [IQR, 4,7-12,5 anni] contro 7,2 anni [IQR, 4,5-11,3 anni]; P<-001). I pazienti che hanno continuato la terapia con sirolimus al secondo anno hanno avuto una sopravvivenza migliore di quelli che hanno continuato la terapia con micofenolo mofetil al secondo anno, all’interno di ogni gruppo (sopravvivenza mediana, 10,5 anni [IQR, 6,6 anni da non raggiungere] vs 8,1 anni [IQR, 4,7-12,5 anni]; P==.006).
Nei pazienti trattati con sirolimus, la sopravvivenza a lungo termine non differisce significativamente dall’antimetabolite inizialmente utilizzato prima dell’inizio della terapia con sirolimus (micofenolato mofetil [riferimento], azatioprina [HR, 0,72; 95% CI, 0,27-1,91], o micofenolato di sodio [HR, 1,12; 95% CI, 0,43-2,95]; P==,26). Come mostrato nella eTabella 2 del Supplemento, gli aHR per l’uso di ciascun farmaco a induzione rispetto all’assenza di induzione erano tutti superiori a 1,00, suggerendo che la sopravvivenza non era migliore, e forse peggiore, se veniva somministrata una terapia a induzione di anticorpi, tra i pazienti trattati con sirolimus.
Confronto della sopravvivenza tra le combinazioni di terapia a induzione e terapia di mantenimento
Tra le combinazioni di terapie di mantenimento basate sull’induzione e sul tacrolimus, nei pazienti vivi a 1 anno, il sirolimus senza terapia di induzione ha avuto la sopravvivenza più favorevole (10,7 anni [IQR, 7.3-12,7 anni]; aHR, 0,41; 95% CI, 0,26-0,64; P<-001) rispetto alla combinazione più comune, micofenolato mofetil senza induzione (6,8 anni [IQR, 2,2-10,5 anni]). La tabella 2 mostra i risultati per ogni combinazione di induzione e manutenzione. Dei 67 pazienti che hanno ricevuto sirolimus senza induzione, 23 (34,3%) sono stati somministrati corticosteroidi ad alte dosi al momento del trapianto. La somministrazione di corticosteroidi ad alte dosi non è stata associata alla mortalità complessiva (HR, 0,85; 95% CI, 0,24-3,02; P==,95); i pazienti che l’hanno ricevuto hanno avuto meno decessi dovuti al rigetto ma più decessi dovuti a infezioni e altre cause.
| Classifica | Terapia di manutenzioneb | Terapia ad induzione | aHR (95% CI) per la Morte | P Valorec | Numero di pazienti | Numero di centri |
|---|---|---|---|---|---|---|
| 1 | Sirolimus | Nessuno | 0.41 (0.26-0.64) | <.001 | 67 | 25 |
| 2 | Sirolimus | Daclizumab | 0.57 (0.38-0.88) | .01 | 60 | 8 |
| 3 | Azatioprina | Equino ATG | 0.75 (0.54-1.03) | .08 | 149 | 9 |
| 4 | Mofetil micofenolato | Daclizumab | 0.79 (0.66-0.94) | .009 | 467 | 25 |
| 5 | Mofetil micofenolato | Alemtuzumab | 0.79 (0.62-1.02) | .07 | 504 | 7 |
| 6 | Mofetil micofenolato | Equino ATG | 0.80 (0.64-1.01) | .06 | 323 | 12 |
| 7 | Azatioprina | Daclizumab | 0.82 (0.66-1.02) | .08 | 269 | 15 |
| 8 | Azatioprina | Basiliximab | 0.82 (0.70-0.97) | .02 | 972 | 30 |
| 9 | Sirolimus | Basiliximab | 0.87 (0.60-1.27) | .48 | 71 | 18 |
| 10 | Mofetil micofenolato | Basiliximab | 0.89 (0.78-1.01) | .07 | 1890 | 52 |
| 11 | Azatioprina | Nessuno | 0.90 (0.79-1.02) | .09 | 1136 | 42 |
| 12 | Mofetil micofenolato | Nessuno | 1 [Riferimento] | NA | 2332 | 58 |
| 13 | Mofetil micofenolato | Coniglio ATG | 1.15 (0.90-1.46) | .27 | 266 | 26 |
Lafigura 3 mostra le curve di sopravvivenza Kaplan-Meier (a partire da 1 anno) per i gruppi sirolimus e MMF, con o senza induzione. Rispetto al micofenolato mofetil con induzione, il sirolimus senza induzione ha avuto una sopravvivenza significativamente migliore (sopravvivenza mediana, 10,7 [IQR, 7,3-12,7 anni] vs 7,4 anni [IQR, 3,9-12,6 anni]; aHR, 0,48; 95% CI, 0,31-0,76; P=.002). Questi risultati sono persistiti nelle analisi a partire dal momento del trapianto basate sull’identificazione di un trattamento sirolimus pianificato per imputazione multipla, come mostrato nella eFigure 3 nel Supplemento . Si è verificata una significativa interazione tra le variabili di mantenimento e di induzione(P per interazione=.002); i risultati hanno suggerito che l’induzione era dannosa per i pazienti che ricevono sirolimus (HR per induzione, 1,81; 95% CI, 1,09-3,02) ma leggermente benefica per i pazienti che ricevono micofenolati mofetil-riceventi (HR per induzione, 0,86; 95% CI, 0,77-0,96). A partire dal momento del trapianto (tra i pazienti che ricevono l’antimetabolito), la terapia di induzione non è stata associata ad un miglioramento della sopravvivenza fino a 1 anno dopo il trapianto (cioè fino all’inizio della terapia con sirolimus), come mostrato nella eFigure 4 del supplemento. Inoltre, la sopravvivenza ad 1 anno dopo il trapianto non differisce(P==.21) a seconda dell’antimetabolite inizialmente utilizzato per la terapia di mantenimento dal momento del trapianto: micofenolato mofetile (riferimento), azatioprina (HR, 0.91; 95% CI, 0.78-1.05), e micofenolato di sodio (HR, 0.80; 95% CI, 0.58-1.11).
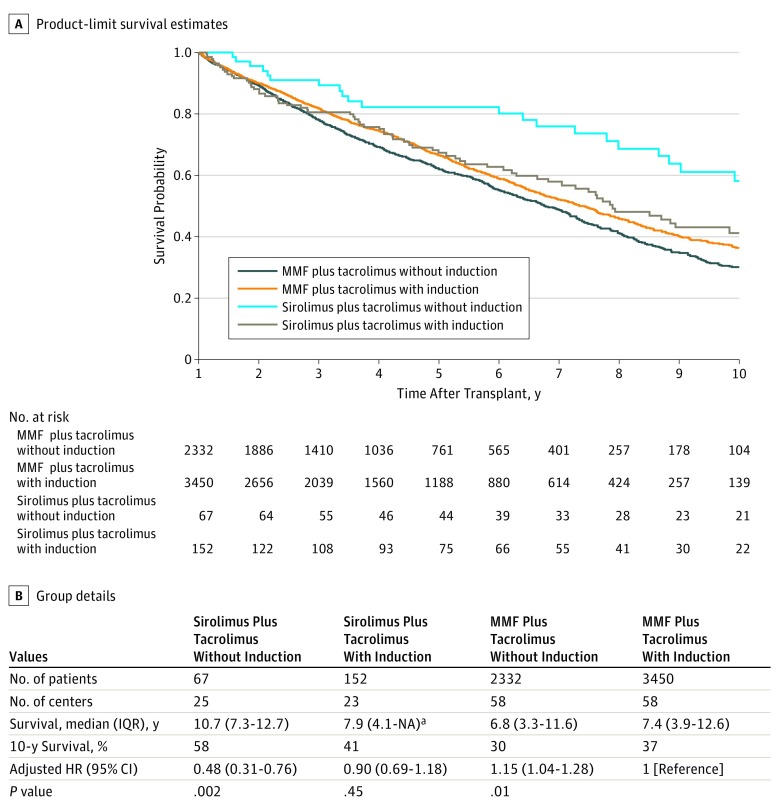
Figura 3.Figura 3. Sopravvivenza per Sirolimus vs Micofenolato Mofetil (MMF), con o senza terapia ad induzioneTipi di terapia di induzione sono alemtuzumab, globulina antitimocita, basiliximab e daclizumab. HR indica il rapporto di rischio; IQR, intervallo interquartile; e NA, non applicabile.aNon c‘è un valore superiore per questo intervallo perché il follow-up è terminato prima del 75° percentile del tempo di sopravvivenza.

Figura 3.Figura 3. Sopravvivenza per Sirolimus vs Micofenolato Mofetil (MMF), con o senza terapia ad induzioneTipi di terapia di induzione sono alemtuzumab, globulina antitimocita, basiliximab e daclizumab. HR indica il rapporto di rischio; IQR, intervallo interquartile; e NA, non applicabile.aNon c‘è un valore superiore per questo intervallo perché il follow-up è terminato prima del 75° percentile del tempo di sopravvivenza.
Discussione
A nostra conoscenza, questo studio fornisce il primo rapporto sulla sopravvivenza a lungo termine per l’uso profilattico (o quasi profilattico) del sirolimus basato sui dati nazionali di trapianto di polmoni degli Stati Uniti. Tutti gli approcci analitici hanno indicato che la terapia con sirolimus è stata associata a una migliore sopravvivenza rispetto al micofenolato mofetil e anche alla sopravvivenza più favorevole tra le alternative, tra cui sirolimus più micofenolato mofetil, azatioprina e micofenolato di sodio, all’interno di un regime a base di tacrolimus.
In precedenza, uno studio randomizzato a etichetta aperta di Bhorade et al.6 ha confrontato la terapia con sirolimus iniziata 3 mesi dopo il trapianto con la terapia con azatioprina e non ha trovato differenze significative nella sopravvivenza a 3 anni, mentre uno studio di coorte di Sacher et al.14 ha scoperto che la terapia con sirolimus iniziata 1 anno dopo il trapianto è stata associata ad una sopravvivenza significativamente migliore rispetto al micofenolato mofetil, e il miglioramento è stato sostenuto per il periodo di follow-up di 10 anni. Le diverse durate dello studio possono in parte spiegare i risultati discrepanti perché la mortalità a breve termine è relativamente bassa e comunemente non è correlata all’efficacia immunosoppressiva o agli effetti avversi, per cui le differenze di sopravvivenza legate all’immunosoppressione possono manifestarsi solo in seguito. In realtà, abbastanza coerente con i risultati dello studio randomizzato di Bhorade et al,6 che si è concluso a 3 anni dal trapianto, i nostri risultati suggeriscono che il beneficio in termini di sopravvivenza di sirolimus può iniziare a manifestarsi solo dopo circa 2 o 3 anni dal trapianto (considerando che alcuni pazienti hanno iniziato la terapia con sirolimus solo a 1 anno dal trapianto), anche se questo beneficio è considerevole a lungo termine. Un altro fattore che differenzia gli studi di Bhorade et al.6 e Sacher et al14 è che quasi la metà dei pazienti nello studio di Bhorade et al.6 ha interrotto la terapia con sirolimus entro 1 anno dall’inizio, rispetto al solo 21% di quest’ultimo studio di Sacher et al.14 Sacher et al.14 attribuito questa ritenzione superiore a ritardare l’inizio della terapia con sirolimus a 1 anno dopo il trapianto; i farmaci tossici per il midollo osseo, tra cui valganciclovir cloridrato e voriconazolo, sono stati interrotti per allora, e il tempo sufficiente di recupero del rene era trascorso dopo il trapianto,14 considerando che la disfunzione renale è stata la ragione più comune per l’interruzione della terapia con sirolimus nello studio di Bhorade et al.6 Pertanto, nei primi mesi dopo il trapianto, sirolimus può esacerbare gli effetti nefrotossici derivanti dallo stress perioperatorio e dagli elevati livelli di tacrolimus, anche se lo studio di Sacher et al.14 ha trovato una funzione renale a lungo termine significativamente migliore con sirolimus plus tacrolimus rispetto a micofenolato mofetil plus tacrolimus, indicando un eventuale effetto di risparmio renale di sirolimus, coerente con altri studi.17,23 Infine, lo studio di Bhorade et al.6 ha usato l’induzione con basiliximab o daclizumab, mentre il nostro studio ha trovato che la terapia di induzione è stata associata a una diminuzione della sopravvivenza tra i pazienti trattati con sirolimus.
Oltre al miglioramento della sopravvivenza, abbiamo trovato una minore incidenza di rigetto cronico con sirolimus rispetto al micofenolato mofetil e un minor rischio di morte dopo l’insorgenza del rigetto cronico, risultati che sono degni di nota perché i rapporti affermano costantemente che i pazienti che ricevono sirolimus sono mantenuti con livelli di tacrolimus significativamente più bassi rispetto ai pazienti che ricevono l’antimetabolito.6,14,24 Sebbene l’incidenza dell’infezione fosse simile tra i gruppi, il rischio di morte dopo l’infezione era significativamente più basso nel gruppo dei sirolimus, con una riduzione del 36% dei decessi correlati all’infezione durante 10 anni. Questo risultato suggerisce che le infezioni che si verificano nei pazienti trattati con sirolimus possono essere generalmente meno pericolose per la vita rispetto a quelle dei pazienti trattati con antimetabolite ed è supportato dalla constatazione precedentemente riportata di una riduzione delle infezioni da citomegalovirus con sirolimus.6 Coerente con la letteratura,8,9,10,11 i nostri risultati hanno anche suggerito una minore incidenza di malattia maligna con sirolimus, con decessi dovuti a malattia maligna che si verificano 38% meno frequentemente durante 10 anni.
Considerando insieme la terapia di induzione e la terapia di mantenimento, i pazienti trattati con sirolimus che non hanno ricevuto alcuna terapia di induzione anticorpale hanno avuto la migliore sopravvivenza tra tutte le combinazioni di induzione e mantenimento valutate. La sopravvivenza mediana associata a sirolimus senza induzione è stata di quasi 3 anni più lunga rispetto alla sopravvivenza con induzione. Una spiegazione è che in presenza di terapia di mantenimento con sirolimus, gli effetti a lungo termine dell’induzione25 può risultare in un’eccessiva immunosoppressione, aumentando così le infezioni, le malattie maligne, ecc., ma non diminuendo sostanzialmente il rigetto perché l’immunosoppressione sirolimus plustacrolimus sembra efficace anche senza terapia di induzione. Una spiegazione opposta è che i pazienti che ricevono l’induzione ricevono generalmente dosi di sirolimus e tacrolimus di mantenimento più basse, inadeguate a prevenire il rigetto. Anche se i nostri dati mancano di dosi o livelli di farmaci, quest’ultima spiegazione può essere supportata dal fatto che lo studio di Bhorade et al.6 (in cui tutti i pazienti hanno ricevuto l’induzione) ha riportato livelli di sirolimus e tacrolimus costantemente più bassi rispetto allo studio di Sacher et al,14 e lo studio di Sacher e colleghi ha mostrato una migliore capacità di evitare i rifiuti e di sopravvivere.
Dovremmo chiarire che l’uso di sirolimus è ancora appropriato nei pazienti che hanno ricevuto la terapia di induzione perché il gruppo sirolimus ha avuto una sopravvivenza almeno pari a quella del gruppo MMF tra i pazienti che hanno ricevuto la terapia di induzione. Il punto chiave è che la sopravvivenza sembra essere massimizzata se sirolimus viene somministrato senza terapia di induzione, e il beneficio di sirolimus apparentemente supera il beneficio di qualsiasi farmaco ad induzione, anche con un’altra terapia di mantenimento. È importante notare che la sopravvivenza entro il primo anno (fino al momento in cui il sirolimus potrebbe essere iniziato) sembra non essere influenzata dall’assenza di induzione. Il fenomeno dell’eccessiva immunosoppressione potrebbe anche spiegare perché la combinazione sirolimus più micofenolato mofetil più tacrolimus abbia avuto una sopravvivenza inferiore a quella del solo sirolimus plustacrolimus. Questo risultato suggerisce che la terapia con micofenolato mofetil dovrebbe essere interrotta ogni volta che la terapia con sirolimus viene iniziata all’interno di un regime a base di tacrolimus, tranne forse in casi speciali (con dosaggi per evitare l’eccessiva immunosoppressione), come nei pazienti con rigetto grave o con un rischio di rigetto particolarmente elevato.
Considerazioni pratiche
Poiché sirolimus appare significativamente benefico, si dovrebbero fare sforzi per consentire la tolleranza del paziente ed evitare l’interruzione della terapia; sono descritte strategie per minimizzare e gestire i rischi dei comuni effetti avversi dei mammiferi bersaglio degli inibitori della rapamicina.26 Purtroppo non disponiamo di dati per valutare i dosaggi ottimali o i livelli di depressione. Nello studio di Sacher et al,14 che ha riportato un’ottima sopravvivenza e un’incidenza incoraggiante di rigetto cronico con sirolimus plustacrolimus, il dosaggio iniziale di sirolimus a 1 anno dal trapianto era di 2 mg/d (aggiustato secondo necessità), e i dosaggi medi del prednisone erano di 7,5 mg/d a 2 anni dal trapianto e di 4,5 mg/d al follow-up finale (approssimativamente una media di 7 anni dal trapianto). I livelli medi dei trogoli a 2 anni dopo il trapianto erano 9,1 ng/mL per il sirolimus e 8,6 ng/mL per il tacrolimus; al follow-up finale, i livelli medi dei trogoli erano 7,7 ng/mL per il sirolimus e 6,8 ng/mL per il tacrolimus.14 Analogamente, in uno studio su un singolo braccio sono stati riportati livelli di sirolimus elevati e un basso dosaggio di prednisone a circa 1 o 2 anni dal trapianto, con una sopravvivenza favorevole e un’incidenza molto bassa di rigetto cronico, con sirolimus più ciclosporina.16 Poiché entrambi gli studi hanno avuto pazienti relativamente giovani (età media, rispettivamente 43 e 46 anni), i livelli ottimali di immunosoppressore possono essere più bassi per i pazienti più anziani. Lo studio di Bhorade et al,6 che non ha osservato un beneficio significativo del sirolimus, ha riportato livelli di sirolimus e di inibitori della calcineurina costantemente più bassi rispetto agli altri studi. Nel complesso, questi risultati suggeriscono che la terapia con sirolimus, se mantenuta a livelli di trogolo adeguati, può essere particolarmente efficace nel prevenire il rigetto cronico insieme a un inibitore della calcineurina, anche se i livelli di farmaco sicuri devono essere attentamente valutati per ogni paziente per evitare l’eccessiva immunosoppressione.
Limitazioni e punti di forza
Questo studio ha diversi limiti. Come studio non randomizzato, è suscettibile di confondere, anche se le nostre analisi di regressione sono state adattate per un ampio elenco di potenziali confonditori, e i gruppi sirolimus e MMF erano comparabili al momento del trapianto in quasi tutte le variabili esaminate. In particolare, anche se abbiamo controllato le prestazioni dei centri di trapianto come probabile cofondatore, la possibilità di una tendenza generale rimane all’interno dei singoli centri che i medici che hanno scelto di somministrare sirolimus possono essere stati intrinsecamente più (o meno) efficaci nella gestione dei pazienti, il che potrebbe aver portato ad un vantaggio (o svantaggio) per i pazienti trattati con sirolimus. Tuttavia, dato che il gruppo di sirolimus era composto da pazienti provenienti da più di 30 centri, era improbabile che una tendenza uniforme di confusione indotta dal medico nella stessa direzione fosse costantemente prevalente in tutti questi centri. Un certo grado di confusione per indicazione è anche plausibile, considerando che molti centri avevano meno di 10 pazienti nel gruppo sirolimus. Questo suggerisce che il sirolimus non era una tipica terapia profilattica in quei centri, quindi i pazienti di quei centri probabilmente hanno iniziato la terapia con sirolimus entro il primo anno a causa di alcune gravi complicazioni (oltre al rigetto cronico o alla malattia maligna, di cui si è tenuto conto) che sono sorte al momento del trattamento iniziale, e la loro prognosi potrebbe essere già stata compromessa all’inizio del trattamento con sirolimus. Anche nei centri che utilizzano frequentemente il sirolimus in modo profilattico, il requisito di un’iniziazione ritardata rappresenta un potenziale svantaggio per il sirolimus a causa della possibile riluttanza a passare a sirolimus i pazienti che stanno andando molto bene con il loro antimetabolite iniziale, mentre per i pazienti che stanno andando male, il passaggio a sirolimus può essere una strategia favorita, aumentando così anche la probabilità che i pazienti con una prognosi alterata ricevano il sirolimus.
I punti di forza dello studio includono l’uso di dati nazionali contenenti tutti i destinatari statunitensi di trapianti di polmoni e gli aggiustamenti per molte covariate, incluso il centro trapianti, escludendo la spiegazione che i centri che hanno somministrato il sirolimus fossero intrinsecamente più performanti indipendentemente dal farmaco. Inoltre, abbiamo esplorato diversi approcci per evitare la distorsione temporale immortale dovuta all’inizio ritardato della terapia con sirolimus, confermando che i risultati erano coerenti tra gli approcci.
Conclusioni
Utilizzando i dati nazionali statunitensi sul trapianto di polmoni, il nostro studio suggerisce che il sirolimus è associato a una migliore sopravvivenza rispetto al micofenolato mofetile all’interno di un regime basato sul tacrolimus. Abbiamo scoperto che la sopravvivenza massima può essere raggiunta se sirolimus viene somministrato senza terapia di induzione, anche se l’uso di sirolimus in pazienti che hanno ricevuto una terapia di induzione è ancora associato a una sopravvivenza favorevole. Sono necessari ulteriori studi a lungo termine su ulteriori pazienti sottoposti a trapianto di polmoni per confermare questi risultati promettenti associati a sirolimus. Nel frattempo, per migliorare potenzialmente la sopravvivenza dei pazienti, la sostituzione degli antimetaboliti con sirolimus nel primo anno, se possibile, all’interno di un regime a base di tacrolimus e idealmente senza terapia di induzione di anticorpi, dovrebbe essere fortemente considerata per tutti i destinatari del trapianto di polmoni.
References
- Update on chronic lung allograft dysfunction. Curr Transplant Rep. 2016; 3(3)DOI | PubMed
- Current views on chronic rejection after lung transplantation. Transpl Int. 2015; 28(10):1131-1139. DOI | PubMed
- Airway anastomotic dehiscence associated with use of sirolimus immediately after lung transplantation. Transplantation. 2003; 75(9):1437-1443. DOI | PubMed
- Immunosuppression for lung transplantation. Proc Am Thorac Soc. 2009; 6(1):47-53. DOI | PubMed
- Rapamycin prevents bronchiolitis obliterans through increasing infiltration of regulatory B cells in a murine tracheal transplantation model. J Thorac Cardiovasc Surg. 2016; 151(2):487-96.e3. DOI | PubMed
- Comparison of sirolimus with azathioprine in a tacrolimus-based immunosuppressive regimen in lung transplantation. Am J Respir Crit Care Med. 2011; 183(3):379-387. DOI | PubMed
- Rapamycin in lung transplantation. Transplant Proc. 2005; 37(9):3999-4000. DOI | PubMed
- Long-term immunosuppression and malignancy in thoracic transplantation: where is the balance?. J Heart Lung Transplant. 2014; 33(5):461-467. DOI | PubMed
- Review of combination therapy with mTOR inhibitors and tacrolimus minimization after transplantation. Transplant Rev (Orlando). 2013; 27(4):97-107. DOI | PubMed
- Rapalogs in cancer prevention: anti-aging or anticancer?. Cancer Biol Ther. 2012; 13(14):1349-1354. DOI | PubMed
- Rapamycin: an anti-cancer immunosuppressant?. Crit Rev Oncol Hematol. 2005; 56(1):47-60. DOI | PubMed
- Rapalogs and mTOR inhibitors as anti-aging therapeutics. J Clin Invest. 2013; 123(3):980-989. DOI | PubMed
- Tumor regression and sirolimus-based therapy in lung transplantation. J Heart Lung Transplant. 2013; 32(9):938-939. DOI | PubMed
- Effects of prophylactic use of sirolimus on bronchiolitis obliterans syndrome development in lung transplant recipients. Ann Thorac Surg. 2014; 97(1):268-274. DOI | PubMed
- Sirolimus improves renal function and may prevent BOS progression after lung transplant. J Heart Lung Transplant. 2014; 33(4):S190. DOI
- Early sirolimus-based immunosuppression is safe for lung transplantation patients: retrospective, single arm, exploratory study. Ann Transplant. 2018; 23:598-607. DOI | PubMed
- Immunosuppression in lung transplantation. J Thorac Dis. 2014; 6(8):1039-1053. DOI | PubMed
- Use of the landmark method to address immortal person-time bias in comparative effectiveness research: a simulation study. Stat Med. 2016; 35(26):4824-4836. DOI | PubMed
- Landmark analysis at the 25-year landmark point. Circ Cardiovasc Qual Outcomes. 2011; 4(3):363-371. DOI | PubMed
- Multiple imputation for continuous and categorical data: comparing joint multivariate normal and conditional approaches. Polit Anal. 2014; 22(4):497-519. DOI
- 2018. Publisher Full Text
- Semi-competing risks data analysis. Circ Cardiovasc Qual Outcomes. 2016; 9(3):322-331. DOI | PubMed
- Beyond composite endpoints analysis: semicompeting risks as an underutilized framework for cancer research. J Natl Cancer Inst. 2016; 108(12):1-6. DOI | PubMed
- Successful use in lung transplantation of an immunosuppressive regimen aimed at reducing target blood levels of sirolimus and tacrolimus. J Heart Lung Transplant. 2005; 24(4):421-425. DOI | PubMed
- Induction therapy in lung transplantation? a frustrating message of persisting uncertainty. Am J Transplant. 2016; 16(8):2250-2251. DOI | PubMed
- Strategies for the management of adverse events associated with mTOR inhibitors. Transplant Rev (Orlando). 2014; 28(3):126-133. DOI | PubMed
Fonte
Wijesinha M, Hirshon JM, Terrin M, Magder L, Brown C, et al. (2019) Survival Associated With Sirolimus Plus Tacrolimus Maintenance Without Induction Therapy Compared With Standard Immunosuppression After Lung Transplant. JAMA Network Open 2(8): e1910297. https://doi.org/10.1001/jamanetworkopen.2019.10297





