Abstract
Introduzione
L’identificazione dei circuiti neurali che controllano specifici comportamenti richiede la capacità di comunicare con specifici neuroni nel cervello di animali svegli e in movimento. L’interfaccia più consolidata è quella degli elettrodi impiantati nel cervello. Essi forniscono una rapida stimolazione neuronale e registrazione, tuttavia, a costo di essere invasivi e con un limitato targeting spaziale e di tipo cellulare. L’optogenetica, la stimolazione basata sulla luce visibile dei neuroni geneticamente modificati per esprimere i canali di luce e le pompe ioniche, fornisce il targeting genetico di specifici tipi di cellule in combinazione con la stimolazione rapida(Banghart et al., 2004; Boyden et al., 2005). Il metodo ha rapidamente guadagnato popolarità ed è stato utilizzato in vari modelli animali per studiare i circuiti cerebrali associati al morbo di Parkinson (Gradinaruet al., 2009; Kravitz et al. , 2010), il comportamento di dipendenza (Chen et al.,2013; Stefanik et al., 2013 ), la depressione (Nieh et al., 2013; Zhu et al., 2016) e l’ansia (Tye et al.,2011). Tuttavia, l’optogenetica richiede impianti cerebrali permanenti per guidare la luce nel cervello, e in genere, una fibra ottica, legando l’animale alla fonte di luce. Un terzo approccio, la neuromodulazione farmacologica che utilizza i GPCR Designer GPCRs Attivati esclusivamente dai Designer Drugs (DREADDs), fornisce un’alternativa senza fili all’optogenetica, ma genera una risposta molto più lenta, che va da decine di minuti a ore, poiché il farmaco deve diffondersi fino al luogo dell’azione(Armbruster et al., 2007; Urban e Roth, 2015). L’approccio sperimentale ideale per la stimolazione cerebrale profonda combinerebbe una minima invasività – per evitare di perturbare il comportamento, una velocità sufficiente – per consentire una risposta in tempo reale e un targeting specifico per le cellule.
La stimolazione basata sul campo magnetico ha un notevole potenziale per fornire una stimolazione cerebrale profonda veloce, senza legami e senza impianti, perché i campi magnetici sono minimamente dispersi, minimamente assorbiti dai tessuti e viaggiano liberamente nello spazio(Walsh e Cowey, 2000). Queste caratteristiche della stimolazione magnetotermica semplificano una serie di saggi sperimentali, che sono impegnativi da eseguire con le tecniche attuali, e permettono nuovi tipi di esperimenti: L’assenza di attacchi permetterà nuovi test comportamentali sociali in un gruppo di animali che interagiscono liberamente in un’arena, mentre solo un sottogruppo di essi viene stimolato. Poiché la stimolazione magnetica avviene solo quando l’animale risiede all’interno del campo magnetico, la geometria del campo può essere adattata in modo che coincida con un altro segnale per la preferenza di luogo condizionale o per i saggi di alimentazione. Allo stesso modo, la stimolazione magnetica di più siti in un cervello per studiare la connettività di rete richiede solo iniezioni multiple di soluzioni, possibilmente lungo un percorso di iniezione condiviso, in contrapposizione agli impianti di cannule multiple. Inoltre, l’assenza di qualsiasi connessione fisica dal cervello al cranio riduce al minimo i danni ai tessuti e la risposta immunitaria(Chen et al., 2015). Infine, i saggi che utilizzano animali facilmente spaventati dai lampi di luce visibile utilizzati in optogenetica, come Zebrafish, beneficerebbero della stimolazione magnetica. Pertanto, un metodo affidabile di stimolazione del campo magnetico non solo semplificherebbe gli esperimenti, attualmente eseguiti con le tecniche esistenti, ma consentirebbe una serie di nuovi test.
La sfida nell’implementazione della stimolazione magnetica è stata quella di sviluppare un trasduttore in grado di sfruttare l’energia del campo magnetico e di tradurla in un segnale biologico robusto con un’elevata specificità temporale e spaziale. I campi magnetici interagiscono solo con i dipoli magnetici. Il dipolo magnetico complessivo di una particella è causato dal momento magnetico intrinseco della particella, che risulta dall’orientamento di un gran numero di rotazioni degli ioni che compongono la nanoparticella. Le rotazioni in un ferromagnete interagiscono fortemente, causando il loro allineamento parallelo a persistere nel tempo e creando un momento magnetico permanente. Nelle particelle ferromagnetiche, il momento magnetico è fissato alla struttura cristallina della particella, causando un dipolo magnetico netto della particella, che interagisce fortemente con i campi magnetici esterni. Tuttavia, i dipoli permanenti delle singole particelle interagiscono anche in assenza di un campo esterno, causando l’aggregazione di particelle, rendendole inadatte alla neurostimolazione.
In particelle molto piccole, costituite da materiali ferromagnetici alla rinfusa, gli spin interagiscono, ma a temperatura ambiente la direzione del loro momento magnetico rispetto alla particella oscilla rapidamente(Brown, 1963). Dopo che un campo magnetico esterno allinea i momenti, questo allineamento persiste per un breve momento di tempo per permettere l’interazione. Tali particelle sono chiamate superparamagnetiche(Bean e Livingston, 1959). Sono i trasduttori preferiti per la biostimolazione magnetica(Xu e Sun, 2013; Pankhurst et al., 2009). Le particelle superparamagnetiche possono essere utilizzate come trasduttore di energia del campo magnetico sfruttando due diversi meccanismi: In un forte campo esterno DC, i dipoli magnetici indotti nei NP vicini interagiscono in modo sufficientemente forte da aggregare gli NP e un gradiente di campo esercita una piccola forza(Mannix et al., 2008). In alternativa, il nostro gruppo ha dimostrato che l’applicazione di un campo magnetico alternato (AMF) alle nanoparticelle superparamagnetiche può essere utilizzato per generare localmente calore, che poi attiva i canali TRPV1 sensibili alla temperatura nelle vicinanze(Huang et al., 2010). Questo approccio successivo, quando viene utilizzato per stimolare i neuroni TRPV1+, viene definito “genetica magnetotermica” (Chen et al.,2015; Huang et al., 2010; Stanleyet al., 2012).
L’attivazione di un canale richiede il superamento di una barriera energetica leggermente più grande dell’energia di fluttuazione termica (Etica=kBT~4⋅10-21Jat 37°C, con la costante di Boltzmann kB). L’energia massima erogata per ogni particella del trasduttore dipende dal meccanismo di interazione con il campo magnetico. Nel caso di interazione dipolo-dipolo di due NPs con dipolo magnetico m e una distanza r separata, la loro energia di interazione è Ediople~μ0m2/4πr3 (μ0 è la permeabilità al vuoto). In un campo esterno di 0,1 T, il dipolo magnetico di due NPs con nucleo a guscio utilizzati in questo studio è abbastanza forte che il loro Edipole è più grande dell’energia termica non appena sono più vicini a 22 nm(García-Prieto et al., 2016; Zhang et al., 2015a) (Figura1-figure supplement 1A B). Tuttavia, per la ferritina cavallo il dipolo magnetico a 0,1 T per particella è così debole che l’energia di interazione del dipolo è molto più piccola dell’energia termica anche se le molecole di ferritina si toccano tra loro(García-Prieto et al., 2016; Zhang et al., 2015a) (Figura1-figure supplement 1B).
Nella stimolazione magnetotermica, il trasduttore converte l’energia del campo magnetico esterno alternato in calore. Questo processo dipende dalla frequenza f e dall’intensità di campo H del campo magnetico esterno, dal tempo τ durante il quale le fluttuazioni termiche randomizzano l’orientamento dei momenti nella particella, il volume della particella e la magnetizzazione. Le nanoparticelle sintetizzate utilizzate in questo studio, riscaldano di 450 W/g a 500 kHz e 15 kA/m, mentre la ferritina cavallo non riscalda nello stesso AMF (Figura 1-figure supplement 1C). Anche se aumentando la frequenza che guida la ferritina a 50 MHz e 0,15 kA/m la ferritina di cavallo si riscalda meno di 1 W/g. In questo confronto, il prodotto H⋅f è lasciato costante, in quanto è una misura per gli effetti di fondo nei tessuti (Atkinsonet al., 1984; Chen et al., 2015). Quindi, i trasduttori che si accoppiano tramite dipolo-polo o meccanismo magnetotermico, forniscono energia sufficiente se si utilizzano costituiti da NPs superparamagnetici sintetizzati. Questo è in contrasto con la fisica poco chiara della magnetogenetica basata sulla ferritina(Meister, 2016; Stanley et al., 2015; 2012; Wheeler et al., 2016).
Nella stimolazione genetica magnetotermica, il calore deve essere erogato al canale TRPV1 in modo efficiente, evitando un’eccessiva perdita di calore al fluido tampone circostante. Classicamente, il riscaldamento ipertermico a base di nanoparticelle magnetiche utilizza una sospensione densa di nanoparticelle, un ferrofluido, in cui i vicini MNPs schermano il raffreddamento. Un MNP isolato fornisce solo pochi femtowatt di calore, che si disperde rapidamente nel volume dell’acqua. In una matrice bidimensionale densa di MNPs sulla membrana, i MNPs vicini schermano il raffreddamento laterale, lasciando solo la direzione normale alla membrana per la dissipazione del calore. MNP legati alla membrana forniscono una potenza sufficiente per aumentare la temperatura in un foglio sottile lungo la membrana(Huang et al., 2010). Pertanto, abbiamo mirato a utilizzare il riscaldamento AMF di MNP a membrana per evocare il comportamento negli animali svegli.
Qui, riportiamo la prima robusta e ripetuta attivazione genetica magnetotermica del comportamento motorio nei topi svegli, in movimento liberamente utilizzando nanoparticelle magnetiche (MNP), attaccate alla membrana plasmatica dei neuroni TRPV1+ sensibilizzati alla temperatura, in profondità nel cervello. Dimostriamo l’attivazione magnetotermica di successo di tre regioni cerebrali separate, corteccia motoria, striato dorsale e la cresta tra striato dorsale e ventrale. Tutti e tre sono stati precedentemente attivati sia optogeneticamente(Gradinaru et al., 2007; Kravitz et al., 2010) che chimogeneticamente(Arenkiel et al., 2008). Abbiamo osservato le stesse risposte comportamentali che erano state segnalate come risultato di neurostimolazione optogenetica o chemiogenetica in quelle aree. Siamo stati in grado di ottenere la neurostimolazione di successo in vivo senza aumentare la temperatura complessiva del tessuto legando MNPs alla membrana neuronale. Questo metodo magnetotermico non richiede impianti o attacchi fissi, permettendo così una stimolazione ripetibile con il monitoraggio della risposta in tempo reale e la registrazione delle capacità dei topi svegli che si muovono liberamente.
Risultati
Principi di neurostimolazione genetica magnetotermica
Per ottenere una stimolazione neuronale rapida e robusta nei topi svegli, che si comportano liberamente, abbiamo depolarizzato i neuroni sensibili al calore (TRPV1+) attraverso il riscaldamento indotto dal campo magnetico dei MNP superparamagnetici(Figura 1A,B,F). I MNPs sono stati mirati alla membrana neuronale attraverso un anticorpo A2B5 specifico per le proteine di membrana glicosilate neuronali. Questo approccio ha fornito l’etichettatura specifica e densa di membrane neuronali(Figura 1E), riducendo al minimo la quantità di MNPs necessari per l’attivazione.
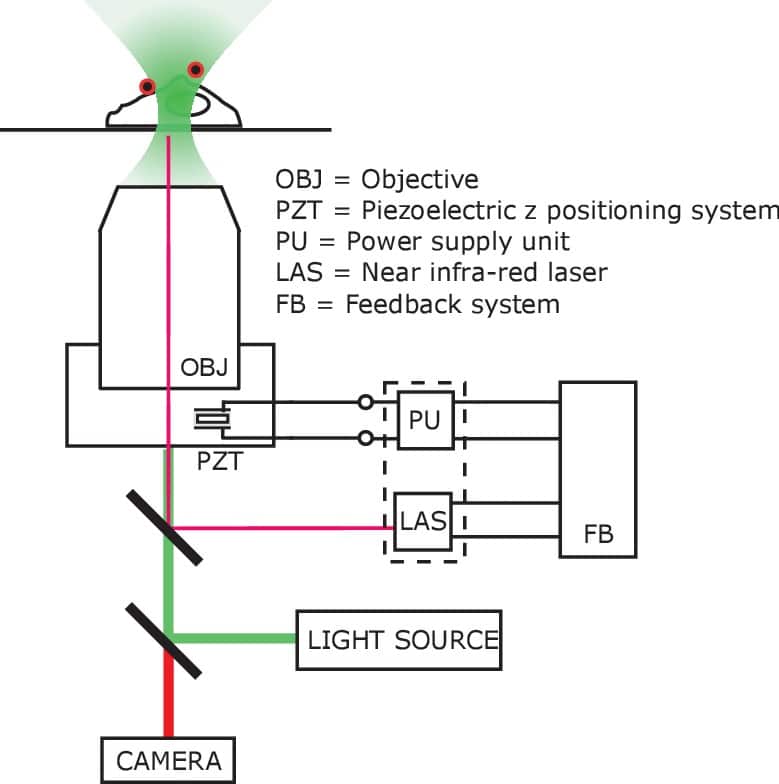
Figura 1-figure supplemento 4.Figura 1—figura supplemento 4. La neurostimolazione genetica magnetotermica attiva i canali TPRV1 riscaldando le nanoparticelle magnetiche legate alla membrana utilizzando un campo magnetico alternato.proprietà magnetiche di nanoparticelle e ferritina.esperimenti di controllo in cellule HEK293T.calibrazione per le misure di temperatura in situ.imaging set-up compatibile con il riscaldamento AMF.(A) Nanoparticelle magnetiche (MNPs) (marrone), incapsulato in polimero PMA (anello blu) sono funzionalizzati con NeutrAvidin (verde), coniugato con fluorofori Dylight550 (stelle rosse), e collegato alla membrana neuronale tramite anticorpi biotinilati che mirano alle proteine di membrana. I neuroni sono trasfettati per esprimere i canali TRVP1 sensibili alla temperatura e l’indicatore di calcio GCaMP6f.(B) L’applicazione di un campo magnetico alternato (‘AMF su’) riscalda i MNPs legati alla membrana. Questo calore dissipa, aumentando la temperatura localmente vicino alla membrana, che attiva i canali TRPV1. L’afflusso di calcio risultante depolarizza i neuroni ed è misurato come un aumento di intensità transitoria della fluorescenza GCaMP6f.(C) La configurazione sperimentale che combina l’applicazione del campo magnetico alternato (AMF) con la microscopia a fluorescenza per studi in vitro. L’AMF (linee tratteggiate) è prodotto da una bobina di cinque giri, raffreddata ad acqua in continuo in tubo di rame. La bobina e il condensatore C formano un risonatore elettrico che è azionato da una fonte di energia alternata di 7,5 kW. I neuroni cresciuti su vetro di copertura sono posti direttamente sotto la bobina in un portacampioni non metallico. L’AMF provoca correnti parassite nelle parti metalliche, compreso l’obiettivo del microscopio (OBJ). Eventuali derive di messa a fuoco sono compensate da un autofocus laser veloce (AF) (vedi anche la figura 1-figure supplement 4). I componenti all’interno della scatola rossa, tratteggiata, sono in scala.(D) Trasmissione micrografie elettroniche che mostrano 12,5 ± 1,2 nm core-shell MNPs. (A sinistra) MNPs come sintetizzati. (A destra) La colorazione negativa visualizza il guscio polimerico PMA incapsulando le nanoparticelle inorganiche scure. La barra di scala è lunga 100 nm.(E) Da sinistra a destra: micrografie a fluorescenza del neurone GCaMP6f+ (verde); etichettato con MNPs (rosso); sovrapposizione dei segnali GCaMP6f (verde) e MNP (rosso); e immagine luminosa trasmessa degli stessi neuroni. Barra di scala 10 µm (vedi anche Figura 1-figure supplement 2A).(F) (in alto) Riscaldamento locale di MNPs durante l’applicazione AMF misurata come un tuffo in intensità di fluorescenza DyLight 550 (traccia rossa), che scende linearmente con l’aumentare della temperatura. La barra grigia indica l’applicazione dell’AMF (22,4 kA/m, 412,5 kHz). (Medio) Variazione di temperatura vicino a MNPs, come calcolato dai dati di fluorescenza utilizzando la calibrazione mostrata inFigura 1-figure supplement 3 ( traccianera ). (In basso) Il segnale di fluorescenza GCaMP6f registrato nel neurone decorato con nanoparticelle mostra un transitorio di calcio dopo 5 s di AMF quando la temperatura della membrana è aumentata di 2 ° C. La temperatura è diminuita dopo che l’AMF è stato rimosso e il calcio transitori lentamente si è abbassato di nuovo.(A) Magnetizzazione in funzione del campo esterno a 37 ° C per particella, confrontando la ferritina della milza cavallo (Credito dati nella sezione Metodi supplementari) per lo scambio accoppiato core-shell MNPs core-shell utilizzati nel nostro lavoro. La magnetizzazione per particella per la ferritina è considerevolmente più piccola di quella delle particelle sintetizzate.(B) Energia di interazione magnetica dipolo-polo in funzione della separazione centro-centro tra due MNP, confrontando le particelle di ferritina della milza del cavallo (HoSF) con le particelle del nucleo del guscio (ferrite di cobalto/ Ferrite di manganese). La magnetizzazione per particella è stata calcolata utilizzando le intensità di campo magnetico indicate a 37°C. Il limite inferiore dell’asse x per ogni tipo di particella coincide con la distanza minima di separazione, quando le particelle vicine si toccano fisicamente. Come è evidente, l’energia di interazione tra le particelle di ferritina sono 6-7 ordini inferiori all’energia termica.(C) Confronto tra le SLP delle MNP del nucleo del guscio e le particelle di ferritina della milza del cavallo a varie frequenze. L’intensità del campo magnetico scelto si ottiene dai casi limite delle applicazioni biomediche, a queste frequenze. 5 unità log valori di SLP più bassi si vedono a frequenze inferiori a 1 MHz.(A) Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto varie condizioni di controllo e sperimentali. Cellule co-trasferiti con(i) GCaMP6f solo; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.(B) Cambiamento del segnale GCaMP6f registrato dalla cultura (scattato in B). Solo a) Le celle TRPV1+/MNP+ mostrano l’afflusso di calcio con applicazione AMF (barra grigia; 22,4 kA/m, 412,5 kHz). Condizioni b) TRPV1- /MNP+;c) TRPV1+/MNP- non ha mostrato alcun cambiamento nella linea di base GCaMP6f intensità di fluorescenza. Questo dimostra che TRPV1+/MNP+ è la condizione necessaria e sufficiente per evocare l’afflusso di calcio con AMF.Calibrazione della dipendenza della temperatura dell’intensità di fluorescenza di DyLight 550. Una sospensione di MNPs rivestita con NeutrAvidin – DyLight 550 è stata lentamente riscaldata a 44°C, mentre si registrava l’intensità della fluorescenza. Ad ogni punto di temperatura, sono state effettuate misurazioni multiple, che sono state poi mediate e il s.e.m. calcolato.Schema dell’impostazione dell’autofocus, compensando le aberrazioni ottiche e lo z-shift causato dal riscaldamento a correnti parassite dell’obiettivo. L’obiettivo del microscopio (OBJ) è stato montato su un adattatore, controllato dal sistema di posizionamento piezoelettrico z (PZT). Il cristallo piezoelettrico era alimentato (-30V – 130V) da un’unità di alimentazione (PU) controllata dal sistema di feedback (FB). Il sistema di feedback ha regolato la potenza piezoelettrica in accordo con il segnale trasduttore dell’unità laser (LAS), che ha monitorato la posizione relativa del coprioggetti in vetro rispetto all’obiettivo. Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto vari controlli e condizioni sperimentali. Le cellule co-trasferiti con(i) GCaMP6f solo GCaMP6f; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.

Figura 1-figure supplement 4.Figura 1— supplemento figura 4. La neurostimolazione genetica magnetotermica attiva i canali TPRV1 riscaldando le nanoparticelle magnetiche legate alla membrana utilizzando un campo magnetico alternato.proprietà magnetiche di nanoparticelle e ferritina.esperimenti di controllo in cellule HEK293T.calibrazione per misure di temperatura in situ.imaging set-up compatibile con il riscaldamento AMF.(A) Nanoparticelle magnetiche (MNPs) (marrone), incapsulato in polimero PMA (anello blu) sono funzionalizzati con NeutrAvidin (verde), coniugato con fluorofori Dylight550 (stelle rosse), e collegato alla membrana neuronale tramite anticorpi biotinilati che mirano alle proteine di membrana. I neuroni sono trasfettati per esprimere i canali TRVP1 sensibili alla temperatura e l’indicatore di calcio GCaMP6f.(B) L’applicazione di un campo magnetico alternato (‘AMF su’) riscalda i MNPs legati alla membrana. Questo calore dissipa, aumentando la temperatura localmente vicino alla membrana, che attiva i canali TRPV1. L’afflusso di calcio risultante depolarizza i neuroni ed è misurato come un aumento di intensità transitoria della fluorescenza GCaMP6f.(C) La configurazione sperimentale che combina l’applicazione del campo magnetico alternato (AMF) con la microscopia a fluorescenza per studi in vitro. L’AMF (linee tratteggiate) è prodotto da una bobina di cinque giri, raffreddata ad acqua in continuo in tubo di rame. La bobina e il condensatore C formano un risonatore elettrico che è azionato da una fonte di energia alternata di 7,5 kW. I neuroni cresciuti su vetro di copertura sono posti direttamente sotto la bobina in un portacampioni non metallico. L’AMF provoca correnti parassite nelle parti metalliche, compreso l’obiettivo del microscopio (OBJ). Eventuali derive di messa a fuoco sono compensate da un autofocus laser veloce (AF) (vedi anche la figura 1-figure supplement 4). I componenti all’interno della scatola rossa, tratteggiata, sono in scala.(D) Trasmissione micrografie elettroniche che mostrano 12,5 ± 1,2 nm core-shell MNPs. (A sinistra) MNPs come sintetizzati. (A destra) La colorazione negativa visualizza il guscio polimerico PMA incapsulando le nanoparticelle inorganiche scure. La barra di scala è lunga 100 nm.(E) Da sinistra a destra: micrografie a fluorescenza del neurone GCaMP6f+ (verde); etichettato con MNPs (rosso); sovrapposizione dei segnali GCaMP6f (verde) e MNP (rosso); e immagine luminosa trasmessa degli stessi neuroni. Barra di scala 10 µm (vedi anche Figura 1-figure supplement 2A).(F) (in alto) Riscaldamento locale di MNPs durante l’applicazione AMF misurata come un tuffo in intensità di fluorescenza DyLight 550 (traccia rossa), che scende linearmente con l’aumentare della temperatura. La barra grigia indica l’applicazione dell’AMF (22,4 kA/m, 412,5 kHz). (Medio) Variazione di temperatura vicino a MNPs, come calcolato dai dati di fluorescenza utilizzando la calibrazione mostrata inFigura 1-figure supplement 3 ( traccianera ). (In basso) Il segnale di fluorescenza GCaMP6f registrato nel neurone decorato con nanoparticelle mostra un transitorio di calcio dopo 5 s di AMF quando la temperatura della membrana è aumentata di 2 ° C. La temperatura è diminuita dopo che l’AMF è stato rimosso e il calcio transitori lentamente si è abbassato di nuovo.(A) Magnetizzazione in funzione del campo esterno a 37 ° C per particella, confrontando la ferritina della milza cavallo (Credito dati nella sezione Metodi supplementari) per lo scambio accoppiato core-shell MNPs core-shell utilizzati nel nostro lavoro. La magnetizzazione per particella per la ferritina è considerevolmente più piccola di quella delle particelle sintetizzate.(B) Energia di interazione magnetica dipolo-polo in funzione della separazione centro-centro tra due MNP, confrontando le particelle di ferritina della milza del cavallo (HoSF) con le particelle del nucleo del guscio (ferrite di cobalto/ Ferrite di manganese). La magnetizzazione per particella è stata calcolata utilizzando le intensità di campo magnetico indicate a 37°C. Il limite inferiore dell’asse x per ogni tipo di particella coincide con la distanza minima di separazione, quando le particelle vicine si toccano fisicamente. Come è evidente, l’energia di interazione tra le particelle di ferritina sono 6-7 ordini inferiori all’energia termica.(C) Confronto tra le SLP delle MNP del nucleo del guscio e le particelle di ferritina della milza del cavallo a varie frequenze. L’intensità del campo magnetico scelto si ottiene dai casi limite delle applicazioni biomediche, a queste frequenze. 5 unità log valori di SLP più bassi si vedono a frequenze inferiori a 1 MHz.(A) Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto varie condizioni di controllo e sperimentali. Cellule co-trasferiti con(i) GCaMP6f solo; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.(B) Cambiamento del segnale GCaMP6f registrato dalla cultura (scattato in B). Solo a) Le celle TRPV1+/MNP+ mostrano l’afflusso di calcio con applicazione AMF (barra grigia; 22,4 kA/m, 412,5 kHz). Condizioni b) TRPV1- /MNP+;c) TRPV1+/MNP- non ha mostrato alcun cambiamento nella linea di base GCaMP6f intensità di fluorescenza. Questo dimostra che TRPV1+/MNP+ è la condizione necessaria e sufficiente per evocare l’afflusso di calcio con AMF.Calibrazione della dipendenza della temperatura dell’intensità di fluorescenza di DyLight 550. Una sospensione di MNPs rivestita con NeutrAvidin – DyLight 550 è stata lentamente riscaldata a 44°C, mentre si registrava l’intensità della fluorescenza. Ad ogni punto di temperatura, sono state effettuate misurazioni multiple, che sono state poi mediate e il s.e.m. calcolato.Schema dell’impostazione dell’autofocus, compensando le aberrazioni ottiche e lo z-shift causato dal riscaldamento a correnti parassite dell’obiettivo. L’obiettivo del microscopio (OBJ) è stato montato su un adattatore, controllato dal sistema di posizionamento piezoelettrico z (PZT). Il cristallo piezoelettrico era alimentato (-30V – 130V) da un’unità di alimentazione (PU) controllata dal sistema di feedback (FB). Il sistema di feedback ha regolato la potenza piezoelettrica in accordo con il segnale trasduttore dell’unità laser (LAS), che ha monitorato la posizione relativa del coprioggetti in vetro rispetto all’obiettivo. Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto vari controlli e condizioni sperimentali. Le cellule co-trasferiti con(i) GCaMP6f solo GCaMP6f; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.
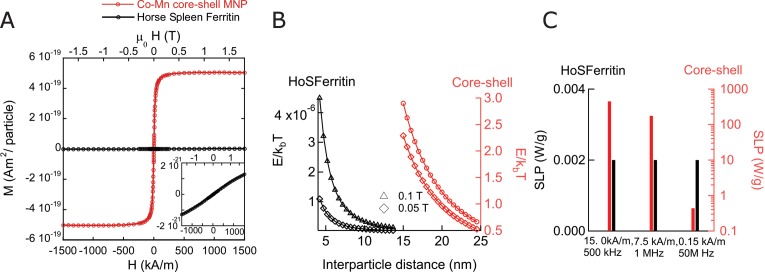
Figura 1-figure supplement 1.Proprietà magnetiche delle nanoparticelle e della ferritina.(A) Magnetizzazione in funzione del campo esterno a 37°C per particella, confrontando la ferritina della milza del cavallo (Credito dati nella sezione Metodi supplementari) con i MNPs accoppiati di scambio core-shell usati nel nostro lavoro. La magnetizzazione per particella per la ferritina è considerevolmente più piccola di quella delle particelle sintetizzate.(B) Energia di interazione magnetica dipolo-polo in funzione della separazione centro-centro tra due MNP, confrontando le particelle di ferritina della milza del cavallo (HoSF) con le particelle del nucleo del guscio (ferrite di cobalto/ Ferrite di manganese). La magnetizzazione per particella è stata calcolata utilizzando le intensità di campo magnetico indicate a 37°C. Il limite inferiore dell’asse x per ogni tipo di particella coincide con la distanza minima di separazione, quando le particelle vicine si toccano fisicamente. Come è evidente, l’energia di interazione tra le particelle di ferritina sono 6-7 ordini inferiori all’energia termica.(C) Confronto tra le SLP delle MNP del nucleo del guscio e le particelle di ferritina della milza del cavallo a varie frequenze. L’intensità del campo magnetico scelto si ottiene dai casi limite delle applicazioni biomediche, a queste frequenze. 5 unità log valori di SLP più bassi si vedono a frequenze inferiori a 1 MHz.
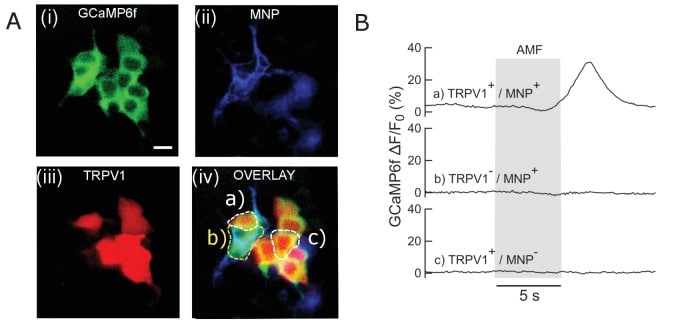
Figura 1-figure supplement 2.Esperimenti di controllo in cellule HEK293T.(A) Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto varie condizioni di controllo e sperimentali. Cellule co-trasferiti con(i) GCaMP6f solo; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.(B) Cambiamento del segnale GCaMP6f registrato dalla cultura (scattato in B). Solo a) Le celle TRPV1+/MNP+ mostrano l’afflusso di calcio con applicazione AMF (barra grigia; 22,4 kA/m, 412,5 kHz). Condizioni b) TRPV1- /MNP+;c) TRPV1+/MNP- non ha mostrato alcun cambiamento nella linea di base GCaMP6f intensità di fluorescenza. Questo dimostra che TRPV1+/MNP+ è la condizione necessaria e sufficiente per evocare l’afflusso di calcio con AMF.
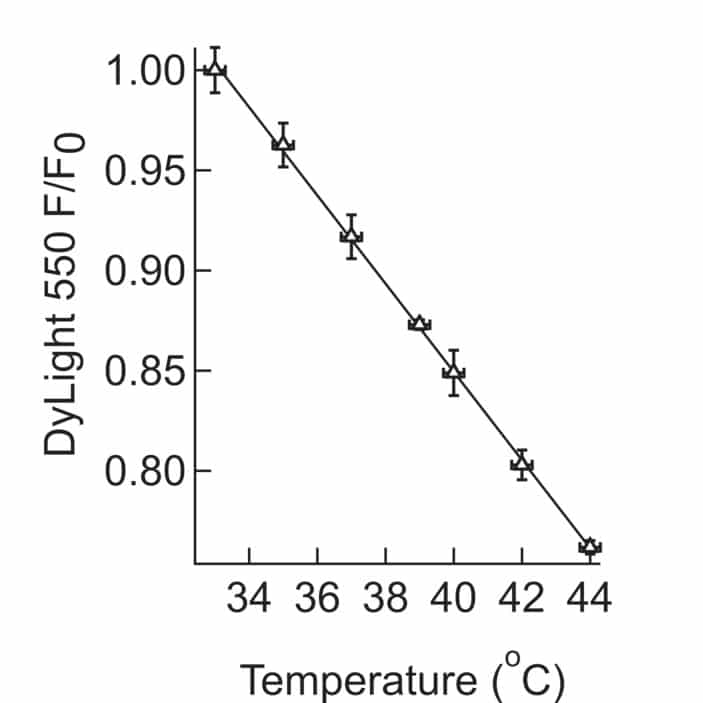
Figura 1-figure supplemento 3.3. Calibrazione per le misure di temperatura in situ.4. Calibrazione della dipendenza della temperatura dell’intensità di fluorescenza di DyLight 550. Una sospensione di MNP rivestita con NeutrAvidin – DyLight 550 è stata lentamente riscaldata a 44°C, mentre si registrava l’intensità della fluorescenza. Ad ogni punto di temperatura, sono state effettuate misurazioni multiple, che sono state poi mediate e il s.e.m. calcolato.

Figura 1-figure supplemento 4.Imaging set-up compatibile con il riscaldamento AMF.Schema dell’impostazione dell’autofocus, compensando eventuali aberrazioni ottiche e z-shift causate dal riscaldamento a correnti parassite dell’obiettivo. L’obiettivo del microscopio (OBJ) è stato montato su un adattatore, controllato dal sistema di posizionamento piezoelettrico z (PZT). Il cristallo piezoelettrico era alimentato (-30V – 130V) da un’unità di alimentazione (PU) controllata dal sistema di feedback (FB). Il sistema di feedback ha regolato la potenza piezoelettrica in accordo con il segnale trasduttore dell’unità laser (LAS), che ha monitorato la posizione relativa del coprioggetti in vetro rispetto all’obiettivo. Micrografo a colori falsi che mostra un gruppo di cellule HEK293T che mostra nello stesso piatto vari controlli e condizioni sperimentali. Le cellule co-trasferiti con(i) GCaMP6f solo GCaMP6f; (ii) GCaMP6f + AP CFP-TM; (iii) GCaMP6f + TRPV1; (iv) GCaMP6f + TRPV1 + TRPV1 +AP CFP-TM sono stati coltivati nello stesso piatto. Il campo visivo contiene cellule con tutte e quattro le condizioni di trasfezione. MNPs solo legati alla membrana (tramite anticorpi biotinilati) delle cellule AP-CFP-TM (condizioni, ii e iv). Così, potremmo ottenere tutte le condizioni, ad esempio(a) TRPV1+ /MNP+;(b) TRPV1- /MNP+;(c) TRPV1+/MNP- nello stesso campo visivo. Le celle rappresentative sono contrassegnate nella micrografia. In alto a sinistra sono riportate le micrografie a fluorescenza scattate attraverso il canale delle PFL. Tutte le celle che esprimono GCaMP6f sono visibili qui. In alto a destra mostra l’espressione TRPV1 attraverso la fluorescenza dei marcatori DsRed, nello stesso campo visivo. La fluorescenza MNP è mostrata attraverso il canale Alexa 647 (in basso a sinistra). La sovrapposizione di tutti e tre i canali è mostrata in basso a destra.
Sviluppo e sintesi di un trasduttore magnetotermico ottimale
Un efficace trasduttore magnetotermico deve convertire l’energia del campo magnetico alternato in calore in modo efficiente, essere targetable a cellule specifiche e sufficientemente piccolo da potersi diffondere facilmente tra i neuroni nel cervello (<30 nm) (Thornee Nicholson, 2006). MNP con nucleo accoppiato a scambio che combinano materiali magnetici morbidi e duri (ossido di cobalto e ossido di manganese) in una geometria del nucleo del guscio, permettono l’ottimizzazione indipendente delle dimensioni e delle proprietà magnetiche del MNP (Leeet al., 2011; Zhang et al., 2015b). Così, questi MNP possono essere sintonizzati per riscaldare in modo efficiente alle frequenze del campo magnetico, noto per penetrare in modo sicuro nei tessuti (<1 MHz) (Young et al., 1980), mantenendo un diametro inferiore a 30 nm.
Abbiamo sintetizzato MNPs con un nucleo di Co-ferrite di 8,0 ± 1,0 nm circondato da un guscio di Mn-ferrite di 2,25 nm. Per conferire stabilità colloidale in buffer fisiologici, questi MNPs sono stati poi incapsulato nel polimero PMA (dodecil-grafted-poly-(isobutilene-alt-maleic-anidride)(Lin et al., 2008). Il rivestimento PMA aggiunto 5,4 ± 1,4 nm al diametro MNP (Figura 1D). Abbiamo analizzato attentamente le proprietà sperimentali magnetiche e di riscaldamento di questi MNP e abbiamo trovato i risultati di essere ben descritto dalla teoria dei NPs superparamagnetici(Zhang et al., 2015b). L’efficienza di particolari MNPs nella conversione di potenza AMF in calore è misurata e quantificata come perdita specifica di potenza (SLP) in W / g. Gli MNP utilizzati in questo studio hanno una SLP di 733,3 ± 2,8 W/g a 37,0 kA/m e 412,5 kHz, vicino al massimo teorico per particelle di queste dimensioni (Zhang et al., 2015a).
Per indirizzare gli MNP specificamente ai neuroni, li abbiamo funzionalizzati con NeutrAvidin che poi si lega agli anticorpi biotinilati. Abbiamo usato o anticorpi contro i marcatori di superficie neuronali endogeni, come anti-CD56 (Thy-1), anti-CD90 (NCAM) o anti-A2B5, o contro un tag proteico fluorescente. Il più tardi ha permesso il targeting genetico di cellule specifiche, esprimendo transitoriamente una proteina di superficie con una GFP extracellulare o mCherry(Figura 1-figure supplemento 2A e B).
L’aumento di temperatura locale in prossimità delle nanoparticelle è stato misurato con variazioni di intensità di fluorescenza di un fluoroforo Dylight 550 integrato nel rivestimento di NeutrAvidin. Le intensità di fluorescenza dei fluorofori molecolari sono sufficientemente dipendenti dalla temperatura per fornire un termometro a scala molecolare(Huang et al., 2010). Abbiamo scoperto che l’intensità di fluorescenza di DyLight 550 è diminuita del 2,2% per ogni aumento di temperatura di grado(Figura 1-figure supplement 3).
Le nanoparticelle legate alla membrana hanno prodotto un riscaldamento efficiente e ben localizzato
Per aprire un numero sufficiente di canali TPRV1 per influenzare la cottura neuronale, la temperatura della superficie cellulare deve aumentare solo di pochi gradi al di sopra della temperatura fisiologica(Huang et al., 2010; Chen et al., 2015). In primo luogo, abbiamo determinato l’efficacia di AMF-driven riscaldamento guidato di MNPs in sospensione, alias ferrofluido, e poi separatamente di MNPs a membrana, utilizzando identiche condizioni sperimentali e AMF(Figura 2). La temperatura del bagno è stata misurata in continuo utilizzando un termometro a fibre ottiche immerso(Figura 2A), mentre la temperatura della membrana è stata misurata utilizzando l’intensità di fluorescenza di DyLight 550 integrato nel rivestimento NeutrAvidin della membrana legata MNPs(Figura 2B). L’AMF (22,4 kA/m a 412,5 kHz) è stato generato in una bobina costruita su misura, raffreddata ad acqua, che circonda il piatto campione, che è stato montato su un microscopio invertito.
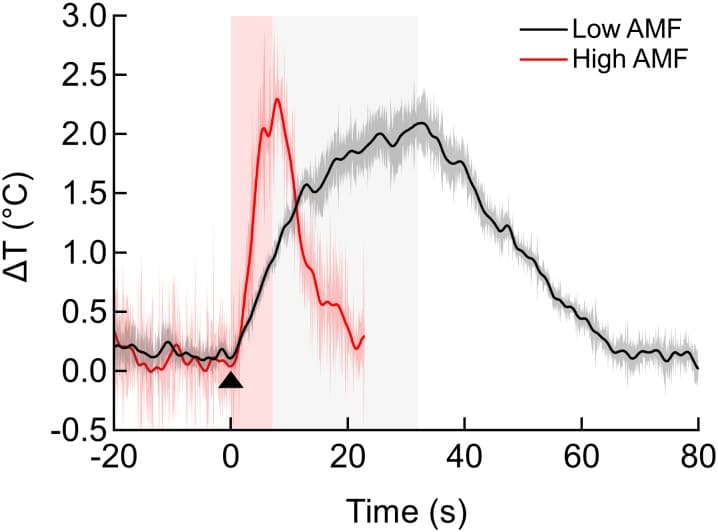
Figura 2-figure supplemento 1.Figura 2—figura supplemento 1. MNP legati a membrana riscaldano la membrana localmente senza riscaldamento del bagno, si raffreddano rapidamente per spegnere il segnale, e può riscaldare in modo più efficiente di MNP suspensions.Effetto della forza AMF sul riscaldamento locale.(A) Illustrazione che mostra la sospensione MNP nel bagno sopra le cellule. Durante l’applicazione AMF il MNPs riscaldato, aumentando la temperatura dell’intero volume del bagno, come misurato dal termometro a fibra ottica. L’intera colonna di sinistra di questa figura si concentra sul riscaldamento di una sospensione MNP, mentre la colonna di destra lo confronta con il riscaldamento degli stessi MNP quando la membrana è legata. Non in scala.(B) Illustrazione che mostra i MNP legati tramite anticorpi alla membrana cellulare. MNPs formano un foglio bidimensionale lungo il contorno della membrana cellulare. AMF riscaldamento nanoparticelle è limitato solo nelle immediate vicinanze della membrana cellulare. DyLight fluorofori sono stati attaccati al MNPs (MNPs arancione) per misurare le variazioni di temperatura locale in prossimità della membrana legata MNPs tramite microscopia a fluorescenza. La temperatura del bagno è stata monitorata utilizzando il termometro a fibra ottica. Non in scala.(C) Aumento della temperatura e successivo raffreddamento durante un 7 s AMF (22,4 kA / m a 412,5 kHz) applicazione in una sospensione MNP (10 mg / ml) sopra le cellule (blu).(D) Aumento della temperatura e successivo raffreddamento durante un 7 s AMF (22,4 kA/m a 412,5 kHz) applicazione su MNP legati alla cella-membrana (solido arancione, registrato tramite fluorescenza). La registrazione simultanea della temperatura del bagno ((nessuna perfusione, linea tratteggiata arancione) ha confermato che il riscaldamento MNP rimane confinato vicino alla membrana cellulare. Questo è diverso dal riscaldamento in sospensione dei MNP, dove l’intero bagno si riscalda in modo uniforme. Un’altra caratteristica contrastante del riscaldamento MNP a membrana visto qui è il raffreddamento rapido.(E) Aumento della temperatura nelle sospensioni di CoFe2O4 – MnFe2O4 MNPs a varie concentrazioni tracciate rispetto al tempo. I numeri a destra indicano la concentrazione MNP in mg / ml (AMF in tutti i casi 22,4 kA / m a 412,5 kHz).(F) I tassi di riscaldamento dei MNP legati dipendono dalla densità di area sulla membrana. Le temperature registrate in vari punti temporali sono lineari (linee tratteggiate). I marcatori blu indicano i dati raccolti dai neuroni, utilizzando biotinilati anti-A2B5 per il legame delle particelle. I marcatori rossi indicano i dati raccolti da cellule HEK293T con MNP attaccati a proteine superficiali biotinilate enzimaticamente. Le barre di errore incorporano errori di misurazione ed errori associati alla calibrazione della temperatura dalla misurazione della fluorescenza. (vedi anche Figura 1C).(G) Tasso di aumento della temperatura tracciata in funzione della densità di MNP in sospensione. Le barre di errore indicano un errore nella stima della concentrazione. Gli errori Y sono più piccoli della dimensione del marcatore. La linea tratteggiata mostra l’adattamento lineare.(H) Aumento della temperatura intorno ai MNP legati alle membrane cellulari tracciate in funzione della densità media della distribuzione dei MNP. Le barre di errore X indicano l’errore nella stima della densità MNP e gli errori Y si ottengono come indicato in(F).(I) Fogli impilati di nanoparticelle isotropiche distribuite. La barra di scala è lunga 100 nm. La densità delle nanoparticelle mostrata, corrisponde a quella richiesta per l’aumento di 0,5 °C/s della temperatura di sospensione.(J) Fogli individuali da(I). Stessa scala. La densità è sufficiente a riscaldare la membrana di 0,5 °C/s.Aumento della temperatura locale su cellule HEK decorato con MNPs per due diverse intensità di campo AMF e durate: Nero= AMF basso (12 kA/m, 412 kHz), durata 30 s; Rosso = AMF alto (30 kA/m, 412 kHz), durata 5 s; (sem mostrato come ombreggiatura, n = 3). Si noti la natura asintotica dell’evoluzione della temperatura nel caso degli AMF bassi: man mano che il tasso di dissipazione del calore al bagno si avvicina a quello di generazione di calore degli MNP, il tasso di aumento della temperatura diminuisce. Tuttavia, in entrambi i casi, la membrana viene riscaldata di oltre 2° C.
Nel campione di sospensione MNP sospensione, la temperatura dell’intero bagno (insieme con le cellule) è aumentato di due gradi(Figura 2C). Dopo un riscaldamento AMF sette secondi, la sospensione MNP ha richiesto più di 1 minuto per raffreddare alla temperatura iniziale. Al contrario, quando i MNP sono stati legati alla membrana cellulare, solo la membrana, e non il bagno, è stato riscaldato di diversi gradi(Figura 2D). Dopo aver rimosso l’AMF, la temperatura della membrana è tornata al valore iniziale in pochi secondi. Quindi, utilizzando MNPs legati alla membrana fornisce una precisione temporale di pochi secondi per terminare la neurostimolazione magnetotermica.
I tassi di aumento della temperatura dipendono dalla concentrazione di MNPs. Per varie concentrazioni di volume di MNPs abbiamo misurato tassi da 0,1 a 0,5°C/s (Figura 2E). Per i MNP a membrana, i tassi sono stati 0,1 a 1,0 ° C / s, a seconda della densità di area di MNP (Figura 2F). Tracciare la velocità di riscaldamento in funzione della concentrazione di MNP crolla queste misure. Per il riscaldamento in sospensione, la velocità di riscaldamento dipende linearmente dalla concentrazione di MNP ed è adatta a 5,8 × 10-4 ± 1,9×10-6°C.µm3/s (Figura 2G). Quindi, la potenza di riscaldamento per MNP è di 2,55 ± 0,94 fW/particella, coerente con la previsione delle misurazioni magnetiche, 3,34 fW/particella (Zhang et al.,2015a). Nel caso della membrana, il grafico della velocità di riscaldamento rispetto alla densità di area MNP è adatto a 1,1 × 10-3 ± 6,7×10-5 C.µm2/s(Figura 2H). Confrontando l’adattamento ottenuto per il riscaldamento della membrana con il riscaldamento della sospensione, si nota che il volume di acqua riscaldata nel caso della membrana corrisponde ad una lastra di 0,5-µm di spessore della sospensione MNP. In realtà, la temperatura lontano dalla membrana scende inversamente con la distanza dalla membrana(Baffou et al., 2013). Figura 2I e J visualizzare la spaziatura MNP per i casi di membrana e sospensione, assumendo una distribuzione omogenea MNP.
Per determinare un limite inferiore per l’intensità di campo di AMF richiesto per il riscaldamento locale della membrana, abbiamo confrontato l’aumento della temperatura della membrana in cellule HEK decorate con MNP a due diverse intensità di campo, 12 kA/m e 30 kA/m (entrambi a 412 kHz). Un’applicazione di 30 s dell’AMF più debole ha riscaldato la membrana tanto quanto un’applicazione di 5 s dell’AMF più forte(Figura 2-figure supplement 1). Tuttavia, a 12 kA/m AMF, una volta che la temperatura locale è aumentata di oltre 2°C sopra l’ambiente, il raffreddamento all’ambiente diventa paragonabile al riscaldamento. Quindi, anche durante le applicazioni AMF più lunghe, l’aumento massimo della temperatura locale rimarrà in un intervallo di sicurezza per le celle.
Nel complesso, abbiamo trovato che per le MNP a membrana, la durata di AMF per raggiungere l’aumento di due gradi necessario per attivare i canali TPRV1 varia tra 2,1 s e 4,2 s(Figura 2F). La quantità di MNP necessaria per velocità di riscaldamento simili nel riscaldamento in sospensione è di pochi ordini più alta, 20-30 mg/ml (Figura 2E – H).

Figura 2-figure supplement 1.Figura 2— figura 1. MNP legati alla membrana riscaldano la membrana localmente senza riscaldamento del bagno, si raffreddano rapidamente per spegnere il segnale, e possono riscaldare in modo più efficiente rispetto alle sospensioni MNP.Effetto della forza AMF sul riscaldamento locale.(A) Illustrazione che mostra la sospensione MNP nel bagno sopra le cellule. Durante l’applicazione AMF il MNPs riscaldato, aumentando la temperatura dell’intero volume del bagno, come misurato dal termometro a fibra ottica. L’intera colonna di sinistra di questa figura si concentra sul riscaldamento di una sospensione MNP, mentre la colonna di destra lo confronta con il riscaldamento degli stessi MNP quando la membrana è legata. Non in scala.(B) Illustrazione che mostra i MNP legati tramite anticorpi alla membrana cellulare. MNPs formano un foglio bidimensionale lungo il contorno della membrana cellulare. AMF riscaldamento nanoparticelle è limitato solo nelle immediate vicinanze della membrana cellulare. DyLight fluorofori sono stati attaccati al MNPs (MNPs arancione) per misurare le variazioni di temperatura locale in prossimità della membrana legata MNPs tramite microscopia a fluorescenza. La temperatura del bagno è stata monitorata utilizzando il termometro a fibra ottica. Non in scala.(C) Aumento della temperatura e successivo raffreddamento durante un 7 s AMF (22,4 kA / m a 412,5 kHz) applicazione in una sospensione MNP (10 mg / ml) sopra le cellule (blu).(D) Aumento della temperatura e successivo raffreddamento durante un 7 s AMF (22,4 kA/m a 412,5 kHz) applicazione su MNP legati alla cella-membrana (solido arancione, registrato tramite fluorescenza). La registrazione simultanea della temperatura del bagno ((nessuna perfusione, linea tratteggiata arancione) ha confermato che il riscaldamento MNP rimane confinato vicino alla membrana cellulare. Questo è diverso dal riscaldamento in sospensione dei MNP, dove l’intero bagno si riscalda in modo uniforme. Un’altra caratteristica contrastante del riscaldamento MNP a membrana visto qui è il raffreddamento rapido.(E) Aumento della temperatura nelle sospensioni di CoFe2O4 – MnFe2O4 MNPs a varie concentrazioni tracciate rispetto al tempo. I numeri a destra indicano la concentrazione MNP in mg / ml (AMF in tutti i casi 22,4 kA / m a 412,5 kHz).(F) I tassi di riscaldamento dei MNP legati dipendono dalla densità di area sulla membrana. Le temperature registrate in vari punti temporali sono lineari (linee tratteggiate). I marcatori blu indicano i dati raccolti dai neuroni, utilizzando biotinilati anti-A2B5 per il legame delle particelle. I marcatori rossi indicano i dati raccolti da cellule HEK293T con MNP attaccati a proteine superficiali biotinilate enzimaticamente. Le barre di errore incorporano errori di misurazione ed errori associati alla calibrazione della temperatura dalla misurazione della fluorescenza. (vedi anche Figura 1C).(G) Tasso di aumento della temperatura tracciata in funzione della densità di MNP in sospensione. Le barre di errore indicano un errore nella stima della concentrazione. Gli errori Y sono più piccoli della dimensione del marcatore. La linea tratteggiata mostra l’adattamento lineare.(H) Aumento della temperatura intorno ai MNP legati alle membrane cellulari tracciate in funzione della densità media della distribuzione dei MNP. Le barre di errore X indicano l’errore nella stima della densità MNP e gli errori Y si ottengono come indicato in(F).(I) Fogli impilati di nanoparticelle isotropiche distribuite. La barra di scala è lunga 100 nm. La densità delle nanoparticelle mostrata, corrisponde a quella richiesta per l’aumento di 0,5 °C/s della temperatura di sospensione.(J) Fogli individuali da(I). Stessa scala. La densità è sufficiente a riscaldare la membrana di 0,5 °C/s.Aumento della temperatura locale su cellule HEK decorato con MNPs per due diverse intensità di campo AMF e durate: Nero= AMF basso (12 kA/m, 412 kHz), durata 30 s; Rosso = AMF alto (30 kA/m, 412 kHz), durata 5 s; (sem mostrato come ombreggiatura, n = 3). Si noti la natura asintotica dell’evoluzione della temperatura nel caso degli AMF bassi: man mano che il tasso di dissipazione del calore al bagno si avvicina a quello di generazione di calore degli MNP, il tasso di aumento della temperatura diminuisce. Tuttavia, in entrambi i casi, la membrana viene riscaldata di oltre 2° C.

Figura 2-figure supplemento 1.Effetto della resistenza AMF sul riscaldamento locale.Aumento della temperatura locale su cellule HEK decorato con MNPs per due diverse intensità di campo AMF e durate: Nero= AMF basso (12 kA/m, 412 kHz), durata 30 s; Rosso = AMF alto (30 kA/m, 412 kHz), durata 5 s; (sem mostrato come ombreggiatura, n = 3). Si noti la natura asintotica dell’evoluzione della temperatura nel caso degli AMF bassi: man mano che il tasso di dissipazione del calore al bagno si avvicina a quello di generazione di calore degli MNP, il tasso di aumento della temperatura diminuisce. Tuttavia, in entrambi i casi, la membrana viene riscaldata di oltre 2° C.
Attivazione termica dei neuroni ippocampali TPRV1 + ippocampali
Per misurare la risposta dei neuroni ippocampali TRPV1+ alla stimolazione termica, abbiamo usato l’indicatore di calcio veloce geneticamente codificato GCaMP6f(Chen et al., 2015; Grewe et al., 2010), e abbiamo deconvolto i transitori Ca2+ per scoprire il treno di picco sottostante(Figura 3-figure supplement 1). In primo luogo, abbiamo indagato il tasso di cottura spontanea di 10 giorni vecchi neuroni ippocampali TRPV1 + ippocampali attraverso una gamma di temperature di bagno fisiologicamente rilevanti. Da 32 ° C a 36 ° C, il tasso di picco di calcio era indipendente dalla temperatura. Come temperatura del bagno è stato aumentato da 37 ˚ C a 39 ˚ C, l’attività spontanea dei neuroni TRPV1 + neuroni è aumentata da 1,5 ± 1,2 potenziali d’azione (APs) per 5 s a 13 ± 3 APs nello stesso periodo. A 39°C, solo il 15-20% circa dei canali TRPV1 del ratto si aprono (Grandlet al., 2010), ma l’afflusso di calcio che ne risulta è sufficiente a innescare l’attività neuronale perché il TRPV1 ha una conduttanza a canale singolo circa 1.000 volte superiore a quella del ChR2 (Lórenz-Fonfríae Heberle, 2014; Studer e McNaughton, 2010). Nei neuroni di controllo, senza TRPV1, abbiamo osservato una leggera diminuzione del tasso di picco, a 1 ± 1 APs per 5 s (Figura 3A). L’analisi dettagliata dei singoli transitori di calcio in assenza di TRPV1, e con TRPV1 a temperature di attivazione del canale ha mostrato, che, all’interno della risoluzione di GCaMP6f basato su calcio imaging, l’attività TRPV1 non cambia la forma del transitorio di calcio e l’AP sottostante(Figura 3-figure supplement 1). Pertanto, esprimendo di TRPV1 in neuroni ippocampali rende il loro tasso di cottura altamente sensibile al calore senza interrompere la funzione naturale.
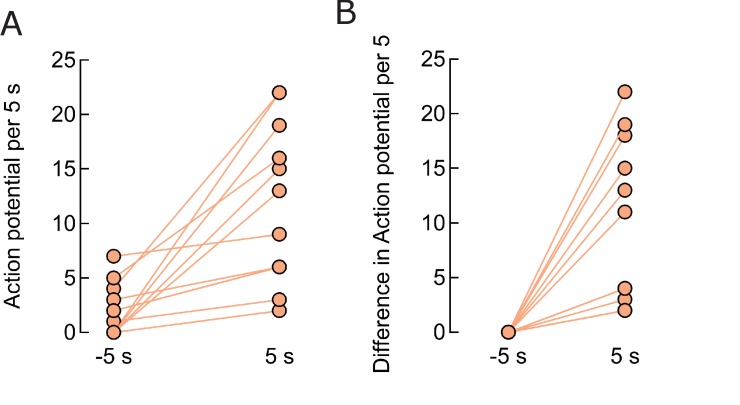
Figura 3-figure supplemento 2.Figura 3—figura supplemento 2. Entro pochi secondi di applicazione AMF, membrane-targeted MNP stimolare magnetotermicamente TPRV1 + neuroni in culture.procedure e controlli per dedurre treno picco da GCaMP signal.Firing aumento della velocità di cottura nei singoli neuroni.(A) Velocità di azione Potenziale di sparo in funzione della temperatura del bagno, registrata dai transitori GCaMP6f osservati in TRPV1 che esprimono i neuroni ippocampali (rosso) e i neuroni wild-type (controllo, nero) quando perfuso con tampone preriscaldato. I transitori Ca2+ sono modellati da un treno di picco (vedi Figura 3-figure supplement 1). I punti dei dati sono dotati dell’equazione di Hill, che dà un punto medio di 37,7 ± 0,06°C, che corrisponde alla metà della velocità massima di cottura (curva tratteggiata).(B) Variazioni di intensità di fluorescenza GCaMP6f (verde, Ca2+) in diversi TPRV1 +neuroni decorati con MNP (campo 5 s, 22,4 kA/m a 412,5 kHz, in grigio). Gli eventi di picco calcolati (nero) sono indicati sotto ogni traccia di Ca2+ (vedi Figura 3-figure supplement 2).(C) Variazione della temperatura della superficie della cella misurata dalla fluorescenza DyLight550 (media di tre esperimenti).(D) GCaMP6f segnale registrato da nanoparticelle rivestite TRPV1 +neuroni binned in intervalli di 5 s, indicato da barra di errore x (media ±s.e.m, 13 neuroni). La frequenza di picco è aumentata da 1,8 ± 0,6 per 5 s, prima dell’AMF (campo 0 a 5 s), a 4,5 ± 1,2 per 5 s, durante l’AMF (n = 13, **p=0.0028, T-test non accoppiato), e 12,1 ± 2,0 per 5 s immediatamente dopo l’AMF (n = 13, ***p=0,0002, T-test non accoppiato, intervalli di confidenza del 95% [1.5,2.23] e [10.8,13.3]) (Supplemento 2).(E) Trama della latenza di attivazione, intervallo di tempo tra l’inizio della stimolazione del campo e il primo AP rilevato rispetto alla durata del campo. Tutti i punti di dati che si trovano sullo sfondo grigio indicano che il primo picco è stato rilevato mentre il campo era ancora attivo (87% degli eventi, n = 79, sei culture). Le barre di errore indicano l’incertezza della misura temporale.(F) Percentuale di neuroni che sparano il loro primo AP dopo l’inizio del campo nell’intervallo di tempo indicato (sottoinsieme di 41 cellule da A che sono state stimolate per 5 s). L’istogramma è stato montato (senza ponderazione) con una curva di Poisson (λ = 2,18 ± 0,17 s). Le barre di errore si ottengono come differenza di popolazione tra i bidoni spostati a sinistra e a destra, in seguito all’incertezza temporale come indicato in(E).(G) Percentuale di neuroni attivi in ogni intervallo di tempo (campo magnetico alternato applicato 0-5 s). Barre di errore: x indicano un intervallo di tempo di 5 s, y come indicato in(F). Un’applicazione AMF di cinque secondi ha aumentato la popolazione attiva da 53,7 ± 1,6% a 80,5 ± 5,1% dei neuroni, *p = 0,032, non accoppiato T-test, (n = 41, come in (F)).(A) Micrografie a fluorescenza di un GCaMP6f che esprime un neurone. (Da sinistra a destra) immagine grezza, come registrata; sfondo sottratto con sfera rotante di 50 pixel sullo stesso ROI; immagine dopo aver ruotato i valori di grigio di tutti i pixel sotto un particolare valore di intensità di soglia su Not a Number (NaN). Questa operazione rimuove il rumore ed estrae i pixel corrispondenti a soma per ogni fotogramma di un video.(B) Media e SEM dei picchi di calcio corrispondenti ad eventi potenziali di singola azione (vedi metodi supplementari), registrati da 5 soma di neuroni ippocampali di ratto WT che esprimono GCaMP6f. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel). Il tempo medio di salita è di 232,2 ms e il t1/2 di decadimento è di 335,5 ms. I picchi sono il risultato di una cottura spontanea e sono stati registrati in un intervallo di temperatura di 32-40°C. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e di discesa.(C) Media e sem dei picchi di calcio corrispondenti ad eventi potenziali di singola azione, registrati da 6 somas di neuroni ippocampali di ratto che esprimono i canali GCaMP6f e TRPV1. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel) (con un punteggio superiore a 32-39°C). Il tempo medio di salita è di 220,0 ms e il t1/2 di decadimento è di 320,2 ms, non mostrando alcuna deviazione significativa dai picchi risultanti dalla cottura spontanea. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e discesa.(D) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto WT. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto alla linea di base del segnale.(E) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto che esprime i canali TRPV1 e decorato con nanoparticelle sulla membrana. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. Durante l’applicazione AMF (barra grigia) si osserva un aumento della velocità di cottura (barra grigia) (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto al bacino del segnale.(A) Confronto tra la cottura 5 s prima, 1,8±0,6 APs, e dopo l’inizio del campo, 12,1±2,0 APs (p=0,0002, n = 13). (B) Differenza nella velocità di cottura durante il periodo di 5 s prima e lo stesso periodo dopo l’applicazione sul campo, media 10,2±2,1 APs (p=0,0004, n = 13).

Figura 3-figure supplement 2.Figura 3. Entro pochi secondi di applicazione AMF, membrane-target MNP stimolare magnetotermicamente TPRV1 + neuroni in cultura.procedura e controlli per dedurre treno picco da GCaMP signal.Firing miglioramento della velocità di cottura nei singoli neuroni.(A) Velocità di azione Potenziale di sparo in funzione della temperatura del bagno, registrata dai transitori GCaMP6f osservati in TRPV1 che esprimono i neuroni ippocampali (rosso) e i neuroni wild-type (controllo, nero) quando perfuso con tampone preriscaldato. I transitori Ca2+ sono modellati da un treno di picco (vedi Figura 3-figure supplement 1). I punti dei dati sono dotati dell’equazione di Hill, che dà un punto medio di 37,7 ± 0,06°C, che corrisponde alla metà della velocità massima di cottura (curva tratteggiata).(B) Variazioni di intensità di fluorescenza GCaMP6f (verde, Ca2+) in diversi TPRV1 +neuroni decorati con MNP (campo 5 s, 22,4 kA/m a 412,5 kHz, in grigio). Gli eventi di picco calcolati (nero) sono indicati sotto ogni traccia di Ca2+ (vedi Figura 3-figure supplement 2).(C) Variazione della temperatura della superficie della cella misurata dalla fluorescenza DyLight550 (media di tre esperimenti).(D) GCaMP6f segnale registrato da nanoparticelle rivestite TRPV1 +neuroni binned in intervalli di 5 s, indicato da barra di errore x (media ±s.e.m, 13 neuroni). La frequenza di picco è aumentata da 1,8 ± 0,6 per 5 s, prima dell’AMF (campo 0 a 5 s), a 4,5 ± 1,2 per 5 s, durante l’AMF (n = 13, **p=0.0028, T-test non accoppiato), e 12,1 ± 2,0 per 5 s immediatamente dopo l’AMF (n = 13, ***p=0,0002, T-test non accoppiato, intervalli di confidenza del 95% [1.5,2.23] e [10.8,13.3]) (Supplemento 2).(E) Trama della latenza di attivazione, intervallo di tempo tra l’inizio della stimolazione del campo e il primo AP rilevato rispetto alla durata del campo. Tutti i punti di dati che si trovano sullo sfondo grigio indicano che il primo picco è stato rilevato mentre il campo era ancora attivo (87% degli eventi, n = 79, sei culture). Le barre di errore indicano l’incertezza della misura temporale.(F) Percentuale di neuroni che sparano il loro primo AP dopo l’inizio del campo nell’intervallo di tempo indicato (sottoinsieme di 41 cellule da A che sono state stimolate per 5 s). L’istogramma è stato montato (senza ponderazione) con una curva di Poisson (λ = 2,18 ± 0,17 s). Le barre di errore si ottengono come differenza di popolazione tra i bidoni spostati a sinistra e a destra, in seguito all’incertezza temporale come indicato in(E).(G) Percentuale di neuroni attivi in ogni intervallo di tempo (campo magnetico alternato applicato 0-5 s). Barre di errore: x indicano un intervallo di tempo di 5 s, y come indicato in(F). Un’applicazione AMF di cinque secondi ha aumentato la popolazione attiva da 53,7 ± 1,6% a 80,5 ± 5,1% dei neuroni, *p = 0,032, non accoppiato T-test, (n = 41, come in (F)).(A) Micrografie a fluorescenza di un GCaMP6f che esprime un neurone. (Da sinistra a destra) immagine grezza, come registrata; sfondo sottratto con sfera rotante di 50 pixel sullo stesso ROI; immagine dopo aver ruotato i valori di grigio di tutti i pixel sotto un particolare valore di intensità di soglia su Not a Number (NaN). Questa operazione rimuove il rumore ed estrae i pixel corrispondenti a soma per ogni fotogramma di un video.(B) Media e SEM dei picchi di calcio corrispondenti ad eventi potenziali di singola azione (vedi metodi supplementari), registrati da 5 soma di neuroni ippocampali di ratto WT che esprimono GCaMP6f. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel). Il tempo medio di salita è di 232,2 ms e il t1/2 di decadimento è di 335,5 ms. I picchi sono il risultato di una cottura spontanea e sono stati registrati in un intervallo di temperatura di 32-40°C. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e di discesa.(C) Media e sem dei picchi di calcio corrispondenti ad eventi potenziali di singola azione, registrati da 6 somas di neuroni ippocampali di ratto che esprimono i canali GCaMP6f e TRPV1. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel) (con un punteggio superiore a 32-39°C). Il tempo medio di salita è di 220,0 ms e il t1/2 di decadimento è di 320,2 ms, non mostrando alcuna deviazione significativa dai picchi risultanti dalla cottura spontanea. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e discesa.(D) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto WT. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto alla linea di base del segnale.(E) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto che esprime i canali TRPV1 e decorato con nanoparticelle sulla membrana. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. Durante l’applicazione AMF (barra grigia) si osserva un aumento della velocità di cottura (barra grigia) (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto al bacino del segnale.(A) Confronto tra la cottura 5 s prima, 1,8±0,6 APs, e dopo l’inizio del campo, 12,1±2,0 APs (p=0,0002, n = 13). (B) Differenza nella velocità di cottura durante il periodo di 5 s prima e lo stesso periodo dopo l’applicazione sul campo, media 10,2±2,1 APs (p=0,0004, n = 13).
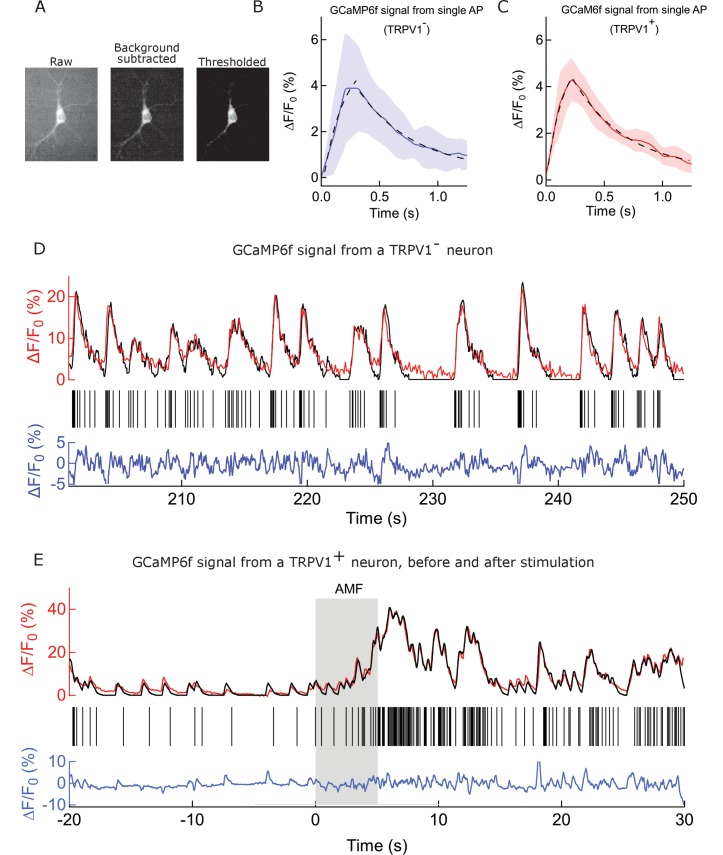
Figura 3-figure supplement 1.Procedura e controlli per dedurre il treno di picchi dal segnale GCaMP.(A) Micrografie a fluorescenza di un GCaMP6f che esprime un neurone. (Da sinistra a destra) immagine grezza, come registrata; sfondo sottratto con sfera rotante di 50 pixel sullo stesso ROI; immagine dopo aver ruotato i valori di grigio di tutti i pixel sotto un particolare valore di intensità di soglia a Not a Number (NaN). Questa operazione rimuove il rumore ed estrae i pixel corrispondenti a soma per ogni fotogramma di un video.(B) Media e SEM dei picchi di calcio corrispondenti ad eventi potenziali di singola azione (vedi metodi supplementari), registrati da 5 soma di neuroni ippocampali di ratto WT che esprimono GCaMP6f. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel). Il tempo medio di salita è di 232,2 ms e il t1/2 di decadimento è di 335,5 ms. I picchi sono il risultato di una cottura spontanea e sono stati registrati in un intervallo di temperatura di 32-40°C. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e di discesa.(C) Media e sem dei picchi di calcio corrispondenti ad eventi potenziali di singola azione, registrati da 6 somas di neuroni ippocampali di ratto che esprimono i canali GCaMP6f e TRPV1. I dati di ogni soma sono la media dei 3 più piccoli transienti di calcio (funzione del kernel) (con un punteggio superiore a 32-39°C). Il tempo medio di salita è di 220,0 ms e il t1/2 di decadimento è di 320,2 ms, non mostrando alcuna deviazione significativa dai picchi risultanti dalla cottura spontanea. La curva nera tratteggiata mostra un adattamento esponenziale corrispondente alle fasi di salita e discesa.(D) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto WT. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto alla linea di base del segnale.(E) Analisi del corso del tempo GCaMP6f variazione di intensità di fluorescenza GCaMP6f dal soma di un neurone ippocampale di ratto che esprime i canali TRPV1 e decorato con nanoparticelle sulla membrana. (In alto) Registrazione del corso del tempo del segnale GCaMP6f dallo stesso soma (rosso) dopo la correzione esponenziale della candeggina. Sovrapposto in nero è il segnale ricostruito ottenuto con la convoluzione della funzione del kernel con eventi potenziali di azione binaria. Durante l’applicazione AMF (barra grigia) si osserva un aumento della velocità di cottura (barra grigia) (centrale) Potenziali d’azione calcolati (bastoncini neri). (In basso) Il residuo tra la forma d’onda ricostruita e il segnale normalizzato è mostrato in blu. La scala indica la variazione percentuale rispetto al bacino del segnale.

Figura 3-figure supplement 2.Aumento della velocità di combustione nei singoli neuroni.(A) Confronto di cottura 5 s prima, 1,8±0,6 APs, e dopo l’inizio del campo, 12,1±2,0 APs (p = 0,0002, n = 13). (B) Differenza nella velocità di cottura durante il periodo di 5 s prima e lo stesso periodo dopo l’applicazione sul campo, media 10,2±2,1 APs (p = 0,0004, n = 13).
Il riscaldamento MNP localizzato a membrana stimola i neuroni dell’ippocampo in coltura
Per misurare la stimolazione evocata dal riscaldamento MNP, abbiamo trasfettato i neuroni ippocampali coltivati con TRPV1 e GCaMP6f, quindi abbiamo decorato la membrana plasmatica con MNP. La fluorescenza rossa dei MNPs etichettati DyLight550 è stata rilevata lungo tutta la membrana neuronale, indicando una buona etichettatura superficiale(Figura 1E).
Quando esposto ad un AMF (22,4 kA / m a 412,5 kHz, 5 s), MNP decorato TRPV1 + neuroni MNP ha mostrato un aumento di picco, misurata come transitori di calcio(Figure 1F e 3B). Il treno di picco di ogni neurone è stato derivato dai transitori di calcio registrati, convolgendo un treno di picco stimato con il segnale di calcio GCaMP6f registrato di un singolo potenziale d’azione; quindi calcolando il residuo tra la traccia di calcio misurata e quella calcolata; e regolando il treno di picco stimato per minimizzare il residuo (vedere Materiali e metodi e Figura 3-figure supplement 1) (Yaksi eFriedrich, 2006). Rispetto all’attività basale (1,8 ± 0,6 APs) durante 5 s prima dell’applicazione AMF, il picco è aumentato significativamente a 4,5 ± 1,2 APs durante l’AMF 5 s (p = 0.0028, non accoppiato T-test), e 12,1 ± 2,0 APs nel 5 s dopo che l’AMF è stato rimosso (p = 0,0002, non accoppiato T-test) (n = 13 cellule, tre culture) (Figura 3D, Figura 3-figuresupplemento 2) . Durante l’applicazione AMF, la temperatura della membrana dei neuroni TRPV1+ decorati con MNP è aumentata di 2°C, come misurato dalla fluorescenza DyLight550 (Figura 3C). La stimolazione è molto riproducibile con 87,5% delle cellule che rispondono alla seconda stimolazione, dopo 5 minuti dopo il primo.
Latenza e la consistenza della stimolazione magnetotermica
Abbiamo analizzato la consistenza dell’attivazione, l’aumento della velocità di cottura e del numero di cellule attive, così come la latenza di attivazione. La Figura 3E mostra la latenza di attivazione, il ritardo temporale tra l’inizio dell’applicazione sul campo e il primo evento di spiking, per tutte le stimolazioni registrate (79 neuroni, 6 colture, varie durate di AMF). L’87% dei neuroni aumenta durante i primi 5 s di applicazione del campo, e il 64% dei neuroni si attiva già entro 2 o 3 s dopo l’accensione del campo(Figura 3E). Un istogramma delle latenze di tutte le cellule esposte a 5 s di stimolazione del campo è stato dotato di una distribuzione di Poisson dando un valore di aspettativa di 2,18 ± 0,17 s (Figura 3F). Questi dati mostrano la più veloce stimolazione magnetotermica fino ad oggi(Chen et al., 2015; Huang et al., 2010). Successivamente, abbiamo determinato se la stimolazione magnetotermica è anche in grado di attivare i neuroni quiescenti, che non erano già vicino alla soglia di depolarizzazione. Abbiamo definito come attivi i neuroni con almeno un transitorio di calcio durante un periodo di 5-s. In condizioni basali, 53,7 ±1,6% dei neuroni erano attivi nelle culture. Cinque secondi AMF applicazione AMF aumentato la popolazione attiva a 80,5 ± 5,1% dei neuroni (Figura3G). Abbiamo dimostrato che 5 s di stimolazione magnetotermica non solo aumenta i tassi di cottura dei neuroni già attivi (Figura 3D), ma aumenta anche la percentuale di cellule attive in una popolazione (Figura 3G).
La stimolazione genetica magnetotermica della corteccia motoria ha evocato i topi a correre lungo la periferia dell’arena
Abbiamo poi verificato che la stimolazione genetica magnetotermica termica nel cervello potrebbe essere specifica e sufficiente per evocare un comportamento preciso in un animale sveglio e in movimento. Il nostro obiettivo era quello di evocare una risposta nei topi svegli e in movimento, che potesse essere facilmente e rapidamente rilevata. L’accensione e lo spegnimento ripetibili con latenze ragionevoli dimostrerebbero la causalità. In particolare, abbiamo scelto diverse risposte motorie che sono state precedentemente evocate con l’attivazione chemiogenetica o optogenetica.
Successo di successo di attivazione della corteccia motoria secondaria motore evocazione in esecuzione è stato segnalato utilizzando l’optogenetica(Gradinaru et al., 2007). Abbiamo cercato di riprodurre queste risposte, utilizzando la stimolazione magnetotermica dei neuroni della corteccia motoria(Figura 4-figure supplemento 1). Mentre una certa espressione di TRPV1 nel cervello del roditore è stato segnalato(Basbaum et al., 2009), la stimolazione genetica magnetotermica robusta richiede uniforme, sostenuta sovra-espressione di TRPV1 nei neuroni bersaglio. Abbiamo ottenuto la sovraespressione di TRPV1 nella corteccia motoria del topo consegnando il sierotipo 5 del virus adeno-associato (AAV5) come veicolo per il transgene TRPV1 sotto il promotore neuronale specifico della sinapsiina-1 hSyn (AAV5-hSyn-TRPV1) mediante iniezione stereotassica(Kügler et al., 2003). Tuttavia, AAV è troppo piccolo per confezionare un vettore, codificando TRPV1 e un marcatore proteico fluorescente. Quindi, per alcuni esperimenti, abbiamo anche creato un lentivirus che porta i geni per TRPV1 e una proteina fluorescente rossa con sequenza di targeting nucleare dietro un sito di ingresso ribosoma interno (EF1a-TRPV1-IRES-DSRed). Entrambi, AAV5 e lentivirus, hanno portato a una robusta espressione in vivo, permettendo la stimolazione di un comportamento specifico.
I neuroni della corteccia motoria sono stati sensibilizzati al calore, iniettando unilateralmente AAV5-hSyn-TRPV1(Carvalho-de-Souza et al., 2015; Lein et al., 2007). Due o quattro settimane dopo, 500-600 ng di MNP coniugati con anticorpi sono stati iniettati nella stessa posizione. (AP = 1, ML = 0.5, DV = 0.5 (tutti in mm)). Utilizzando immuno-istologia, abbiamo confermato l’espressione del TRPV1 indotta da virus e il legame di MNPs ai neuroni nell’area della corteccia motoria bersaglio(Figura 4-figure supplement 2).
Tutti i topi 6 in un totale di 14 prove ha iniziato a correre lungo la periferia dell’arena di osservazione (AMF era 7,5 kA / m e 570 kHz; Figura 4A, B, Figura 4-figure supplemento 3). Per illustrare il contrasto tra i comportamenti indotti e quelli a riposo, la traccia della testa (colore contrassegnato per il riconoscimento automatico degli oggetti) di un mouse rappresentativo è mostrato in Figura 4C. La corsa lungo la periferia dell’arena circolare, registrata durante l’applicazione sul campo (mostrato in rosso)(Video 1) è in netto contrasto con le tracce di esplorazione / riposo, osservate in assenza di AMF. I dati di controllo acquisiti dallo stesso mouse prima dell’iniezione MNP, e di nuovo tra una prova e l’altra hanno mostrato una locomozione più lenta orientata in modo casuale, non limitata alla periferia(Video 2). Poco dopo l’inizio dell’applicazione AMF, il mouse ha iniziato a funzionare, che ha rallentato rapidamente dopo che l’AMF è stato rimosso(Figura 4D). La velocità lineare del mouse è aumentata da 5,3 ± 2,75 mm/s a 83,8 ± 3,75 mm/s (Figura 4E; un mouse, quattroprove, p=5,9-10-6, 95% C.I. [0,9, 9,7] e [77,8, 89,8] mm/s). La velocità angolare è aumentata da 0,21 ± 0,19 giri/min a 3,27 ± 0,30 giri/min (Figura 4F; p=0,0003). In tutte le 14 prove in 6 topi, la velocità angolare è stata significativamente più veloce durante le applicazioni AMF, 2,81 ± 0,20 giri/min, rispetto a 0,34 ± 0,08 giri/min durante i periodi di riposo tra i campi (Figura 4G; p=5,2-10-9; 95% C.I. [0,29, 0,39] e [2,69, 2,93] giri/min). La figura 4-figure supplement 1 mostra sette risposte individuali alla simulazione (quattro topi). In tutte le prove abbiamo osservato una forte risposta in corsa, ma alcuni topi hanno cambiato direzione occasionalmente. Quindi, tracciamo la distanza angolare percorsa, oltre allo spostamento angolare.

Video 1.Risposta ambulatoriale generata dalla stimolazione della corteccia motoria secondaria.La stimolazione unilaterale nella corteccia motoria evoca la corsa con un certo ritardo. La risposta ambulatoriale persiste durante i 60 s di applicazione in campo lungo e la stimolazione può essere ripetuta in pochi minuti. Il video mostra un esperimento continuo con quattro campi, che portano ciascuno ad una lunga corsa, tipicamente 3-4 volte intorno all’arena. La velocità del video è 3x accelerata, l’iniezione MNP e l’applicazione del campo contrassegnato all’interno dei fotogrammi video.

Video 2.Controlla il video dello stesso mouse senza alcuna applicazione di campo.
Figura 4-figure supplement 5.Figura 4—supplemento figura 5. La neurostimolazione magnetotermica nella corteccia motoria provoca scurry veloce intorno all’arena. (In alto) Spostamento angolare (negativo CW, positivo CCW) di topi stimolati magnetotermicamente nella corteccia motoria (7 prove, 3 topi).Un esempio per un topo iniettato con virus e MNPs, ma senza l’anticorpo anti-A2B5.Repeatability di stimolazione nella corteccia motoria.(A) Impostazione sperimentale per la stimolazione magnetotermica in vivo del comportamento motorio nei topi svegli. Una bobina a due giri raffreddata ad acqua intorno all’arena ha generato l’AMF. L’AMF nella bobina è stato alimentato dallo stesso sistema come per gli esperimenti in vitro. Una telecamera a soffitto è stata usata per registrare il comportamento del mouse nell’arena.(B) Fotografia del topo nell’arena di osservazione; bobina raffreddata ad acqua a due giri visibile come anello nero.(C) Traiettoria rappresentativo registrato da un mouse stimolato nella corteccia motoria prima (nero), durante (rosso), e dopo (blu) applicazione sul campo (ogni 1 min di lunghezza). Il bordo circolare nero denota il confine effettivo della camera. (Vedi anche la Figura 4-figure supplemento 1 per le posizioni di iniezione; e Video 1 e 2).(D) (in alto) Posizione della testa del mouse, (x verde; y arancione) misurata prendendo il centro dell’arena per essere l’origine. (Middle) La traccia nera mostra le velocità lineari del mouse. La velocità aumenta notevolmente durante tutte le applicazioni AMF (barre grigie). Dopo ogni applicazione AMF, il mouse rallenta il movimento esplorativo regolare (in basso). Il totale delle svolte effettuate dal mouse è stato tracciato in funzione del tempo. I cambiamenti angolari in senso antiorario sono stati conteggiati come un cambiamento positivo degli angoli. Durante l’applicazione AMF, il mouse ha girato unilateralmente in modo significativamente maggiore rispetto alle applicazioni AMF.(E) Confronto della velocità lineare di questo mouse TRPV1+ / MNP+, iniettato nella corteccia motoria, con e senza AMF. La velocità lineare media è aumentata di 16 volte dopo l’applicazione AMF, da 5,3 ± 2,75 mm/s, prima dell’AMF, a 83,8 ± 3,75 mm/s, durante l’AMF (un mouse, quattro prove, le barre di errore sono più piccole dei simboli; p=5,9-10-6, intervalli di confidenza del 95% [0,9, 9,7] e[77,8, 89,8] mm/s).(F) Confronto della velocità angolare dallo stesso mouse come in(E). La velocità angolare durante l’AMF era di 3,27 ± 0,30 giri/min contro 0,21 ± 0,19 giri/min tra le applicazioni AMF (un mouse, quattro prove, le barre di errore sono più piccole dei simboli; p=0,0003, intervalli di confidenza del 95% [-0,10, 0,53] e [2,78, 3,74] giri/min).(G) Confronto della velocità angolare, o velocità di rotazione dell’arena, misurata per tutti i topi TRPV1+ / MNP+, iniettati nella corteccia motoria, con o senza AMF. La velocità di girare l’arena in giri al minuto è aumentata di 8 volte con AMF, da 0,34 ± 0,08 giri/min a 2,81 ± 0,20 giri/min (6 topi, 14 prove; p = 5,2-10-9; intervalli di confidenza del 95% [0,29, 0,39] e [2,69, 2,93] giri/min).(H) Latenza di inizio e fine della risposta comportamentale dopo l’accensione e lo spegnimento del campo, rispettivamente (n = 21).(I) Velocità di rotazione per il controllo e gli animali da esperimento (topi indipendenti): Controllo1: PBS invece di MNP iniettato (TRPV1+ / MNP-, n = 4; Video 3 );Controllo2: PBS invece di virus iniettato (TRPV1- / MNP+, n = 4; Video 4); e Esperimento (TRPV1+ / MNP+). Non c’è stata alcuna differenza significativa nelle velocità osservate con o senza AMF (AMF+ e AMF-, rispettivamente) nei casi di controllo. Con TRPV1+ / MNP+, i topi hanno mostrato un aumento molto significativo della velocità con AMF, 3,17 ± 0,17 giri/min, rispetto ai topi senza applicazione AMF, 0.42 ± 0,07 giri/min (n = 10, p=1,1-10-5; test T non accoppiato; intervalli di confidenza del 95% [0,32, 0,52] e [2,94, 3,40] giri/min). Negli esperimenti e nei controlli 1 e 2 e MNP sono stati iniettati con anticorpo A2B5 (AB). Controllo3: MNP senza anticorpo iniettato (TRPV1+ / MNP+, AB-, n = 3).(In basso) Man mano che i topi cambiano direzione durante le corse abbiamo anche tracciato la distanza angolare totale percorsa.(A) Immagine laser confocale di soma e dendriti di neuroni etichettati con l’anticorpo anti-microtubuli-proteina associata (MAP2).(B) Anti-TRPV1 anticorpo mostrato l’espressione TRPV1 sulla membrana. Stesso ROI come A. TRPV1 sovraespressione TRPV1 è stato raggiunto attraverso AAV5-hSyn-TRPV1 infezione virale.(C) MNPs etichettatura membrana di neuroni nella corteccia motoria. Stesso ROI come nel pannello A. I MNPs sono stati co-iniezione con anticorpi A2B5.(D) Sovrapposizione dei pannelli MAP2 (verde), anti-TRPV1 (rosso) e MNP (blu).Questi animali non rispondono all’applicazione AMF.La figura mostra due sessioni di prove eseguite sullo stesso topo nel corso di 2 giorni (12 ore e 36 ore dopo l’iniezione di MNP). La posizione degli animali viene registrata dal video e la distanza angolare cumulativa percorsa viene tracciata. Quattro settimane prima, l’animale è stato iniettato con TRPV1 + e MNP + (con AB) nella corteccia motoria.Radice, cioè l’intensità del campo magnetico quadrato è stata misurata da una sonda a campo alternato Fluxtrol. Il grafico mostra il profilo del campo magnetico di una bobina di 100 mm di diametro a due giri di risonanza a 570 kHz. Le misurazioni sono state effettuate lungo un diametro della bobina, che giace su un piano a metà strada tra i due giri. Le barre di errore mostrano i limiti di variazione dell’intensità del campo magnetico nel corso dei cicli. Tutte le stimolazioni in vivo sono state effettuate in un’arena circolare delimitata dalla bobina.
La stimolazione ripetuta dello stesso animale evocava un aumento della locomozione in modo affidabile in ogni prova. La Figura 4D mostra quattro applicazioni sul campo da 1 minuto in una prova di 15 minuti. Sessioni ripetute sugli stessi topi dimostrano che la sensibilizzazione persiste per diversi giorni(Figura 4-figure supplement 4). C’è una stretta correlazione temporale tra il riscaldamento AMF ed il comportamento osservato: Ogni volta, poco dopo l’applicazione dell’AMF, il mouse inizia a correre. La deambulazione stimolata persiste per tutta la durata dell’applicazione sul campo e termina poco dopo che l’AMF è stato rimosso. Per una forza AMF di 7,5 kA/m rms a 570 kHz, la risposta comportamentale è iniziata 22,8 ± 2,6 s (n = 14, 6 topi, Figura 4H) dopo l’inizio dell‘AMF. Questa latenza di insorgenza del comportamento è coerente con la rapida risposta in vitro, perché il riscaldamento dipende dal quadrato della forza dell’AMF, che per il caso in vivo era circa un terzo di quello degli esperimenti in vitro. Esecuzione di riscaldamento AMF su MNP decorato cellule HEK decorato ha mostrato che abbassando l’intensità del campo di un terzo ha aumentato il tempo necessario per raggiungere un aumento di due gradi a 20 s(Figura 2-figure supplemento 1). Il ritardo è paragonabile a stimolazioni optogenetiche nella corteccia motoria, anche utilizzando virus consegnato geni attivatore(Airan et al., 2009). Dopo che l’AMF è terminato, il comportamento di deambulazione è continuato per 14,7 ± 2,5 s, probabilmente il tempo necessario per raffreddare la membrana legata MNPs (Figura 4H). L’utilizzo di nanoparticelle legate alla membrana per la neuro-stimolazione magnetotermica garantisce una veloce cinetica on e off perché solo un minuscolo volume di spazio viene riscaldato e raffreddato.
Topi iniettati con solo AAV5-hSyn-TRPV1 virus o solo MNPs non ha mostrato alcuna risposta all’applicazione AMF(Video 3 e 4 rispettivamente) dimostrando che né l’iniezione MNP né l’espressione TRPV1 MNP da sola è sufficiente per evocare la risposta. Stimolazione osservabile si è verificato solo quando AMF è stato applicato in presenza del canale ionico temperatura-gated, TRPV1, e l’energia trasduttore MNPs nelle stesse posizioni del cervello. Per gli animali privi di iperespressione TRPV1 o MNP, l’applicazione AMF non ha causato alcuna deviazione significativa dalla velocità di rotazione di base speedEquation (quattro topi singoli per ciascuno, Figura 4I). D’altra parte, in tutti i topi iniettati sia con MNP e TRPV1 nella stessa posizione cerebrale, la velocità angolare è aumentata significativamente con AMF, 3,17 ± 0.17 giri/min rispetto alla velocità di base di 0,42 ± 0,07 giri/min (n = 10, p = 1,1-10-5; T-test non accoppiato; 95% C.I.[0,32, 0,52] e [2,94, 3,40] giri/min) (Figura 4I). Membrana di targeting i MNPs è essenziale come animali iniettati con virus e MNPs senza l’anticorpo anti-A2B5 erano insensibili all’applicazione AMF(Figura 4I, Figura 4-figure supplement 3).

Video 3.Video di controllo di un mouse iniettato con virus ma non MNP.

Video 4.Video di controllo di un mouse iniettato con MNP ma senza virus.

Video 1.2. Risposta ambulatoriale generata dalla stimolazione della corteccia motoria secondaria.La stimolazione unilaterale nella corteccia motoria evoca la corsa con un certo ritardo. La risposta ambulatoriale persiste durante i 60 s di applicazione in campo lungo e la stimolazione può essere ripetuta in pochi minuti. Il video mostra un esperimento continuo con quattro campi, che portano ciascuno ad una lunga corsa, tipicamente 3-4 volte intorno all’arena. La velocità del video è 3x accelerata, l’iniezione MNP e l’applicazione del campo contrassegnato all’interno dei fotogrammi video.

Video 2.Controlla il video dello stesso mouse senza alcuna applicazione di campo.

Figura 4-figure supplement 5.Figura 4—supplemento figura 5. La neurostimolazione magnetotermica nella corteccia motoria provoca scurry veloce intorno all’arena. (In alto) Spostamento angolare (negativo CW, positivo CCW) di topi stimolati magnetotermicamente nella corteccia motoria (7 prove, 3 topi).Un esempio per un topo iniettato con virus e MNPs, ma senza l’anticorpo anti-A2B5.Repeatability di stimolazione nella corteccia motoria.(A) Impostazione sperimentale per la stimolazione magnetotermica in vivo del comportamento motorio nei topi svegli. Una bobina a due giri raffreddata ad acqua intorno all’arena ha generato l’AMF. L’AMF nella bobina è stato alimentato dallo stesso sistema come per gli esperimenti in vitro. Una telecamera a soffitto è stata usata per registrare il comportamento del mouse nell’arena.(B) Fotografia del topo nell’arena di osservazione; bobina raffreddata ad acqua a due giri visibile come anello nero.(C) Traiettoria rappresentativo registrato da un mouse stimolato nella corteccia motoria prima (nero), durante (rosso), e dopo (blu) applicazione sul campo (ogni 1 min di lunghezza). Il bordo circolare nero denota il confine effettivo della camera. (Vedi anche la Figura 4-figure supplemento 1 per le posizioni di iniezione; e Video 1 e 2).(D) (in alto) Posizione della testa del mouse, (x verde; y arancione) misurata prendendo il centro dell’arena per essere l’origine. (Middle) La traccia nera mostra le velocità lineari del mouse. La velocità aumenta notevolmente durante tutte le applicazioni AMF (barre grigie). Dopo ogni applicazione AMF, il mouse rallenta il movimento esplorativo regolare (in basso). Il totale delle svolte effettuate dal mouse è stato tracciato in funzione del tempo. I cambiamenti angolari in senso antiorario sono stati contati come un cambiamento positivo degli angoli. Durante l’applicazione AMF, il mouse ha girato unilateralmente in modo significativamente maggiore rispetto alle applicazioni AMF.(E) Confronto della velocità lineare di questo mouse TRPV1+ / MNP+, iniettato nella corteccia motoria, con e senza AMF. La velocità lineare media è aumentata di 16 volte dopo l’applicazione AMF, da 5,3 ± 2,75 mm/s, prima dell’AMF, a 83,8 ± 3,75 mm/s, durante l’AMF (un mouse, quattro prove, le barre di errore sono più piccole dei simboli; p=5,9-10-6, intervalli di confidenza del 95% [0,9, 9,7] e[77,8, 89,8] mm/s).(F) Confronto della velocità angolare dallo stesso mouse come in(E). La velocità angolare durante l’AMF era di 3,27 ± 0,30 giri/min contro 0,21 ± 0,19 giri/min tra le applicazioni AMF (un mouse, quattro prove, le barre di errore sono più piccole dei simboli; p=0,0003, intervalli di confidenza del 95% [-0,10, 0,53] e [2,78, 3,74] giri/min).(G) Confronto della velocità angolare, o velocità di rotazione dell’arena, misurata per tutti i topi TRPV1+ / MNP+, iniettati nella corteccia motoria, con o senza AMF. La velocità di girare l’arena in giri al minuto è aumentata di 8 volte con AMF, da 0,34 ± 0,08 giri/min a 2,81 ± 0,20 giri/min (6 topi, 14 prove; p = 5,2-10-9; intervalli di confidenza del 95% [0,29, 0,39] e [2,69, 2,93] giri/min).(H) Latenza di inizio e fine della risposta comportamentale dopo l’accensione e lo spegnimento del campo, rispettivamente (n = 21).(I) Velocità di rotazione per il controllo e gli animali da esperimento (topi indipendenti): Controllo1: PBS invece di MNP iniettato (TRPV1+ / MNP-, n = 4; Video 3 );Controllo2: PBS invece di virus iniettato (TRPV1- / MNP+, n = 4; Video 4); e Esperimento (TRPV1+ / MNP+). Non c’è stata alcuna differenza significativa nelle velocità osservate con o senza AMF (AMF+ e AMF-, rispettivamente) nei casi di controllo. Con TRPV1+ / MNP+, i topi hanno mostrato un aumento molto significativo della velocità con AMF, 3,17 ± 0,17 giri/min, rispetto ai topi senza applicazione AMF, 0.42 ± 0,07 giri/min (n = 10, p=1,1-10-5; test T non accoppiato; intervalli di confidenza del 95% [0,32, 0,52] e [2,94, 3,40] giri/min). Negli esperimenti e nei controlli 1 e 2 e MNP sono stati iniettati con anticorpo A2B5 (AB). Controllo3: MNP senza anticorpo iniettato (TRPV1+ / MNP+, AB-, n = 3).(In basso) Man mano che i topi cambiano direzione durante le corse abbiamo anche tracciato la distanza angolare totale percorsa.(A) Immagine laser confocale di soma e dendriti di neuroni etichettati con l’anticorpo anti-microtubuli-proteina associata (MAP2).(B) Anti-TRPV1 anticorpo mostrato l’espressione TRPV1 sulla membrana. Stesso ROI come A. TRPV1 sovraespressione TRPV1 è stato raggiunto attraverso AAV5-hSyn-TRPV1 infezione virale.(C) MNPs etichettatura membrana di neuroni nella corteccia motoria. Stesso ROI come nel pannello A. I MNPs sono stati co-iniezione con anticorpi A2B5.(D) Sovrapposizione dei pannelli MAP2 (verde), anti-TRPV1 (rosso) e MNP (blu).Questi animali non rispondono all’applicazione AMF.La figura mostra due sessioni di prove eseguite sullo stesso topo nel corso di 2 giorni (12 ore e 36 ore dopo l’iniezione di MNP). La posizione degli animali viene registrata dal video e la distanza angolare cumulativa percorsa viene tracciata. Quattro settimane prima, l’animale è stato iniettato con TRPV1 + e MNP + (con AB) nella corteccia motoria.Radice, cioè l’intensità del campo magnetico quadrato è stata misurata da una sonda a campo alternato Fluxtrol. Il grafico mostra il profilo del campo magnetico di una bobina di 100 mm di diametro a due giri di risonanza a 570 kHz. Le misurazioni sono state effettuate lungo un diametro della bobina, che giace su un piano a metà strada tra i due giri. Le barre di errore mostrano i limiti di variazione dell’intensità del campo magnetico nel corso dei cicli. Tutte le stimolazioni in vivo sono state effettuate in un’arena circolare delimitata dalla bobina.
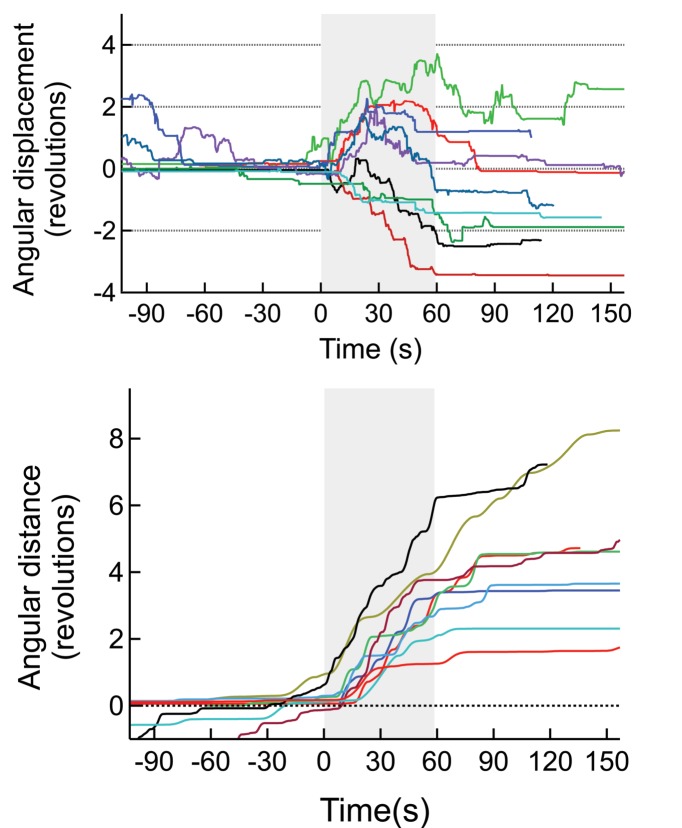
Figura 4-figure supplement 1.(In alto) Spostamento angolare (CW negativo, CCW positivo) di topi stimolati magnetotermicamente nella corteccia motoria (7 prove, 3 topi).(In basso) Come i topi cambiano direzione durante le corse abbiamo anche tracciato la distanza angolare totale percorsa.
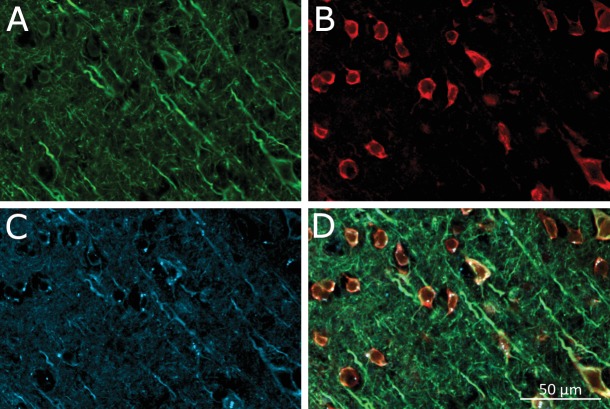
Figura 4-figure supplemento 2.Virus-indotta TRPV1 sovra-espressione indotta da virus e la membrana di etichettatura MNP legato MNP dei neuroni nella corteccia motoria.(A) Immagine laser confocale di soma e dendriti di neuroni etichettati da anti-microtubuli-associati-proteina (MAP2) anticorpo.(B) Anti-TRPV1 anticorpo mostrato l’espressione TRPV1 sulla membrana. Stesso ROI come A. TRPV1 sovraespressione TRPV1 è stato raggiunto attraverso AAV5-hSyn-TRPV1 infezione virale.(C) MNPs etichettatura membrana di neuroni nella corteccia motoria. Stesso ROI come nel pannello A. I MNPs sono stati co-iniezione con anticorpi A2B5.(D) Sovrapposizione dei pannelli MAP2 (verde), anti-TRPV1 (rosso) e MNP (blu).
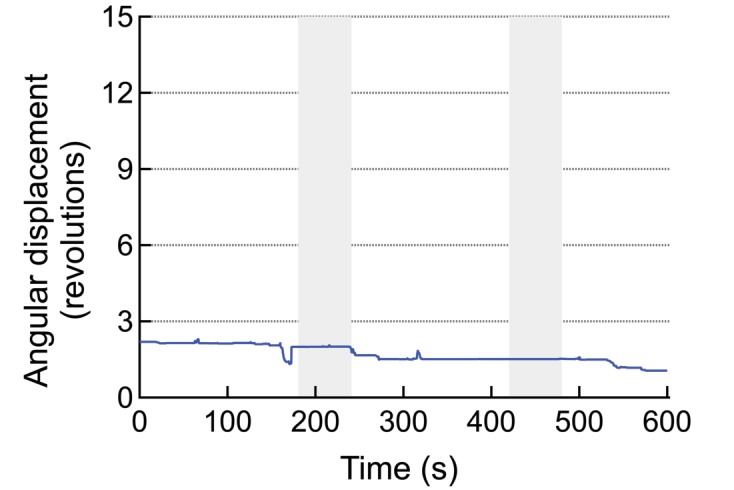
Figura 4-figure supplemento 3.Un esempio per un topo iniettato con virus e MNPs ma senza l’anticorpo anti-A2B5.Questi animali non rispondono all’applicazione AMF.
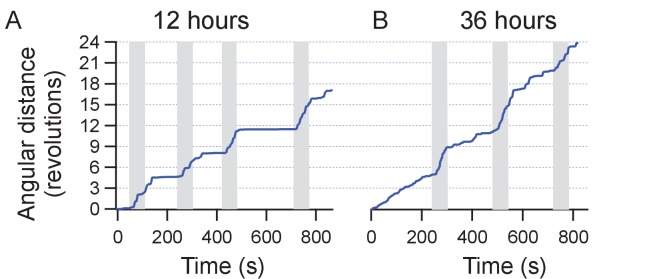
Figura 4-figure supplemento 4.Ripetibilità della stimolazione nella corteccia motoria.La figura mostra due sessioni di prove eseguite sullo stesso mouse in un corso di 2 giorni (12 ore e 36 ore dopo l’iniezione di MNPs). La posizione degli animali viene registrata dal video e la distanza angolare cumulativa percorsa viene tracciata. Quattro settimane prima, l’animale è stato iniettato con TRPV1 + e MNP + (con AB) nella corteccia motoria.

Figura 4-figure supplemento 5.Figura 4. Distribuzione del campo magnetico in tutta l’arena sperimentale.Radice, cioè l’intensità del campo magnetico quadrato è stato misurato da una sonda a campo alternato Fluxtrol. Il grafico mostra il profilo del campo magnetico di una bobina di 100 mm di diametro a due giri di risonanza a 570 kHz. Le misurazioni sono state effettuate lungo un diametro della bobina, che giace su un piano a metà strada tra i due giri. Le barre di errore mostrano i limiti di variazione dell’intensità del campo magnetico nel corso dei cicli. Tutte le stimolazioni in vivo sono state effettuate in un’arena circolare delimitata dalla bobina.

Video 3.Video di controllo di un mouse iniettato con virus ma non MNP.

Video 4.Video di controllo di un mouse iniettato con MNP ma senza virus.
Stimolazioni genetiche magnetotermiche cerebrali profonde nello striato causano la rotazione intorno all’asse del corpo
Successivamente, abbiamo studiato l’efficacia della stimolazione genetica magnetotermica nello striato, una regione cerebrale profonda. L’attivazione chemogenetica dei nuclei di putamene caudato nello striato ha dimostrato in precedenza di evocare un aumento della locomozione sotto forma di rotazione intorno all’asse del corpo(Arenkiel et al., 2008; Kreitzer e Malenka, 2008). Per replicare questi risultati con la stimolazione magnetotermica, abbiamo iniettato il virus AAV5-hSyn-TRPV1 e MNPs nel caudato putamen nuclei nello striato dorsale, 3 mm di profondità (AP = 0, ML = 2,3 da bregma) (Li et al., 2015; Ohet al., 2014). L’istologia immunologica ha confermato il successo della sovra-espressione TRPV1, l’iniezione di MNP al bersaglio(Figura 5-figure supplements 1,2), e una buona sovrapposizione di entrambi (Figura 5-figure supplement 3. Durante l’applicazione AMF, il mouse gira intorno al suo asse del corpo, in modo che la sua testa traccia cerchi di 22 ± 5 mm di raggio (Figura 5A-C,Video 3). Questi giri sono stati molto regolari e veloci (19,3 ± 2,2 mm/s; Figura 5D), con il risultato di 4,7 ± 0,8 giri al minuto (Figura 5E). Questo comportamento è stato molto diverso dal movimento di corsa osservato durante l’attivazione della corteccia motoria, dove i topi correvano a velocità di 83,8 ± 3,75 mm/s, vicino al bordo dell’arena, che ha un raggio di 50 mm. In questo caso, i raggi di rotazione dei cerchi fatti dai topi erano considerevolmente più piccoli, e la velocità lineare più bassa. Il movimento di virata evocato dalla stimolazione nello striato era molto riproducibile di prova in prova e attraverso gli animali(Figure 5F, 12 prove, 4 animali). I topi si sono rivolti controlaterali all’iniezione in 11 delle 12 prove e non hanno mai invertito la direzione di rotazione dopo aver iniziato il movimento.

Video 5.5. Ruotamento dell’asse corporeo causato dalla stimolazione locale nello striato dorsale.Il video mostra la risposta del mouse al campo, risultante dalla stimolazione dello striato. La risposta è ripetibile, come mostrato qui in una ricodifica continua con due prove. Il mouse esegue due giri ipsilaterali completi e ininterrotti durante la prima applicazione del campo e un giro ipsi – e contro – laterale completo ciascuno durante il secondo campo. I raggi di svolta non sono limitati dal confine dell’arena. Velocità di riproduzione video 3X; i tempi di iniezione del sito e del campo sono mostrati come overlay.
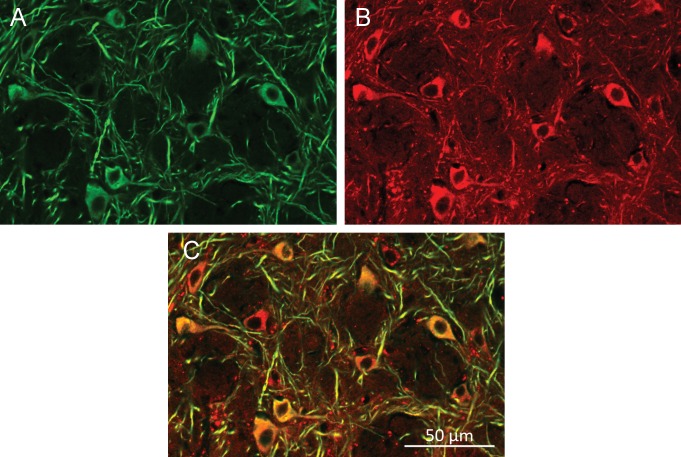
Figura 5-video 4.Figura 5—video 4. Neurostimolazione magnetotermica nello striato provoca rapide rotazioni intorno all’asse del corpo.conferma della regione bersaglio nello Striatum.co-localizzazione dell’espressione dei canali indotti dal virus e il legame MNP nello striato.virus-indotta TRPV1 sovra-espressione nello Striatum.ripetibilità della stimolazione nello striato.antibody-assistito targeting confina MNP diffusione.anticorpo migliora il targeting di membrana di MNPs.cellule neuronali salute dopo esposizioni multiple AMF.Risoluzione cellulare confocale z sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello. (esempio 1) Risoluzione cellulare z confocale z sezioni di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello.(esempio 2) Risoluzione cellulare confocale z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 3).risoluzione cellulare confocale z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 4).risoluzione cellulare z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 4).(A) Traiettoria di un topo rappresentativo TRPV1+/MNP+, iniettato nello striato, durante l’applicazione di AMF (1 min.). Il mouse è rimasto vicino al centro dell’arena, mentre girava unilateralmente intorno al suo asse corporeo (in contrasto con la corteccia motoria del mouse iniettato). Il cerchio nero rappresenta il confine effettivo dell’arena.(B) Due traiettorie di un minuto dello stesso mouse senza AMF (nero: prima dell’applicazione AMF, blu: dopo l’applicazione AMF). Il mouse svolgeva regolari attività di riposo/esplorazione, girando cinque volte meno di quello con AMF (vedi anche Video 6).(C) (in alto) Traiettoria (x,y posizioni, x verde; y arancione) del mouse mostrata nella parte(A) e nel Video 5. Un minuto di AMF è stato applicato due volte (barra grigia). (Middle) Velocità lineare in mm/s dello stesso mouse calcolata dalla traiettoria. (In basso) Trama dello spostamento angolare, in giri, calcolato dalla traiettoria. Il mouse gira unilateralmente in senso antiorario (a sinistra) durante le applicazioni AMF.(D) ,(E) Confronto tra velocità lineare e angolare dello stesso mouse con (rosso) e senza (blu) AMF.(F) Registrazione di 12 prove di stimolazione in quattro topi. Il movimento è tracciato e lo spostamento angolare è registrato (lo spostamento angolare negativo è CW, mentre positivo è CCW). Nell’applicazione AMF, il mouse gira in una sola direzione, tipicamente per 3 o 4 giri, e in 11 casi su 12 si gira contro-laterale alla metà del cervello iniettata.(G) Confronto della velocità angolare, o velocità di rotazione, in giri al minuto misurati per tutti i topi TRPV1+/MNP +, iniettati nello striato: la velocità angolare durante AMF, 3,46 ± 1,04 giri/min, era 5.8 volte la velocità angolare senza AMF, 0,37 ± 0,22 giri/min (4 topi, 12 prove, p=3,74-10-7; T-test non accoppiato; intervalli di confidenza del 95%[0,33, 0,41] e [3,27, 3,65] giri/min, media ± s.d.).(A) MNPs coperto cellule nel volume di destinazione nello striato visto attraverso Alexa 647 allegato al MNPs. (Linee tratteggiate sono aggiunti per la guida visiva anatomica). (B) MNPs (re. (C) d) sovrapposti su immagine luminosa trasmessa della sezione del cervello.(A) Immunostaining TRPV1 che esprime cellule, infettate con AAV5-hSyn-TRPV1. Il TRPV1 è etichettato utilizzando l’anticorpo anti-TRPV1 (Abcam) con anticorpo secondario.(B) MNPs etichettato con marcatore fluorescente (Alexa 647), iniettato nella stessa posizione 4 settimane dopo l’iniezione del virus.(C) Una sovrapposizione di espressione TRPV1 (verde), MNPs (rosso) e l’immagine luminosa trasmessa (scala di grigi).(A) Immagine confocale laser di soma e dendriti di neuroni etichettati con anticorpo anti microtubuli-proteina associata (MAP2).(B) TRPV1 sovraespresso attraverso l’infezione virale AAV5-hsyn-TRPV1, visualizzato utilizzando l’anticorpo anti-TRPV1 (Abcam) con l’anticorpo secondario marcato con alessano-647.(C) Sovrapposizione delle etichette MAP2 (verde) e TRPV1 (rosso).(A) Lentivirus indotta da TRPV1 cellule in sovraespressione in striato visualizzate mediante l’immagine del marcatore nucleare NLS-mCherry codificato nel lentivirus.(B) Sovrapposizione del NLS-mCherry (marcatore di infezione virale, verde) e un’immagine luminosa trasmessa (scala di grigi).La figura mostra tre sessioni di prove eseguite sullo stesso mouse in un corso di 2,5 giorni (i punti di tempo sono indicati sopra ogni grafico, le aree grigie ombreggiate sono le applicazioni AMF). L’animale è stato iniettato con TRPV1+ e MNP+ (con AB) nello striato.(A) Micrografie a fluorescenza, che mostrano la diffusione di MNP intorno al punto di consegna, quando è stato introdotto con(i) e senza (ii) anticorpi A2B5. Le MNP contrassegnate con alessandrina 647 sono visualizzate come macchie rosse in entrambi i casi. La fluorescenza relativa non è normalizzata per(i) e (ii).(B) Grafici di intensità di fluorescenza che confrontano la diffusione di MNP intorno al punto di consegna, quando introdotti con (rosso) e senza (nero) anticorpi A2B5. L’ombreggiatura indica SEM (tre sezioni cerebrali di tre animali). La diffusione FWHM è stata di 106,0 ± 0,8 µm e 251,3 ± 4,8 µm per i casi con e senza anticorpi A2B5, rispettivamente.Quattro video che mostrano l’etichettatura MNP sulle cellule, immagini come sezioni confocali a risoluzione cellulare. In tutti i casi il verde indica la colorazione MAP2 nello striato, mentre l’etichettatura MNP è mostrata in rosso. In tutti i casi, MNP è stato co-consegnato con anticorpi A2B5 (particella 1:1: rapporto molecole anticorpali). Il pannello di sinistra in ogni filmato mostra l’etichettatura MNP, mentre il pannello di destra è una sovrapposizione dello stesso roi, che mostra i canali MAP2 e MNP. Le sezioni cerebrali di due animali sono state mostrate qui. Entrambi gli animali sono stati sacrificati e la perfusione è stata fissata, 24 ore dopo la procedura di consegna MNP. Video-animazioni associate.Istologia di MNPs neuroni decorati neuroni dopo il risveglio, animale comportamento è stato esposto a 20 volte un minuto AMF applicazioni nel corso di tre sessioni nel corso di un periodo di 24 ore.(A) Neuroni etichettati con anticorpo anti-MAP2.(B) MNPs etichettati da allegato Alexa-647 tintura.(C) Sovrapposizione di MAP2 (verde) e MNPs (rosso).Relativo allafigura 5-figure supplement 6.Relativo allaFigura 5; Figura 5—supplemento di figura 6.Relativo allaFigura 5;supplemento a 5 cifre 6 . Relativo a Figura 5—supplemento di figura6.
La risposta media di quattro topi striati in 12 prove è stata un aumento di 6 volte della velocità angolare durante l’attivazione AMF, 2,86 ± 0.19 giri/min rispetto ad un tasso di base di 0,47 ± 0,09 giri/min (Figura 5G; p = 3,4-10-7; T-test non accoppiato; 95% C.I. [0,42, 0,56] e [2,71, 3,01] giri/min). La risposta osservata è coerente con una precedente relazione di stimolazione dello striato dorsale mediante attivazione capsaicina dei canali TRPV1 alle stesse coordinate cerebrali(Arenkiel et al., 2008).
Oltre alla prova di stimolazione multipla durante una sessione, abbiamo eseguito diverse sessioni con successo oltre 54 ore(Figura 5-figure supplemento 4).

Video 5.5. Ruotamento dell’asse corporeo causato dalla stimolazione locale nello striato dorsale.Il video mostra la risposta del mouse al campo, risultante dalla stimolazione dello striato. La risposta è ripetibile, come mostrato qui in una ricodifica continua con due prove. Il mouse esegue due giri ipsilaterali completi e ininterrotti durante la prima applicazione del campo e un giro ipsi – e contro – laterale completo ciascuno durante il secondo campo. I raggi di svolta non sono limitati dal confine dell’arena. Velocità di riproduzione video 3X; i tempi di iniezione del sito e del campo sono mostrati come overlay.

Figura 5-video 4.Figura 5—video 4. Neurostimolazione magnetotermica nello striato provoca rapide rotazioni intorno all’asse del corpo.conferma della regione bersaglio nello Striatum.co-localizzazione dell’espressione dei canali indotti dal virus e il legame MNP nello striato.virus-indotta TRPV1 sovra-espressione nello Striatum.ripetibilità della stimolazione nello striato.antibody-assistito targeting confina MNP diffusione.anticorpo migliora il targeting di membrana di MNPs.cellule neuronali salute dopo esposizioni multiple AMF.Risoluzione cellulare confocale z sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello. (esempio 1) Risoluzione cellulare z confocale z sezioni di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello.(esempio 2) Risoluzione cellulare confocale z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 3).risoluzione cellulare confocale z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 4).risoluzione cellulare z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 4).(A) Traiettoria di un topo rappresentativo TRPV1+/MNP+, iniettato nello striato, durante l’applicazione di AMF (1 min.). Il mouse è rimasto vicino al centro dell’arena, mentre girava unilateralmente intorno al suo asse corporeo (in contrasto con la corteccia motoria del mouse iniettato). Il cerchio nero rappresenta il confine effettivo dell’arena.(B) Due traiettorie di un minuto dello stesso mouse senza AMF (nero: prima dell’applicazione AMF, blu: dopo l’applicazione AMF). Il mouse svolgeva regolari attività di riposo/esplorazione, girando cinque volte meno di quello con AMF (vedi anche Video 6).(C) (in alto) Traiettoria (x,y posizioni, x verde; y arancione) del mouse mostrata nella parte(A) e nel Video 5. Un minuto di AMF è stato applicato due volte (barra grigia). (Middle) Velocità lineare in mm/s dello stesso mouse calcolata dalla traiettoria. (In basso) Trama dello spostamento angolare, in giri, calcolato dalla traiettoria. Il mouse gira unilateralmente in senso antiorario (a sinistra) durante le applicazioni AMF.(D) ,(E) Confronto tra velocità lineare e angolare dello stesso mouse con (rosso) e senza (blu) AMF.(F) Registrazione di 12 prove di stimolazione in quattro topi. Il movimento è tracciato e lo spostamento angolare è registrato (lo spostamento angolare negativo è CW, mentre positivo è CCW). Nell’applicazione AMF, il mouse gira in una sola direzione, tipicamente per 3 o 4 giri, e in 11 casi su 12 si gira contro-laterale alla metà del cervello iniettata.(G) Confronto della velocità angolare, o velocità di rotazione, in giri al minuto misurati per tutti i topi TRPV1+/MNP +, iniettati nello striato: la velocità angolare durante AMF, 3,46 ± 1,04 giri/min, era 5.8 volte la velocità angolare senza AMF, 0,37 ± 0,22 giri/min (4 topi, 12 prove, p=3,74-10-7; T-test non accoppiato; intervalli di confidenza del 95%[0,33, 0,41] e [3,27, 3,65] giri/min, media ± s.d.).(A) MNPs coperto cellule nel volume di destinazione nello striato visto attraverso Alexa 647 allegato al MNPs. (Linee tratteggiate sono aggiunti per la guida visiva anatomica). (B) MNPs (re. (C) d) sovrapposti su immagine luminosa trasmessa della sezione del cervello.(A) Immunostaining TRPV1 che esprime cellule, infettate con AAV5-hSyn-TRPV1. Il TRPV1 è etichettato utilizzando l’anticorpo anti-TRPV1 (Abcam) con anticorpo secondario.(B) MNPs etichettato con marcatore fluorescente (Alexa 647), iniettato nella stessa posizione 4 settimane dopo l’iniezione del virus.(C) Una sovrapposizione di espressione TRPV1 (verde), MNPs (rosso) e l’immagine luminosa trasmessa (scala di grigi).(A) Immagine confocale laser di soma e dendriti di neuroni etichettati con anticorpo anti microtubuli-proteina associata (MAP2).(B) TRPV1 sovraespresso attraverso l’infezione virale AAV5-hsyn-TRPV1, visualizzato utilizzando l’anticorpo anti-TRPV1 (Abcam) con l’anticorpo secondario marcato con alessano-647.(C) Sovrapposizione delle etichette MAP2 (verde) e TRPV1 (rosso).(A) Lentivirus indotta da TRPV1 cellule in sovraespressione in striato visualizzate mediante l’immagine del marcatore nucleare NLS-mCherry codificato nel lentivirus.(B) Sovrapposizione del NLS-mCherry (marcatore di infezione virale, verde) e un’immagine luminosa trasmessa (scala di grigi).La figura mostra tre sessioni di prove eseguite sullo stesso mouse in un corso di 2,5 giorni (i punti di tempo sono indicati sopra ogni grafico, le aree grigie ombreggiate sono le applicazioni AMF). L’animale è stato iniettato con TRPV1+ e MNP+ (con AB) nello striato.(A) Micrografie a fluorescenza, che mostrano la diffusione di MNP intorno al punto di consegna, quando è stato introdotto con(i) e senza (ii) anticorpi A2B5. Le MNP contrassegnate con alessandrina 647 sono visualizzate come macchie rosse in entrambi i casi. La fluorescenza relativa non è normalizzata per(i) e (ii).(B) Grafici di intensità di fluorescenza che confrontano la diffusione di MNP intorno al punto di consegna, quando introdotti con (rosso) e senza (nero) anticorpi A2B5. L’ombreggiatura indica SEM (tre sezioni cerebrali di tre animali). La diffusione FWHM è stata di 106,0 ± 0,8 µm e 251,3 ± 4,8 µm per i casi con e senza anticorpi A2B5, rispettivamente.Quattro video che mostrano l’etichettatura MNP sulle cellule, immagini come sezioni confocali a risoluzione cellulare. In tutti i casi il verde indica la colorazione MAP2 nello striato, mentre l’etichettatura MNP è mostrata in rosso. In tutti i casi, MNP è stato co-consegnato con anticorpi A2B5 (particella 1:1: rapporto molecole anticorpali). Il pannello di sinistra in ogni filmato mostra l’etichettatura MNP, mentre il pannello di destra è una sovrapposizione dello stesso roi, che mostra i canali MAP2 e MNP. Le sezioni cerebrali di due animali sono state mostrate qui. Entrambi gli animali sono stati sacrificati e la perfusione è stata fissata, 24 ore dopo la procedura di consegna MNP. Video-animazioni associate.Istologia di MNP neuroni decorati neuroni dopo il risveglio, animale comportamento è stato esposto a 20 volte un minuto AMF applicazioni nel corso di tre sessioni per un periodo di 24 ore.(A) Neuroni etichettati con anticorpo anti-MAP2.(B) MNPs etichettati da allegato Alexa-647 colorante.(C) Sovrapposizione di MAP2 (verde) e MNPs (rosso).Relativo allafigura 5-figure supplement 6.Relativo allaFigura 5; Figura 5—supplemento di figura 6.Relativo allaFigura 5;supplemento a 5 cifre 6 . Relativo a Figura 5—supplemento di figura6.
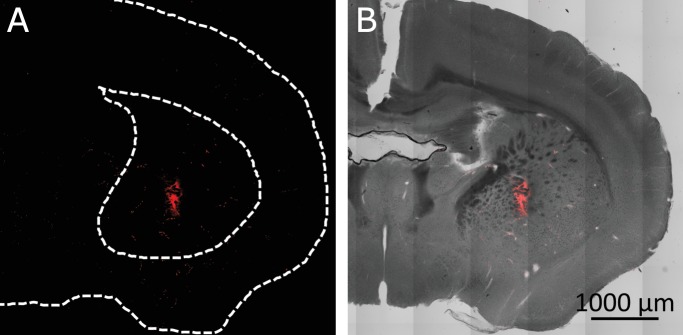
Figura 5-figure supplement 1.Conferma della regione interessata nello Striatum.(A) MNPs coperto cellule nel volume target nello striato visto attraverso Alexa 647 allegato al MNPs. (Linee tratteggiate sono aggiunti per la guida visiva anatomica). (B) MNPs (re. (C) d) sovrapposti su immagine luminosa trasmessa della sezione del cervello.

Figura 5-figure supplemento 2.Figura 5—figura 2. Co-localizzazione dell’espressione dei canali indotti dal virus e del legame MNP nello striato.(A) Immunostaining TRPV1 che esprime le cellule, infettate con AAV5-hSyn-TRPV1. Il TRPV1 è etichettato usando l’anticorpo anti-TRPV1 (Abcam) con anticorpo secondario.(B) MNPs etichettato con marcatore fluorescente (Alexa 647), iniettato nella stessa posizione 4 settimane dopo l’iniezione del virus.(C) Una sovrapposizione di espressione TRPV1 (verde), MNPs (rosso) e l’immagine luminosa trasmessa (scala di grigi).
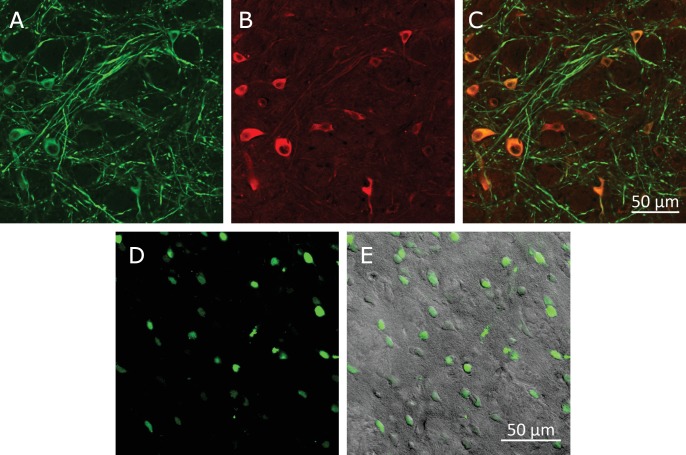
Figura 5-figure supplement 3.Figura 5—supplemento alla figura 3. Sovrapposizione dell’espressione del TRPV1 indotta dal virus nello Striatum.(A) Immagine confocale laser di soma e dendriti di neuroni etichettati da anticorpo anti microtubuli-proteina associata (MAP2).(B) TRPV1 sovraespresso attraverso l’infezione virale AAV5-hsyn-TRPV1, visualizzato utilizzando l’anticorpo anti-TRPV1 (Abcam) con l’anticorpo secondario marcato Alexa-647.(C) Sovrapposizione delle etichette MAP2 (verde) e TRPV1 (rosso).(A) Lentivirus indotta da TRPV1 cellule in sovraespressione in striato visualizzate mediante l’immagine del marcatore nucleare NLS-mCherry codificato nel lentivirus.(B) Sovrapposizione del NLS-mCherry (marcatore di infezione virale, verde) e un’immagine luminosa trasmessa (scala di grigi).

Figura 5-figure supplement 4.Ripetibilità della stimolazione in striato.La figura mostra tre sessioni di prove eseguite sullo stesso mouse in un corso di 2,5 giorni (i punti di tempo sono indicati sopra ogni grafico, le aree grigie ombreggiate sono le applicazioni AMF). L’animale è stato iniettato con TRPV1+ e MNP+ (con AB) nello striato.
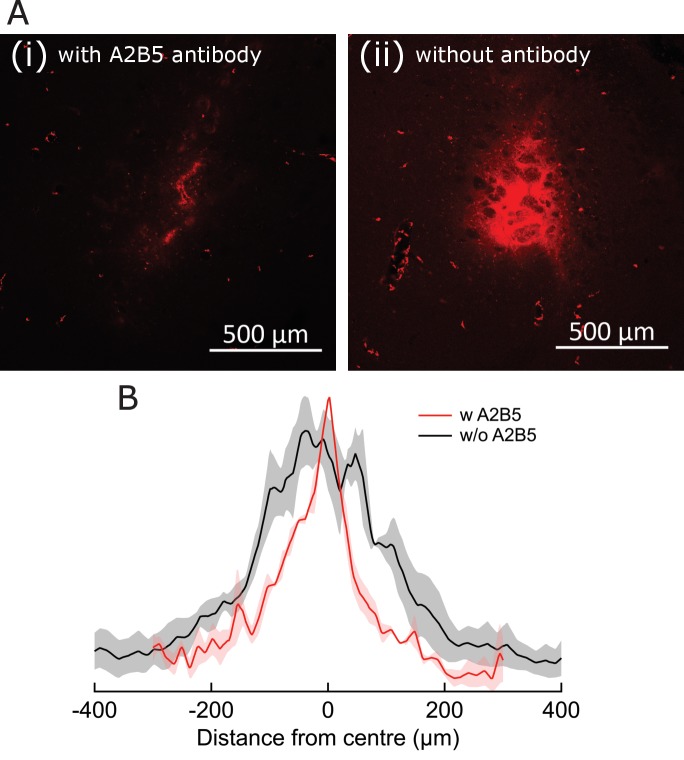
Figura 5-figure supplemento 5.Antibody-assistito di targeting confina la diffusione MNP.(A) Micrografie a fluorescenza, che mostrano la diffusione di MNP intorno al punto di consegna, se introdotte con(i) e senza (ii) anticorpi A2B5. Le MNP marcate con alessandrina 647 sono visualizzate come macchie rosse in entrambi i casi. La fluorescenza relativa non è normalizzata per(i) e (ii).(B) Grafici di intensità di fluorescenza che confrontano la diffusione di MNP intorno al punto di consegna, quando introdotti con (rosso) e senza (nero) anticorpi A2B5. L’ombreggiatura indica SEM (tre sezioni cerebrali di tre animali). La diffusione FWHM è stata di 106,0 ± 0,8 µm e 251,3 ± 4,8 µm per i casi con e senza anticorpi A2B5, rispettivamente.
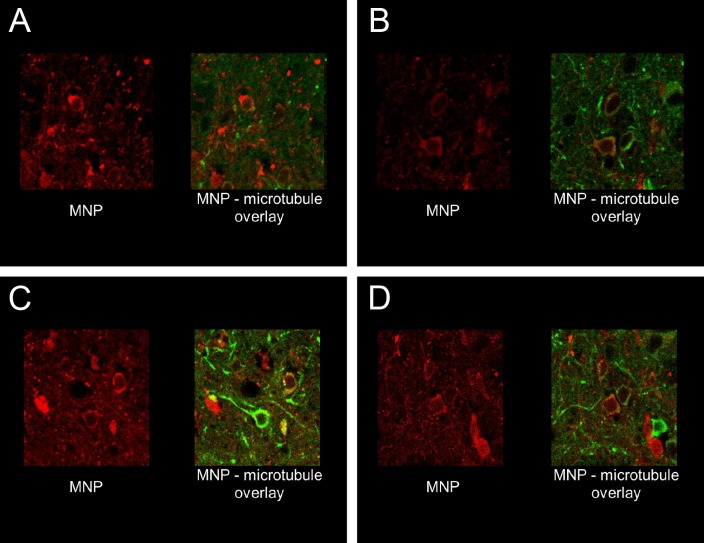
Figura 5-figure supplement 6.Anticorpo migliora il targeting della membrana di MNPs.Quattro video che mostrano l’etichettatura MNP sulle cellule, ripresi come sezioni confocali a risoluzione cellulare. In tutti i casi il verde indica la colorazione MAP2 nello striato, mentre l’etichettatura MNP è mostrato in rosso. In tutti i casi, MNP è stato co-consegnato con anticorpi A2B5 (particella 1:1: rapporto molecole anticorpali). Il pannello di sinistra in ogni filmato mostra l’etichettatura MNP, mentre il pannello di destra è una sovrapposizione dello stesso roi, che mostra i canali MAP2 e MNP. Le sezioni cerebrali di due animali sono state mostrate qui. Entrambi gli animali sono stati sacrificati e la perfusione è stata fissata, 24 ore dopo la procedura di consegna MNP. Video-animazioni associate.

Figura 5-figure supplemento 7.Salute delle cellule neuronali dopo esposizioni multiple AMF.Istologia di MNP neuroni decorati neuroni dopo il risveglio, animale comportamento è stato esposto a 20 volte un minuto AMF applicazioni AMF nel corso di tre sessioni nel corso di un periodo di 24 ore.(A) Neuroni etichettati con anticorpo anti-MAP2.(B) MNPs etichettati da allegato Alexa-647 colorante.(C) Sovrapposizione di MAP2 (verde) e MNPs (rosso).

Figura 5-video 1.Risoluzione cellulare confocale z sezioni confocali di MNP con anticorpi anti-A2B5 anticorpi che legano i neuroni nel cervello. (esempio 1)Relativo allafigura 5-figure supplement 6.

Figura 5-video 2.Figura 5—video 2. Risoluzione cellulare confocale z-sezioni confocali di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello. (esempio 2)Relativo allafigura 5-figure supplement 6.

Figura 5-video 3.Figura 5—video 3. Sezioni confocali a z di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 3).Relativo allaFigura 5-figure supplement 6 .

Figura 5-video 4.Figura 5—video 4. Risoluzione cellulare confocale z-sezioni di MNP con anticorpi anti-A2B5 che legano i neuroni nel cervello (esempio 4).Relativo alla Figura 5-figuresupplement 6.
Stimolazione genetica magnetotermica cerebrale profonda sulla cresta tra lo striato dorsale e ventrale provoca il congelamento dell’andatura
Per evocare magnetotermicamente una risposta che non comporti un aumento della locomozione, abbiamo voluto dimostrare la stimolazione del congelamento dell’andatura. Il team Deisseroth ha dimostrato che la stimolazione optogenetica vicino alla cresta tra lo striato dorsale e ventrale inibisce la locomozione volontaria(Gradinaru et al., 2009; Kravitz et al., 2010). Pertanto, abbiamo approfittato del fatto che la profondità di stimolazione è limitata solo da accessibilità regione cerebrale in termini di virus e la consegna MNP, e iniettato AAV5-hSyn-TRPV1 virus AAV5-hSyn-TRPV1 e MNPs alla cresta tra striato dorsale e ventrale (AP = 0,01, ML = 2,3) (Figura 6-figuresupplemento 1). L’applicazione dell’AMF ha causato il congelamento dell’andatura (FOG), caratterizzato dall’inibizione della locomozione, con tutte e quattro le zampe bloccate in posizione mentre il topo era ancora in grado di muovere la testa in tutte le direzioni, collo in avanti. La FOG è comune nei pazienti con malattia di Parkinson avanzata (Mooreet al., 2008). I video 6 e 7, Figura 6A-C mostrano le tracce del collo del topo. Le attività ambulatoriali sono diminuite notevolmente durante la stimolazione, che può anche essere visto dalle tracce della zampa(Figura 6-figure supplement 2). Oltre alla FOG, c’è stato un eccessivo allungamento verso l’esterno degli arti insieme all’incapacità delle estremità anteriori di seguire il movimento della testa(Figura 6D). Durante l’applicazione AMF, la velocità lineare media è diminuita significativamente, da 17,7 ± 2,2 mm / s prima della stimolazione a riposo essenzialmente, 1,04 ± 0,13 mm / s (Figura 6C; due topi, sei prove;p = 0,0006; non accoppiato T-test; 95% C.I. [15,4, 20,1] e [0,90, 1,18] mm / s). La velocità tracciata durante l’AMF era indistinguibile da quella di un marcatore fisso sul pavimento dell’arena (0,52 ± 0,11 mm/s).

Video 6.6. Congelamento dell’andatura causato dalla stimolazione locale nello striato profondo.Il topo è stato iniettato 4,1 mm di profondità nello striato, vicino alla cresta tra lo striato dorsale e lo striato ventrale. All’applicazione sul campo, gli arti e la coda del topo sono resi immobili, mentre il resto del corpo, compreso il collo, mantiene la normale mobilità. A volte, dopo la stimolazione, il topo riprende il controllo degli arti e si muove di nuovo liberamente. Velocità di riproduzione video in 3 volte la velocità di registrazione. Il sito di iniezione nel cervello e i tempi di campo sono mostrati come sovrapposizioni.

Video 7.Video di controllo del congelamento dell’andatura.
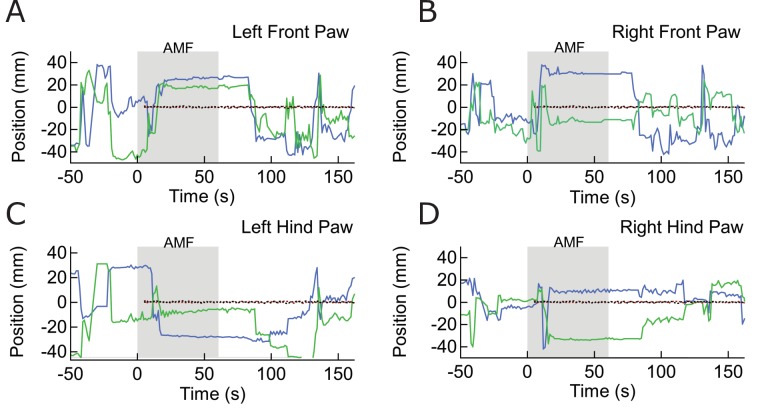
Figura 6. Supplemento a 6 cifre 2.Figura 6—supplemento alla figura 2. La stimolazione magnetotermica vicino alla cresta tra lo striato ventrale e dorsale ha causato il congelamento dell’andatura (FOG).Targeting Region in the Striatum.Paw Location Data for Freezing of Gait Response.(A) Traccia di topo stimolato nel profondo striato prima (nero), durante (rosso), e dopo (blu) l’applicazione AMF (ogni 1 min (vedi anche Figura 6-figure supplemento 2, Video 4 e 5).(B) Posizione X, Y e velocità lineare dello stesso animale rintracciato al collo. La velocità viene confrontata con un punto di riferimento fisso nella camera del campione (linea blu; la barra grigia indica la durata del campo).(C) Trama di dispersione, che mostra la risposta di due topi con AMF. La velocità media senza AMF (17,7 ± 2,2 mm/s) è stata significativamente più veloce di quella con AMF (1,04 ± 0,13 mm/s) (due topi, sei prove; p=0,0006; T-test non accoppiato; intervalli di confidenza del 95% [15,4, 20,1] e [0,90, 1,18] mm/s). La velocità durante l’AMF era molto simile alla velocità del marcatore di riferimento fisso (0,52 ± 0,11 mm/s).(D) Immagine fissa dello stesso prima (in alto) e durante (in basso) il campo. Le punte delle frecce rosse indicano la posizione della zampa durante il congelamento stimolato dell’andatura (FOG). Durante l’AMF, il mouse è in grado di muovere la testa ma non di controllare gli arti che finiscono per distanziarsi più del normale e non sono in grado di seguire il movimento della testa. In assenza di AMF, la deambulazione è normale e le zampe anteriori sono posizionate su entrambi i lati del positone della testa e le zampe posteriori sotto il corpo dell’animale.(A) Coronal Rostral alla sezione caudale dello striato profondo dove il virus e poi due settimane dopo MNP sono stati iniettati vicino alla cresta tra lo striato dorsale e lo striato ventrale (AP = 0,01, ML = 2,3, DV = 4,1) (punto rosso, tutto in mm).(B) Vista Sagittale.(E) – – (H) Dati di posizione della zampa per il congelamento della risposta dell’andatura. Dati di tracciamento (X, blu; Y, verde) delle quattro zampe, prima, durante e dopo l’applicazione sul campo. Il campo viene applicato da 0 s a 60 s. Le tracce rosse e nere sono le coordinate X, Y di un marcatore di riferimento fisso.

Video 6.Congelamento dell’andatura causato dalla stimolazione locale nello striato profondo.Il mouse è stato iniettato 4,1 mm di profondità nello striato, vicino alla cresta tra lo striato dorsale e lo striato ventrale. All’applicazione sul campo, gli arti e la coda del topo sono resi immobili, mentre il resto del corpo, compreso il collo, mantiene la normale mobilità. A volte, dopo la stimolazione, il topo riprende il controllo degli arti e si muove di nuovo liberamente. Velocità di riproduzione video in 3 volte la velocità di registrazione. Il sito di iniezione nel cervello e i tempi di campo sono mostrati come sovrapposizioni.

Video 7.Video di controllo del congelamento dell’andatura.

Figura 6. Supplemento a 6 cifre 2.Figura 6—supplemento alla figura 2. La stimolazione magnetotermica vicino alla cresta tra lo striato ventrale e dorsale ha causato il congelamento dell’andatura (FOG).Targeting Region in the Striatum.Paw Location Data for Freezing of Gait Response.(A) Traccia di topo stimolato nel profondo striato prima (nero), durante (rosso), e dopo (blu) l’applicazione AMF (ogni 1 min (vedi anche Figura 6-figure supplemento 2, Video 4 e 5).(B) Posizione X, Y e velocità lineare dello stesso animale rintracciato al collo. La velocità viene confrontata con un punto di riferimento fisso nella camera del campione (linea blu; la barra grigia indica la durata del campo).(C) Trama di dispersione, che mostra la risposta di due topi con AMF. La velocità media senza AMF (17,7 ± 2,2 mm/s) è stata significativamente più veloce di quella con AMF (1,04 ± 0,13 mm/s) (due topi, sei prove; p=0,0006; T-test non accoppiato; intervalli di confidenza del 95% [15,4, 20,1] e [0,90, 1,18] mm/s). La velocità durante l’AMF era molto simile alla velocità del marcatore di riferimento fisso (0,52 ± 0,11 mm/s).(D) Immagine fissa dello stesso prima (in alto) e durante (in basso) il campo. Le punte delle frecce rosse indicano la posizione della zampa durante il congelamento stimolato dell’andatura (FOG). Durante l’AMF, il mouse è in grado di muovere la testa ma non di controllare gli arti che finiscono per distanziarsi più del normale e non sono in grado di seguire il movimento della testa. In assenza di AMF, la deambulazione è normale e le zampe anteriori sono posizionate su entrambi i lati del positone della testa e le zampe posteriori sotto il corpo dell’animale.(A) Coronal Rostral alla sezione caudale dello striato profondo dove il virus e poi due settimane dopo MNP sono stati iniettati vicino alla cresta tra lo striato dorsale e lo striato ventrale (AP = 0,01, ML = 2,3, DV = 4,1) (punto rosso, tutto in mm).(B) Vista Sagittale.(E) – – (H) Dati di posizione della zampa per il congelamento della risposta dell’andatura. Dati di tracciamento (X, blu; Y, verde) delle quattro zampe, prima, durante e dopo l’applicazione sul campo. Il campo viene applicato da 0 s a 60 s. Le tracce rosse e nere sono le coordinate X, Y di un marcatore di riferimento fisso.
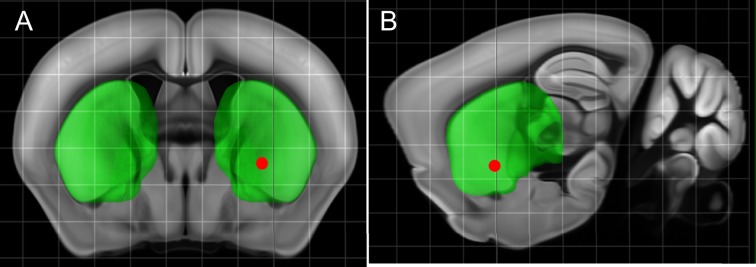
Figura 6-figure supplement 1.1. Regione di destinazione nello Striatum.(A) Coronal Rostral alla sezione caudale dello striato profondo dove il virus e poi due settimane dopo MNP sono stati iniettati vicino alla cresta tra striato dorsale e ventrale (AP = 0,01, ML = 2,3, DV = 4,1) (punto rosso, tutto in mm).(B) Vista Sagittale.

Figura 6-figure supplement 2.Dati di posizione della zampa per il congelamento della risposta dell’andatura.(E) – – (H) Dati di posizione della zampa per la risposta al congelamento dell’andatura. Dati di tracciamento (X, blu; Y, verde) delle quattro zampe, prima, durante e dopo l’applicazione sul campo. Il campo viene applicato da 0 s a 60 s. Le tracce rosse e nere sono le coordinate X, Y di un marcatore di riferimento fisso.
Discussione
Il nostro lavoro dimostra che la stimolazione genetica magnetotermica può efficacemente attivare specifici circuiti neuronali in topi svegli e in libero movimento per evocare comportamenti definiti in modo rapido, robusto e ripetuto. Tre diversi circuiti e comportamenti sono stati stimolati magnetotermicamente e confrontati con la stimolazione optotermica o chemiogenetica precedente degli stessi circuiti: in esecuzione, in risposta alla stimolazione della corteccia motoria (lavoro optogenetico precedente:[Gradinaru et al., 2009]); rotazione intorno all’asse del corpo, dopo la stimolazione in profondità nello striato (lavoro chemiogenetico precedente:(Arenkiel et al., 2008); e il congelamento dell’andatura, in risposta alla stimolazione sulla cresta tra lo striato dorsale e ventrale (precedente lavoro optogenetico:[Kravitz et al., 2010]). Abbiamo evocato con successo comportamenti opposti, la corsa o il congelamento dell’andatura, mirando lo striato dorsale o la cresta tra lo striato dorsale e ventrale, rispettivamente, le posizioni nel cervello solo 1 mm di distanza l’uno dall’altro. Questo dimostra chiaramente che il comportamento evocato è il risultato della stimolazione di un circuito neuronale specifico, e che il calore generato dal MNPs in risposta al AMF è sufficientemente localizzato ai neuroni bersaglio.
La stimolazione genetica magnetotermica porta rapidamente al comportamento motorio mirato, osservabile entro 15-20 s dall’attivazione dell’AMF. Questo breve ritardo non è un limite intrinseco della tecnica, ma piuttosto il risultato di un debole campo medio nel sito della testa del topo(Figura 4-figure supplement 5). Poiché la velocità di riscaldamento è proporzionale al quadrato dell’intensità del campo magnetico, il triplice campo più debole ha causato nel topo una latenza circa nove volte superiore a quella osservata negli studi in vitro. È tecnicamente possibile generare campi elettromagnetici sufficientemente grandi da ridurre la latenza per la stimolazione magnetotermica del comportamento nei topi a volte solo marginalmente più lenta della stimolazione elettrofisiologica o optogenetica, e significativamente più veloce della stimolazione chimica utilizzando DREADD(Armbruster et al., 2007). Allo stesso modo, i nostri risultati mostrano che il comportamento locomotorio evocato è diminuito rapidamente entro 15 s dopo la rimozione del campo. Uno stretto controllo temporale on- e off-control è vitale per una precisa correlazione della stimolazione del circuito con l’osservazione comportamentale, e finora era stato raggiunto solo utilizzando l’optogenetica, ma non la magnetogenetica o la chemiogenetica.
I brevi ritardi di accensione e spegnimento della stimolazione genetica magnetotermica permettono simulazioni multiple in brevi tempi di osservazione. Nei nostri esperimenti, tre o quattro stimolazioni di un minuto sono state possibili in un esperimento di 10-15 minuti. Tale ripetibilità è fondamentale per ottenere dati comportamentali statisticamente significativi. Altri profili temporali di stimolazione sono facilmente realizzabili, permettendo studi sulla formazione della memoria, o con variazioni nel saggio. La cosa più importante, la stimolazione da diversi secondi a molti minuti è facilmente realizzabile, colmando un importante divario tra l’optogenetica più veloce e la chemiogenetica più lenta.
In questo studio, i MNP sono stati legati tramite l’anticorpo A2B5, che riconosce indiscriminatamente tutte le proteine di membrana glicosilate. Ha prodotto la più alta densità di nanoparticelle sulla superficie cellulare e, di conseguenza, ha ottenuto il riscaldamento più rapido. Tuttavia, abbiamo anche utilizzato con successo anti-CD56 (Thy-1), anti-CD90 (NCAM) per le proteine di membrana endogene, così come anti-GFP per colpire le proteine di membrana marcate con GFP in eccesso. La genetica magnetotermica in tandem con le nanoparticelle legate alla membrana fornisce tre grandi vantaggi: In primo luogo, fornisce una migliore localizzazione e un targeting specifico per i neuroni. La regione di stimolazione è spazialmente meglio confinata in quanto il legame anticorpale limita la distanza che il MNP diffonde nel cervello(Figura 5-figure supplement 5). Inoltre, solo i tipi di cellule con il recettore di membrana specifico bersaglio dell’anticorpo si legano le nanoparticelle(Figura 5-figure supplement 6). In secondo luogo, il riscaldamento è limitato alla vicinanza della membrana. Ciò consente il targeting ortogonale in cui il canale TRPV1 è espresso in un tipo specifico di cellula e gli MNP sono mirati ad un secondo tipo di cellula, e la stimolazione magnetotermica si verificherebbe solo alla loro sinapsi. In terzo luogo, il targeting a membrana fornisce una migliore risoluzione temporale perché solo un minuscolo volume vicino alla membrana viene riscaldato e si raffredda immediatamente dopo la rimozione dell’AMF. Questo fornisce anche meno calore complessivo al cervello. Infine, abbiamo ottenuto un’attivazione robusta con appena 500 ng di nanoparticelle, che è 200 volte inferiore al volume della sospensione di nanoparticelle per la stimolazione dei neuroni cerebrali nei topi anestetizzati(Chen et al., 2015).
Una preoccupazione per la stimolazione magnetotermica può essere che i MNP sia direttamente o attraverso il riscaldamento della membrana inducono la morte cellulare. Abbiamo ripetuto con successo la stimolazione degli stessi animali per sette-otto prove per alcuni giorni senza osservare alcun cambiamento nel comportamento normale o evocato. Inoltre, l’istologia del cervello dopo 20 applicazioni di un minuto AMF, distribuiti in tre sessioni durante un periodo di 24 ore, ha mostrato neuroni decorati MNP intatti(Figura 5-figure supplemento 7). Quindi, se c’è qualche danno, non è rilevabile nell’istologia e nel comportamento. I danni termici possono essere evitati scegliendo l’intensità di campo sufficientemente piccola in modo che il raffreddamento all’ambiente limiti l’eventuale aumento di temperatura a pochi gradi.
Poiché la stimolazione genetica magnetotermica non richiede una connessione fisica con l’animale, offre una libertà senza precedenti nella progettazione di nuovi test comportamentali. Per esempio, diversi animali potrebbero condividere l’arena della stimolazione simultaneamente, e solo gli animali iniettati con MNP sarebbero interessati dall’AMF. Questo fornisce la capacità di studiare gli animali stimolati e non influenzati simultaneamente, sia come controlli che per studiare la loro interazione. L’assenza di un legame o di un impianto ha anche il vantaggio che gli animali non portano alcun marcatore esterno, che può interferire con il normale comportamento del gruppo sociale. Inoltre, esclusiva della stimolazione genetica magnetotermica, la stimolazione avviene solo quando l’animale si trova all’interno del campo magnetico. Quindi, l’adattamento della geometria del campo permette di controllare i tempi e le condizioni di stimolazione. Questo è l’ideale per i saggi che dipendono dallo spazio o dalla posizione, come i saggi di preferenza a più camere, quando gli animali devono essere stimolati solo quando sono in una camera.
Una limitazione dell’attuale implementazione della stimolazione genetica magnetotermica è la potenza necessaria per generare elevati campi elettromagnetici su un grande volume. In questo studio, una fonte di alimentazione di 7,5 kW ha prodotto l’AMF su un volume di 300 cm3. Tuttavia, fonti di energia più forti sono disponibili per produrre AMF in volumi più grandi, sufficienti a coprire l’intero cervello di primati non umani così come gli esseri umani. La stimolazione magnetotermica può fornire un’alternativa all’optogenetica per la stimolazione cerebrale profonda nei primati non umani. In primo luogo, i cervelli di grandi dimensioni si muovono in modo significativo rispetto al cranio, spostando potenzialmente gli elettrodi e le fibre di vetro dal loro obiettivo originale. Poiché il trasduttore per la stimolazione magnetotermica è attaccato alle cellule e non al cranio, la posizione di stimolazione rimane con le cellule originariamente bersaglio. In secondo luogo, l’attivazione del comportamento nei primati non umani può richiedere l’attivazione coordinata di diverse regioni cerebrali distinte e ogni regione può essere più grande del volume coperto da una fibra ottica(Han, 2012; Inoue et al., 2015). La stimolazione genetica magnetotermica può stimolare facilmente più sedi cerebrali distinte, in quanto l’erogazione del MNP è minimamente invasiva e il campo magnetico copre l’intero volume. Il volume effettivamente stimolato può essere controllato dalla quantità di MNP e dal tasso di iniezione. Pertanto, la stimolazione genetica magnetotermica è adatta per la stimolazione cerebrale profonda nei primati non umani.
Proprio come per altre tecniche genetiche, un ostacolo all’applicazione negli esseri umani sarà la preoccupazione per la sicurezza intorno all’iniezione di virus e nanoparticelle nel cervello. Tuttavia, la reazione del corpo alle iniezioni di nanoparticelle è stata ampiamente studiata e può essere minimizzata utilizzando un rivestimento superficiale di nanoparticelle biologicamente compatibile. La chirurgia cerebrale invasiva attualmente utilizzata per iniettare il MNP può essere presto sostituita dalla somministrazione di MNP attraverso il flusso sanguigno, come la recente ricerca ha dimostrato, che gli ultrasuoni focalizzati possono rendere transitoriamente la barriera emato-encefalica permeabile alle particelle di virus(Price, 2015). Nel complesso, la neurostimolazione magnetotermica offre una serie di vantaggi per la stimolazione cerebrale profonda o il silenziamento nei primati non umani e nei primati.
Materiali e metodi
Generazione di campi magnetici
I campi magnetici alternati sono stati generati da bobine raffreddate ad acqua, azionate da un generatore di potenza da 7,5 kW di MSI Automation. Lo strumento è separato in due unità(Figura 1C, Figura 1-figure supplement 4). La fonte di alimentazione (anche l’unità di controllo) era a una certa distanza dal microscopio, mentre lo stadio di testa, su cui è stata montata la bobina di ipertermia, è stato posizionato sopra lo stadio del microscopio attraverso un’apertura nell’incubatrice. La bobina è stata posta direttamente sopra la camera del campione. Circolando acqua raffreddato qualsiasi elemento resistivo nei sistemi. Il campo magnetico per tutti gli esperimenti in vitro è stato generato utilizzando una bobina di rame da 5 mm Ф, cinque giri. Le misurazioni del campo sul sito dei campioni sono state effettuate separatamente utilizzando una sonda magnetica Fluxtrol. Per gli studi in vivo, lo stesso strumento è stato utilizzato per alimentare una bobina di rame raffreddata ad acqua a due giri di 10 mm Ф (Figura 4A, Figura 4-figure supplement 5).
Preparazione di nanoparticelle magnetiche
Le nanoparticelle superparamagnetiche Co-Mn-Ferrite (MNP) con un diametro di 12,5 ± 1,0 nm (Figura 1D) sono statesintetizzate e caratterizzate secondo i metodi pubblicati (Zhang et al.,2015a). Il MNP sono stati trasferiti in acqua mediante rivestimento con PMA (poli-isobutilene-anidride maleica) a seguito di protocolli pubblicati (Lin et al., 2008). I MNP rivestiti con PMA sono stati funzionalizzati applicando covalentemente Neutravidina marcata fluorescente, che potrebbe poi legarsi ad un anticorpo biotinilato.
Sperimentale e teorica caratterizzazione magnetica nanoparticelle
I dati di magnetizzazione della ferritina della milza del cavallo sono stati generosamente condivisi con noi dal Dr. I. Orue (SGIker, Universidad del País Vasco UPV/EHU, 48940 Leioa, Spagna). I dati di magnetizzazione per il core-shell sintetizzato MNP, Co-Mn-Ferrite nanoparticelle (MNP) sono stati misurati anche dal Dr. I. Orue; Figura 1-figure supplement 1A . Per il calcolo dell’energia di interazione dei dipoli magnetici(Figura 1-figure supplement 1), MNP sferici sono stati assunti come dipoli puntiformi, con momenti allineati perpendicolarmente all’asse del dipolo. L’energia di interazione, quindi è data daU (r)=μ04πr3⋅(2μ2)
dove µ è il momento magnetico di singole nanoparticelle separate da una distanza r.
Per il calcolo dei valori di SLP(Figura 1-figure supplement 1), un valore di magnetizzazione di saturazione di 340 µB è stato utilizzato per la ferritina della milza del cavallo. La costante di anisotropia è stata ottenuta dai valori riportati(García-Prieto et al., 2016). La magnetizzazione di saturazione e la costante di anisotropia per i MNP del nucleo del guscio sono state ottenute da misurazioni precedenti(Zhang et al., 2015b). L’intensità del campo magnetico ammissibile per ogni punto di frequenza è stata calcolata utilizzando il limite accettato di attenuazione del campo (e conseguente riscaldamento a correnti parassite nei tessuti)(Atkinson et al., 1984; Chen et al., 2015). La potenza erogata in W/g di particelle è quindi data da:Pparticle=πμ0χ0H02f2πfτ1+(2πfτ)2
Qui, la suscettibilità magnetica χ0 segue l’equazione di Langevin ed è una funzione sia dell’ampiezza del campo magnetico H che T (Rosensweig,2002).
Termometria molecolare
Per misurare il riscaldamento locale vicino alla superficie delle cellule decorate con nanoparticelle, abbiamo utilizzato il fatto che la durata della fluorescenza e l’intensità dei fluorofori molecolari e delle proteine fluorescenti diminuiscono con l’aumentare della temperatura(Figura 1-figure supplement 3).
Etichettatura fluorescente della neutravidina e legame con i MNP
La neutravidina (31000, Thermo Scientific), disciolta in soluzione salina tamponata ai fosfati (PBS) a 2 mg/ml (pH 7,34), è stata etichettata con il colorante estere DyLightTM 550 NHS (62262, Life Technologies), o con il colorante Alexa 647 (A37573, Life technologies) miscelando la soluzione madre di neutravidina con cinque volte l’eccesso molare del fluoroforo e incubata al buio per 2 ore. Il colorante in eccesso (peso molecolare, sotto i 3 kDa) è stato rimosso utilizzando un filtro centrifugo Microcon 10 kDa (EMD Millipore), 8000 r.c.f. I gruppi carbossilici sulla superficie del PMA-MNP (1 mg/ml) sono stati attivati con 0.5 mg/ml di EDC [1-etil-3-(3-dimetilaminopropil) carbodiimmide cloridrato] (22980, tecnologie Life) e 1,4 mg/ml di Sulfo-NHS (N-hydroxysulfosuccinimide) (24510, tecnologie Life). Gli MNP attivati sono stati risospesi in PBS, e aggiunti a goccia alla Neutravidina -Dylight 550 o -Alexa 647, in eccesso molare 10 volte. Dopo aver reagito per due ore al buio, la reazione è stata estinta con 10 mM di tampone di idrossilammina. La neutrravidina non legata è stata rimossa lavando MNP in filtri a centrifuga da 300 kDa (8000 r.c.f.).
Microscopia a fluorescenza
Acquisizione di immagini e condizioni di imaging
Le intensità di fluorescenza di GCaMP6f come misura per i livelli di Ca2+, e di DyLight 550 dye (Life Technologies, Carlsbad, CA) come termometro molecolare, sono state registrate utilizzando un microscopio a epifluorescenza invertito (ZEISS AXIO OBSERVER A1.0m). Le cellule cresciute su coprioggetti in vetro da 12 mm sono state fissate in una camera non conduttiva (ALA MS-512DWPW) e poste sullo stadio XY del microscopio. Una camera di incubazione ambientale costruita su misura ha racchiuso il microscopio. La temperatura all’interno della camera è stato impostato prima dell’inizio dell’esperimento e mantenuto stabile a 33,0 ± 1,0 ° C. I fluorofori sono stati eccitati utilizzando una lampada ad arco corto di mercurio HBO 200 con filtri appropriati. L’emissione è stata raccolta con un obiettivo 40x NA 0,75 Zeiss e registrata con una telecamera Andor NEO sCMOS controllata da un software micromanager (Edelsteinet al., 2014). I video continui sono stati acquisiti con un tempo di esposizione di 100 ms a 2 × 2 binning, e salvati come pila di non compressi. File TIFF. L’otturatore Uniblitz electronics VS14S2T0, pilotato dal driver Uniblitz VCM-D1, è stato utilizzato per sincronizzare l’illuminazione della luce di eccitazione con i tempi di acquisizione della telecamera tramite il software micromanager.
Microscopia in campo magnetico alternato
I campi magnetici alternati inducono correnti parassite nell’obiettivo del microscopio metallico, riscaldandolo. L’espansione termica dell’obiettivo può causare distorsioni ottiche e cambiamenti di messa a fuoco. Per correggerle in tempo reale, abbiamo utilizzato un sistema piezoelettrico di autofocus veloce e personalizzato (Motion X Corporation, basato su interferometro laser a 780 nm). Il raggio laser autofocus è stato accoppiato nel percorso ottico del microscopio da uno specchio dicroico, focalizzato attraverso la lente dell’obiettivo sul fondo del coperchio e riflesso nell’interferometro(Figura 1-figure supplement 4). Pertanto, non solo rileva e corregge i cambiamenti nella separazione tra coprioggetti e lente dell’obiettivo, ma anche i cambiamenti ottici interni.
Etichettatura delle celle con MNP
Celle a T HEK 293
Le cellule HEK che crescono su vetrino coprioggetti da 12 mm, 50% confluenti sono state co-trasfettate con plasmidi che esprimono il braccio accettore della biotina AP-CFP-TM el’enzima BirA (p-DISPLAY) (Howarthet al., 2005) (0,4 µg ciascuno). Dopo la trasfezione, 5 uM di biotina sono stati somministrati alle cellule in crescita. 24 ore dopo i coprioggetti sono stati trasferiti alla camera di imaging (ALA MS-512DWPW) in 200 µl di soluzione salina fisiologica (PSS, ingredienti in mM: CaCl2 2, NaCl 151, MgCl2 1, KCl 5, HEPES 10, e glucosio 10, pH 7,3). MNP coniugato con neutravidina-DL550 (0,5 mg/ml) sono stati aggiunti (2 µl). Dopo 5 minuti, il piatto è stato perfuso con tampone PSS per rimuovere le particelle non legate.
Cultura neuronale
Nanoparticelle sono stati mirati alla membrana cellulare neuronale attraverso l’anticorpo IgM biotinilato (433110, Invitrogen). Colture neuronali coltivate su coprioggetti da 12 mm sono state caricate in camera di imaging (ALA scientifico) con 200 µl di tampone di imaging pH.7.34. Anticorpo biotinilato (2 µg / ml) è stato aggiunto, incubato per 10 minuti, prima di essere lavato via da perfusore con tampone HEPES pH 7,3. Nanoparticelle coniugate con neutravidina sono stati poi aggiunti a 10 µg / ml, e dopo 5 minuti le nanoparticelle non legate sono stati lavati via.
Clonazione molecolare e imballaggio virus
Il ratto TRPV1(VR1) in pcDNA3 è stato un regalo del Dr. Julius (UCSF). Il vettore lentivirus pLKO.1-EF1a-TRPV1-IRES-DSRed è stato costruito come segue. Un frammento di TRPV1 pcr (5′ Sal I e 3′ Hpa I) è stato subclonato in pLKO.1-EF1a-IRES-DSRed con un primer 5′ (5′-GCG TCG TCG TCG GTC GAC GCC ACC ATG GAA CAA CGG CGG GCT AGC TTA GAC TC-3′) e un primer 3′ (5′-GCG TCG TCG TCA AGC TTT TAT TTC TTC TCC CCT GGG ACC ATG GAA TC-3′). AAV5-hSyn-TRPV1 è stato costruito generando un frammento di TRPV1 pcr (5′ Sal I e 3′ EcoR I) con 5′ primer (5’GCG TCG TCG TCG TCG GTC GAC GCC GCC ACC ATG GAA CAA CGGG CGG GCT AGC TTA GAC TC-3′) e 3′ primer (5′-GCG TCG TCG TCG AAT TCT TCT TAT TTC TTC TCC CCT GGG ACC ATG GAA TC-3′). Il prodotto TRPV1 pcr è stato clonato in Sal I e EcoR I di pAAV-hSyn-HA-hM4D(Gi)-mCherry un regalo di Bryan Roth (Plasmide Addgene #50475). Tutti i costrutti sono stati verificati in sequenza. Il virus adeno-associato, AAV5-hSyn-TRPV1, è stato generato presso il Virus Vector Core della University of North Carolina a Chapel Hill. Il titolo qPCR era 1,5 × 1012. L’imballaggio del pLKO.1-EF1a-TRPV1-IRES-DSRed plasmid in lentivirus ha seguito i protocolli stabiliti(Boyden et al., 2005).
Esperimenti in vitro sui neuroni
Preparazione dei neuroni
Dopo la trasfezione o nucleofezione, le colture neuronali sono state messe in incubatrice per le successive 24-48 ore per esprimere le proteine. Durante questo tempo, 1 µM TTX (tetrodotossina) è stato aggiunto alla coltura neuronale per ridurre al minimo l’attività endogena. Per l’imaging, il TTX è stato lavato via, ei neuroni sono stati messi in soluzione di Tirode (NaCl 145, CaCl2 2, MgCl2 1, KCl 2.5, HEPES 10, Glucosio 20; tutto in mM). Il buffer di imaging conteneva anche i bloccanti sinaptici DLAP-5 25 µM, NBQX 10 µM, e Gabazina 20 µM, e l’osmolalità è stata regolata a 310-315 mOsmole/L.
Attivazione TRPV1 mediante tampone riscaldato
Le cellule neuronali ippocampali che esprimono transitoriamente GCaMP6f e il ratto TRPV1 sono state studiate per l’attivazione del TRPV1 tramite calore. GCaMP6f ha agito come marcatore per i neuroni nucleofected e come indicatore di calcio geneticamente codificato. TRPV1 attivazione per calore è stato raggiunto da perfusione di tampone di imaging preriscaldato (HEPES 10 mM, NaCl 140 mM, CaCl2 2 mM, MgCl2 1 mM, KCl 4 mM, glucosio 10 mM). I buffer di perfusione sono stati riscaldati utilizzando un riscaldatore in linea (SH-27B, Warner Instruments) con un feedback di temperatura integrato (TC-324C). La temperatura del bagno è stata monitorata utilizzando la sonda termica ottica Neoptix ReFlex. Una camera di alloggiamento per microscopio costruita su misura ha mantenuto la temperatura ambiente di 33 ± 1,0°C. Come misura di temperatura-driven TRPV1 attivazione guidata dalla temperatura, l’aumento transitorio nel livello intracellulare Ca2 + è stato registrato da GCaMP6f cambiamenti di intensità di fluorescenza GCaMP6f (Figura 1F; Figura 1-figure supplemento 2B; Figura 3B ).
Evocare e osservare il comportamento degli animali
Interventi sugli animali per l’iniezione stereotassica di virus o nanoparticelle
I topi maschi BALB/c (di 3-4 settimane, del peso di 15-20 g) sono stati ottenuti dai laboratori di Harlan, e alloggiati nella struttura per animali vivi (LAF) sotto il ciclo luce-buio di 12 ore in conformità con i protocolli approvati per gli animali dall’Università di Buffalo SUNY Institutional Animal Care.
I topi sono stati anestetizzati con una miscela di ketamina e xilazina (100 mg di ketamina e 10 mg di xilazina per chilogrammo di peso corporeo i.p.). Rupenorfina (0,1 mg per kg di peso corporeo, s.c.) è stato somministrato come antidolorifico pre-operatorio. Il topo anestetizzato è stato montato su un telaio stereotassico (Stoelting) con l’aiuto di barre auricolari e barre dentali. La testa è stata rasata e strofinata con betadine e poi etanolo. La pelle è stata ritratta e il periostio è stato rimosso sul sito. Il cuoio capelluto è stato aperto e il foro è stato praticato nel cranio, attraverso il quale è stato inserito nella corteccia motoria (MC) o striato1 (St1), o St2, a sinistra o a destra (vedi tabella supplementare 1 per le coordinate dell’iniezione). Utilizzando quella siringa e una pompa a siringa automatica (World Precision Instruments), 600 nl virus sono stati infettati ad una velocità di 2 nl/s. L’ago di iniezione è stato sollevato di 0,01 mm e mantenuto in posizione per 5-10 minuti e lentamente rimosso. Il cuoio capelluto del topo è stato suturato e Carprofen antinfiammatorio (5 mg/ml) è stato dato per 2 giorni dopo l’intervento. Tutte le procedure chirurgiche sono state effettuate in condizioni asettiche. Gli animali sono stati ospitati per 2 settimane per consentire l’espressione virale prima di qualsiasi esperimento comportamentale sono stati avviati.
Consegna delle nanoparticelle a sito mirato nel cervello
Moli uguali di MNP coniugati con Neutravidina e anticorpo biotinilato sono stati miscelati a 1 mg/ml. I topi sono stati anestetizzati con Xilazina e Ketamina, fissati in un telaio stereotassico, il periostio rimosso, e il foro pre-perforato dall’iniezione del virus 2-4 settimane prima è stato identificato. Poi, 600 nl di anticorpo MNP-anticorpo sono stati iniettati nello stesso sito dell’iniezione del virus 2 settimane prima, seguendo esattamente la stessa procedura (vedi sopra). La procedura è stata completata entro 45 minuti e i topi sono stati recuperati entro 1 ora, dopo l’anestesia. Gli animali sono stati messi in gabbia fresca e ospitati per 12 ore prima di iniziare l’esperimento.
Registrazione del comportamento degli animali
Per ogni sessione, gli animali sono stati collocati in un’area di osservazione circolare. Le sessioni sono state limitate a 30 min, di cui 10 min assuefazione, e 15-20 min esperimento, durante il quale sono state date tre o quattro applicazioni AMF 1-min lungo.
Una telecamera consumer (Nikon D810) è stata utilizzata per registrare video (HD720, 60fps) dei topi prima, durante e dopo la stimolazione del campo magnetico. Per la risposta di ‘congelamento dell’andatura’ causata dalla stimolazione nello striato, è stata utilizzata una diversa telecamera consumer (SONY DSC-H50) a 20fps. Per ridurre al minimo l’influenza della luce e delle ombre sul comportamento del mouse, i livelli di luce sono stati mantenuti estremamente bassi (sensibilità della telecamera impostata a ISO 12.800). I video (12-18 min di lunghezza, 1,2-2,4 Gb, non compressi) sono stati trasferiti su un computer iMac27′. Sui topi sono stati fatti dei segni rossi con comuni vernici atossiche per dita (Crayola) per facilitare il tracciamento del movimento tramite la visione al computer.
Analisi dei dati di calcio
I filmati di microscopia a fluorescenza sono stati registrati (Micromanager) come stack TIFF e i dati di post-elaborazione e ROI (regione di interesse) sono stati estratti utilizzando FIJI (Fiji Is Just ImageJ). I ROI rilevanti sono stati ritagliati dai file video e la registrazione (utilizzando il plugin Stack Registration) è stata effettuata per eliminare qualsiasi spostamento x-y delle immagini sui fotogrammi video. In seguito, è stata effettuata un’operazione di soglia basata sull’intensità per convertire i pixel di sfondo non dimmerabili a livello cellulare in NAN(Figura 3-figure supplement 1A). Un ROI poligonale è stato poi disegnato per coprire il corpo della cellula. I dati di intensità media (profondità di bit) di tutti i pixel all’interno di quel ROI sono stati salvati con i rispettivi numeri di fotogramma. I dati dell’intensità rispetto al tempo sono stati poi esportati in IgorPro, che è stato utilizzato per ulteriori analisi.
Normalizzazione dell’intensità
Dopo aver importato i dati di intensità media del ROI come onda in Igor Pro, sono stati sottratti i valori di rumore scuro costante da tutti i punti dell’onda. Il rumore scuro è il segnale medio registrato dalla telecamera in assenza di condizioni di illuminazione. Tutti gli esperimenti sono stati fatti nella stessa camera oscura e il valore del rumore scuro si è discostato di poco da un esperimento all’altro ed è per lo più dipendente dai tempi di esposizione della telecamera. Dopo, la cancellazione del rumore scuro, è stata effettuata un’ulteriore sottrazione della linea di base per la correzione del candeggio, se è stato osservato un sostanziale decadimento basato sul candeggio nella linea di base. Per questo, la linea di base è stata adattata ad una funzione esponenziale e si è ottenuto un segnale modificato secondo F(t)=F'(t)+(F'(0)-F’fit(t)). Qui, F'(t) è il valore del segnale ottenuto dopo la cancellazione del rumore scuro e F’fit(t) è la corrispondente funzione di adattamento esponenziale. Il risultato, così ottenuto, è stato normalizzato e convertito in variazione percentuale di fluorescenza. La variazione percentuale dell’intensità di fluorescenza è stata data da:ΔF(t)F0=F(t)-F0F0F0×100
dove, F0 è l’intensità del ROI della linea di base corretta per la candeggina e F(t), l’intensità in qualsiasi momento t.
Stima del singolo picco
Il cambiamento di intensità del GCaMP6f lo rende abbastanza sensibile per il rilevamento del potenziale di singola azione, ma la sua risoluzione temporale non è abbastanza alta da produrre picchi isolati temporalmente corrispondenti ad ogni sparo in un treno AP(Chen et al., 2013). Per estrarre gli eventi di potenziale d’azione da un segnale di fluorescenza GCaMP6f (picchi di Ca2+), abbiamo prima isolato tutti i picchi dai dati normalizzati di intensità corrispondenti a ciascun neurone con un massimo medio di circa il 5% (della linea di base). I picchi sono stati poi mediati e si è creato un profilo medio dei picchi(Figura 3-figure supplement 1B,C). L’onda di picco media è stata poi interpolata linearmente per aumentare la risoluzione temporale a 100 Hz.
Ricostruzione del treno AP
È stata creata un’onda nulla di lunghezza temporale pari a quella dei dati originali, ma di frequenza 100 Hz (a differenza di 10 Hz, per i dati originali). L’onda nulla è stata poi convertita in un’onda binaria, con 1 s nella posizione dei picchi AP stimati(Figura 3-figure supplement 1D,E; barre nere). L’onda di picco singola stimata è stata poi convoluta con l’onda binaria. Una sovrapposizione dei dati normalizzati e la corrispondente ricostruzione basata sulla convoluzione è mostrata in Figura 3-figure supplement 1D,E. Un istogramma del residuo dell’originale e delle onde ricostruite è stato adattato ad una funzione gaussiana. Le posizioni di 1 s nell’onda binaria sono state regolate dinamicamente per ottenere un sigma complessivo inferiore al 2%. L’onda binaria ottenuta dopo l’ottimizzazione ha dato la funzione temporale degli eventi AP per ogni registrazione.
Analisi comportamentale di topi in libero movimento
Tracciamento del movimento
Per tutte le analisi del comportamento del motore, la posizione del marcatore del collo rosso è stata registrata automaticamente utilizzando lo strumento gratuito di analisi video e modellazione TRACKER costruito da Douglas Brown sul framework Open Source Physics Java. Per le risposte motorie attive, è stato analizzato ogni secondo fotogramma, con il risultato di 30 misure di posizione al secondo. Le coordinate prodotte dal tracker sono state trasferite a IgorPro (Wavemetrics) per ulteriori analisi e grafici. Per il tracciamento del movimento della risposta del “congelamento dell’andatura”, la posizione di ogni zampa è stata tracciata ogni 1,2 s e la velocità del mouse è stata calcolata come valore assoluto della velocità lineare media su 3 s. Per altre registrazioni che coinvolgono movimenti rapidi del mouse, la velocità lineare e una velocità angolare sono riportate come media su 500 ms. Per visualizzare il movimento spaziale sono stati generati direttamente dalle coordinate XY grezze XY per visualizzare i diagrammi XY del movimento in finestre temporali selezionate. Per visualizzare il flusso temporale, tracciamo anche le coordinate XY in funzione del tempo.
Montaggio video per la presentazione
I video scelti per la pubblicazione sono stati editati utilizzando il software di editing video VSDC (Flash-Integro) e Lightworks. I video grezzi sono stati compressi utilizzando un encoder H.264 e sono stati ridimensionati a 15 fps e accelerati di 3X per il download e l’osservazione veloce. I segni rossi sul collo sono stati applicati per facilitare il tracciamento del movimento. I periodi di applicazione sul campo sono indicati in basso a destra, mentre i siti di iniezione MNP nel cervello sono indicati in basso a sinistra.
Istologia
Congelati sezioni coronali Rostrali a sezioni cerebrali caudali sono stati preparati seguendo i protocolli standard. Le fette di 75μm di spessore sono stati macchiati per la successiva imaging laser confocale.
Soma e dendriti dei neuroni sono stati contrassegnati con un coniglio anti-microtubuli-associati proteina (MAP2) anticorpo (ab32454, Abcam) (24 ore, 1:500), in combinazione con anti-coniglio IgG Alexa 488 (ab150077, Abcam) (1 ora).
Gli MNP rivestiti con PMA sono stati coniugati con Neutravidina, marcati con ATTO 488. Per aumentare il segnale di fluorescenza, alcune fette di cervello sono stati incubati con Biotin-PEG, etichettato con Alexa 647 colorante (24 ore, 1:500).
AAV5 o lenti-virus è stato utilizzato per la consegna del canale TRPV1 al cervello. Il lenti-virus ha consegnato anche un marcatore nucleare (NLS-mCherry). Poiché l’AAV5 non conteneva alcun marcatore, le fette di AAV sono state incubate con l’anticorpo anti-TRPV1 (ab31895, Abcam), che abbiamo coniugato direttamente con Alexa 647.
References
- Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Temporally precise in vivo control of intracellular signalling. Nature. 2009; 458:1025-1029. DOI | PubMed
- Arenkiel BR, Klein ME, Davison IG, Katz LC, Ehlers MD. Genetic control of neuronal activity in mice conditionally expressing TRPV1. Nature Methods. 2008; 5:299-302. DOI | PubMed
- Armbruster BN, Li X, Pausch MH, Herlitze S, Roth BL. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. PNAS. 2007; 104:5163-5168. DOI | PubMed
- Atkinson WJ, Brezovich IA, Chakraborty DP. Usable frequencies in hyperthermia with thermal seeds. IEEE Transactions on Bio-Medical Engineering. 1984; 31:70-75. DOI | PubMed
- Baffou G, Berto P, Bermúdez Ureña E, Quidant R, Monneret S, Polleux J, Rigneault H. Photoinduced heating of nanoparticle arrays. ACS Nano. 2013; 7:6478-6488. DOI | PubMed
- Banghart M, Borges K, Isacoff E, Trauner D, Kramer RH. Light-activated ion channels for remote control of neuronal firing. Nature Neuroscience. 2004; 7:1381-1386. DOI | PubMed
- Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain. Cell. 2009; 139:267-284. DOI | PubMed
- Bean CP, Livingston JD. Superparamagnetism. Journal of Applied Physics. 1959; 30:S129. DOI
- Boyden ES, Zhang F, Bamberg E, Nagel G, Deisseroth K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 2005; 8:1263-1268. DOI | PubMed
- Brown WF. Thermal fluctuations of a single-domain particle. Physical Review. 1963; 130:1677-1686. DOI
- Carvalho-de-Souza JL, Treger JS, Dang B, Kent SB, Pepperberg DR, Bezanilla F. Photosensitivity of neurons enabled by cell-targeted gold nanoparticles. Neuron. 2015; 86:207-217. DOI | PubMed
- Chen BT, Yau HJ, Hatch C, Kusumoto-Yoshida I, Cho SL, Hopf FW, Bonci A. Rescuing cocaine-induced prefrontal cortex hypoactivity prevents compulsive cocaine seeking. Nature. 2013; 496:359-362. DOI | PubMed
- Chen R, Romero G, Christiansen MG, Mohr A, Anikeeva P. Wireless magnetothermal deep brain stimulation. Science. 2015; 347:1477-1480. DOI | PubMed
- Edelstein AD, Tsuchida MA, Amodaj N, Pinkard H, Vale RD, Stuurman N. Advanced methods of microscope control using μManager software. Journal of Biological Methods. 2014; 1:10. DOI
- García-Prieto A, Alonso J, Muñoz D, Marcano L, Abad Díaz de Cerio A, Fernández de Luis R, Orue I, Mathon O, Muela A, Fdez-Gubieda ML. On the mineral core of ferritin-like proteins: structural and magnetic characterization. Nanoscale. 2016; 8:1088-1099. DOI | PubMed
- Gradinaru V, Mogri M, Thompson KR, Henderson JM, Deisseroth K. Optical deconstruction of parkinsonian neural circuitry. Science. 2009; 324:354-359. DOI | PubMed
- Gradinaru V, Thompson KR, Zhang F, Mogri M, Kay K, Schneider MB, Deisseroth K. Targeting and readout strategies for fast optical neural control in vitro and in vivo. Journal of Neuroscience. 2007; 27:14231-14238. DOI | PubMed
- Grandl J, Kim SE, Uzzell V, Bursulaya B, Petrus M, Bandell M, Patapoutian A. Temperature-induced opening of TRPV1 ion channel is stabilized by the pore domain. Nature Neuroscience. 2010; 13:708-714. DOI | PubMed
- Grewe BF, Langer D, Kasper H, Kampa BM, Helmchen F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nature Methods. 2010; 7:399-405. DOI | PubMed
- Han X. Optogenetics in the nonhuman primate. Progress in brain research. 2012; 196:213-233. DOI | PubMed
- Hooks BM, Mao T, Gutnisky DA, Yamawaki N, Svoboda K, Shepherd GM. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. Journal of Neuroscience. 2013; 33:748-760. DOI | PubMed
- Howarth M, Takao K, Hayashi Y, Ting AY. Targeting quantum dots to surface proteins in living cells with biotin ligase. Proceedings of the National Academy of Sciences. 2005; 102:7583-7588. DOI
- Huang H, Delikanli S, Zeng H, Ferkey DM, Pralle A. Remote control of ion channels and neurons through magnetic-field heating of nanoparticles. Nature Nanotechnology. 2010; 5:602-606. DOI | PubMed
- Inoue K, Takada M, Matsumoto M. Neuronal and behavioural modulations by pathway-selective optogenetic stimulation of the primate oculomotor system. Nature Communications. 2015; 6DOI | PubMed
- Kravitz AV, Freeze BS, Parker PR, Kay K, Thwin MT, Deisseroth K, Kreitzer AC. Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry. Nature. 2010; 466:622-626. DOI | PubMed
- Kreitzer AC, Malenka RC. Striatal plasticity and basal ganglia circuit function. Neuron. 2008; 60:543-554. DOI | PubMed
- Kügler S, Lingor P, Schöll U, Zolotukhin S, Bähr M. Differential transgene expression in brain cells in vivo and in vitro from AAV-2 vectors with small transcriptional control units. Virology. 2003; 311:89-95. DOI | PubMed
- Lee JH, Jang JT, Choi JS, Moon SH, Noh SH, Kim JW, Kim JG, Kim IS, Park KI, Cheon J. Exchange-coupled magnetic nanoparticles for efficient heat induction. Nature Nanotechnology. 2011; 6:418-422. DOI | PubMed
- Lein ES, Hawrylycz MJ, Ao N, Ayres M, Bensinger A, Bernard A, Boe AF, Boguski MS, Brockway KS, Byrnes EJ, Chen L, Chen L, Chen TM, Chin MC, Chong J, Crook BE, Czaplinska A, Dang CN, Datta S, Dee NR, Desaki AL, Desta T, Diep E, Dolbeare TA, Donelan MJ, Dong HW, Dougherty JG, Duncan BJ, Ebbert AJ, Eichele G, Estin LK, Faber C, Facer BA, Fields R, Fischer SR, Fliss TP, Frensley C, Gates SN, Glattfelder KJ, Halverson KR, Hart MR, Hohmann JG, Howell MP, Jeung DP, Johnson RA, Karr PT, Kawal R, Kidney JM, Knapik RH, Kuan CL, Lake JH, Laramee AR, Larsen KD, Lau C, Lemon TA, Liang AJ, Liu Y, Luong LT, Michaels J, Morgan JJ, Morgan RJ, Mortrud MT, Mosqueda NF, Ng LL, Ng R, Orta GJ, Overly CC, Pak TH, Parry SE, Pathak SD, Pearson OC, Puchalski RB, Riley ZL, Rockett HR, Rowland SA, Royall JJ, Ruiz MJ, Sarno NR, Schaffnit K, Shapovalova NV, Sivisay T, Slaughterbeck CR, Smith SC, Smith KA, Smith BI, Sodt AJ, Stewart NN, Stumpf KR, Sunkin SM, Sutram M, Tam A, Teemer CD, Thaller C, Thompson CL, Varnam LR, Visel A, Whitlock RM, Wohnoutka PE, Wolkey CK, Wong VY, Wood M, Yaylaoglu MB, Young RC, Youngstrom BL, Yuan XF, Zhang B, Zwingman TA, Jones AR. Genome-wide atlas of gene expression in the adult mouse brain. Nature. 2007; 445:168-176. DOI | PubMed
- Li N, Chen TW, Guo ZV, Gerfen CR, Svoboda K. A motor cortex circuit for motor planning and movement. Nature. 2015; 519:51-56. DOI | PubMed
- Lin CA, Sperling RA, Li JK, Yang TY, Li PY, Zanella M, Chang WH, Parak WJ. Design of an amphiphilic polymer for nanoparticle coating and functionalization. Small. 2008; 4:334-341. DOI | PubMed
- Lórenz-Fonfría VA, Heberle J. Channelrhodopsin unchained: structure and mechanism of a light-gated cation channel. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 2014; 1837:626-642. DOI | PubMed
- Mannix RJ, Kumar S, Cassiola F, Montoya-Zavala M, Feinstein E, Prentiss M, Ingber DE. Nanomagnetic actuation of receptor-mediated signal transduction. Nature Nanotechnology. 2008; 3:36-40. DOI | PubMed
- Meister M. Physical limits to magnetogenetics. eLife. 2016; 5DOI | PubMed
- Moore ST, MacDougall HG, Ondo WG. Ambulatory monitoring of motor fluctuations in Parkinson’s disease. Journal of Neuroscience Methods. 2008; 167:340. DOI | PubMed
- Nieh EH, Kim SY, Namburi P, Tye KM. Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors. Brain Research. 2013; 1511:73-92. DOI | PubMed
- Oh SW, Harris JA, Ng L, Winslow B, Cain N, Mihalas S, Wang Q, Lau C, Kuan L, Henry AM, Mortrud MT, Ouellette B, Nguyen TN, Sorensen SA, Slaughterbeck CR, Wakeman W, Li Y, Feng D, Ho A, Nicholas E, Hirokawa KE, Bohn P, Joines KM, Peng H, Hawrylycz MJ, Phillips JW, Hohmann JG, Wohnoutka P, Gerfen CR, Koch C, Bernard A, Dang C, Jones AR, Zeng H. A mesoscale connectome of the mouse brain.. Nature. 2014; 508:207-221. DOI | PubMed
- Pankhurst QA, Thanh NTK, Jones SK, Dobson J. Progress in applications of magnetic nanoparticles in biomedicine. Journal of Physics D: Applied Physics. 2009; 42DOI
- Price R. Ultrasound-targeted nanoparticle delivery across the blood-brain barrier. Journal of Therapeutic Ultrasound. 2015; 3DOI
- Rosensweig RE. Heating magnetic fluid with alternating magnetic field. Journal of Magnetism and Magnetic Materials. 2002; 252:370-374. DOI
- Stanley SA, Gagner JE, Damanpour S, Yoshida M, Dordick JS, Friedman JM. Radio-wave heating of iron oxide nanoparticles can regulate plasma glucose in mice. Science. 2012; 336:604-608. DOI | PubMed
- Stanley SA, Sauer J, Kane RS, Dordick JS, Friedman JM. Remote regulation of glucose homeostasis in mice using genetically encoded nanoparticles. Nature Medicine. 2015; 21:92-98. DOI | PubMed
- Stefanik MT, Moussawi K, Kupchik YM, Smith KC, Miller RL, Huff ML, Deisseroth K, Kalivas PW, LaLumiere RT. Optogenetic inhibition of cocaine seeking in rats. Addiction Biology. 2013; 18:50-53. DOI | PubMed
- Studer M, McNaughton PA. Modulation of single-channel properties of TRPV1 by phosphorylation. The Journal of Physiology. 2010; 588:3743-3756. DOI | PubMed
- Thorne RG, Nicholson C. In vivo diffusion analysis with quantum dots and dextrans predicts the width of brain extracellular space. Proceedings of the National Academy of Sciences. 2006; 103:5567-5572. DOI | PubMed
- Tye KM, Prakash R, Kim SY, Fenno LE, Grosenick L, Zarabi H, Thompson KR, Gradinaru V, Ramakrishnan C, Deisseroth K. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 2011; 471:358-362. DOI | PubMed
- Urban DJ, Roth BL. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 2015; 55:399-417. DOI | PubMed
- Walsh V, Cowey A. Transcranial magnetic stimulation and cognitive neuroscience. Nature Reviews Neuroscience. 2000; 1:73-80. DOI | PubMed
- Wheeler MA, Smith CJ, Ottolini M, Barker BS, Purohit AM, Grippo RM, Gaykema RP, Spano AJ, Beenhakker MP, Kucenas S, Patel MK, Deppmann CD, Güler AD. Genetically targeted magnetic control of the nervous system. Nature Neuroscience. 2016; 19:756-761. DOI | PubMed
- Xu C, Sun S. New forms of superparamagnetic nanoparticles for biomedical applications. Advanced Drug Delivery Reviews. 2013; 65:732-743. DOI | PubMed
- Yaksi E, Friedrich RW. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nature Methods. 2006; 3:377-383. DOI | PubMed
- Young JH, Wang M-T, Brezovich IA. Frequency/depth-penetration considerations in hyperthermia by magnetically induced currents. Electronics Letters. 1980; 16:358-359. DOI
- Zhang Q, Castellanos-Rubio I, Munshi R, Orue I, Pelaz B, Gries KI, Parak WJ, del Pino P, Pralle A. Model driven optimization of magnetic anisotropy of exchange-coupled core–shell ferrite nanoparticles for maximal hysteretic loss. Chemistry of Materials. 2015a; 27:7380-7387. DOI | PubMed
- Zhang S, Gao H, Bao G. Physical principles of nanoparticle cellular endocytosis. ACS Nano. 2015b; 9:8655-8671. DOI | PubMed
- Zhu Y, Wienecke CF, Nachtrab G, Chen X. A thalamic input to the nucleus accumbens mediates opiate dependence. Nature. 2016; 530:219-222. DOI | PubMed
Fonte
Munshi R, Qadri SM, Zhang Q, Castellanos Rubio I, del Pino P, et al. () Magnetothermal genetic deep brain stimulation of motor behaviors in awake, freely moving mice. eLife 6e27069. https://doi.org/10.7554/eLife.27069





