Abstract
Introduzione
Gli strumenti di valutazione del rischio di diabete sono utilizzati per identificare le persone a maggior rischio di diabete in modo da poter effettuare esami del sangue e per indirizzare gli interventi per ridurre il rischio. Il primo modello di QDiabetes per stimare il rischio di diabete di tipo 2 a 10 anni è stato pubblicato nel 2009.1 Da allora è stato aggiornato regolarmente e ricalibrato all’ultima versione del database QResearch; anche la fascia di età in cui si applica è stata estesa, da 25-79 a 25-84 anni, il fumo è valutato a cinque livelli invece che a due, e il punteggio di Townsend è stato aggiornato utilizzando i valori più recenti del censimento del 2011.234Ciò contribuisce a garantire che l’algoritmo rifletta i cambiamenti nelle caratteristiche della popolazione (come i cambiamenti nella prevalenza del fumo, nell’indice di massa corporea e nell’incidenza del diabete di tipo 2) e i miglioramenti nella qualità dei dati, come una migliore registrazione dei fattori di rischio o l’accertamento del diabete. Gli algoritmi del QDiabetes sono stati convalidati da noi stessi e da altri in gruppi indipendenti di pazienti utilizzando database di cure primarie del Regno Unito come QResearch,5 Clinical Practice Research Datalink (CPRD),5 e The Health Improvement Network (THIN).6 Gli algoritmi sono stati validati in modo indipendente ed esterno in popolazioni internazionali e confrontati con altri modelli di previsione del rischio diabete e hanno dimostrato di avere le migliori prestazioni.7 L’uso del QDiabetes è stato valutato anche in studi osservazionali e revisioni sistematiche.8
9
10
11
QDiabetes è ora integrato nei principali sistemi informatici di medicina generale del Regno Unito e utilizzato all’interno del Servizio Sanitario Nazionale del Regno Unito. È raccomandato nei controlli sanitari del NHS e nelle linee guida del National Institute for Health and Care Excellence dell’Istituto nazionale per la salute e l’assistenza sanitaria (National Institute for Health and Care Excellence) sulla prevenzione del diabete di tipo 2 nelle persone ad alto rischio.1213Viene utilizzato anche in contesti di salute sul lavoro e a livello internazionale attraverso il sito web pubblico sul QDiabetes(www.qdiabetes.org). Un recente aggiornamento della linea guida del NICE sulla prevenzione del diabete nel 2017 ha messo in evidenza diverse condizioni associate all’aumento del rischio di diabete che potrebbero non essere completamente catturate dal QDiabetes.14 Queste includono la sindrome dell’ovaio policistico, il diabete gestazionale, le difficoltà di apprendimento e i problemi di salute mentale.15 Inoltre, vi sono ora buone prove, sia da studi clinici che da studi osservazionali, che gli antipsicotici atipici e le statine sono associati a un aumento del rischio di diabete.161718191920212223Questi fattori non sono specificamente identificati nell’ambito del diabete QD, il che può comportare una sottovalutazione del rischio nei gruppi di pazienti interessati.
Una volta che i pazienti con un aumentato rischio di sviluppare il diabete sono stati identificati utilizzando uno strumento di valutazione del rischio di diabete come il QDiabetes, allora le linee guida raccomandano di sottoporsi a un test della glicemia, sia per l’emoglobina glicata (HBA1c) che per il glucosio nel sangue a digiuno.121324Questo serve a determinare chi ha già il diabete; chi è ad alto rischio di progressione verso il diabete di tipo 2 e chi è a rischio moderato.13 Le linee guida internazionali differiscono in merito alle soglie di glucosio nel sangue a digiuno e HBA1c da utilizzare per definire il gruppo ad alto rischio, soprattutto a causa della mancanza di dati basati sulla popolazione su cui basare le analisi.2526Ad esempio, le linee guida americane raccomandano una concentrazione di glucosio nel sangue a digiuno di 5,6-6,9 mmol/L o un valore HBA1c di 39-46 mmol/mol (5,7-6,4%). Le linee guida britanniche raccomandano una concentrazione di glucosio nel sangue a digiuno di 5,5-6,9 mmol/L o un valore HBA1c di 42-47 mmol/mol (6,0-6,4%).12
Gli strumenti di valutazione del rischio ampiamente utilizzati non incorporano i risultati di nessuno dei due esami del sangue, rendendo difficile fornire ai pazienti una stima accurata del loro livello di rischio assoluto dopo un esame del sangue. Abbiamo quindi derivato e convalidato una nuova versione dell’equazione (QDiabetes-2018) per determinare se questi fattori debbano essere incorporati nell’equazione e come possano essere utilizzati per migliorare la stima del rischio diabete e la comunicazione con i pazienti, nonché per migliorare la progettazione di strategie di valutazione del rischio diabete basate sulla popolazione.
Metodi
Progettazione dello studio e fonte dei dati
Abbiamo intrapreso uno studio di coorte in un’ampia popolazione di pazienti di cure primarie in Inghilterra che sono stati registrati con pratiche che contribuiscono al database QResearch (versione 42). EMIS Health è il principale fornitore commerciale di sistemi informatici di medicina generale nel Regno Unito ed è utilizzato da circa 4400 studi medici. Si tratta di circa il 58% di tutti i 7613 studi medici generici in Inghilterra (NHS Information Centre, marzo 2016). Di queste, 1503 (34,2%) contribuiscono al database di QResearch. Abbiamo incluso tutte le pratiche inglesi che contribuiscono a QResearch e che hanno utilizzato il loro sistema informatico EMIS Health per almeno un anno. Abbiamo assegnato a caso tre quarti delle pratiche al set di dati di derivazione e il restante quarto a un set di dati di convalida. Abbiamo identificato una coorte aperta di pazienti di età compresa tra i 25 e gli 84 anni registrati con pratiche tra il 1° gennaio 2005 e il 31 dicembre 2016. Abbiamo escluso i pazienti che non avevano un punteggio Townsend correlato al codice postale (questi di solito derivano da pazienti che si trasferiscono in case di nuova costruzione con nuovi codici postali non ancora collegati ai dati sulla deprivazione, o da pazienti che sono senza fissa dimora o che non hanno una residenza permanente) e quelli con diabete di tipo 1 o 2 preesistente. Abbiamo anche escluso quelli con una concentrazione di glucosio nel sangue a digiuno pari o superiore a 7 mmol/L o con un valore di HBA1c pari o superiore a 48 mmol/mol in quanto questi pazienti potrebbero essere in procinto di sottoporsi ad ulteriori esami per confermare una diagnosi di diabete. Per ogni paziente abbiamo determinato una data di ingresso nella coorte, che era l’ultima delle seguenti: 25° compleanno, data di iscrizione allo studio più un anno, data di installazione del sistema informatico dello studio più un anno e inizio del periodo di studio (1° gennaio 2005). I pazienti sono stati censurati alla prima data della diagnosi di diabete di tipo 2, del decesso, della cancellazione dallo studio, dell’ultimo caricamento di dati computerizzati o della data di fine studio (31 dicembre 2016).
Risultati
La nostra principale misura di outcome è stata la prima diagnosi (incidente) di diabete mellito di tipo 2, come registrato nei registri del computer di medicina generale. Abbiamo identificato i pazienti affetti da diabete cercando nella cartella clinica elettronica i codici diagnostici per il diabete (C10%). Come in altri studi, abbiamo classificato i pazienti con diabete di tipo 2 se avevano una diagnosi di diabete e non gli era stata prescritta l’insulina di età inferiore ai 35 anni.1
27
28
Variabili predittive
Abbiamo esaminato le seguenti variabili predittive basate su fattori di rischio già inclusi nell’attuale versione di QDiabetes-2017 e le nuove variabili candidate evidenziate in letteratura o nelle linee guida del NICE. Laddove le diagnosi sono menzionate, esse si riferiscono ai codici diagnostici registrati nella cartella clinica elettronica dei pazienti alla data di entrata nello studio o prima di essa.
Variabili esistenti di QDiabetes (versione attuale 2017)
- – Età all’ingresso dello studio (linea di base)
- – Etnia (nove categorie)
- – Deprivazione (misurata dal punteggio di Townsend, dove valori più alti indicano livelli più alti di deprivazione materiale)
- – Indice di massa corporea
- – Stato di fumo: non fumatore, ex fumatore, fumatore leggero (1-9/giorno), fumatore moderato (10-19/giorno), fumatore pesante (≥20/giorno)
- – Anamnesi familiare di diabete in un parente di primo grado
- – Malattia cardiovascolare (cardiopatia ischemica, ictus o attacco ischemico transitorio)
- – Ipertensione trattata (diagnosi di ipertensione e trattamento attuale con almeno un farmaco antipertensivo)
- – Corticosteroidi (British National Formulary capitolo 6.3.2, comprese le iniezioni di prednisolone sistemico, betametasone, cortisone, depo-medrone, desametasone, deflazacort, efcortesolo, idrocortisone, metilprednisolone o triamcinolone)
Fattori di rischio nuovi o modificati considerati
- – Diagnosi di schizofrenia o disturbo affettivo bipolare
- – Disabilità di apprendimento
- – Diagnosi del diabete gestazionale
- – Diagnosi della sindrome dell’ovaio policistico
- – Antipsicotici “atipici” di seconda generazione (tra cui amisulpride, aripiprazolo, clozapina, lurasidone, olanzapina, paliperidone, quetiapina, risperidone, sertindolo e zotepina)
- – Statine prescritte
- – Livello di glucosio nel sangue a digiuno
- – Valore dell’emoglobina glicata (HBA1c)
Dal registro della medicina generale abbiamo estratto i dati sui fattori demografici, le diagnosi cliniche e i valori clinici. Abbiamo selezionato il valore più vicino all’ingresso della coorte per l’indice di massa corporea, lo stato di fumo, il livello di glucosio nel sangue a digiuno e il livello di HBA1c, limitandoci ai valori registrati prima della linea di base. L’uso di farmaci al basale è stato definito come almeno due prescrizioni in totale, con la più recente non più di 28 giorni prima della data di ingresso nella coorte. Tutte le altre variabili predittive si sono basate sulle ultime informazioni registrate nel registro della medicina generale prima dell’ingresso nella coorte.
Derivazione e convalida dei modelli
Abbiamo sviluppato e convalidato le equazioni di previsione del rischio utilizzando metodi consolidati.1029303132È stata eseguita un’analisi iniziale basata su pazienti con dati completi. Abbiamo utilizzato l’imputazione multipla con equazioni concatenate per sostituire i valori mancanti per l’indice di massa corporea, l’HBA1c, il glucosio nel sangue a digiuno e lo stato di fumo e abbiamo utilizzato questi valori nelle nostre analisi principali.333435Affinché i valori imputati corrispondessero meglio alla distribuzione dei valori osservati, abbiamo registrato i valori trasformati per le variabili continue che non erano normalmente distribuite per l’inclusione nel modello di imputazione. In quel modello abbiamo incluso tutte le variabili predittive, insieme allo stimatore Nelson-Aalen dello stimatore del rischio cumulativo di base e all’indicatore di risultato. Abbiamo effettuato cinque imputazioni, poiché questo ha un’efficienza relativamente elevata36 ed è stato un approccio pragmatico che ha tenuto conto della dimensione dei set di dati e della capacità dei server e del software disponibili. Lo stesso set di dati imputati è stato utilizzato per tutte le analisi di derivazione.
Per stimare separatamente i coefficienti per ogni fattore di rischio negli uomini e nelle donne abbiamo utilizzato i modelli di rischio proporzionali di Cox. Abbiamo usato le regole di Rubin per combinare i risultati attraverso i dataset imputati.37 Abbiamo usato polinomi frazionari38 per modellare relazioni di rischio non lineari con variabili continue. Abbiamo selezionato termini polinomiali frazionari di secondo grado derivati usando i dati di pazienti con valori registrati.39 Prima di eseguire i modelli Cox abbiamo applicato i termini polinomiali frazionari ai dati imputati. Inizialmente abbiamo montato modelli completi. Per coerenza, abbiamo incluso le variabili dei modelli di QDiabetes esistenti e poi abbiamo mantenuto variabili aggiuntive se avevano un rapporto di rischio aggiustato inferiore a 0,90 o superiore a 1,10 (per le variabili binarie) ed erano statisticamente significative a livello 0,01. Abbiamo utilizzato questi criteri in combinazione con il giudizio clinico per garantire che le variabili dei candidati fossero probabilmente importanti dal punto di vista clinico e per ridurre la possibilità di includere predittori deboli o non informativi che potrebbero portare a un eccessivo adattamento del modello e all’ottimismo.40 Abbiamo esaminato le interazioni tra le nuove variabili predittive e l’età all’ingresso nello studio e abbiamo incluso interazioni significative nei modelli finali insieme alle interazioni già incluse nella versione attuale di QDiabetes. Per confrontare l’adattamento e le prestazioni dei diversi modelli nella coorte di derivazione abbiamo utilizzato il criterio informativo Akaikes.
Abbiamo sviluppato tre modelli principali. Il modello A includeva le variabili dei modelli di QDiabetes esistenti e le variabili aggiuntive che soddisfacevano i nostri criteri di inclusione, ma non includeva né il glucosio nel sangue a digiuno né l’HBA1c. Il modello B è lo stesso del modello A, tranne che includeva la glicemia a digiuno ma non l’HBA1c. Il modello C è lo stesso del modello A, tranne per il fatto che includeva la glicemia a digiuno ma non la glicemia a digiuno.
Abbiamo usato i coefficienti di regressione per ogni variabile dei modelli finali come pesi, che abbiamo combinato con stime non parametriche della funzione di sopravvivenza della linea di base,41 valutate per ogni anno fino a 10 anni per ricavare equazioni di rischio in 10 anni di follow-up.42 Ciò ci ha permesso di ricavare stime di rischio per ogni anno di follow-up, con particolare attenzione alle stime di rischio a 10 anni. Abbiamo stimato la funzione di sopravvivenza di base basata su valori zero di variabili continue centrate, con tutti i valori dei predittori binari impostati a zero.
Convalida dei modelli
Nella coorte di convalida abbiamo usato l’imputazione multipla per sostituire i valori mancanti per l’indice di massa corporea, la glicemia a digiuno, l’HBA1c e lo stato di fumo. Abbiamo effettuato cinque imputazioni. Le equazioni di rischio per uomini e donne ottenute dalla coorte di derivazione sono state poi applicate alla coorte di convalida e sono state calcolate le misure di discriminazione. Come negli studi precedenti,5 abbiamo calcolato la statistica D43 (una misura della discriminazione dove valori più alti indicano una migliore discriminazione), il valore R2 (variazione spiegata dove valori più alti indicano una maggiore proporzione di variazione spiegata dal modello nel tempo alla diagnosi di diabete di tipo 244) basata sulla statistica D di Royston, e la statistica C di Harrell a 10 anni e le abbiamo combinate tra i set di dati utilizzando le regole di Rubin. La statistica C di Harrell45è una misura di discriminazione simile alla statistica delle caratteristiche operative del ricevitore, ma tiene conto della natura censurata dei dati.
La calibrazione è stata valutata confrontando il rischio medio previsto a 10 anni con il rischio osservato di 10 del rischio previsto. I rischi osservati sono stati ottenuti utilizzando le stime di Kaplan-Meier valutate a 10 anni. Abbiamo anche valutato le prestazioni per sottogruppi per ogni fascia d’età (<40, 40-59, ≥60 anni), gruppo etnico minoritario e comorbilità e gruppo di trattamento. Abbiamo calcolato le pendenze di calibrazione. Le prestazioni sono state valutate anche calcolando le statistiche C di Harrell nelle singole pratiche generali e combinando i risultati utilizzando tecniche meta-analitiche.46
Applicando ogni equazione al set di dati di convalida abbiamo confrontato le statistiche di performance dei nuovi modelli QDiabetes-2018 con l’ultima versione di QDiabetes (versione 2017).
Stratificazione del rischio
Per il modello A abbiamo calcolato la sensibilità, la specificità e i rischi osservati a diverse soglie di rischio nella coorte di convalida.
Abbiamo anche confrontato le prestazioni dei modelli con le attuali raccomandazioni dell’approccio “a due fasi” raccomandato nella guida del NICE “Prevenzione del rischio di diabete di tipo 2” 13 e nella guida alle migliori pratiche del NHS Health Checks.12 La fase 1 attualmente prevede l’utilizzo di uno strumento di valutazione del rischio come il QDiabetes per identificare i pazienti ad “alto rischio”, dove per QDiabetes l’alto rischio è definito come coloro che hanno un rischio decennale di diabete di tipo 2 del 5,6% o superiore.12 Questa soglia sembra essere stata selezionata prevalentemente per ottimizzare la sensibilità (cioè per evitare casi mancanti di diabete di tipo 2). La fase 2 prevede un esame del sangue per le persone identificate ad alto rischio per valutare se hanno il diabete di tipo 2 non diagnosticato e nei pazienti rimanenti per stratificare più accuratamente il rischio di progressione verso il diabete. Questo esame del sangue può essere sia per la glicemia a digiuno che per l’HBA1c nei pazienti ad alto rischio per classificare i pazienti in uno dei tre gruppi: glicemia a digiuno ≥7 mmol/L o HBA1c ≥48 mmol/mol = diagnosi di diabete (o ulteriori esami necessari per la conferma se il paziente non ha sintomi); glicemia a digiuno 5.5. 5-6,9 mmol/L o HBA1c 42-47 mmol/mol = “alto rischio di diabete” per consigli di stile di vita intensivi o programmi di intervento; e glicemia a digiuno <5,5 mmol/L o HBA1c <42 mmol/mol = “rischio moderato di diabete” per semplici consigli di stile di vita.
I modelli aggiornati di QDiabetes sono stati progettati per supportare tale approccio, con il modello A inteso per identificare i pazienti con un rischio aumentato per i quali si potrebbe fare un esame del sangue. I due ulteriori modelli (il modello B, che comprende il glucosio nel sangue a digiuno, e il modello C, che comprende l’HBA1c) hanno potuto essere utilizzati per perfezionare lo strumento di valutazione del rischio, una volta disponibile il relativo risultato dell’esame del sangue. La valutazione del rischio a questo punto potrebbe anche consentire la comunicazione di una stima del rischio più accurata per i pazienti per informare il loro processo decisionale e i loro piani di gestione.
Per confrontare le prestazioni dei modelli con le raccomandazioni attuali, abbiamo calcolato la sensibilità per quattro diverse strategie per classificare i pazienti come ad alto rischio di progressione per il diabete utilizzando la coorte di validazione. I pazienti sono stati classificati come ad alto rischio se avevano un punteggio iniziale di rischio QDiabete a 10 anni pari o superiore al 5,6% (utilizzando il modello A) e (i) avevano una concentrazione di glucosio nel sangue a digiuno compresa tra 5,5 e 6.9 mmol/L (strategia 1), (ii) un valore HBA1c compreso tra 42 e 47 mmol/mol (strategia 2), (iii) un punteggio di rischio nel primo 28% dei punteggi di rischio utilizzando il modello B (che include i valori della glicemia a digiuno) per corrispondere al numero di pazienti ad alto rischio per la strategia 1 (strategia 3), e (iv) un punteggio di rischio nel primo 28% dei punteggi di rischio utilizzando il modello C (che include i valori HBA1c) per corrispondere al numero di pazienti ad alto rischio per le strategie 1 e 3 (strategia 4).
Analisi della curva decisionale
Per valutare i benefici netti delle equazioni di rischio aggiornate abbiamo utilizzato l’analisi della curva di decisione nella coorte di convalida.474849Questo approccio valuta i benefici della corretta individuazione delle persone che svilupperanno il diabete di tipo 2 rispetto ai danni derivanti da una classificazione falso positivo (che potrebbe portare a interventi non necessari). Il beneficio netto di un’equazione di rischio a una determinata soglia di rischio è dato dal calcolo della differenza tra la proporzione di veri positivi e la proporzione di falsi positivi moltiplicata per le probabilità definite per il valore della soglia di rischio.48 Abbiamo calcolato i benefici netti dei modelli A, B e C attraverso una gamma di probabilità di soglia e li abbiamo confrontati con strategie alternative, come l’ipotesi che nessun paziente svilupperà il diabete di tipo 2 (nessun intervento) o l’ipotesi che tutti i pazienti svilupperanno il diabete di tipo 2 (intervento in tutti i pazienti). In generale, la strategia con il più alto beneficio netto a qualsiasi soglia di rischio è considerata quella con il maggior valore clinico.
Per massimizzare la potenza e la generalizzabilità dei risultati, abbiamo utilizzato tutti i pazienti rilevanti del database. Per tutte le analisi è stato utilizzato Stata (versione 14). Abbiamo aderito alla dichiarazione TRIPOD per la segnalazione.40
Coinvolgimento del paziente
Dalla pubblicazione originale di QDiabetes-2009 si è svolta una discussione pubblica sui metodi di valutazione del rischio diabete nell’ambito dello sviluppo delle linee guida del NICE e dei controlli sanitari del NHS.50 Abbiamo quindi deciso di concentrarci sulle questioni già individuate nelle linee guida del NICE e nella letteratura. Abbiamo deciso che sarebbe stato più efficace discutere l’aggiunta di nuove variabili una volta pubblicato il documento e quantificata l’importanza relativa dei singoli fattori di rischio. Data l’ampia diffusione del QDiabetes all’interno del NHS e la sua inclusione nelle linee guida, ciò consentirebbe di ottenere un feedback dalle parti interessate (compresi i gruppi di pazienti e gli enti di beneficenza) su quali cambiamenti sarebbero più vantaggiosi e su come potrebbero essere implementati i miglioramenti.
Risultati
Popolazione studiata
Nel complesso, 1457 pratiche di QResearch in Inghilterra hanno soddisfatto i nostri criteri di inclusione (il 96,9% di tutte le pratiche che contribuiscono a QResearch). Di queste, tre quarti (n=1094) sono stati assegnati in modo casuale al set di dati di derivazione, mentre il restante quarto (n=363) è stato assegnato a una coorte di convalida. Abbiamo identificato 8-640-363 pazienti nella coorte di derivazione di età compresa tra i 25 e gli 84 anni, di cui abbiamo escluso in sequenza 26 602 (0,3%) che non avevano un punteggio Townsend registrato, 3495 (0,4%) che avevano una diagnosi di diabete di tipo 1 al basale, 342 858 (4).0%) che aveva una diagnosi di diabete di tipo 2 al basale, 23&522 (0,3%) con una concentrazione di glucosio nel sangue a digiuno di 7 mmol/L o più al basale, e 26&481 (0,3%) con un valore HBA1c di 48 mmol/mol o più al basale. Questo ha lasciato 8 -186 – 705 per l’analisi di derivazione.
Abbiamo identificato 2 779 075 pazienti nella coorte di validazione di età compresa tra i 25 e gli 84 anni, di cui abbiamo escluso sequenzialmente 7971 (0,3%) che non avevano un punteggio Townsend registrato, 11 076 (0.4%) che avevano una diagnosi di diabete di tipo 1 al basale, 113-653 (4,1%) che avevano una diagnosi di diabete di tipo 2 al basale, 7758 (0,3%) con un glucosio nel sangue a digiuno di 7 mmol/L o più, e 8677 (0,3%) con una concentrazione di HBA1c di 48 mmol/mol o più al basale. Questo ha lasciato 2-629-940 per l’analisi di convalida.
Caratteristiche di base
La tabella 1 mostra le caratteristiche di base di uomini e donne nelle coorti di derivazione e di convalida. Nella coorte di derivazione, l’età media era di 44,9 (SD 15,3) anni, e 4-062-142 (49,6%) erano uomini. L’etnia auto-assegnata è stata registrata in 5933-548 (72,5%), lo stato di fumo in 7 834-644 (95,7%), l’indice di massa corporea in 6 482691 (79,2%), il glucosio nel sangue a digiuno in 1 189-398 (14,5%), e HBA1c in 506-776 (6,2%). In totale, 6-453-196 (78,8%) avevano informazioni complete per lo stato del fumo e l’indice di massa corporea, e 1-367-483 (16,7%) avevano informazioni complete per il fumo, l’indice di massa corporea e la glicemia a digiuno o HBA1c. Questi valori erano simili ai valori corrispondenti nella coorte di convalida (tabella 1).
| Caratteristiche | Coorte di derivazione (n=8-186-705) | Coorte di convalida (n=2-629-940) |
|---|---|---|
| Uomini | 4 062 142 (49.6) | 1 307 505 (49.7) |
| Donne | 4 124 563 (50.4) | 1 322 435 (50.3) |
| Età media (SD) (anni) | 44.9 (15.3) | 45.6 (15.5) |
| Media (SD) Punteggio di Townsend | 0.5 (3.3) | 0.2 (3.2) |
| Indice di massa corporea registrato | 6 482 691 (79.2) | 2 03 3369 (77.3) |
| Indice di massa corporea medio (SD) | 26.0 (5.0) | 26.0 (5.0) |
| Glicemia a digiuno registrata | 1 189 398 (14.5) | 373 808 (14.2) |
| Glicemia a digiuno (mmol/L) | 5.0 (0.6) | 5.0 (0.6) |
| HBA1c registrato | 506 776 (6.2) | 161 966 (6.2) |
| Mean (SD) HBA1c (mmol/mol) | 37.2 (4.5) | 37.3 (4.4) |
| Dati completi* | 6 453 196 (78.8) | 2 024 909 (77.0) |
| Dati completi† | 1 367 483 (16.7) | 416 142 (15.8) |
| Origine etnica: | ||
| Etnia registrata | 5 933 548 (72.5) | 1 870 332 (71.1) |
| Bianco o non registrato | 7 136 377 (87.2) | 2 323 760 (88.4) |
| Indiano | 188 049 (2.3) | 58 084 (2.2) |
| Pakistani | 101 231 (1.2) | 33 954 (1.3) |
| Bangladeshi | 81 834 (1.0) | 22 148 (0.8) |
| Altri asiatici | 122 981 (1.5) | 38 222 (1.5) |
| Caraibi | 80 657 (1.0) | 22 379 (0.9) |
| Nero africano | 179 423 (2.2) | 48 446 (1.8) |
| Cinese | 65 999 (0.8) | 15 947 (0.6) |
| Altro | 230 154 (2.8) | 67 000 (2.5) |
| Stato del fumo: | ||
| Fumo registrato | 7 834 644 (95.7) | 2 520 127 (95.8) |
| Non fumatore | 4 441 795 (54.3) | 1 422 825 (54.1) |
| Ex-fumatore | 1 518 799 (18.6) | 502 297 (19.1) |
| Fumatore leggero | 1 098 645 (13.4) | 344 874 (13.1) |
| Fumatore moderato | 485 756 (5.9) | 155 933 (5.9) |
| Fumatore pesante | 289 649 (3.5) | 94 198 (3.6) |
| Caratteristiche mediche: | ||
| Anamnesi familiare di diabete | 1 21 8682 (14.9) | 379 889 (14.4) |
| Ipertensione trattata | 737 303 (9.0) | 249 614 (9.5) |
| Malattie cardiovascolari | 290 345 (3.5) | 101 370 (3.9) |
| Schizofrenia o disturbo affettivo bipolare | 62 014 (0.8) | 19 619 (0.7) |
| Incapacità di apprendimento | 56 092 (0.7) | 18 458 (0.7) |
| Diabete gestazionale‡ | 17 214 (0.4) | 5201 (0.2) |
| Sindrome dell’ovaio policistico‡ | 81 164 (2.0) | 24 217 (0.9) |
| Farmaci attuali: | ||
| Statine | 526 969 (6.4) | 173 528 (6.6) |
| Antipsicotici atipici | 58 655 (0.7) | 19 776 (0.8) |
| Corticosteroidi | 238 683 (2.9) | 83 760 (3.2) |
La tabella 1 mostra anche le caratteristiche mediche all’ingresso dello studio. Per le nuove variabili di interesse: 58-655 (0,7%) pazienti della coorte di derivazione sono stati prescritti antipsicotici atipici, 526-969 (6,4%) sono state prescritte statine, la schizofrenia o il disturbo affettivo bipolare è stato registrato in 62-014 (0.8%), l’incapacità di apprendimento è stata registrata in 56 092 (0,7%), il diabete gestazionale in 17-214 (0,4% delle donne) e la sindrome dell’ovaio policistico in 81-164 (2,0% delle donne).
La tabella supplementare 1a mostra la distribuzione dei fattori di rischio per gruppo etnico nella coorte di derivazione. I test per il glucosio nel sangue a digiuno e l’HBA1c sono risultati più elevati tra tutti i gruppi etnici non bianchi diversi dai cinesi rispetto al gruppo bianco o non registrato. Rispetto agli altri gruppi etnici, le persone di origine sud-asiatica e caraibica tendevano ad avere valori medi di HBA1c marginalmente più alti, e proporzioni più alte avevano una storia familiare di diabete.
La tabella supplementare 1b mostra informazioni simili per i pazienti con glucosio nel sangue a digiuno o HBA1c registrati rispetto a quelli senza valore per entrambi i test.
Incidenza del diabete di tipo 2
La tabella 2 mostra il numero di pazienti con una nuova diagnosi di diabete di tipo 2 durante il follow-up nelle coorti di derivazione e di validazione. Nella coorte di derivazione, abbiamo identificato 178-314 casi di diabete di tipo 2 derivanti da 42,7 milioni di anni di osservazione. La tabella supplementare 2 mostra una ripartizione per nove gruppi etnici. Ad esempio, 6181 casi di diabete di tipo 2 per uomini e donne di etnia indiana sono stati rilevati in 795.000 anni di osservazione.
| Variabili | Coorte di derivazione | Coorte di convalida | |||||
|---|---|---|---|---|---|---|---|
| Casi di incidente | Anni della persona (000s) | Incidenza per 1000 (95% CI) | Casi di incidente | Anni della persona (000s) | Incidenza per 1000 (95% CI) | ||
| Totale | 178 314 | 42 718 | 4,17 (da 4,15 a 4,19) | 62 326 | 14 317 | 4,35 (da 4,32 a 4,39) | |
| Donne | 77 895 | 21 561 | 3,61 (da 3,59 a 3,64) | 27 311 | 7242 | 3,77 (da 3,73 a 3,82) | |
| Uomini | 100 419 | 21 157 | 4,75 (da 4,72 a 4,78) | 35 015 | 7076 | 4,95 (da 4,90 a 5,00) | |
| Fascia d’età (anni): | |||||||
| 25-29 | 2351 | 5042 | 0,47 (da 0,45 a 0,49) | 809 | 1593 | 0,51 (da 0,47 a 0,54) | |
| 30-34 | 6058 | 5442 | 1,11 (dall’1.09 all’1.14) | 2000 | 1699 | 1,18 (da 1,13 a 1,23) | |
| 35-39 | 11 419 | 5580 | 2,05 (dal 2.01 al 2.08) | 3952 | 1807 | 2,19 (da 2,12 a 2,26) | |
| 40-44 | 16 770 | 5336 | 3,14 (da 3,10 a 3,19) | 5519 | 1778 | 3,10 (da 3,02 a 3,19) | |
| 45-49 | 20 199 | 4502 | 4,49 (da 4,42 a 4,55) | 6863 | 1509 | 4,55 (da 4,44 a 4,66) | |
| 50-54 | 21 698 | 3776 | 5,75 (da 5,67 a 5,82) | 7203 | 1289 | 5,59 (da 5,46 a 5,72) | |
| 55-59 | 24 688 | 3668 | 6,73 (da 6,65 a 6,82) | 8862 | 1305 | 6,79 (6,65 a 6,93) | |
| 60-64 | 22 518 | 2906 | 7,75 (da 7,65 a 7,85) | 8021 | 1031 | 7,78 (7,61 a 7,95) | |
| 65-69 | 20 039 | 2315 | 8,66 (da 8,54 a 8,78) | 7256 | 827 | 8,78 (8,58 a 8,98) | |
| 70-74 | 16 102 | 1829 | 8,81 (8,67 a 8,94) | 5844 | 655 | 8,92 (8,69 a 9,15) | |
| 75-79 | 10 818 | 1399 | 7,73 (da 7,59 a 7,88) | 3892 | 493 | 7,89 (da 7,65 a 8,14) | |
| 80-84 | 5654 | 923 | 6,13 (5,97 a 6,29) | 2105 | 333 | 6,33 (da 6,07 a 6,61) | |
| Caratteristiche mediche: | |||||||
| Anamnesi familiare di diabete | 44 822 | 6360 | 7,05 (6,98 a 7,11) | 15 951 | 2104 | 7,58 (da 7,46 a 7,70) | |
| Ipertensione trattata | 54 367 | 4491 | 12.11 (dalle 12.00 alle 12.21) | 19 202 | 1574 | 12,20 (dal 12.03 al 12.38) | |
| Malattia cardiovascolare | 20 206 | 1583 | 12,76 (12,59-12,94) | 7310 | 570 | 12,82 (12,53 a 13,11) | |
| Schizofrenia o disturbo affettivo bipolare | 2506 | 272 | 9,21 (da 8,86 a 9,58) | 856 | 89 | 9,61 (da 8,99 a 10,28) | |
| Incapacità di apprendimento | 1313 | 251 | 5,22 (da 4,95 a 5,51) | 426 | 84 | 5,05 (da 4,59 a 5,56) | |
| Diabete gestazionale | 1123 | 63 | 17,75 (16,74 a 18,82) | 345 | 19 | 17,72 (15,95-19,69) | |
| Sindrome dell’ovaio policistico | 1243 | 322 | 3,85 (da 3,65 a 4,08) | 428 | 99 | 4,34 (da 3,94 a 4,77) | |
| Farmaci attuali: | |||||||
| Statine | 37 231 | 2,879 | 12,93 (12,80 al 13,06) | 12 603 | 977 | 12,89 (12,67 a 13,12) | |
| Antipsicotici atipici | 2350 | 247 | 9,50 (da 9,12 a 9,89) | 832 | 84 | 9,86 (9,22 a 10,56) | |
| Corticosteroidi | 13 390 | 1579 | 8,48 (da 8,34 a 8,63) | 4849 | 574 | 8,45 (da 8,21 a 8,69) | |
Il follow-up mediano nella coorte di derivazione era di 3,90 anni (intervallo interquartile da 1,54 a 8,50). Complessivamente, 2279 pazienti hanno avuto 10 o più anni di follow-up. Il follow-up mediano nella coorte di validazione è stato di 4,22 anni (da 1,57 a 9,25). Complessivamente, 602 661 pazienti hanno avuto 10 o più anni di follow-up.
Variabili predittive
La tabella 3 mostra i rapporti di pericolo corretti per i modelli A, B e C nelle donne della coorte di derivazione. La tabella 4 mostra i valori corrispondenti per gli uomini.
| Variabili | Rapporto di pericolo regolato (95% CI) | ||
|---|---|---|---|
| Modello A | Modello B | Modello C | |
| Punteggio Townsend (aumento di 5 unità) | 1,21 (da 1,19 a 1,22) | 1,20 (da 1,18 a 1,21) | 1,20 (da 1,18 a 1,21) |
| Gruppo etnico: | |||
| Bianco o non registrato | 1.00 | 1.00 | 1.00 |
| Indiano | 2,91 (2,80 a 3,03) | 2,69 (da 2,57 a 2,81) | 1,82 (1,74 a 1,91) |
| Pakistani | 3,83 (da 3,66 a 4,01) | 3,49 (da 3,29 a 3,71) | 2,19 (da 2,05 a 2,33) |
| Bangladeshi | 6,07 (da 5,77 a 6,38) | 4,45 (da 4,20 a 4,73) | 3,30 (da 3,10 a 3,52) |
| Altri asiatici | 3,09 (da 2,92 a 3,26) | 2,63 (da 2,48 a 2,79) | 2,04 (da 1,92 a 2,17) |
| Caraibi | 1,52 (da 1,45 a 1,60) | 1,62 (da 1,54 a 1,71) | 1,13 (1,07 a 1,18) |
| Africa Nera | 1,33 (1,26 a 1,40) | 1,61 (1,53 a 1,70) | 1,01 (0,96 a 1,07) |
| Cinese | 2,41 (da 2,15 a 2,72) | 2,12 (da 1,88 a 2,39) | 1,77 (1,53 a 2,05) |
| Altro | 1,44 (1,37 a 1,52) | 1,50 (da 1,42 a 1,58) | 1,19 (da 1,12 a 1,25) |
| Stato del fumo: | |||
| Non fumatore | 1.00 | 1.00 | 1.00 |
| Ex-fumatore | 1,07 (dall’1.05 all’1.09) | 1,04 (dall’1.01 all’1.06) | 1,07 (dall’1.05 all’1.09) |
| Fumatore leggero | 1,33 (da 1,30 a 1,36) | 1,25 (1,22 a 1,29) | 1,16 (da 1,13 a 1,19) |
| Fumatore moderato | 1,43 (1,38 a 1,48) | 1,36 (da 1,32 a 1,41) | 1,16 (da 1,12 a 1,21) |
| Fumatore pesante | 1,71 (1,65 a 1,77) | 1,55 (da 1,48 a 1,62) | 1,36 (da 1,29 a 1,43) |
| Caratteristiche mediche*: | |||
| Anamnesi familiare di diabete† | 1,70 (da 1,67 a 1,74) | 1,57 (da 1,53 a 1,61) | 1,56 (da 1,52 a 1,59) |
| Ipertensione trattata | 1,55 (da 1,53 a 1,58) | 1,33 (da 1,30 a 1,35) | 1,50 (da 1,47 a 1,53) |
| Malattia cardiovascolare | 1,19 (da 1,16 a 1,23) | 1,22 (da 1,18 a 1,26) | 1,18 (da 1,14 a 1,22) |
| Schizofrenia o disturbo affettivo bipolare | 1,30 (da 1,21 a 1,39) | 1,18 (1,08 a 1,28) | 1,37 (1,27 a 1,49) |
| Incapacità di apprendimento† | 1,32 (da 1,19 a 1,46) | 1,57 (da 1,41 a 1,76) | 1,34 (da 1,20 a 1,48) |
| Diabete gestazionale | 4,59 (da 4,32 a 4,88) | 2,91 (da 2,71 a 3,13) | 3,08 (da 2,87 a 3,31) |
| Sindrome dell’ovaio policistico | 1,41 (1,33 a 1,49) | 1,43 (da 1,35 a 1,51) | 1,40 (1,31 a 1,50) |
| Farmaci attuali*: | |||
| Statine† | 1,93 (1,84 a 2,03) | 1,79 (da 1,70 a 1,88) | 1,58 (da 1,49 a 1,68) |
| Antipsicotici atipici† | 1,74 (da 1,60 a 1,89) | 1,61 (da 1,46 a 1,76) | 1,73 (1,56 a 1,92) |
| Corticosteroidi | 1,31 (1,28 a 1,34) | 1,46 (1,42 a 1,50) | 1,18 (da 1,15 a 1,21) |
| Variabili | Rapporto di pericolo regolato (95% CI) | ||
|---|---|---|---|
| Modello A | Modello B | Modello C | |
| Punteggio Townsend (aumento di 5 unità) | 1,14 (da 1,13 a 1,15) | 1,14 (da 1,12 a 1,15) | 1,13 (da 1,12 a 1,15) |
| Gruppo etnico: | |||
| Bianco o non registrato | 1.00 | 1.00 | 1.00 |
| Indiano | 3,00 (da 2,90 a 3,11) | 2,74 (2,64 a 2,84) | 1,97 (1,89 a 2,04) |
| Pakistani | 3,63 (da 3,48 a 3,79) | 3,80 (3,64 a 3,98) | 2,30 (da 2,20 a 2,40) |
| Bangladeshi | 5,33 (dal 5.09 al 5.59) | 4,40 (da 4,14 a 4,68) | 2,99 (da 2,82 a 3,18) |
| Altri asiatici | 3,13 (2,98 a 3,28) | 2,82 (2,67 a 2,99) | 2,16 (da 2,04 a 2,28) |
| Caraibi | 1,60 (da 1,52 a 1,68) | 1,68 (da 1,59 a 1,78) | 1,23 (da 1,15 a 1,32) |
| Africa Nera | 2,01 (da 1,92 a 2,11) | 2,36 (da 2,23 a 2,49) | 1,46 (da 1,39 a 1,54) |
| Cinese | 1,99 (1,78 a 2,23) | 1,90 (da 1,67 a 2,16) | 1,41 (1,22 a 1,62) |
| Altro | 1,52 (da 1,45 a 1,59) | 1,62 (da 1,55 a 1,70) | 1,25 (1,18 a 1,31) |
| Stato del fumo: | |||
| Non fumatore | 1.00 | 1.00 | 1.00 |
| Ex-fumatore | 1,18 (da 1,16 a 1,20) | 1,12 (da 1,10 a 1,14) | 1,12 (da 1,10 a 1,14) |
| Fumatore leggero | 1,38 (1,35 a 1,40) | 1,36 (1,34 a 1,39) | 1,16 (da 1,13 a 1,18) |
| Fumatore moderato | 1,38 (1,34 a 1,42) | 1,39 (da 1,35 a 1,44) | 1,11 (1,07 a 1,16) |
| Fumatore pesante | 1,57 (da 1,52 a 1,62) | 1,53 (1,48 a 1,58) | 1,22 (da 1,18 a 1,26) |
| Caratteristiche mediche*: | |||
| Anamnesi familiare di diabete† | 1,91 (da 1,88 a 1,95) | 1,78 (1,74 a 1,81) | 1,76 (1,72 a 1,80) |
| Ipertensione trattata | 1,40 (da 1,37 a 1,42) | 1,28 (1,26 a 1,30) | 1,39 (da 1,36 a 1,43) |
| Malattia cardiovascolare | 1,22 (da 1,20 a 1,25) | 1,24 (da 1,21 a 1,27) | 1,16 (da 1,13 a 1,19) |
| Schizofrenia o disturbo affettivo bipolare | 1,26 (1,18 a 1,34) | 1,24 (1,16 a 1,34) | 1,33 (da 1,24 a 1,43) |
| Incapacità di apprendimento† | 1,26 (1,16 a 1,38) | 1,49 (da 1,37 a 1,63) | 1,30 (da 1,17 a 1,43) |
| Farmaci attuali‡: | |||
| Statine† | 1,79 (1,74 a 1,86) | 1,67 (1,61 a 1,74) | 1,53 (1,48 a 1,58) |
| Antipsicotici atipici† | 1,52 (da 1,40 a 1,65) | 1,56 (da 1,43 a 1,70) | 1,58 (da 1,44 a 1,72) |
| Corticosteroidi | 1,25 (da 1,21 a 1,28) | 1,41 (1,36 a 1,45) | 1,15 (da 1,11 a 1,18) |
Tra i nuovi fattori di rischio, tutti soddisfano i nostri criteri di inclusione del modello. Il modello A include le variabili: età, etnia, deprivazione, indice di massa corporea, stato di fumo, storia familiare di diabete in un parente di primo grado, malattie cardiovascolari, ipertensione trattata, corticosteroidi, antipsicotici atipici, statine, schizofrenia o disturbo affettivo bipolare e disabilità di apprendimento. Il modello nelle donne comprendeva anche il diabete gestazionale e la sindrome dell’ovaio policistico.
Il modello B è lo stesso del modello A, ma include il glucosio nel sangue a digiuno. Il modello C è lo stesso del modello A, tranne che include l’HBA1c.
La figura supplementare S1 mostra i grafici dei rapporti di pericolo corretti per i modelli A e B per i termini polinomiali frazionari per l’età e l’indice di massa corporea, nonché i termini di interazione tra l’età e le variabili predittive rilevanti, come elencato nelle note a piè di pagina delle tabelle 3 e 4. La figura supplementare S1 mostra anche i grafici dei rapporti di pericolo corretti per la glicemia a digiuno nel modello B e HBA1c nel modello C e le loro interazioni con l’età.
Per le nuove variabili di interesse nel modello A, gli antipsicotici atipici sono stati associati a un aumento del rischio di diabete di tipo 2 nelle donne del 74% (intervallo di confidenza del 95% dal 60% all’89%) e a un aumento del rischio per gli uomini del 52% (dal 40% al 65%); le statine sono state associate a un aumento del rischio nelle donne del 93% (dall’84% al 103%) e a un aumento del rischio negli uomini del 79% (dal 74% all’86%); la schizofrenia o il disturbo affettivo bipolare era associato a un aumento del rischio del 30% (dal 21% al 39%) nelle donne e del 26% (dal 18% al 34%) negli uomini; la disabilità di apprendimento era associata a un aumento del rischio del 32% (dal 19% al 46%) nelle donne e del 26% (dal 16% al 38%) negli uomini. Il diabete gestazionale è stato associato a un aumento del rischio nelle donne del 359% (dal 332% al 388%) e la sindrome dell’ovaio policistico è stata associata a un aumento del rischio del 41% (dal 33% al 49%). Laddove vi sono state interazioni con l’età, questi valori si riferiscono ai rischi valutati alle età medie.
Le note a piè di pagina delle tabelle 3 e 4 contengono l’elenco completo delle interazioni per età per ogni modello. Sia negli uomini che nelle donne, tra le nuove variabili vi sono state interazioni statisticamente significative tra età e disabilità di apprendimento, età e antipsicotici atipici, età e statine, età e glicemia a digiuno (modello B), e tra età e HBA1c (modello C). I rapporti di rischio per la disabilità di apprendimento, gli antipsicotici atipici e le statine, l’indice di massa corporea e l’anamnesi familiare del diabete erano più alti in età più giovane rispetto alle età più avanzate (figura supplementare S1c-g). Ad esempio, per il modello B negli uomini, le statine sono state associate a un aumento del rischio del 141% a 35 anni, del 66% a 45 anni, del 30% a 55 anni e del 15% a 65 anni (cifra supplementare S1d).
Complessivamente i rapporti di rischio per i modelli B e C tendevano ad essere inferiori a quelli del modello A. I rapporti di rischio per i gruppi etnici non bianchi tendevano ad essere inferiori per il modello C rispetto al modello B. Ad esempio, il rapporto di rischio per le donne del Bangladesh era di 6,07 (5,77 a 6,38) per il modello A, 4,45 (4,20 a 4,73) per il modello B, e 3,30 (3,10 a 3,52) per il modello C.
Le tabelle supplementari 3 e 4 mostrano i risultati dell’analisi completa dei casi per ciascuno dei tre modelli. I rapporti di pericolo corretti per i modelli A e B sono sostanzialmente simili all’analisi basata su dati imputati.
Convalida
Discriminazione
La tabella 5 mostra la performance di ciascuna equazione nella coorte di convalida per donne e uomini per ciascuno dei modelli A, B e C rispetto all’attuale modello QDiabetes. Tutti i modelli avevano una buona calibrazione e alti livelli di variazione e discriminazione spiegata. Il modello B ha avuto la migliore performance complessiva, seguito dal modello C. Il modello A ha una performance simile agli attuali modelli QDiabetes. Le prestazioni di tutti i modelli sono state leggermente migliori tra le donne che tra gli uomini.
| Statistiche | Modello QDiabetes-2017 attuale | Modello A: QDiabetes-2018 | Modello B: QDiabetes-2018 (incluso FBG) | Modello C: QDiabetes-2018 (incluso HBA1c) |
|---|---|---|---|---|
| Le donne: | ||||
| Statistica D* | 2,02 (da 2.00 a 2.04) | 2,07 (dal 2.05 al 2.09) | 2,69 (da 2,65 a 2,73) | 2,52 (da 2,47 a 2,57) |
| Ärell’s C* | 0,831 (da 0,828 a 0,833) | 0,834 (da 0,832 a 0,837) | 0,889 (da 0,887 a 0,891) | 0,878 (da 0,875 a 0,881) |
| R2(% )† | 49,3 (da 48,8 a 49,8) | 50,5 (da 50,0 a 51,0) | 63,3 (62,7 a 64,0) | 60,3 (59,4 a 61,2) |
| Uomini: | ||||
| Statistica D* | 1,89 (1,88 a 1,91) | 1,91 (1,89 a 1,93) | 2,42 (da 2,40 a 2,45) | 2,28 (da 2,20 a 2,36) |
| Ärell’s C* | 0,813 (da 0,810 a 0,815) | 0,814 (da 0,812 a 0,816) | 0,866 (da 0,863 a 0,868) | 0,855 (da 0,849 a 0,861) |
| R2(% )† | 46,1 (da 45,7 a 46,6) | 46,6 (46,1 a 47,1) | 58,4 (57,9 a 58,8) | 55,5 (53,7 a 57,2) |
Nelle donne, il modello A spiegava il 50,5% della variazione nel tempo della diagnosi di diabete di tipo 2 (R2), la statistica D era 2,07 e la statistica C di Harrell era 0,834. I valori corrispondenti per il modello A negli uomini erano 46,6%, 1,91 e 0,814.
Nelle donne, il modello B spiegava il 63,3% della variazione nel tempo della diagnosi di diabete di tipo 2 (R2), la statistica D era 2,69, e la statistica C di Harrell era 0,889. I valori corrispondenti per il modello B negli uomini erano 58,4%, 2,42 e 0,866.
Nelle donne, il modello C spiegava il 60,3% della variazione nel tempo della diagnosi di diabete di tipo 2 (R2), la statistica D era 2,52 e la statistica C di Harrell era 0,878. I valori corrispondenti per il modello C negli uomini erano 55,5%, 2,28 e 0,855.
Inoltre, abbiamo calcolato la statistica C di Harrell per il modello B sul sottogruppo di pazienti con dati completi per il glucosio nel sangue a digiuno e per il modello C su quelli con dati completi per HBA1c. I risultati per il modello B sono stati 0,836 per le donne e 0,812 per gli uomini. I risultati corrispondenti per il modello C sono stati 0,772 e 0,738.
La tabella supplementare 5 mostra le statistiche D, R2 e Harrell’s C per i modelli A e B per le donne in vari sottogruppi, tra cui tre gruppi di età, gruppi etnici e quelli con specifiche patologie. La tabella supplementare 6 mostra i valori corrispondenti per gli uomini.
La migliore performance per gruppo etnico è stata per il modello B tra le donne cinesi (R2=68,0%, D=2,99, Harrell’s C=0,912). La performance più bassa per gruppo etnico è stata per il modello A tra le donne del Bangladesh (R2=35,6%, D=1,52, Harrell C=0,776). I valori di performance sono stati più alti nella fascia d’età più giovane (<40 anni) e più bassi nella fascia d’età più anziana (≥60 anni) per entrambi i modelli.
La figura supplementare S2a-d mostra le trame della statistica C di Harrell per i modelli A e B negli uomini e nelle donne nelle 363 pratiche della coorte di convalida. I grafici mostrano i valori C di Harrell per ogni pratica generale rispetto al numero di pazienti con diagnosi di diabete di tipo 2 in ogni pratica. Le pratiche con meno pazienti con una diagnosi di diabete di tipo 2 hanno avuto una variazione più ampia nella statistica C rispetto alle pratiche con più diagnosi. Ad esempio, la figura supplementare 2a mostra che la statistica C riassuntiva (media) per il modello A nelle donne è stata di 0,834 da una meta-analisi degli effetti casuali. Il valore I2 (cioè la percentuale di variazione totale della statistica C dovuta all’eterogeneità tra le pratiche) era del 90,1%. L’intervallo di previsione del 95% circa per la statistica C reale nelle donne in una nuova pratica è stato di 0,72 a 0,94. La figura supplementare 2c mostra i risultati corrispondenti per il modello B nelle donne (statistica riassuntiva C = 0,891, I2 = 77,5%, intervallo di previsione del 95% da 0,83 a 0,96).
Calibrazione
Nelle donne, il rischio medio previsto a 10 anni era del 3,62% per il modello A e del 3,42% per il modello B. Il rischio osservato a 10 anni era del 4,21% (intervallo di confidenza del 95% dal 4,16% al 4,26%). Negli uomini, il rischio medio previsto a 10 anni è stato del 4,97% per il modello A e del 4,71% per il modello B. Il rischio osservato a 10 anni è stato del 5,56% (dal 5,48% al 5,61%).
La Figura 1 mostra i rischi medi previsti e i rischi osservati a 10 anni per 10 anni di rischio previsto, applicando i modelli A, B e C a tutti gli uomini e le donne della coorte di convalida. La tabella supplementare 7 mostra i valori della pendenza di calibrazione complessiva e per sottogruppo per i modelli A e B. Ad esempio, la pendenza di calibrazione per il modello A è stata di 0,997 (0,986 a 1,008) nelle donne e di 0,986 (0,976 a 0,996) negli uomini. Per il modello B, i valori corrispondenti erano 0,993 (da 0,978 a 1,007) e 0,985 (da 0,975 a 0,996). La stretta corrispondenza tra i rischi medi previsti e i rischi osservati all’interno di ogni modello 10 per ogni modello indica che le equazioni sono state ben calibrate nel complesso e per fascia d’età. La calibrazione all’interno dei sottogruppi era variabile, anche se tendeva ad essere migliore per il modello B che per il modello A (vedi tabella supplementare 7).
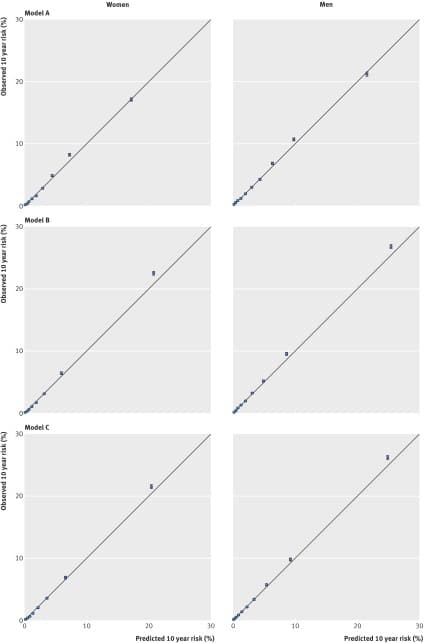
Fig. 1 Previsione e osservazione del rischio di diabete a 10 anni utilizzando i modelli A, B e C

Fig. 1 Rischio di diabete previsto e osservato a 10 anni utilizzando i modelli A, B e C
Uso clinico del QDiabete
La Figura 2 mette a confronto quattro strategie per identificare i pazienti ad alto rischio sulla base delle attuali raccomandazioni della guida alle migliori pratiche del NHS Health Checks (strategie 1 e 2) e la valutazione del rischio utilizzando i modelli B e C in combinazione con il modello A (strategie 3 e 4). Mostra che nella coorte di validazione per i pazienti identificati come ad alto rischio utilizzando il modello A la strategia 3 (basata sul modello B) è stata la più sensibile quando si confrontano gruppi di pari dimensioni poiché ha identificato 28-953 (67,3%) dei 43-010 pazienti con diagnosi di diabete di tipo 2 durante 10 anni di follow-up che sono stati classificati come ad alto rischio al punto 1 (e il 49,8% di tutti i 58-130 pazienti con diagnosi di diabete di tipo 2 durante 10 anni di follow-up nell’intera coorte di validazione). La strategia 1 (basata su una concentrazione di glucosio nel sangue a digiuno di 5,5-6,9 mmol/L) ha identificato 27 459 (63,8% del 43010 e 47,2% del 58130) e la strategia 4 (basata sul modello C) ha identificato 27 661 (62,9% del 43010 e 46,6% del 58130) pazienti con una diagnosi di diabete di tipo 2 durante 10 anni di follow-up. La strategia 2 (basata su valori HBA1c di 42-47 mmol/mol) ha identificato una percentuale inferiore di pazienti ad alto rischio (19,1%) e la percentuale minore di pazienti con diagnosi di diabete di tipo 2 durante 10 anni di follow-up, con solo 20-37 (46,6% di 43 010 e 34,5% di 58 130) identificati.
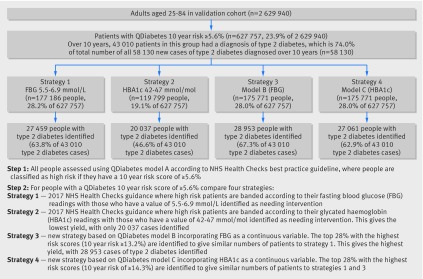
Fig. 2 Confronto tra quattro strategie per l’identificazione di pazienti ad alto rischio di sviluppare il diabete. FBG=velocizzazione del glucosio nel sangue
La tabella supplementare 8 mostra la popolazione totale, il numero di casi di diabete di tipo 2 identificati durante il follow-up e la sensibilità, la specificità e il rischio osservato a diverse soglie di rischio per il modello A. Ad esempio, utilizzando una soglia di rischio a 10 anni dell’11,1% si identificherebbe il 10% dei pazienti con il più alto rischio di diabete utilizzando il modello A. A questa soglia, la sensibilità era del 45,9%, la specificità del 90,8% e il rischio osservato del 19,3% (intervallo di confidenza del 95% dal 19,1% al 19,5%). Utilizzando una soglia di rischio del 6,6% (il 20% superiore) i valori corrispondenti sarebbero 68,1%, 81,1% e 14,3%. Le soglie per i modelli B e C variano a seconda della strategia scelta per l’identificazione iniziale dei pazienti che utilizzano il modello A, pertanto non sono presentate in questa sede.
Le figure 3 e 4 sono schermate del calcolatore web aggiornato con diversi esempi clinici per mostrare come il QDiabetes-2018 potrebbe essere utilizzato all’interno di un consulto. L’esempio 1 (figura 3) mostra che una donna bianca di 40 anni con un indice di massa corporea di 30 kg/m2 e una storia familiare di diabete ha un rischio stimato a 10 anni di diabete di tipo 2 del 3,6%. Se soffre di sindrome dell’ovaio policistico, il suo rischio è del 5,0%. Se ha avuto anche un diabete gestazionale, il suo rischio è del 21,1%. Se ha anche la schizofrenia, il suo rischio è del 26,5%. Se ha un valore di glucosio a digiuno di 5,5 mmol/L, il suo rischio a 10 anni è del 13,7%. Se il suo valore di glucosio a digiuno è di 6,2 mmol/L, il suo rischio è del 67,7%. L’esempio 2 (figura 4) è per un uomo pakistano di 35 anni che ha un indice di massa corporea di 30 kg/m2. Ha anche la schizofrenia e gli sono stati prescritti antipsicotici atipici. Il suo rischio stimato a 10 anni di diabete di tipo 2 è del 15,6%. Se gli viene prescritta una statina il suo rischio a 10 anni è del 35,5%. Se ha un valore HBA1c di 35 mmol/mol, il suo rischio a 10 anni è del 16,8%.

Fig. 3 Esempio clinico 1: Utilizzo del QDiabetes per calcolare il rischio assoluto di diabete in una paziente di sesso femminile. TIA=attacco ischemico transitorio

Fig. 4 Esempio clinico 2: Utilizzo del QDiabetes per calcolare il rischio assoluto di diabete in un paziente di sesso maschile. TIA=attacco ischemico transitorio

Fig. 2 Confronto tra quattro strategie per identificare i pazienti ad alto rischio di sviluppare il diabete. FBG=velocizzazione del glucosio nel sangue

Fig. 3 Esempio clinico 1: Utilizzo del QDiabetes per calcolare il rischio assoluto di diabete in una paziente di sesso femminile. TIA=attacco ischemico transitorio

Fig. 4 Esempio clinico 2: Utilizzo del QDiabetes per calcolare il rischio assoluto di diabete in un paziente di sesso maschile. TIA=attacco ischemico transitorio
Analisi della curva decisionale
La Figura 5 mostra le curve dei benefici netti per uomini e donne. Queste mostrano che le equazioni di previsione per i modelli A, B e C hanno avuto un beneficio netto maggiore rispetto alle strategie basate sulla considerazione di nessun paziente o di tutti i pazienti per l’intervento attraverso una gamma di soglie, e queste sono utili fino ad una soglia di rischio assoluto di circa il 40%. Il modello B aveva un beneficio netto leggermente migliore rispetto al modello C ed entrambi erano migliori del modello A.
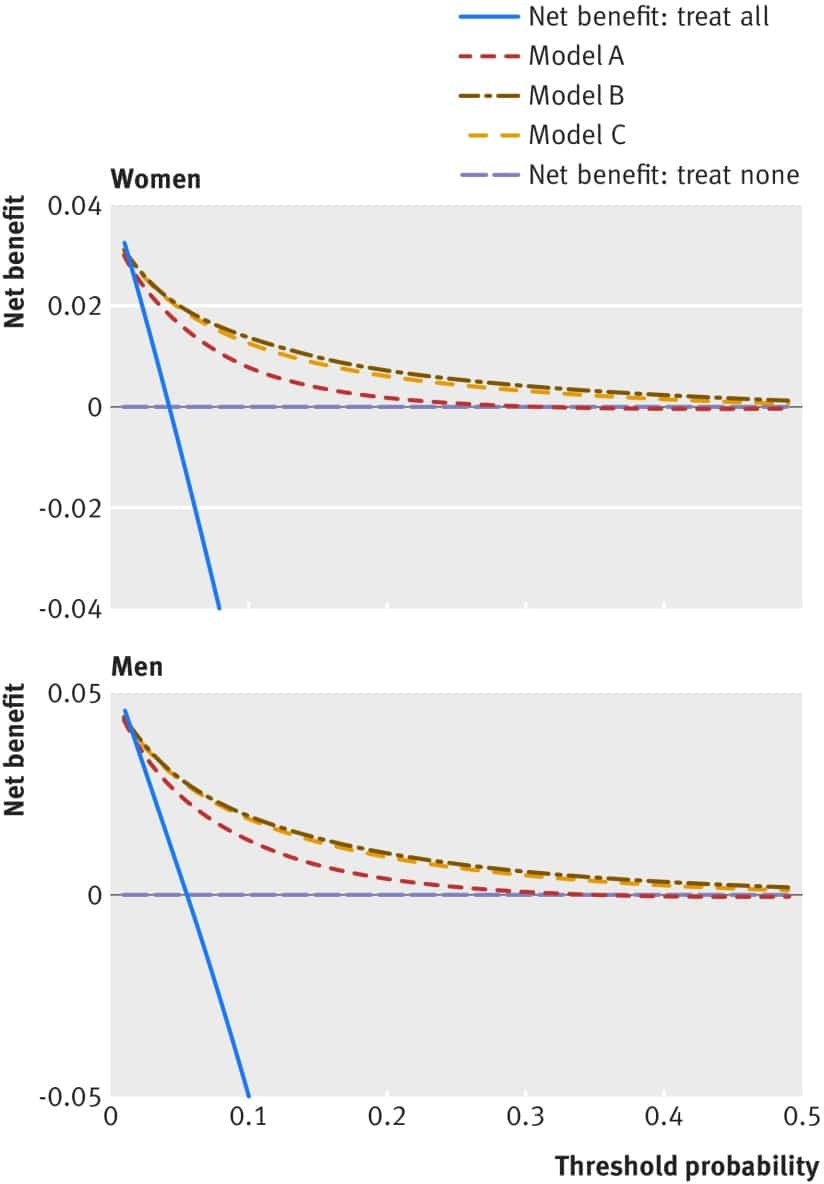
Fig. 5 Curve di beneficio netto per uomini e donne

Fig. 5 Curve di beneficio netto per uomini e donne
Discussione
Abbiamo sviluppato e convalidato equazioni aggiornate per prevedere il rischio di 10 anni di diabete di tipo 2 (QDiabetes-2017) in uomini e donne di età compresa tra i 25 e gli 84 anni. Le equazioni incorporano le variabili predittive stabilite e nuovi fattori di rischio associati a un aumento del rischio di diabete di tipo 2. Sono stati prodotti tre modelli: il modello A include i fattori di rischio esistenti (età, etnia, deprivazione, indice di massa corporea, fumo, storia familiare del diabete in un parente di primo grado, malattie cardiovascolari, ipertensione trattata e uso regolare di corticosteroidi) e nuovi fattori di rischio (antipsicotici atipici, statine, schizofrenia o disturbo affettivo bipolare, difficoltà di apprendimento, diabete gestazionale e sindrome dell’ovaio policistico). L’inclusione di questi nuovi fattori di rischio contribuirà a garantire una stima più accurata del livello di rischio nella popolazione colpita per migliorare le informazioni per le singole pazienti e per le strategie di sorveglianza.
Sebbene i nuovi modelli siano più complessi di quelli esistenti, è improbabile che ciò influisca sull’adozione dei nuovi modelli, in quanto sono tutti progettati per essere calcolati automaticamente sulla base delle informazioni registrate nella cartella clinica elettronica del paziente. Le figure 3 e 4 includono studi di casi in cui l’impatto di fattori di rischio aggiuntivi per un paziente di esempio porterebbe a una gestione diversa. Per i singoli individui, la presenza di questi nuovi fattori di rischio potrebbe aumentare sostanzialmente i loro rischi assoluti di diabete. Questi cambiamenti nel rischio assoluto potrebbero spingere gli individui oltre la soglia di rischio, il che potrebbe portare a una diversa gestione clinica. Tuttavia, il numero effettivo di persone in questi gruppi è relativamente piccolo, per cui le statistiche sulla discriminazione sono troppo crude per poter rilevare questi effetti nei singoli individui.
Inoltre, abbiamo sviluppato due ulteriori modelli, che includono i risultati degli esami del sangue oltre ai fattori di rischio del modello A. Il modello B include il glucosio nel sangue a digiuno e il modello C include l’emoglobina glicata (HBA1c) come valori continui. Questo approccio migliora gli approcci attuali che utilizzano soglie fisse per la glicemia a digiuno o HBA1c,1251 in quanto tiene conto di altri fattori di rischio e consente di comunicare ai pazienti una stima più precisa del rischio. I nuovi modelli possono essere utilizzati per supportare l’approccio in due fasi per l’identificazione dei pazienti ad alto rischio di diabete, come raccomandato dalle linee guida del NICE13 e dai controlli sanitari del NHS.12 Il modello A potrebbe essere utilizzato per identificare i pazienti ad alto rischio di diabete che richiedono un test per il glucosio nel sangue a digiuno o HBA1c. Dopo aver identificato i pazienti che soddisfano i criteri per una diagnosi di diabete, il modello B potrebbe essere utilizzato per affinare la stima del rischio nei pazienti rimanenti una volta noto il risultato del test della glicemia a digiuno, poiché queste informazioni forniscono una valutazione più accurata del rischio. Analogamente, il modello C potrebbe essere utilizzato quando il risultato del test HBA1c è noto. Il modello B aveva una migliore discriminazione e spiegava più della variazione nel tempo della diagnosi di diabete rispetto al modello C. Il modello B aveva anche la sensibilità più elevata per l’identificazione dei casi di diabete (fig. 2), identificando più di due terzi dei casi in quelli determinati come ad alto rischio al punto 1 rispetto all’attuale strategia del NHS basata su bande di HBA1c che avevano la sensibilità più bassa. Anche il modello B ha avuto il beneficio netto più elevato, come dimostra la curva di analisi decisionale in figura 5, sebbene sia stato solo un piccolo miglioramento rispetto al modello C. La strategia basata sul modello B ha identificato un gruppo ad alto rischio pari al 6,7% della coorte di validazione, che comprendeva quasi la metà (49,8%) di tutti i pazienti con diagnosi di diabete di tipo 2 in 10 anni. Nel complesso, l’uso del modello B nella strategia 3 e del modello C nella strategia 4 (fig. 2) fornisce previsioni più accurate sul futuro rischio di diabete tra i pazienti testati rispetto alla strategia 1 o 2 basata solo sugli esami del sangue.
Confronti con la letteratura
I rapporti di rischio per le nuove variabili di rischio incluse nei nostri modelli finali sono simili, sia per grandezza che per direzione, a quelli riportati in altri studi.
Antipsicotici, problemi di salute mentale e difficoltà di apprendimento – la guida pubblicata dal NICE sull’identificazione delle persone a rischio di diabete di tipo 2 evidenzia l’aumento del rischio associato alle difficoltà di apprendimento e ai problemi di salute mentale.14 Le difficoltà di apprendimento hanno colpito circa l’1% della nostra coorte di derivazione e sono state associate a un aumento del rischio di diabete del 32% nelle donne e del 26% negli uomini all’età media (modello A). Ciò è coerente con altri studi15 ed è probabile che sia correlato a fattori negativi dello stile di vita, tra cui la mancanza di esercizio fisico.52 Anche la schizofrenia o il disturbo affettivo bipolare ha colpito circa l’1% dei pazienti ed è stato associato a un aumento del rischio di diabete del 30% nelle donne e del 26% negli uomini. Sono stati prescritti antipsicotici atipici a circa l’1% dei pazienti. Essi erano associati ad un aumento del rischio di diabete del 74% nelle donne e del 52% negli uomini. Questo è indipendente dal rischio associato alla schizofrenia o al disturbo affettivo bipolare, e quindi se i pazienti hanno entrambi i fattori ci sarà un effetto composto sul rischio di diabete. L’entità di questo aumento del rischio era coerente con altri studi.16 Sebbene la prevalenza di ciascuna di queste condizioni sia di circa l’1%, l’entità dell’effetto è sostanziale e probabilmente rappresenta un problema clinico importante per i pazienti. I medici potranno ora utilizzare il QDiabetes-2018 per fornire a questi pazienti informazioni migliori sia sui potenziali effetti degli antipsicotici atipici che sugli interventi per ridurre il rischio di diabete.
Statine – L’aumento del rischio di diabete di tipo 2 associato all’uso di statine è ormai assodato. Una meta-analisi di 13 studi sulle statine ha riportato un aumento del rischio del 9% (intervallo di confidenza del 95%, dal 2% al 17%).20 Il rischio associato all’uso di statine è risultato più elevato nel nostro studio rispetto agli studi, il che può riflettere l’orientamento delle statine verso coloro che sono già a più alto rischio di diabete. Inoltre, i partecipanti agli studi di meta-analisi erano sostanzialmente più anziani (età media 65 anni) rispetto ai partecipanti al nostro studio (età media 45 anni). Quando si confrontano gruppi di età simili, l’entità dell’aumento del rischio associato alle statine nel nostro studio è ampiamente comparabile a quello riportato nella meta-analisi degli studiclinici20 , riflettendo l’interazione tra l’età e l’uso delle statine. Mentre l’entità del rischio di diabete associato alle statine era di entità simile all’aumento del rischio riscontrato per i farmaci antipsicotici atipici, le implicazioni per la salute pubblica possono essere maggiori perché le statine sono uno dei farmaci più comunemente prescritti a livello internazionale e sono rivolte a coloro che hanno già profili di rischio cardiovascolare avverso. Tuttavia, l’aumento del rischio di diabete con le statine deve essere bilanciato con la potenziale riduzione degli eventicoronarici20 , rendendo ancora più importante la fornitura di informazioni accurate sui rischi e i benefici delle statine.
Diabete gestazionale e sindrome dell’ovaio policistico – Abbiamo studiato due fattori di rischio (diabete gestazionale e sindrome dell’ovaio policistico) che si verificano solo nelle donne. La sindrome dell’ovaio policistico è nota per essere associata ad una maggiore prevalenza del diabete.53 Recentemente è stata identificata come fattore di rischio per il diabete di tipo 2.5455Abbiamo scoperto che la sindrome dell’ovaio policistico ha colpito il 2% delle donne al basale ed è stata associata a un aumento del rischio del 41% nel modello A. Abbiamo anche scoperto che il diabete gestazionale è stato associato a un rischio di diabete 4,6 volte maggiore, confermando che è uno dei fattori di rischio più forti per il successivo sviluppo del diabete di tipo 2.5657Sebbene le recenti linee guida del NICE sul diabete in gravidanza del 2008 e del 201558 raccomandino un test annuale della glicemia postnatale per le donne con diagnosi di diabete gestazionale, solo il 20% di queste donne riceve uno screening regolare nelle cure primarie.59 L’inclusione della sindrome dell’ovaio policistico e del diabete gestazionale nel QDiabetes-2018 garantirà la presenza di uno strumento integrato automatizzato disponibile nei sistemi informatici di medicina generale per avvertire i medici dell’aumento del rischio di diabete di queste pazienti e facilitare il follow-up proattivo nelle cure primarie.
Confronto con la versione originale di QDiabetes-2009: il nostro primo modello di QDiabetes, pubblicato nel 2009, si basava su un follow-up di coorte tra il 1993 e il 2008. Da allora sono stati apportati miglioramenti al database di QResearch utilizzato per derivare l’equazione, che potrebbero aver portato a modifiche del modello. Ad esempio, il numero di pratiche che contribuiscono al database è quasi triplicato, passando da 531 nel 2009 a 1465 in questo studio. La dimensione della coorte di derivazione è triplicata, con 178-314 diagnosi di diabete di tipo 2 derivanti da 42,7 milioni di anni di osservazione rispetto a 78081 diagnosi di diabete di tipo 2 derivanti da 16,4 milioni di anni di osservazione nel 2009.1 La prevalenza registrata della storia familiare di diabete è aumentata del 50%, passando dal 9,9% al 14,9%. La prevalenza di base dell’ipertensione e dei corticosteroidi trattati è raddoppiata. La registrazione dell’etnia autoassegnata è triplicata, passando dal 24% al 72,5% nello studio attuale. Di conseguenza, abbiamo molti più eventi all’interno dei vari sottogruppi. Questo si riflette nei rapporti di rischio più precisi, con intervalli di confidenza più stretti e statistiche di performance migliorate. È interessante notare che gli indici di pericolosità per gruppo etnico variano tra i diversi modelli, con i modelli B e C che tendono ad avere valori più bassi per i gruppi etnici non bianchi rispetto al modello A. Le statistiche di discriminazione sono però sostanzialmente simili. Nel complesso, i nuovi modelli sono ben calibrati se applicati a una coorte di validazione separata e presentano elevati livelli di discriminazione. Sebbene il modello A abbia avuto prestazioni simili all’attuale modello QDiabetes, gli altri due modelli hanno mostrato un notevole miglioramento, con le migliori prestazioni complessive del modello B.
Ulteriori considerazioni metodologiche
I metodi per derivare e convalidare questi modelli sono sostanzialmente gli stessi di una serie di altri strumenti di previsione del rischio clinico derivati dal database di QResearch.12960616263I punti di forza e i limiti dell’approccio sono già stati discussi in dettaglio.163162636465In sintesi, i punti di forza principali includono la dimensione, la durata del follow-up, la rappresentatività e la mancanza di selezione, il richiamo e la parzialità degli intervistati. Le pratiche generali del Regno Unito hanno buoni livelli di accuratezza e completezza nella registrazione delle diagnosi cliniche e dei farmaci prescritti.66 Il nostro studio ha incluso circa il 20% di tutte le pratiche generali in Inghilterra e le caratteristiche della popolazione registrata con QResearch sono simili a quelle della popolazione registrata con altri grandi database di pratiche generali che utilizzano altri sistemi informatici clinici.5 È quindi probabile che sia rappresentativo della popolazione in generale, soprattutto perché circa il 98% della popolazione del Regno Unito è registrata presso uno studio medico generico. Di tutti i pazienti con diabete di tipo 1 o 2 esclusi al basale, il 9,1% è stato classificato come affetto da diabete di tipo 1, il che è coerente con altri studi che utilizzano approcci diversi.6768Riteniamo che il nostro studio abbia una buona validità facciale in quanto è stato condotto nel contesto in cui la maggior parte dei pazienti nel Regno Unito viene valutata, trattata e seguita.
Limitazioni di questo studio
I limiti del nostro studio includono la mancanza di un giudizio formale sulle diagnosi, la parzialità delle informazioni e il potenziale di parzialità a causa della mancanza di dati. I termini polinomiali frazionari sono stati identificati utilizzando dati completi piuttosto che imputati. Ciò può aver portato ad un certo bias o ad un minor potere di rilevare tendenze non lineari.69 Solo il 16% dei pazienti aveva dati completi per le misurazioni della glicemia, il fumo e l’indice di massa corporea. Tuttavia, le caratteristiche dei pazienti e l’entità dei rapporti di rischio sull’analisi del caso completo erano ampiamente simili, sia per entità che per direzione, all’analisi basata su dati imputati (risultati mostrati nelle tabelle supplementari 3 e 4), il che è rassicurante. Abbiamo usato cinque imputazioni, che possono essere meno di quanto raccomandato a causa di considerazioni pratiche, data l’enorme dimensione del set di dati. Tuttavia, dato l’alto livello di dati mancanti per i modelli B e C, un’ulteriore validazione esterna di questi modelli in set di dati con dati raccolti in modo più completo sarebbe preziosa prima che i modelli vengano utilizzati nella pratica clinica.
Potrebbe essere presente una certa sottovalutazione delle diagnosi di diabete di tipo 2 che potrebbe portare ad un errore di classificazione dell’esito. Questo perché non tutti i pazienti avranno consultato il proprio medico di base durante il periodo di studio e saranno stati sottoposti a screening per il diabete. Allo stesso modo, ci può essere un sotto-rilevamento di alcune delle variabili predittive come la sindrome dell’ovaio policistico e il diabete gestazionale, poiché la prevalenza di base è inferiore rispetto ad altri studi.67 Ciò può essere dovuto al fatto che il diabete gestazionale non era stato diagnosticato o che la diagnosi non era stata registrata sulla cartella clinica elettronica di medicina generale. Un altro limite è che non siamo stati in grado di utilizzare il test della tolleranza al glucosio per via orale come variabile predittiva, poiché i risultati di questi test non vengono memorizzati di routine nel registro della medicina generale. Non abbiamo tenuto conto dei rischi concorrenti in questa analisi perché i risultati possono essere controintuitivi70 e difficili da usare nella pratica clinica.71 Tuttavia, non tenendo conto del rischio di morte concorrente nei pazienti anziani, è probabile che le stime del rischio siano troppo elevate in questa fascia d’età.
Abbiamo escluso i pazienti senza un punteggio di deprivazione valido in quanto questo gruppo può rappresentare una popolazione più transitoria in cui il follow-up potrebbe essere inaffidabile o non rappresentativo. È improbabile che i loro punteggi di deprivazione siano mancanti a caso, quindi non abbiamo ritenuto opportuno imputarli.
Potrebbe essersi verificato un eccesso di adattamento, ma questo è improbabile dato il gran numero di eventi. In generale, per evitare l’overfitting si raccomanda che ci siano almeno 10 eventi per variabile predittiva, compresi i termini di interazione.72 Il nostro modello più complesso (modello C nelle donne) aveva 45 variabili predittrici. Il nostro campione di derivazione aveva 178-314 eventi, dando 3962 eventi per variabile predittrice, che è quasi 400 volte il livello minimo raccomandato.
La presente validazione è stata effettuata su un insieme separato di pratiche e individui selezionati a caso rispetto a quelli utilizzati per sviluppare il punteggio, anche se le pratiche utilizzano tutte lo stesso sistema informatico di medicina generale (EMIS, il sistema informatico utilizzato dal 58% delle pratiche generali in Inghilterra). Alcuni ricercatori sostengono che non è necessaria la convalida di un campione separato quando il campione è abbastanza grande,73 come nel nostro studio. Altri sostengono che una convalida frazionata del campione è ancora valida. Tuttavia, poiché la suddivisione casuale di un enorme set di dati può portare a popolazioni simili, è preferibile suddividere il campione in base al tempo o alla posizione geografica per ottenere una selezione non casuale di pratiche che coprano una gamma più ampia di impostazioni.40 Uno studio di validazione esterno indipendente sarebbe un test più rigoroso e dovrebbe essere effettuato, ma quando tali studi hanno esaminato QDiabetes67 e altre equazioni di rischio,657475hanno mostrato prestazioni comparabili alla validazione nel database QResearch.67 Abbiamo pubblicato il codice sorgente per consentire un’implementazione accurata di QDiabetes-2018 sul sito web di QDiabetes(www.qdiabetes.org) insieme alle versioni precedenti del punteggio dei precedenti aggiornamenti. La ragione di ciò è di garantire che coloro che sono interessati a rivedere o utilizzare l’open source saranno poi in grado di trovare l’ultima versione disponibile man mano che il punteggio continua ad essere aggiornato.
Conclusioni
Abbiamo sviluppato equazioni di rischio aggiornate (QDiabetes-2018) per quantificare i rischi assoluti del diabete di tipo 2 nelle persone di età compresa tra i 25 e gli 84 anni, che includono fattori di rischio accertati e nuovi fattori di rischio: antipsicotici atipici, statine, schizofrenia o disturbo affettivo bipolare, difficoltà di apprendimento, diabete gestazionale e sindrome dell’ovaio policistico. Le equazioni di rischio aggiornate forniscono valide misure di rischio assoluto nella popolazione generale delle pazienti, come dimostrato dalle prestazioni in una coorte di validazione separata. L’aggiunta del glucosio nel modello aggiornato (modello B) ha avuto la migliore discriminazione e sensibilità e migliora potenzialmente gli approcci di valutazione del rischio attualmente disponibili per identificare le persone a rischio di diabete.
Ciò che è già noto su questo argomento
- Sono necessari metodi per identificare i soggetti a maggior rischio di diabete di tipo 2 per identificare i pazienti per i quali possono essere necessari interventi o valutazioni più frequenti
- Il QDiabetes è attualmente ampiamente utilizzato per stimare il rischio di diabete di tipo 2 a 10 anni in persone di età compresa tra i 25 e gli 84 anni sia per comunicare il rischio ai pazienti che per identificare i pazienti ad alto rischio per interventi e sorveglianza attiva
- Il QDiabetes non include alcuni fattori di rischio consolidati e quindi sottovaluterà il rischio in questi pazienti
- Inoltre non include i valori di glicemia a digiuno o HBA1c
Cosa aggiunge questo studio
- Sono stati sviluppati algoritmi aggiornati (QDiabetes-2018) per quantificare i rischi assoluti del diabete di tipo 2 negli adulti di età compresa tra i 25 e gli 84 anni, che includono fattori di rischio accertati e nuovi fattori di rischio come antipsicotici atipici, statine, schizofrenia o disturbo affettivo bipolare, difficoltà di apprendimento, diabete gestazionale e sindrome dell’ovaio policistico, e possono anche incorporare valori di glucosio nel sangue a digiuno e HBA1c
- Gli algoritmi di rischio aggiornati forniscono valide misure di rischio assoluto nella popolazione generale dei pazienti, come dimostrato dalle prestazioni in una coorte di validazione separata
- Il modello che include il glucosio nel sangue a digiuno aveva la migliore discriminazione e la più alta sensibilità rispetto alla pratica corrente raccomandata nel NHS basata su bande di glucosio nel sangue a digiuno o HBA1c
References
- BMJ. 2009; 338:b880. Publisher Full Text | PubMed
- Publisher Full Text
- Publisher Full Text
- Publisher Full Text
- BMJ Open. 2014; 4:e005809. Publisher Full Text | DOI
- Diabet Med. 2011; 28:599-607. Publisher Full Text | DOI | PubMed
- Lancet Diabetes Endocrinol. 2014; 2:19-29. Publisher Full Text | DOI | PubMed
- Br J Gen Pract. 2012; 62:e663-70. Publisher Full Text | DOI | PubMed
- BMJ. 2011; 343:d7163. Publisher Full Text | DOI | PubMed
- BMC Med. 2011; 9:103. Publisher Full Text | DOI | PubMed
- BMJ. 2012; 345:e5900. Publisher Full Text | DOI | PubMed
- 2017.
- Preventing type 2 diabetes: risk identification and interventions for individuals at high risk. NICE Guideline September 2017.. 2017.
- BMJ. 2012; 345:e4624. Publisher Full Text | DOI | PubMed
- Drug Saf. 2017; 40:771-81. Publisher Full Text | DOI | PubMed
- Schizophr Res. 2010; 123:225-33. Publisher Full Text | PubMed
- Pharmacotherapy. 2007; 27:27-35. Publisher Full Text | DOI | PubMed
- Ann Clin Psychiatry. 2006; 18:183-94. Publisher Full Text | PubMed
- Lancet. 2010; 375:735-42. Publisher Full Text | DOI | PubMed
- JAMA. 2011; 305:2556-64. Publisher Full Text | DOI | PubMed
- BMC Cardiovasc Disord. 2014; 14:85. Publisher Full Text | DOI | PubMed
- Arch Intern Med. 2012; 172:144-52. Publisher Full Text | DOI | PubMed
- .Publisher Full Text
- Diabetologia. 2013; 56:1489-93. Publisher Full Text | DOI | PubMed
- World Health Organization. Use of glycated haemoglobin (HbA1c) in the diagnosis of diabetes. Abbreviated report of a WHO consultation, 2011:25.
- Lancet. 2004; 364:423-8. Publisher Full Text | DOI | PubMed
- BMJ. 2001; 322:1389-93. Publisher Full Text | DOI | PubMed
- BMJ. 2008; 336:1475-82. Publisher Full Text | DOI | PubMed
- BMJ. 2007; 335:136. Publisher Full Text | PubMed
- Heart. 2008; 94:34-9. Publisher Full Text | DOI | PubMed
- BMJ. 2009; 339:b2584. Publisher Full Text | DOI | PubMed
- Psychol Methods. 2002; 7:147-77. Publisher Full Text | DOI | PubMed
- J Clin Epidemiol. 2007; 60:979. Publisher Full Text | DOI | PubMed
- J Clin Epidemiol. 2006; 59:1092-101. Publisher Full Text | DOI | PubMed
- Stat Methods Med Res. 1999; 8:3-15. Publisher Full Text | DOI | PubMed
- Multiple Imputation for Non-response in Surveys.. 1987. DOI
- Int J Epidemiol. 1999; 28:964-74. Publisher Full Text | DOI | PubMed
- J R Stat Soc Ser A Stat Soc. 2002; 165:399-400. DOI
- Ann Intern Med. 2015; 162:55-63. Publisher Full Text | DOI | PubMed
- The Statistical Analysis of Failure Time Data.. 2002. DOI
- Applied Survival Analysis: Regression Modelling of Time to Event data.. 1999.
- Stat Med. 2004; 23:723-48. Publisher Full Text | DOI | PubMed
- Stata J. 2006; 6:1-14.
- Stat Med. 1996; 15:361-87. Publisher Full Text | DOI | PubMed
- BMJ. 2016; 353:i3140. Publisher Full Text | DOI | PubMed
- Epidemiology. 2010; 21:128-38. Publisher Full Text | DOI | PubMed
- BMJ. 2016; 352:i6. Publisher Full Text | DOI | PubMed
- Med Decis Making. 2006; 26:565-74. Publisher Full Text | DOI | PubMed
- Diabetes Care. 2012; 35(Suppl 1):S64-71. Publisher Full Text | DOI | PubMed
- Res Dev Disabil. 2000; 21:469-86. Publisher Full Text | DOI | PubMed
- Metabolism. 2003; 52:908-15. Publisher Full Text | DOI | PubMed
- Diabetes. 2012; 61:2369-74. Publisher Full Text | DOI | PubMed
- Br J Diabetes Vasc Dis. 2009; 9:15-8. DOI
- Diabetes Care. 1998; 21(Suppl 2):B43-9. Publisher Full Text | PubMed
- Lancet. 2009; 373:1773-9. Publisher Full Text | DOI | PubMed
- Diabetes in pregnancy: management from conception to the postnatal period.. 2015.
- Br J Gen Pract. 2014; 64:e17-23. Publisher Full Text | DOI | PubMed
- BMJ. 2012; 344:e3427. Publisher Full Text | PubMed
- BMC Fam Pract. 2010; 11:49. Publisher Full Text | DOI | PubMed
- BMJ. 2011; 343:d4656. Publisher Full Text | DOI | PubMed
- BMJ. 2017; 357:j2099. Publisher Full Text | DOI | PubMed
- BMJ. 2009; 339:b4229. Publisher Full Text | DOI | PubMed
- BMJ. 2011; 342:d3651. Publisher Full Text | DOI | PubMed
- Health Stat Q. 2004; 21:5-14. Publisher Full Text
- Diabetes UK Facts and Statistics.. 2016.
- Clin Epidemiol. 2016; 8:373-80. Publisher Full Text | DOI | PubMed
- Stat Med. 2015; 34:3298-317. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2012; 41:861-70. Publisher Full Text | DOI | PubMed
- BMJ. 2010; 341:c6624. Publisher Full Text | DOI | PubMed
- BMJ. 2015; 351:h3868. Publisher Full Text | DOI | PubMed
- Clinical Prediction Models: A Practical Approach to Development, Validation, and Updating.. 2010.
- BMJ. 2012; 344:e4181. Publisher Full Text | DOI | PubMed
- BMJ. 2010; 340:c2442. Publisher Full Text | DOI | PubMed
Fonte
Hippisley-Cox J, Coupland C (2017) Development and validation of QDiabetes-2018 risk prediction algorithm to estimate future risk of type 2 diabetes: cohort study. The BMJ 359j5019. https://doi.org/10.1136/bmj.j5019





