Background
Nel corso dell’ultimo decennio, i nanobiomateriali (NBM) sono diventati sempre più importanti per l’uso in ingegneria biomedica e farmaceutica[1]. Attualmente, uno dei temi caldi della nanomedicina è l’uso dei NBM per la somministrazione di farmaci. Un biomateriale è qualsiasi materiale progettato per interagire con i sistemi biologici per uno scopo medico. L’International Standards Organization (ISO) ha definito un nanomateriale come un materiale con una, due o tre dimensioni esterne in scala nanometrica (1-100 nm), mentre una nanoparticella è invece definita come una particella con tutte e tre le dimensioni esterne inferiori a 100 nm [2, 3].
I nanomateriali inorganici sono stati comunemente utilizzati in nanomedicina. La loro generazione relativamente semplice e la modificazione della superficie, così come la biocompatibilità, rendono le nanoparticelle d’oro (Au) attraenti per l’utilizzo nell’imaging medico o nella rilevazione e nel trattamento del cancro[4- 6]. Le nanoparticelle d’argento (Ag) sono applicate come rivestimenti per cateteri interni, agenti antibatterici, medicazioni per ferite, impianti ortopedici e impalcature per l’ingegneria tissutale. Le nanoparticelle di ossido di ferro (Fe3O4) sono utilizzate per la bioimmagine, la terapia fototermica e il biosensing[7]. L’idrossiapatite (HAP) appartiene al gruppo dei fosfati di calcio ed è un minerale naturale di importanza biologica e agricola. Per esempio, le ossa umane e animali sono composte da HAP[8, 9]. Sono state esplorate varie applicazioni dell’HAP, compreso il loro uso in rivestimenti che promuovono la rigenerazione ossea e come vettori di farmaci per la somministrazione di antibiotici. La combinazione di HAP con antibiotici è considerata molto promettente e può garantire l’integrazione dell’impianto osseo senza adesione batterica[8, 10].
I nanomateriali a base di polimeri sono spesso utilizzati in applicazioni mediche grazie alla loro elevata sicurezza biologica, alla buona biodegradabilità e alla facilità di produzione e modificazione[11]. Esempi di NBM polimeriche sono il chitosano, l’acido polilattico (PLA), il poliacrilonitrile (PAN), i polidrossialcanoati (PHA) e il poli(acido lattico-glicolico) (PLGA). Il chitosano è un polisaccaride che si trova nell’esoscheletro dei crostacei ed è usato per la guarigione rapida delle ferite o come agente coagulante del sangue[12]. Il PLA ha un buon modulo elastico, una buona formabilità termica e una buona resistenza meccanica ed è quindi utilizzato nella rigenerazione della cartilagine, nell’ingegneria del tessuto osseo e nella riparazione della cartilagine. Inoltre, poiché il PLA aiuta a rilasciare gradualmente un farmaco attraverso una lenta degradazione in vivo, viene utilizzato nella formulazione di farmaci a rilascio controllato[11]. Il PAN è ben noto per la produzione di nanofibre di carbonio con eccellenti proprietà termiche, filabilità, lavorabilità, stabilità meccanica e resistenza alla maggior parte delle sostanze chimiche, ai microrganismi, al calore e alla luce del sole. Inoltre, le fibre PAN sono state studiate per il loro rilascio controllato di varie nanoparticelle metalliche come le nanoparticelle d’argento o d’oro insieme ad additivi organici ed inorganici per la terapia antibatterica[13]. Il PHA è una nuova classe di biopolimeri microbici che ha attirato grande interesse da parte degli ingegneri dei tessuti come potenziale materiale medico[14]. Il PLGA è ampiamente utilizzato in nanoparticelle, microsfere, pellet e microcapsule. I farmaci incapsulati nella PLGA riducono le reazioni avverse e si accumulano meglio nei tumori[11].
Come tutte le altre sostanze antropogeniche, le NBM possono trovare la loro strada nell’ambiente dove gli individui, le popolazioni, le comunità e gli ecosistemi possono essere esposti ad esse in modi che possono causare impatti. È importante distinguere tra la presenza di una sostanza senza effetti negativi significativi e la presenza di sostanze a livelli che causano effetti negativi. L’ecotossicologia si occupa della relazione tra i risultati delle attività umane e i loro impatti sugli ecosistemi[15]. Ci si aspetta che i prodotti farmaceutici e le farine di carne e ossa si comportino in modo simile nell’ambiente. Come i prodotti farmaceutici, gli NBM vengono escreti nelle urine e nelle feci e quindi entrano nel sistema fognario da dove vengono infine scaricati nelle acque superficiali e distribuiti in tutta la biosfera. Uno studio dell’Agenzia Federale Tedesca per l’Ambiente ha riportato il rilevamento di un totale di 156 prodotti farmaceutici in diversi mezzi ambientali come le acque superficiali, le acque sotterranee e l’acqua potabile[16]. La maggior parte dei prodotti farmaceutici è stata trovata nelle acque superficiali in un intervallo di concentrazione di 0,1-10,0 μg/l. In tutto il mondo sono state identificate più di 600 sostanze farmaceutiche nell’ambiente[17] e 17 sostanze farmaceutiche sono state trovate in ciascuna delle regioni delle Nazioni Unite[16]. Gli effetti tossici dei farmaci sono stati dimostrati a partire da un livello molecolare, come l’inibizione della cicloossigenasi, fino al livello della popolazione, come i cambiamenti comportamentali e gli effetti sulla riproduzione[17, 18]. Per questo motivo, il Bundesamt tedesco Umwelt Bundesamt ha condotto una valutazione del rischio ambientale di 120 medicinali per uso umano, con il risultato che circa il 10% presenta un notevole rischio ambientale potenziale[17].
Le caratteristiche chimiche, fisiche e biologiche dei nanomateriali si differenziano notevolmente dalle proprietà delle particelle a microscala per la loro maggiore superficie rispetto al rapporto volume[2, 19, 20] e per le proprietà nanospecifiche che derivano dagli effetti quantistici o superficiali[21]. Pertanto, l’esperienza disponibile con le sostanze chimiche polimeriche o inorganiche esistenti per quanto riguarda la salute umana e la sicurezza ambientale può non essere rilevante per le NBM[22]. Inoltre, alcuni nanomateriali possono avere un impatto sull’ambiente meno grave di quello che hanno sulla salute umana, mentre altri possono essere più pericolosi per l’ambiente[23]. Quindi, anche se un NBM è biocompatibile e sicuro per l’uomo, ciò non significa che lo stesso valga per l’ambiente. Queste incertezze riguardo alla sicurezza delle NBM potrebbero frenare la loro futura crescita di mercato. Pertanto, è importante valutare il rischio di questi materiali in quanto possono avere effetti negativi sulla salute umana o sull’ambiente[4, 19].
Un primo passo in una valutazione del rischio ambientale è la valutazione del pericolo. Il pericolo complessivo per un comparto ambientale può essere descritto dalla concentrazione prevista senza effetti (PNEC), che è la soglia alla quale non si prevedono effetti negativi sull’ecosistema[24]. La PNEC può essere ottenuta dalle più basse concentrazioni senza effetto osservate (NOEC) o da metodi di estrapolazione statistica che utilizzano distribuzioni cumulative della sensibilità delle specie (SSD)[25]. Per vari nanomateriali ingegnerizzati (ENM) sono state pubblicate valutazioni di rischio che utilizzano SSD per il calcolo della PNEC[26- 29]. Per quanto riguarda le NBM, finora è stato pubblicato solo uno studio che valuta il rischio dei nanomateriali d’oro per applicazioni mediche[30]. Non è stato ancora effettuato alcuno studio sul rischio dei nanomateriali polimerici o altri nanomateriali inorganici utilizzati per la somministrazione di farmaci. Pertanto, lo scopo di questo lavoro è stato quello di condurre una prima valutazione del rischio ambientale per i nanobiomateriali polimerici chitosano, PLA, PAN, PHA e PLGA, ampiamente studiati, nonché per le NBM HAP inorganiche basate su una meta-analisi di studi di ecotossicità pubblicati. Se possibile, la nanoforma del materiale è stata confrontata con la forma sfusa o disciolta per identificare la potenziale tossicità nanospecifica.
Metodi
Raccolta dati sui pericoli
È stata esaminata la letteratura sui pericoli ambientali per chitosano, PLA, PAN, PHA, PLGA e HAP pubblicata prima dell’ottobre 2017 su riviste con un fattore di impatto superiore a 2 nel 2016. Inoltre, sono state utilizzate le schede di sicurezza dei materiali delle aziende interessate, anche se hanno contribuito solo allo 0,8% (2 punti di dati) del database totale.
Sono stati considerati solo gli effetti ecotossicologici sulla sopravvivenza, la crescita, la riproduzione, la schiusa e i cambiamenti in processi metabolici significativi (come la fotosintesi)[27]. All’interno di uno studio, sono stati raccolti solo i dati relativi a un effetto importante per evitare una sovrarappresentazione eccessiva di un singolo studio. Sono stati esclusi effetti minori come cambiamenti nel comportamento, nella colorazione, lievi aggiustamenti biochimici o regolamenti enzimatici. Non sono stati inclusi gli studi di citotossicità su test in vitro con linee cellulari animali. Inoltre, gli endpoint cronici sono stati preferiti rispetto agli endpoint acuti se entrambi erano disponibili nello stesso studio. Quando nello stesso studio sono state testate diverse fonti di particelle, dimensioni delle particelle, condizioni di coltura ecc. sono stati presi in considerazione tutti i diversi endpoint. Pertanto, i dati presentati in seguito non si limitano a una specifica forma di nanomateriale o proprietà delle particelle (ad es. rivestimento superficiale specifico o carica superficiale), ma considerano piuttosto una gamma di possibili caratteristiche dei nanomateriali e rendono quindi il modello applicabile a un’ampia gamma di NBM. Nella valutazione sono stati riportati e utilizzati diversi endpoint: MIC (concentrazione minima inibitoria), LOEC (concentrazione minima di effetto osservata), EC15, EC25, EC50, IC50 e LC50. Negli studi in cui anche la più alta concentrazione di esposizione non ha mostrato effetti negativi sull’organismo testato, questo valore è stato incluso come la più alta concentrazione osservata senza effetto (HONEC).
Valutazione dei dati
Nella maggior parte dei casi, i valori NOEC cronici, necessari per la derivazione del valore PNEC[25], non erano disponibili. Così ognuno degli endpoint ecotossicologici è stato trasformato da due diversi fattori di valutazione (AF) basati sulla guida REACH[25]. Il primo AF viene utilizzato per estrapolare l’effetto osservato in concentrazioni senza effetto. Un AF di 10 è stato utilizzato per LC/EC/IC25-50, un AF di 2 per LC/EC/IC10-20, MIC e LOEC, e un AF di 1 per HONEC e NOEC. Il secondo fattore di valutazione rappresenta l’estrapolazione da effetti a breve e a lungo termine. Gli studi acuti hanno ricevuto AF più elevati rispetto agli studi che riportavano effetti cronici. Agli studi a lungo termine è stato assegnato un AF di 1, mentre gli studi a breve termine hanno ricevuto un AF di 10. Maggiori informazioni sulla selezione dei fattori di valutazione si trovano in uno studio precedente[26].
Gli endpoint raccolti provenivano da materiali di diversa morfologia (rotondi, ovali, sferici, a forma di bastoncelli, fogli, ad ago, ecc.) e di diverse dimensioni (fino a 400 nm per alcune NBM). Complessivamente sono stati raccolti 231 punti di dati. I risultati sono riassunti nella Tabella 1.Tutti i punti di dati e i rispettivi fattori di valutazione si trovano nel file aggiuntivo 1: Tabelle S1-S6. 2. Non sono stati trovati dati per PLGA, PLA o PHA. Pertanto non è stato possibile effettuare una valutazione dei pericoli per questi materiali. La maggior parte degli esperimenti ecotossicologici utili per la nostra valutazione dei pericoli sono stati condotti su organismi d’acqua dolce, mentre sono stati effettuati solo pochi studi sugli organismi del suolo. Non sono stati trovati studi ecotossicologici per altri comparti ambientali (ad es. sedimenti e sistemi marini). Molti studi hanno lavorato con batteri patogeni e sono stati inclusi in una prima valutazione complessiva. La ragione di ciò è che molti studi si sono concentrati sulle proprietà antimicrobiche del chitosano/nano-chitosano disciolto invece che sul loro impatto ecologico, e quindi la maggior parte degli organismi di prova erano batteri e funghi patogeni. Una valutazione finale è stata effettuata senza questi batteri, designati come “organismi ambientali”. Eliminando questi punti di dati, l’ecotossicità per tutti gli altri organismi ambientali viene visualizzata in modo più esplicito. Inoltre, negli studi in cui è stato espressamente indicato che le particelle erano “nanoparticelle”, questa designazione è stata controllata per le dimensioni delle particelle segnalate. Se non è stato menzionato nulla, le pubblicazioni sono state vagliate se il lavoro ha utilizzato la forma disciolta o alla rinfusa del materiale e poi caratterizzato come “non-nano”. Durante la preparazione del chitosano per l’esposizione, il materiale viene disciolto e quindi il termine disciolto è stato utilizzato per il chitosano non-nano.Tabella1Riepilogo del numero di endpoint ecotossicologici trovati per le NBMsNBMCompartment# Endpoints# Endpoints# Specie# Gruppi tassonomici# Endpoints sull’organismo ambientalesaNano-chitosanFreshwater16734Terreno000000Non-nano chitosanbFreshwater1382555Terreno60820Nano-HAPFreshwater13638Terreno1110Non-nano HAPFreshwater000000Terreno000000PAN nanofibreFreshwater2110Terreno1110Non-nano PANFreshwater0000Soil0000Nano-PLGAFreshwater0000Soil0000Non-nano PLGAFreshwater0000Soil0000Nano-PLAFreshwater0000Soil0000Non-nano PLAFreshwater0000Soil00Nano-PHAFreshwater0000Soil0000Nano-PHAFreshwater0000Non-nano PHAFreshwater0000Soil0000aOrganismo ambientale sta per tutte le specie ad eccezione di batteri e funghi patogeniDissolto
Modellazione della distribuzione della sensibilità delle specie
Gli endpoint raccolti nella Tabella 1sono stati convertiti in PNEC sulla base di due approcci. Se per una determinata NBM era disponibile un solo endpoint ecotossicologico, è stato applicato un fattore di valutazione di 1000 sul più basso EC50 o, se non era disponibile un valore EC50, sull’endpoint riportato, come suggerito dalla linea guida REACH[25]. Se erano disponibili più endpoint per più specie, è stato costruito un SSD. Le concentrazioni ecotossicologiche degli endpoint sono state prima convertite in valori NOEC cronici utilizzando i fattori di valutazione sopra descritti. Poi è stata calcolata una distribuzione probabilistica della sensibilità delle specie (pSSD)[31] per ogni sostanza, utilizzando tutti gli endpoint disponibili. È stato estratto un valore PNEC come 5° percentile delle pSSD, come raccomandato dalla guida REACH[25]. Con 10.000 cicli di simulazione e una PNEC estratta per ciclo, è stata ricavata una distribuzione di probabilità PNEC.
Risultati
Caratterizzazione delle nanoparticelle
Le distribuzioni dimensionali delle nanoparticelle di nano-chitosano e HAP utilizzate negli studi sull’acqua dolce sono mostrate in Fig. 1.La figura mostra anche la percentuale di punti di dati per i quali è stato riportato il diametro delle particelle. I diametri medi variavano da 0 a 350 nm per il nano-chitosano e da 0 a 250 nm per le nanoparticelle HAP. Per il nano-chitosano, il diametro era disponibile per l’81% dei punti di dati, mentre per l’HAP, il diametro medio era disponibile per tutti i punti di dati. Le forme delle nanoparticelle variavano notevolmente per i diversi materiali in diversi studi (File aggiuntivo 1: Tabella S7). La maggior parte delle nanoparticelle di chitosano sono di forma rotonda o ovale; alcune sono agglomerate in cluster. La maggior parte delle nanoparticelle HAP sono a forma di asta, mentre il PAN è per lo più a forma di nanofibre e caricato con altri materiali.Fig. 1Riepilogo delle distribuzioni dimensionali del nano-chitosano e dell’HAP utilizzati negli studi di ecotossicità dell’acqua dolce. “NA”: dimensioni non riportate nello studio
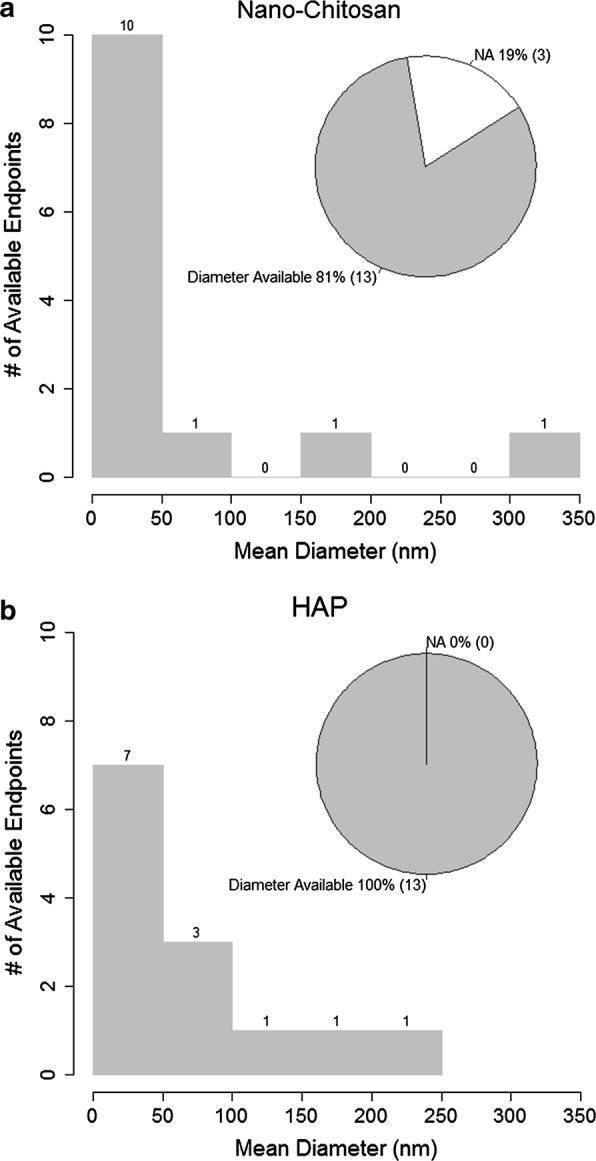
Fig. 1.Sintesi delle distribuzioni dimensionali di nano-chitosano e HAP utilizzati negli studi di ecotossicità in acqua dolce. “NA”: dimensioni non riportate nello studio
Distribuzioni probabilistiche della sensibilità delle specie (pSSD)
I pSSD per chitosano, nano-chitosano e HAP in acqua dolce sono mostrati in Fig. 2. Per quanto riguarda il chitosano in acqua dolce, sono mostrati la forma nano e disciolta. Le sfumature mostrano il massimo, il minimo, il 95° e il 75° quantile; la linea mostra la media di tutti i singoli pSSD. I singoli NOEC derivati dai diversi endpoint sono stati raggruppati per specie e sono mostrati come punti. Per molte specie, l’intervallo dei singoli valori NOEC si estende per molti ordini di grandezza. Per esempio, i diversi valori NOEC per E. coli, S. aureus e S. typ hi per il chitosano in acqua dolce, provenienti da diversi studi, variano su tre ordini di grandezza (vedi Fig. 2a). Ciò può essere attribuito ad una serie di incertezze, come le diverse proprietà delle nanoparticelle, le diverse condizioni sperimentali, ecc. Alcune specie sono state testate per quanto riguarda la loro tossicità per diverse NBM. Ad esempio, la tossicità dell’E. coli è stata testata per il chitosano, il nano-chitosano e l’HAP. Mentre l ‘E. coli è la specie meno sensibile per quanto riguarda l’HAP, è intorno alla media per il chitosano e il nano-chitosano.Fig. 2Probabilistic species sensitivity distributions (pSSDs) di chitosano, nanoparticelle di chitosano, e nanoparticelle HAP in acqua dolce
La valutazione finale è stata eseguita dove tutti i batteri e funghi patogeni sono stati rimossi dal pSSD originale per dissolvere e nano-chitosano in acqua dolce. Questi pSSD sono mostrati in Fig. 3.Per il chitosano, le cinque specie più sensibili sono le specie ambientali, mentre tutte le altre specie sono batteri o funghi patogeni. Pertanto, i batteri e i funghi patogeni sono meno sensibili al chitosano rispetto alle specie ambientali. Le specie ambientali per il nano-chitosano, d’altra parte, si trovano da qualche parte al centro del pSSD.Fig. 3Probabilistic species sensitivity distributions (pSSDs) di chitosano e nanoparticelle di chitosano in acqua dolce, rimuovendo tutti i batteri e funghi patogeni presenti nei dati raccolti.
Per il terreno, sono stati trovati solo dati sufficienti per calcolare un pSSD per il chitosano disciolto, che è mostrato in Fig. 4. Non sono stati trovati dati per la forma nano. Per HAP e PAN, era disponibile solo un endpoint ecotossicologico per ciascuna di queste sostanze e quindi solo un PNEC ma non è stato possibile calcolare un pSSD.Fig. 4Probabilistic species sensitivity distribution (pSSD) del chitosano nel suolo
Per consentire un confronto tra i diversi materiali, i pSSD medi in acqua dolce di tutti i composti sono tracciati insieme in Fig. 5. Poiché è stato possibile calcolare un pSSD nel terreno solo per il chitosano, non viene mostrato un confronto di questo tipo per il comparto del terreno. La figura mostra che il chitosano ha una distribuzione molto ampia dei dati di tossicità, che vanno oltre sei ordini di grandezza da100 a106 μg/l. Il chitosano e il nano-chitosano, d’altra parte, hanno un pSSD molto più ripido, con dati di tossicità distribuiti solo su tre ordini di grandezza.Fig. 5Distribuzioni probabilistiche cumulative di sensibilità delle specie (pSSD) di chitosani e HAP in acqua dolce. Per il chitosano, le curve sono mostrate per tutti i dati e per i batteri patogeni rimossi (etichettati “env”)
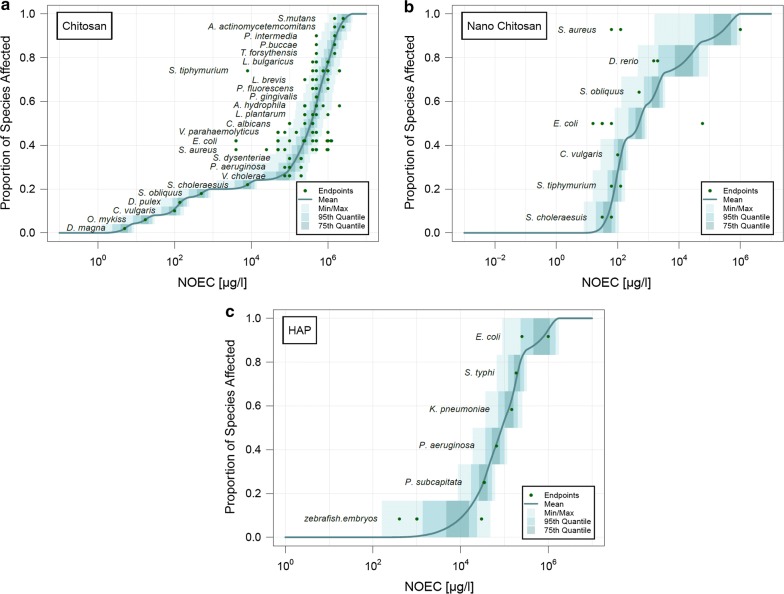
Fig. 2.Distribuzioni della sensibilità delle specie probabilistiche (pSSDs) di chitosano, nanoparticelle di chitosano e nanoparticelle HAP in acqua dolce
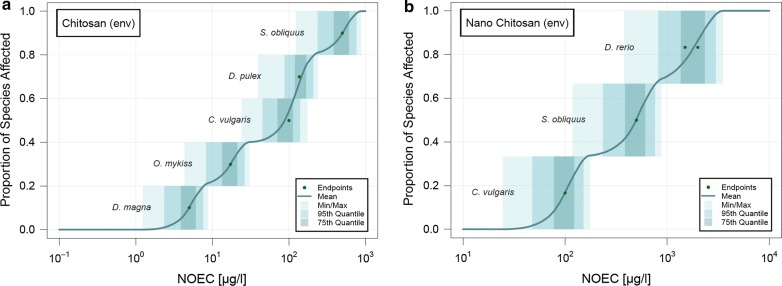
Fig. 3.Distribuzioni probabilistiche della sensibilità delle specie (pSSD) del chitosano e delle nanoparticelle di chitosano in acqua dolce rimuovendo tutti i batteri e funghi patogeni presenti nei dati raccolti
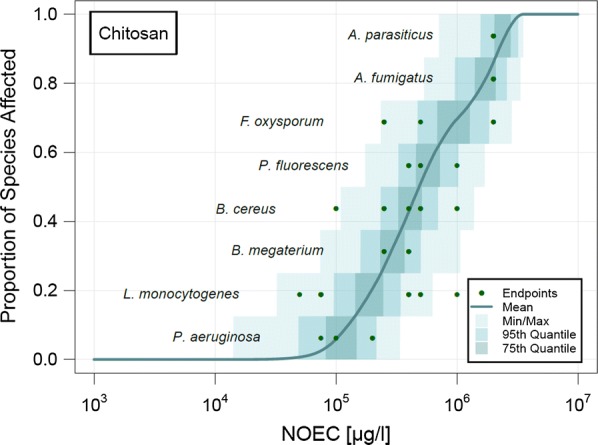
Fig. 4.Distribuzione della sensibilità delle specie probabilistiche (pSSD) del chitosano nel suolo
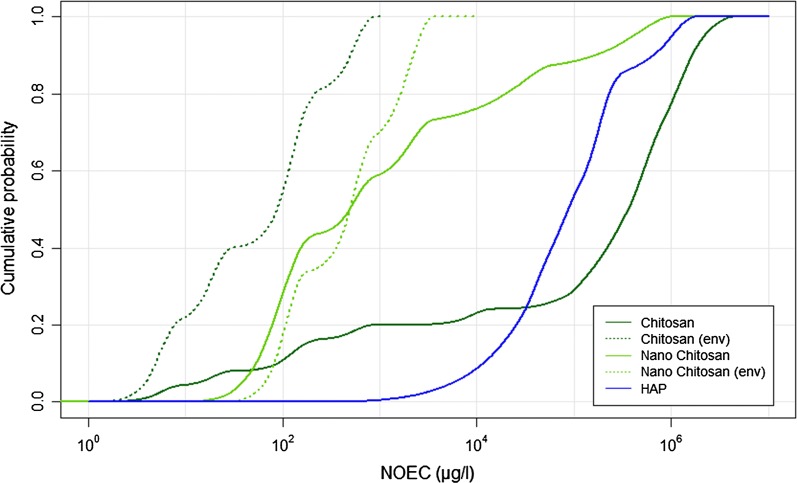
Fig. 5.Distribuzioni cumulative di sensibilità delle specie probabilistiche (pSSD) di chitosani e HAP in acqua dolce. Per il chitosano, le curve sono mostrate per tutti i dati e per i batteri patogeni rimossi (etichettati “env”)
Distribuzione prevista della concentrazione senza effetto (PNEC)
La distribuzione PNEC per ogni NBM è stata derivata calcolando il 5° percentile di ogni singolo pSSD. La distribuzione è diversa per ogni nanomateriale ed è mostrata per l’acqua dolce nel file aggiuntivo 1: Figura S1. Sono state calcolate la mediana, la media e la modalità delle distribuzioni PNEC. Esse sono mostrate per ogni NBM inclusa la loro nanoforma (se disponibile) nella Tabella 2 per l’acqua dolce e nella Tabella 3 per il suolo. Sono elencati anche il minimo, il massimo e il 25° e il 75° percentile. Non è possibile mostrare alcuna distribuzione per il PAN in acqua dolce così come per il PAN e il HAP nel suolo, poiché in ogni caso era disponibile un solo endpoint. Dalle tabelle 2 e 3 si può vedere che la PNEC per l’acqua dolce e il suolo aumenta da più sensibile a meno sensibile nel seguente ordine: Tabella 2Mediano, media, modalità, minimo, massimo, 25° e 75° quantile dalle distribuzioni previste di concentrazione senza effetto (PNEC) in acqua dolce[μg/l]ChitosanaNano-ChitosanaHAPPANMedian5999.4*103NAbMean51001.1*1043.0*106Mode5972.7*103NAMin125120NA25%4784.4*103NA75%61201.5*104NAMax81805.0*104NATutti i valori in µg/l (I valori per chitosano e nano-chitosano utilizzando tutti gli endpoint disponibili si trovano nel file aggiuntivo 1: Tabella S9)valoriaPNECconsiderando solo la distribuzione ambientale delle speciebNo come un solo endpoint è stato trovatoTabella 3Mediano, media, modalità, minimo, massimo, 25° e 75° quantile dalle distribuzioni previste di concentrazione senza effetto (PNEC) nel suolo[mg/kg]ChitosanHAPPANMedian110NAaNAaNAaMean1190.333Mode97NANAMin12NANA25%83NANA75%148NANAMax335NANATutti i valori in mg/kgaNessuna distribuzione in quanto è stato trovato un solo punto finaleAcqua dolce: Chitosano: Chitosano: HAP: HAP: HAP: Chitosano
Questi ordini indicano che le nanofibre PAN hanno la più alta concentrazione prevista di nanofibre senza effetto in acqua dolce e la seconda più alta nel suolo e quindi ci si aspetta che siano le meno tossiche delle NBM studiate. È anche interessante notare che l’HAP ha una PNEC elevata in acqua dolce, ma la PNEC più bassa tra i materiali studiati nel suolo. Ciò potrebbe implicare che la tossicità di un materiale potrebbe anche dipendere dai mezzi in cui si trova.
Discussione
La disponibilità di dati ecotossicologici differisce in modo significativo tra le FCO studiate. Per il chitosano erano disponibili molti studi ecotossicologici, mentre per il PLA, il PHA e il PLGA non ne sono stati trovati. Ci sono diverse ragioni per la mancanza di dati per alcune NBM in alcuni comparti ambientali. Per il PAN sono stati trovati alcuni studi di tossicità, ma la maggior parte di essi si è concentrata sulla citotossicità in vitro e sui test sugli animali (ratti e topi) nel contesto della valutazione del rischio per l’uomo. Inoltre, gli endpoint ecologici per una serie di studi sulle membrane nano-PAN e sulle nanofibre PAN non erano disponibili perché le concentrazioni esatte utilizzate non erano menzionate nello studio. Mentre ci sono dati sufficienti per il chitosano e l’HAP, le loro proprietà antimicrobiche (antibatteriche/fungicide) erano più preoccupanti in molti studi. Ciò è causato dall’applicazione antimicrobica dei materiali studiati (ad esempio medicazioni per ferite, impalcature dei tessuti e ingegneria ossea). Di conseguenza, la maggior parte degli studi sugli effetti si è concentrata sui microrganismi patogeni e non dovrebbe essere utilizzata direttamente per una valutazione ecotossicologica.
A causa della loro biodegradabilità[32, 33], si prevede che le quantità di residui di NBM polimeriche rilasciate nell’ecosistema saranno sostanzialmente ridotte. La maggior parte degli studi tossicologici di questi materiali ha quindi mostrato una maggiore preoccupazione per i rischi per l’uomo (in vivo) rispetto al rischio ecologico. Ad esempio, la PLGA è considerata come uno dei nanosistemi biodegradabili più utilizzati con successo per lo sviluppo di nanomedicine, poiché subisce l’idrolisi nell’organismo per produrre i metaboliti biodegradabili acido lattico e acido glicolico che sono facilmente metabolizzati dall’organismo. Pertanto, non ci si aspetta che la PLGA sia presente nell’ambiente a concentrazioni elevate e raramente vengono condotti studi sugli effetti ecotossicologici di questo materiale.
Un’altra ragione per la mancanza di dati è che in alcuni studi, la NBM, in particolare le nanofibre/nanoparticelle PAN e PLGA, non era il centro dell’esperimento, ma la tossicità del principio attivo. Pertanto solo il controllo o il bianco era rilevante per la nostra valutazione. È stata prestata particolare attenzione a scartare gli esperimenti per HAP che utilizzavano nanoparticelle di idrossiapatite drogate con metallo, poiché ciò aumenta la tossicità per gli organismi di prova, il che porta ad una sopravvalutazione della tossicità. Ci sono molti meno dati disponibili per il sistema del suolo che per l’acqua dolce. Una delle ragioni di questa carenza di dati è che diversi studi ecotossicologici non hanno potuto essere presi in considerazione perché gli organismi del suolo sono stati studiati in sospensioni acquose e queste condizioni di prova sono state ritenute inappropriate ai fini della valutazione del rischio[27]. Inoltre, non va dimenticato che le riviste spesso scartano gli studi che non mostrano alcun effetto sull’organismo studiato[34]. Questo innesca possibili distorsioni o sovrastima degli effetti ambientali (cioè l’ecotossicità), soprattutto per le nanofibre PAN relativamente meno tossiche e le nanoparticelle PLGA.
Per il chitosano, che è risultato essere il più tossico delle NBM studiate in acqua dolce, sono stati trovati molti endpoint per diverse specie diverse. Per il PAN, invece, è stato trovato solo un endpoint che non mostrava quasi nessuna tossicità. È comprensibile che un materiale con una bassa tossicità prevista sia meno studiato di un materiale abbastanza tossico.
Inoltre, è necessario prestare attenzione quando si utilizza il PNEC calcolato a partire da un solo endpoint disponibile. Per l’HAP in acqua dolce, erano disponibili due endpoint: un EC50 e un HONEC per l ‘E. coli. Il valore EC50 è stato preso e diviso per il fattore di valutazione per ricavare la PNEC. Per HAP e PAN nel suolo, è stato trovato un solo endpoint ciascuno: un MIC di K. pneumoniae per HAP e un HONEC di B. cereus per PAN. In mancanza di dati migliori, questi valori rappresentano una prima indicazione di tossicità per questi materiali.
Le linee guida REACH stabiliscono che la fiducia può essere associata a una PNEC derivata per estrapolazione statistica se il database contiene almeno 10 NOEC (preferibilmente più di 15) per diverse specie che coprono almeno otto gruppi tassonomici[25]. In questo studio, più di 10 NOEC sono state trovate solo per il nano-chitosano in acqua dolce (16 endpoint), il chitosano disciolto in acqua dolce (138) e nel suolo (60), e il nano-HAP in acqua dolce (13). Per tutte le NBM valutate, sono stati ottenuti punti di dati per meno di otto gruppi tassonomici. Il chitosano disciolto in acqua dolce ha coperto il maggior numero di gruppi tassonomici in questo studio con i dati di cinque gruppi tassonomici. Sebbene i dati non siano sufficienti per una rigorosa valutazione del rischio normativo, essi forniscono una prima analisi dei dati disponibili sull’ecotossicità.
Uno degli obiettivi del lavoro era quello di valutare se esiste una tossicità nano-specifica delle NBM. Questo poteva essere valutato solo per il chitosano, dove erano disponibili dati sia per il chitosano disciolto che per il nano-chitosano. Convenzionalmente, le nanoparticelle sono definite come particelle di dimensioni comprese tra 1 e 100 nm [35], tuttavia il termine “nanoparticelle” è utilizzato anche in letteratura per le NBM le cui dimensioni sono superiori a 100 nm. Questa contraddizione dovrebbe essere notato quando si fanno politiche o linee guida per tali “nanoparticelle”. Inoltre, il numero di informazioni disponibili sulle distribuzioni delle dimensioni delle nanoparticelle era molto limitato, in alcuni studi mancava anche completamente (come mostrato nella Fig. 1). I dati disponibili suggeriscono che la nano-forma di chitosano è meno tossica della forma disciolta. Questo è simile ai dati relativi ad altre nanoparticelle che possono dissolversi, ad esempio nano-Ag, nano-CuO e nano-ZnO, dove anche la forma disciolta è risultata essere molto più tossica della nanoforma[36].
La figura 6 confronta i valori PNEC nel comparto dell’acqua dolce per le NBM studiate (punti rossi) e per diversi altri inquinanti comuni: nanomateriali ingegnerizzati (marrone), prodotti farmaceutici (verde) e altri inquinanti come metalli e pesticidi (blu). Se disponibile, è stata utilizzata la PNEC utilizzando solo specie ambientali. I dettagli e i relativi riferimenti sono riportati nel file aggiuntivo 1: tabella S8. In generale, il chitosano ha una tossicità relativamente elevata in acqua dolce, paragonabile ad altri ENM, mentre il PAN e l’HAP possono essere trattati come quasi non tossici. Il chitosano ha un’ecotossicità simile a quella di molti altri prodotti farmaceutici che sono stati studiati per i loro effetti sugli organismi. La nano-forma del chitosano è, tuttavia, meno tossica dei comuni ENM, gli antibiotici estrogeni, doxiciciclina e amoxicillina, i metalli pesanti Cu, Pb, Cd e Hg e gli inquinanti organici triclosan, dibutilftalato (DBP) e diclorvos. Quindi, in sintesi, sulla base dei dati disponibili per le NBM studiate c’è un’indicazione che il nano-chitosano potrebbe essere di massima preoccupazione per l’ambiente, mentre il PAN e l’HAP sembrano non rappresentare una tossicità significativa. È importante notare in questa sede che possiamo solo presentare una valutazione del pericolo ambientale e quindi non possiamo avanzare alcuna pretesa sui rischi ambientali. Per poter effettuare una valutazione del rischio ambientale, avremmo bisogno anche di informazioni sull’esposizione ambientale delle NBM considerate, che attualmente non sono disponibili. L’unica valutazione del rischio di un nanomateriale utilizzato in un contesto medico pubblicata finora è per i nano-Au[30]. Gli studi futuri devono fornire maggiori informazioni sull’esposizione ambientale delle NBM in modo da poter effettuare una valutazione completa del rischio per un numero maggiore di materiali.Fig. 6Concentrazioni senza effetto previsto (PNEC) di nanobiomateriali (NBM), nanomateriali ingegnerizzati (ENM), prodotti farmaceutici e alcuni inquinanti in acqua dolce. Per i riferimenti, cfr. il file aggiuntivo 1: tabella S8
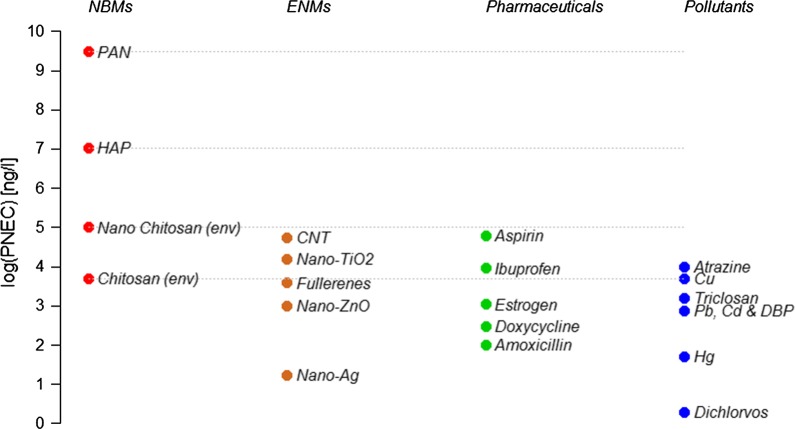
Fig. 6.Fig. 6. Concentrazioni previste senza effetto (PNEC) di nanobiomateriali (NBM), nanomateriali ingegnerizzati (ENM), prodotti farmaceutici e alcuni inquinanti in acqua dolce. Per i riferimenti, cfr. il file aggiuntivo 1: tabella S8
File aggiuntivo
File aggiuntivo 1. 2. Tabelle aggiuntive e figura.
References
- Li X, Lee SC, Zhang S, Akasaka T. Biocompatibility and toxicity of nanobiomaterials 2014. J Nanomater. 2015; 2015:2012-2014.
- Mahmoudi M, Hofmann H, Rothen-Rutishauser B, Petri-Fink A. Assessing the in vitro and in vivo toxicity of superparamagnetic iron oxide nanoparticles. Chem Rev. 2012; 112(4):2323-2338. DOI | PubMed
- Landsiedel R. Toxico-/biokinetics of nanomaterials. Arch Toxicol. 2012; 86(7):1021-1060. DOI | PubMed
- Bonakdar S, Mashinchian O. Stem cell nanoengineering. Wiley: Hoboken; 2015.
- Hirn S. Particle size-dependent and surface charge-dependent biodistribution of gold nanoparticles after intravenous administration. Eur J Pharm Biopharm. 2011; 77(3):407-416. DOI | PubMed
- Rambanapasi C. Dual radiolabeling as a technique to track nanocarriers: the case of gold nanoparticles. Molecules. 2015; 20(7):12863-12879. DOI | PubMed
- Lin Z, Monteiro-Riviere NA, Riviere JE. Pharmacokinetics of metallic nanoparticles. Rev Nanomed Nanobiotechnol. 2015; 7(2):189-217. DOI
- Al-Sokanee ZN, Toabi AAH, Al-assadi MJ, Alassadi EAS. The drug release study of ceftriaxone from porous hydroxyapatite scaffolds. AAPS Pharm Sci Tech. 2009; 10(3):772-779. DOI
- Shashvatt U, Aris H, Blaney L. Evaluation of animal manure composition for protection of sensitive water supplies through nutrient recovery processes. Elsevier Inc.: New York; 2016.
- Geuli O, Metoki N, Zada T, Reches M, Eliaz N, Mandler D. Synthesis, coating, and drug-release of hydroxyapatite nanoparticles loaded with antibiotics. J Mater Chem B. 2017; 5(38):7819-7830. DOI
- Han J, Zhao D, Li D, Wang X, Jin Z, Zhao K. Polymer-based nanomaterials and applications for vaccines and drugs. Polymers (Basel). 2018; 10(1):1-14. DOI
- Singh P, Mall BB, Singh RR, Chandra R, Saxena A. Nanobiomaterial in dental medicine: a review. IOSR J Dent Med Sci. 2017; 16(10):68-71.
- Grumezescu AM. Engineering of nanobiomaterials. Elsevier: Chennai; 2016.
- Zhao K, Deng Y, Chen JC, Chen GQ. Polyhydroxyalkanoate (PHA) scaffolds with good mechanical properties and biocompatibility. Biomaterials. 2003; 24(6):1041-1045. DOI | PubMed
- Calow P, Forbes VE. eLS. Wiley: New York; 2014.
- .Publisher Full Text
- Bergmann A, Fohrmann F, Weber F-A. Zusammenstellung von Monitoringdaten zu Umweltkonzentrationen von Arzneimitteln. Umwelt Bundesamt: Dessau-Roßlau; 2011.
- Whitacre DM. Reviews of environmental contamination and toxicology. Springer: Berlin; 2018.
- Christenson EM. Nanobiomaterial application in orthopedics. J Orthop Res. 2007; 25:11-22. DOI | PubMed
- Guisbiers G, Mejía-Rosales S, Leonard Deepak F. Nanomaterial properties: size and shape dependencies. J Nanomater.. 2012; 2012:2012-2014. DOI
- Roduner E. Size matters: why nanomaterials are different. Chem Soc Rev. 2006; 35:583-592. DOI | PubMed
- Klaine SJ. Paradigms to assess the environmental impact of manufactured nanomaterials. Environ Toxicol Chem. 2012; 31(1):3-14. DOI | PubMed
- Som C, Nowack B, Krug HF, Wick P. Toward the development of decision supporting tools that can be used for safe production and use of nanomaterials. Acc Chem Res. 2013; 46(3):863-872. DOI | PubMed
- ECHA. Guidance on information requirements and chemical safety assessment part B: hazard assessment. 2011.
- ECHA. Guidance on information requirements and chemical safety assessment chapter R. 10: characterisation of dose [concentration]-response for environment. 2008. p. 1–65.
- Wang Y, Kalinina A, Sun T, Nowack B. Probabilistic modeling of the flows and environmental risks of nano-silica. Sci Total Environ. 2016; 545–546:67-76. DOI
- Coll C, Notter D, Gottschalk F, Sun T, Som C, Nowack B. Probabilistic environmental risk assessment of five nanomaterials (nano-TiO2, nano-Ag, nano-ZnO, CNT, and fullerenes). Nanotoxicology. 2016; 10(4):436-444. DOI | PubMed
- Wang Y, Deng L, Caballero-Guzman A, Nowack B. Are engineered nano iron oxide particles safe? an environmental risk assessment by probabilistic exposure, effects and risk modeling. Nanotoxicology. 2016; 10(10):1545-1554. DOI | PubMed
- Gottschalk F, Kost E, Nowack B. Engineered nanomaterials in water and soils: a risk quantification based on probabilistic exposure and effect modeling. Environ Toxicol Chem. 2013; 32(6):1278-1287. DOI | PubMed
- Mahapatra I. Probabilistic modelling of prospective environmental concentrations of gold nanoparticles from medical applications as a basis for risk assessment. J Nanobiotechnol. 2015; 13(1):1-14. DOI
- Gottschalk F, Nowack B. A probabilistic method for species sensitivity distributions taking into account the inherent uncertainty and variability of effects to estimate environmental risk. Integr Environ Assess Manag. 2013; 9(1):79-86. DOI | PubMed
- Hu Y-L, Qi W, Han F, Shao J-Z, Gao J-Q. Toxicity evaluation of biodegradable chitosan nanoparticles using a zebrafish embryo model. Int J Nanomed. 2011; 6:3351-3359.
- Kumari A, Yadav SK, Yadav SC. Biodegradable polymeric nanoparticles based drug delivery systems. Colloids Surf B Biointerfaces. 2010; 75(1):1-18. DOI | PubMed
- Krug HF. Nanosafety research-are we on the right track?. Angew Chemie Int Ed.. 2014; 53(46):12304-12319.
- European Commission. Commission recommendation of 18 october 2011 on the definition of nanomaterial (2011/696/EU). Off J Eur Union. 2011; 275:38-40.
- Notter D, Mitrano DM, Nowack B. Are nanosized or dissolved metals more toxic in the environment? A meta-analysis. Environ Toxicol Chem. 2014; 33(12):2733-2739. DOI | PubMed
Fonte
Hauser M, Li G, Nowack B (2019) Environmental hazard assessment for polymeric and inorganic nanobiomaterials used in drug delivery. Journal of Nanobiotechnology 1756. https://doi.org/10.1186/s12951-019-0489-8





