Abstract
Introduzione
Il dolore lombare cronico (CLBP) è molto comune ed è associato ad un notevole onere per il paziente e ad una notevole spesa per la salute[1- 3]. È in gran parte di natura aspecifica e fino all’85% dei pazienti non ha una chiara diagnosi pathoanatomica quando è presente in isolamento[1– 4]. Abbiamo già evidenziato in precedenza le considerazioni eziologiche e terapeutiche per il CLBP, insieme alle limitazioni all’interno delle evidenze esistenti[5]. Una gran parte dei pazienti affetti da CLBP sono trattati con farmaci analgesici di routine con risultati insoddisfacenti che portano ad una frequente esplorazione delle opzioni di seconda linea, compresi i gabapentinoidi[6, 7]. In particolare, l’uso di gabapentin (GB) e di pregabalin (PG) si basa sulla logica della modulazione della neurotrasmissione potenziata a livello dei recettori presinaptici dei neuroni afferenti. Entrambi questi farmaci agiscono principalmente sulla sottounità α-2 delta-2 dei canali del calcio dipendenti dalla tensione [8, 9] e possono essere considerati come aventi azioni farmacodinamiche molto simili sul dolore e altri sintomi. Sono considerati molto efficaci per le condizioni di dolore neuropatico (NP). I tentativi di sfruttare il loro potenziale terapeutico per altre condizioni dolorose hanno mostrato risultati contrastanti[10, 11]. L’uso dei gabapentinoidi per il CLBP richiede una lenta titolazione a dosi terapeutiche e un mantenimento a lungo termine. Con un trattamento prolungato, il potenziale di guadagno rispetto a possibili effetti avversi e rischi potrebbe diventare poco chiaro[9]. Ci sono state preoccupazioni per l’uso eccessivo di GB fuori etichetta, nonostante l’evidente mancanza di studi clinici[12], che richiedono linee guida consultive da parte del National Health Services (NHS), Regno Unito, sul rischio di uso improprio dei gabapentinoidi[13]. I nostri obiettivi primari erano di valutare i benefici della GB e della PG nel CLBP per diminuire il dolore e di esaminare il rischio di effetti avversi. In secondo luogo, abbiamo valutato gli effetti di PG e GB sugli esiti dell’Iniziativa sui metodi, la misurazione e la valutazione del dolore negli studi clinici (IMMPACT)[14]. I risultati considerati sono stati il funzionamento fisico ed emotivo, le valutazioni dei partecipanti sul miglioramento globale e la soddisfazione per il trattamento e la disposizione dei partecipanti. Inoltre, abbiamo cercato di valutare se l’uso dei gabapentinoidi migliora selettivamente il sollievo dal dolore nei pazienti con CLBP neuropatici predominanti.
Metodi
Trattandosi di una revisione sistematica, l’approvazione del comitato etico non è applicabile.
Protocollo e registrazione
La nostra recensione è stata registrata presso PROSPERO con il numero di registrazione CRD42016034040. Questo rapporto è stato redatto secondo le linee guida PRISMA[15], come suggerito dalla rete EQUATOR (Enhancing the QUAlity and Transparency Of health Research)(lista di controllo S1 PRISMA). Il nostro protocollo di revisione dettagliata è stato pubblicato in precedenza[5].
Criteri di ammissibilità
Abbiamo incluso studi randomizzati controllati (RCT) che coinvolgono pazienti adulti (>18 anni di età) con CLBP predominante di 3 mesi o più, con o senza dolore alle gambe. Non abbiamo avuto esclusioni linguistiche. Gli studi con popolazione mista di dolore cronico sono stati inclusi solo se riportano i risultati separatamente per la nostra popolazione di studio di interesse, o se almeno il 90% dei pazienti dello studio sono >18 anni con CLBP predominante. Gli studi sono stati ulteriormente vagliati per gli interventi e sono stati inclusi se hanno randomizzato i pazienti a ricevere “PG” o “GB”, “da soli” o “in combinazione con altri trattamenti”, e li hanno confrontati con eventuali trattamenti attivi o inattivi.
Fonti di informazione
Abbiamo cercato nelle banche dati elettroniche di EMBASE, MEDLINE e nel Registro Centrale delle Prove Controllate (CENTRALE) di Cochrane, dal loro inizio fino al 26 gennaio 2016. Anche il registro degli studi clinici dell’OMS(http://apps.who.int/trialsearch/Default.aspx) e il registro degli studi clinici(https://clinicaltrials.gov/) sono stati ricercati per cercare gli studi registrati, che soddisfano i nostri criteri di idoneità, e sono stati sottoposti a controlli incrociati per le pubblicazioni risultanti. Per essere esaustivi, sono state esaminate le bibliografie delle recensioni pertinenti e degli studi selezionati. Dopo aver effettuato la ricerca originale, abbiamo anche ripetuto la nostra ricerca il20 dicembre 2016 per assicurarci di non aver perso nessuna pubblicazione recente.
Strategia di ricerca
La ricerca è stata effettuata utilizzando una strategia sensibile da un bibliotecario esperto per ogni specifico database. Abbiamo incluso termini che si riferiscono alla popolazione di studio del mal di schiena e termini che si riferiscono ad interventi di studio come GB, PG e anticonvulsivanti[5]. La strategia è fornita come file supplementare(S1 Text).
Screening e selezione dello studio
Con l’aiuto di revisori accoppiati che hanno effettuato lo screening in modo indipendente e in doppio, la selezione dello studio è stata effettuata in 2 fasi. I titoli e gli abstract sono stati vagliati nella prima fase, seguita da uno screening full text sulle citazioni ritenute potenzialmente idonee. Un esercizio di calibrazione tra le coppie di revisori ha garantito la coerenza nello screening e il disaccordo è stato risolto per consenso o attraverso la discussione con il ricercatore principale (HS). Una statistica quadratica kappa sulla decisione finale dell’articolo completo è stata stimata come misura dell’accordo interobserver[16].
Processo di raccolta dei dati
Gli stessi revisori accoppiati hanno estratto i dati in modo indipendente e in doppio, utilizzando moduli di estrazione elettronica dei dati che sono stati pilotati tra i revisori per coerenza e precisione. È stato fornito un manuale di istruzioni per assistere il processo di estrazione dei dati.
Elementi dei dati
I dati estratti da ogni studio comprendevano le caratteristiche dello studio, il rischio di distorsioni (RoB), le informazioni demografiche, la disposizione dei partecipanti attraverso lo studio e i risultati della nostra revisione sulle misure continue e binarie catturate su 6 domini principali, come raccomandato dalle linee guida per la dichiarazione IMMPACT[14].
RoB negli studi individuali
RoB è stato valutato utilizzando lo strumento Cochrane RoB modificato per catturare i componenti della generazione di sequenze casuali, l’occultamento dell’allocazione, l’accecamento dei partecipanti, l’accecamento della valutazione dell’esito e l’analisi di dati di esito incompleti. Inoltre, abbiamo modificato le opzioni di risposta dei domini come “decisamente sì”, “probabilmente sì”, “probabilmente no” e “decisamente no”.”Per ogni dominio, alle risposte delle categorie “decisamente sì” e “probabilmente sì” è stato assegnato un RoB alto e quelle delle categorie “probabilmente no” e “sicuramente no” un RoB basso[17]. Gli studi di crossover sono stati valutati per un ragionevole periodo di dilavamento[18]. Non è stato fatto alcun tentativo di contattare gli autori per avere chiarimenti sulle voci RoB. La segnalazione selettiva dei risultati è stata giudicata sulla base dei risultati descritti nella sezione dei metodi, ma non riportata nella sezione dei risultati[19].
Altre voci RoB
Inoltre, abbiamo considerato i domini per gli studi sul dolore cronico come suggerito da Moore et al.[20] e abbiamo aggiunto i domini del tempo di valutazione dell’esito (12 settimane o più come basso rischio), la soglia di valutazione dell’esito (>30% di miglioramento nel sollievo dal dolore come basso rischio), e il potenziale di bias di pubblicazione basato sulla soglia di dimensione del campione (>50 come basso rischio) per identificare uno studio come avente il potenziale di bias di pubblicazione basato sulla bassa dimensione del campione. Gli studi con un campione di dimensioni ridotte possono aumentare le possibilità di ottenere effetti terapeutici di dimensioni erroneamente elevate e contribuire indirettamente alla distorsione della pubblicazione[21, 22].
Risultati e priorità
A priori, abbiamo specificato l’alleviamento del dolore e la sicurezza (effetti avversi) come risultati primari e altri come risultati secondari, e abbiamo dato priorità all’uso dell’intento di trattare l’analisi. Il sollievo dal dolore espresso come risultato sia continuo che categorico, e in vari punti temporali, è stato estratto per tutti i punti temporali riportati. Per il pooling, abbiamo considerato il tipo più comune e la durata più lunga del follow-up riportato. A priori, abbiamo dato priorità ai punteggi dei cambiamenti rispetto ai punteggi finali per l’analisi di pooling. I punteggi di cambiamento sono considerati più efficienti e potenti rispetto al confronto dei punteggi finali, in quanto eliminano dall’analisi una componente di variabilità tra le persone[18]. Per il sollievo dal dolore espresso sotto forma di punteggi continui, abbiamo convertito tutti i risultati dello studio in una comune scala di valutazione numerica 0-10, in quanto è comunemente usata e facile da interpretare [14]. L’approccio alla conversione in una scala comune è mostrato nel testo S2. La sicurezza è stata valutata confrontando il rischio di eventi avversi gravi che causano morte, ospedalizzazione o ritiro dallo studio. Se non è chiaro, abbiamo considerato di segnalare gli effetti avversi più comunemente segnalati. A causa delle differenze previste all’interno delle scale di misurazione, i risultati secondari del miglioramento del funzionamento fisico ed emotivo e le valutazioni dei partecipanti sul miglioramento globale e sulla soddisfazione non sono stati convertiti in un’unica scala comune.
Sintesi dei risultati e misure di sintesi
I dati sono stati messi in comune solo se ci sono 3 o più studi che contribuiscono a un dominio di risultato. I nostri criteri di selezione hanno permesso di selezionare una popolazione relativamente omogenea di CLBP che tende ad essere avvicinata in modo simile da una situazione clinica. Tuttavia, abbiamo riconosciuto il potenziale di eterogeneità basato su interventi di studio e interventi di comparazione. In considerazione di queste ovvie fonti di eterogeneità, abbiamo deciso a priori di mettere in comune gli studi utilizzando PG o GB, da soli o in combinazione, separatamente. I dati estratti sono stati compilati e controllati per verificarne l’accuratezza con Microsoft Excel. RoB è stato valutato utilizzando uno strumento Cochrane RoB modificato, descritto di seguito. Per l’analisi primaria, abbiamo utilizzato un’analisi completa del caso, come riportato nei singoli studi. Sono state effettuate analisi di sensibilità per dati di risultato incompleti. L’analisi e la sintesi sono state effettuate utilizzando Review Manager (RevMan) [Programma per computer], versione 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014; e Microsoft Excel 2011 (versione Mac). Sulla base del comparatore e degli interventi, se non ci si aspettava molto tra le varianze dello studio, è stato utilizzato un modello di effetti fissi per il pooling. Tuttavia, se si sospettava una variazione tra gli studi, o in presenza di un’eterogeneità inspiegabile, è stato scelto un modello di effetti casuali[18]. Per gli studi di crossover, abbiamo dato priorità ai risultati di un test accoppiato. Se non forniti, sono stati considerati i risultati di test non accoppiati. Se c’era un potenziale effetto di carryover, o se c’è un significativo tasso di drop out (>20%), sono stati considerati solo i risultati del primo periodo [18]. L’eterogeneità statistica è stata stimata utilizzando il test Q di Cochrane, con una soglia di p-valore a 0,10, e la variabilità percentuale nelle stime dei singoli effetti è stata descritta dalla statistica I2 [18]. Il rapporto di rischio (RR) e la differenza media (MD) o le differenze medie standardizzate (SMD), a seconda dei casi, sono stati stimati insieme ai loro intervalli di confidenza al 95% (CI). Abbiamo pianificato di riportare i risultati in misure di rischio assoluto, se sono state osservate come statisticamente significative. La valutazione della qualità delle prove è stata effettuata utilizzando l’approccio GRADE, con una tabella di sintesi dei risultati (SOF).
Analisi supplementare
Un’analisi di sottogruppo è stata presa in considerazione in studi che hanno analizzato la presenza di NP utilizzando un questionario di screening al basale e hanno riportato il sollievo dal dolore nei pazienti di NP separatamente. Le analisi di sensibilità per l’esito del sollievo dal dolore sono state effettuate per studi che riportavano una perdita >5% al follow-up (LTFU). Queste sono state effettuate utilizzando strategie di imputazione ben descritte[23, 24].
Risultati
Selezione dello studio
La nostra ricerca ha individuato un totale di 1.385 citazioni dopo l’esclusione dei duplicati. Tra i 29 articoli valutati per il testo integrale, 21 studi sono stati esclusi con le motivazioni riportate nella Fig. 1. Otto studi sono stati inclusi per l’analisi qualitativa e sei per l’analisi quantitativa(Fig 1). C’è stato un accordo quasi perfetto, indicato da kappa = 0,82, tra i revisori nella fase di screening del testo completo.
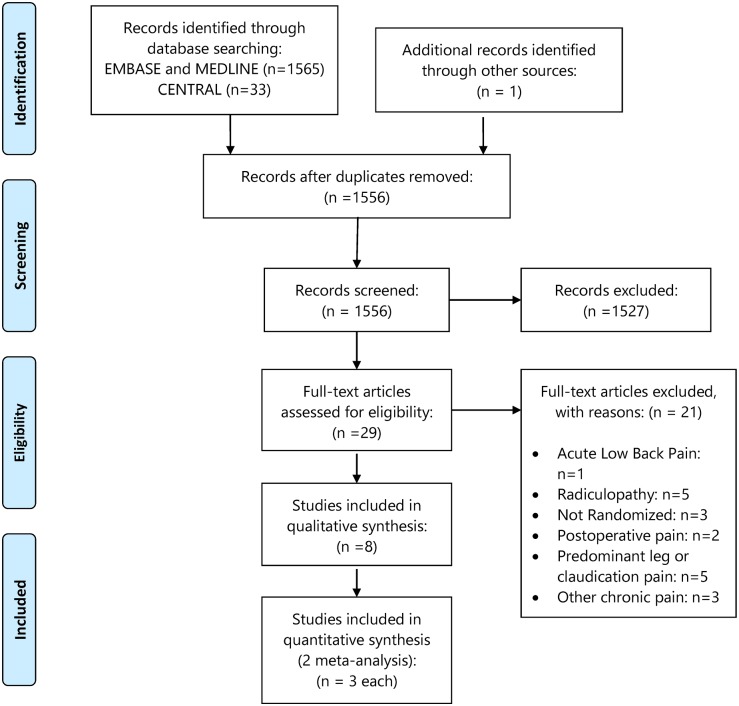
Fig 1.Diagramma di flusso PRISMA.

Fig 1.Diagramma di flusso PRISMA.
Caratteristiche dello studio
Le caratteristiche importanti della popolazione dello studio e dei trattamenti sono fornite nella Tabella 1. Degli 8 studi, 3 hanno confrontato l’uso di GB al trattamento con placebo[25, 27], e 5 hanno usato PG[28- 32]. Ci sono stati 2 studi crossover che hanno utilizzato GB[26] e PG[31]. Solo 2 studi erano multicentrici e avevano finanziamenti esterni per la conduzione della loro sperimentazione[25, 28]. Tra gli studi PG, 3 studi utilizzavano un comparatore attivo (amitriptlina, celebrex, tramacet) contro il solo PG[29, 31, 32]. Poiché lo studio di Romano et al. aveva 3 braccia[31], hanno confrontato la sola PG contro la celebrex (CX) contro una combinazione di PG più CX. Quindi, ci sono stati 3 confronti che coinvolgevano la PG come aggiunta a un farmaco analgesico contro i loro rispettivi farmaci analgesici[28, 30, 31]. L’età media variava tra i 41,6 e i 58,5 anni, tranne che nello studio di Sakai et al.[32]. Tuttavia, la durata del CLBP preesistente aveva una gamma molto più ampia di 13-213 mesi. Le dosi di trattamento sono state titolate per effetto clinico in tutti gli studi, ad eccezione di Sakai et al., che avevano un dosaggio fisso di PG[32]. Le dosi variavano da 300 a 3.600 mg/giorno con GB e da 100 a 600 mg/giorno con PG, in dosi divise. Solo 3 studi valutati specificamente per la PG utilizzando un questionario di screening[28, 31, 32].
| STUDIO DEL DISEGNO DELLA POPOLAZIONE E DEI GRUPPI | FEMMINE (%) | ETÀ MEDIA (SD) | DURATA MEDIA IN MESI (SD) | STUDIARE I TRATTAMENTI | DURATA DEL TRATTAMENTO | PERIODO DI PRE-RANDOMIZZAZIONE E MOTIVO | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Anno dell’autore; popolazione e design | INT | CNT | INT | CNT | INT | CNT | INT | CNT | ||
| Barone 2015CLBP >3 mesiProgettazione parallela a 2 gruppi | 86 (54) | 95 (62) | 56.3 (11.83) | 58.5 (11.01) | 104.4 (111.36) | 112.8 (125.76) | TAP 300 mg/giorno + PG 100-200 mg/giorno | TAP 300 mg/giorno + TAP 100-200 mg/giorno | 8 settimane | SìSenza il sito |
| Pota 2012#CLBP >12 mesiProgettazione parallela a 2 gruppi | 22/44 (50) in totale | 55.5 (8.31) | 15.25 (8.69) | PG 300 mg/giorno + BUP 35 mcg/h | BUP 35 mcg/h | 3 settimane | Yesto stabilizzarsi su BUP per 3 settimane | |||
| Sakai 2015CLBP > 3 mesiProgettazione parallela a 2 gruppi | 9 (30) | 11 (37) | 72.03 (6.23) | 72.60 (5.23) | 34.77 (29.91) | 34.70 (32.54) | PG 75 mg BID | TRA 2 tavolette/giorno | 4 settimane | Yesto dilavamento ed escludere il dolore acuto |
|
Kalita 2014 #CLBP >3 mesiProgettazione parallela a 2 gruppi |
91/200 (45,5) in totale | 42.6 (11.6) | 41.6 (10.7) | 35.9 (46.8) | 35.2 (39.8) | PG 75 mg BID X 2 settimane; 150 mg BID X 4 settimane; 300 mg BID 6-14 settimane | AMT 12,5 mg OD X 2 settimane; 25 mg OD X 4 settimane; 50 mg OD 6-14 settimane | 14 settimane | Yesto lavare e trattare con FANS Se necessario | |
| Romano 2009CLBP> 6 mesi3 gruppi; design crossover con 1 settimana di lavaggio; rischio minimo di effetti di carryover | 20 (56) | 53 (16) | 13 (6) | PG 1mg/kg 1 settimana; e 2-4 mg/kg le prossime 4 settimane | CX: 3-6 mg/kg | 4 settimane | SìSenza il sito | |||
| PG + CX come per i 2 gruppi | ||||||||||
| McCleane 2001Cronico-durata non fornitaProgettazione parallela a 2 gruppi | 15 (48) | 21 (62) | 41.3 (13.1) | 47.8 (11.7) | 63.1 (45.3) | 74.5 (82) | GB 300 mg OD aumentato settimanalmente a 1.200 mg al giorno | Simili (capsule placebo) | 8 settimane | SìNon fornito |
| McCleane 2000CLBP >3 mesi (dolore nocicettivo);design crossover con 1 settimana di lavaggio; minimo rischio di carryover | 13 (54.2) | 42.4 (14.6) | 105.5 (97.2) | GB 300 mg al giorno aumentando di 300 mg alla settimana fino ad una dose massima di 15 mg/kg | Placebo crossover | 6 settimane | NoNA | |||
| Atkinson 2016CLBP >6 mesiProgettazione parallela a 2 gruppi con ipotesi di non inferiorità | 12 (18.9) | 13 (24.5) | 57.58 (8.84) | 54.62 (11.38) | 205.92 (181.44) | 213.48 (153.6) | GB a partire da 300 mg/giorno fino a 1.200 mg TID a 4 settimane | Simili (capsule placebo) | 12 settimane | NoNA |
RoB all’interno degli studi (Fig. 2)
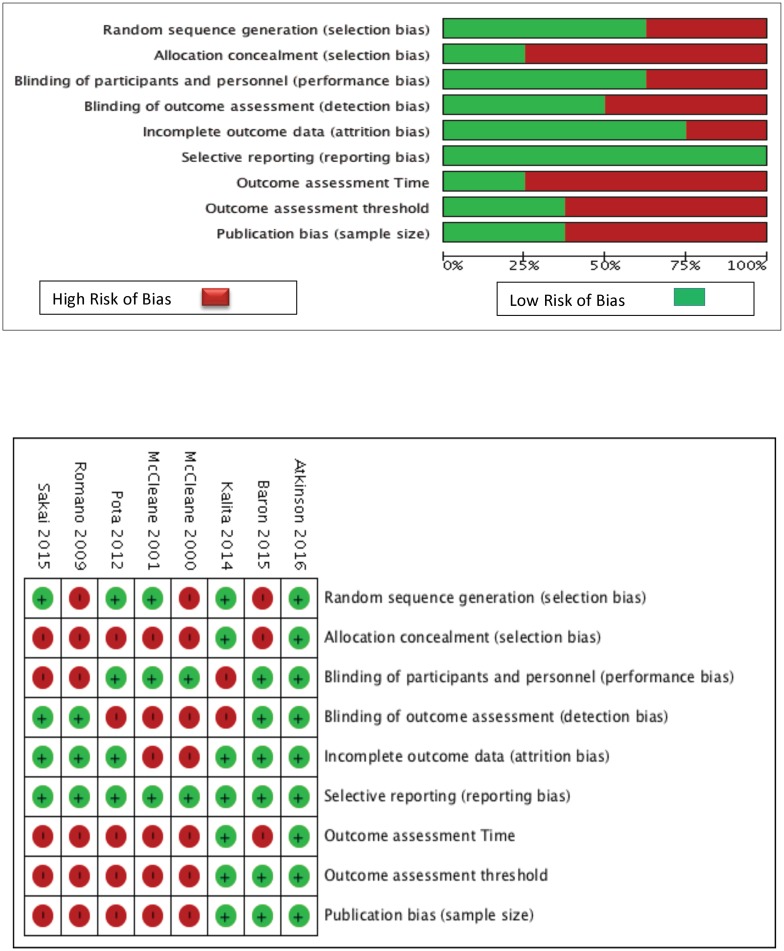
Fig. 2.RoB all’interno degli studi inclusi.RoB, rischio di pregiudizio.
Sei degli otto studi avevano un rischio di bias di selezione, sei per l’occultamento dell’assegnazione e tre per la generazione di sequenze, e quattro comportavano un rischio di bias di rilevamento. Gli studi di Baron et al.[28], e Atkinson et al.[25] sono stati valutati a basso RoB per la maggior parte dei domini, ed entrambi gli studi crossover avevano un rischio maggiore di bias di selezione[26, 31].

Fig. 2.RoB all’interno degli studi inclusi.RoB, rischio di bias.
Risultati dello studio e sintesi dei risultati
Ad eccezione di 2 studi che hanno riportato utilizzando la scala 0-100 [30,31], tutti gli altri hanno riportato i loro punteggi di dolore su una scala da 0-10 NRS o Visual Analogue Scale (VAS). Cinque studi hanno fornito una misura dicotomica del successo del trattamento con soglie variabili[25- 29,32]. Tutti gli studi hanno riportato uno o più effetti avversi. Il miglioramento funzionale è stato riportato in 5 studi[25, 26, 28, 29, 32], il miglioramento della qualità della vita (QOL) da 2 studi[28, 32], il miglioramento psicologico o il miglioramento della depressione da 3 studi [25, 28, 32], e l’impressione globale del cambiamento (GIC) solo da 2 studi[25, 28].
Sollievo dal dolore
Il sollievo dal dolore espresso in scale NRS o VAS è stato convertito in una scala comune di 0-10 NRS. Gli autori di 2 studi sono stati contattati con successo per ottenere i risultati finali dei punteggi del dolore, in quanto non era chiaro nel loro rapporto[25, 32]. Non siamo stati in grado di utilizzare i punteggi di cambiamento in quanto molti studi non hanno riportato il loro cambiamento nelle deviazioni standard (SD), e imputarli sulla base di un altro studio o utilizzando un coefficiente di correlazione del cambiamento è stato osservato essere inappropriato e non preciso[18]. Quindi, la messa in comune è stata effettuata utilizzando i punteggi finali. Sulla base della variabilità dei confronti degli studi, abbiamo deciso di mettere in comune gli studi per l’uso di GB e PG. Nel primo gruppo(Fig 3a), gli studi che utilizzavano GB(n = 91) contro placebo(n = 94) sono stati combinati utilizzando un modello a effetti fissi. Rispetto al placebo, il gruppo GB ha avuto una piccola riduzione del dolore (MD = 0,22 unità, 95% CI [da -0,51 a 0,07], I2 = 0%). Non ci sono stati studi che confrontano il PG con il placebo. PG(n = 163) è stato confrontato con un comparatore attivo(n = 169) in 3 studi(Fig 3b), utilizzando il modello degli effetti casuali. Questa analisi ha mostrato un miglioramento del dolore favorendo l’uso del gruppo di comparatori attivi (MD = 0,42 unità, 95% CI [0,20 a 0,64], I2 = 0). Entrambi i confronti di cui sopra sono stati valutati come prove di qualità molto bassa da GRADO(Tabella 2). Il terzo gruppo consisteva in confronti che utilizzavano PG come coadiuvante di un altro farmaco analgesico(n = 215), come buprenorfina (BUP)[30], tapentadolo (TAP) [28], e CX[30], e lo confrontavano con l’uso del solo farmaco analgesico (n = 208). Abbiamo deciso che non era opportuno mettere in comune questi studi considerando l’eterogeneità clinica coinvolta all’interno degli studi, sia dal punto di vista dell’intervento che da quello del comparatore. Ciò è stato supportato dalla sostanziale eterogeneità statistica osservata con tale tentativo utilizzando il modello degli effetti casuali, I2 = 77%. L’appezzamento forestale per questo confronto è mostrato come S1 Fig. Tra questi 3 studi, il più grande studio di Baron et al. non ha trovato alcuna differenza aggiungendo PG a TP al loro follow-up di 10 settimane[28]. Tuttavia, gli studi più piccoli di Pota et al.[30] e Romano et al.[31] hanno osservato importanti differenze nei punteggi del dolore (differenza di oltre 2 punti in 0-10 NRS) utilizzando PG come aggiunta a BP e CX, rispettivamente. Non ci sono state differenze significative anche quando i pazienti sono stati valutati come successo o fallimento con GB contro placebo(Fig 3c) o PG contro il comparatore attivo(Fig 3d).
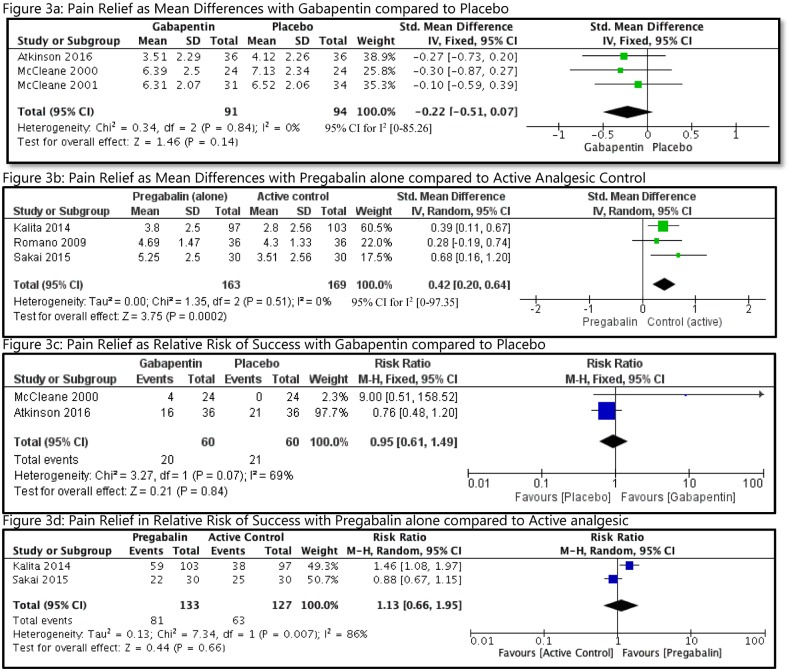
Fig 3.Analisi del sollievo dal dolore con GB o PG in pazienti con CLBP.CLBP, lombalgia cronica; GB, gabapentin; IV, intravenosa; M-H, Mantel-Haenszel; PG, pregabalin.
| Risultati | № di partecipanti (studi)Follow-up | Qualità delle prove(GRADO) | Effetto relativo (95% CI) | Effetti assoluti previsti | |
|---|---|---|---|---|---|
| Rischio con i farmaci Placebo o Active | Differenza di rischio con Gabapentin o Pregabalin *. | ||||
| Gabapentin rispetto al Placebo (sollievo dal dolore ottenuto) valutato con: Paziente segnalatoScala da: 0 a 10seguito in su: range da 8 settimane a 12 settimane | 185(3 RCT) | ⨁◯◯◯◯VERY BASSO a,b,c | – | – | SMD 0,22 inferiore(0,51 inferiore a 0,07 superiore) |
| Pregabalin da solo rispetto al controllo attivo (sollievo dal dolore raggiunto) valutato con: Paziente segnalatoScala da: 0 a 10seguito in su: range da 4 settimane a 14 settimane | 332(3 RCT) | ⨁◯◯◯◯VERY BASSO a,b,c,d | – | – | SMD 0,42 SD superiore(da 0,2 a 0,64 superiore) |
| Vertigini o instabilità con Gabapentin rispetto a Placeboassessed con: Segue il rapporto del paziente: da 6 settimane a 12 settimane | 221(3 RCT) | ⨁◯◯◯◯VERY BASSO a,b,c | RR 1,99(1,17 a 3,37) | 225 per 1.000 | 223 in più per 1.000(da 38 in più a 534 in più) |
| Fatica o letargia con il Gabapentin rispetto al Placebo (Fatica) valutato con: Segue il rapporto del paziente: da 6 settimane a 12 settimane | 221(3 RCT) | ⨁◯◯◯◯VERY BASSO a,b,c | RR 1,85(1,12 a 3,05) | 261 per 1.000 | 222 in più per 1.000(31 in più a 536 in più) |
| Disturbi della vista con Gabapentin rispetto al Placebo (offuscamento della vista) valutato con: Segue il rapporto del paziente: da 6 settimane a 12 settimane | 221(3 RCT) | ⨁⨁⨁⨁◯MODERATE a,c | RR 5,72(1,94 a 16,91) | 180 per 1.000 | 850 in più ogni 1.000(da 169 in più a 2.867 in più) |
| Vertigini o instabilità con il solo Pregabalin rispetto al solo Active Controlassessed con: Segue il rapporto del paziente: da 4 settimane a 14 settimane | 332(3 RCT) | ⨁◯◯◯◯VERY BASSO a,c,e | RR 2,70(1,25 a 5,83) | 130 per 1.000 | 221 in più per 1.000(33 in più a 629 in più) |
| Difficoltà con la mentalità con il Gabapentin rispetto al Placeboassessed con: Paziente reportedfollow up: range da 6 settimane a 12 settimane | 220(3 RCT) | ⨁⨁◯◯LOW a,c | RR 3,34(1,54 a 7,25) | 209 per 1.000 | 489 in più per 1.000(113 in più a 1.307 in più) |
| GRADO Gruppo di lavoro gradi di provaAlta qualità: Siamo molto fiduciosi che il vero effetto si avvicini a quello della stima dell’effettoQualità moderata: Siamo moderatamente fiduciosi nella stima dell’effetto: È probabile che l’effetto reale sia vicino alla stima dell’effetto, ma c’è la possibilità che sia sostanzialmente diversoBassa qualità: La nostra fiducia nella stima dell’effetto è limitata: L’effetto reale può essere sostanzialmente diverso dalla stima dell’effettoMolto bassa qualità: Abbiamo poca fiducia nella stima dell’effetto: È probabile che l’effetto reale sia sostanzialmente diverso dalla stima dell’effetto | |||||

Fig. 3.Analisi del sollievo dal dolore con GB o PG in pazienti con CLBP.CLBP, lombalgia cronica; GB, gabapentin; IV, per via endovenosa; M-H, Mantel-Haenszel; PG, pregabalin.
Effetti avversi
Non sono stati segnalati decessi o ricoveri ospedalieri. I motivi del ritiro dallo studio non sono stati forniti in tutti gli studi. Tutti gli effetti negativi riportati in più di uno studio sono riassunti nella Tabella 3. Rispetto al placebo, i seguenti eventi avversi sono stati riportati più comunemente con GB: vertigini (RR = 1,99, 95% IC [1,17 a 3,37], I2 = 49); affaticamento (RR = 1,85, 95% IC [1.12 a 3,05], I2 = 0); difficoltà con la mentazione (RR = 3,34, 95% IC [1,54 a 7,25], I2 = 0); e disturbi visivi (RR = 5,72, 95% IC [1,94 a 16,91], I2 = 0)(Fig 4). La qualità delle prove GRADO è stata notata essere molto bassa per vertigini e fatica, bassa per difficoltà di mentazione, e moderata per i disturbi visivi(Tabella 2). La risultante percentuale di aumento del rischio assoluto (ARI) e il numero necessario per danneggiare (NNH) con il 95% di CI per vertigini, stanchezza, difficoltà mentali e disturbi visivi sono stati rispettivamente del 14% e 7 (da 4 a 30), 13% e 8 (da 4 a 44), 16% e 6 (da 4 a 15), e 15% e 6 (da 4 a 13). Con il PG, le vertigini erano più comuni rispetto al comparatore attivo (RR = 2,70, 95% CI [1,25 a 5,83], I2 = 0), con una qualità di evidenza molto bassa. L’ARI% e NNH erano del 9% e 11 (da 6 a 30).
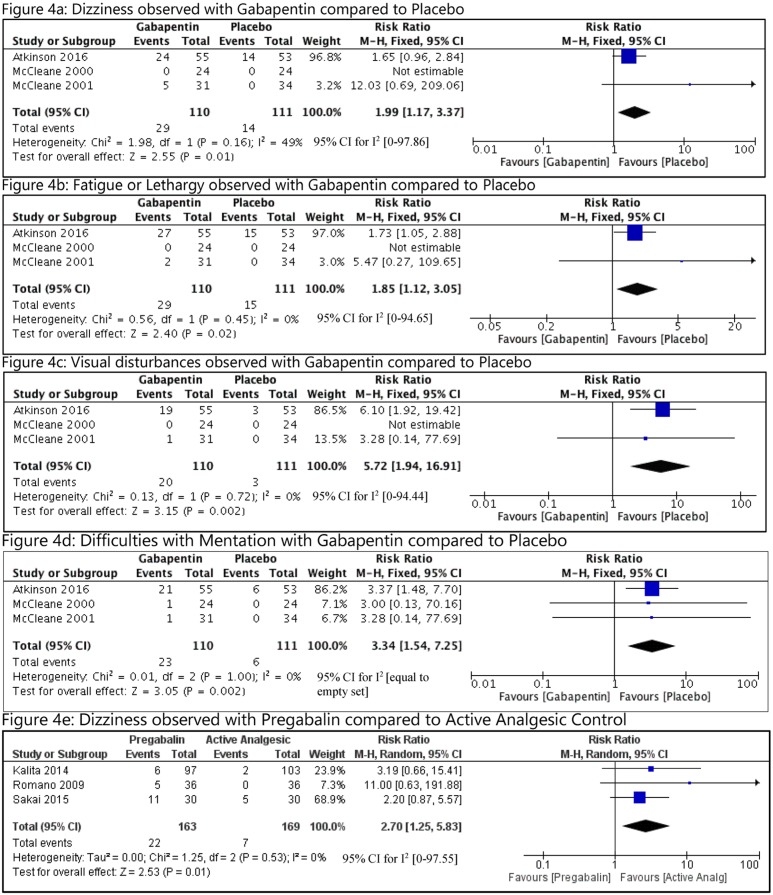
Fig. 4.Analisi degli effetti negativi osservati con GB o PG nel CLBP.CLBP, lombalgia cronica; GB, gabapentin; IV, endovenoso; M-H, Mantel-Haenszel; PG, pregabalin.
| Effetti avversi come descritti | BARONE 2015 | POTA 2012 | SAKAI 2015 | KALITA 2014 | ROMANO 2009 | MCCLEANE 2001 | MCCLEANE 2000 | ATKINSON 2016 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| INT (154) | CNT (159) | INT (22) | CNT (22) | INT (30) | CNT (30) | INT (97) | CNT (103) | INT (36) | CNT (36) | INT (31) | CNT (34) | INT (24) | CNT (24) | INT (55) | CNT (53) | |
| Nausea/ Vomito | 20 | 25 | 3 | 3 | 0 | 10 | PG: 5 | CX: 4 | 6 | 5 | 2 | 2 | ||||
| CX + PG: 7 | ||||||||||||||||
| Sonnolenza/ sonnolenza/ sedazione | 19 | 13 | 4 | 5 | 11 | 5 | 4 | 10 | 2 | 0 | 2 | 0 | ||||
| Dimenticanza/ Disturbo della memoria | 1 | 0 | 9 | 1 | ||||||||||||
| Costipazione | 8 | 11 | 5 | 3 | 0 | 6 | 0 | 1 | 1 | 0 | 7 | 9 | ||||
| Capogiri/scalzi/instaticità/vertigini | 28 | 17 | 0 | 22 | 11 | 5 | 6 | 2 | PG: 5 | CX: 0 | 5 | 0 | 24 | 14 | ||
| CX + PG: 7 | ||||||||||||||||
| Fatica/perdita di energia | 16 | 13 | 2 | 0 | 27 | 15 | ||||||||||
| Difficoltà di concentrazione (perdita di concentrazione/disorientamento/sensazione elevata) | 1 | 0 | 1 | 0 | 21 | 6 | ||||||||||
| Bocca asciutta | 8 | 6 | 1 | 3 | ||||||||||||
| Mal di testa | 13 | 10 | 1 | 1 | 2 | 0 | ||||||||||
| Problemi con l’alloggio visivo/visione offuscata | 1 | 0 | 19 | 3 | ||||||||||||
| Eruzione cutanea | 1 | 0 | 0 | 1 | ||||||||||||
| Inquietudine | 1 | 0 | 1 | 0 | ||||||||||||

Fig. 4.Analisi degli effetti avversi osservati con GB o PG nel CLBP.CLBP, lombalgia cronica; GB, gabapentin; IV, endovenoso; M-H, Mantel-Haenszel; PG, pregabalin.
Esiti secondari
Questi sono riassunti nelle tabelle 4 e 5. Tutti gli studi tranne Pota et al. hanno avuto pazienti che erano LTFU[30]. Ci sono stati 5 studi che hanno incluso LTFU, anche con >5% del loro campione randomizzato, nella loro analisi finale [25- 27, 31, 32] . Il miglioramento funzionale è stato osservato in 5 studi utilizzando varie scale[25, 26, 28, 29, 32]. I risultati indicano che ci sono stati miglioramenti dalla linea di base sia nei gruppi di trattamento che in quelli di controllo, senza grandi differenze tra i gruppi. Il funzionamento emotivo è stato osservato in 3 studi, ma 2 studi hanno riportato i punteggi finali, senza differenze tra i gruppi[25, 28]. Il miglioramento globale del cambiamento è stato riportato come un miglioramento globale, come riportato dal medico, da Atkinson et al.[25] e dal paziente, come riportato dal Barone et al.[28]. Non ci sono state differenze tra i gruppi negli studi con la GB o la PG, rispettivamente.
| DISPOSIZIONE DEI PARTECIPANTI | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| STUDIO/ANNO | RANDOMIZZATO | SEGUITO DELLO STUDIO COMPLETATO | TOTALE LTFU (incluso il ritiro a causa di effetti collaterali) | LTFU (studio interrotto solo per gli effetti collaterali) | ANALIZZATO | |||||
| INT | CNT | INT | CNT | INT | CNT | INT | CNT | INT | CNT | |
| Barone 2015 | 159 | 154 | 133 | 126 | 26 | 28 | 17 | 16 | 157# | 152# |
| Pota 2012 | 22 | 22 | 22 | 22 | 0 | 0 | 0 | 0 | 22 | 22 |
| Sakai 2015 | 32 | 33 | 2 | 3 | 2 | 3 | 2 | 3 | 30 | 30 |
| Kalita 2014 | 97 | 103 | 70 | 77 | 27 | 26 | 12 | 11 | 97# | 103# |
| Romano 2009a | 42 in ogni periodo di trattamento | 36 in ogni periodo di trattamento | 6 in ogni periodo di trattamento | 4 in ogni periodo di trattamento | 36 in ogni periodo di trattamento | |||||
| McCleane 2001 | 40 | 40 | 31 | 34 | 9 | 6 | Non fornito | 31 | 34 | |
| McCleane 2000b | 30 in ogni periodo di trattamento | 24 in ogni periodo di trattamento | 6 in ogni periodo di trattamento | 1 | 0 | 24 in ogni periodo di trattamento | ||||
| Atkinson 2016 | 55 | 53 | 36 | 36 | 19 | 17 | 12 | 6 | 36 | 36 |
| FUNZIONAMENTO FISICO | ||||||
| STUDIO | SCALA UTILIZZATA | DIMENSIONE | BASELINA | FINE STUDIO | ||
| AUTORE/ ANNO | INT | CNT | INT | CNT | ||
| Barone 2015cINT (159) CNT (154) | SF-12 funzione fisica composita | 0-100 (più alto è meglio) | 33.9 (8.49) | 34.2 (9.26) | 39.6 (9.03) | 40.1 (9.64) |
| McCleane 2000bINT (24) CNT (24) | NRS (scala di mobilità) | 0-10 (più alto è meglio) | 4.65 (2.03) | 5.07 (2.08) | 5.46 (2.41) | 5.05 (2.04) |
| Atkinson 2016INT (55) CNT (53) | ODI | 0-100 (più basso è meglio) | 40.3 (10.4) | 41.1 (9.8) | 31.1 (10.6) | 30.9 (13.3) |
| Sakai 2015INT (30) CNT (30) | RDQ | 0-24 (più basso è meglio) | 9.73 (4.44) | 11.47 (4.99) | Non fornito come da gruppo di trattamento e controllo | |
| Kalita 2014INT (97) CNT (103) | ODI | 0-100 (più basso è meglio) | 42.2 (15.2) | 42.2 (12.5) | 22 (15) | 19 (12.5) |
| QOL | ||||||
| STUDIO | SCALA UTILIZZATA | DAL PIÙ BASSO AL PIÙ ALTO | BASELINA | FINE STUDIO | ||
| AUTORE/ ANNO | INT | CNT | INT | CNT | ||
| Barone 2015cINT (159) CNT (154) | EQ-5D | 0-1 (più alto è meglio) | 0.51 (0.246) | 0.54 (0.262) | 0.60 (0.283) | 0.61 (0.305) |
| Sakai 2015INT (30) CNT (30) | EQ-5D | 0-1 (più alto è meglio) | 0.63 (0.10) | 0.58 (0.12) | Non fornito come da gruppo di trattamento e controllo | |
| FUNZIONAMENTO EMOTIVO | ||||||
| STUDIO | SCALA UTILIZZATA | DIMESSIONE | BASELINA | FINE STUDIO | ||
| AUTORE/ ANNO | INT | CNT | INT | CNT | ||
| Barone 2015cINT (159) CNT (154) | SF-12 composito per la salute mentale | 0-100 (più alto è meglio) | 47.6 (11.85) | 48.8 (11.81) | 50 (11.44) | 48.2 (10.71) |
| Atkinson 2016INT (55) CNT (53) | Inventario della depressione Beck | 0-63 (più basso è meglio) | 8.38 (4.32) | 8.67 (4.16) | 5.79 (3.14) | 7.11 (4.60) |
| Sakai 2015INT (30) CNT (30) | GDI | 0-15 (più basso è meglio) | 4.70 (3.44) | 5.73 (4.25) | Non fornito come da gruppo di trattamento e controllo | |
| GIC | ||||||
| STUDIO | SCALA UTILIZZATA | CRITERI | FOLLOW-UP DI FINE TRATTAMENTO | |||
| AUTORE/ ANNO | INT | CNT | ||||
| Barone 2015cINT (159) CNT (154) | GIC-paziente osservato | Minimamente migliorata a molto migliorata | 130/157 | 126/152 | ||
| Atkinson 2016INT (55) CNT (53) | Medico GIC osservato | Minimamente migliorata a molto migliorata | 14/38 | 11/33 | ||
| DOLORE NEUROPATICO | ||||||
| STUDIO/ANNO | METODO DI SCREENING E STRUMENTO PER IL DOLORE NEUROPATICO UTILIZZATO | BASELINA | FINE DEL TRATTAMENTO/SEGUITO | |||
| INT | CNT | INT | CNT | |||
| Barone 2015 | DETECT del dolore (0-38) | Non segnalato | Non segnalato | Diminuito di: -6,1 (7,42) | Diminuito di: -5,8 (8,66) | |
| Barone 2015 | NPSI: tutti i pazienti hanno riportato i loro punteggi per i singoli domini | Punteggio complessivo (0-100) | 46 (18.39) | 45.6 (18.52) | 29.9 (22.24) | 29.8 (22.18) |
| Dolore da bruciore (0-10) | 5 (2.38) | 4.7 (2.6) | 2.8 (2.69) | 3 (2.67) | ||
| Dolore di pressione (0-10) | 4.5 (2.56) | 4.6 (2.49) | 3.1 (2.52) | 3.2 (2.54) | ||
| Dolore parossistico (0-10) | 4.9 (2.29) | 4.9 (2.28) | 3.3 (2.66) | 2.9 (2.53) | ||
| Dolore evocato (0-10) | 4.2 (2.22) | 4.2 (2.28) | 2.6 (2.37) | 2.6 (2.42) | ||
| Parestesia/distesia (0-10) | 4.8 (2.46) | 4.7 (2.61) | 3.3 (2.66) | 3.4 (2.56) | ||
| Sakai 2015 | Screening NP con uno strumento giapponese con una soglia >6 come NP+; riportato come punteggio VAS 0-10 del dolore (INT:13/30; CNT:9/30) | 4.56 (3.19) | 4.53 (4.46) | 6.25 | 3.43 | |
| Romano 2009 | LANSS con una soglia >12 come NP+; 16 in ogni gruppo (studio crossover); Dopo 4 settimane di trattamento sono stati riportati i punteggi del dolore in ogni gruppo (0-100 VAS) | PG: 47,2 (15) | CX: 46.8 (13.6) | PG: 36,3 (12,7) | CX: 45.7 (14.3) | |
| CX + PG: 47,9 (15,2) | CX + PG: 23,1 (14,6) | |||||
RoB tra gli studi (Fig. 2)
Sulla base dei nostri criteri, il potenziale pregiudizio dovuto alla soglia di risultato, al punto di tempo di valutazione e al pregiudizio di pubblicazione dovuto alla bassa dimensione del campione è stato osservato in gran parte da 5 studi[26, 27, 30- 32].
Analisi dei sottogruppi
NP è stato valutato utilizzando un questionario di screening in 3 studi. Sakai et al. hanno osservato che i punteggi del dolore diminuiscono maggiormente con tramacet rispetto al PG nei pazienti con NP[32]. Baron et al. non hanno osservato differenze nei componenti dei punteggi dell’inventario dei sintomi del dolore neuropatico utilizzando PG più TP rispetto al solo TP[28]. Invece, Romano et al. hanno osservato che i punteggi del dolore sono diminuiti significativamente nei pazienti di NP con PG così come in combinazione con CX[31].
Analisi della sensibilità
Le analisi per GB contro placebo e PG contro comparatore attivo hanno resistito all’analisi di sensibilità per LTFU >5% utilizzando strategie di imputazione progressivamente rigorose per i punteggi di dolore medio.
Discussione
Nonostante l’uso diffuso, la nostra revisione sistematica con la meta-analisi ha rilevato che ci sono pochissimi RCT che hanno tentato di valutare il beneficio dell’uso di GB o PG in pazienti affetti da CLBP. L’uso di GB e PG, rispetto rispettivamente ai placebo e ai comparatori analgesici attivi, sono stati associati a un aumento significativo degli effetti avversi senza prove limitate di miglioramento dei punteggi del dolore o di altri risultati. Non siamo stati in grado di esaminare l’effetto combinato dell’uso di PG come farmaco analgesico adiuvante, date le limitate prove e l’eterogeneità degli studi. È ragionevole supporre che il beneficio clinico dipenda dal farmaco primario e dalla sua potenza all’interno di ogni studio. Le differenze nei risultati di Pota et al.[30] e Romano et al.[31], rispetto a Baron et al. [28], potrebbero essere attribuite a differenze metodologiche. Lo studio di Baron et al. ha avuto un campione di dimensioni maggiori e una maggiore durata del follow-up. Pertanto, le prove esistenti non supportano l’uso dei gabapentinoidi per il CLBP predominante e richiedono RCT più grandi e di alta qualità per informare in modo più definitivo questo problema.
Considerando l’uso crescente di gabapentinoidi per il dolore cronico e il CLBP[33, 34], questa revisione soddisfa l’immediata necessità di esaminare ed esaminare attentamente le prove esistenti. Notando che esiste un protocollo Cochrane pubblicato[35], la nostra è la prima revisione combinata con la meta-analisi per esaminare i benefici e la sicurezza dei gabapentinoidi nel CLBP. I risultati della nostra revisione sono in contrasto con studi non randomizzati che hanno mostrato benefici con il PG in pazienti affetti da CLBP[36, 37]. I gabapentinoidi hanno dimostrato la loro efficacia in condizioni di NP[38]. Tuttavia, sono anche ampiamente utilizzati per condizioni in cui la componente neuropatica è difficile da stabilire, la maggior parte delle quali è fuori uso[12]. Questo sviluppo riflette forse l’effetto di tipo penombra (i clinici generalizzano i criteri di selezione degli studi clinici nella loro popolazione di pazienti senza riconoscerne i limiti)[39]. In Inghilterra, c’è stato un aumento del 46% e del 53% nell’uso di GB e PG rispettivamente dal 2011 al 2013[13]. Un recente studio canadese ha dimostrato che l’uso off-label della PG è pari al 75% e la condizione d’uso più diffusa è stata il CLBP[40]. Il vero peso del NP nel CLBP è difficile da stabilire[41]. La distribuzione del dolore può essere considerata come un corollario del processo patologico, ed è importante classificare ampiamente i pazienti in base alla loro predominanza di dolore assiale o alla gamba per la diagnosi e la gestione[2]. Un’ipotesi comune è quella del dolore alla gamba che indica la NP. Tuttavia, nella maggior parte dei casi il dolore alla gamba non è specifico e non è coerente con il dolore radicolare, e solo una radicolopatia dolorosa con segni sensoriali soddisferebbe la diagnosi di NP definitivo[41]. Anche se si considera che i gabapentinoidi sono efficaci contro il NP correlato al CLBP, in letteratura si osservano evidenze contrastanti. Nei pazienti con dolore radicolare o dolore da stenosi spinale, gli studi osservazionali del CLBP dimostrano miglioramenti significativi con il PG[42, 43]. Tuttavia, gli RCT eseguiti da Baron et al. nei pazienti con radicolopatia lombare e Markman et al. nei pazienti con stenosi spinale non hanno riscontrato miglioramenti clinici quando il PG è stato confrontato con il placebo[44, 45]. Cohen et al. hanno esaminato il beneficio della GB nei pazienti con dolore alla gamba e non hanno trovato alcuna differenza rispetto alle iniezioni di steroidi epidurali[46]. Anche all’interno dello studio incluso da Baron et al., la riduzione del dolore e dei sintomi della NP era simile alla combinazione di PG con TP, rispetto alla TP[28]. I nostri risultati sono importanti per i professionisti di diverse specialità che trattano i pazienti con CLBP e devono decidere sui relativi meriti e demeriti del trattamento con gabapentinoidi.
Il nostro esame non è privo di limiti. Abbiamo escluso gli studi in pazienti con dolore predominante alle gambe o stenosi spinale. Questo è stato fatto per limitare l’eterogeneità all’interno della nostra popolazione di studio. Sebbene la misura dell’eterogeneità (proporzione I2 della variabilità che può essere spiegata dai singoli studi) fosse bassa in molti confronti, gli IC intorno a questi I2 erano molto ampi, riflettendo che c’è incertezza in qualsiasi affermazione di omogeneità. È stato dimostrato che l’eterogeneità è un problema con le meta-analisi che coinvolgono un numero minore di prove o eventi[47]. Il topiramato non è stato preso in considerazione in questa revisione, in quanto ha un meccanismo d’azione leggermente diverso e non è comunemente usato, anche se alcuni studi controllati hanno mostrato benefici[48]. L’uso di PG o GB è associato a significativi effetti negativi, costi[13], e potenziale per un uso improprio[34, 49].
La nostra revisione dimostra che ci sono prove limitate sull’uso dei gabapentinoidi in CLBP non specifici, e le prove esistenti sotto forma di RCT non ne supportano l’uso. È possibile che gli studi in corso o non pubblicati[50, 51] possano informarci in modo più definitivo su questo argomento, anche se uno di questi studi specifici per il CLBP è stato ritirato prima dell’iscrizione[52].
Informazioni di supporto
References
- Deyo RA, Weinstein JN. Low back pain. The New England journal of medicine. 2001; 344(5):363-70. Publisher Full Text | PubMed
- Hooten WM, Cohen SP. Evaluation and Treatment of Low Back Pain: A Clinically Focused Review for Primary Care Specialists. Mayo Clin Proc. 2015; 90(12):1699-718. Publisher Full Text | PubMed
- Hoy D, Bain C, Williams G, March L, Brooks P, Blyth F. A systematic review of the global prevalence of low back pain. Arthritis Rheum. 2012; 64(6):2028-37. Publisher Full Text | PubMed
- Morlion B. Chronic low back pain: pharmacological, interventional and surgical strategies. Nature reviews Neurology. 2013; 9(8):462-73. Publisher Full Text | PubMed
- Shanthanna H, Gilron I, Thabane L, Devereaux PJ, Bhandari M, AlAmri R. Gabapentinoids for chronic low back pain: a protocol for systematic review and meta-analysis of randomised controlled trials. BMJ open. 2016; 6(11)
- Chou R, Huffman LH. Medications for acute and chronic low back pain: a review of the evidence for an American Pain Society/American College of Physicians clinical practice guideline. Ann Intern Med. 2007; 147(7):505-14. PubMed
- White AP, Arnold PM, Norvell DC, Ecker E, Fehlings MG. Pharmacologic management of chronic low back pain: synthesis of the evidence. Spine. 2011; 36(21 Suppl):S131-43. PubMed
- Patel R, Dickenson AH. Mechanisms of the gabapentinoids and alpha 2 delta-1 calcium channel subunit in neuropathic pain. Pharmacol Res Perspect. 2016; 4(2):e00205. Publisher Full Text | PubMed
- Maizels M, McCarberg B. Antidepressants and antiepileptic drugs for chronic non-cancer pain. Am Fam Physician. 2005; 71(3):483-90. PubMed
- Moore RA, Straube S, Wiffen PJ, Derry S, McQuay HJ. Pregabalin for acute and chronic pain in adults. Cochrane Database Syst Rev. 2009; 3:Cd007076. Publisher Full Text | PubMed
- Chaparro LE, Smith SA, Moore RA, Wiffen PJ, Gilron I. Pharmacotherapy for the prevention of chronic pain after surgery in adults. Cochrane Database Syst Rev. 2013; 7:Cd008307. Publisher Full Text | PubMed
- Mack A. Examination of the evidence for off-label use of gabapentin. J Manag Care Pharm. 2003; 9(6):559-68. Publisher Full Text | PubMed
- . First published 14 December 2014. Last accessed 22 January, 2017.Publisher Full Text
- Dworkin RH, Turk DC, Farrar JT, Haythornthwaite JA, Jensen MP, Katz NP. Core outcome measures for chronic pain clinical trials: IMMPACT recommendations. Pain. 2005; 113(1–2):9-19. Publisher Full Text | PubMed
- Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. International journal of surgery (London, England). 2010; 8(5):336-41.
- Viera AJ, Garrett JM. Understanding interobserver agreement: the kappa statistic. Family medicine. 2005; 37(5):360-3. PubMed
- Schandelmaier S, Ebrahim S, Burkhardt SC, de Boer WE, Zumbrunn T, Guyatt GH. Return to work coordination programmes for work disability: a meta-analysis of randomised controlled trials. PLoS ONE. 2012; 7(11):e49760. Publisher Full Text | PubMed
- Higgins JPT, G S. Cochrane Handbook for Systematic Reviews of Interventions. The Cochrane Collaboration; 2011. Publisher Full Text
- Chan AW, Altman DG. Identifying outcome reporting bias in randomised trials on PubMed: review of publications and survey of authors. BMJ (Clinical research ed). 2005; 330(7494):753.
- Andrew Moore R, Eccleston C, Derry S, Wiffen P, Bell RF, Straube S. "Evidence" in chronic pain—establishing best practice in the reporting of systematic reviews. Pain. 2010; 150(3):386-9. PubMed
- Ioannidis JP, Cappelleri JC, Lau J. Issues in comparisons between meta-analyses and large trials. Jama. 1998; 279(14):1089-93. PubMed
- Sterne JA, Gavaghan D, Egger M. Publication and related bias in meta-analysis: power of statistical tests and prevalence in the literature. Journal of clinical epidemiology. 2000; 53(11):1119-29. PubMed
- Ebrahim S, Johnston BC, Akl EA, Mustafa RA, Sun X, Walter SD. Addressing continuous data measured with different instruments for participants excluded from trial analysis: a guide for systematic reviewers. J Clin Epidemiol. 2014; 67(5):560-70. Publisher Full Text | PubMed
- Akl EA, Johnston BC, Alonso-Coello P, Neumann I, Ebrahim S, Briel M. Addressing dichotomous data for participants excluded from trial analysis: a guide for systematic reviewers. PLoS ONE. 2013; 8(2):e57132. Publisher Full Text | PubMed
- Atkinson JH, Slater MA, Capparelli EV, Patel SM, Wolfson T, Gamst A. A randomized controlled trial of gabapentin for chronic low back pain with and without a radiating component. Pain. 2016; 157(7):1499-507. Publisher Full Text | PubMed
- McCleane GJ. Gabapentin reduces chronic benign nociceptive pain: a double-blind, placebo-controlled cross-over study. The Pain Clinic. 2000; 12(2):81-5.
- McCleane GJ. Does gabapentin have an analgesic effect on background, movement and referred pain? A randomised, double-blind, placebo controlled study. The Pain Clinic. 2001; 13(2):103-7.
- Baron R, Martin-Mola E, Muller M, Dubois C, Falke D, Steigerwald I. Effectiveness and Safety of Tapentadol Prolonged Release (PR) Versus a Combination of Tapentadol PR and Pregabalin for the Management of Severe, Chronic Low Back Pain With a Neuropathic Component: A Randomized, Double-blind, Phase 3b Study. Pain Pract. 2015; 15(5):455-70. Publisher Full Text | PubMed
- Kalita J, Kohat AK, Misra UK, Bhoi SK. An open labeled randomized controlled trial of pregabalin versus amitriptyline in chronic low backache. J Neurol Sci. 2014; 342(1–2):127-32. Publisher Full Text | PubMed
- Pota V, Barbarisi M, Sansone P, Moraci M, Pace MC, Passavanti MB. Combination therapy with transdermal buprenorphine and pregabalin for chronic low back pain. Pain Manag. 2012; 2(1):23-31. Publisher Full Text | PubMed
- Romano CL, Romano D, Bonora C, Mineo G. Pregabalin, celecoxib, and their combination for treatment of chronic low-back pain. J Orthop Traumatol. 2009; 10(4):185-91. Publisher Full Text | PubMed
- Sakai Y, Ito K, Hida T, Ito S, Harada A. Pharmacological management of chronic low back pain in older patients: a randomized controlled trial of the effect of pregabalin and opioid administration. European spine journal: official publication of the European Spine Society, the European Spinal Deformity Society, and the European Section of the Cervical Spine Research Society. 2015; 24(6):1309-17.
- Morlion B. Pharmacotherapy of low back pain: targeting nociceptive and neuropathic pain components. Current medical research and opinion. 2011; 27(1):11-33. Publisher Full Text | PubMed
- Chiappini S, Schifano F. A Decade of Gabapentinoid Misuse: An Analysis of the European Medicines Agency’s ‘Suspected Adverse Drug Reactions’ Database. CNS drugs. 2016; 30(7):647-54. Publisher Full Text | PubMed
- Bezerra DM, El Dib R, Vidal EIO, De Barros GAM, Chou R, Fukushima F. Anticonvulsants for chronic low-back pain. Cochrane Database of Systematic Reviews. 2014; 6:CD011171.
- Tetsunaga T, Tetsunaga T, Tanaka M, Sugimoto Y, Takigawa T, Ozaki T. Outcomes of pregabalin in lumbar-disease patients with depression. Journal of orthopaedic science: official journal of the Japanese Orthopaedic Association. 2014; 19(2):229-34. PubMed
- Sakai Y, Ito K, Hida T, Ito S, Harada A. Neuropathic pain in elderly patients with chronic low back painand effects of pregabalin: a preliminary study. Asian spine journal. 2015; 9(2):254-62. Publisher Full Text | PubMed
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015; 14(2):162-73. Publisher Full Text | PubMed
- Simunovic M, Baxter NN. Knowledge translation research: a review and new concepts from a surgical case study. Surgery. 2009; 145(6):639-44. Publisher Full Text | PubMed
- Giladi H, Choinière M, Fitzcharles M-A, Ware MA, Tan X, Shir Y. Pregabalin for chronic pain: does one medication fit all?. Current medical research and opinion. 2015; 31(7):1403-11. Publisher Full Text | PubMed
- Baron R, Binder A, Attal N, Casale R, Dickenson AH, Treede RD. Neuropathic low back pain in clinical practice. Eur J Pain. 2016; 20(6):861-873. Publisher Full Text | PubMed
- Taguchi T, Igarashi A, Watt S, Parsons B, Sadosky A, Nozawa K. Effectiveness of pregabalin for the treatment of chronic low back pain with accompanying lower limb pain (neuropathic component): a non-interventional study in Japan. J Pain Res. 2015; 8:487-97. Publisher Full Text | PubMed
- Orita S, Yamashita M, Eguchi Y, Suzuki M, Inoue G, Miyagi M. Pregabalin for Refractory Radicular Leg Pain due to Lumbar Spinal Stenosis: A Preliminary Prospective Study. Pain Research and Management. 2016; 2016:10.
- Baron R, Freynhagen R, Tolle TR, Cloutier C, Leon T, Murphy TK. The efficacy and safety of pregabalin in the treatment of neuropathic pain associated with chronic lumbosacral radiculopathy. Pain. 2010; 150(3):420-7. Publisher Full Text | PubMed
- Markman JD, Frazer ME, Rast SA, McDermott MP, Gewandter JS, Chowdhry AK. Double-blind, randomized, controlled, crossover trial of pregabalin for neurogenic claudication. Neurology. 2015; 84(3):265-72. Publisher Full Text | PubMed
- Cohen SP, Hanling S, Bicket MC, White RL, Veizi E, Kurihara C. Epidural steroid injections compared with gabapentin for lumbosacral radicular pain: multicenter randomized double blind comparative efficacy study. BMJ: British Medical Journal. 2015; 350:h1748. Publisher Full Text | PubMed
- Thorlund K, Imberger G, Johnston BC, Walsh M, Awad T, Thabane L. Evolution of heterogeneity (I2) estimates and their 95% confidence intervals in large meta-analyses. PLoS ONE. 2012; 7(7):e39471. Publisher Full Text | PubMed
- Muehlbacher M, Nickel MK, Kettler C, Tritt K, Lahmann C, Leiberich PK. Topiramate in treatment of patients with chronic low back pain: a randomized, double-blind, placebo-controlled study. Clin J Pain. 2006; 22(6):526-31. PubMed
- Spence D. Bad medicine: gabapentin and pregabalin. BMJ (Clinical research ed). 2013; 347:f6747.
- Mathieson S, Maher CG, McLachlan AJ, Latimer J, Koes BW, Hancock MJ. PRECISE—pregabalin in addition to usual care for sciatica: study protocol for a randomised controlled trial. Trials. 2013; 14(1):213. PubMed
- . Last accessed 22 January, 2017.Publisher Full Text
- . Last accessed 22 January, 2017.Publisher Full Text
Fonte
Shanthanna H, Gilron I, Rajarathinam M, AlAmri R, Kamath S, et al. (2017) Benefits and safety of gabapentinoids in chronic low back pain: A systematic review and meta-analysis of randomized controlled trials. PLoS Medicine 14(8): e1002369. https://doi.org/10.1371/journal.pmed.1002369





